Микология и фитопатология, 2021, T. 55, № 2, стр. 105-118
Биомасса грибов и разнообразие культивируемых микромицетов в сезонноталом слое бугристых торфяников Южной Тундры
Ю. А. Виноградова 1, *, Е. М. Лаптева 1, **, В. А. Ковалева 1, ***, Е. М. Перминова 1, ****
1 Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, Россия
* E-mail: vinogradova@ib.komisc.ru
** E-mail: lapteva@ib.komisc.ru
*** E-mail: kovaleva@ib.komisc.ru
**** E-mail: perminova@ib.komisc.ru
Поступила в редакцию 19.06.2020
После доработки 15.09.2020
Принята к публикации 23.12.2020
Аннотация
Исследованы состав и структура биомассы микроскопических грибов, а также видовое разнообразие культивируемых микромицетов в сезонноталых слоях (СТС) торфяных мерзлотных почв плоскобугристого болотного комплекса южной тундры (бассейн верхнего течения р. Коротаиха, Большеземельская тундра, Ненецкий автономный округ). Рассмотрено их профильное распределение в торфяных почвах, занимающих различное положение в рельефе бугристого болота под разными типами растительности. Показано, что биомасса грибов (спор и мицелия) в СТС бугристого торфяника варьирует от 0.44 до 21.46 мг/г абсолютно сухой почвы (а.с.п.). В верхних слоях СТС в структуре биомассы доминирует мицелий, в надмерзлотных – споры грибов. Максимум биомассы грибов отмечен в почвах торфяных пятен, лишенных растительного покрова (11.5–20.2 мг/г а.с.п.), минимум – в почвах микропонижений с мохово-лишайниковыми сообществами (0.4–16.8 мг/г а.с.п.) и мочажинах с осоково-сфагновым растительным покровом (2.3–6.9 мг/г а.с.п.). Мицелий грибов в почвах рассмотренного торфяника представлен в основном функционально активными гифами (81–100%). Таксономический список культивируемых микромицетов включает 40 видов (в т.ч. две формы стерильного мицелия). Отдел Mucoromycota представлен 11 видами (28%) из родов Mucor, Mortierellа, Umbelopsis. По числу видов доминирует род Penicillium (13 видов). Роды Akanthomyces, Alternaria, Cladosporium, Pseudogymnoascus, Oidiodendron включают единичные виды. По частоте встречаемости структура комплекса микромицетов представлена случайными видами (55%), на долю редких, частых и доминирующих приходится соответственно 25, 13 и 7%. Наиболее обильны в сезонноталых слоях два вида – Talaromyces funiculosus (28%) и Pseudogymnoascus pannorum (16%). Наибольшим видовым разнообразием грибов (21 вид) характеризуются почвы торфяных пятен, минимальным (13 видов) – почва мочажин. Основу комплекса микромицетов составляют мезофилы и психротолерантные виды (от 75 до 100%). К типичным психрофильным видам, растущим при температуре культивирования 4°С, следует отнести Mortierella alliacea, M. schmuckeri, Mucor sp., Penicillium lividum. Данные виды активно спорулируют в СТС почв торфяного бугра и не встречены в почве мочажин.
ВВЕДЕНИЕ
В условиях активного освоения северных регионов особое внимание уделяется изучению состава и структуры грибных сообществ, функционирующих в почвах тундровых и полярных областей. Это обусловлено значимой ролью эукариотического комплекса микробных сообществ в процессах почвообразования (Soil functions.., 1990; Kurakov et al., 2016) и формирования качества среды (Korneykova et al., 2012, Kirtsideli, 2015). Благодаря использованию классических и современных молекулярно-генетических методов в последнее время существенно расширен таксономический список почвенных микромицетов криогенных почв, установлены особенности их видового состава в зависимости от характера субстрата в наземных экосистемах Арктики (Blaud et al., 2015; Nikitin et al., 2019) и Антарктики (Arenz et al., 2011; Kirtsideli et al., 2018; Fungi.., 2019). Выявлено доминирование в почвах полярных регионов микромицетов с широкой экологической амплитудой (Cox et al., 2016), установлены механизмы их адаптации к неблагоприятным условиям среды – низким температурам, наличию многолетней мерзлоты, высокой УФ инсоляции, частым циклам замерзания-оттаивания, низкому уровню и слабой доступности элементов питания (Ruisi et al., 2007; Hassan et al., 2016; Sazanova et al., 2019). Отмечено изменение под влиянием антропогенного загрязнения видового состава и структуры микоценозов в тундровых почвах, возрастание в них доли патогенных и снижение доли редких видов (Marfenina et al., 2016; Kirtsideli et al., 2018, 2020).
Одним из характерных и широко распространенных элементов в структуре наземных экосистем криолитозоны являются бугристые торфяники, представленные сочетанием торфяных бугров и разделяющих их переувлажненных понижений – мочажин (топей). Совокупность криогенных процессов (пучение, криотурбации, снеговая корразия), особенности рельефа болотного комплекса и микрорельефа поверхности бугров, специфика гидротермических условий обусловливают развитие здесь под разными типами растительности торфяных почв с разной мощностью активного сезонноталого слоя (СТС) (Kaverin et al., 2019), в том числе деструктивных почв торфяных пятен, лишенных растительного покрова (Kaverin et al., 2016; Ogneva et al., 2016; Seppälä 2006; Matyshak et al., 2017). Различия в характере накопления органического вещества, элементов питания, закономерностях процессов промерзания-оттаивания, тепловом и водном режиме почв в той или иной мере отражаются в распределении и функционировании комплекса микроскопических грибов (Effmert et al., 2012; Andersen, 2013; Timling et al., 2014; Peršoh, 2015). Однако микробный статус торфяных мерзлотных почв, профильное распределение в них микроорганизмов, в том числе микроскопических грибов, их пространственная и временная динамика исследованы крайне фрагментарно (Vinogradova et al., 2019; Yakushev et al., 2019), что и предопределило цель данной работы.
Цель исследования – выявление особенностей распределения в сезонноталых слоях бугристого торфяника биомассы микроскопических грибов, ее структуры и разнообразия культивируемых микромицетов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в центральной части Большеземельской тундры (БЗТ). Район исследования расположен в границах Ненецкого автономного округа, в 160–165 км севернее Полярного круга, в регионе со сплошным распространением многолетнемерзлых пород (ММП). Приурочен к Среднекоротаихинскому р-ну Коротаихо-Приуральского округа Предуральско-Уральской подпровинции Европейско-Западносибирской тундровой провинции подзоны южных тундр (Lavrinenko, 2013), для которого характерно распространение ивняково-мелкоерниковых тундр в сочетании с плоскобугристыми заозеренными болотными комплексами.
Территориально исследования проводили в бассейне верхнего течения р. Коротаиха. Непосредственным объектом исследования послужили почвы болотного массива, расположенного на плоском с обширной депрессией водоразделе рек Коротаиха и ее левобережного притока Падимей-Ты-Вис (68°02′ с.ш.; 62°43′ в.д.) с абсолютными высотами от 30 до 100 м над ур. м. Основную часть площади рассматриваемого болотного комплекса занимают плоские бугры высотой до 1–1.5 м (рис. 1). Поверхность бугров имеет мелкобугорковатый микрорельеф с редкими морозобойными трещинами. Деградация торфяников выражена слабо: в пределах бугра оголенные торфяные пятна встречаются единично, имеют небольшие по диаметру размеры, по периферии зарастают мхами и лишайниками. Понижения между торфяными буграми заняты мочажинами (топями) и озерками, занимающими до 20% площади. Растительный покров торфяных бугров неоднороден, представлен полидоминантными кустарничково-моховыми и мохово-лишайниковыми сообществами. Из кустарничков доминируют Ledum decumbens, Betula nana и Rubus chamaemorus. Высоким обилием отличаются Empetrum hermaphroditum, Vaccinium vitis-idaea, V. uliginosum, Andromeda polifolia и Eriophorum vaginatum. Единично встречаются E. russeolum, Carex brunnescens, C. globularis. Напочвенный покров образован мхами и лишайниками. Мхи представлены Sphagnum fuscum, S. russowii, видами родов Polytrichum и Dicranum. Синузии лишайников тяготеют к межбугорковым понижениям. Среди них преобладают виды рода Cladonia (C. arbuscula, C. rangiferina, C. coccifera, C. gracilis, C. crispata и др.), Flavocetraria nivalis, Cetraria islandica, Icmadophila ericetorum. Растительность мочажин представлена осоково-сфагновыми группировками с господством Carex rotundata и Sphagnum lindbergii. Из других растений обычны только Eriophorum russeolum, Sphagnum jensenii и Warnstorfia exannulata. Остальные виды представлены единично.
Рис. 1.
Плоскобугристый болотный комплекс, расположенный в центральной части Большеземельской тундры (подзона южных тундр): а – общий вид плоскобугристого болота; б – растительный покров торфяных бугров; в – растительное сообщество мочажин.

Для оценки видового разнообразия культивируемых микромицетов и распределения грибной биомассы в СТС мерзлотного торфяника анализировали пробы торфа, отобранные из разрезов, заложенных в различных позициях микрорельефа торфяного бугра и в мочажине (топи). Исследовали комплексы микромицетов: а) торфяных олиготрофных деструктивных мерзлотных почв, приуроченных к центральной части (I) оголенного торфяного пятна и его краевой зоне (II), зарастающей мхами и лишайниками; б) торфяных олиготрофных остаточно-эутрофных мерзлотных почв, развитых в микропонижении под мохово-лишайниковым сообществом (III) и микроповышении (бугорок) с кустарничково-моховой растительностью (IV); в) торфяной олиготрофной мерзлотной почвы мочажины (топи) с осоково-сфагновым сообществом (V).
Отбор проб проводили на глубину сезонного оттаивания почв с учетом изменения в пределах СТС ботанического состава торфа и степени его разложенности. Пробы торфа извлекали с соблюдением условий, препятствующих их контаминации (Methods.., 1991). До начала микологических исследований образцы торфа хранили в морозильной камере при температуре –18–20°С.
Численность спор, длину грибного мицелия, их биомассу и жизнеспособность мицелия учитывали методом люминесцентной микроскопии (Methods.., 1991) с использованием красителя флюоресцеин диацетата (ФДА), позволяющего дифференцировать мицелий с нарушенной (мертвый) и ненарушенной (живой) клеточной мембраной (Gaspar et al., 2001). Для каждого образца готовили по 12 препаратов с просмотром в каждом 90 полей зрения под люминесцентным микроскопом Zeiss Axioskop (Германия), увеличение ×400. Биомассу вычисляли с учетом измеренного диаметра спор грибов и длины фрагментов мицелия в соответствии с формулами, приведенными в работе (Polyanskaya, 1996).
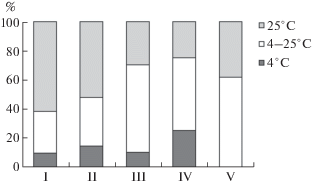
Для выявления разнообразия культивируемых микроскопических грибов использовали метод серийных разведений почвенной суспензии. Выделение и учет микромицетов осуществляли на твердых питательных средах (подкисленная среда Чапека, среда Гетчинсона, среда Сабуро, сусло-агар) при разных температурах оттаивания замороженных образцов торфа (25, 35, 52°С) и культивирования посевов (4, 25°С) (Ozerskaya et al., 2008; Kochkina et al., 2014). Почвенные суспензии готовили в трехкратной повторности с трехкратным приготовлением разведений и трехкратным посевом на чашки Петри из каждого разведения. Таким образом, повторность посевов почвенной суспензии на плотные питательные среды для каждой температуры размораживания и культивирования была 21-кратная. Данные по численности микромицетов, полученные методом посева на агаризованные среды, выражали в КОЕ/г абсолютно сухой почвы (а.с.п.).
Таксономическую принадлежность микромицетов идентифицировали с использованием современных определителей (Ellis, 1971; Ramirez, 1982; Egorova, 1986; Pitt, 1991; Aleksandrova, 2006; Domsch, 2007). Названия и положения таксонов унифицировали с помощью базы данных CBS (www.indexfungarum.org) и MycoBank (http://www.mycobank.org). После идентификации культуры микромицеты пересевали в трехкратной повторности в стерильные пробирки со скошенным агаром (среда Чапека) и хранили в холодильнике при температуре 4°С. В совокупности из 31 образца торфа выделено в чистую культуру 40 видов грибов с учетом двух видов стерильного мицелия.
Для характеристики микобиоты использовали индексы видового разнообразия Шеннона (Н), выравненности Пиелу (Е), доминирования Симпсона (D) (Magurran, 1992), а также показатели частоты встречаемости и относительного обилия видов (Kurakov, 2001). Статистическую обработку полученных данных проводили с помощью плагина программы “ExcelToR” (Novakovskij, 2016).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биомасса микроскопических грибов и ее структура. Специфика поверхности мерзлотных болотных комплексов (наличие торфяных бугров и мочажин), микрорельефа торфяных бугров (сочетание микробугорков и микропонижений), неоднородность растительного покрова определяют различия в глубине протаивания СТС торфяных почв и их температурных режимов (Kaverin et al., 2019). Лучше прогреваются в летний период почвы на участках торфяных бугров, лишенных растительности (оголенные пятна торфа). Это способствует более глубокому снижению в них верхней границы ММП по сравнению с другими биотопами в пределах болотного массива. Проведенные нами исследования показали, что, в зависимости от участка и глубины отбора торфа, биомасса микроскопических грибов в СТС бугристого торфяника варьирует от 0.4 до 21.5 мг/г а.с.п. Основной вклад в ее структуру вносят гифы грибов (52–88%), которые представлены мицелием без пряжек. Несущий пряжки мицелий базидиомицетов, присутствие которого характерно для микоценозов почв в лесных экосистемах (Domsch et al., 2007), в СТС бугристого торфяника южной тундры не отмечен.
Максимальные величины биомассы микроскопических грибов приурочены к верхним слоям СТС (до глубины 20–30 см), наиболее прогреваемым в летний период. В нижних слоях СТС, на контакте с верхней границей ММП, ее значения в 1.2–7.1 раза ниже (рис. 2). Полученные нами данные о величине биомассы грибов в почвах бугристого торфяника сопоставимы с результатами других исследований, проведенных на территории БЗТ. В частности, в почвах Воркутинской тундры биомасса микроскопических грибов характеризуется значениями порядка 7.9–14.8 мг/г (Ananyeva et al., 2008), в торфяниках лесотундры – 1.6–15.2 мг/г (Lapteva et al., 2017). В почвах Кольского Севера и полярных областях российской Арктики (архипелаг Земля Франца-Иосифа) эти показатели существенно ниже, соответственно 0.009–2.6 мг/г почвы (Korneykova, 2018) и 0.1–0.6 мг/г (Nikitin et al., 2019).
Рис. 2.
Изменение биомассы мицелия, спор грибов и длины мицелия в сезонноталых слоях торфяных мерзлотных почв плоскобугристого болотного комплекса южной тундры: I – оголенное торфяное пятно; II – краевая зона торфяного пятна, зарастающая мхами и лишайниками; III – микропонижение; IV – бугорок; V – мочажина (те же обозначения для рис. 3–8).
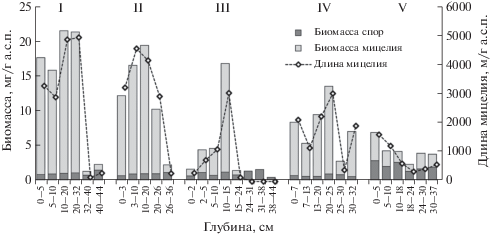
В исследованном нами торфянике наибольшие величины биомассы грибов выявлены в образцах торфа из СТС почвы оголенного торфяного пятна (16.8–20.2 мг/г а.с.п.) и его периферической части (11.5–18.4 мг/г а.с.п.), постепенно зарастающей мхами и лишайниками. Высокие показатели биомассы обусловлены присутствием здесь значительного количества (3–5 тыс. м/г а.с.п.) фрагментов мицелия грибов (рис. 2), представленных в основном функционально активными гифами с ненарушенной клеточной стенкой.
На участках торфяного бугра с хорошо развитым растительным покровом профильное распределение мицелия в почвах бугорковатого комплекса имеет определенную дифференциацию. В почве бугорка (IV) с кустарничково-моховой растительностью гифы грибов встречены нами на всех глубинах СТС, их длина варьирует от 396 до 3033 м/г а.с.п., а биомасса грибов – от 2.8 до 13.5 мг/г а.с.п. В почве микропонижения (III) с мохово-лишайниковым покровом гифы грибов отмечены только до глубины 20–24 см (рис. 2), ниже на контакте с ММП присутствуют только споры грибов. Максимальная концентрация мицелия (3050 м/г а.с.п.) выявлена в образцах торфа, приуроченных к глубине 10–15 см, где присутствуют фрагменты слабо- и среднеразложенных остатков гипновых и сфагновых мхов. Они составляют основу торфа верхней части СТС почвы бугорка. Их наличие в почве микропонижения обусловлено процессами криотурбации и криогенного массопереноса, типичными для профилей тундровых почв (Ping et al., 2008). В верхних слоях торфа (0–5 см) почвы микропонижения, представленных в основном хорошо разложенными остатками дикрановых мхов и продуктами разложения талломов лишайников, биомасса мицелия невелика (1.0–3.3 мг/г а.с.п.) и составляет 60–74% от суммарной биомассы грибов. В отличие от почв оголенного торфяного пятна (I, II) и бугорка (IV), в верхних слоях торфа микропонижения (III) присутствует не только функционально активный мицелий, но и фрагменты мицелия с нарушенной клеточной стенкой (до 4–19%).
В мочажине (участок V), где торф представлен в основном слаборазложенными фрагментами сфагновых мхов и осок, биомасса грибов варьирует от 2.3 до 6.9 мг/г а.с.п. В ее структуре на долю мицелия приходится 37–59%. Гифы грибов преимущественно находятся в функционально активном состоянии, однако на глубине 5–10 см выявлено значительное (до 49%) количество “мертвого” мицелия с нарушенной клеточной стенкой.
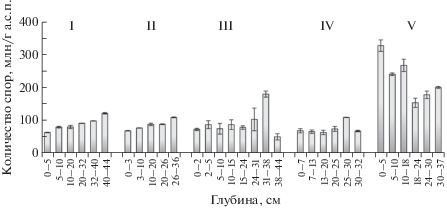
Во всех рассмотренных биотопах споры грибов встречаются во всей толще СТС (рис. 3). Их диаметр не превышает 4 мкм, что характерно для почв территорий с экстремально холодным климатом (Sterflinger et al., 2012; Nikitin et al., 2019). Максимальное число спор приурочено к почве мочажины – 153–328 млн кл./г а.с.п, в почвах торфяного бугра численность спор не превышает 114 ± 2 млн кл./г а.с.п. Для сравнения, в торфяных почвах осоково-сфагновых топей болотных массивов Томской обл. число спор составляло 60–80 млн кл./г (Sergeeva et al., 2008), в почвах торфяных бугров севера Западной Сибири – 4–8 млн кл./г (Yakushev et al., 2019), в почвах Воркутинской тундры – 16.8–19.0 млн кл./г (Ananyeva et al., 2008). Значительный разброс в содержании неактивных форм грибов (спор) в болотных почвах может быть обусловлен многими факторами: особенностями климатических условий регионов исследований, генезисом почв, своеобразием ботанического состава торфа, погодными условиями на момент отбора проб.
Рис. 3.
Профильное распределение числа спор грибов в сезонноталых слоях торфяных мерзлотных почв плоскобугристого болотного комплекса южной тундры. Планками погрешности показана величина стандартного квадратичного отклонения.
В условиях южной тундры наиболее благоприятные условия для функционирования микроскопических грибов в плоскобугристом болотном комплексе складываются в почвах торфяного пятна. В СТС участков I и II средневзвешенные значения длины мицелия составили 3233–3700 м/г а.с.п., в почве бугорка (IV) – 1827 м/г а.с.п. Минимальные показатели выявлены при исследовании почв микропонижения (III) и мочажины (V), соответственно 566 и 754 м/г а.с.п. Полученные нами данные противоречат результатам А.В. Якушева с соавторами (Yakushev et al., 2019), согласно которым микроскопические грибы в почвах торфяных пятен находятся преимущественно в неактивном состоянии. Известно, что разнообразие и численность микроскопических грибов определяются типом почв и характером растительного покрова (Peršoh, 2015), однако на флуктуацию их численных характеристик существенное влияние могут оказывать климатические факторы (Timling et al., 2014). Погодные условия в период проведения наших исследований отличались аномально теплой третьей декадой июля (18.9°С) и резким дефицитом осадков (8.3 мм), что обусловило существенное иссушение болотного массива (уровень болотных вод в мочажинах находился на глубине 25–30 см). Это могло способствовать активизации жизнедеятельности почвенных микробных сообществ, в т.ч. микроскопических грибов, в наиболее прогреваемых (наиболее теплых) почвах торфяных пятен бугристых болот (Kaverin et al., 2016; Ogneva et al., 2016), характеризующихся более высокой степенью разложения торфа и более глубокой гумификацией в них органического материала, по сравнению с почвами других биотопов (Vasilevich et al., 2019).
Численность культивируемых микроскопических грибов. Результаты учета колоний микромицетов на твердых питательных средах свидетельствуют о том, что численность культивируемых микромицетов в почвах бугристого торфяника южной тундры варьирует в пределах 103–105 КОЕ/г а.с.п. В торфяниках лесотундры она оценивалась на уровне 103 КОЕ/г а.с.п. (Lapteva et al., 2017; Vinogradova et al., 2019), в почвах различных биотопов Арктики не превышала 104 КОЕ/г субстрата (Bergero et al., 1999; Kirtsideli et al., 2014; Kirtsideli, 2015). Таким образом, полученные нами результаты подтверждают гипотезу о том, что с возрастанием широты местности обилие грибов в почвах не уменьшается, меняются лишь доминирующие экологические группировки (Timling et al., 2014).
Максимальное число изолятов получено нами при использовании богатых углеводами питательных сред – Сабуро (82 × 103–123 × 105 КОЕ/г а.с.п.) и сусло-агаре (50 × 103–94 × 105 КОЕ/г а.с.п.). На средах Чапека и Гетчинсона колоний грибов меньше (соответствено 1.2 × 103–10.8 × × 105 КОЕ/г а.с.п. и 1.0 × 103–14 × 103 КОЕ/г а.с.п.). На этих средах, особенно на среде Гетчинсона, отсутствовал рост колоний при анализе образцов торфа из надмерзлотных горизонтов СТС. Однако в почвах бугорковатого комплекса (бугорок, микропонижение), где развитая растительность и СТС, пронизанный конями кустарничков, способствуют активному функционированию грибного сообщества, число микромицетов, дающих рост колоний на среде Чапека, на 2–3 порядка выше по сравнению с почвами торфяного пятна и мочажины.
Участок V (мочажина) занимает особое место в исследованном ряду почв. В отличие от остальных биотопов, где практически на всех глубинах отмечено присутствие культивируемых микроскопических грибов (особенно на богатых углеводами средах), в почве мочажины они сконцентрированы только в верхних слоях СТС на глубине 0–24 см. Их максимальная численность приурочена к самому верхнему слою торфяных отложений – слою очеса сфагновых мхов (0–5 см). Здесь на среде Сабуро учтено (123 ± 6) × 105 КОЕ/г а.с.п., на сусло-агаре – (94 ± 27) × 105 КОЕ/г а.с.п. В верхних горизонтах СТС остальных почв количество изолятов, фиксируемых на этих средах, на порядок (участки III, IV) или на два–три порядка (участки I, II) ниже. В слоях торфа на глубине 5–24 см, представленных в почве мочажины слаборазложенными остатками сфагновых мхов и осок, рост колоний отмечался только на средах Сабуро (10 × 103–23 × 104 КОЕ/г а.с.п.) и Чапека (18 × × 103 КОЕ/г а.с.п.). На среде Чапека рост колоний был зафиксирован только при анализе образца торфа с глубины 10–18 см, в котором визуально определялось значительное количество живых и мертвых корней осок. В выше- и нижележащих слоях торфа рост колоний на среде Чапека, в отличие от среды Сабуро, отсутствовал. Возможно, в стрессовых условиях обводненных топей тундровых болотных комплексов споры грибов имеют очень низкую скорость роста. Несмотря на значительное количество спор грибов в почве мочажины (рис. 3), низкая энергия их прорастания могла быть причиной недоучета численности и видового разнообразия культивируемых микроскопических грибов в почве участка V.
Таксономическая структура и видовое разнообразие культивируемых микромицетов. Идентификация таксономической принадлежности изолятов показала, что в СТС торфяной залежи рассмотренного болотного массива комплекс культивируемых микромицетов, c учетом двух форм стерильного мицелия, представлен 40 видами из 11 родов (табл. 1). Основу составляют анаморфные грибы (27 видов). Отдел Mucoromycota включает 11 видов из родов Mucor, Mortierellа, Umbelopsis.
Таблица 1.
Видовое разнообразие микромицетов и их относительное обилие (%) в торфяной залежи сезонноталых слоев плоскобугристого болота южной тундры
| Виды микромицетов | Участок | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| 0–44 см | 0–36 см | 0–44 см | 0–32 см | 0–37 см | |
| Mucoromycota | |||||
| Mortierella alliacea Linnem. | 0.00 | 0.40 | 0.00 | 0.00 | 0.00 |
| M. alpina Peyronel | 7.14 | 6.85 | 4.77 | 11.54 | 17.99 |
| M. antarctica Linnem. | 4.76 | 0.00 | 0.00 | 0.00 | 10.07 |
| M. horticola Linnem. | 2.38 | 8.47 | 0.00 | 0.00 | 0.00 |
| M. humicola Oudem. | 7.14 | 1.21 | 0.66 | 0.00 | 5.76 |
| M. schmuckeri Linnem. | 4.76 | 1.61 | 0.00 | 0.00 | 0.00 |
| Mortierella sp. | 9.52 | 12.10 | 1.33 | 2.66 | 2.16 |
| Mucor hiemalis Wehmer | 0.00 | 2.02 | 0.95 | 0.48 | 0.00 |
| Mucor sp. | 0.00 | 0.00 | 0.00 | 0.48 | 0.0 |
| Umbelopsis ramanniana (Möller) W. Gams | 0.00 | 0.00 | 0.10 | 0.00 | 0.00 |
| U. vinacea (Dixon-Stew.) Arx | 2.38 | 4.44 | 2.29 | 3.61 | 1.44 |
| Ascomycota | |||||
| Akanthomyces muscarius (Petch) Spatafora, Kepler et B. Shrestha | 4.76 | 0.00 | 0.00 | 0.00 | 0.00 |
| Alternaria alternata (Fr.) Keissl. | 2.38 | 0.00 | 0.00 | 0.00 | 0.00 |
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | 2.38 | 0.00 | 0.00 | 0.00 | 0.00 |
| Oidiodendron maius G.L. Barron | 0.00 | 0.00 | 0.00 | 0.48 | 0.00 |
| Penicillium aurantiogriseum Dierckx | 0.00 | 1.21 | 0.00 | 0.00 | 0.00 |
| P. camemberti Thom | 0.00 | 0.00 | 1.81 | 0.00 | 0.00 |
| P. canescens Sopp | 0.00 | 2.02 | 2.96 | 0.24 | 0.00 |
| P. citreonigrum Dierckx | 0.00 | 0.00 | 0.00 | 3.61 | 0.72 |
| P. decumbens Thom | 2.38 | 0.00 | 10.10 | 0.00 | 0.00 |
| P. lanosum Westling | 0.00 | 0.00 | 0.38 | 3.85 | 0.00 |
| P lividum Westling | 0.00 | 0.00 | 0.00 | 9.13 | 0.00 |
| P. olivicolor Pitt. | 0.00 | 0.00 | 0.19 | 0.00 | 0.00 |
| P. roqueforti Thom | 2.38 | 0.00 | 0.00 | 0.00 | 0.00 |
| P. simplicissimum (Oudem.) Thom | 0.00 | 0.00 | 5.24 | 11.38 | 14.39 |
| P. spinulosum Thom | 0.00 | 0.00 | 1.33 | 0.72 | 0.00 |
| P. thomii Maire | 7.14 | 0.81 | 2.19 | 7.02 | 0.00 |
| Penicillium sp. | 4.76 | 2.82 | 0.76 | 3.85 | 5.76 |
| Pseudogymnoascus pannorum (Link) Minnis et D.L. Lindne | 11.90 | 22.98 | 16.76 | 9.62 | 23.02 |
| Talaromyces funiculosus (Thom) Samson, N. Yilmaz, Frisvad et Seifert | 4.76 | 0.40 | 39.02 | 28.13 | 16.55 |
| T. diversus (Raper et Fennell) Samson, N. Yilmaz et Frisvad | 0.00 | 0.00 | 0.00 | 0.72 | 0.00 |
| T. rugulosus (Thom) Samson, N. Yilmaz, Frisvad et Seifert | 0.00 | 0.00 | 2.75 | 0.00 | 0.00 |
| Trichoderma hamatum (Bonord.) Bainier | 2.38 | 0.81 | 0.00 | 0.00 | 0.00 |
| T. harzianum Rifai | 0.00 | 2.82 | 0.00 | 0.00 | 0.00 |
| T. koningii Oudem. | 2.38 | 8.87 | 0.00 | 0.48 | 0.72 |
| T. polysporum (Link) Rifai | 0.00 | 0.40 | 0.00 | 0.00 | 0.00 |
| T. viride Pers. | 2.38 | 0.81 | 0.00 | 0.24 | 0.72 |
| Trichoderma sp. | 0.00 | 1.21 | 0.00 | 0.00 | 0.00 |
| светлоокрашенный стерильный мицелий | 9.52 | 17.74 | 6.25 | 1.94 | 0.72 |
| темноокрашенный стерильный мицелий | 2.38 | 0.00 | 0.38 | 0.00 | 0.00 |
По видовой насыщенности преобладает род Penicillium. Он является доминирующей (космополитной) группой микроорганизмов и активно выделяется в почвенных экосистемах как Субарктических (Vinogradova et al., 2019), так и Арктических территорий (Sonjak et al., 2006). В рассмотренном нами торфянике род Penicillium представлен всего 13 видами, что составляет 30% от всех выделенных и идентифицированных видов микромицетов. Однако, как показали ранее проведенные исследования (Vinogradova et al., 2019), в торфяниках лесотундры, в которых был исследован таксономический состав торфяных отложений и СТС и ММП, виды рода Penicillium характеризуются более значительным видовым разнообразием – 38 видов. Такая разница может быть связана с недоучетом в почвах южнотундрового торфяника разнообразия микроскопических грибов, споры которых приурочены к мерзлым слоям торфа, микологический анализ которых находится в стадии завершения и в данной статье не приведен. На втором месте находятся роды Mortierella (7 видов) и Trichoderma (6), на третьем – Talaromyces (3), Mucor (3) и Umbelopsis (2). Роды Akanthomyces, Alternaria, Cladosporium, Pseudogymnoascus, Oidiodendron включают по одному виду.
Структура комплекса микромицетов СТС торфяных почв представлена в основном случайными видами (55%), на долю редких приходится 25%, частых и доминирующих – 13 и 7%, соответственно. Преобладание случайных видов микромицетов отмечено нами и при исследовании торфяников лесотундры (Vinogradova et al., 2019). По относительному обилию в СТС торфяной залежи рассмотренного болотного массива доминируют Talaromyces funiculosus (28%) и Pseudogymnoascus pannorum (16%). Это типичные виды арктических биотопов (Kochkina et al., 2011; Edgington et al., 2014; Kirtsideli, 2015). Группу видов, обилие которых варьирует в пределах от 1 до 7%, составляют: Mortierella alpina (7%), светлоокрашенный стерильный мицелий (6%), Penicillium simplicissimum (6%), P. decumbens (5%), P. olivicolor (3%), P. thomii (3%), Mortierella sp. (3%), Umbelopsis vinacea (3%), Penicillium lividum (2%), Penicillium canescens (2%), Penicillium sp. (2%), Talaromyces rugulosus (1%), Trichoderma koningii (1%), Mortierella horticola (1%), Penicillium lanosum (1%), P. camemberti (1%). Для остальных идентифицированных видов показатель обилия менее 1%.
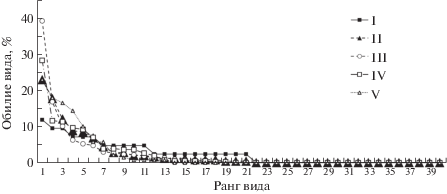
Видовое разнообразие грибов в СТС рассмотренного ряда почв последовательно снижается от оголенного торфяного пятна (21 вид) к мочажине (13 видов). Наиболее высокими значениями индексов видового разнообразия Шеннона (2.32–2.42) и выравненности Пиелу (0.79) характеризуются микоценозы СТС почвы краевой зоны торфяного пятна (II), зарастающего лишайниками и мхами, и почвы бугорка (IV) с кустарничково-моховым растительным сообществом (табл. 2). Кривые рангового распределения видов (по обилию) во всех рассмотренных биотопах имеют сходный характер, отвечающий логнормальному распределению (рис. 4). Однако в почве участка I кривая рангового распределения имеет более сглаженный вид за счет присутствия здесь относительно большого количества видов (13) с незначительным разбросом в значениях величины обилия (от 4 до 12%). В остальных биотопах четко выделяются доминанты с обилием выше 20% и субдоминанты с обилием в пределах 10–20%. Таким образом, в почвах практически всех участков, кроме центральной части торфяного пятна (I), лишенной растительности, отмечено доминирование небольшого (3–5) количества видов (табл. 1).
Таблица 2.
Показатели структуры комплекса микромицетов в сезонноталых слоях торфяной залежи плоскобугристого болотного комплекса южной тундры
| Показатели | Сезонноталые слои торфа | ||||
|---|---|---|---|---|---|
| Номер участка | I | II | III | IV | V |
| Мощность сезонноталого слоя, см | 44 | 36 | 44 | 32 | 37 |
| Количество выделенных видов, шт | 21 | 21 | 20 | 20 | 13 |
| Индекс видового разнообразия Шеннона (Н) | 1.66 | 2.42 | 2.08 | 2.32 | 1.79 |
| Индекс выравненности Пиелу (Е) | 0.55 | 0.79 | 0.71 | 0.79 | 0.70 |
| Индекс доминирования Симпсона (S) (1-D) | 0.57 | 0.88 | 0.80 | 0.87 | 0.86 |
Рис. 4.
Кривые рангового распределения (по обилию) видов микромицетов в почвах плоскобугристого торфяника южной тундры.
Наиболее разнообразны по видовой насыщенности микроскопических грибов верхние горизонты СТС торфяной залежи (глубина 0–5 см). Здесь идентифицировано, в зависимости от участка, от 10 до 15 видов (рис. 5). В профиле почв оголенного пятна (I) и его краевой зоны (II) отмечено два пика видового разнообразия микромицетов: первый приурочен к глубине 0–5 см, второй – к средней части СТС (глубина 20–32 см и 20–26 см соответственно). Появление второго пика может быть связано с изменением ботанического состава торфа. В верхней части (0–20 см) торф темно-коричневый, хорошо разложенный (степень разложения 40–50%), в нижней части (20–44 см) торф имеет более светлый буровато-коричневый оттенок с обилием слабо- и среднеразложенных фрагментов мхов, осок, коры кустарничков. Аналогичная картина (два пика видового разнообразия в профиле) отмечена также в СТС почвы мочажины, где второй пик, приуроченный к глубине 10–18 см, связан, по всей видимости, с присутствием в составе сфагнового торфа фрагментов других видов мхов, а также стеблей и листьев Carex rotundata. В верхней части СТС, представленном очесом сфагновых мхов (глубина 0–5 см) и их слаборазложенными фрагментами (глубина 5–10 см), эти компоненты отсутствуют. В почве бугорка (IV) с хорошо развитой кустарничково-моховой растительностью сравнительно высокое разнообразие микромицетного комплекса (10–13 видов из 6–7 родов) охватывает толщу СТС до глубины 20–25 см, в которой сконцентрирована основная масса корней кустарничков Ledum decumbens, Betula nana, Vaccinium vitis-idaea, Empetrum hermaphroditum (рис. 5).
Рис. 5.
Изменение количества родов (А) и видов (Б) культивируемых микроскопических грибов в профиле сезонноталых слоев торфяных почв плоскобугристого болота южной тундры.
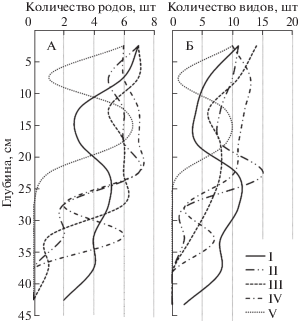
В нижних слоях СТС, на границе с ММП (глубина 35–45 см), разнообразие культивируемых микромицетов во всех рассмотренных нами почвах резко снижается, вплоть до полного отсутствия роста колоний (участки III, V). Несмотря на наличие в этих горизонтах значительного количества спор (рис. 3), их способность к активному росту на используемых средах в условиях культивирования, по всей видимости, резко ограничена.
Почвы торфяного пятна, лишенного растительности (I, II), и бугорковатого комплекса с мохово-лишайниковым и кустарничково-моховым сообществами (III, IV) достаточно четко различаются по видовой насыщенности ведущих родов микромицетов (рис. 6). В первом случае наиболее насыщены видами роды Mortierella (6 видов) и Trichoderma (3–6), во втором случае – род Penicillium (8–9). Почва мочажины (V) по видовой насыщенности родов занимает промежуточное положение.
Рис. 6.
Видовая насыщенность ведущих родов микромицетов в сезонноталых слоях торфяных почв плоскобугристого болота южной тундры.
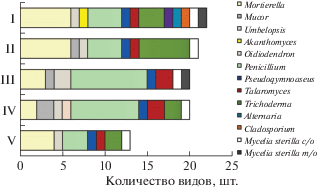
В зависимости от типа почвы, который напрямую связан с положением в рельефе (микрорельефе) болотного массива и характером растительного покрова, наблюдаются соответствующие изменения в доминировании (по обилию) видов в сообществах культивируемых микромицетов. В частности, в почвах торфяного пятна (I) и его краевой зоны (II) в тройку доминантов входят Pseudogymnoascus pannorum (соответственно 12 и 23%), светлоокрашенный стерильный мицелий (10 и 18%) и Mortierella sp. (10 и 12%).
В почвах бугорковатого комплекса (участки III и IV) вид Pseudogymnoascus pannorum сохраняет свои ведущие позиции (обилие 17 и 10% соответственно). Однако в них на первое место по обилию выходит вид Talaromyces funiculosus (= Penicillium funiculosum), соответственно 39 и 28%. Этот вид участвует в разложении сфагновых мхов, он характерен для микоценозов верховых болот (Grum-Grzhymaylo et al., 2012), встречается в почвах заболоченных местообитаний полярных регионов (Kirtsideli et al., 2014). Среди почвенных микроскопических грибов это наиболее стрессоустойчивый вид, приуроченный к зоне ризосферы (Kanse et al., 2015), хотя по данным Е.Ю. Ворониной (Voronina, 2011), в хвойных лесах он встречается преимущественно в свободной от распространения корней и гиф базидиомицетов почве. Помимо этих видов в число доминантов (с обилием 10–12%) входят также Penicillium decumbens (участок III), P. simplicissimum и Mortierella alpina (участок IV).
В почве мочажины (V) комплекс доминирующих по обилию видов представлен пятью видами – Pseudogymnoascus pannorum (23%), Mortierella alpina (18%), Talaromyces funiculosus (17%), Penicillium simplicissimum (14%) и Mortierella antarctica (10%). Известно, что виды рода Mortierella являются активными грибами-эндофитами мохообразных, лишайников, сосудистых растений Арктики и Антарктики (Tossi et al., 2002; Mello et al., 2014; Münchberg et al., 2015; Fungi.., 2019), они широко представлены и зачастую доминируют в почвах этих регионов (Kirtsideli et al., 2014; Nikitin et al., 2019). В рассмотренном нами торфянике южной тундры, в отличие от торфяных почв лесотундры (Vinogradova et al., 2019), отмечены новые виды из рода Mortierella – Mortierella alliacea, M. antarctica, M. schmuckeri. Изоляты этих видов выделены из образцов торфа СТС почвы оголенного торфяного пятна (I), его краевой зоны (II) и мочажины (V) (табл. 1).
Некоторые виды микромицетов имеют четкую приуроченность к конкретным биотопам. Так, например, только из образцов СТС почвы торфяного пятна (I) были выявлены изоляты вида Cladosporium cladosporioides, из почвы краевой зоны пятна (II) – виды Penicillium aurantiogriseum и Trichoderma polysporum. В почве микропонижения с мохово-лишайниковым покровом (III) отмечено присутствие видов Talaromyces rugulosus и Penicillium olivicolor. В почве бугорка с кустарниково-моховой растительностью (IV) встречен вид Oidiodendron maius, являющийся микоризным эндофитом вересковых (Rice, 2006).
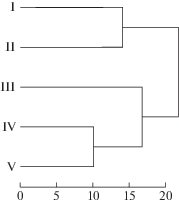
В целом, комплексы культивируемых микромицетов, представленные в СТС торфяных почв исследованных биотопов, достаточно видоспецифичны. Коэффициент Сёренсена–Чекановского (Ks) между разными парами почв варьирует от 50 до 67% (табл. 3). Согласно результатам кластерного анализа, почвы рассмотренных биотопов по составу видов культивируемых микромицетов образуют два кластера (рис. 7). Первый кластер представлен почвами участков I и II, в которых структура, состав и степень разложения торфа достаточно близки. Второй кластер образуют почвы всех остальных участков, общность видового состава микромицетов в которых может определяться присутствием (участки III, IV) или преобладанием (V) в составе торфа фрагментов сфагновых мхов, а также наличием опада и корней сосудистых растений.
Таблица 3.
Коэффициент сходства Сёренсена–Чекановского (%) комплексов культивируемых микромицетов, выявленных при анализе торфяной залежи в различных биотопах плоскобугристого болотного комплекса южной тундры
| Биотоп | Торфяное пятно (I) | Краевая зона торфяного пятна (II) | Микропонижение (III) | Бугорок (IV) | Мочажина (V) |
|---|---|---|---|---|---|
| Торфяное пятно (I) | − | ||||
| Краевая зона торфяного пятна (II) | 67 | − | |||
| Микропонижение (III) | 51 | 53 | − | ||
| Бугорок (IV) | 50 | 60 | 65 | − | |
| Мочажина (V) | 67 | 59 | 52 | 67 | − |
Рис. 7.
Дендрограмма сходства комплексов микромицетов в сезонноталых слоях торфяной залежи плоскобугристого болота южной тундры (кластеризация – по Варду, мера расстояния – Манхэттенское расстояние).
В арктических и субарктических регионах одним из основных факторов стресса для микроорганизмов являются низкие температуры среды, которые определяют различные стратегии адаптации к ним микробиоты, в том числе присутствие в составе микробных сообществ психротрофных и психрофильных групп микроорганизмов (Bergero et al., 1999; Hassan et al., 2016; Nikitin et al., 2019). В исследованных нами почвах плоскобугристого болота южной тундры количество видов-психрофилов, способных давать рост колоний только при температуре 4°С, незначительно. При этой температуре были идентифицированы изоляты Mortierella alliacea, M. schmuckeri, Mucor sp., Penicillium lividum. К типичным мезофилам (идентифицированы при температуре культивирования 25°С) можно отнести 14 видов микромицетов (Cladosporium cladosporioides, Akanthomyces muscarius, Alternaria alternata, Oidiodendron maius, Penicillium olivicolor, P. aurantiogriseum, P. roqueforti, Talaromyces diversus, T. rugulosus, Trichoderma hamatum, T. harzianum, T. koningii, T. viride, Umbelopsis ramanniana) и темноокрашенный стерильный мицелий. Остальные виды, в зависимости от биотопа, микрорельефа и типа почвы, могут вести себя либо как психрофилы, либо как психротрофы, либо как мезофилы. При этом в СТС всех рассмотренных почв основу микоценозов составляют психротрофы и мезофилы, на их долю приходится от 75 до 100% (рис. 8). Прослеживается достаточно четкий тренд уменьшения доли мезофилов от почвы торфяного пятна (I), наиболее теплообеспеченной в летний период, к почве бугорка с хорошо развитым кустарничково-моховым покровом (IV), играющим экранирующую роль при поступлении в почву тепла в летний период, и увеличения в этом направлении микромицетов – психрофилов. Особое положение в этом ряду занимает почва мочажины (V), в микоценозах которой, несмотря на наличие значительного количества спор не только в надмерзлотных горизонтах, но и во всей толще СТС (рис. 3), микромицеты, активно размножающиеся только при низких температурах (психрофилы), не зафиксированы. Последнее, скорее всего, связано с более низкими темпами роста почвенных микромицетов в этом биотопе, обусловленными сочетанным действием нескольких факторов стресса, наиболее значимыми из которых следует считать 1) низкие температуры и 2) недостаток кислорода в силу значительной обводненности почвенного профиля.
ЗАКЛЮЧЕНИЕ
Установлены закономерности пространственного распределения грибной биомассы и видового разнообразия культивируемых микромицетов в пределах сезонноталого слоя торфяных почв плоскобугристого болотного комплекса, формирующегося в биоклиматических условиях южной тундры. Показано, что сообщества культивируемых почвенных микромицетов представлены 40 видами микроскопических грибов из 12 родов, включая две формы стерильного мицелия. Доминируют в структуре микоценозов Pseudogymnoascus pannorum (77%), Mortierella alpina (65%) и светлоокрашенный стерильный мицелий (65%). Ведущие позиции по обилию занимают два вида – Talaromyces funiculosus (28%) и Pseudogymnoascus pannorum (16%). В торфяных почвах тундровой зоны, по сравнению с почвами лесотундры, отмечены новые виды микроскопических грибов из рода Mortierella – M. alliacea, M. antarctica, M. schmuckeri.
Почвы оголенного торфяного пятна, лишенного растительности (I, II), и бугорковатого микрокомплекса с мохово-лишайниковым (III) и кустарничково-моховым (IV) сообществами различаются по видовой насыщенности ведущих родов микромицетов. В первом случае наиболее насыщены видами роды Mortierella и Trichoderma, во втором – Penicillium. Почва мочажины (V) занимает промежуточное положение по видовой насыщенности родов.
На количественные характеристики микоценозов, представленных в СТС почв тундрового торфяника (величина грибной биомассы, видовое разнообразие, видовая насыщенность ведущих родов микромицетов), значимое влияние оказывают положение почвы в рельефе (микрорельефе) болотного комплекса и характер растительного покрова. Максимальными величинами концентрации грибной биомассы характеризуются СТС (до 30 см) почвы оголенного пятна (16.76–20.21 мг/г) и его краевой зоны, постепенно зарастающей мхами и лишайниками (11.49–18.39 мг/г). Во всех исследованных торфяных почвах в структуре грибной биомассы СТС в основном доминирует живой мицелий грибов, доля которого составляет 81–100% от общего количества учитываемого мицелия, на долю мертвого мицелия приходится 5–19%.
Работа выполнена в рамках темы государственного задания Института биологии Коми НЦ УрО РАН “Выявление общих закономерностей формирования и функционирования торфяных почв на территории Арктического и Субарктического секторов Европейского Северо-Востока России” (№ АААА-А17-117122290011-5).
Список литературы
Aleksandrova A.V., Velikanov L.L., Sidorova I.I. Key to species of the genus Trichoderma. Mikologiya i fitopatologiya. 2006. V. 40. P. 457–468 (in Russ.).
Ananyeva N.D., Polyanskaya L.M., Susyan E.A. et al. Comparative assessment of soil microbial biomass determined by the methods of direct microscopy and substrate-induced respiration. Microbiology. 2008. V. 77. P. 356–364. https://doi.org/10.1134/S0026261708030168
Andersen R., Chapman S.J., Artz R.R.E. Microbial communities in natural and disturbed peatlands: A Review. Soil Biol. Biochem. 2013. V. 57. P. 979–994. https://doi.org/10.1016/j.soilbio.2012.10.003
Arenz B.E., Held B.W., Jurgens J.A. et al. Fungal colonization of exotic substrates in Antarctica. Fungal Diversity. 2011. V. 49. P. 13–22. https://dx.doi.org/1007/s13225-010-0079-4
Bergero R., Girlanda M., Varese G.C. et al. Psychrooligotrophic fungi from Arctic soils of Franz Joseph Land. Polar Biol. 1999. V. 21. P. 361–368. https://doi.org/10.1007/s003000050374
Blaud A., Phoenix G.K., Osborn A.M. Variation in bacterial, archaeal and fungal community structure and abundance in High Arctic tundra soil. Polar Biol. 2015. V. 38. P. 1009–1024. https://doi.org/10.1007/s00300-015-1661-8
Cox F., Newsham K.K., Bol R. et al. Not poles apart: Antarctic soil fungal communities show similarities to those of the distant Arctic. Ecol. Lett. 2016. V. 19 (5). P. 528–536. https://doi.org/10.1111/ele.12587
Domsh K.H., Gams W., Anderson T.H. Compendium of soil fungi. IHW-Verlag, Eching. 2007.
Edgington S., Thompson E., Moore D. et al. Investigating the insecticidal potential of Geomyces (Myxotrichaceae: Helotiales) and Mortierella (Mortierellaceae: Mortierellales) isolated from Antarctica. Springer Plus. 2014. V. 3. P. 1–289. https://doi.org/doi:10.1186/2193-1801-3-289
Effmert U., Kalderás J., Warnke R. et al. Volatile mediated interactions between bacteria and fungi in the soil. J. Chem. Ecol. 2012. V. 38. P. 665–703. https://doi.org/10.1007/s10886-012-0135-5
Egorova L.N. Soil fungi of the Far East: Hyphomycetes. Nauka, Leningrad. 1986 (in Russ.).
Ellis M.B. Dematiaceous Hyphomycetes. Kew, 1971.
Fungi of Antarctica: Diversity, ecology and biotechnological application In: L.H. Rosa (ed.). Springer Nature, 2019.
Gaspar M.L., Cabello M.N., Pollero R. et al. Fluorescein diacetete hydrolysis as a measure of fungal biomass in soil. Current Microbiol. 2001. V. 42. P. 339–344. https://doi.org/10.1007/s002840010226
Grum-Grzhymaylo O.A., Bilanenko E.N. The micromycete complexes of bogs at the Kandalaksha bay of the White Sea. Mikologiya i fitopatologiya. 2012. V. 46. P. 297–305 (in Russ.).
Hassan N., Rafiq M., Hayat M. et al. Psychrophilic and psychrotrophic fungi: a comprehensive review. Rev. Envir. Sci. Bio/Tech. 2016. V. 15. P. 147–172. https://doi.org/10.1007/s11157-016-9395-9
Kanse O.S., Whitelaw-Weckert M., Kadam T.A. Phosphate solubilization by stress-tolerant soil fungus talaromyces funiculosus SLS8 isolated from the Neem rhizosphere. Ann. Microbiol. 2015. V. 65. P. 85–93. https://doi.org/10.1007/s13213-014-0839-6
Kaverin D.A., Pastukhov A.V., Lapteva E.M. et al. Morphology and properties of the soils of permafrost peatlands in the southeast of the Bolshezemelskaya tundra. Eurasian Soil Sci. 2016. V. 49. P. 498–511. https://doi.org/10.1134/S1064229316050069
Kaverin D.A., Pastukhov A.V., Novakovsky A.B. et al. Landscape and climatic factors impacting the thaw depth in soils of permafrost peat plateaus (on the example of calm r52 site). Kriosfera Zemli. 2019. V. 23. P. 61–71 (in Russ.). https://doi.org/10.21782/KZ1560-7496-2019-2(62-71)
Kirtsideli I.Yu. Microscopic fungi in the soils of Hays Island (Franz Josef Land). Novosti sistematiki nizshikh rasteniy. 2015. V. 49. P. 151–160 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Barantsevich E.P. et al. Microfungi from soil of polar island Izvestia TSIK (Kara Sea). Mikologiya i fitopatologiya. 2014. V. 48 (6). P. 365–371 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Novozhilov Yu.K. et al. Assessment of anthropogenic influence on antarctic mycobiota in areas of Russian polar stations. Contemporary Problems of Ecology. 2018. Vol. 11 (5). P. 449–457. https://doi.org/10.1134/S1995425518050074
Kirtsideli I.Yu., Vlasov D.Yu., Zelenskaya M.S. et al. Assessment of anthropogenic invasion of microfungi in arctic ecosystems (exemplified by Spitsbergen archipelago). Gigiena i sanitariya. 2020. V. 99 (2). P. 145–151 (in Russ.). https://doi.org/10.33029/0016-9900-2020-99-2-145-151
Kochkina G.A., Ivanushkina N.E., Ozerskaya S.M. Structure of mycobiota of permafrost. Mikologiya segodnya. 2011. V. 2. P. 178–184 (in Russ.).
Kochkina G.A., Ozerskaya S.M., Ivanushkina N.E. et al. Fungal diversity in the Antarctic active layer. Microbiology. 2014. V. 83 (1–2). P. 94–101. https://doi.org/10.1134/S002626171402012X
Korneykova M.V., Evdokimova G.A., Lebedeva E.V. The complexes of potentially pathogenic microscopic fungi in anthropogenic polluted soils of Kola North. Mikologiya i fitopatologiya. 2012. V. 46 (5). P. 323–328 (in Russ.).
Korneikova M.V. Comparative analysis of number and structure of the complexes of microscopic fungi in tundra and taiga soils in the north of the Kola Peninsula. Eurasian Soil Science. 2018. V. 51 (1). P. 86–92. https://doi.org/10.7868/S0032180X18010094
Kurakov A.V. Methods for isolation and characterization of complexes of microscopic fungi in terrestrial ecosystems. Moscow, Maks Press, 2001 (in Russ.).
Kurakov A.V., Semenova T.A. Species diversity of microfungi in the forest ecosystems of southern taiga in the European part of Russia. Mikologiya i fitopatologiya. 2016. V. 50. P. 367–378 (in Russ.).
Lapteva E.M., Vinogradova Yu.A., Chernov T.I. et al. Structure and diversity of soil microbial communities in the permafrost peatlands in the north-west of Bolshezemelskaya tundra. Izvestiya Komi Nauchnogo Tsentra. 2017. V. 4. P. 5–10 (in Russ.).
Lavrinenko I.A. Geobotanical division into districts (regionalization) of the Bolshezemelskaya tundra and surrounding areas. Geobotanicheskoye kartografirovanie. 2013. P. 74–92 (in Russ.). https://doi.org/10.31111/geobotmap/2013.74
Magurran E. Ecological diversity and its measurement. Mir, Moscow. 1992 (in Russ.).
Marfenina O.E., Nikitin D.A., Ivanova A.E. The structure of fungal biomass and diversity of cultivated micromycetes in Antarctic soils (Progress and Russkaya Stations). Eurasian Soil Sci. 2016. V. 49 (8). P. 934–941. https://doi.org/10.1134/S106422931608007X
Matyshak G.V., Bogatyrev L.G., Goncharova O.Y. et al. Specific features of the development of soils of hydromorphic ecosystems in the northern taiga of Western Siberia under conditions of cryogenesis. Eurasian Soil Sci. 2017. V. 50 (10). P. 1115–1124. https://doi.org/10.1134/S1064229317100064
Melo I.S., Santos S.N., Rosa L H. et al. Isolation and biological activities of an endophytic Mortierella alpina strain from the Antarctic moss Schistidium antarctici. Extremophiles. 2014. P. 15–23. https://doi.org/10.1007/s00792-013-0588-7
Methods of soil microbiology and biochemistry. Moscow, 1991 (in Russ.).
Münchberg U., Wagner L., Rohrer C. et al. Quantitative assessment of the degree of lipid unsaturation in intact Mortierella by Raman microspectroscopy. Anal Bioanal Chem. 2015. V. 407. P. 3303–3311. https://doi.org/10.1007/s00216-015-8544-2
Nikitin D.A., Semenov M.V., Semikolennykh A.A. et al. Biomass of fungi and species diversity of the cultivated mycobiota of soils and substrates in Northbrook Island (Franz Josef Land). Mikologiya i fitopatologiya. 2019. V. 53 (4). P. 210–222 (in Russ.). https://doi.org/10.1134/S002636481904010X
Novakovskiy A.B. The interaction between Excel and the statistical package R for data processing in ecology. Vestnik Instituta biologii. 2016. V. 3. P. 26–33 (in Russ.).
Ogneva O.A., Matyshak G.V., Goncharova O.Yu. et al. Soils of peat spots of frozen peatlands in the north of West Siberia. Kriosfera Zemli. 2016. V. 20 (2). P. 61–68 (in Russ.).
Ozerskaya S.M., Kochkina G.A., Ivanushkina N.E. et al. The structure of micromycete complexes in permafrost and cryopegs of the Arctic. Microbiology. 2008. V. 77 (4). P. 482–489. https://doi.org/10.1134/S0026261708040152
Peršoh D. Plant-associated fungal communities in the light of meta’omics. Fungal Diversity. 2015. V. 75. P. 1–25. https://doi.org/10.1007/s13225-015-0334-9
Ping C.L., Michaelson G.J., Jorgenson M.T. et al. High stocksof soil organic carbon in the North American Arctic region. Nature Geoscience. 2008. V. 1. P. 615–619. https://doi.org/10.1038/ngeo284
Pitt J. A laboratory guide to common Penicillium species. Commonwealth scientific and industrial research organization. N.S.W., 1991.
Polyanskaya L.M. Microbial succession in the soil. Autoref. Dr. Sci. thesis. Moscow, 1996.
Ramirez C. Manual and atlas of the Penicillia. Elsevier Biomedical Press, Amsterdam etc., 1982.
Rice A.V., Currah R.S. Oidiodendron maius: Saprobe in sphagnum peat, mutualist in ericaceous roots? In: Schulz B., Boyle C., Sieber T. (eds.) Microbial root endophytes. Springer, Berlin, 2006. P. 227–246.
Ruisi S., Barreca D., Selbmann L. et al. Fungi in Antarctica. Rev. Environ. Sci. Biotechnol. 2007. V. 6. P. 127–141. https://doi.org/10.1007/s11157-006-9107-y
Seppälä M. Palsa mires in Finland. The Finnish environment. 2006. V. 23. P. 155–162.
Sergeeva M.A., Inisheva L.I. Biochemical processes in oligotrophic peat deposits of the Vasyugan swamp. Vestnik TGPU. 2008. V. 4 (78). P. 57–63 (in Russ.).
Soil functions in the biosphere and ecosystems. In: G.V. Dobrovolsky end E.D. Nikitin (eds.). Nauka, Moscow, 1990 (in Russ.).
Sonjak S., Frisvad J.C., Gunde-Cimerman N. Penicillium mycobiota in Arctic subglacial ice. Microb. Ecol. 2006. V. 52. P. 207–216.
Sterflinger K., Tesei D., Zakharova K. Fungi in hot and cold deserts with particular reference to microcolonial fungi. Fungal Ecol. 2012. V. 5 (4). P. 453−462. https://doi.org/10.1016/j.funeco.2011.12.007
Timling I., Walker D.A., Nusbaum C. et al. Rich and cold: diversity, distribution and drivers of fungal communities in patterned-ground ecosystems of the North American Arctic. Molecular Ecol. 2014. V. 23 (13). P. 3258–3272. https://doi.org/doi:10.1111/mec.12743
Tosi S., Casado B., Gerdol R. et al. Fungi isolated from Antartic mosses. Polar Biol. 2002. V. 25. P. 262–268. https://doi.org/10.1007/s00300-001-0337-8
Vasilevich R.S., Beznosikov V.A., Lodygin E.D. Molecular structure of humus substances in permafrost peat mounds in forest-tundra. Eurasian Soil Sci. 2019. V. 52 (3). P. 283–295. https://doi.org/10.1134/S1064229319010150
Vinogradova Yu.A., Lapteva E.M., Kovaleva V.A. et al. Profile distribution pattern of microfungi in the permafrost-affected peatland of forest-tundra. Mikologiya i fitopatologiya. 2019. V. 53 (6). P. 342–353 (in Russ.). https://doi.org/10.1134/S0026364819060072
Voronina E.Yu. The influence of mycorrhizosphere on species composition and community structure of soil microfungi in comparison with rhizosphere and hyphosphere effects. Mikologiya i fitopatologiya. 2011. V. 45 (1). P. 26–34 (in Russ.).
Yakushev A.V., Matyshak G.V., Tarhov M.O. et al. Microbiological characteristics of bare peat circles on flat-topped peat mounds in the north of Western Siberia. Eurasian Soil Science. 2019. V. 52 (9). P. 1081–1090. https://doi.org/10.1134/S1064229319090114
Виноградова Ю.А., Лаптева Е.М., Ковалева В.А. и др. (Vinogradova et al.) Распределение микроскопических грибов в многолетнемерзлых торфяниках лесотундры // Микология и фитопатология. 2019. Т. 53. № 6. С. 342–353.
Воронина Е.Ю. (Voronina) Влияние микоризосферы на видовой состав и сруктуру сообщества почвенных микромицетов по сравнению с ризосферным и гифосферным эффектами // Микология и фитопатология. 2011. Т. 45. № 1. С. 26–34.
Грум-Гржимайло О.А., Биланенко Е.Н. (Grum-Grzhymaylo et al.) Комплексы микромицетов верховых болот побережья Кандалакшского залива Белого моря // Микология и фитопатология. 2012. Т. 46. № 5. С. 297–305.
Егорова Л.Н. (Egorova) Почвенные грибы Дальнего Востока: Гифомицеты. Л.: Наука, 1986. 191 с.
Каверин Д.А., Пастухов А.В., Новаковский А.Б. и др. (Kaverin et al.) Влияние ландшафтных и климатических факторов на глубину сезонного протаивания в почвах бугристых торфяников (на примере площадки CALM R52) // Криосфера Земли. 2019. Т. 23. № 2. С. 62–71.
Кирцидели И.Ю. (Kirtsideli) Микроскопические грибы в почвах острова Хейса (Земля Франца Иосифа) // Новости систематики низших растений. 2015. Т. 49. С. 151–160.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П. и др. (Kirtsideli et al.) Комплексы микроскопических грибов в почвах и грунтах полярного острова Известий ЦИК (Карское море) // Микология и фитопатология. 2014. Т. 48. № 6. С. 365–371.
Кирцидели И.Ю., Власов Д.Ю., Зеленская М.С. и др. (Kirtsideli et al.) Оценка антропогенной инвазии микроскопических грибов в арктические экосистемы (Архипелаг Шпицберген) // Гигиена и санитария. 2020. Т. 99. № 2. С. 145–151.
Корнейкова М.В., Евдокимова Г.А., Лебедева Е.В. (Korneikova et al.) Комплексы потенциально патогенных микроскопических грибов в антропогенно-загрязненных почвах Кольского Севера // Микология и фитопатология. 2012. Т. 46. № 5. С. 323–328.
Кочкина Г.А., Иванушкина Н.Е., Озерская С.М. (Kochkina et al.) Структура микобиоты многолетней мерзлоты // Микология сегодня. Т. 2. Национальная академия микологии. 2011. С. 178–186.
Кураков А.В. (Kurakov) Методы выделения и характеристика комплексов микроскопических грибов наземных экосистем: Учебное пособие. М.: Макс Пресс, 2001. 92 с.
Кураков А.В., Семенова Т.А. (Kurakov et al.) Видовое разнообразие микроскопических грибов в лесных экосистемах южной тайги европейской части России // Микология и фитопатология Т. 50. № 6. С. 367–378.
Лавриненко И.А. (Lavrinenko) Геоботаническое районирование Большеземельской тундры и прилегающих территорий // Геоботаническое картографирование. 2013. СПб. С. 74–92.
Лаптева Е.М., Виноградова Ю.А., Чернов Т.И. и др. (Lapteva et al.) Структура и разнообразие почвенных микробных сообществ в бугристых болотах северо-запада Большеземельской тундры // Известия Коми научного центра. 2017. № 4. С. 5–10.
Методы почвенной микробиологии и биохимии / под ред. Д.Г. Звягинцева (Methods). М.: МГУ, 1991. 304 с.
Мэгарран Э. Экологическое разнообразие и его измерение (Magurran). Москва: Мир, 1992. 161 с.
Никитин Д.А., Семенов М.В., Семиколенных А.А. и др. (Nikitin et al.) Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нотртбрук (земля Франца-Иосифа) // Микология и фитопатология. 2019. Т. 53. № 4. С. 213–231.
Новаковский А.Б. (Novakovskiy) Взаимодействие Excel и статистического пакета R для обработки данных в экологии // Вестник Института биологии Коми НЦ УрО РАН. 2016. № 3. С. 26–33.
Огнева О.А., Матышак Г.В., Гончарова О.Ю. и др. (Ogneva et al.) Почвы торфяных пятен бугристых торфяников севера Западной Сибири // Криосфера Земли. 2016. Т. 20. № 2. С. 61–68.
Полянская Л.М. (Polyanskaya) Микробная сукцессия в почве. Автореф. дис. … докт. биол. наук. М., 1996. 96 с.
Сергеева М.А., Инишева Л.И. (Sergeeva et al.) Биохимические процессы в олиготрофных торфяных залежах Васюганского болота // Вестник ТПГУ. 2008. Вып. 4 (78). С. 57–63.
Функции почв в биосфере и экосистемах (Soil functions). М. : Наука, 1990. 260 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология