Микология и фитопатология, 2021, T. 55, № 3, стр. 165-177
Оппортунистические грибы прибрежных территорий Кольского залива Баренцева моря
Е. А. Исакова 1, 2, *, М. В. Корнейкова 2, 3, **
1 Кольский научный центр РАН
184209 Апатиты, Россия
2 Институт проблем промышленной экологии Севера КНЦ РАН
184209 Апатиты, Россия
3 Российский университет дружбы народов
117198 Москва, Россия
* E-mail: ya.kristina-i2014@yandex.ru
** E-mail: korneykova.maria@mail.ru
Поступила в редакцию 04.08.2020
После доработки 07.11.2020
Принята к публикации 21.12.2020
Аннотация
Представлены данные по видовому разнообразию и потенциальной патогенности микроскопических грибов, выделенных из субстратов прибрежных территорий Кольского залива Баренцева моря. Из 34 видов микромицетов, относящихся к родам Acremonium, Aspergillus, Fusarium, Isaria, Penicillium, Trichoderma, Purpureocillium отдела Ascomycota, 23 вида встречались в объектах пос. Белокаменка и 25 видов – г. Кола. Общими оказались 14 видов микроскопических грибов, принадлежащих к родам Acremonium, Aspergillus, Isaria, Trichoderma, Penicillium. Среди выделенных микромицетов 24 вида (71%) относились к группе потенциально патогенных, из которых доминантными видами по индексу обилия в пос. Белокаменка были 21% видов грибов: Acremonium charticola, Isaria farinosа, Penicillium aurantiogriseum st. 1, P. simplicissimum st. 1, Talaromyces purpureogenus, Trichoderma viride st. 1. В г. Кола по данному экологическому показателю доминировали 15% выделенных микромицетов: Fusarium oxysporum, Penicillium decumbens, P. spinulosum st. 1, P. aurantiogriseum st. 1., Trichoderma viride st. 2. По результатам оценки протеазной и фосфолипазной активностей грибов и способности роста при 37°С семь штаммов обладали тремя факторами патогенности. Микромицеты Aspergillus flavus st. 1, A. flavus st. 2, A. niger, Talaromyces purpureogenus, P. glabrum, P. simplicissimum st. 2, Isaria farinosa могут представлять потенциальную угрозу человеку в суровых природно-климатических условиях Крайнего Севера в виде инвазий на клеточном и тканевом уровнях.
ВВЕДЕНИЕ
В настоящее время прибрежные зоны и морские акватории испытывают значительные антропогенные нагрузки, обусловленные поступлением больших объемов различных загрязняющих веществ (Boychenko, 2019). В то же время в прибрежных районах происходит наиболее интенсивное биопродуцирование органического вещества, сосредоточены основные ресурсы моря (Nemirovskaya, 2013). Загрязняющие вещества способны стимулировать развитие патогенных микроорганизмов, приводить к увеличению их численности, тем самым повышая риски дополнительного загрязнения окружающей среды и ставя под сомнение ее биологическую безопасность.
На сегодняшний день проблемам биологической безопасности уделяется все большее внимание (Ozerskaya et al., 2011). Так, в последние десятилетия широко и активно изучается вопрос контаминации грибами среды обитания человека и проблемы формирования специфических антропогенных микоценозов, негативно влияющих на его здоровье (Hedayati et al., 2007; Marfenina, Fomicheva, 2007; Vicente et al., 2008; Bogomolova et al., 2009; Ozerskaya et al., 2011; Kuzikova et al., 2012; Šegvić Klarić, 2012; Sobolev, Aak, 2012; Park et al., 2013; Babaeva et al., 2015; Mosina et al., 2017; Hadebe, Brombacher, 2019; Krylova et al., 2019; Reddy et al., 2019; Yen et al., 2020; Sangeetha et al., 2020; Tayeb, 2020).
Среди широкого многообразия микроскопических грибов в природе существуют потенциально патогенные грибы (ППГ), которые способны вызывать микозы человека (De Hoog et al., 2000; Ozerskaya et al., 2007). Такие микромицеты также называют оппортунистическими грибами. Они обитают во внешней среде, разлагая отмерший органический субстрат или паразитируя на растениях (Kulko, 2012). При благоприятных условиях грибы-оппортунисты в виде спор или фрагментов мицелия внедряются в ткани человека и размножаются, давая начало микотическому процессу и вызывая различные по локализации и клиническим формам микозы (Zachinyaeva et al., 2018; Gosma-nov et al., 2019). Обычной причиной заражения возбудителями микозов во внешней среде является вдыхание спор грибов, а в случае повреждения кожных покровов занос в раны инфекции, причем часто из почвы. При вдыхании крупные споры (более 5 мкм) проникают недалеко и обычно вызывают заболевания носоглотки, в первую очередь, синуситы. Более мелкие споры (1–5 мкм) могут достигать альвеол и вызывать глубокие микозы (Marfenina, Fomicheva, 2007). Главная причина развития микозов – изменение функциональной активности иммунной системы (Zachinyaeva et al., 2018).
В различных странах и международных организациях используются разные классификации патогенных и условно-патогенных микроорганизмов по категориям биологического риска. По определению Европейского экономического сообщества (Directive 2000/54/EC, 2000) выделяют “уровни биологического риска” (biosafety level, BSL) от BSL 4 – самого высокого, до BSL 1 – самого низкого, к которому относят грибы, способные вызывать заболевания человека в случае значительного снижения иммунного статуса. В Российской Федерации согласно Санитарно-эпидемиологическим правилам СП 1.3.2322-08 используют понятие “группы патогенности” от первой группы – самой опасной, где грибов нет, до четвертой, включающей условно патогенные грибы (Ozerskaya et al., 2007; Elinov et al., 2011). Однако принципиальным отличием двух разных систем является то, что российские правила заранее считают включенные в списки виды микроорганизмов опасными для человека, присваивая им статус определенной группы патогенности. В значительной степени такое присвоение статуса патогенности не соответствует действительности, т.к. патогенные свойства каждого отдельного штамма должны быть проверены и доказаны. В особенности это может быть отнесено к видам, включенным в четвертую группу патогенности, куда в настоящее время входит огромное число видов грибов – как известных возбудителей дерматомикозов, так и обычных, широко распространенных, почвенных грибов (Elinov et al., 2011).
В современной ситуации невозможно предсказать, какие микроорганизмы, ранее не упоминавшиеся в качестве возбудителей инфекционных заболеваний, при создании определенных экологических условий в совокупности с ослабленной имунной системой человека могут оказаться серьезными патогенами (Ozerskaya et al., 2007). Мурманская обл., как регион Крайнего Севера, является зоной с суровыми природно-климатическими факторами, такими как низкие температуры, высокая относительная влажность, тяжелый аэродинамический режим и др. Система дыхания человека в таких условиях является открытой к контакту с неблагоприятными природно-климатическими факторами и испытывает большую нагрузку с их стороны (Gudkov, Popova, 2008). Поэтому потенциально патогенные грибы, первостепенно инвазирующие органы дыхания, представляют наибольший интерес в плане оценки экологической безопасности среды обитания человека.
Цель работы – изучение видового состава комплексов микроскопических грибов прибрежных территорий Кольского залива Баренцева моря, выявление среди них оппортунистических грибов с последующей оценкой их потенциальной патогенности на основе анализа ферментативной активности и способности роста при температуре 37°С.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор образцов субстратов (морская вода, затапливаемый прибрежный грунт, прибрежная почва) проводили в районе Кольского залива Баренцева моря в точках г. Кола и пос. Белокаменка в октябре 2017 г. (рис. 1).
Водные и почвенные образцы отбирали стерильно в 3–5-кратной повторности по стандартным методикам (Zvyagintsev, 1991; GOST 31861-2012). Всего проанализировано 28 образцов, каждый их которых анализировали в трех повторностях. Для приготовления почвенной суспензии навеску почвы с учетом влажности растворяли в воде, затем готовили суспензии до второго 10–2 (песок) и третьего 10–3 (почвогрунты) разведения. Водные пробы анализировали без разведения. Учет численности микроскопических грибов проводили методом глубинного посева (по 0.5 мл соответствующей суспензии) на питательную среду сусло-агар с последующим выделением чистых культур. Чистые культуры микромицетов хранили в криопробирках с глицерином в низкотемпературной морозильной камере Premium U410 (Германия) при –72°С. Идентификацию грибов выполняли с использованием светового микроскопа Olympus CX41 (Япония) на основе культурально-морфологических признаков по определителям российских и зарубежных авторов (Egorova, 1986; Klich, 2002; Domsch et al., 2007), названия таксонов унифицировали с использованием базы данных Index Fungorum (2020).
Для характеристики структуры сообществ культивируемых грибов прибрежных территорий Баренцева моря определяли индекс обилия видов, который показывает их значимость в данных сообществах и равен отношению колоний конкретного вида к общему числу колоний, выросших при посеве образцов данного объекта (Kurakov, 2001).
Списки потенциально патогенных видов грибов уточняли по определителям (De Hoog et al., 2000; Satton et al., 2001), руководству (Elinov et al., 2011) и на основе нормативного документа SP 1.3.2322-08.
Микроскопические грибы, относящиеся к ППГ (29 видов), анализировали на наличие протеазной и фосфолипазной активности, а также на способность роста при температуре 37°С. Фосфолипазную активность определяли на питательной среде с яичным желтком (Price et al., 1982), протеазную активность – на питательной среде с добавлением бычьего сывороточного альбумина (Fotedar, Al-Hedaithy, 2005). Инокулируемые микромицетами чашки Петри инкубировали при температуре 27°С в течение 7–10 суток. Затем измеряли диаметр колонии и диаметр колонии с зоной помутнения/просветления, образующейся под воздействием внеклеточных фосфолипаз/протеаз гриба. Коэффициент ферментативной активности определяли по формуле П = Дк/Д (к + з.п.), где Дк – диаметр колонии, Д (к + з.п.) – диаметр колонии с учетом зоны помутнения/просветления. Значение коэффициента ферментативной активности равное 1.0 свидетельствовало об отсутствии ее у исследуемых микромицетов; значения коэффициента, равные 0.6–0.4 и ниже, указывали на интенсивное выделение в среду экзоферментов (Price et al., 1982; Fotedar, Al-Hedaithy, 2005).
У быстрорастущих грибов фосфолипазную и протеазную активность определяли на 3–4-е сутки инкубирования в связи с активным ростом и обильным спороношением.
Исследование роста и выживаемости культур грибов при температуре 37°С проводили на агаризованной среде Чапека. Грибы первоначально выращивали при комнатной температуре в течение нескольких дней (для контроля жизнеспособности культуры). После появления визуально различимой зоны роста колонии фиксировали ее диаметр и помещали культуру в термостат, где инкубировали в течение 7–15 дней при температуре 37°С. При отсутствии роста в течение 15 дней продолжали инкубировать культуру при комнатной температуре и определяли ее жизнеспособность. Часть культур теряла жизнеспособность в период инкубации при температуре 37°С (Kirtsideli, 2019).
Каждый штамм тестировали в трех повторностях. Статистическую обработку данных проводили при помощи программы Microsoft Office Excel, 2010.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видовое разнообразие микромицетов. Видовое разнообразие микроскопических грибов прибрежных территорий Баренцева моря относительно небогатое. Всего из образцов исследуемых субстратов г. Кола и пос. Белокаменка было выделено 80 изолятов микромицетов, принадлежащих к 34 видам из 10 родов отдела Ascomycota: Acremonium, Aspergillus, Fusarium, Isaria, Paecilomyces, Penicillium, Purpureocillium, Sarocladium, Talaromyces, Trichoderma (табл. 1).
Таблица 1.
Видовой состав и обилие (%) микроскопических грибов, выделенных с прибрежных территорий Баренцева моря
| Виды микромицетов | пос. Белокаменка | г. Кола | ||||
|---|---|---|---|---|---|---|
| субстраты | ||||||
| В | З/Г | П | В | З/Г | П | |
| *Acremonium charticola (Lindau) W. Gams | 71 | 22 | 8 | 10 | ||
| *Acremonium sp. st. 1 | 0.8 | |||||
| *Acremonium sp. st. 2 | 30 | |||||
| *Aspergillus flavus Link st. 1 | 5 | 0.6 | ||||
| *A. flavus Link st. 2 | 6 | |||||
| *A. fumigatus Fresen. | 25 | 1.6 | 11.5 | |||
| *A. niger Tiegh. | 11 | 1 | 10 | |||
| *Fusarium oxysporum Schltdl. | 33 | |||||
| *Isaria farinosa (Holmsk.) Fr. | 40 | 23 | 21 | 28 | ||
| *Paecilomycessр. | 2 | |||||
| *Penicillium aurantiogriseum Dierckx st. 1 | 67 | 35 | 12 | |||
| *P. aurantiogriseum Dierckx st. 2 | 1 | |||||
| *P. brevicompactum Dierckx | 7 | |||||
| *P. camemberti Thom | 20 | |||||
| *P. canescens Sopp | 7 | |||||
| *P. chrysogenum Thom | 2 | 3.6 | ||||
| P. corylophilum Dierckx | 71 | 22 | 8 | |||
| *P. decumbens Thom | 33 | 1.7 | ||||
| P. dierckxii Biourge | 12 | |||||
| *P. glabrum (Wehmer) Westling | 25 | |||||
| P. hirsutum Dierckx | 7 | 37 | 6.5 | |||
| P. implicatum Biourge | 1 | |||||
| P. jensenii K.W. Zaleski | ||||||
| *P. miczynskii K.W. Zaleski | 1.7 | |||||
| P. nalgiovense Laxa | 17 | |||||
| *P. simplicissimum (Oudem.) Thom st. 1 | 59 | 9 | 24 | |||
| *P. simplicissimum (Oudem.) Thom st. 2 | 26 | 4 | ||||
| P. raistrickii G. Sm. | 34 | 8 | ||||
| *P. spinulosum Thom st. 1 | 59 | 33 | 1.7 | |||
| *P. spinulosum Thom st. 2 | 50 | 16 | ||||
| P. thomii Maire | 9 | 1.7 | ||||
| Penicillium sр. | 11 | |||||
| *Purpureocillium lilacinum (Thom) Luangsa-ard, Houbraken, Hywel-Jones et Samson | 20 | 36 | ||||
| *Sarocladium terricola (J.H. Mill., Giddens et A.A. Foster) A. Giraldo, Gené et Guarro | 1.7 | |||||
| *Talaromyces purpureogenus Samson, N. Yilmaz, Houbraken, Spierenb., Seifert, Peterson, Varga et Frisvad | 17 | 9 | 5 | 10 | ||
| *Trichoderma koningii Oudem. | 7 | 5 | 15 | 20 | ||
| T. polysporum (Link) Rifai | 6.5 | 1.6 | 5.7 | |||
| *Trichoderma viride Pers. st. 1 | 4 | 52 | ||||
| *T. viride Pers. st. 2 | 8 | 37 | 52 | |||
| Светлоокрашенный мицелий | 1.6 | |||||
Большинство выделенных родов (Penicillium, Trichoderma, Acremonium, Fusarium, Isaria) встречаются в районах арктических поселений (Kirtsideli et al., 2011, 2016; Evdokimova, 2014; Evdokimova et al., 2016), в водах, донных грунтах и береговых экотопах арктических морей (Bubnova, 2005, 2017а; Bubnova, Nikitin, 2017b; Bubnova et al., 2018a, 2018b; Kirtsideli et al., 2012), в почвах и грунтах полярных пустынь (Kirtsideli, 2015). Эти грибы можно считать космополитами, они, вероятнее всего, попадают в Арктику вместе с человеком (Kirtsideli et al., 2016). Среди них значительную долю составляют условно патогенные грибы, а также известные деструкторы материалов (Kirtsideli et al., 2011, 2016). Кроме того, в работах авторов (Bubnova, Nikitin, 2017b; Bubnova et al., 2018а, 2018b; Kirtsideli et al., 2012, 2018) выявлены темноокрашенные грибы, а также представители отдела Mucoromycota. Однако в наших исследованиях таких грибов выявлено не было. Возможно, это связано со специфичностью исследуемых субстратов, т.к. песок и прибрежная почва существенно отличаются от фоновых почв Севера.
Среди микромицетов, выделенных из субстратов прибрежных зон Баренцева моря, 23 (68%) видов встречались в пос. Белокаменка, из них 7 (20%) обнаружены в морской воде, 18 (53%) – в затапливаемых грунтах, 13 видов (38%) – в почве береговой линии. В г. Кола было выделено 25 видов микромицетов, 4 вида (11%) из которых встречались в морской воде, 19 (56%) – в затапливаемых грунтах и 13 видов (38%) – в почвах. В затапливаемых грунтах в г. Кола также была выделена группа грибов со стерильным мицелием.
Общими для изучаемых местообитаний г. Кола и пос. Белокаменка оказались 14 видов микромицетов, среди них представители родов Penicillium (7 видов), Aspergillus (3 вида), Trichoderma (2 вида), Acremonium и Isaria (по 1 виду) (см. табл. 1).
Оппортунистические грибы исследуемых местообитаний. К группе потенциально патогенных, среди всех выделенных грибов из субстратов прибрежных территорий Баренцева моря, принадлежали 24 вида (71%), в числе которых по количеству преобладали роды Penicillium, Acremonium, Aspergillus (табл. 1). Грибы этих родов встречались во всех анализируемых субстратах, что свидетельствует об их эвритопности, т.е. широком диапазоне толерантности к неблагоприятным экологическим условиям и способности утилизировать разные субстраты, по сравнению с другими видами микромицетов изучаемых местообитаний.
Причиной такого большого количества потенциально патогенных грибов в изучаемых субстратах может быть, с одной стороны, смещение их рН в область нейтральной и слабощелочной реакции (Marfenina, 2002), а с другой стороны, наличие в них дополнительных источников питания для грибов в виде загрязняющих веществ органической и неорганической природы.
Необходимо отметить, что больше половины выделенных видов для каждого субстрата относились к группе ППГ (табл. 2). Наибольшим разнообразием микромицетов как в пос. Белокаменка, так и в г. Кола отличался затапливаемый грунт, который представляет собой приливно-отливную зону морской акватории и характеризуется привносом видов из морской воды и прибрежной почвы. В данном субстрате в г. Кола обнаружено 56% от всех выделенных грибов, в пос. Белокаменка – 53%; на долю ППГ для обоих местообитаний приходилось по 38% грибов. В почвенных субстратах обоих местообитаний выделено по 38% грибов; при этом потенциально патогенными оказались почти все выделенные виды. Наименьшее количество видов микромицетов характерно для морской воды, где разница по их количеству в обоих районах исследования отличалась почти в два раза.
В пос. Белокаменка в субстрате “морская вода” по индексу обилия среди потенциально патогенных доминировали грибы Acremonium charticola, Penicillium simplicissimum st. 1, P. spinulosum st. 1 (см. табл. 1). В затапливаемых грунтах в данном местообитании оказались значимыми P. aurantiogriseum st. 1 и Isaria farinosa, в прибрежной почве – Trichoderma viride st. 1. В г. Кола среди ППГ в субстрате морская вода доминировали Fusarium oxysporum, Penicillium decumbens, P. spinulosum st. 1, в затапливаемых грунтах – P. aurantiogriseum st. 1. Микромицет Trichoderma viride st. 2 доминировал и в затапливаемых грунтах, и в прибрежных почвах.
Особого внимания заслуживает факт, что среди ППГ исследуемых субстратов Баренцева моря были выделены характерные для более южных широт виды Aspergillus flavus, A. fumigatus, А. niger (табл. 1). Ранее в наших работах было отмечено увеличение количества таких видов, а также установлена тенденция увеличения доли потенциально патогенных грибов в загрязненных нефтепродуктами почвах Кольского полуострова (Korneykova et al., 2011) и промышленно загрязненных районах Мурманской области (Korneykova, Lebedeva, 2017).
Экзоферментная активность оппортунистических грибов. Потенциальная патогенность грибов определяется комплексом свойств адаптационного характера, позволяющих им противостоять защитным механизмам организма и осуществлять инвазию (Kuzikova et al., 2011). Такими факторами патогенности оппортунистических грибов являются способность роста при температуре 37°С, меланизация, капсуляция клеток, мицелиально-дрожжевой диморфизм, способность к экстраклеточной секреции протеиназ и фосфолипаз и ряд других свойств (Cox et al., 2001; De Bernardis et al., 2001; Zachinyaeva et al., 2018).
Белки и фосфолипиды человека, выступающие основными компонентами клеточных оболочек, являются мишенью для атаки внеклеточных ферментов грибов (Kuzikova et al., 2011). Гидролитические грибные экзоферменты протеиназы способны разрушать поверхностный роговой слой кожи, а фосфолипазы – мембраны клеток тканей человека (Babaeva et al., 2015).
Результаты исследования экзоферментной активности оппортунистических грибов, выделенных из субстратов прибрежных территорий Кольского залива Баренцева моря, представлены на рис. 2.
Рис. 2.
Экзоферментная активность микроскопических грибов, выделенных из субстратов прибрежных территорий Кольского залива Баренцева моря: ПА – протеазная активность; ФА – фосфолипазная активность; *грибы, у которых отмечен рост при 37°С.
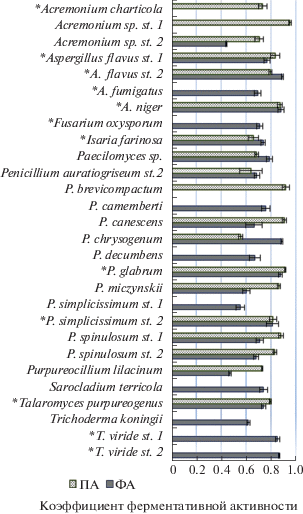
Фосфолипазная активность обнаружена у 25 видов (86%) ППГ. Величина коэффициента фосфолипазной активности изменялась от 0.44 до 0.87. Наиболее существенные значения этого показателя (0.44–0.62) отмечены у пяти видов: Acremonium st. 2, Purpureocillium lilacinum, Penicillium simplicissimum st. 2, P. miczynskii, Trichoderma koningii.
Известно, что фосфолипазы С по принципу действия субстратной специфичности работают как фосфатазы, расщепляя глицерофосфатную связь фосфолипидов с высвобождением внеклеточных сигнальных молекул (инозитолтрифосфатов) (Cocco et al., 2015; Filkin et al., 2020). Следовательно, эти ферменты могут играть важную роль в формировании адаптационных механизмов у грибов при действии на них различных экстремальных факторов (Smirnov et al., 2002). В качестве экстремальных условий в высоких широтах могут выступать низкие температуры окружающей среды, бедные по отношению доступного органического углерода природные субстраты, а также сниженные метаболические процессы микробиоты (Evdokimova, 2014). Скорее, именно адаптацией грибов к указанным природным условиям можно объяснить такой высокий процент видов, обладающих фосфолипазной активностью.
Также известно, что при выделении микромицетами внеклеточных фосфолипаз на среде с яичным желтком возникает помутнение среды вокруг грибной колонии. Это происходит за счет гидролиза липидов, содержащихся в яичном желтке, и последующего образования кальциевого комплекса с жирными кислотами (преципитата), освобождающимися под действием секретируемого экзофермента (Bogomolova et al., 2012). Однако по нашим наблюдениям, у грибов Penicillium canescens и P. miczynskii отмечалось просветление преципитата на границе колонии и зоны действия экзоферментов, что объясняется присутствием липолитических или протеолитических ферментов в исследуемых грибах (Babaeva et al., 2015).
Протеазную активность на среде с бычьим сывороточным альбумином проявили 19 штаммов (65%) микроскопических грибов (рис. 2). Коэффициент протеазной активности изменялся в пределах от 0.56 до 0.95. При этом наиболее активно в питательную среду внеклеточные протеазы выделяли грибы Penicillium chrysogenum, P. aurantiogriseum st. 2, Isaria farinosa, значения коэффициента их протеазной активности равны 0.56, 0.64, 0.66 соответственно. Кроме того, после завершения инкубационного периода в течение 10 суток при 27°С эти колонии давали хорошее спороношение на питательной среде.
Все грибы рода Aspergillus активно развивались на средах и с яичным желтком, и с добавлением бычьего сывороточного альбумина. Уже на 3–4-е сутки инкубирования у микромицетов был отмечен быстрый рост, обильное спорообразование и выделение экзоферментов в агаризованные питательные среды. Исключение составил штамм A. fumigatus, он слабо развивался на среде для определения протеазной активности с образованием тонкого паутинистого мицелия.
Интересно отметить, что все тестируемые штаммы рода Trichoderma обладали лишь фосфолипазной активностью. Значения коэффциента ферментативной активности у штаммов T. viride st. 1 и T. viride st. 2 оказались фактически равны, т.е. они обладали одинаковой степенью патогенности.
Штаммы Penicillium simplicissimum st. 1 и P. simplicissimum st. 2, а также P. aurantiogriseum st. 2 и P. aurantiogriseum st. 1, наоборот, проявляли разные свойства патогенности. Последний штамм не имел ни одного из исследуемых физиолого-биохимических свойств, отвечающих за патогенность.
Способность микроскопических грибов к росту при 37°С является важным признаком, по которому медицинские микологи выделяют обладающие патогенными свойствами грибы в группу ППГ (Kuzikova et al., 2011).
По результатам наших исследований, рост колоний потенциально патогенных грибов при температуре 37°С на агаризованной среде Чапека отмечен у 41% тестируемых видов. Наилучший рост и развитие показали Aspergillus fumigatus, A. flavus st. 1, A. flavus st. 2, Acremonium charticola, Trichoderma viride st. 1. Спорообразование на 7–10-е сутки инкубирования выявлено у большинства исследуемых микромицетов за исключением Penicillium aurantiogriseum st. 1, P. glabrum, Trichoderma viride st. 2, T. koningii. Эти штаммы имели слабо развитый, погруженный в агар, паутинистый мицелий.
На основе оценки факторов патогенности установлено, что среди исследуемых грибов потенциальную опасность для человека могут представлять шесть видов (21%): Aspergillus flavus st. 1, A. flavus st. 2, A. niger, Talaromyces purpureogenus, Penicillium glabrum, P. simplicissimum st. 2, они обладали протеазной, фосфолипазной активностью и способностью роста при 37°С. Микромицет Isaria farinosа также обладал тремя факторами патогенности, однако строго говорить о наличии патогенных свойств для человека у данного гриба мы не можем. Несмотря на то, что род Isaria включен в официальные списки групп патогенности, уровень риска на здоровье человека для этого вида не определен (Еlinov et al., 2011).
Четырнадцать видов (48%) грибов проявляли активность двух каких-либо факторов патогенности, семь видов (24%) обладали хотя бы одним из них и лишь единственный вышеупомянутый вид, Penicillium aurantiogriseum st. 1 не имел ни одного фактора патогенности.
Очевидно, что чем интенсивнее оппортунистические грибы выделяют гидролитические экзоферменты для расщепления субстратов, тем более агрессивными они являются, повышая свои инвазивные способности (Bezshapochnyy et al., 2018). Важно отметить, что у выявленных потенциально опасных микромицетов, обладающих тремя факторами патогенности, установлены достаточно большие значения коэффициентов ферментативной активности (табл. 3), что свидетельствует об их невысокой потенциальной агрессивности для возможной инвазии и развития инфекционного процесса.
Таблица 3.
Результаты культурального тестирования потенциально патогенных грибов, обладающих тремя факторами патогенности (протеазной, фосфолипазной активностью и способностью роста при 37°С)
| Виды микромицетов | Коэффициент ферментативной активности | |
|---|---|---|
| ПА | ФА | |
| Aspergillus flavus st. 1 | 0.84 ± 0.04 | 0.77 ± 0.02 |
| A. flavus st. 2 | 0.80 ± 0.01 | 0.89 ± 0.01 |
| A. niger | 0.87 ± 0.02 | 0.88 ± 0.03 |
| Isaria farinosa | 0.66 ± 0.04 | 0.74 ± 0.02 |
| Penicillium simplicissimum st. 2 | 0.80 ± 0.03 | 0.81 ± 0.05 |
| P. glabrum | 0.91 ± 0.01 | 0.88 ± 0.01 |
| Talaromyces purpureogenus | 0.80 ± 0.01 | 0.74 ± 0.02 |
Грибы, обладающие тремя факторами патогенности – Aspergillus flavus, A. niger, Isaria farinosa и Talaromyces purpureogenus – встречались в пос. Белокаменка и в г. Кола в почвенных субстратах и затапливаемых грунтах. Штамм Penicillium glabrum встречался только в г. Кола в затапливаемых грунтах, а Р. simplicissimum st. 2 – в морской воде и затапливаемых грунтах пос. Белокаменка (табл. 1). Общая информация о микологических свойствах и экологических характеристиках этих оппортунистических грибов представлена в табл. 4.
Таблица 4.
Характеристика оппортунистических грибов прибрежных территорий Баренцева моря
| Вид патогена | Характер и особенности роста колоний при 37°С | Размер спор, мкм | Инфекционное заболевание | Вызываемые заболевания, клинические проявления | Экология, распространение | Уровень биологического риска, BSL | Группа патоген-ности |
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Aspergillus flavus | Быстрый рост, на 7-е сутки разрастается по всей чашке, обильное спороношение | 3.5–4 .5 (реже 5.0) | Аспергиллез | Возбудитель пневмонии, микотоксикоза, отита, синусита, инвазивного микоза и других инфекционных заболеваний, провоцирует развитие инфаркта и некроза, вызывает поражения почек и печени | Широко распространен, часто выделяем в тропических регионах, встречается в почве, на гниющем растительном материале, пищевых продуктах | 2 | III |
| Aspergillus niger | Быстрый рост, на 7-е сутки разрастается по всей чашке, обильное спороношение | 4.0–5.0 | то же | Выявляется обычно как вторичный инфицирующий организм после бактериального отита; вызывает рениты, провоцирует заболевания легких | Широко распространен, встречается в почве и на растениях, в пищевых продуктах, хорошо растет на различных субстратах | 1 | IV |
| Penicillium glabrum | Слабый рост мицелия без спороносящих структур | 3.0–3.5 | Пенициллиоз | Вызывает аллергический альвеолит, пневмонию, поражение почек или снижение их функции | Широко распространен, в т.ч. в кислых почвах, на злаковых растениях и зерне, на пищевых продуктах | 1 | IV |
| Penicillium simplicissimum | Умеренный рост, дает дочерние колонии, спорошение | 2.5–3.0 | то же | Вызывает тремор позвоночных животных, атаксию, мышечную ригидность; провоцирует вирусные инфекции | Широко распространен, встречается в почве, эндофит | 1 | IV |
| Talaromyces purpureogenus | Хороший рост, дает дочерние колонии, спороношение | 3.0–3.5 | “ “ | Вызывает легочные инфекции и поражения печени, редкие случаи синуситов | Широко распространен, встречается в почве и во влажных местоотбитаниях | 1 | IV |
Примечание. Данные по: (1) – De Hoog G.S. et al. (2000); Satton et al. (2001); Elinov et al. (2011); SP 1.3.2322-08; (2) – на основе собственных наблюдений; (3,6) – Egorova (1986); Satton et al. (2001); Domsch et al. (2007); (4, 5) – Satton et al. (2001); Gupta (2007); Hyalogyphomycosis: [site]. URL: https://doctorspb.ru/articles.php?article_id=1721; SP 1.3.2322-08; Zachinyaeva et al. (2018); Gosmanov et al. (2019); (7) – De Hoog G.S. et al. (2000); Elinov et al. (2011); (8) – SP 1.3.2322-08.
Анализ показал, что рассматриваемые виды ППГ имеют терригенное происхождение, широко распространены по земному шару и могут расти на различных субстратах. Эти грибы, как в естественных, так и в лабораторных условиях способны давать обильное спороношение. По нашим наблюдениям, у всех изученных штаммов, за исключением P. glabrum, отмечен хороший рост при температуре 37°С и способность к обильному образованию спор. При температуре 37°С у данного микромицета спороношение не обнаружено.
Учитывая, что заражение человека оппортунистическими грибами обычно происходит через дыхательную систему, стоит обратить внимание на размеры спор и на их способность к переносу на большие расстояния от места зарождения, а также на длительность переживания во внешней среде при неблагоприятных условиях (Zachinyaeva et al., 2018). По данным табл. 4 нами отмечено, что конидии у исследуемых грибов по размеру не превышают 5 мкм (а чаще равны 3–3.5 мкм). Такой размер спор способствует почти беспрепятственному проникновению их в легочно-дыхательные пути человека, повышая инвазивный потенциал возбудителей микозов.
Согласно классификации потенциально патогенных грибов С. де Хога (De Hoog et al., 2000) наибольшую опасность из рассматриваемых грибов для здоровья человека может представлять вид Aspergillus flavus, который отнесен во вторую группу риска BSL 2, характеризующуюся как грибы, способные попадать в организм здорового человека и сохраняться в нем, вызывая локализованные микозы. Остальные виды (Aspergillus niger, Penicillium glabrum, P. simplicissimum, Talaromyces purpureogenus) отнесены в первую группу риска BSL 1 как безопасные для здоровых людей грибы (De Hoog et al., 2000).
ЗАКЛЮЧЕНИЕ
Таким образом, разнообразие микроскопических грибов, выделенных из субстратов прибрежных территорий Кольского залива Баренцева моря, относительно небогатое и представлено видами грибов аскомицетного аффинитета. Наибольшим разнообразием сообществ микромицетов как в пос. Белокаменка, так и в г. Кола отличался затапливаемый грунт. Среди выделенных микромицетов 71% видов грибов оказался потенциально патогенным, 50% встречались в пос. Белокаменка, 53% – в г. Кола. В пос. Белокаменка среди ППГ по индексу обилия доминировали Acremonium charticola, Penicillium simplicissimum st. 1, P. spinulosum st. 1, P. aurantiogriseum st. 1 и Isaria farinosa, Trichoderma viride st. 1. В г. Кола по данному экологическому параметру значимыми оказались Fusarium oxysporum, Penicillium decumbens, P. spinulosum st. 1, P. aurantiogriseum st. 1., Trichoderma viride st. 2. Наиболее опасными, обладающими протеазной, фосфолипазной активностью и способностью роста при 37°С, оказались семь штаммов грибов: Aspergillus flavus st. 1, A. flavus st. 2, A. niger, Talaromyces purpureogenus, Penicillium glabrum, P. simplicissimum st. 2 и Isaria farinosa. Поскольку эти грибы представляют потенциальную угрозу человеку в виде инвазий на клеточном и тканевом уровне, необходимо уделять особое внимание мониторинговым исследованиям микологического состояния природных субстратов, с которыми контактирует человек, оценивать возможное распространение потенциально опасных видов и степень их агрессивности.
Авторы выражают благодарность к.б.н. В.А. Мязину (ИППЭС КНЦ РАН) за помощь в организации и проведении полевых работ. Проведение полевых работ выполнено за счет проекта Коларктик КО1001. Выделение, учет и идентификацию видов микроскопических грибов осуществляли в рамках темы НИР по госзаданию АААА-А18-118021490070-5. Анализ ферментативной активности микромицетов проводили в рамках темы НИР по госзаданию 0186-2019-0009.
Список литературы
Babaeva I.Kh., Aliyeva V.G., Qasumova S.Y. Activity of hydrolytic enzymes of the micromycetes allocated from soil and rock Along gas pipeline route Astara-Kazimagomed. Nauchnyy fond “Biolog”. 2015. V. 3 (7). P. 28–31 (in Russ.).
Bezshapochny S.B., Zachepilo S.V., Polyanskaya V.P. et al. Opportunistic mycoses of ENT organs. Part 1. Vestnik otorinolaringologii. 2018. V. 6. P. 67–71 (in Russ.). https://doi.org/10.17116/otorino20188306167
Bogomolova E.V., Kirtsideli I.Yu., Minenko E.A. Potentially dangerous microfungi from dwelling houses. Mikologiya i fitopatologiya. 2009. V. 43 (6). P. 506–513 (in Russ.).
Bogomolova E.V., Velikova T.D., Goryaeva A.G. et al. Microfungi in the air of Saint Petersburg. Khimizdat, SPb., 2012. 215 p. (in Russ.).
Boychenko T.V. Experience of microbial indication methods application in evaluating the environmental quality of the chronically polluted marine aquatories. Vestnik SVFU. 2019. V. 2 (70). P. 5–13 (in Russ.). https://doi.org/10.25587/SVFU.2019.70.28396
Bubnova E.N. Changes in the complexes of soil fungi during the transition from zonal soils to marine ecotopes (on the example of the coast of the Kandalaksha Gulf of the White Sea). Cand. Sci. Thesis. Moscow, 2005 (in Russ.).
Bubnova E.N. Diversity of microscopic fungi in lithorial sands of the White Sea. Vestnik Moskovskogo universiteta. 2017a. V. 72 (3). P. 142–148 (in Russ.).
Bubnova E.N., Georgieva M.L., Grum-Grzhimailo O.A. Method for isolation and enumeration of fungi developing in marine sediments. Mikrobiologiya. 2018a. V. 87 (6). P. 672–678 (in Russ.).https://doi.org/10.1134/S002636561806006X
Bubnova E.N., Konovalova O.P. Diversity of the filamentous fungi on the littoral and sublittoral sediments of the Barents Sea (Near the Dalnie Zelentsy Settlement). Mikologiya i fitopatologiya. 2018b. V. 52 (5). P. 319–327. (in Russ.).https://doi.org/10.1134/S0026364818050021
Bubnova E.N., Nikitin D.A. Fungi in bottom sediments of the Barents and Kara Seas. Biologiya morya. 2017b. V. 43 (5). P. 366–371 (in Russ.).
Cocco L., Follo M.Y., Manzoli L. et al. Phosphoinositide-specific phospholipase C in health and disease. Journal of lipid research. 2015. V. 56 (10). P. 1853–1860. https://doi.org/10.1194/jlr.R057984
Cox G.M., McDade H.C., Chen S.C. A. et al. Extracellular phospholipase activity is a virulence factor for Cryptococcus neoformans. Mol. Microbiol. 2001. V. 39 (1). P. 166–175.
De Bernardis F., Sullivan P.A., Cassone A. Aspartyl proteinases of Candida albicans and their role in pathogenicity. Med. Mycology. 2001. V. 39 (4). P. 303–313.
De Hoog G.S., Guarro J., Gene J. et al. Atlas of clinical fungi. Sec. ed. Baarn: Cen-traalbureau voor Schimmelcultures, 2000.
Directive 2000/54/EC – biological agents at work [site]. https://osha.europa.eu/en/legislation/directives/exposure-to-biological-agents/77. Accessed 20.11.2020.
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi. IHW-Verlag, Eching, 2007.
Egorova L.N. Soil fungi of the Far East. Hyphomycetes. Nauka, Leningrad, 1986 (in Russ.).
Elinov N.P., Vasileva N.V., Mamateva A.A. et al. Pathogenic and conditionally pathogenic macro- and micromycetes as objects of the kingdom of mushrooms (Fungi), their characteristics taking into account the requirements of the international code of botanical nomenclature. Kosta, SPb., 2011 (in Russ.).
Evdokimova G.A. Soil microbiota as a factor of soil resistance to pollution. Teoreticheskie problemy ekologii. 2014. V. 2. P. 17–24 (in Russ.).
Evdokimova G.A., Korneykova M.V., Mozgova N.P. et al. Ecological and biological characteristics of soils in the border region of Russia – Norway. Vestnik Kolskogo nauchnogo tsentra RAN. 2016. V. 1 (24). P. 89–99 (in Russ.).
Filkin S.Yu., Lipkin A.V., Fedorov A.N. The superfamily of phospholipases: structure, functions and application in biotechnology. Uspekhi biologicheskoy khimii. 2020. V. 60. P. 369–410 (in Russ.).
Fotedar R., Al-Hedaithy S. Comparison of phospholipases and proteinase activity in Candida albicans and Candida dubliniensis. Mycoses. 2005. V. 48. P. 62–67.
Gosmanov R.G., Galiullin A.K., Nurgaliev F.M. Mycology and mycotoxicology. Lan, SPb., 2019 (in Russ.).
GOST 31861-2012 Interstate standard. Water. General sampling requirements. 2012 (in Russ.).
Gudkov A.B., Popova O.N. Pulmonotropic factors of the European North (review). Vestnik pomorskogo universiteta. 2008. V. 2. P. 15–22 (in Russ.).
Gupta R.C. Veterinary toxicology. Basic and clinical principles. Acad. Press, 2007.
Hadebe S., Brombacher F. Environment and Host-genetic determinants in early development of allergic asthma. Contribution of Fungi. Frontiers in Immunology. 2019. V. 10. P. 1–15. https://doi.org/10.3389/fimmu.2019.02696
Hedayati M.T., Pasqualotto A.C., Warn P.A. et al. Aspergillus flavus: human pathogen, allergen and mycotoxin producer. Microbiology. 2007. V. 153. P. 1677–1692. https://doi.org/10.1099/mic.0.2007/007641-0
Hyalogyphomycosis // Medical portal for doctors and students: [2007–2019]. https://doctorspb.ru/articles.php?article_id=1721. Accessed 05.17.2020 (in Russ.).
Index Fungorum (2020). [A nomenclatural database]. http://www.indexfungorum.org. Accessed 20.11.2020.
Kirtsideli I.Yu. Microfungi in soils and grounds. In: N.V. Matveeva (ed.). Plants and fungi of the polar deserts of the Northern hemisphere. Marafon, SPb., 2015. P. 242–272 (in Russ.).
Kirtsideli I.Yu. Soil microscopic fungi in the ecosystems of the Arctic and Antarctic. Dr. Sci. SPb., 2019. (in Russ.).
Kirtsideli I.Yu., Abakumov E.V., Teshebaev Sh.B. et al. Microbial communities in regions of arctic settlements. Gigiena i Sanitaria (Hygiene and Sanitation, Russian journal). 2016. V. 95 (10). P. 923–929 (in Russ.). https://doi.org/10.18821/0016-9900-2016-95-10-923-929
Kirtsideli I.Yu., Vlasov D.Yu., Barantsevich E.P. et al. Distribution of terrigenous microfungi in Arctic Seas. Mikologiya i fitopatologiya. 2012. V. 46 (5). P. 306–310 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Krylenkov V.A. et al. Airborne fungi in the areas of Russian Arctic stations near White, Barents and Kara Seas. Mikologiya i fitopatologiya. 2011. V. 45 (3). P. 228–239 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Krylenkov V.A. et al. Comparative study of airborne fungi at Arctic stations near water area of the Northern Sea route. Ekologiya cheloveka. 2018. V. 4. P. 16–21 (in Russ.).
Klich M.A. Identification of common Aspergillus species. Utrecht, 2002.
Korneykova M.V., Evdokimova G.A. Lebedeva E.V. The complexes of microscopic fungi in oil products polluted cultivated soil on Kola North. Mikologiya i fitopatologiya. 2011. V. 45 (3). P. 249–256 (in Russ.).
Korneykova M.V., Lebedeva E.V. Mycobiota of the air layers in different natural and industrial zones of the Murmansk Region. Mikologiya i fitopatologiya. 2017. V. 51 (4). P. 202–210 (in Russ.).
Krylova I.O., Balandina S.Yu., Chetina O.A. Complex analy-sis of mould micromycetes of inhabited barracks rooms. Vestnik Permskogo universiteta. 2019. V. 46. P. 167–174 (in Russ.).
Kulko A.B. Pathogens spectrum of deep human mycosis. Onkogematologiya. 2012. V. 3. P. 55–61 (in Russ.).
Kurakov A.V. Methods of isolation and characteristics of microscopic fungi complexes in terrestrial ecosystems. Maks Press, Moscow, 2001 (in Russ.).
Kuzikova, I.L., Medvedeva, N.G., Sukharevich V.I. Study of potential pathogenicity factors of fungi as contaminants in the Library of the Academy of Sciences. Trudy laboratorii konservatsii i restavratsii dokumentov SPF ARAN. 2011. V. 2. P. 237–245 (in Russ.).
Kuzikova I.L., Tileva E.A., Trosheva T.D. et al. Potential pathogenicity of microfungi contaminating library funds. Mikologiya i fitopatologiya. 2012. V. 46 (5). P. 329–333 (in Russ.).
Marfenina O.E. Dangerous mildew in the environment. Priroda. 2002. V. 11. P. 33–38 (in Russ.).
Marfenina O.E., Fomicheva G.M. Potentially pathogenic mycelial fungi in the human environment. Modern trend. In: Yu.T. Dyakov, Yu.V. Sergeev (ed.). Mikologiya segodnya. T. 1. Moskow, Natsionalnaya akademiya mikologii, 2007. P. 235–267 (in Russ.).
Mosina L.V., Dovletyarova E.A., Efremova S.Yu. Mycotoxins as an environmental hazard. Megaprint, Irkutsk, 2017. (in Russ.).
Nemirovskaya I.A. Oil in the ocean (pollution and natural flow). Nauchnyy mir, Moscow, 2013 (in Russ.)
Ozerskaya S.M., Ivanushkina G.A., Kochkina N.E. Taxonomic diversity of pathogenic fungi. Mikologiya segodnya. 2007. V. 1. P. 268–282 (in Russ.).
Ozerskaya S.M., Ivanushkina G.A., Kochkina N.E. Micromycetes in the connection with problems of biological safety (review). Problemy meditsinskoy mikologii. 2011. V. 13 (3). P. 3–12 (in Russ.).
Park M., Do E., Jung W.H. Lipolytic enzymes involved in the virulence of human pathogenic fungi. Mycobiology. 2013 V. 41 (2). P. 67–72. https://doi.org/10.5941/MYCO.2013.41.2.67
Price M., Wilkinson I.D., Gentry L.O. Plate method for detection of phospholipase activity in Candida albicans. Sabouraudia. 1982. V. 20. P. 7–14.
Reddy P., Guthridge K., Vassiliadis S. et al. Tremorgenic mycotoxins: structure, diversity and biological activity. Toxins. 2019. V. 11 (302). P. 1–26. https://doi.org/10.3390/toxins11050302
Sangeetha A.B., Abdel-hadi A., Hassan A.S. et al. Evaluation of in vitro activities of extracellular enzymes from Aspergillus species isolated from corneal ulcer/keratitis. Saudi J. Biol. Sci. 2020. V. 27 (2). P. 701–705.
Satton D., Fotergill A., Rinaldi M. Determinant of pathogenic and conditionally pathogenic fungi. Mir, Moscow, 2001 (in Russ.).
Šegvić Klarić M. Adverse effects of combined mycotoxins. Arh Hig Rada Toksikol. 2012. V. 63. P. 519–530. https://doi.org/10.2478/10004-1254-63-2012-2299
Smirnov V.F., Kuzmin D.A., Smirnova O.N. et al. Action of terpenoids on the physiological and biochemical activity of fungi-destructors of industrial materials. Khimiya rastitelnogo syrya. 2002. V.4. P. 29–33 (in Russ.).
Sobolev A.V., Aak O.V. Clinic, diagnostic and treatment of mycoallergy. Problemy meditsinskoy mikologii. 2012. V. 14 (1). P. 37–39 (in Russ.).
SP 1.3.2322-08. Sanitary and epidemiological rules. “Safety of work with microorganisms of the III–IV groups of pathogenicity (danger) by pathogens of parasitic diseases. 2008.
Tayeb M.M.S. The relationship between mold sensitization and allergic diseases: a retrospective study (Jeddah, Saudi). AIMS Allergy and Immunology. 2020. V. 4 (1). P. 14–19. https://doi.org/10.3934/Allergy.2020002
Vicente V.A., Attili-Angelis D., Pie M. R. et al. Environmental isolation of black yeast-like fungi involved in human infection. Stud. Mycol. 2008. V. 61. P. 137–144. https://doi.org/10.3114/sim.2008.61.14
Yen Y.C., Yang C.Y., Wang T.N. et al. Household airborne endotoxin associated with asthma and allergy in elementary school-age children: a case-control study in Kaohsiung, Taiwan. Environmental Science and Pollution Research. 2020. https://doi.org/10.1007/s11356-020-07899-x
Zachinyaeva A.V., Moskalev A.V., Andreev V.A. et al. Medical mycology: a guide for doctors. Moscow, Geotar-Media, 2018 (in Russ.).
Zvyagintsev D.G. Methods of soil microbiology and biochemistry. Moscow, 1991 (in Russ.).
Бабаева И.Х., Касумова С.Ю., Алиева В.Г. (Babaeva et al.) Активность гидролитических ферментов микромицетов, выделенных из почв и грунтов трассы газопровода Астара–Казимагомед // Научный фонд “Биолог”. 2015. Т. 3. № 7. С. 28–31.
Безшапочный С.Б., Зачепило С.В., Полянская В.П. и др. (Bezshapochny et al.) Оппортунистические микозы ЛОР-органов. Сообщение 1 // Вестник оториноларингологии. 2018. № 6. С. 67–71. https://doi.org/10.17116/otorino20188306167
Богомолова Е.В., Великова Т.Д., Горяева А.Г. и др. (Bogomolova et al.) Микроскопические грибы в воздушной среде Санкт-Петербурга; под ред. М.А. Бондарцевой. СПб.: Химиздат, 2012. 215 с.
Богомолова Е.В., Кирцидели И.Ю., Миненко Е.А. (Bogomolova et al.) Потенциально опасные микромицеты жилых помещений // Микология и фитопатология. 2009. Т. 43. № 6. С. 506–513.
Бойченко Т.В. (Boychenko) Опыт применения методов микробной индикации в оценке качества среды хронически загрязненных морских акваторий // Вестник СВФУ. 2019. Т. 2. № 70. С. 5–13.
Бубнова Е.Н. (Bubnova) Изменения комплексов почвообитающих грибов при переходе от зональных почв к морским экотопам (на примере побережья Кандалакшского залива Белого моря). Дисс… канд. биол. наук. М.: МГУ, 2005.
Бубнова Е.Н. (Bubnova) Разнообразие микроскопических грибов в литоральных песках Белого моря // Вестник Московского университета. 2017. Т. 72. № 3. С. 142–148.
Бубнова Е.H., Георгиева М.Л., Грум-Гржимайло О.А. (Bubnova et al.) Способ выделения и учета грибов, развивающихся в морских грунтах // Микробиология. 2018. Т. 87. № 6. С. 672–678.
Бубнова Е.Н., Коновалова О.П. (Bubnova, Konovalova) Разнообразие мицилиальных грибов в грунтах литорали и сублиторали Баренцева моря (окрестности поселка Дальние Зеленцы) // Микология и фитопатология. 2018. Т. 52. № 5. С. 319–327. https://doi.org/10.1134/S0026364818050021
Бубнова Е.Н., Никитин Д.A. (Bubnova, Nikitin) Грибы в донных грунтах Баренцева и Карского морей // Биология моря. 2017. Т. 43. № 5. С. 366–371.
Гиалогифомикозы // Медицинский портал для врачей и студентов [2007–2019]. https://doctorspb.ru/articles.php?article_id=172. Дата обращения: 17.05.2020.
Госманов Р.Г., Галиуллин А.К., Нургалиев Ф.М. (Gosmanov et al.) Микология и микотоксикология. СПб.: Лань, 2019. 168 с.
ГОСТ 31861-2012 Межгосударственный стандарт. Вода. Общие требования к отбору проб. 2012.
Гудков А.Б., Попова О.Н. (Gudkov, Popova) Пульмонотропные факторы Европейского Севера (обзор) // Вестник Поморского университета. 2008. № 2. С. 15–22.
Евдокимова Г.А. (Evdokimova) Почвенная микробиота как фактор устойчивости почв к загрязнению // Теоретические проблемы экологии. 2014. № 2. С. 17–24.
Евдокимова Г.А., Корнейкова М.В., Мозгова Н.П. и др. (Evdokimova et al.) Эколого-биологическая характеристика почв приграничного района Россия – Норвегия // Вестник Кольского научного центра РАН. 2016. Т. 1. № 24. С. 89–99.
Егорова Л.Н. (Egorova) Почвенные грибы Дальнего Востока. Гифомицеты. Ленинград, Наука, 1986. 192 с.
Елинов Н.П., Васильева Н.В, Маматьева А.А. и др. (Elinov et al.) Патогенные и условно-патогенные макро- и микромицеты как объекты царства грибов (Fungi), их характеристика с учетом требований международного кодекса ботанической номенклатуры. Учебное пособие. Выпуск 1. Под ред. Н.П. Елинова СПб.: Коста, 2011. 64 с.
Зачиняева А.В., Москалев А.В., Андреев В.А. и др. (Zachi-nyaeva et al.) Медицинская микология: руководство для врачей. М.: Гэотар-Медиа, 2018. 288 с.
Звягинцев Д.Г. (Zvyagintsev) Методы почвенной микробиологии и биохимии: Учеб. пособие / Под ред. Д.Г. Звягинцева. М.: Изд-во МГУ, 1991. 304 с.
Кирцидели И.Ю., Власов Д.Ю., Крыленков А.В. и др. (Kirtsideli et al.) Аэромикота в районах расположения арктических станций России в акваториях Белого, Баренцева и Карского морей // Микология и фитопатология. 2011. Т. 45. № 3. С. 228–239.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П. и др. (Kirtsideli et al.) Распространение терригенных микромицетов в водах Арктических морей // Микология и фитопатология. 2012. Т. 46. № 5. С. 306–310.
Кирцидели И.Ю. (Kirtsideli) Микроскопические грибы в почвах и грунтах / Под ред. Н.В. Матвеевой. Растения и грибы полярных пустынь Северного полушария. СПб., Марафон, 2015. С. 242–272.
Кирцидели И.Ю., Абакумов Е.В., Тешебаев Ш.Б. и др. (Kirtsideli et al.) Микробные сообщества в районах арктических поселений // Гигиена и санитария. 2016. Т. 95. № 10. С. 923–929. https://doi.org/10.1882/0016-9900-2016-10-923-929
Кирцидели И.Ю., Власов Д.Ю., Крыленков В.А. и др. (Kirtsideli et al.) Сравнительное исследование аэромикоты арктических станций по Северному морскому пути // Экология человека. 2018. № 4. С. 16–21.
Кирцидели И.Ю. (Kirtsideli) Микроскопические грибы в экосистемах Арктики и Антарктики: дис. … докт. биол. наук. СПб., 2019. 459 с.
Корнейкова М.В. (Korneykova) Вирулентность потенциально патогенных микромицетов, выделенных из почв Кольского полуострова // Успехи медицинской микологии. 2016. № 15. С. 26–32.
Корнейкова М.B., Евдокимова Г.A., Лебедева Е.В. (Korneykova et al.) Комплексы микроскопических грибов в загрязненных нефтепродуктами агроземах Кольского полуострова // Микология и фитопатология. 2011. Т. 45. № 3. С. 249–256.
Корнейкова М.В., Лебедева Е.В. (Korneykova, Lebedeva) Микобиота приземного воздуха различных природных и промышленных зон Мурманской области // Микология и фитопатология. 2017. Т. 51. № 4. С. 202–210.
Крылова И.О., Баландина С.Ю., Четина О.А. (Krylova et al.) Комплексный анализ плесневых микромицетов жилых казарменных помещений // Вестник Пермского университета. 2019. № 2. С. 167–174.
Кузикова И.Л., Медведева Н.Г., Сухаревич В.И. (Kuzikova et al.) Изучение факторов потенциальной патогенности грибов-контаминантов фондов Библиотеки Академии наук // Труды лаборатории консервации и реставрации документов СПФ АРАН. 2011. № 2. С. 237–245.
Кузикова С.И., Тилева Е.А., Трошева Е.Д. и др. (Kuzikova et al.) Потенциальная патогенность микромицетов – контаминантов библиотечных фондов // Микология и фитопатология. 2012. Т. 46. № 5. С. 229–333.
Кулько А.Б. (Kulko) Спектр возбудителей глубоких микозов человека // Онкогематология. 2012. № 3. С. 55–61.
Кураков А.В. (Kurakov) Методы выделения и характеристики комплексов микроскопических грибов наземных экосистем. М.: Макс Пресс, 2001. 92 с.
Марфенина О.E. (Marfenina) Опасные плесени в окружающей среде // Природа. 2002. № 11. С. 33–38.
Марфенина О.Е., Фомичева Г.М. (Marfenina, Fomicheva) Потенциально патогенные мицелиальные грибы в среде обитания человека. Современные тенденции / Под ред. Ю.Т. Дьякова, Ю.В. Сергеева // Микология сегодня. Т. 1. М.: Национальная академия микологии, 2007. С. 235–266.
Мосина Л.В., Довлетярова Э.А., Ефремова С.Ю. (Mosina et al.) Микотоксины как экологическая опасность. Иркутск: Мегапринт, 2017. 144 с.
Немировская И.А. (Nemirovskaya) Нефть в океане (загрязнение и природные потоки). М.: Научный мир, 2013. 432 с.
Озерская С.М., Иванушкина Г.А., Кочкина Н.E. (Ozerskaya et al.) Таксономическое разнообразие патогенных грибов // Микология сегодня. Т. 1. 2007. С. 268–282.
Озерская С.М., Иванушкина Г.А., Кочкина Н.Е. (Ozerskaya et al.) Микроскопические грибы в связи с проблемами биологической безопасности (обзор) // Проблемы медицинской микологии. 2011. Т. 13. № 3. С. 3–12.
Саттон Д., Фотергилл А., Ринальди М. (Satton et al.) Определитель патогенных и условно патогенных грибов: пер. с англ. М.: Мир, 2001. 486 с.
Смирнов В.Ф., Кузьмин Д.А., Смирнова О.Н. и др. (Smirnov et al.) Действие терпеноидов на физиолого-биохимическую активность грибов-деструкторов промышленных материалов // Химия растительного сырья. 2002. № 4. С. 29–33.
Соболев А.В., Аак О.B. (Sobolev, Aak) Клиника, диагностика и лечение микогенной аллергии // Проблемы медицинской микологии. 2012. Т. 14. № 1. С. 37–39.
СП 1.3.2322-08. Санитарно-эпидемиологические правила. “Безопасность работы с микроорганизмами III–IV групп патогенности (опасности) возбудителями паразитарных болезней”. М., 2008. 54 с.
Филькин C.Ю., Липкин A.В., Федоров A.Н. (Filkin et al.) Суперсемейство фосфолипаз: структура, функции и применение в биотехнологии // Успехи биологической химии. 2020. № 60. С. 369–410.
Хмельницкий О.К., Быков В.Л., Хмельницкая Н.М. (Khmelnitskiy et al.) Патоморфологическая диагностика микозов, вызываемых условно-патогенными грибами: пособие для врачей. СПб., 2000. 35 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология