Микология и фитопатология, 2021, T. 55, № 3, стр. 178-188
Разнообразие микроскопических грибов на древесине в береговой зоне Гренландского моря (архипелаг Шпицберген)
И. Ю. Кирцидели 1, *, Е. Г. Лукина 2, **, В. А. Ильюшин 1, ***, Д. Ю. Власов 1, 2, ****
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: microfungi@mail.ru
** E-mail: elizaveta121999@mail.ru
*** E-mail: ilva94@yandex.ru
**** E-mail: dmitry.vlasov@mail.ru
Поступила в редакцию 29.11.2020
После доработки 07.12.2020
Принята к публикации 21.12.2020
Аннотация
Материалом для исследования послужили 59 образцов древесины, которые были собраны в период 2018–2019 гг. в прибрежной зоне Грюн-фьорда Гренландского моря (архипелаг Шпицберген). Древесина была принесена морем (плáвник) и находилась на берегу залива на разном удалении от линии воды. В результате исследований выявлены комплексы микроскопических грибов на плавнике (ель, сосна, лиственница и осина), которые могут формироваться при нахождении древесины в морской воде, а также за счет видов из прибрежной зоны арктических морей. Идентифицировано 65 видов микроскопических грибов, преимущественно из отдела Ascomycota. Виды рода Cadophora отмечены в наибольшем числе исследованных образцов. Показатели видового разнообразия и встречаемости представителей отдела Basidiomycota оказались сравнительно низкими. Всего на образцах древесины с отсутствием внешних признаков деструкции было отмечено 50 видов, а на образцах древесины с признаками разрушения – 36 видов микромицетов. Разрушение структуры древесины сопровождается снижением видового разнообразия и увеличением встречаемости почвенных грибов, типичных для природной среды Арктики, в частности, Pseudogymnoascus pannorum и видов рода Penicillium.
ВВЕДЕНИЕ
Микромицеты северных морей рассматриваются как экологически неоднородная группа организмов (Rämä et al., 2014). Температура и соленость воды – два основных экологических фактора, влияющих на распространение водных грибов в глобальном масштабе (Hughes, 1986). Микромицеты могут входить в пищевые цепи Мирового океана, являться паразитами на водорослях и животных, сапротрофами и биодеструкторами природных и антропогенных материалов, находящихся в воде (Jones, 2011). Для характеристики некоторых грибов, отмеченных в морской воде, использовали термины “факультативные морские грибы” (Kohlmeyer, 1974), “вторично-водные грибы” (Pivkin, 2010), “терригенные грибы” (Terekhova, 2007). Экология этих грибов обсуждается достаточно давно (Sparrow, 1937; Johnson, 1967). Однако гораздо больше внимания микологи уделяли истинным морским грибам, представления о которых формировались на основе культурально-морфологических характеристик и молекулярных данных (Rämä et al., 2014, 2017).
Морфологическая и метаболическая пластичность позволяет грибам адаптироваться к различным экологическим условиям и развиваться как в наземной, так и в водной среде (Slepecky, Starmer, 2009; Wittenberg et al., 2009). Было показано, что переход к морскому существованию и выход на сушу происходят сравнительно часто (Richards et al., 2012). В водах Белого, Баренцева и Карского морей, а также моря Лаптевых было выделено 36 видов из 17 родов микромицетов (Kirtsideli et al., 2012). При этом у береговой линии было выявлено 29 видов, а в открытом море 20 видов грибов, т.е. при удалении от суши число видов падает, что может служить доказательством наземного происхождения большинства полученных изолятов. В этой связи особый интерес представляет изучение микобиоты древесины, которая может длительное время находиться в морской среде, а затем оказывается на суше. Хорошо известно, что древесина представляет собой привлекательный субстрат для различных групп грибов. Это особенно актуально для полярных регионов, характеризующихся бедностью субстратов и суровостью окружающей среды, что может существенно ограничивать расселение микромицетов в полярных экосистемах. В некоторых работах говорится об особенностях микобиоты древесины в арктических регионах (Pang et al., 2011, 2016; Hagestad et al., 2020). В таких условиях привнесенная морем древесина (плáвник) может служить одним из возможных доступных мест обитания и накопления грибов в прибрежной зоне арктических морей. В исследовании Hellmann et al. (2013) показано, что почти половина плавника арктических морей представляет собой древесину лесозаготовительных работ. Очевидно, что главным источником попадания древесины в моря Северного Ледовитого океана является ее вынос сибирскими реками из мест лесозаготовки (Johansen, Hytteborn, 2001). Однако до настоящего времени этот вопрос остается недостаточно исследованным.
Целью нашего исследования было изучение видового разнообразия микроскопических грибов на привнесенном морем древесном субстрате в береговой зоне Грюн-фьорда Гренландского моря (архипелаг Шпицберген).
МАТЕРИАЛ И МЕТОДЫ
Образцы древесины для микологического анализа отбирали в прибрежной зоне Грюн-фьорда Гренландского моря (архипелаг Шпицберген) в р-не жилого поселка Баренцбург (78°02′ c.ш., 14°18′ в.д.) и заброшенного поселения Грумант (78°10′ с.ш., 15°06′ в.д.) в июне–июле 2018–2019 гг. На исследуемой территории соленость воды составляет 34‰, а средняя годовая температура морской воды – 2°C (Marchenko et al., 2019). Архипелаг Шпицберген относится к зоне тундр и полярных пустынь (Aleksandrova, 1977), а древесина на данной территории может иметь антропогенное происхождение или являться плавником (привнесена морем). В исследование были включены только образцы плавника, которые имели признаки недавнего пребывания в морской воде (наличие морских водорослей и животных). Фрагменты древесины собирали в стерильные контейнеры и хранили при температуре 4°C. Размер одного образца, как правило, составлял 10–20 см3.
Определение пород древесины проводилось в секторе химико-биологических исследований Государственного Русского музея с.н.с. Н.Г. Соловьевой на основе анализа микроструктурных признаков внутреннего строения древесины (Yatsenko-Khmelevsky, 1954; Kolosova, Solovieva, 2013).
Каждый образец был разделен на несколько мелких фрагментов, которые были помещены на поверхность питательной среды (прямой посев). Использовали следующие питательные среды: агар Чапека, агар Чапека с добавлением NaCl (5%), агаризованная минеральная среда с целлюлозой. Для подавления роста бактерий использовали антибиотик левомицетин (25 мг/л). Инкубацию полученных изолятов проводили в темноте при температуре 4–5 и 20°С. Чистые культуры были идентифицированы на основании культурально-морфологических признаков (Methods.., 1982; Raper, Thom, 1949; Domsch et al., 2007, и др.) и результатов молекулярных исследований. Культуры, используемые для молекулярных исследований, выращивали на среде Чапека при 20°С в течение 14 дней. ДНК из чистых культур грибов выделяли с использованием коммерческого набора DiamondDNA Plant kit (ABT, Барнаул, Россия), согласно инструкции изготовителя. В качестве филогенетического маркера была использована последовательность региона ITS (White et al., 1990). Последовательность ITS1–5.8S–ITS2 амплифицировали с использованием праймеров ITS1 (5'-TCC-GTA-GGT-GAA-CCT-TGC-GG-3′) и ITS4 (5'-TCC-TCC-GCT-TAT-TGA-TAT-GC-3'). По окончании амплификации проводили детекцию образцов электрофоретическим методом в 1.5%-м агарозном геле с GelRed. Секвенирование полученных фрагментов ДНК проводили в BioBeagle (Санкт-Петербург, Россия) методом Сэнгера. Последовательности были проверены и выровнены с использованием программы BioEdit версии 7.1.9. Анализировали данные с помощью программы поиска Blast в GenBank (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Для универсального региона ITS были выбраны критерии идентичности, предложенные Годинье с соавторами (Godinho et al., 2013). Если идентичность последовательности региона ITS составляла ≥98%, то считали, что изолят принадлежит данному виду, если идентичность последовательности составляла 95–97%, считали, что изолят принадлежит соответствующему роду.
Названия и положение таксонов микроскопических грибов унифицировали с использованием базы данных Index Fungorum (2020).
Образцы древесины просматривали в сканирующем электронном микроскопе Tescan MIRA3 LMU в ресурсном центре “Развитие молекулярных и клеточных технологий” СПбГУ, а также в настольном растровом электронном микроскопе ТМ 3000 HITACHI в “Ресурсном центре микроскопии и микроанализа” СПбГУ.
Статистическую обработку данных осуществляли с использованием пакета статистических программ EstimateS9.10 (Colwell, 2014), MS Excel 2007 и Statistica 10.0.
Для оценки ожидаемого числа видов в области исследования мы использовали подход, основанный на алгоритме генерации выборки (Colwell et al., 2012). В основе этого подхода лежит конструирование кривой разрежения (rarefaction curve) с помощью специального алгоритма случайной многократной перестановки данных в пределах выборок из числа обнаруженных изолятов. Данная кривая является функцией математического ожидания видовой насыщенности S(N) при увеличении численности сообщества. Разрежение дает возможность найти предполагаемое число видов для любой промежуточной совокупности из N особей, считая ее случайной и независимой выборкой из всей генеральной совокупности. Эмпирические данные о числе видов при построении этой кривой сглаживаются параметрической модельной зависимостью с последующей экстраполяцией к некоторой асимптоте “насыщения” (Shitikov et al., 2011).
Для расчета ожидаемого числа видов в генеральной совокупности, из которой была сделана выборка, использовался скорректированный индекс Chao1 (индекс с поправкой на смещение), который рассчитывался на основе регистрации количества видов, представленных одним изолятом. Для этого расчета использовалась некоммерческая программа EstimateS 9.10 (Colwell et al., 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате культурально-морфологических исследований было получено более 400 чистых культур микроскопических грибов и идентифицировано 65 видов микромицетов. Использование метода сканирующей микроскопии показало, что развитие микроскопических грибов активно происходит как на поверхности, так и в глубинных слоях древесины (рис. 1). Отмечен рост мицелия между сохранившимися волокнами целлюлозы. На поверхности древесины локально формируется спороношение микромицетов.
Отдел Mucoromycota представлен только двумя видами (Mortierella parvispora и Mucor hiemalis), которые были отмечены единичными находками и не развивались на средах с целлюлозой в качестве единственного источника органического вещества.
Отдел Basidiomycota оказался представлен только семью видами грибов (Dioszegia hungarica, Goffeauzyma gilvescens, Leucosporidium scottii, Mrakia frigida, Rhodotorula sp., Tremella indecorata, Vishniacozyma victoriae), что согласуется с литературными данными о встречаемости базидиомицетов в полярных экосистемах (Tosi et al., 2002; Connell et al., 2006; Malosso et al., 2006; Ludley, Robinson, 2008; Blanchette et al., 2010; Arenz, Blanchette, 2011; Arenz et al., 2014). Авторы отмечали, что чаще всего в таких условиях выявляются дрожжевые грибы базидиомицетного аффинитета. Хотя привнесенная морем древесина могла быть заселена ксилотрофными базидиомицетами, обитающими в бореальных лесах, эти грибы не были обнаружены на плавнике в наших исследованиях. Вероятно, в период нахождения древесины в морской воде и прибрежной зоне архипелага Шпицберген происходит заселение данного субстрата преимущественно вторично-водными и почвенными микроскопическими грибами. Водная (морская) среда и экстремальные условия Арктики, по-видимому, ограничивают рост ксилотрофных грибов, способных колонизировать и разлагать древесину. На их место приходят сумчатые грибы, о чем свидетельствуют полученные данные (табл. 1).
Таблица 1.
Видовой состав микромицетов, выделенных из образцов древесины
| Виды грибов | Номер штамма в Генбанке | Год отбора образца | *Деструкция древесины | **Место отбора образца | ***Порода дерева |
|---|---|---|---|---|---|
| Acremonium charticola (Lindau) W. Gams | 2018 | – | Б | – | |
| Alternaria alternata (Fr.) Keissl | 2019 | + | Б | С, О | |
| A. tenuissima (Kunze) Wiltshire | 2019 | + | Б | С | |
| Botrytis cinerea Pers. | MW204929, MW204938, MW201486 | 2018, 2019 | ± | Б, Г | С |
| Cadophora fastigiata Lagerb. et Melin | 2018, 2019 | ± | Б | С, Е, О | |
| C. luteo-olivacea (J.F.H. Beyma) T.C. Harr. et McNew | 2019 | ± | Б | О | |
| C. malorum (Kidd et Beaumont) W. Gams | 2018, 2019 | ± | Б, Г | С, Е | |
| C. melinii Nannf. | 2018, 2019 | ± | Б, Г | С, Е | |
| Cadophora sp. | 2018, 2019 | ± | Б, Г | С, Е | |
| Chrysosporium merdarium (Ehrenb.) J.W. Carmich | 2018 | – | Б | – | |
| Cladosporium cladosporioides (Fresen.) G.A. de Vries | 2018, 2019 | ± | Б, Г | С, Е | |
| C. herbarum (Pers.) Link | 2018, 2019 | ± | Б, Г | С, Е | |
| C. oxysporum Berk. et M.A. Curtis | 2018, 2019 | ± | Б, Г | С, Е, Л | |
| C. sinuosum K. Schub., C.F. Hill, Crous et U. Braun | MW201488 | 2019 | + | Б | Е |
| C. sphaerospermum Penz. | 2019 | ± | Б | С | |
| C. tenellum K. Schub., C.F. Hill, Crous et U. Braun, | MW201487 | 2019 | + | Б | С |
| Claussenomyces atrovirens (Pers.) Korf et Abawi | MW204926 | 2018 | – | Г | – |
| Cordyceps farinosa (Holmsk.) Kepler, B. Shrestha et Spatafora | 2018 | – | Г | – | |
| Cosmospora berkeleyana (P. Karst.) Gräfenhan, Seifert et Schroers | 2018, 2019 | ± | Б, Г | С, Е | |
| Didymella pomorum (Thüm.) Qian Chen et L. Cai | 2019 | + | Б | Е | |
| Dioszegia hungarica Zsolt | MW201503 | 2019 | + | Б | С |
| Exophiala xenobiotica de Hoog, J.S. Zeng, Harrak et Deanna A. Sutton | MW204928, MW201501, MW201483 | 2018, 2019 | ± | Б, Г | С, Е |
| Ilyonectria destructans (Zinssm.) Rossman, L. Lombard et Crous | 2019 | + | Б | Л | |
| Juxtiphoma eupyrena (Sacc.) Valenz.-Lopez, Crous, Stchigel, Guarro et Cano | 2019 | + | Б | Е | |
| Goffeauzyma gilvescens (Chernov et Babeva) Xin Zhan Liu, F.Y. Bai, M. Groenew. et Boekhout | MW201493 | 2019 | + | Б | С |
| Kabatiella sp. | MW201495 | 2019 | + | Б | Е |
| Leptosphaeria doliolum (Pers.) Ces. et De Not. | MW201489 | 2019 | + | Б | Е |
| L. sclerotioides (Preuss ex Sacc.) Gruyter, Aveskamp et Verkley | MW201497, MW201504 | 2019 | + | Б | Л, Е |
| Leucosporidium scottii Fell, Statzell, I.L. Hunter et Phaff | MW204930 | 2018 | – | Б | – |
| Lophium arboricola (Buczacki) Madrid et Gené | MW201485, MW201496 | 2019 | + | Б | Е, С |
| Microdochium lycopodinum (Jaklitsch, Siepe et Voglmayr) Hern.-Restr. et Crous, | MW201491, MW201492 | 2019 | + | Б | С |
| Mortierella parvispora Linnem | MW204932 | 2018 | – | Б | – |
| Mucor hiemalis Wehmer | 2018 | – | Б | – | |
| Mrakia frigida (Fell, Statzell, I.L. Hunter et Phaff) Y. Yamada et Komag. | MW201502 | 2019 | + | Б | С |
| Nectria ramulariae (Wollenw.) E. Müll | MW204936, MW201505 | 2018, 2019 | ± | Б | С |
| Neocosmospora solani (Mart.) L. Lombard et Crous | 2019 | + | Б | С | |
| Paraphoma fimeti (Brunaud) Gruyter, Aveskamp et Verkley | MW201498 | 2019 | + | Б | С, О |
| Penicillium aurantiogriseum Dierckx | 2018 | – | Б | – | |
| P. brevicompactum Dierckx | 2019 | + | Б | Л | |
| P. camemberti Thom | 2018 | – | Б | – | |
| P. chrysogenum Thom | 2018, 2019 | ± | Б, Г | С, Е, Л | |
| P. commune Thom | MW204937 | 2018 | – | Б | – |
| P. jensenii K.W. Zaleski | 2018, 2019 | ± | Б, Г | Е | |
| P. lanosum Westling | 2018, 2019 | ± | Б, Г | С, Е, Л | |
| P. miczynskii K.W. Zaleski | 2019 | + | Б | С | |
| P. nalgiovense Laxa | 2019 | + | Б | Е | |
| P. olsonii Bainier et Sartory | 2019 | + | Б | С | |
| P. roqueforti Thom | 2018 | – | Б | – | |
| P. simplicissimum (Oudem.) Thom | 2018, 2019 | ± | Б, Г | С, Е, Л | |
| P. solitum Westling | 2018, 2019 | ± | Б, Г | Е О | |
| P. waksmanii K.W. Zaleski | 2019 | + | Б | С | |
| Phialocephala dimorphospora W.B. Kendr. | MW204931 | 2018 | – | Б | – |
| Phoma herbarum Westend | MW204933, MW201494 | 2018, 2019 | ± | Б, Г | Е |
| Pleosporales | MW204935 | 2018 | – | Б | – |
| Pochonia sp. | MW204934 | 2018 | – | Б | – |
| Pseudogymnoascus pannorum (Link) Minnis et D.L. Lindner | 2018, 2019 | ± | Б, Г | С, Е, Л | |
| Rhodotorula sp. | 2018 | – | Б | – | |
| Talaromyces funiculosus (Thom) Samson, N. Yilmaz, Frisvad et Seifert | 2018 | – | Б | – | |
| T. piceae (Raper et Fennell) Samson, N. Yilmaz, Houbraken, Spierenb., Seifert, Peterson, Varga et Frisvad | 2019 | + | Б | С | |
| T. rugulosus (Thom) Samson, N. Yilmaz, Frisvad et Seifert | 2019 | + | Б | С, Е, Л | |
| T. verruculosus (Peyronel) Samson, N. Yilmaz, Frisvad et Seifert | 2019 | + | Б | Л | |
| Tremella indecorata Sommerf. | MW201499, MW204927 | 2018, 2019 | ± | Б | Л |
| Tricellula aquatica J. Webster | MW201484 | 2019 | + | Б | С |
| Variabilispora flava S. Bien, C. Kraus et Damm | MW201500 | 2019 | + | Б | Е |
| Vishniacozyma victoriae (M.J. Montes, Belloch, Galiana, M.D. García, C. Andrés, S. Ferrer, Torr.-Rodr. et J. Guinea) Xin Zhan Liu, F.Y. Bai, M. Groenew. et Boekhout | MW201490 | 2019 | + | Б | С |
Большинство выделенных нами видов относятся к отделу Ascomycota (56 видов). Наиболее высокой была доля микромицетов из родов Cadophora, Pseudogymnoascus, Penicillium, Cladosporium, Phoma и Didymella. В образцах древесины с признаками деструкции и без таковых были встречены как облигатно водные (например, Tricellula aquatica), так и вторично-водные микроскопические грибы. Наиболее часто встречались представители рода Cadophora (5 видов), которые преобладали на древесине, не имеющей следов деструкции. Виды этого рода ранее отмечались на древесине в Гренландии и Исландии (Blanchette et al., 2016), в канадской Арктике на мумифицированной древесине, на плавнике, а также на исторической антропогенной древесине в других районах Арктики (Jurgens et al., 2009; Rämä et al., 2014). Виды рода Cadophora также широко распространены в почве и на растительных субстратах в арктических экосистемах (Kirtsideli et al., 2014; Zhang, Yao, 2015), хотя также являются и фитопатогенами (Martín-Sanz et al., 2018). Они были отмечены как доминанты на антропогенной древесине в исторических хижинах, построенных Скоттом и Шеклтоном в р-не моря Росса в Антарктиде (Blanchette et al., 2004, 2010). Показано, что грибы рода Cadophora широко встречаются в почвах в р-не моря Росса, а также распространены на изученных территориях Антарктического п-ова (Arenz, Blanchette, 2009, 2011; Blanchette et al., 2010; Kirtsideli et al., 2018). Они также были обнаружены в пресноводных антарктических озерах (Goncalves et al., 2012). Накопленные данные указывают на то, что грибы рода Cadophora могут рассматриваться как аборигенные виды полярных регионов, которые способны колонизировать различные субстраты и переносить экстремальные условия окружающей среды.
Наибольшим числом видов представлен род Peni-cillium (14 видов), а наибольшим числом изолятов характеризовался вид Penicillium lanosum. Число изолятов грибов из рода Penicillium заметно увеличивалось в образцах древесины, находящихся в стадии разложения (с разрушенной структурой древесины). В таких пробах также постоянно присутствовал аскомицет Pseudogymnoascus pannorum, который, как и виды рода Penicillium, относится к типичным обитателям почв в зоне арктических тундр (Kirtsideli et al., 2014, 2018).
Род Cladosporium был представлен шестью видами. В их числе оказались такие виды, как Cladosporium tenellum и Cladosporium sinuosum, которые ранее были выделены из образцов льда в Северном Ледовитом океане в 2007 г. (Schubert et al., 2007). Виды этого рода отмечались преимущественно на образцах древесины, не имеющих следов деструкции. Виды рода Alternaria были отмечены исключительно на образцах древесины, не имеющих следов заметной деструкции. Распределение основных групп микроскопических грибов представлено на рис. 2.
Рис. 2.
График рангового распределения микроскопических грибов в изученных образцах древесины при отсутствии признаков деструкции (I) и с признаками деструкции (II). По горизонтали – число образцов древесины, в которых выявлены микромицеты. По вертикали ранжированы микроскопические грибы: 1 – Cadophora spp.; 2 – Penicillium spp.; 3 – Cladosporium spp.; 4 – Pseudogymnoascus pannorum; 5 – Exophiala xenobiotica; 6 – Talaromyces spp.; 7 – Cosmospora berkeleyana; 8 – Phoma spp.; 9 – Alternaria spp.; 10 – Nectria ramulariae; 11 – Acremonium charticola; 12 – Neocosmospora solani; 13 – Leucosporidium scottii.
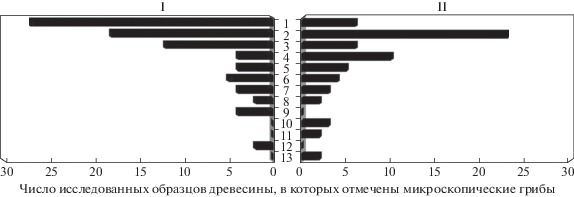
Полученные данные свидетельствуют о достаточно высоком разнообразии и встречаемости видов рода Alternaria, Cadophora, Cladosporium на образцах древесины с отсутствием внешних признаков деструкции. На древесине с признаками разрушения отмечено увеличение встречаемости Pseudogymnoascus pannorum и видов рода Penicillium, т.е. видов, типичных для почв данного региона. Всего на образцах древесины с отсутствием внешних признаков деструкции было отмечено 49 видов, а на образцах с разрушенной структурой древесины – 36 видов. Общими оказались 20 видов грибов (табл. 2).
Таблица 2.
Распределение микромицетов по изученным образцам древесины
| Число образцов/видов | Год отбора проб | ***Порода древесины | *Деструкция древесины | **Место отбора проб | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | С | Е | Л | О | + | – | Б | Г | |
| Число образцов | 32 | 27 | 15 | 7 | 5 | 2 | 29 | 30 | 47 | 12 |
| Число видов | 39 | 49 | 33 | 25 | 9 | 5 | 50 | 36 | 63 | 18 |
Примечание. *Деструкция древесины: “+” – отсутствие признаков деструкции; “–“ – разрушенная структура древесины. **Место отбора проб: Б – р-н пос. Баренцбург, Г – р-н пос. Грумант. ***Порода древесины (определялась только для образцов, не имеющих признаков деструкции): С – сосна; Е – ель; Л – лиственница; О – осина.
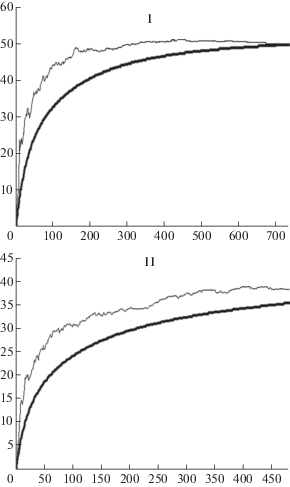
По максимальному среднему значению индекса Chao1, рассчитанному для кривой накопления видов (рис. 3), нами выявлены практически все ожидаемые виды, обитающие на древесине с отсутствием признаков деструкции (I) (Chao 1 = 50.5 ± ± 1.03; 50 видов). В меньшей степени выявлен видовой состав грибов для группы образцов с разрушенной структурой древесины (II) (Chao 1 = 38.99 ± ± 3.4; 36 видов).
Рис. 3.
Результаты бутстреп-анализа для оценки полноты выявления видов в зависимости от числа полученных изолятов. Тонкие линии показывают средние значения индекса Chao1 (ожидаемое число видов) по мере увеличения числа изолятов, сплошные линии – сглаженные кривые разрежения (individual-based rarefaction curves) в зависимости от числа выявленных изолятов. Условные обозначения: I – группа образцов древесины c отсутствием внешних признаков деструкции; II – группа образцов с разрушенной структурой древесины (по горизонтали – число изолятов, по вертикали – число видов).
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что формирование комплексов микромицетов древесины, привнесенной в арктические экосис-темы по морю, является длительным сукцессионным процессом. Можно предположить, что в процессе переноса плавника морскими водами от бореальной зоны (где производится лесозаготовка) до арктических морей, омывающих архипелаг Шпицберген, происходит последовательное снижение встречаемости базидиомицетов, типичных для древесины бореальной зоны, и заселение древесины вторично-водными и водными микроскопическими грибами (преимущественно аскомицетами). В дальнейшем в комплексах микромицетов может происходить увеличение доли видов, типичных для почв Арктики. Культурально-морфологические методы позволяют оценить разнообразие и встречаемость микромицетов на древесном субстрате, однако молекулярные методы идентификации помогают уточнить видовой состав грибов и выявить истинное разнообразие микромицетов, населяющих морскую древесину. Разложение древесины влияет на структуру сообществ микромицетов на данном субстрате. Разрушение структуры древесины сопровождается снижением видового разнообразия и увеличением встречаемости почвенных грибов, типичных для природной среды Арктики. Можно предположить, что значительная часть привнесенных с древесиной микромицетов способна сохранять жизнеспособность и переходить в почвы прибрежных арктических территорий (Kirtsideli et al., 2012). Вероятно, часть из них может переходить на деловую древесину в арктических поселениях, вызывая ее биодеструкцию.
Работа выполнялась в рамках госзадания согласно тематическому плану БИН РАН по теме № АААА-А19-119020890079-6, часть работы выполнена на оборудовании ЦКП “Клеточные и молекулярные технологии изучения растений и грибов” Ботанического института им. В.Л. Комарова РАН (Санкт-Петербург). Исследования проводились при поддержке Российского фонда фундаментальных исследований (проект № 18-29-05031мк). Авторы благодарят Н.Г. Соловьеву за проведение работ по определению пород древесины и М.С. Зеленскую за помощь в проведении сканирующей микроскопии. Благодарим руководителя Российской научной арктической экспедиции на архипелаг Шпицберген Ю.В. Угрюмова, а также сотрудников Российского научного центра на Шпицбергене за содействие в проведении исследований.
Список литературы
Alexandrova V.D. Geobotanical zoning of the Arctic and Antarctic. Nauka, Leningrad, 1977 (in Russ.).
Arenz B.E., Blanchette R.A. Distribution and abundance of soil fungi in Antarctica at sites on the Peninsula, Ross Sea region and McMurdo dry valleys. Soil Biol. Biochem. 2011. V. 43. P. 308–315. https://doi.org/10.1016/j.soilbio.2010.10.016
Arenz B.E., Blanchette R.A. Investigations of fungal diversity in wooden structures and soils at historic sites on the Antarctic Peninsula. Can. J. Microbiol. 2009. V. 55. P. 46–56. https://doi.org/10.1139/W08-120
Arenz B.E., Blanchette R.A., Farrell R.L. Fungal diversity in Antarctic soils. In: D. Cowan (ed.), Antarctic terrestrial microbiology: Physical and biological properties of Antarctic soils. Springer, Berlin, 2014, pp. 35–53. https://doi.org/10.1007/978-3-642-452 13-0_3
Blanchette R.A., Held B.W., Arenz B.E. et al. An Antarctic hot spot for fungi at Shackleton’s historic hut on Cape Royds. Microb. Ecol. 2010. V. 60. P. 29–38. https://doi.org/10.1007/s00248-010-9664-z
Blanchette R.A., Held B.W., Hellmann L. et al. Arctic driftwood reveals unexpectedly rich fungal diversity. Fungal Ecol. 2016. V. 23. P. 58–65. https://doi.org/10.1016/j.funeco.2016.06.001
Blanchette R.A., Held B.W., Jurgens J.A. et al. Wood destroying soft rot fungi in the historic expedition huts of Antarctica. Appl. Environ. Microbiol. 2004. V. 70. P. 1328–1335. https://doi.org/10.1128/AEM.70.3.1328-1335.2004
Colwell R. K., Chao A., Gotelli N.J. et al. Models and estimators linking individual-based and sample based rarefaction, extrapolation and comparison of assemblages. J. Plant Ecology. 2012. V. 5 (1). P. 3–21. https://doi.org/10.1093/jpe/rtr044
Colwell R.K. EstimateS 9.10. User’s guide. 2014. http://viceroy.eeb.uconn.edu/EstimateS.
Connell L., Redman R., Craig S. et al. Distribution and abundance of fungi in the soils of Taylor Valley, Antarctica. Soil Biol. Biochem. 2006. V. 38. P. 3083–3094. https://doi.org/10.1016/j.soilbio.2006.02.016
Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi. IHW-Verlag, Eching, 2007
Godinho V.M., Furbino L.E., Santiago I.F. et al. Diversity and bioprospecting of fungal communities associated with endemic and cold-adapted macroalgae in Antarctica. The ISME J. 2013. V. 7. P. 1434–1451.
Goncalves V.N., Vaz A.B., Rosa C.A. et al. Diversity and distribution of fungal communities in lakes of Antarctica. FEMS Microbiol. Ecol. 2012. V. 82. P. 59–471. https://doi.org/10.1038/ismej.2013.77
Hagestad O.C., Andersen J.H., Altermark B. et al. Cultivable marine fungi from the Arctic Archipelago of Svalbard and their antibacterial activity. Mycology. 2020. V. 11 (3). P. 230–242. https://doi.org/10.1080/21501203.2019.1708492
Hellmann L., Tegel W., Eggertsson Ó. et al. Tracing the origin of Arctic driftwood. J. Geophysical Research: Biogeosciences. 2013. V. 118 (1). P. 68–76. https://doi.org/10.1002/jgrg.20022
Hughes G. Biogeography and the marine fungi S.T. Moss (ed.), The biology of marine fungi, Cambridge University Press, Cambridge, 1986, pp. 275–295.
Index Fungorum. [A nomenclature database]. 2020. http://www.indexfungorum.org/names/Names.asp. Accessed 12.07.2020.
Johansen S., Hytteborn H. A contribution to the discussion of biota dispersal with drift ice and driftwood in the North Atlantic. J. Biogeography. 2001. V. 28. P. 105–115. https://doi.org/10.1046/j.1365-2699.2001.00532.x
Johnson T. The estuarine mycoflora. G. Lauff (ed.), Estuaries, American Association for the Advancement of Science Publication, Washington, 1967, pp. 303–305.
Jones E.B.G. Are there more marine fungi to be described? Bot. Mar. 2011. V. 54. P. 343–354. https://doi.org/10.1515/bot.2011.043
Jurgens J.A., Blanchette R.A., Filley T.R. Fungal diversity and deterioration in mummified woods from the ad Astra ice Cap Region in the Canadian high Arctic. Polar Biol. 2009. V. 32. P. 751–758. https://doi.org/10.1007/s00300-008-0578-x
Kirtsideli I.Yu., Vlasov D.Yu., Barantsevich E.P. et al. Microfungi from soil of polar desert at Izvestia island (in Kara Sea). Mikoligiya i fitopatologiya. 2014. V. 48 (3). P. 365–371 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Barantsevich E.P. et al. Distribution of terrigenous microfungi in Arctic Seas. Mikoligiya i fitopatologiya. 2012. V. 46 (5). P. 306–310 (in Russ.).
Kirtsideli I.Yu., Vlasov D.Yu., Novozhilov Yu.K. et al. Assessment of anthropogenic influence on Antarctic mycobiota in areas of Russian polar stations. Contemporary Problems of Ecology. 2018. V. 11 (5). P. 449–457. https://doi.org/10.1134/S1995425518050074
Kirtsideli I.Yu., Vlasov D.Yu., Zelenskaya M.S. et al. Anthropogenic modification of mycobiota on Vize island (in the Kara Sea). Gigiena i Sanitariya. 2018. V. 97 (11). P. 1058–1063 (in Russ.). https://doi.org/10.18821/0016-9900-2018-97-11-1058-63
Kohlmeyer J. On the definition and taxonomy of higher marine fungi. Veröffentlichungen des Instituts für Meeresforschung in Bremenhaven Supplement. 1974. V. 5. P. 263–286.
Kolosova M.I., Solovieva N.G. The main anatomical features of the wood of deciduous trees and shrubs. SPb., 2013 (in Russ.).
Ludley K.E., Robinson C.H. Decomposer’ Basidiomycota in Arctic and Antarctic ecosystems. Soil Biol. Biochem. 2008. V. 40. P. 11–29. https://doi.org/10.1016/j.soilbio.2007.07.023
Malosso E., Waite I.S., English L. et al. Fungal diversity in maritime Antarctic soils determined using a combination of culture isolation, molecular fingerprinting and cloning techniques. Polar Biol. 2006. V. 29. P. 552–561. https://doi.org/10.1007/s00300-005-0088-z
Marchenko S., Cheng G., Lötstedt P. et al. Thermal conductivity of firn at Lomonosovfonna, Svalbard, derived from subsurface temperature measurements. The Cryosphere. 2019. V. 13 (7). P. 1843–1859. https://doi.org/10.5194/tc-13-1843-2019
Martín-Sanz A., Rueda S., García-Carneros A.B. et al. Cadophora malorum: a new pathogen of sunflower causing wilting, yellowing, and leaf necrosis in Russia. Plant Disease. 2018. V. 102 (4). P. 823–827. https://doi.org/10.1094/PDIS-08-17-1182-PDN
Methods of experimental mycology. Naukova Dumka, Kiev, 1982 (in Russ.).
Pang K.-L., Chow R., Chan C. et al. Diversity and physiology of marine lignicolous fungi in Arctic waters: a preliminary account. Polar Res. 2011. V. 30. P. 5859–5863. https://doi.org/10.3402/polar.v30i0.5859
Pang K.-L., Overy D.P., Jones E.B.G. et al. “Marine fungi” and “marine-derived fungi” in natural product chemistry research: toward a new consensual definition. Fungal Biol. Rev. 2016. V. 30(4). P. 163–175. https://doi.org/10.1016/j.fbr.2016.08.001
Pivkin M.V. Secondary marine fungi of the Japan and Okhotsk Sea. Abstract of thesis … Doct. Biol. Moscow, 2010 (in Russ.).
Rämä T., Hassett B.T., Bubnova E. Arctic marine fungi: from filaments and flagella to operational taxonomic units and beyond. Botanica Marina. 2017. V. 60 (4). P. 433–452. https://doi.org/10.1515/bot-2016-0104
Rämä T., Norden J., Davey M. et al. Fungi ahoy! Diversity on marine wooden substrata in the high North. Fungal Ecol. 2014. V. 8. P. 46–58. https://doi.org/10.1016/j.funeco.2013.12.002
Raper K.B., Thom C. A manual of the Penicillia. The Williams and Wilkins Company, Baltimore, 1949.
Richards T.A., Jones M.D.M., Leonard G. et al. Marine fungi: their ecology and molecular diversity. Annual Review of Marine Science. 2012. V. 4. P. 495–522. https://doi.org/10.1146/annurev-marine-120710-100802
Schubert K., Groenewald J.Z., Braun U. et al. Biodiversity in the Cladosporium herbarum complex (Davidiellaceae, Capnodiales), with standardisation of methods for Cladosporium taxonomy and diagnostics. Stud. Mycol. 2007. V. 58. P. 105–156. https://doi.org/10.3114/sim.2007.58.05
Shitikov V.K., Zinchenko T.D., Rozenberg G.S. Macroecology of river communities: concepts, methods, models. Tolyatti, 2011 (in Russ.).
Slepecky R.A., Starmer W.T. Phenotypic plasticity in fungi: a review with observations on Aureobasidium pullulans. Mycologia. 2009. V. 101 (3). P. 823–832. https://doi.org/10.3852/08-197
Sparrow F.K. The occurrence of saprophytic fungi in marine muds. The Biological Bulletin. 1937. V. 73. P. 242–248.
Terekhova V.A. Micromycetes in the ecological assessment of aquatic and terrestrial ecosystems. M.: Science. 2007. 214 p. (in Russ.)
Tosi S., Casado B., Gerdol R. et al. Fungi isolated from Antarctic mosses. Polar Biol. 2002. V. 25. P. 262–268. https://doi.org/10.1007/s00300-001-0337-8
White T.J., Bruns T., Lee S. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: M. Innis (eds). PCR Protocols: a guide to methods and applications. Academic Press, San Diego, 1990, pp. 315–322.
Wittenberg A.H.J., van der Lee T.A.J., Ben M’Barek S. et al. Meiosis drives extraordinary genome plasticity in the haploid fungal plant pathogen Mycosphaerella graminicola. PloS One. 2009. V. 4(6). e5863. https://doi.org/10.1371/journal.pone.0005863
Yatsenko-Khmelevsky A.A. Fundamentals and methods of anatomical study of wood. Moscow, Leningrad, 1954 (in Russ.).
Zhang T., Yao Y.-F. Endophytic fungal communities associated with vascular plants in the high Arctic zone are highly diverse and host specific. PLoS One. 2015. 10. https://doi.org/10.1371/journal.pone.0130051
Александрова В.Д. (Aleksandrova) Геоботаническое районирование Арктики и Антарктики. Л.: Наука. 1977. 188 с.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П. и др. (Kirtsideli et al.) Комплексы микроскопических грибов в почвах и грунтах полярного острова Известий ЦИК (Карское море) // Микология и фитопатология. 2014. Т. 48. № 6. С. 365–371.
Кирцидели И.Ю., Власов Д.Ю., Баранцевич Е.П. и др. (Kirtsideli et al.) Распространение терригенных микромицетов в водах Арктических морей // Микология и фитопатология. 2012. Т. 46. № 5. С. 306–310.
Кирцидели И.Ю., Власов Д.Ю., Зеленская М.С. и др. (Kirtsideli et al.) Антропогенная модификация микобиоты на острове Визе (Карское море) // Гигиена и санитария. 2018. Т. 97. № 11. С. 1058–1063.
Колосова М.И., Соловьева Н.Г. (Kolosova, Solovieva) Основные анатомические признаки древесины лиственных деревьев и кустарников. СПб., 2013. 104 с.
Методы экспериментальной микологии. (Methods) / под ред. В.И. Билай. Киев.: Наукова Думка, 1982. 550 с.
Пивкин М.В. (Pivkin) Вторичные морские грибы Японского и Охотского морей. Автореф. дис. … докт. биол. наук. М.: МГУ, 2010. 40 с.
Терехова В.А. (Terekhova) Микромицеты в экологической оценке водных и наземных экосистем. М.: Наука, 2007. 214 с.
Шитиков В.К., Зинченко Т.Д., Розенберг Г.С. (Shitikov et al.) Макроэкология речных сообществ: концепции, методы, модели. Тольятти, 2011. 255 с.
Яценко-Хмелевский А.А. (Yatsenko-Khmelevskiy) Основы и методы анатомического исследования древесины. М.-Л., 1954. 337 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология



