Микология и фитопатология, 2021, T. 55, № 3, стр. 189-202
Влияние технологии no-till на численность и таксономический состав микроскопических грибов в южных агрочерноземах
Д. А. Никитин 1, *, М. В. Семенов 1, **, А. Д. Железова 1, ***, О. В. Кутовая 1, ****
1 Почвенный институт им. В.В. Докучаева
119017 Москва, Россия
* E-mail: dimnik90@mail.ru
** E-mail: mikhail.v.semenov@gmail.com
*** E-mail: alferrum@mail.ru
**** E-mail: langobard@mail.ru
Поступила в редакцию 30.10.2020
После доработки 10.12.2020
Принята к публикации 21.12.2020
Аннотация
Охарактеризованы сообщества культивируемых микроскопических грибов в южных агрочерноземах Ставропольского края, обрабатываемых по технологии no-till и традиционной вспашкой с оборотом пласта, для вариантов с различными сельскохозяйственными культурами и при внесении/отсутствии минеральных удобрений. В исследованных образцах преобладают олиготрофные, сапротрофные и целлюлолитические микромицеты. Наибольшей численностью и таксономическим разнообразием характеризуется род Penicillium. Почвы с традиционной вспашкой имеют более высокое разнообразие микромицетов по сравнению с почвами под no-till. Высокая численность целлюлолитиков выявлена в почвах с традиционной обработкой под соей и озимой пшеницей, а также под кукурузой с обработкой no-till вне зависимости от наличия/отсутствия удобрений. Оценка β-разнообразия показала, что сообщества микромицетов четко кластеризуются по фактору обработки почвы, разделяясь на два кластера (почвы под вспашкой и под технологией no-till). На полях no-till значительно выше обилие фитопатогенов и целлюлолитиков, а на вспаханных делянках – сапротрофов и олиготрофов. Возделываемая сельскохозяйственная культура также влияла на доминирование тех или иных таксонов микобиоты, однако ее вклад в различия между сообществами микромицетов был значительно ниже. Таким образом, тип обработки почвы является более важным фактором формирования сообществ микромицетов, чем сельскохозяйственная культура и внесение удобрений в невысоких дозах. Применение технологии no-till не возвращает сообщество микобиоты к значениям для фоновых экосистем (некосимых степей), но значительно трансформирует его.
ВВЕДЕНИЕ
Основной целью сельского хозяйства является получение максимально высоких урожаев (Wallach et al., 2018). Для этого в настоящее время черноземы подвергаются усиленной агрогенной нагрузке (Zamotaev et al., 2016; Dridiger et al., 2017). Интенсивное воздействие орудиями землепользования при традиционной обработке почвы приводит к ухудшению многих агрономических свойств (Pykhtin, Gostev, 2012; Kiryushin, 2014; Lebedeva et al., 2016). При воздействии тяжелых механизмов на почву возрастает плотность подпахотного слоя, разрушаются агрономически ценные агрегаты, увеличивается эрозия (Dridiger et al., 2017). Усиленная обработка почвы приводит к уменьшению запасов углерода, качества и доступности органического вещества почвы (Semenov, Kogut, 2015; Tsiafouli et al., 2015). Кроме того, интенсивная вспашка существенно снижает биоразнообразие агроценозов (Kutovaya et al., 2018; Brown et al., 2019), в том числе сокращается численность и разнообразие микробиоты (Semenov et al., 2016, 2018). Это негативно сказывается на супрессивной активности почв по отношению к фитопатогенам (Van Agtmaal et al., 2018). Таким образом, следствием длительного применения традиционной обработки почвы может являться спад урожайности полей и рост частоты заболеваний растений (Pykhtin, Gostev, 2012; Ma et al., 2012; Ju, 2014; Stewart, Globig, 2016). Однако в большинстве хозяйств черноземной полосы традиционная обработка с оборотом пласта по-прежнему остается наиболее распространенным способом земледелия.
Недостатки традиционной обработки почвы, а также тенденции к экологизации земледелия привели к распространению альтернативных технологий с минимальным воздействием на почву, в частности, no-till (Kiryushin, 2014; Makhotova, 2015; Dridiger, 2016; Pretty, Bharucha, 2018). Ее суть заключается в сокращении числа и глубины механических обработок полей, использовании относительно легких агрегатов для уменьшения физического давления на почву и покрывание ее поверхности растительной мульчей (Rainbow, Derpsch, 2011; Kiryushin, 2014; Dridiger, 2016). Ввиду того, что верхний слой почвы остается уплотненным по сравнению с традиционной обработкой, no-till в значительной мере препятствует водной и ветровой эрозии, а также помогает сохранить большие запасы почвенной влаги (Gras et al., 2016). Поэтому no-till рационально применять для почв в условиях недостаточного увлажнения, в том числе и для черноземной полосы. Тем не менее, большинство преимуществ нулевой обработки проявляется обычно не сразу, а в относительно долгосрочной (более 5 лет) перспективе (Pittelkow et al., 2015; Zhelezova et al., 2017; Blanco-Canqui et al., 2018). No-till считается почвосберегающей технологией, наиболее выгодной с экономической точки зрения для почв засушливого климата (Toliver et al., 2012; Pittelkow et al., 2015; Dridiger, 2016; Dridiger et al., 2017; Melnikov, Zhelezova, 2019; Yu et al., 2020). Применение no-till технологий должно предусматривать диверсификацию севооборотов как природного механизма элиминирования фитопатогенов (Orlova, Chernov, 2006; Toropova et al., 2018; Sommermann et al., 2018).
Черноземы, ввиду хорошей оструктуренности и богатства гумусом, имеют благоприятные свойства для культивирования растений и не требуют интенсивной механической обработки, что облегчает внедрение на поля с этим типом почв технологии no-till (Lebedeva et al., 2016; Dridiger et al., 2017). К достоинствам данной технологии также относятся снижение механической нагрузки на почву, сохранение ее структуры и запасов органического вещества (Drechsel et al., 2005; Trusov, 2012; Kiryushin, 2014). Таким образом, данная технология земледелия может помочь сохранить не возобновляемые почвенные ресурсы самых плодородных земель России.
Минимальная обработка почвы имеет и ряд недостатков, главными из которых являются повышенная засоренность посевов вредными растениями и фитопатогенными микроорганизмами (Anderson, 2008; Kiryushin, 2013; Turusov et al., 2017; Van Agtmaal et al., 2018), а также увеличение пестицидных нагрузок (Holland, 2004; Kharalgina, Rzaeva, 2007). Кроме того, no-till неэффективно использовать для переувлажненных территорий и полей со сложным рельефом (Anderson, 2008; Trusov, 2012; Kiryushin, 2013; Sheehy et al., 2015; Liang et al., 2020). Нулевая обработка почв из-за недостаточного рыхления приводит также и к снижению аэрации, что усиливает денитрификацию и приводит к потерям азота из почвы (Yuan et al., 2018). В умеренном климатическом поясе обилие растительной мульчи на полях с no-till приводит к замедлению прогревания почвы, как следствие, растягиванию во времени периода всходов возделываемой культуры, а также к трудностям с внесением удобрений (Sheehy et al., 2015; Zhelezova et al., 2017). Фактически большинство из приведенных данных по преимуществам и недостаткам применения той или иной обработки почвы противоречиво, поэтому необходимо использование более чувствительных методов оценки почв.
По сравнению с остальной почвенной биотой, микроорганизмы наиболее быстро реагируют на разнообразные внешние воздействия, в том числе и на сельскохозяйственную обработку полей (Kuznetsova et al., 2016; Wang et al., 2017; Semenov et al., 2018). Изменения в численном и таксономическом составе прокариот и микобиоты могут служить индикатором заболеваний растений. Ввиду того, что большинство фитопатогенов являются грибами (Stewart, Globig, 2016), мы уделили внимание в исследовании именно этой группе почвенной микробиоты. Влияние no-till на микробиологические свойства почв и, в частности, на сообщества микроскопических грибов, изучено недостаточно полно (Wang et al., 2017; Schmidt et al., 2019). Однако микромицеты в значительной степени определяют здоровье почвы (Schmidt et al., 2019), а деятельность сапротрофных микроскопических грибов может приводить к улучшению плодородия (Irawan et al., 2017). Следствием высокого содержания остатков мульчи сельскохозяйственных культур, характерного для технологии no-till, являются неконтролируемые вспышки заболеваний, вызываемых фитопатогенной микобиотой (Rainbow, Derpsch, 2011; Stewart, Globig, 2016; Schlatter et al., 2017). Проведено мало исследований по сравнению численности и таксономической структуры сообществ микроскопических грибов с применением технологии no-till даже для черноземов – наиболее плодородных и изученных почв (Kutovaya et al., 2018; Melnichuk et al., 2018).
Целью работы стала оценка численности КОЕ и таксономической структуры сообществ культивируемых микроскопических грибов в южных агрочерноземах Ставропольского края, обрабатываемых по технологии no-till и традиционной вспашкой с оборотом пласта для вариантов с различными сельскохозяйственными культурами и при внесении/отсутствии минеральных удобрений. Исследование включало следующие задачи: оценка влияния обработки почвы no-till на численность микромицетов; выявление соотношений экологических групп микромицетов в почвах полей с нулевой сельскохозяйственной обработкой по сравнению со вспашкой; проверка гипотезы о возможности возвращения микробиологических и агрономических свойств пашни чернозема к целинному состоянию после длительного применения на полях технологии no-till.
МАТЕРИАЛЫ И МЕТОДЫ
Почвы. Исследованы делянки полей с тремя типами учитываемых факторов: обработка почвы (традиционная вспашка с оборотом пласта и технология no-till); наличие/отсутствие минеральных удобрений; сельскохозяйственные культуры (соя, подсолнечник, кукуруза, озимая пшеница) (табл. 1). Площадь делянок опытных полей составляет 300 м2 (50 × 6 м), учетная – 90 м2. Объекты исследования расположены в пределах опытного хозяйства ФГБНУ “Северо-Кавказский ФНАЦ” (45°07′48″ с.ш. 42°01′39″ в.д.), Шпаковский р-н Ставропольского края. Почвы всех опытных полей отнесены к чернозему обыкновенному среднемощному слабогумусированному тяжелосуглинистому на лессовидных карбонатных суглинках (Gadzhiumarov, Zhukova, 2018).
Таблица 1.
Перечень факторов, изучаемых на делянках опытных полей
| Обработка почвы | Культура | Удобрения |
|---|---|---|
| Минимальная, прямой посев (no-till) | соя | – |
| + | ||
| кукуруза | – | |
| + | ||
| подсолнечник | – | |
| + | ||
| озимая пшеница | – | |
| + | ||
| Традиционная (вспашка с оборотом пласта) | соя | – |
| + | ||
| кукуруза | – | |
| + | ||
| подсолнечник | – | |
| + | ||
| озимая пшеница | – | |
| + | ||
| Контроль (почва без обработки) | залежь | – |
Пахотный горизонт вспаханной почвы содержит меньше органического углерода (3.87%) и нитратного азота (11.9 мг/кг) по сравнению с нативной почвой. Содержание лабильных форм фосфора составляет 18.7 мг/кг почвы, обменного калия – 245 мг/кг. Почва слабокислая (рН = 6.32).
Длительность обработок изучаемых почв составляет 7 лет. Повторность полевого опыта 3-кратная. На поля с обоими типами обработки перед посевом вносили минеральные удобрения (нитроаммофоска) в дозе N160P90K60 под озимую пшеницу; N72P58K32 – под подсолнечник; N80P48K48 – под кукурузу; N60P60K60 – под сою.
Плотность почвы полей перед уборкой урожая в слое 0–10 см с традиционной обработкой составляла 1.23 г/см3, а для полей no-till – 1.24 г/см3. В качестве контроля рассматривалась необрабатываемая залежная почва вблизи опытных полей. Отбор образцов проводили в 3-кратной повторности из слоя 0–10 см в октябре 2018 г. с возможными мерами по предотвращению контаминации. До анализов образцы хранились при температуре 4°С. Список образцов приведен в табл. 1.
Микробиологический посев. Таксономический состав культивируемых микроскопических грибов определяли методом микробиологического посева на агаризованные среды (Zvyagintsev, 1991). В стерильных пластиковых пробирках готовили суспензии исследуемых образцов с разведениями 1 : 1000, 1 : 10 000, 1 : 100 000 для сред Чапека (ЧА), голодного агара (ГА) и крахмало-аммиачного агара (КАА) и с разведениями 1 : 10, 1 : 100, 1 : 1000 для среды Гетчинсона (ГЕ) с целлюлозой. Десорбцию грибных пропагул от почвенных частиц осуществляли путем обработки почвенной суспензии на вортексе MSV-3500 (Латвия) при скорости 3500 об./мин в течение 5 мин. Аликвоту почвенной суспензии объемом 100 мкл помещали на поверхность стерильных агаризованных сред в чашках Петри диаметром 90 мм. Повторность каждого варианта посевов шестикратная. Для подавления роста бактерий в питательные среды добавляли стрептомицин (100 мг/л). Учет численности выросших колониеобразующих единиц (КОЕ) микромицетов осуществляли на 7, 14 и 20-е сутки. Из посевов в чистые культуры выделяли морфотипы по макро- и микрокультуральным признакам (микроскоп Биомед-5). Общее α-разнообразие грибных сообществ оценивали по индексу Шеннона. β-разнообразие сообществ микромицетов оценивали с использованием многомерного шкалирования (nMDS) по метрике Брэя-Кертиса (Semenov et al., 2019).
Процедура ПЦР. Для всех изолятов микроскопических грибов предварительно проведена идентификация по культурально-морфологическим (Ellis, 1971; Domsch et al., 2007; Seifert, Gams, 2011) или молекулярно-биологическим признакам (по анализу участков ITS1–ITS2 рДНК). Выделение ДНК из чистых культур микромицетов проводили по методике Глушаковой с соавторами (Gluschakova et al., 2011): биомассу 5–6-суточной культуры переносили в 2 мл эппендорфы, добавляли 400 мкл стеклянных шариков (300–500 мкм диаметром) и 500 мкл лизирующего буфера (TrisBase 50 mM, NaCl 250 mM, ЭДТА 50 mM, SDS0.3%, pH 8). Приготовленную смесь взбалтывали на вортексе на скорости 3500 об./мин в течение 15 мин, затем инкубировали 1 ч при температуре 65°С, после снова трясли на вортексе 15 мин и центрифугировали (13.4 тыс. об/мин) 10 мин, отбирали над-осадочную жидкость. Для амплификации региона рДНК, содержащего D1/D2 домен региона 26S рДНК, использовали праймеры ITS1f (5' CTTGGTCATTTAGAGGAAGTA) и NL4 (5' GGTCCGTGTTTCAAGACGG) и смеси для ПЦР ScreenMix (ЗАО “Евроген”, Москва). Амплификатор использовали по следующей программе: (начальная денатурация – 2 мин при температуре 96°С; затем 35 циклов: денатурация – 20 с при температуре 96°С, отжиг праймеров – 50 с при температуре 52°С, синтез ДНК – 1.5 мин при температуре 72°С; конечная достройка 7 мин при температуре 72°С). Очистку ПЦР-продукта проводили с использованием набора BigDye XTerminator Purification Kit (Applied Biosystems, США). Для секвенирования использовали праймер NL4. Секвенирование ДНК проводили с помощью набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (Applied Biosystems, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в Научно-производственной компании “Синтол” (Москва). Идентификацию по полученным хроматограммам проводили, используя данные генбанка NCBI и Index Fungorum (2020).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность и таксономический состав микромицетов. Общая численность культивируемых микромицетов в посевах исследованных почв (для индивидуального образца) составляла от 2.5 × 103 до 5.9 × 104 КОЕ/г почвы (рис. 1). Минимальные значения выявлены на среде ЧА и ГЕ, а максимальные – на голодном агаре, что, по-видимому, связано с преобладанием олиготрофной микобиоты.
Рис. 1.
Тепловая карта влияния исследуемых факторов [тип обработки почвы – no-till (NT) или традиционная (TR); сельскохозяйственная культура – соя (SO), кукуруза (C), подсолнечник (SU) или озимая пшеница (W); наличие (F) или отсутствие удобрений на развитие культивируемых микроорганизмов]. Данные представлены в виде значений lgN (где N – количество КОЕ/г почвы микроорганизмов определенной эколого-трофической группы), нормализованных по принципу Z-трансформации. Буквами обозначены: А – среда ЧА; Б – среда ГЕ; В – среда КАА; Г – среда ГА.
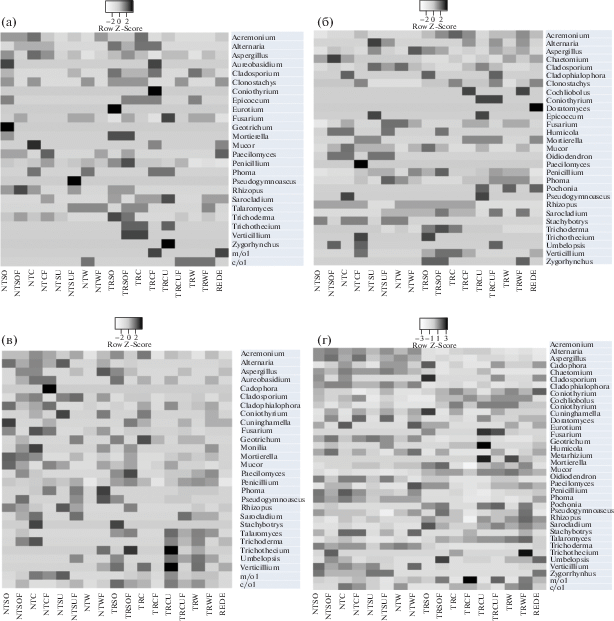
Для среды ЧА наименьшая численность микромицетов (2.5 × 103 КОЕ/г почвы) определена для неудобренных полей no-till под подсолнечником и кукурузой на традиционно обрабатываемых делянках (рис. 1). На среде ГЕ наименьшее количество грибных пропагул в образцах полей с минимальной обработкой под соей без удобрений. Для обеих упомянутых сред максимальные значения выявлены для традиционно возделываемых делянок под соей вне зависимости от содержания удобрений. Значения численности микромицетов на среде КАА отличаются выравненностью для всех вариантов почв (около 2.5 × 104 КОЕ/г почвы), кроме образцов полей no-till под пшеницей без удобрений, традиционно обрабатываемых удобренных полей кукурузы и залежи, где численность культивируемой микобиоты меньше на порядок (от 2 × 103 до 7×103 КОЕ/г почвы). Для ГА также свойственна выравненность значений численности микромицетов для всех образцов (от 4 × 104 до 5.0 × 104 КОЕ/г почвы), кроме традиционно обрабатываемой делянки кукурузы с удобрениями.
Из исследованных почв выделено 63 вида микроскопических грибов, которые относятся к 35 родам из 2 отделов (рис. 1). Отдел Mucoromycota представлен шестью родами – Cuninghamella, Mortierella, Mucor, Rhizopus, Umbelopsis, Zygorhynchus. Отдел Ascomycota – тремя телеоморфными (Chaetomium, Eurotium и Talaromyces) и 28-ю анаморфными родами (доминанты Aspergillus, Fusarium, Penicillium, Trichoderma). Выделено также и 2 типа изолятов, представленных стерильными пигментированными или гиалиновыми мицелиями неопределенного систематического положения ввиду их сложного культивирования. Наибольшим видовым разнообразием характеризовались роды Penicillium (8 видов), Aspergillus (8 видов), Acremonium (3 вида), Trichoderma (3 вида) и Cladosporium (3 вида). Данные роды являются типичными представителями сапротофного блока культивируемой почвенной микобиоты в умеренном климате (Ellis, 1971; Domsch et al., 2007; Seifert, Gams, 2011). В то же время многие представители этих родов, в первую очередь Trichoderma harzianum и Cladosporium herbarum, часто являются активными целлюлолитиками, разлагающими растительные остатки (Domsch et al., 2007), продукты деградации которых могут увеличивать плодородие почвы (Irawan et al., 2017). Известно, что целлюлолитическая активность почв, обрабатываемых по технологии no-till, гораздо больше, нежели для вспаханных земель (Kuznetsova et al., 2016). Максимальная встречаемость среди видов выявлена для Penicillium janthinellum, Acremonium strictum, Fusarium solani, Clonostachys rosea и Trichoderma harzianum. Penicillium janthinellum является типичным почвенным сапротрофом, продуцирующим токсины. Acremonium strictum известен как сапротроф и/или микопатоген. Fusarium solani и Clonostachys rosea – сапротрофы и/или фитопатогены. Trichoderma harzianum является активным целлюлолитиком и антагонистом многих фитопатогенов. Кроме того, в исследуемых почвах распространен целлюлолитик и фитопатоген Cladosporium cladosporioides. Таким образом, фитопатогенными свойствами из данного списка обладают лишь Fusarium solani и Cladosporium cladosporioides (Ellis, 1971; Domsch et al., 2007; Seifert, Gams, 2011). С другой стороны, все выявленные микромицеты, кроме Acremonium sp., входят в перечень условно патогенных для человека видов (Hoog et al., 2000).
Поскольку в исследовании использовались селективные питательные среды, на них выявлен различный таксономический состав микромицетов. Значительная часть родов присутствовала одновременно на всех средах, однако некоторые росли лишь на одной или двух средах. На среде ЧА не было выявлено 12 родов (в том числе Chaetomium, Cochliobolus, Cuninghamella, Humicola); на среде ГЕ не обнаружены восемь родов микромицетов (в первую очередь Aureobasidium, Eurotium, Geotrichum, Monilia); на среде КАА не были детектированы представители 11 родов (в том числе Clonostachys, Doratomyces, Epicoccum, Metarhizium, Oidiodendron); на ГА отсутствуют Aureobasidium, Epicoccum и Monilia. Зная экологические особенности представителей каждого рода, можно объяснить такие закономерности. Эккрисотрофы (Aureobasidium, Geotrichum, Epicoccum, Monilia) не способны к росту при отсутствии легкодоступной органики; для целлюлолитиков (Chaetomium, Cuninghamella, Doratomyces, Humicola, Oidiodendron, Zygorhynchus) основной субстрат – растительные остатки, а для энтомопатогенов (Clonostachys, Metarhizium, Pochonia) – беспозвоночные. Такие результаты подчеркивают важность применения нескольких сред для более полного изучения таксономического разнообразия микромицетов в биотопах (Seifert, Gams, 2011).
В исследованных образцах по обилию, численности и таксономическому разнообразию преобладают восемь целлюлолитических (доминирующие роды: Chaetomium, Humicola, Trichoderma, Zygorhynchus) и восемь олиготрофных/сапротрофных (доминанты Aspergillus, Paecilomyces, Penicillium, Pseudo-gymnoascus) родов микромицетов. Значительно меньше по обилию фитопатогенных микромицетов (доминирующие роды: Alternaria, Cladosporium, Cochliobolus, Fusarium, Verticillium). Наибольшей численностью (от 3.4 × 104 до 8.2 × 104 КОЕ/г почвы) и таксономическим разнообразием (до восьми видов во всех образцах) характеризовался род Penicillium. Обилие представителей этого рода максимально на среде КАА в образцах полей с традиционной обработкой под культурой сои и подсолнечника вне зависимости от наличия удобрения (рис. 1). Наиболее редкими по встречаемости видами в исследованных почвах являлись Aspergillus clavatus, Aspergillus sclerotiorum, Eurotium niveoglaucum, Tri-chotecium roseum, Humicola fuscoatra, Oideodendron sp., Cochliobolus lunatus. Большинство из перечисленных в этом списке микромицетов – целлюлолитики (Seifert, Gams, 2011).
Сапротрофные микромицеты в исследуемых образцах выявлены на всех применяемых средах и представлены типичными почвенными таксонами (Domsch et al., 2007; Seifert, Gams, 2011) – Aspergillus spp., Cuninghamella elongata, Eurotium niveoglaucum, Paecilomyces lilacinus, Penicillium spp., Pseudogymnoascus pannorum, Talaromyces flavus, Umbelopsis ramanniana. Их значительная часть входит в базу данных BSL патогенных для человека видов (Hoog et al., 2000). Наибольшая численность КОЕ представителей рода Aspergillus (102–103 КОЕ/г почвы) выявлена в образцах полей с нулевой и традиционной обработкой под пшеницей, среди которых особо выделялись образцы с удобрениями, где детектировали высокую численность (103–104 КОЕ/г почвы) условно-патогенных для человека видов родов Aspergillus и Penicillium. Сапротрофная группа микроскопических грибов широко специализирована и может одинаково хорошо разлагать разнообразные типы субстрата: как сложные полисахариды (лигнин, целлюлозу и др.), так и легкодоступную органику (сахара, аминокислоты и др.). В результате деятельности сапротрофов разлагается большая часть растительных и животных остатков, происходит минерализация органики и может происходить образование почвенного органического вещества, увеличивающего плодородие почвы (Irawan et al., 2017).
Высокая численность (103–104 КОЕ/г почвы) целлюлолитиков выявлена, в основном, на селективной среде ГЕ в посевах образцов поля с традиционной обработкой под подсолнечником без удобрений (преобладал вид Sarocladium kiliense), поля с нулевой обработкой под удобренной пшеницей (доминировал Zygorhynchus moelleri) и неудобренной кукурузой (преобладали Sarocladium kiliense и Chaetomium globosum). На этой среде численность КОЕ микромицетов вышеперечисленных родов существенно возрастает по сравнению с количеством пропагул, вырастающих на среде ЧА.
Образцы полей no-till под подсолнечником и почвы вспаханных делянок под кукурузой и подсолнечником содержали большое таксономическое разнообразие и значительную численность (103–104 КОЕ/г почвы) фитопатогенов, выявленных преимущественно на средах Чапека и голодном агаре. В образце поля no-till под подсолнечником с удобрением доминировали Phoma herbarum и Ph. exhigua, а без удобрений – Alternaria alternata, A. tenuissima и Cladosporium cladosporioides; в образцах полей с традиционной обработкой под кукурузой и пшеницей – Acremonium sp., Acremonium murorum, A. strictum; в образце полей с традиционной обработкой под кукурузой – Verticillium tenerum, Verticillium sp.; в образце вспаханных полей под подсолнечником – Cladosporium cladosporioides и C. herbarum.
Эккрисотрофы участвуют в разложении и преобразовании специфической легкодоступной органики, выделяемой растениями (Bacon, White, 2016). Численность эккрисотрофной группы, выявленной в данной работе, преимущественно, на среде ЧА и КАА, также была незначительной (101–102 КОЕ/г почвы для каждого из видов), кроме Fusarium solani – фитопатогена и аллергена человека (Kirk et al., 2008; Tadych, White, 2009), количество КОЕ которого доходила до 103 КОЕ/г почвы в образце поля с нулевой обработкой под неудобренной пшеницей на среде ГЕ. Единичные колонии Geotrichum candidum выявлены лишь в образце поля с нулевой обработкой под соей без удобрений. Данный вид обычно имеет дрожжеподобный рост и имеет широкую экологическую пластичность, хорошо адаптируясь как к относительно засушливым, так и к переувлажненным локусам (Domsch et al., 2007; Deak, 2009). Численность эпифитов в исследованных почвах относительно велика (до 103 КОЕ/г почвы) за счет Trichotecium roseum и Aureobasidium pullulans в образцах полей с традиционной обработкой под кукурузой вне зависимости от наличия удобрений. Колонии эккрисотрофов (Aureobasidium pullulans, Epicoccum nigrum, Monilia geophila, Trichotecium roseum) отмечены единично. Чрезвычайно редко и с крайне низкой численностью (101–102 КОЕ/г почвы) встречались энтомопатогенные/нематодопатогенные микромицеты (Driver et al., 2000; Vega et al., 2008) родов Clonostachys, Metarhizium, Pochonia.
Часть эккрисотрофов одновременно являются эпифитными или эндофитными микромицетами – неотъемлемым компонентом филлосферы растений (Tadych, White, 2009; Bacon, White, 2016). Влияние данной экологической группы микобиоты, выявленной в данной работе в основном на средах ЧА и КАА, на физиологию растений по-прежнему слабо изучено. Однако известно, что если растение является здоровым, то эпифитные микромицеты защищают его от фитопатогенов и выделяют вещества, способствующие росту растения (Bacon, White, 2016). С другой стороны, если растение ослаблено, некоторые из этих грибов могут переходить к паразитизму на хозяине или сапротрофии (Tadych, White, 2009). Численность эпифитов значительна (до 103 КОЕ/г почвы) исключительно за счет Trichotecium roseum в образце поля с традиционной обработкой под неудобренной кукурузой и дрожжеподобного микромицета Aureobasidium pullulans – в образце поля с традиционной обработкой под удобренной кукурузой. Trichothecium roseum в некоторых условиях продуцирует значительное количество афлотоксинов, опасных для человека и животных (Hoog et al., 2000; Žabka et al., 2006). Aureobasidium pullulans может переходить к эндофитному образу жизни, по-видимому, помогая растению в реализации некоторых метаболических путей (Domsch et al., 2007; Vega et al., 2008).
Численность микромицетов условно патогенных для человека (группы BSL-1 и BSL-2) была незначительной – 101–102 КОЕ/г почвы для каждого из видов. Исключением явился лишь Sarocladium kiliense (ранее известен как Acremonium kiliense), количество КОЕ которого в образцах поля no-till под кукурузой без удобрений, традиционно обработанного поля под пшеницей без удобрений и залежью на среде ГЕ достигало 103 КОЕ/г почвы. Данный вид относится к категории BSL-2 потенциально патогенных микроорганизмов, активно растет и спороносит при температуре 37°C и может выступать агентом микозов у людей с ослабленным иммунитетом (Brady, 1983; Hoog et al., 2000).
Важно отметить, что для многих микромицетов характерна двойная экологическая роль. Например, представители рода Fusarium в одних условиях могут являться эккрисотрофами, в других – сапротрофами и даже стимулировать рост растений гиббереллинами (Tudzynski, 2005), однако при снижении здоровья растений штаммы Fusarium spp. начинают проявлять фитопатогенную активность (Kuldau, Yates, 2000; Stewart, Globig, 2016). В зависимости от многих экологических факторов, обычными почвенными сапротрофами или же фитопатогенами являются также микромицеты родов Acremonium, Alternaria, Cadophora, Cladosporium, Cochliobolus, Coniothyrium, Phoma и Verticillium. Представители родов Clonostachys, Metarhizium, Pochonia могут быть как сапротрофами, так и энтомопатогенными видами (Driver et al, 2000; Vega et al., 2008). Для определения специфической (фитопатогенной, энтомопатогенной и др.) активности конкретных штаммов необходимо проводить дополнительные лабораторные и полевые эксперименты.
Рассматриваемые факторы (тип обработки почвы, растения и наличия/отсутствия удобрений) отражались на таксономическом составе почвенных микромицетов. Так, на среде ЧА представители родов Coniothyrium, Eurotium, Trichothecium, Verticillium, Zygorhynchus и темноокрашенного стерильного мицелия присутствовали только в посевах образцов традиционно возделываемых полей (рис. 1). В то же время, роды Geotrichum и Pseudogymnoascus выявлены для этой среды исключительно в посевах полей no-till. Только к кукурузе на среде ЧА были приурочены Coniothyrium, Mucor и темноокрашенный стерильный мицелий; лишь к сое на этой среде приурочены Eurotium, Geotrichum, Mortierella. Для подсолнечника характерны Pseudogymnoascus и Zygorhynchus. Микромицеты родов Clonostachys, Eurotium, Geotrichum и Zygorhynchus выявлялись лишь в неудобренных вариантах на среде ЧА, а Coniothyrium, Pseudogymnoascus и темноокрашенный стерильный мицелий – исключительно в образцах удобренных полей. На среде ГЕ представители родов Cochliobolus, Coniothyrium, Doratomyces, Pochonia и Zygorhynchus присутствовали только в посевах образцов традиционно возделываемых полей (рис. 1). В то же время роды Oidiodendron, Paecilomyces, Stachybotrys выявлены для этой среды исключительно среди культивируемых микромицетов на полях no-till. Только к подсолнечнику на среде ГЕ приурочены Coniothyrium, Epicoccum и Pochonia; лишь для кукурузы – Paecilomyces. Микромицеты родов Epicoccum, Pochonia и Pseudogymnoascus отмечены лишь в неудобренных вариантах на среде ГЕ, а Cochliobolus, Paecilomyces и Umbelopsis – исключительно в образцах удобренных полей. Только для образцов залежи на среде ГЕ характерен род Doratomyces. Микромицеты рода Cadophora выявлены исключительно в образцах удобренных полей под кукурузой. На ГА представители родов Eurotium и Metarhizium присутствовали только в посевах образцов традиционно возделываемых полей.
Характеристика α-разнообразия микромицетов. Количество выделенных видов микроскопических грибов в исследуемых образцах почвы колебалось от 10 до 23 на образец (рис. 2). Такая широкая вариабельность связана с разнонаправленным влиянием эколого-трофических факторов в вариантах опыта, в том числе с большим количеством сельскохозяйственных культур и разнообразием обработок почвы. Наибольшее число видов отмечено для вспахиваемых и удобренных делянок сои, минимальное – для вспахиваемых делянок озимой пшеницы без удобрений.
Рис. 2.
α-Разнообразие сообщества почвенных микромицетов: А – число видов на вариант эксперимента; Б – индекса Шеннона.
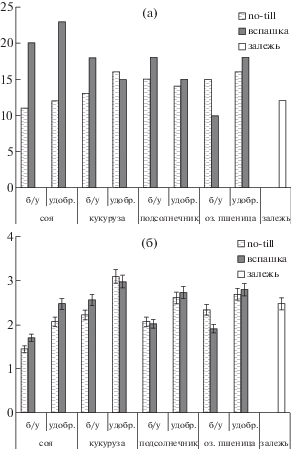
Для сообществ почвенных микромицетов изучаемых вариантов рассчитан индекс Шеннона (рис. 2), по которому можно оценить α-разнообразие. Индекс Шеннона варьирует от 1.4 до 3.3. Его минимальные значения отмечены в варианте поля no-till под неудобренной соей, а максимальные – для делянки no-till под удобренной кукурузой. Высокое содержание азота в почве зачастую благоприятствует развитию быстрорастущих r-стратегов (Männistö et al., 2016). Внесение в почву значительного количества минеральных удобрений обогащает микроэлементами многие олиготрофные локусы, способствуя росту ряда минорных таксонов микробного сообщества в почве (Zhong, Cai, 2007), но также и угнетению многих доминантных таксонов. Кукуруза обладает наиболее развитой корневой системой, захватывая большую площадь почвы по сравнению с остальными рассматриваемыми сельскохозяйственными культурами. При этом происходит более обширная аэрация почвенных слоев, что создает благоприятные условия для развития многих микромицетов (Xiao et al., 2019). Для большинства вариантов эксперимента значения индекса Шеннона составляют от 2.0 до 2.5, что соответствует уровню разнообразия сообществ микромицетов в контроле – залежи, где индекс Шеннона 2.48. Характерно, что в полях с традиционной обработкой почв почти для всех делянок α-разнообразие выше, нежели для вариантов no-till. Сходные тенденции отмечались в предыдущих исследованиях (Kutovaya et al., 2018) и могут быть объяснены более высоким содержанием в почве кислорода, низкая концентрация которого лимитирует многих микромицетов (Golovchenko et al., 2013).
Оценка индекса разнообразия Шеннона выявила четкие тренды в отклике микобиоты, которые связаны, главным образом, с типом обработки почвы и в меньшей степени с видом сельскохозяйственной культуры. Наличие удобрений лишь незначительно влияло на структуру сообществ микобиоты исследованных агрочерноземов. Таким образом, на основе полученных данных α-разнообразия, тип обработки почвы является ключевым фактором агрогенных изменений сообщества почвенных микроскопических грибов. При длительном внесении удобрений роль растений в формировании почвенного и ризосферного сообщества микромицетов может значительно снижаться (Semenov et al., 2019).
Характеристика β-разнообразия микромицетов. Оценка β-разнообразия показала, что сообщества микромицетов четко кластеризуются по фактору обработки почвы, разделяясь на два кластера (почвы под вспашкой и под технологией no-till) (рис. 3). Наиболее четко по фактору обработки почвы кластеризовались сообщества микромицетов на средах ЧА, ГЕ и ГА, поскольку их состав предопределяет появление тех или иных эколого-трофических групп (на ЧА – сахаролитики и сапротрофы; на ГЕ – целлюлолитики и фитопатогены; на ГА – олиготрофы). Такие четкие различия сообществ микромицетов в почвах с разным типом обработки вызваны тем, что на полях no-till значительно выше обилие фитопатогенов (представители родов Alternaria, Cladosporium, Cochliobolus, Fusarium, Phoma и Verticillium) и целлюлолитиков (виды родов Chaetomium, Sarocladium, Zygorhynchus), а на вспаханных делянках – сапротрофов и олиготрофов (виды родов Aspergillus, Cuninghamella, Paecilomyces, Penicillium, Umbelopsis). Возделываемая сельскохозяйственная культура также влияла на доминирование тех или иных таксонов микобиоты, однако ее вклад в различия между сообществами микромицетов был значительно ниже. Например, под подсолнечником преобладали представители родов Alternaria, Cladosporium, Sarocladium, Phoma; под озимой пшеницей – Acremonium и Zygorhynchus moelleri; под кукурузой – Chaetomium, Sarocladium и Verticillium.
Рис. 3.
Оценка различий сообществ микромицетов, культивируемых на средах с использованием многомерного шкалирования (nMDS) и метрики Брэя – Кертиса: А – среда ЧА; Б – среда ГЕ; В – среда ГА; Г – кластерный анализ по факторам для среды ГА.
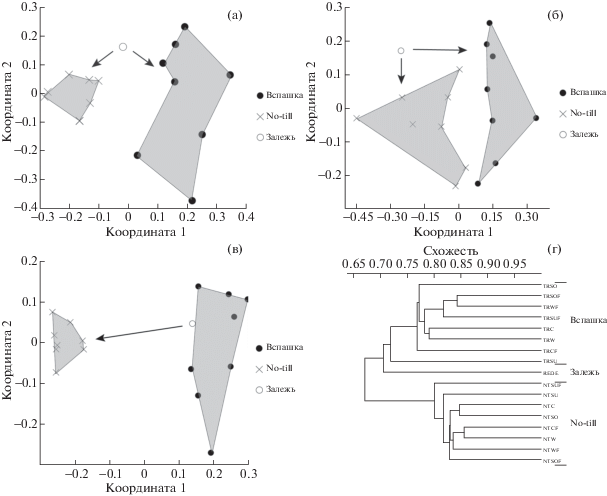
Таким образом, метод микробиологического посева для анализа микобиоты почвы является эффективным приемом выявления изменений в структуре сообществ микромицетов при разных типах обработки почвы. Полученные результаты согласуются с данными других исследований (Wetzel et al., 2014), где показано, что анализ культивируемой микобиоты при разных типах обработки почвы может быть даже более эффективен, чем некоторые молекулярные подходы.
ЗАКЛЮЧЕНИЕ
В исследованных образцах по обилию, численности и таксономическому разнообразию преобладают целлюлолитические (представители родов Chaetomium, Sarocladium, Trichoderma, Zygorhynchus) и олиготрофные/сапротрофные (виды родов Aspergillus, Paecilomyces, Penicillium, Pseudogymnoascus) микромицеты. Наибольшим видовым разнообразием характеризовались роды: Penicillium, Aspergillus, Trichoderma, Cladosporium. Максимальная встречаемость выявлена у Penicillium janthinellum. Среди выявленных микромицетов фитопатогенными свойствами обладают лишь Fusarium solani и Cladosporium cladosporioides.
Разница в технологии обработки почвы значительно изменяет структуру сообществ культивируемых микромицетов, тогда как возделываемая сельскохозяйственная культура является менее важным фактором формирования сообщества микроскопических грибов южных агрочерноземов. Минимальные значения индекса Шеннона отмечаются в варианте поля no-till под неудобренной соей, а максимальные – для делянки no-till под удобренной кукурузой. Для большинства вариантов значения индекса Шеннона соответствуют уровню разнообразия сообществ микромицетов в залежи. Почвы с традиционной вспашкой характеризуются более высоким разнообразием микромицетов по сравнению с почвами под no-till. No-till не возвращает сообщество микобиоты к значениям для фоновых экосистем (некосимых степей), но значительно трансформирует его. Полученные результаты демонстрируют, что метод микробиологического посева для анализа микобиоты почвы является эффективным приемом выявления изменений в структуре сообществ микромицетов при разных типах обработки почвы.
Работа выполнена при поддержке проекта федеральной целевой программы “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы” на тему “Глобальный климат и агроландшафты России: разработка системы оценки и управления рисками деградации Русских черноземов” (соглашение с Минобрнауки России № 075-15-2019-1689 от 06.12.2019 г., уникальный идентификатор проекта RFMEFI60419X0222).
Список литературы
Anderson R.L. Diversity and No-till: keys for pest management in the U/S/Great Plains. Weed Science. 2008. V. 56. P. 141–145. https://doi.org/10.1614/WS-07-007.1
Bacon C.W., White J.F. Functions, mechanisms and regulation of endophytic and epiphytic microbial communities of plants. Symbiosis. 2016. V. 68 (1–3). P. 87–98. https://doi.org/10.1007/s13199-015-0350-2
Blanco-Canqui H., Ruis S.J. No-tillage and soil physical environment. Geoderma. 2018. V. 326 P. 164–200. https://doi.org/10.1016/j.geoderma.2018.03.011
Brady B.L. Acremonium kiliense. CMI Descriptions of Pathogenic Fungi and Bacteria. 1983. P. 741–750.
Brown C., Helgason T., Dytham C. et al. Distance-decay patterns overshadow effects of long-term fertilization and tillage on microbial community structure in agricultural soils. Access Microbiology. 2019. V. 1 (1A). https://doi.org/10.1099/acmi.ac2019.po0276
Deak T. Ecology and biodiversity of yeasts with potential value in biotechnology. In: Yeast biotechnology: diversity and applications. Springer, Dordrecht, 2009, pp. 151–168. https://doi.org/10.1007/978-1-4020-8292-4_8
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi, 2nd taxonomically revised edition by W. Gams. IHW-Verlag, Eching, 2007.
Drechsel P., Olaleye A., Adeoti A. et al. Adoption driver and constraints of resource conservation technologies in sub-Saharan Africa. Berlin, Humbold Universitaet, 2005. P. 1–21.
Dridiger V.K. On the research methodology of no-till technology. Zemledeliye i rasteniyevodstvo. 2016. V. 5. P. 30–32 (in Russ.).
Dridiger V.K., Nevecherya A.F., Tokarev I.D. et al. (Dridiger et al.) Economic efficiency of No-till technology in the arid zone of the Stavropol Territory // Zemledeliye. 2017. V. 3. P. 16–19 (in Russ.).
Driver F., Milner R.J., Trueman W.H.A. A Taxonomic revision of Metarhizium based on sequence analysis of ribosomal DNA. Mycol. Res. 2000. P. 135–151. https://doi.org/10.1017/S0953756299001756
Ellis M.B. Dematiaceous hyphomycetes. Commonwealth Mycological Institute, Kew, London, 1971.
Gadzhiumarov R.G., Zhukova M.P. Influence of cultivation technologies and fertilizers on the growth, development and yield of soybeans in the zone of unstable moisture in the Central Ciscaucasia. Vestnik APK Stavropolya. 2018. V. 1 (29). P. 81–85 (in Russ.).
Glushakova A.M., Kachalkin A.V., Chernov I.Yu. Specific features of the dynamics of epiphytic and soil yeast communities in the thickets of Indian balsam on mucky gley soil. Eurasian Soil Science. 2011. V. 44. P. 886–892. https://doi.org/10.1134/S1064229311080059
Golovchenko A.V., Kurakov A.V., Semenova T.A. et al. Abundance, diversity, viability, and factorial ecology of fungi in peatbogs. Eurasian Soil Science. 2013. V. 46 (1). P. 74–90. https://doi.org/10.1134/S1064229313010031
Gras C., Hernández V. Hegemony, technological innovation and corporate identities: 50 years of agricultural revolutions in Argentina. J. Agrarian Change. 2016. V. 16 (4). P. 675–683. https://doi.org/10.1111/joac.12162
Holland J.M. The environmental consequences of adopting conservation tillage in Europe: reviewing the evidence. Agriculture, Ecosystems and Environment. 2004. V. 103. P. 1–25. https://doi.org/10.1016/j.agee.2003.12.018
Hoog G.S. de, Guarro J., Gené J. et al. Atlas of clinical fungi. 2nd ed. Utrecht, Centraalbureau voor Schimmelcultures, 2000.
Index Fungorum. [A nomenclature database]. 2020. http://www.indexfungorum.org/names/Names.asp. Accessed 12.09.2020.
Irawan B., Afandi A., Hadi S. Effects of saprophytic microfungi application on soil fertility based on their decomposition properties. Journal of Applied Biological Sciences. 2017. V. 2. P. 15–19.
Ju X.T. The concept and meanings of nitrogen fertilizer availability ratio-discussing misunderstanding of traditional nitrogen use efficiency. Acta Pedologica Sinica. 2014. V. 51 (5). P. 921–933.
Kharalgina O.S., Rzaeva V.V. Zero tillage-effective herbicide systems. Agrarnyy vestnik Urala. 2007. V. 5 (41). P. 22–23 (in Russ.).
Kirk P.M., Cannon P.F., Minter D.W., Stalpers J.A. et al. Ainsworth and Bisby’s Dictionary of the Fungi. CAB International, 2008.
Kiryushin V.I. The legacy of V.R. Williams and modern prob-lems of agrosoil science. Izvestiya Timiryazevskoy selskokhozyaystvennoy akademii. 2014. V. 1. P. 5–15 (in Russ.).
Kiryushin V.I. The problem of minimizing soil cultivation: development prospects and research tasks. Zemledeliye. 2013. V. 7. P. 3–6 (in Russ.).
Kuldau G.A., Yates I.E. Evidence for Fusarium Endophytes. In: Microbial endophytes. 2000, p. 85.
Kutovaya O.V., Grebennikov A.M., Tkhakakhova A.K. et al. (Kutovaya et al.) Changes in soil biological processes and the structure of the microbial community of agrochernozems under different methods of soil cultivation. Dokuchaev Soil Bulletin. 2018. V. 92. P. 35–61 (in Russ.).https://doi.org/10.19047/0136-1694-2018-92-35-61
Kuznetsova L.N., Shiryaev A.V., Stupakov A.G. Biological activity of typical chernozem depending on the processing method. Sakharnaya svekla. 2016. V. 1. P. 36–41 (in Russ.).
Lebedeva I.I., Bazykina G.S., Grebennikov A.M. et al. (Lebedeva et al.) Experience of a comprehensive assessment of the impact of the duration of agricultural use on the properties and regimes of agrochernozems of the Kamennaya Steppe. Dokuchaev Soil Bulletin. 2016. V. 83. P. 77–102 (in Russ.).https://doi.org/10.19047/0136-1694-2016-83-77-102
Liang B.C., Vanden Bygaart A.J., MacDonald J.D. et al. Revisiting no-till’s impact on soil organic carbon storage in Canada. Soil and Tillage Research. 2020. V. 198. P. 104–529. https://doi.org/10.1016/j.still.2019.104529
Ma L., Velthof G.L., Wang F.H. et al. Nitrogen and phosphorus use efficiencies and losses in the food chain in China at regional scales in 1980 and 2005. Science of The Total Environment. 2012. V. 434. P. 51–61. https://doi.org/10.1016/j.scitotenv.2012.03.028
Makhotlova M.Sh. Greening Intensive Farming. Zhurnal nauchnykh i prikladnykh issledovaniy. 2015. V. 4. P. 73–74 (in Russ.).
Männistö M., Ganzert L., Tiirola M. et al. Do shifts in life strategies explain microbial community responses to increasing nitrogen in tundra soil? Soil Biol. Biochem. 2016. V. 96. P. 216–228. https://doi.org/10.1016/j.soilbio.2016.02.012
Melnichuk T.N., Abdurashitov S.F., Andronov E.E. et al. Changes in the composition of the microbiome of southern chernozem under the influence of farming systems and microbial preparations. Tavricheskiy vestnik agrarnoy nauki. 2018. V. 4. P. 76–87 (in Russ.).
Melnikov A.V., Zhelezova S.V. Traditional plowing or zero technology – which is more profitable for the production of winter wheat in the non-chernozem zone of Russia? Teoreticheskiye i prikladnyye problemy agroindustrii. 2019. V. 39 (1). P. 35–40 (in Russ.).
Mirchink T.G. Soil mycology. Moscow, 1988 (in Russ.).
Orlova L.V., Chernov N.D. et al. Recommendations. Ed. L.V. Orlova. 3rd ed. Evrotekhnika, Moscow, 2006 (in Russ.).
Pittelkow C.M., Linquist B.A., Lundy M.E. et al. When does no-till yield more? A global meta-analysis. Field Crops Research. 2015. V. 183. P. 156–168. https://doi.org/10.1016/j.fcr.2015.07.020
Pretty J., Bharucha Z.P. Sustainable Intensification of Agriculture: Greening the World’s Food Economy. Routledge. 2018. P. 190.
Pykhtin I.G., Gostev A.V. Modern problems of using various systems and methods of basic soil cultivation. Dostizheniya nauki i tekhniki APK. 2012. V. 1. P. 3–6 (in Russ.).
Rainbow R., Derpsch R. Advances in no-till farming technologies and soil compaction management in rainfed farming systems/Rainfed farming systems. 2011. P. 991–1014. Springer, Dordrecht. https://doi.org/10.1007/978-1-4020-9132-2_39
Schlatter D.C., Schillinger W.F., Bary A.I. et al. Biosolids and conservation tillage: Impacts on soil fungal communities in dryland wheat-fallow cropping systems. Soil Biol. Biochem. 2017. V. 115. P. 556–567. https://doi.org/10.1016/j.soilbio.2017.09.021
Seifert K.A., Gams W. The genera of Hyphomycetes–2011 update. Persoonia: Molecular phylogeny and evolution of fungi. 2011. V. 27 (119). https://doi.org/10.3767/003158511X617435
Semenov M.V., Chernov T.I., Tkhakakhova A.K. et al. Distribution of prokaryotic communities throughout the Chernozem profiles under different land uses for over a century. Applied Soil Ecology. 2018. V. 127. P. 8–18. https://doi.org/10.1016/j.apsoil.2018.03.002
Semenov M.V., Manucharova N.A., Stepanov A.L. Distribution of metabolically active prokaryotes (Archaea and Bacteria) throughout the profiles of chernozem and brown semidesert soil. Eurasian Soil Science. 2016. V. 49 (2). P. 217–225. https://doi.org/10.1134/S1064229316020101
Semenov M.V., Nikitin D.A., Stepanov A.L. et al. The structure of bacterial and fungal communities in the rhizosphere and root-free loci of gray forest soil. Eurasian Soil Science. 2019. V. 52 (3). P. 319–332. https://doi.org/10.1134/S1064229319010137
Semenov V.M., Kogut B.M. Soil organic matter. Moscow, 2015 (in Russ.).
Sheehy J., Regina K., Alakukku L. et al. Impact of no-till and reduced tillage on aggregation and aggregate-associated carbon in Northern European agroecosystems. Soil and Tillage Research. 2015. V. 150. P. 107–113. https://doi.org/10.1016/j.still.2015.01.015
Sommermann L., Geistlinger J., Wibberg D. et al. Fungal community profiles in agricultural soils of a long-term field trial under different tillage, fertilization and crop rotation conditions analyzed by high-throughput ITS-amplicon sequencing. PloS One. 2018. V. 13 (4). P. e0195345. https://doi.org/10.1371/journal.pone.0195345
Stewart P., Globig S. Phytopathology in plants. Academic Press, 2016.
Tadych M., White J.F. Endophytic microbes. In: Encyclopedia of microbiology. V. 1. Elsevier, Amsterdam etc., 2009, pp. 431–442.
Toliver D.K., Larson J.A., Roberts R.K. et al. Effects of no-till on yields as influenced by crop and environmental factors. Agronomy J. 2012. V. 104. P. 530–541. https://doi.org/10.2134/agronj2011.0291
Toropova E.Yu., Selyuk M.P., Posazhennikov S.N. (Toporova et al.) The influence of cultivated plants on saprotrophic microorganisms and soil suppression. Dostizheniya nauki i tekhniki APK. 2018. V. 32 (7). P. 17–20 (in Russ.).
Trusov A.S. No-till and Strip-till technologies – the main advantages (experience OOO “Zerno Belogorya”). Dostizheniya nauki i tekhniki APK. 2012. V. 12. P. 20 (in Russ.).
Tsiafouli M.A., Thébault E., Sgardelis S.P. et al. Intensive agriculture reduces soil biodiversity across Europe. Global Change Biology. 2015. V. 21 (2). P. 973–985. https://doi.org/10.1111/gcb.12752
Tudzynski B. Gibberellin biosynthesis in fungi: genes, enzymes, evolution, and impact on biotechnology. Appl. Microbiol. Biotechnol. 2005. V. 66 (6). P. 597–611. https://doi.org/10.1007/s00253-004-1805-1
Turusov V.I., Garmashov V.M., Nuzhnaya N.A. Weed infestation of crops at different methods and systems of basic tillage in crop rotation. Zashchita i karantin rasteniy. 2017. V. 9. P. 19–21 (in Russ.).
Van Agtmaal M., Straathof A.L., Termorshuizen A. et al. Volatile-mediated suppression of plant pathogens is related to soil properties and microbial community composition. Soil Biol. Biochem. 2018. V. 117. P. 164–174. https://doi.org/10.1016/j.soilbio.2017.11.015
Vega F.E., Posada F., Aime M.C. et al. Entomopathogenic fungal endophytes. 2008. https://doi.org/10.1016/j.biocontrol.2008.01.008
Wallach D., Makowski D., Jones J.W. et al. Working with dynamic crop models: methods, tools and examples for agriculture and environment. Academic Press, 2018.
Wang Y., Li C., Tu C. et al. Long-term no-tillage and organic input management enhanced the diversity and stability of soil microbial community. Science of the Total Environment. 2017. V. 609. P. 341–347. https://doi.org/10.1016/j.scitotenv.2017.07.053
Wetzel K., Silva G., Matczinski U. et al. Superior differentiation of arbuscular mycorrhizal fungal communities from till and no-till plots by morphological spore identification when compared to T-RFLP. Soil Biol. Biochem. 2014. V. 72. P. 88–96. https://doi.org/10.1016/j.soilbio.2014.01.033
Xiao D., Xiao S., Ye Y. et al. Microbial biomass, metabolic functional diversity, and activity are affected differently by tillage disturbance and maize planting in a typical karst calcareous soil. J. Soils and Sediments. 2019. V. 19 (2). P. 809–821. https://doi.org/10.1007/s11368-018-2101-5
Yu Q., Wang H., Wen P. et al. A suitable rotational conservation tillage system ameliorates soil physical properties and wheat yield: An 11-year in-situ study in a semi-arid agroecosystem. Soil Tillage Res. 2020. P. 199. https://doi.org/10.1016/j.still.2020.104600
Yuan M., Greer K.D., Nafziger E.D. et al. Soil N2O emissions as affected by long-term residue removal and no-till practices in continuous corn. GCB Bioenergy. 2018. V. 10 (12). P. 972–985. https://doi.org/10.1111/gcbb.12564
Žabka M., Drastichová K., Jegorov A. et al. Direct evidence of plant-pathogenic activity of fungal metabolites of Trichothecium roseum on apple. Mycopathologia. 2006. V. 162 (1). P. 65–68. https://doi.org/10.1007/s11046-006-0030-0
Zamotaev I.V., Belobrov V.P., Kurbatova A.N. et al. Agrogenic and postagrogenic transformation of soils in the Lgovsky district of the Kursk Region. Dokuchaev Soil Bulletin. 2016. V. 85. P. 97–114 (in Russ.).https://doi.org/10.19047/0136-1694-2016-85-97-114
Zhelezova S.V., Akimov T.A., Beloshapkina O.O. et al. Influence of different technologies of winter wheat cultivation on the yield and phytosanitary state of crops (on the example of the field experience of the Center for Precision Farming of the Timiryazev State Agricultural University – Moscow Agricultural Academy). Agrokhimiya. 2017. V. 4. P. 65–75 (in Russ.).
Zhong W.H., Cai Z.C. Long-term effects of inorganic fertilizers on microbial biomass and community functional diversity in a paddy soil derived from quaternary red clay. Appl. Soil Ecol. 2007. V. 36 (2–3). P. 84–91. https://doi.org/10.1016/j.apsoil.2006.12.001
Zvyagintsev D.G. Methods of soil microbiology and biochemistry. 2nd ed. Moscow State University Publishing House, Moscow, 1991 (in Russ.).
Гаджиумаров Р.Г., Жукова М.П. (Gadzhiumarov, Zhukova) Влияние технологий возделывания и удобрений на рост, развитие и урожайность сои в зоне неустойчивого увлажнения Центрального Предкавказья // Вестник АПК Ставрополья. 2018. № 1 (29). С. 81–85.
Головченко А.В., Кураков А.В., Семенова Т.А. и др. (Golovchenko et al.) Обилие, разнообразие, жизнеспособность и факторная экология грибов в торфяниках // Почвоведение. 2013. № 1. С. 80–97.
Дридигер В.К. (Dridiger) О методике исследований технологии no-till // Земледелие и растениеводство. 2016. № 5. С. 30–32.
Дридигер В.К., Невечеря А.Ф., Токарев И.Д. и др. (Dridiger et al.) Экономическая эффективность технологии No-till в засушливой зоне Ставропольского края // Земледелие. 2017. № 3. С. 16–19.
Железова С.В., Акимов Т.А., Белошапкина О.О. и др. (Zhelezova et al.) Влияние разных технологий возделывания озимой пшеницы на урожайность и фитосанитарное состояние посевов (на примере полевого опыта Центра точного земледелия РГАУ–МСХА им. КА Тимирязева) // Агрохимия. 2017. № 4. С. 65–75.
Замотаев И.В., Белобров В.П., Курбатова А.Н. и др. (Zamotaev et al.) Агрогенная и постагрогенная трансформация почв Льговского района Курской области // Бюлл. Почвенного ин-та им. В.В. Докучаева. 2016. № 85. С. 97–114.
Звягинцев Д.Г. (Zvyagintsev) Методы почвенной микробиологии и биохимии. 2-е изд., перераб. и доп. М.: Изд-во МГУ, 1991. 304 с.
Кирюшин В.И. (Kiryshin) Наследие В.Р. Вильямса и современные проблемы агропочвоведения // Известия Тимирязевской сельскохозяйственной академии. 2014. № 1. С. 5–15.
Кирюшин В.И. (Kiryshin) Проблема минимизации обработки почвы: перспективы развития и задачи исследований // Земледелие. 2013. № 7. С. 3–6.
Кузнецова Л.Н., Ширяев А.В., Ступаков А.Г. (Kuznetsova et al.) Биологическая активность чернозема типичного в зависимости от способа обработки // Сахарная свекла. 2016. № 1. С. 36–41.
Кутовая О.В., Гребенников А.М., Тхакахова А.К. и др. (Kutovaya et al.) Изменение почвенно-биологических процессов и структуры микробного сообщества агрочерноземов при разных способах обработки почвы // Бюлл. Почвенного ин-та им. В.В. Докучаева. 2018. № 92. С. 35–61.
Лебедева И.И., Базыкина Г.С., Гребенников А.М. и др. (Lebedeva et al.) Опыт комплексной оценки влияния длительности земледельческого использования на свойства и режимы агрочерноземов Каменной степи // Бюлл. Почвенного ин-та им. В.В. Докучаева. 2016. № 83. С. 77–102.
Махотлова М.Ш. (Mahotova) Экологизация интенсивного земледелия // Журнал научных и прикладных исследований. 2015. № 4. С. 73–74.
Мельников А.В., Железова С.В. (Melnikova, Zhelezova) Традиционная вспашка или нулевая технология – что выгоднее для производства озимой пшеницы в нечерноземной зоне России? // Теоретические и прикладные проблемы агроиндустрии. 2019. № 39 (1). С. 35–40.
Мельничук Т.Н., Абдурашитов С.Ф., Андронов Е.Е. и др. (Melnichuk et al.) Изменение состава микробиома чернозема южного при влиянии систем земледелия и микробных препаратов // Таврический вестник аграрной науки. 2018. № 4. С. 76–87.
Мирчинк Т.Г. (Mirchink) Почвенная микология. М.: Изд-во Московского ун-та, 1988. 220 с.
Орлова Л.В., Чернов Н.Д. и др. Рекомендации. Под ред. Л.В. Орловой. 3-е изд. Москва: Евротехника, 2006. 183 с.
Пыхтин И.Г., Гостев А.В. (Pykhtin, Gostev) Современные проблемы применения различных систем и способов основной обработки почвы // Достижения науки и техники АПК. 2012. № 1. С. 3–6.
Семенов В.М., Когут Б.М. (Semenov, Kogut). Почвенное органическое вещество. М., 2015.
Семенов М.В., Манучарова Н.А., Степанов А.Л. (Semenov et al.) Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. № 2. С. 239–248.
Семенов М.В., Никитин Д.А., Степанов А.Л. и др. (Semenov et al.) Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369.
Торопова Е.Ю., Селюк М.П., Посаженников С.Н. (Toporova et al.) Влияние культурных растений на сапротрофные микроорганизмы и супрессивность почвы // Достижения науки и техники АПК. 2018. Т. 32. № 7. С. 17–20.
Трусов А.С. (Trusov) Технологии No-till и Strip-till – основные преимущества (опыт ООО “Зерно Белогорья”) // Достижения науки и техники АПК. 2012. № 12. С. 20.
Турусов В.И., Гармашов В.М., Нужная Н.А. (Turusov et al.) Засоренность посевов при разных приемах и системах основной обработки почвы в севообороте // Защита и карантин растений. 2017. № 9. С. 19–21.
Харалгина О.С., Рзаева В.В. (Kharalgina, Rzaeva) Нулевой обработке почвы – эффективные системы гербицидов // Аграрный вестник Урала. 2007. № 5 (41). С. 22–23.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


