Микология и фитопатология, 2021, T. 55, № 3, стр. 225-228
Тромболитический потенциал внеклеточной протеиназы микромицета Aspergillus terreus 2
А. А. Осмоловский 1, 2, *, Е. С. Звонарева 2, **, В. Г. Крейер 1, ***, Н. А. Баранова 1, ****, И. Б. Котова 1, *****, Н. С. Егоров 3, ******
1 Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
109028 Москва, Россия
3 Международный биотехнологический центр МГУ
119234 Москва, Россия
* E-mail: aosmol@mail.ru
** E-mail: zvonareva.es@gmail.com
*** E-mail: vkreyer@yandex.ru
**** E-mail: vkreyer@yandex.ru
***** E-mail: kira1959@mail.ru
****** E-mail: nsegorov21@mail.ru
Поступила в редакцию 30.11.2020
После доработки 17.12.2020
Принята к публикации 21.12.2020
Аннотация
Показан высокий тромболитический потенциал внеклеточной протеиназы микромицета Aspergillus terreus 2: протеиназа способна полностью гидролизовать новообразованные тромбы менее, чем за 120 мин, обладает выраженной фибринолитической и фибриногенолитической активностью. Кроме того, была обнаружена активаторная к плазминогену активность протеиназы, что позволяет рассматривать ее в качестве непрямого фибринолитического агента.
Микромицеты рода Aspergillus широко изучаются в качестве продуцентов протеолитических ферментов, перспективных для гидролиза различных белков и белоксодержащих субстратов (Serba et al., 2020). Некоторые штаммы изученных в последнее время видов аспергиллов секретируют протеиназы, высокоактивные в отношении фибриллярных белков – коллагена, эластина, фибрина (Popova et al., 2020; Chimbekujwo et al., 2020; Popova et al., 2021). Фибринолитические (плазминоподобные) ферменты аспергиллов представляют особый интерес, поскольку могут найти практическое применение в различных областях медицины, демонстрируя высокое сродство к компонентам тромба и способность к его расщеплению (Shilpa et al., 2019; Osmolovskiy et al., 2020). Например, внеклеточные протеиназы Aspergillus ochraceus L-1 по сравнению с аналогами – препаратами трипсина и стрептокиназы – проявляли в 2 раза бóльшую фибринолитическую и фибриногенолитическую активность (Osmolovskiy et al., 2020).
Одним из протеолитически активных микромицетов является A. terreus, секретирующий протеиназы с различной субстратной специфичностью, а их суммарная доля в секретоме достигает 16% (Han et al., 2010; Saritha et al., 2016). Для микромицетов этого вида характерна продукция сериновых протеиназ, как щелочных с оптимумом температуры 37°C (Chakrabarti et al., 2000), так и нейтральных, проявляющих максимальную активность при 50°C (Biaggio et al. 2016; de Lima et al., 2021). Считается, что патогенные штаммы A. terreus, ассоциированные с рядом заболеваний, секретируют протеиназы как факторы вирулентности (Ramirez-Garcia et al., 2018).
Штамм A. terreus 2 – микромицет-сапротроф, известный как продуцент протеолитических ферментов, обладающих способностью проявлять плазминоподобную и активаторную к прекалликреину активность (Zvonareva et al., 2018). Ранее из культуральной жидкости продуцента была выделена протеиназа и изучен спектр ее активности по отношению к различным белкам коагулянтной и антикоагулянтной систем (Osmolovskiy et al., 2014; Zvonareva et al., 2015). Однако выраженность ее действие по отношению к белкам фибринолитической системы человека и способность к тромболизису изучены не были.
Целью работы было изучение тромболитического потенциала внеклеточной протеиназы A. terreus 2.
В работе использовали штамм из коллекции кафедры микробиологии МГУ имени М.В. Ломоносова. Для получения протеолитических ферментов микромицет выращивали в условиях глубинного культивирования в подобранных ранее условиях (Zvonareva et al., 2018). Получение препарата внеклеточных протеиназ включало высаливание белков из культуральной жидкости сульфатом аммония и диализ (Zvonareva et al., 2015). Разделение препарата проводили методом колоночного изоэлектрофокусирования по Вестербергу как описано ранее (Zvonareva et al., 2015). Фракции с рI 4.3–4.8 содержали активную протеиназу. Гомогенность выделенной протеиназы подтверждали электрофоретически по методу Лэммли. Белок определяли по методу Брэдфорд.
Активность протеиназ определяли с помощью 1%-х суспензий фибрина и фибриногена, приготовленных на 0.1 М трис-HCl буфере (pH 8.2) (Sigma-Aldrich, США) по модифицированному методу Ансона–Хагихара (Osmolovskiy et al., 2016). Реакции проводили в течение 10 мин при 37° C при постоянном встряхивании (600 об/мин) в термошейкере TS-100 (BioSan, Латвия). Измерение оптической плотности растворов (275 нм) проводили на спектрофотометре BioSpectrometer® kinetic (Eppendorf, Германия) после их центрифугирования (12 400 об./мин, 10 мин). Активность выражали в мкмолях тирозина, образовавшегося за 1 мин в 1 мл пробы (ЕТир).
Фибринолитическую и активаторную к плазминогену активность определяли на фибриновых пластинах методом Аструпа–Мюллерца–Лассена (Sharkova et al., 2015). Активность выражали в усл. ед. на 1 мл пробы.
Тромболитическую активность протеиназы измеряли гравиметрически по уменьшению массы тромбов, гидролизованных при 37°C в течение 30–180 мин под действием протеиназы A. terreus 2 (Kotb et al., 2015). По окончании реакции рассчитывали процент негидролизованных тромбов.
В табл. 1 представлено действие выделенной протеиназы микромицета A. terreus 2 на фибрин, фибриноген и плазминоген. Видно, что протеиназа активно расщепляет указанные субстраты.
Таблица 1.
Протеолитическая активность внеклеточной протеиназы Aspergillus terreus 2
| Тип активности | Единицы измерения активности (Е) | Общая активность, E/мл | Удельная активность, Е/мг белка |
|---|---|---|---|
| Фибринолитическая | мкмоль тирозина/мин | 75.0 ± 2.5 | 303.6 ± 10.5 |
| Фибриногенолитическая | мкмоль тирозина/мин | 86.0 ± 2.5 | 347.7 ± 10.5 |
| Фибринолитическая | усл. ед. | 420.0 ± 30.0 | 1690.0 ± 60.0 |
| Активаторная к плазминогену | усл. ед. | 254.0 ± 30.0 | 1028.0 ± 60.0 |
Впервые обнаружена активаторная к плазминогену активность протеиназ, образуемых A. terreus 2. Из данных литературы известно, что не все представители рода Aspergillus образуют протеиназы, способные активировать плазминоген (Kotb et al., 2015). Наличие такой активности в совокупности с фибринолитической активностью позволяет утверждать, что выделенная протеиназа может осуществлять как прямой фибринолиз (непосредственный лизис фибрина), так и непрямой (через активацию плазминогена – белка, превращающегося в кровотоке в основной фибринолитический фермент организма человека – плазмин). Активаторная к плазминогену активность протеиназы A. terreus 2 составила около 40% от фибринолитической, что значительно превышает таковую для других микромицетов (Sharkova et al., 2015).
Фибриногенолитическая активность выделенной протеиназы оказалась несколько больше фибринолитической, но несущественно, что подтверждает полученные ранее данные о равноценности гидролиза этих субстратов штаммом A. terreus 2 (Zvonareva et al., 2018).
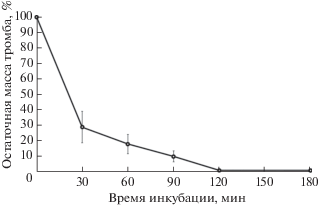
В связи с полученными данными существенный интерес представляет изучение тромболитической активности протеиназы A. terreus 2, позволяющей выявить ее эффективность расщеплять многокомпонентный и объемный субстрат протеолиза. Полученные результаты представлены на рис. 1. Исследованная протеиназа очень быстро растворяла новообразованные тромбы: уже через 30 мин инкубации остаточная масса тромба составила 30%, за 90 мин – 10%. Полностью тромб был гидролизован протеиназой A. terreus 2 менее чем за 120 мин, что говорит о ее высоком тромболитическом потенциале.
Полученные данные дополняют представления о способах применения внеклеточных протеиназ A. terreus и убедительно показывают, что фермент может быть использован не только в легкой промышленности или в составе моющих средств, о чем свидетельствует ряд исследований, но и в биомедицине (Chakrabarti et al., 2000; Biaggio et al. 2016; de Lima et al., 2021).
Таким образом, внеклеточная протеиназа микромицета A. terreus 2 обладает высоким тромболитическим потенциалом, а сам микромицет является перспективным продуцентом протеиназ фибринолитического и тромболитического действия. Способность выделенной протеиназы проявлять активаторную к плазминогену активность позволяет рассматривать ее и в качестве непрямого фибринолитического агента. С непрямыми фибринолитическими агентами в настоящее время связывают развитие одного из ведущих направлений тромболитической терапии (Lal et al., 2017).
Работа выполнена при финансовой поддержке Совета по грантам Президента РФ № СП-3906.2021.4.
Список литературы
Biaggio R.T., Silva R.R., Rosa N.G. et al. Purification and biochemical characterization of an extracellular serine peptidase from Aspergillus terreus. Prep. Biochem. Biotechnol. 2016. V. 46 (3). P. 298–304. https://doi.org/10.1080/10826068.2015.1031387
Chakrabarti S.K., Matsumura N., Ranu R.S. Purification and characterization of an extracellular alkaline serine protease from Aspergillus terreus (IJIRA 6.2). Curr. Microbiol. 2000. V. 40 (4). P. 239–244.
Chimbekujwo K.I., Ja’afaru M.I., Adeyemo O.M. Purification, characterization and optimization conditions of protease produced by Aspergillus brasiliensis strain BCW2. Sci. Afr. 2020. V. 8. A.e00398.
de Lima E.E., Franco D.G., Galeano R.M.S. et al. Biochemical characterization of a partially purified protease from Aspergillus terreus 7461 and its application as an environmentally friendly dehairing agent for leather industry. Prep. Biochem. Biotechnol. 2021. V. 51 (2). P. 1–11. https://doi.org/10.1080/10826068.2020.1815058
Han M.J., Kim N.J., Lee S.Y. et al. Extracellular proteome of Aspergillus terreus grown on different carbon sources. Curr. Genet. 2010. V. 56 (4). P. 369–382. https://doi.org/10.1007/s00294-010-0308-0
Kotb E., Helal G.E.-D.A., Edries F.M. Screening for fibrinolytic filamentous fungi and enzymatic properties of the most potent producer, Aspergillus brasiliensis AUMC 9735. Biologia. 2015. V. 70 (12). P. 1565–1574. https://doi.org/10.1515/biolog-2015-0192
Lal V. Fibrinolytic drug therapy in the management of intravascular thrombosis, especially acute myocardial infarction. A review. Asian J. Pharm. Clin. Res. 2017. V. 2. A. 555593.
Osmolovskiy A.A., Orekhova A.V., Conti E. et al. Production and stability of the proteinase complex from Aspergillus ochraceus L-1 with fibrinolytic and anticoagulant activity. Moscow Univ. Biol. Sci. Bull. 2020. V. 75 (3). P. 130–135.
Osmolovskiy A.A., Popova E.A., Kreyer V.G. et al. Fibrinolytic and collagenolytic activity of extracellular proteinases of the strains of micromycetes Aspergillus ochraceus L-1 and Aspergillus ustus 1. Moscow Univ. Biol. Sci. Bull. 2016. V. 71 (1). P. 62–66.
Osmolovskiy A.A., Zvonareva E.S., Kreyer V.G. et al. The effect of micromycete extracellular proteases of Aspergillus genus on the proteins of haemostatic system. Russ. J. Bioorg. Chem. 2014. V. 40 (6). P. 634–639.
Popova E.A., Kreyer V.G., Komarevtsev S.K. et al. Properties of extracellular proteinase of the micromycete Aspergillus ustus 1 and its high activity during fibrillary-protein hydrolysis. Appl. Biochem. Microbiol. 2021. V. 57 (2). P. 200–205.
Popova E.A., Osmolovskiy A.A., Kreier V.G. et al. Production by Aspergillus ustus strain of proteinases highly active against fibrillar proteins. Mikologiya i fitopatologiya. 2019. V. 53 (4). P. 229–235. https://doi.org/ (in Russ.).https://doi.org/10.1134/S0026364819040111
Ramirez-Garcia A., Pellon A., Buldain I. et al. Proteomics as a tool to identify new targets against Aspergillus and Scedosporium in the context of cystic fibrosis. Mycopathologia. 2018. V. 183 (1). P. 273–289. https://doi.org/10.1007/s11046-017-0139-3
Saritha M., Singh S., Tiwari R. et al. Do cultural conditions induce differential protein expression: profiling of extracellular proteome of Aspergillus terreus CM20. Microbiol. Res. 2016. V. 192. P. 73–83. https://doi.org/10.1016/j.micres.2016.06.006
Serba E.M., Tadzhibova P.Yu. Rimareva L.V. et al. Obtaining peptide and amino acid ingredients by enzymatic treatment of Aspergillus oryzae biomass. Mikologiya i fitopatologiya. 2020. V. 54 (1). P. 23–32 (in Russ.). https://doi.org/10.31857/S0026364820010079
Sharkova T.S., Kurakov A.V., Osmolovskiy A.A. et al. Screening of producers of proteinases with fibrinolytic and collagenolytic activities among micromycetes. Microbiology. 2015. V. 84 (3). P. 359‒364.
Shilpa H.K., Ambekar J.G., Dongre N.N. et al. Application of fibrinolytic enzyme from Aspergillus tamarii – in vitro studies. Eur. J. Pharm. Med. Res. 2019. V. 6 (12). P. 560–562.
Zvonareva E.S., Osmolovskiy A.A., Kreier V.G. et al. Production of proteinase with plasmin-like and prekallikrein activating activity by the micromycete Aspergillus terreus. Appl. Biochem. Microbiol. 2018. V. 54 (2). P. 206–210. https://doi.org/10.1134/S0003683818020151
Zvonareva E.S., Osmolovskiy A.A., Kreyer V.G. et al. Identification of targets for extracellular proteases activating proteins of the haemostatic system produced by micromycetes Aspergillus ochraceus and Aspergillus terreus. Russ. J. Bioorg. Chem. 2015. V. 41 (5). P. 500–505 (in Russ.).
Попова Е.А., Осмоловский А.А., Крейер В.Г. и др. (Popova et al.) Продукция штаммом Aspergillus ustus протеиназ, высокоактивных в отношении фибриллярных белков. Микология и фитопатология. 2019. Т. 53. № 4. С. 229–235.
Серба Е.М., Таджибов П.Ю., Римарева Л.В. и др. (Serba et al.) Получение пептидно-аминокислотных ингредиентов на основе грибной биомассы Aspergillus oryzae // Микология и фитопатология. 2020. Т. 54. № 1. С. 23–32.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология