Микология и фитопатология, 2021, T. 55, № 4, стр. 256-270
Условно-патогенная микобиота пыли в городах разных климатических зон на примере Мурманска и Москвы
М. В. Корнейкова 1, 2, *, А. С. Сошина 2, **, О. В. Гавричкова 3, ***
1 Российский университет дружбы народов
117198 Москва, Россия
2 Институт проблем промышленной экологии Севера ФИЦ КНЦ РАН
184209 Апатиты, Россия
3 Институт наземных экосистем, Национальный консилиум по науке
05010 Порано, Италия
* E-mail: korneykova.maria@mail.ru
** E-mail: anastasiya.soshina97@yandex.ru
*** E-mail: olga.gavrichkova@gmail.com
Поступила в редакцию 04.03.2021
После доработки 04.04.2021
Принята к публикации 27.04.2021
Аннотация
Впервые проведен микологический анализ пыли, в том числе оценка доли условно-патогенных видов, в системе “воздух – зеленые насаждения – запечатанные поверхности в урбоэкосистемах” разных климатических зон (города Мурманск и Москва). Проведена оценка комплексного воздействия факторов (климат, функциональная зона, тип субстрата) на количественные и качественные параметры сообществ микромицетов на основе многофакторного дисперсионного и кластерного анализов. Выявлена меньшая численность культивируемой микобиоты в воздухе, на листьях и запечатанных поверхностях в Мурманске по сравнению с Москвой. При этом примерно половина видов в обоих городах относились к условно-патогенным. Отмечено увеличение доли условно-патогенных грибов группы BSL2 в воздухе транспортной зоны в обоих городах и в селитебной зоне Москвы. В Москве в селитебной и транспортной зонах микроскопические грибы Aspergillus fumigatus, A. niger преобладали по обилию в воздухе и на поверхности дорог, тогда как в Мурманске доминировали представители менее патогенных для человека родов Cephalosporium, Scopulariopsis, Trichoderma. Наибольшее влияние на численность и видовое разнообразие микромицетов, в том числе условно-патогенных видов, оказывали тип субстрата (воздух, листья, запечатанные поверхности) и климат, в то время как функциональная зона не оказывала значимого влияния. Наиболее благоприятной для пребывания человека является рекреационная зона городов в разных климатических районах ввиду меньшего количества условно-патогенных видов в воздухе и отсутствия микроскопических грибов групп BSL-2 и BSL-3. Однако на поверхности листьев и дорог в этой зоне выявлено большее количество потенциально патогенных видов по сравнению с воздухом. Это позволяет рекомендовать жителям городов минимизировать контакт с поверхностью листьев растений и твердых покрытий дорог, что особенно актуально для детей дошкольного возраста, с целью снижения вероятности взаимодействия с условно-патогенной микобиотой как потенциально опасной для здоровья человека.
ВВЕДЕНИЕ
В последние годы в связи с возрастанием масштабов и скорости урбанизации, а также увеличением уровня заболеваемости населения изучению экологии городских агломераций уделяется повышенное внимание (Morel et al., 2015; Vasenev, Kuzyakov, 2018; Steffan et al., 2018).
Крупные города представляют собой антропогенно нарушенные экосистемы, отличающиеся от природных биоценозов по ряду факторов: климатом, физико-химическими свойствами почвы и воздуха, типом растительности, структурой сообществ микроорганизмов, уровнями загрязнения и др. Пространственная структура городов включает в себя разные функциональные зоны: рекреационные, жилые и промышленные. Как правило, функциональное зонирование определяет степень антропогенного воздействия на экосистемы (Ivashchenko et al., 2014; Sarzhanov et al., 2015).
Известно, что воздух не является благоприятной средой для развития микроорганизмов, в том числе и для микроскопических грибов. Пылевые частицы и их состав могут влиять на количество и биоразнообразие микроорганизмов воздуха (Innocente et al., 2017; Liu et al., 2018; Zhai et al., 2018). Положительное воздействие пылевых частиц возможно за счет дополнительных питательных элементов и защиты от неблагоприятных факторов, таких как УФ излучение, однако отдельные химические составляющие пыли могут оказывать токсическое воздействие на определенные группы микроорганизмов. Важным фактором, влияющим на количество пылевых частиц в городском воздухе, а, следовательно, и на количественный и качественный состав микобиома воздуха является зеленая инфраструктура (Escobedo et al., 2011). Древесные породы накапливают значительное количество пыли на листовых пластинках и тем самым являются отличным индикатором количества и качества воздушных поллютантов (Baldacchini et al., 2017). В то же время они являются носителями специфической микрофлоры филлосферы и при определенных условиях могут обмениваться спорами и частичками мицелия грибов с окружающей средой (Gandolfi et al., 2017). Микобиота филлосферы может эффективно способствовать снижению загрязнения воздуха в городах за счет биоразложения загрязняющих веществ на листьях (Sazonova et al., 2017; Franzetti et al., 2020). Кроме того, пыль в городской воздух может поступать с запечатанных поверхностей (асфальт, бетонные покрытия, здания и пр.) и, таким образом, оказывать влияние на состав грибного сообщества воздуха.
Изучению количественного и качественного состава микобиоты воздуха посвящены исследования в России и зарубежных странах. Некоторые из них оценивают только культивируемую часть микобиома воздушной среды (Ivanova, Kirtsideli, 2005; Marfenina et al., 2011; Ivanova et al., 2012; Fernández-Rodríguez et al., 2014; Marfenina et al., 2016; Korneykova, Evdokimova, 2018; Abbasi, Samaei, 2019), другие основаны на количественной оценке методами прямого микроскопирования (Marfenina et al., 2011, 2016; Perrino, Marcovecchio, 2016). Ряд современных работ проведен с использованием молекулярно-генетических методов анализа (Fierer et al., 2008; Fröhlich-Nowoisky et al., 2009; Barberán et al., 2015; Abrego et al., 2018; Liu et al., 2019). Отдельный блок работ посвящен изучению влияния микологического состава воздуха на здоровье населения (O’Gorman, Fuller, 2008; Chakrabarti et al., 2012; Korneykova, Lebedeva, 2018), поэтому большинство таких работ проведены для закрытых помещений (Antropova et al., 2003; Egorova, Klimova, 2005; Abbasi, Samaei, 2019, Chegini et al., 2020; Guo et al., 2020; Pyrri et al., 2020; Wu et al., 2020). Практически отсутствуют работы, одновременно описывающие разные климатические зоны (Barberán et al., 2015; Lee et al., 2017; Dietzel et al., 2019), зонирование городской территории также редко принимается во внимание (Ivanova, Kirtsideli, 2005; Wuyts et al., 2020). Не встречаются работы, оценивающие микобиом пыли сразу нескольких субстратов в одном объекте исследования. В настоящей работе учтен комплекс вышеперечисленных факторов и выявлено влияние каждого на количественный и качественный состав микобиоты, в особенности на грибы – потенциальные патогены для человека. Известно, что многие грибы, находящиеся в воздухе, могут вызывать заболевания человека (Salem, Gardner, 1994), особенно у людей с ослабленным иммунитетом или иным образом чувствительных к широкому спектру аллергенных и токсигенных биологических материалов (Burge, Rogers, 2000; Ross et al., 2000). В последние десятилетия заболеваемость астмой растет во всем мире (Beasley, 2002; Isolauri et al., 2004) и вместе с этим увеличивается потребность в более глубоком понимании разнообразия и пространственно-временной динамики аэромикоты.
В связи с этим целью работы стал микологический анализ тонкой пыли, в том числе оценка доли условно-патогенных видов, в системе “воздух – зеленые насаждения – запечатанные поверхности” в урбоэкосистемах, различных по своим климатическим характеристикам (города Мурманск и Москва).
МАТЕРИАЛЫ И МЕТОДЫ
Климатическая характеристика районов исследования. Исследования проводили в крупных городах, расположенных в двух климатических зонах: субарктической (г. Мурманск), умеренно-континентальной (г. Москва).
Мурманск – крупнейший в мире город, расположенный за полярным кругом, находится в атлантико-арктической зоне умеренного климата. Климат города формируется в условиях непосредственной близости Баренцева моря под влиянием теплого незамерзающего Северо-Атлантического течения. Его среднегодовая температура составляет –0.4°C; среднегодовая скорость ветра – 4.4 м/с. В среднем выпадает около 601 мм осадков в год (Climate data, 2021; Weather online, 2021).
Москва – мегаполис, крупнейший по численности населения город в России. Климат Москвы – умеренно-континентальный, с четко выраженной сезонностью. Среднегодовая температура 5.8°C, среднегодовая скорость ветра – 2.3 м/с, среднегодовая влажность воздуха – 76%. За год в Москве и прилегающей к ней территории выпадает 600–800 мм атмосферных осадков, причем большая часть из них приходится на летние месяцы (Climate data, 2021; Weather online, 2021).
Характеристика участков. Отбор образцов проводили в каждом городе в конце вегетационного периода в трех функциональных зонах, отличающихся друг от друга уровнем антропогенной нагрузки: зона усиленного дорожного трафика, селитебная зона и рекреационная в качестве контроля на территории города (табл. 1).
Таблица 1.
Характеристика обследованных территорий
| Функциональная зона | Координаты |
|---|---|
| г. Москва | |
| транспортная | 55°43′06 с.ш., 37°34′12 в.д. |
| селитебная | 55°42′52 с.ш., 37°36′23 в.д. |
| рекреационная | 55°42′34 с.ш., 37°31′59 в.д. |
| г. Мурманск | |
| транспортная | 68°57′65 с.ш., 33°03′78 в.д. |
| селитебная | 68°58′45 с.ш., 33°05′37 в.д. |
| рекреационная | 68°56′65 с.ш., 33°07′38 в.д. |
Отбор проб. Объект исследований – городская пыль. Пыль собирали и оценивали с трех субстратов: воздух, листья березы и запечатанные поверхности (асфальтированная дорога). Отбор пыли производили однократно за вегетационный сезон – в конце лета в бездождевой период (не менее 4 дней) с целью снизить влияние этой метеорологической составляющей между городами и позволить пыли накопиться на листьях и запечатанных поверхностях (Baldacchini et al., 2017).
Отбор проб воздуха проводили аспиратором ПУ-1Б (Россия) на высоте 1.5 м (высота роста человека) в трех повторностях на селективные питательные среды с последующим пересчетом количества микроорганизмов на 1 м3 воздуха по формуле: C = P × K, где C – количество микромицетов в 1 м3 воздуха, P – количество колоний на чашке, K – коэффициент пересчета на 1 м3 (K = 4, если V = 250 мл; K = 2, если V = 500 мл). На каждой площадке пропускали 250 л (транспортная, селитебная) или 500 л (рекреационная) воздуха.
Листья березы (Betula pendula) отбирали со средневозрастных деревьев одинакового физиологического состояния, на высоте 1.5–2.5 м с четырех сторон кроны. Всего с каждого дерева было отобрано по 50 листьев в стерильные zip-пакеты. На каждом участке листья отбирали с трех деревьев.
Пыль с асфальта собирали предварительно простерилизованной кистью в фальконы с площади 1 м2 в трех повторностях для каждого участка. В Мурманске не удалось отобрать пыль в рекреационной зоне из-за начавшегося дождя.
Приготовление суспензии для анализа. Свежеотобранные листья (10 шт.) помещали в стерильную чашку Петри и добавляли стерильную недистиллированную воду (15 мл). Чашки Петри с листьями и водой помещали на ротатор для тщательного смыва пыли при 300 об./мин в течение 30 мин.
Для получения образца пыли с асфальта, отобранный кистью материал просевали через сито с размером ячеек 100 мкм. Аликвоту пыли (0.7 г) помещали в 15 мл фалькон и добавляли 7 мл стерильной недистиллированной воды, после этого суспензию перемешивали на ротаторе при 300 об./мин в течение 30 мин.
Численность колониеобразующих единиц (КОЕ) и разнообразие культивируемых микромицетов определяли методом глубинного посева на питательную среду сусло-агар с добавлением молочной кислоты (4 мл/л) (Zvyagintsev, 1991). Температура инкубации составляла 27 и 37°С (для выделения условно-патогенных грибов, способных расти при температуре тела человека) в течение 7–14 дней. Идентификацию микроскопических грибов проводили по культурально-морфологическим признакам (микроскоп Olympus CX41) с использованием современных определителей (Klich, 2002; Domsch et al., 2007; Seifert et al., 2011). Для штаммов, выделенных в виде стерильного мицелия, идентификацию осуществляли на основании анализа участка рибосомальных генов ITS1–5.8S–ITS2 рДНК. Секвенирование участков ДНК делали с помощью набора реактивов BigDye Terminator V. 3.1 Cycle Sequencing Kit (Applied Biosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130l Genetic Analyzer в научно-производственном центре Синтол (Москва). Наименование видов и систематическое положение проверяли по базе данных CABI Bioscience Databases (Index Fungorum, 2021).
Условно-патогенные виды. Выделенные виды микромицетов относили к группе условно-патогенных (УПГ) по классификации de Hoog et al. (2019), согласно которой УПГ грибы разделены на три группы, в соответствии с их потенциальной опасностью для здоровья человека – BSL1, BSL2, BSL3 (по мере увеличения степени патогенности).
Статистическая обработка результатов. Статистическую обработку и визуализацию экспериментальных данных проводили в программном пакете R 4.0.3 и в программе Microsoft Оffice Excel. Анализ сходства видового состава проводили с помощью кластерного анализа, реализованного в пакете vegan. Для построения дендрограммы использовали метод “ближайшего соседа”. Влияние факторов на исследуемый признак оценивали с помощью многофакторного дисперсионного анализа. Уровень значимости составлял 0.05.
РЕЗУЛЬТАТЫ
Численность и разнообразие микроскопических грибов в Москве, в том числе условно-патогенных видов. Численность микромицетов-аэробионтов в воздухе разных функциональных зон Москвы изменялась от 74 до 193 КОЕ/м3. Наименьшее их количество выделено в селитебной зоне, наибольшее – в рекреационной и вблизи дорог. Однако в селитебной зоне почти 70% видов относились к УПГ, вблизи дорог – 57%, в воздухе рекреационной зоны – 50% от общего количества выделенных видов (рис. 1, а).
Рис. 1.
Численность микромицетов в воздухе (а), в пыли с поверхности листьев (б) и в дорожной пыли (в) в разных функциональных зонах г. Москвы: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
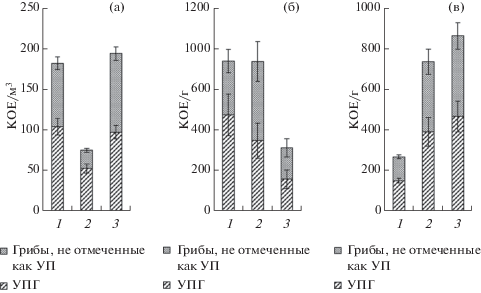
На поверхности листьев в Москве численность микромицетов в селитебной зоне и вблизи дорог достигала 880 КОЕ/г, тогда как в рекреационной зоне в 2.5 раза меньше (370 КОЕ/г) (рис. 1, б). Однако доля УПГ почти одинакова во всех функциональных зонах и составила 45–65% от общего количества выделенных видов, достигая наибольшего значения вблизи дороги.
Численность микромицетов в дорожной пыли г. Москвы изменялась от 267 КОЕ/г вблизи дорог до 863 КОЕ/г – в рекреационной зоне, что соответствует таковой на поверхности листьев в г. Москва (рис. 1, в). В селитебной зоне выделено также высокое содержание микромицетов – 735 КОЕ/г. Вблизи дорог очень высока доля УПГ – 56% от общего количества выделенных видов, в селитебной –53%, в рекреационной – 54%.
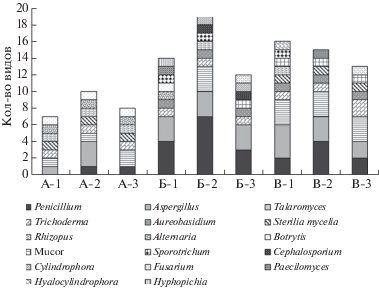
Всего в объектах г. Москвы выделено 43 вида микроскопических грибов, относящихся к 3 отделам (Ascomycota, Basidiomycota, Mucoromycota), 7 классам (Agaricomycetes, Dothideomycetes, Eurotiomycetes, Leotiomycetes, Mucoromycetes, Saccharomycetes, Sordariomycetes), 8 порядкам (Dothideales, Eurotiales, Helotiales, Hypocreales, Mucorales, Pleosporales, Polyporales, Saccharomycetales), 10 семействам (Aspergillaceae, Bionectriaceae, Hypocreaceae, Mucoraceae, Nectriaceae, Phanerochaetaceae, Pleosporaceae, Rhizopodaceae, Saccotheciaceae, Sclerotiniaceae) и 16 родам (Alternaria, Aspergillus, Aureobasidium, Botrytis, Cephalosporium, Cylindrophora, Fusarium, Hyalocylindrophora, Hyphopichia, Mucor, Paecilomyces, Penicillium, Rhizopus, Sporotrichum, Talaromyces, Trichoderma), а также два вида стерильных мицелиев.
В рекреационной зоне разнообразие микромицетов представлено семью видами в воздухе (один вид – стерильный мицелий), 12-ю – на поверхности листьев, 12-ю – в дорожной пыли (один вид – стерильный мицелий). В селитебной зоне разнообразие микромицетов представлено девятью видами в воздухе (один вид – стерильный мицелий), 19-ю – на поверхности листьев и 14-ю в дорожной пыли (один вид – стерильный мицелий); вблизи дорог – шестью (один вид – стерильный мицелий), 14-ю и 15-ю (один вид – стерильный мицелий) видами соответственно (рис. 2).
Рис. 2.
Представленность грибов на уровне родов в воздухе (А), в пыли с поверхности листьев (Б) и в дорожной пыли (В) в разных функциональных зонах г. Москвы: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
В селитебной зоне в воздухе отмечено увеличение разнообразия грибов рода Aspergillus. Особого внимания заслуживает факт преобладания по обилию видов Aspergillus fumigatus в селитебной зоне (табл. 2). В рекреационной зоне доминировали виды Alternaria tenuissima, Botrytis cinerea, в транспортной зоне – Alternaria tenuissima и Talaromyces flavus.
Таблица 2.
Таксономическое разнообразие и обилие (%) условно-патогенных грибов на исследованных территориях
| Вид | Москва | Мурманск | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| воздух | листья | пыль | воздух | листья | пыль | ||||||||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | |
| Ascomycota | |||||||||||||||||
| Dothideomycetes | |||||||||||||||||
| Dothideales | |||||||||||||||||
| Aureobasidium melanogenum (Herm.-Nijh.) Zalar, Gostinčar et Gunde-Cim. | 2 | 4 | |||||||||||||||
| A. pullulans (de Bary et Löwenthal) G. Arnaud | 87 | 63 | 23 | 5 | 1 | 18 | 5 | 2 | 22 | 2 | |||||||
| Pleosporales | |||||||||||||||||
| Alternaria atra (Preuss) Woudenb. et Crous | 8 | ||||||||||||||||
| A. tenuissima (Kunze) Wiltshire | 25 | 7 | 34 | <1 | |||||||||||||
| Eurotiomycetes | |||||||||||||||||
| Eurotiales | |||||||||||||||||
| Aspergillus candidus Link | 3 | 7 | |||||||||||||||
| A. flavipes (Bainier et R. Sartory) Thom et Church | 4 | ||||||||||||||||
| A. flavus Link | <1 | 5 | 2 | 8 | 23 | 7 | 7 | 2 | 7 | 13 | 12 | 2 | |||||
| A. fumigatus Fresen. | 21 | <1 | 2 | 11 | 14 | 11 | 3 | 2 | 4 | 4 | 2 | ||||||
| A. niger Tiegh. | 16 | 1 | 3 | 1 | 17 | 23 | 6 | 4 | 2 | ||||||||
| A. terreus Thom | 2 | ||||||||||||||||
| A. versicolor (Vuill.) Tirab. | 1 | ||||||||||||||||
| Paecilomyces variotii Bainier | 1 | 1 | 3 | 3 | 4 | ||||||||||||
| Penicillium aurantiogriseum Dierckx | 1 | 1 | 1 | ||||||||||||||
| P. chrysogenum Thom | 14 | 1 | |||||||||||||||
| P. expansum Link | <1 | ||||||||||||||||
| P. griseofulvum Dierckx | <1 | 1 | |||||||||||||||
| Penicillium sp. | 32 | 2 | 6 | ||||||||||||||
| P. spinulosum Thom | 1 | 7 | 2 | ||||||||||||||
| Talaromyces helicus (Raper et Fennell) C.R. Benj. | <1 | 2 | 6 | 12 | 4 | 5 | |||||||||||
| T. purpureogenus Samson, N. Yilmaz, Houbraken, Spierenb., Seifert, Peterson, Varga et Frisvad | 3 | 2 | 5 | ||||||||||||||
| T. rugulosus (Thom) Samson, N. Yilmaz, Frisvad et Seifert | 4 | 1 | |||||||||||||||
| Sordariomycetes | |||||||||||||||||
| Hypocreales | |||||||||||||||||
| Trichoderma aureoviride Rifai | 1 | 8 | |||||||||||||||
| T. glaucum E.V. Abbott | 15 | ||||||||||||||||
| T. koningii Oudem. | 2 | 2 | 1 | 22 | 10 | 29 | 6 | 22 | |||||||||
| T. viride Pers. | <1 | <1 | 8 | 5 | |||||||||||||
| Fusarium sp. | 2 | 12 | |||||||||||||||
| Microascales | |||||||||||||||||
| Scopulariopsis candida Vuill. | 16 | 25 | 18 | ||||||||||||||
| Saccharomycetes | |||||||||||||||||
| Saccharomycetales | |||||||||||||||||
| Hyphopichia burtonii (Boidin, Pignal, Lehodey, Vey et Abadie) Arx et Van der Walt | 1 | 1 | 1 | ||||||||||||||
| Mucoromycota | |||||||||||||||||
| Mucoromycetes | |||||||||||||||||
| Mucorales | |||||||||||||||||
| Mucor hiemalis Wehmer | 7 | ||||||||||||||||
| Rhizopus stolonifer (Ehrenb.) Vuill. | 1 | 14 | 1 | 2 | 1 | ||||||||||||
| Всего видов: | 4 | 7 | 4 | 9 | 9 | 6 | 9 | 8 | 7 | 8 | 9 | 5 | 6 | 4 | 7 | 3 | 8 |
| 8 | 14 | 13 | 13 | 10 | 9 | ||||||||||||
| 20 | 23 | ||||||||||||||||
В пыли с листьев и дорог видовое разнообразие микромицетов богаче, чем в воздухе города (рис. 2). На поверхности листьев во всех зонах доминировал Aureobasidium pullulans, в рекреационной зоне также отмечено высокое обилие Penicillium melinii и Aspergillus flavus (табл. 2). В дорожной пыли в селитебной зоне и вблизи дорог отмечено наибольшее разнообразие грибов рода Aspergillus. В селитебной зоне преобладал по обилию Aspergillus niger, вблизи дорог и в рекреационной зоне – Trichoderma koningii.
Анализ степени токсичности УПГ показал, что в воздухе рекреационной зоны выделены грибы, относящиеся только к группе BSL-1, тогда как в селитебной зоне и вблизи дорог также выделены грибы более патогенной группы BSL-2 – их доля составила 15–20% от общего количества видов (рис. 3, а).
Рис. 3.
Доля грибов разных групп патогенности в воздухе (а), в пыли с поверхности листьев (б) и в дорожной пыли (в) в разных функциональных зонах г. Москвы: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
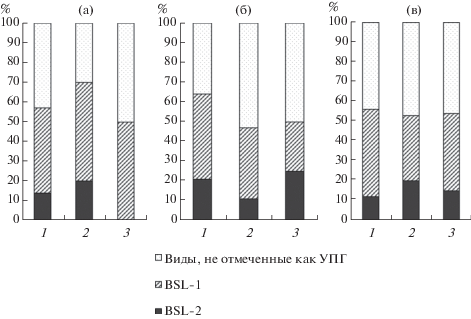
В отличие от воздушной среды, на листьях и в дорожной пыли во всех зонах г. Москвы отмечались грибы, принадлежащие к группам BSL-1 и BSL-2 (рис. 3, б, в). На поверхности листьев высока доля последних в рекреационной зоне и вблизи дорог, где также отмечается максимальное разнообразие грибов рода Aspergillus. В дорожной пыли наибольшее количество представителей BSL-2 отмечено в жилой зоне (рис. 3, б, в).
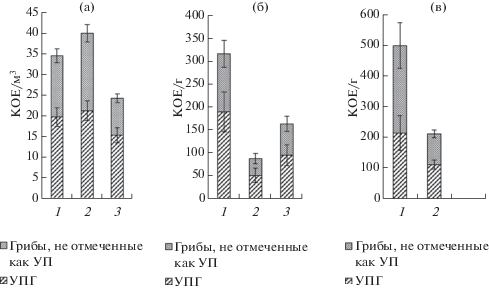
Численность и разнообразие микроскопических грибов в Мурманске, в том числе условно-патогенных видов. Численность микромицетов в воздухе Мурманска составила 24–40 КОЕ/м3, на поверхности листьев – 87–316 КОЕ/г с максимумом вблизи дорог и минимумом в селитебной зоне, в дорожной пыли – 211 до 499 КОЕ/г (рис. 4, а). Доля УПГ в воздухе во всех зонах составляла от 53 до 63%, с минимумом в селитебной зоне. Доля УПГ на поверхности листьев почти одинакова во всех функциональных зонах и составила 58–60% от общего количества выделенных видов, достигая наибольшего значения вблизи дороги (рис. 4, б). Однако несмотря на высокую численность микромицетов в пыли вблизи дорог (в 2.5 раза превышающую таковую в жилой зоне) доля УПГ здесь наименьшая (43%), тогда как в селитебной зоне она составила 53% от общего количества выделенных видов (рис. 4, в).
Рис. 4.
Численность микромицетов в воздухе (а), в пыли с поверхности листьев (б) и в дорожной пыли (в) в разных функциональных зонах г. Мурманска: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
Всего в объектах г. Мурманска выделен 41 вид микроскопических грибов, относящихся к 2 отделам (Ascomycota, Mucoromycota), 6 классам (Dothideomycetes, Eurotiomycetes, Leotiomycetes, Mucoromycetes, Saccharomycetes, Sordariomycetes), 9 порядкам (Dothideales, Eurotiales, Helotiales, Hypocreales, Microascales, Mucorales, Pleosporales, Saccharomycetales, Thelebolales), 11 семействам (Aspergillaceae, Hypocreaceae, Microascaceae, Mucoraceae, Myxotrichaceae, Nectriaceae, Pleosporaceae, Pseudeurotiaceae, Saccotheciaceae, Sarocladiaceae, Sclerotiniaceae) и 19 родам (Alternaria, Aspergillus, Aureobasidium, Botrytis, Cephalosporium, Ciliciopodium, Hyphopichia, Monodictys, Mucor, Oidiodendron, Paecilomyces, Parasarocladium, Penicillium, Pseudeurotium, Rhinocladium, Scopulariopsis, Scytalidium, Talaromyces, Trichoderma), а также один вид стерильного мицелия.
Видовое разнообразие микромицетов в воздухе селитебной зоны и вблизи дорог представлено 13-ю (один вид – стерильный мицелий) и 16-ю (один вид – стерильный мицелий) видами соответственно. В отличие от воздушной среды в жилой зоне выделено наименьшее количество микромицетов на поверхности листьев, наибольшее – в рекреационной. На поверхности листьев разнообразие культивируемой микобиоты представлено шестью (один вид – стерильный мицелий) и девятью (один вид – стерильный мицелий) видами соответственно. В дорожной пыли разнообразие культивируемой микобиоты представлено 14-ю (один вид – стерильный мицелий) и 6-ю (один вид – стерильный мицелий) видами (рис. 5).
Рис. 5.
Представленность грибов на уровне родов в воздухе (А), в пыли с поверхности листьев (Б) и в дорожной пыли (В) в разных функциональных зонах г. Мурманска: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
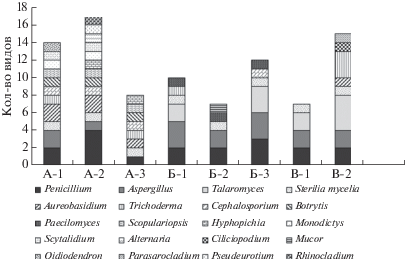
В селитебной зоне отмечено появление грибов родов Trichoderma, Aureobasidium, Ciliciopodium, Parasarocladium. Однако доминировали в обеих зонах грибы Talaromyces ruber.
В Мурманске в воздухе рекреационной зоны выделено 7 видов (один вид – стерильный мицелий), на поверхности листьев – 11 видов (один вид – стерильный мицелий) (рис. 5).
Наиболее патогенные микромицеты, относящиеся к группе BSL-2, появляются в воздухе вблизи дорог (рис. 6, а). В субарктическом городе преобладающие виды отличались в разных зонах (вблизи дорог – Cephalosporium glutineum, в селитебной зоне – Scopulariopsis candida, Scytalidium flavobrunneum, в рекреационной зоне – Trichoderma koningii, Aureobasidium pullulans) (табл. 2).
Рис. 6.
Доля грибов разных групп патогенности в воздухе (а), в пыли с поверхности листьев (б) и в дорожной пыли (в) в разных функциональных зонах г. Мурманска: 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона.
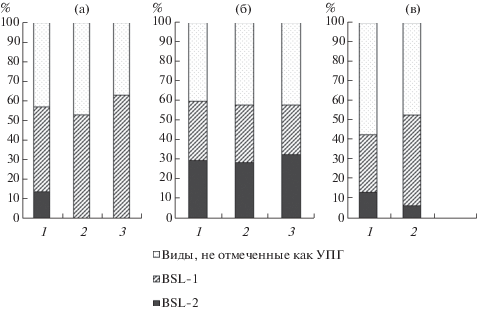
На поверхности листьев в г. Мурманск не выявлено разницы в соотношении групп условно-патогенных микромицетов BSL-1 и BSL-2 для разных функциональных зон (рис. 6, в). В дорожной пыли последние выделены как в селитебной, так и в придорожной зоне. Однако их доля выше вблизи дорог (рис. 6, в).
ОБСУЖДЕНИЕ
Влияние климата. В целом численность культивируемых микромицетов в воздухе, на поверхности листьев и в дорожной пыли в Мурманске ниже, чем в Москве на 1–2 порядка. Эта закономерность сохраняется и при сравнении с другими крупными городами. Так, численность микромицетов воздуха Санкт-Петербурга изменялась от 300–800 КОЕ/м3 летом, достигая в отдельные периоды 1400 КОЕ/м3 (Bogomolova et al., 2012), Москвы – от 50 до 1500 КОЕ/м3 (Marfenina et al., 2011; 2016), Бадахоса (Испания) – до 2000 КОЕ/г (Fernández-Rodríguez et al., 2014), Дублина (Ирландия) – от 30 до 6700 КОЕ/м3 (O’Gorman, Fuller, 2008). Несмотря на более низкую численность микромицетов во всех изучаемых субстратах в Мурманске, их видовое разнообразие сопоставимо с таковым в Москве – 41 и 43 вида, в том числе 23 и 20 УПГ соответственно (табл. 2). Большее количество видов УПГ, выделенных в Мурманске, по сравнению с Москвой, по-видимому, связано с высоким уровнем загрязнения пылью от Мурманского морского порта, ТЭЦ и других предприятий города, а также большим разнообразием поллютантов (Report.., 2020; Novikov et al., 2020). Наибольшее количество видов в Мурманске выделено из воздуха (22 вида), тогда как в Москве наибольшим видовым разнообразием характеризовался микобиом пыли с листьев и поверхности асфальта. Это, вероятно, также связано с промышленными предприятиями как основными источниками выбросов пыли в воздух (Zelenskaya et al., 2017).
В целом только 31% видов являются общими для двух климатических зон, тогда как в группе условно-патогенных видов 43% микромицетов совпадают. Вероятно, это связано с тенденцией выявления “южных” видов в северных регионах на антропогенно нарушенных территориях, включая городские экосистемы (Evdokimova, 1995; Kireeva et al., 2005; Marfenina, 2005; Khabibullina, 2009; Korneykova et al., 2012). В Мурманске наибольшее количество видов микромицетов принадлежало родам Aspergillus, Penicillium и Talaromyces, тогда как в Москве – Aspergillus, Penicillium, Talaromyces и Trichoderma. Грибы, принадлежащие этим родам, известны способностью вызывать у людей и животных заболевания, такие как легочные и кожные инфекции, системные микозы, перитониты, лимфадениты (de Hoog et al., 2019).
Влияние функциональных зон. В воздухе Мурманска в разных функциональных зонах не выявлено разницы как в общей численности микромицетов, так и для группы УПГ. Доля УПГ составила 53–63% на всех изучаемых участках. В Москве наибольшая доля УПГ отмечена в селитебной зоне и вблизи дорог (до 50–70% от общего количества видов), однако общая численность микромицетов-аэробионтов в селитебной зоне была наименьшей. Грибы группы BSL-2 в обоих городах выявлены вблизи дорог, что может свидетельствовать о токсичности выбросов автомобильного транспорта и большей устойчивости этих видов к антропогенной нагрузке (Marfenina, Fomicheva, 2007). В Мурманске видовое разнообразие микромицетов в воздухе селитебной зоны и вблизи дорог существенно богаче, чем в Москве. Так, наибольшее разнообразие видов микромицетов в Москве и Мурманске отмечено в селитебной зоне, наименьшее – в рекреационной зоне. Однако количество видов в воздухе рекреационной зоны было схожим в обоих городах. Структура доминирования сообществ микромицетов-аэробионтов в городах различалась для разных функциональных зон.
Если в Москве на поверхности листьев выделено в 2.5 раза больше микромицетов как вблизи дорог, так и в селитебной зоне по сравнению с рекреационной зоной, то в Мурманске их большое количество выявлено только у дорог, в селитебной зоне, напротив, отмечена наименьшая численность грибов. Однако в городах обеих климатических зон доля условно-патогенных грибов на поверхности листьев составила 50–60% от общего количества видов в разных функциональных зонах, что также отмечается другими авторами (Marfenina, Fomicheva, 2007; Hui et al., 2017). Грибы группы BSL-2 выделены во всех зонах обоих городов, причем наибольшее их количество выявлено на растениях в рекреационной зоне. Это может быть вызвано перемещением спор грибов из наиболее загрязненных участков города в парковую зону, что ранее отмечалось и другими авторами (Ivanova, Kirtsideli, 2005). На поверхности листьев как в Москве, так и в Мурманске различия в составе видов-доминантов между разными функциональными зонами не выявлены. В Москве доминировал вид Aureobasidium pullulans, в Мурманске – Penicillium corylophilum.
В Москве в пыли с асфальта вблизи дорог отмечена минимальная численность микромицетов, тогда как в Мурманске – максимальная. Такой результат можно объяснить регулярным смывом дорожной пыли в транспортной зоне в Москве (Resolution.., 1999), чего не наблюдается в селитебной и рекреационной зонах. В Мурманске в селитебной зоне численность микромицетов в два раза ниже, чем вблизи дорог. Однако в Москве вблизи дорог отмечена высокая доля УПГ (56%), тогда как в Мурманске она составляет только 43%. Грибы группы BSL-2 выделены во всех зонах обоих городов.
Влияние типа субстрата. В среднем численность микроскопических грибов в воздухе на порядок ниже, чем на поверхности листьев или в дорожной пыли как в Мурманске, так и в Москве. В двух последних субстратах численность оказалась сопоставимой. Большее, чем в воздухе городов видовое разнообразие микромицетов на поверхности листьев и в дорожной пыли может быть связано с присутствием на поверхности листьев микромицетов-эпифитов, оседанием на листьях спор грибов из воздуха (Zelenskaya et al., 2017) и с более высоким уровнем загрязнения вблизи дорог (Baldacchini et al., 2017). Кроме того, в воздухе грибы находятся в основном в виде спор, а на поверхности листьев и дорог – в виде спор и мицелия. По количеству выделенных видов в Москве наиболее беден воздух, а в Мурманске – дорожная пыль. Вероятно, это связано с тем, что в Москве более богатая растительность в городе, а в Мурманске больше уровень загрязнения пылью и большее разнообразие поллютантов, о чем свидетельствуют данные химического состава воздуха в точках отбора (Novikov et al., 2020).
Грибы группы BSL-2 присутствовали во всех субстратах, однако в воздухе – в меньшей степени. В воздухе рекреационной зоны ни в Москве, ни в Мурманске грибов этой группы не было обнаружено. Можно предположить, что зеленая инфраструктура в рекреационной зоне оказывает фитонцидный эффект на микобиоту, относящуюся к этой патогенной группе, что подтверждается лабораторными опытами (Nagaki et al., 2011; Kurkina, et al., 2020). Большая устойчивость этих грибов к увеличению количества поллютантов также возможна (Marfenina, Fomicheva, 2007; Korneykova, Evdokimova, 2018; Korneykova, Lebedeva, 2018).
Кластерный и дисперсионный анализ. Кластерный анализ видового состава комплексов микромицетов в воздухе, на поверхности листьев и в дорожной пыли выявил как общие тенденции, так и различия для разных функциональных зон в городах с различным климатом (рис. 7). Видовой состав микромицетов разделился на три крупных кластера, в котором микобиом воздуха в г. Мурманск и поверхности листьев в г. Москва образовали отдельные кластеры. Третий кластер объединил в себя остальные субстраты и функциональные зоны, однако видно, что, как правило, микобиомы разных функциональных зон, но при этом одного субстрата в пределах одного региона, близки друг к другу. Это свидетельствует о значимости типа субстрата и климатического фактора на видовой состав микобиома.
Рис. 7.
Дендрограмма сходства видового состава микромицетов в разных функциональных зонах Москвы и Мурманска. По оси абсцисс: варианты: МСК – Москва; МУР – Мурманск; A – воздух; Б – пыль с поверхности листьев; В – дорожная пыль; 1 – транспортная зона, 2 – селитебная зона, 3 – рекреационная зона. По оси ординат: расстояние между вариантами на основе коэффициента Сёренсена–Чекановского.
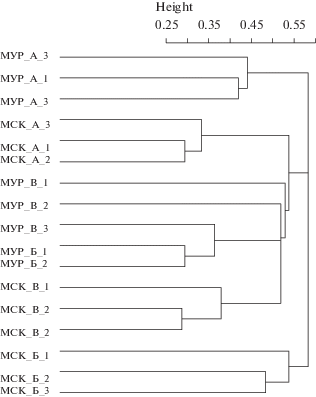
По результатам многофакторного дисперсионного анализа выявлено статистически значимое влияние типа субстрата на численность микроскопических грибов при p = 2.39 × 10-6. Влияние климатического фактора также значимо при p = = 0.0325. Четкой связи между количеством микромицетов и типом функциональной зоны не выявлено.
Каждый субстрат (воздух, поверхность листьев, дорожное покрытие) характеризуется различными условиями обитания (в том числе источниками питания) для микроскопических грибов. Для воздуха характерна засушливость, повышенное УФ- облучение, недостаток питательных элементов и здесь обитают ксерофильные, устойчивые грибы. Пыль на листьях более благоприятна для развития микромицетов за счет наличия дополнительного источника питания – выделений растений, оседающей пыли (Zelenskaya et al., 2017), а также влаги. Дорожная пыль характеризуется обилием связанной с пылью органики, которая является питательным субстратом для грибов. Близость к почве также вносит вклад в численность и разнообразие микромицетов в дорожной пыли (Carlile et al., 2001). Благодаря этим особенностям микроскопические грибы занимают разные экологические ниши на разных типах субстратов, где формируют уникальные комплексы, характеризующиеся разной численностью и разным видовым составом.
Значимое влияние климатического фактора на численность микромицетов может быть связано с общей тенденцией увеличения численности и разнообразия грибов, в том числе и условно-патогенных, с севера на юг, отмеченной также в работах других авторов (Marfenina, Fomicheva, 2007).
На долю УПГ достоверное влияние имеет тип функциональной зоны (p = 0.0481), тогда как тип субстрата и климат не имели значимого влияния. Сила влияния типа функциональной зоны на долю УПГ составляет 21%. Возможно, здесь играет роль повышение доли УПГ в селитебной зоне (на 13–20% для воздуха Москвы) и в транспортной зоне (на 14–17% для листьев в Москве), что может быть связано с большей устойчивостью УПГ к антропогенным загрязнениям (Marfenina, Fomicheva, 2007; Korneykova, Evdokimova, 2018; Korneykova, Lebedeva, 2018).
ЗАКЛЮЧЕНИЕ
В исследовании проанализированы количественные и качественные параметры микобиома городской пыли в воздухе, на поверхности листьев и запечатанных поверхностях разных функциональных зон в городах умеренного и субарктического поясов. Выявлена более низкая численность микромицетов во всех изучаемых субстратах в Мурманске по сравнению с Москвой, однако видовое богатство cообществ микромицетов сопоставимо для городов разных климатических зон. Примерно половина видов в обследуемых городах относились к условно-патогенным. Наиболее опасные виды, относящиеся к группе BSL 2, выявлены в транспортной и в селитебной зоне обоих городов – особенно четко это проявляется в Москве. Тип субстрата и климатический фактор оказывали более значимое влияние на численность, видовое разнообразие микромицетов и количество условно-патогенныx видов по сравнению с функциональным зонированием. В целом воздух в рекреационной зоне изучаемых городов можно считать наиболее безопасным для человека из-за отсутствия грибов группы BSL-2. Однако на поверхности листьев и на запечатанном дорожном покрытии обнаружено существенное количество потенциально патогенных видов. В качестве рекомендации жителям городов можно предложить минимизировать прямой контакт с поверхностью листьев растений и дорожным покрытием, что особенно актуально для детей дошкольного возраста, с целью снижения вероятности взаимодействия с условно патогенной микобиотой как потенциально опасной для здоровья человека.
Исследование выполнено при поддержке проекта РФФИ № 19-05-50112, полевые работы – в рамках темы НИР по госзаданию АААА-А18-118021490070-5.
Список литературы
Abbasi F., Samaei M.R. The effect of temperature on airborne filamentous fungi in the indoor and outdoor space of a hospital. Environ. Sci. Pollut. Res. 2019. V. 26 (17). P. 16868–16876. https://doi.org/10.1007/s11356-017-0939-5
Abrego N., Norros V., Halme P. et al. Give me a sample of air and I will tell which species are found from your region: Molecular identification of fungi from airborne spore samples. Mol. Ecol. Resour. 2018. V. 18 (3). P. 511–524. https://doi.org/10.1111/1755-0998.12755
Antropova A.B., Mokeeva V.L., Bilanenko E.N. et al. Aeromycota of Moscow dwellings. Mikologiya i fitopatologiya. 2003. V. 37 (6). P. 1–11 (in Russ.).
Baldacchini C., Castanheiro A., Maghakyan N. et al. How does the amount and composition of PM deposited on Platanus acerifolia leaves change across different cities in Europe? Environ. Sci. Technol. 2017. V. 51 (3). P. 1147–1156. https://doi.org/10.1021/acs.est.6b04052
Barberán A., Ladau J., Leff J.W. et al. Continental-scale distributions of dust-associated bacteria and fungi. Proc. Natl. Acad. Sci. 2015. V. 112 (18). P. 5756–5761. https://doi.org/10.1073/pnas.1420815112
Beasley R. The burden of asthma with specific reference to the United States. J. Allergy Clin. Immunol. 2002. V. 109 (5). P. S482–S489. https://doi.org/10.1067/mai.2002.122716
Bogomolova Ye.V., Velikova T.D., Goryayeva A.G. et al. Microfungi in the air of Saint Petersburg. P.C. Khimizdat, Saint Peterburg, 2012 (in Russ.).
Burge H.A., Rogers C.A. Outdoor allergens. Environ. Health Perspect. 2000. V. 108 (suppl 4). P. 653–659. https://doi.org/10.1289/ehp.00108s4653
Carlile M.J., Watkinson S.C., Gooday G.W. The Fungi, 2nd edn. Academic press, San Diego et al., 2001.
Chakrabarti H.S., Das S., Gupta-Bhattacharya S. Outdoor airborne fungal spora load in a suburb of Kolkata, India: its variation, meteorological determinants and health impact. Int. J. Environ. Res. Public Health. 2012. V. 22 (1). P. 37–50. https://doi.org/10.1080/09603123.2011.588323
Chegini F.M., Baghani A.N., Hassanvand M.S. et al. Indoor and outdoor airborne bacterial and fungal air quality in kindergartens: Seasonal distribution, genera, levels, and factors influencing their concentration. Build. Environ. 2020. V. 175. P. 106690. https://doi.org/10.1016/j.buildenv.2020.106690
Climate data for cities worldwide. 2021. https://ru.climate-data.org/. Accessed 15.02.21.
de Hoog G.S., Guarro J., Gené J. et al. Atlas of Clinical Fungi, 3rd edition. Utrecht, Reus, 2019.
Dietzel K., Valle D., Fierer N. et al. Geographical distribution of fungal plant pathogens in dust across the United States. Front. Ecol. Evol. 2019. V. 7. P. 304. https://doi.org/10.3389/fevo.2019.00304
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi, 2nd ed. IHW–Verlag, Eching, 2007.
Egorova L.N., Klimova Yu.A. Saprotrophic micromycetes in the air of various rooms in Vladivostok. Uspekhi meditsinskoy mikologii. 2005. V. 5. P. 64–67 (in Russ.).
Evdokimova G.A. Ecological-microbiological foundations of soil protection in the Far North. The Kola Science Centre of the Russian Academy of Sciences, Apatity, 1995 (in Russ.).
Escobedo F.J., Kroeger T., Wagner J.E. Urban forests and pollution mitigation: Analyzing ecosystem services and disservices. Environ. Pollut. 2011. V. 159 (8–9). P. 2078–2087. https://doi.org/10.1016/j.envpol.2011.01.010
Fernández-Rodríguez S., Tormo-Molina R., Maya-Manzano J.M. et al. Outdoor airborne fungi captured by viable and non-viable methods. Fungal Ecol. 2014. V. 7. P. 16–26. https://doi.org/10.1016/j.funeco.2013.11.004
Fierer N., Liu Z., Rodríguez-Hernández M. et al. Short-term temporal variability in airborne bacterial and fungal populations. Appl. Environ. Microbiol. 2008. V. 74 (1). P. 200–207. https://doi.org/10.1128/AEM.01467-07
Franzetti A., Gandolfi I., Bestetti G. et al. Plant-microorganisms interaction promotes removal of air pollutants in Milan (Italy) urban area. J. Hazard. Mater. 2020. V. 384. P. 121021. https://doi.org/10.1016/j.jhazmat.2019.121021
Fröhlich-Nowoisky J., Pickersgill D.A., Després V.R. et al. High diversity of fungi in air particulate matter. Proc. Natl. Acad. Sci. 2009. V. 106 (31). P. 12814–12819. https://doi.org/10.1073/pnas.0811003106
Gandolfi I., Canedoli C., Imperato V. et al. Diversity and hydrocarbon-degrading potential of epiphytic microbial communities on Platanus × acerifolia leaves in an urban area. Environ. Pollut. 2017. V. 220. P. 650–658. https://doi.org/10.1016/j.envpol.2016.10.022
Guo K., Qian H., Zhao D. et al. Indoor exposure levels of bacteria and fungi in residences, schools, and offices in China: A systematic review. Indoor Air. 2020. V. 30 (6). P. 1147–1165. https://doi.org/10.1111/ina.12734
Hui N., Jumpponen A., Francini G. et al. Soil microbial communities are shaped by vegetation type and park age in cities under cold climate. Environ. Microbiol. 2017. V. 19 (3). P. 1281–1295. https://doi.org/10.1111/1462-2920.13660
Index Fungorum. CABI Bioscience, 2021. http://www.indexfungorum.org. Accessed 03.03.21.
Innocente E., Squizzato S., Visin F. et al. Influence of seasonality, air mass origin and particulate matter chemical composition on airborne bacterial community structure in the Po Valley, Italy. Sci. Total Environ. 2017. V. 593. P. 677–687. https://doi.org/10.1016/j.scitotenv.2017.03.199
Isolauri E., Huurre A., Salminen S. et al. The allergy epidemic extends beyond the past few decades. Clin. Exp. Allergy. 2004. V. 34 (7). P. 1007–1010. https://doi.org/10.1111/j.1365-2222.2004.01999.x
Ivanova A.M., Kirtsideli I.Yu. Microfungi from air at St. Petersburg. Novosti sistematiki nizshikh rasteniy. 2005. V. 39. P. 136–141 (in Russ.).
Ivanova A.Ye., Marfenina O.Ye., Danilogorskaya A.A. Cultivated microfungi in the air of some stations of the Moscow underground system and at the places of air intake. Mikologiya i fitopatologiya. 2012. V. 46 (1). P. 33–40 (in Russ.).
Ivashchenko K.V., Ananyeva N.D., Vasenev V.I. et al. Biomass and respiration activity of soil microorganisms in anthropogenically transformed ecosystems (Moscow Region). Eurasian Soil Sci. 2014. V. 47 (9). P. 892–903. https://doi.org/10.1134/S1064229314090051
Khabibullina F.M. Soil mycobiota of natural and anthropogenically disturbed ecosystems in the North-East of the European part of Russia. Dr. Sci. Biol. dissertation. Syktyvkar, 2009 (in Russ.).
Kireeva N.A., Miftakhova A.M., Bakayeva M.D. et al. Complexes of soil microscopic fungi under technogenic conditions. Gilem, Ufa, 2005. (in Russ.).
Klich M.A. Identification of common Aspergillus species. CBS Fungal Biodiversity Centre, Utrecht, 2002.
Korneykova M.V., Evdokimova G.A. Microbiota of the ground air layers in natural and industrial zones of the Kola Arctic. J. Environ. Sci. Health A. 2018. V. 53 (3). P. 271–277. https://doi.org/10.1080/10934529.2017.1397444
Korneykova M.V., Lebedeva E.V. Opportunistic fungi in the polluted soils of Kola Peninsula. Geogr. Environ. Sustain. 2018. V. 11 (2). P. 125–137. https://doi.org/10.24057/2071-9388-2018-11-2-125-137
Korneykova M.V., Evdokimova G.A., Lebedeva E.V. The complexes of potentially pathogenic microscopic fungi in anthropogenic polluted soils of Kola North. Mikologiya i fitopatologiya. 2012. V. 46 (5). P. 322–328 (in Russ.).
Kurkina Y., Esina E., Barskova A. Phytoncidal activity of essential oils of medicinal plants to some strains of mold fungi. J. Agric. Environ. 2020. V. 1 (13). https://doi.org/10.23649/jae.2020.1.13.5
Lee J.Y., Park E.H., Lee S. et al. Airborne bacterial communities in three east Asian cities of China, South Korea, and Japan. Sci. Rep. 2017. V. 7 (1). P. 1–8. https://doi.org/10.1038/s41598-017-05862-4
Liu H., Hu Z., Zhou M. et al. The distribution variance of airborne microorganisms in urban and rural environments. Environ. Pollut. 2019. V. 247. P. 898–906. https://doi.org/10.1016/j.envpol.2019.01.090
Liu H., Zhang X., Zhang H. et al. Effect of air pollution on the total bacteria and pathogenic bacteria in different sizes of particulate matter. Environ. Pollut. 2018. V. 233. P. 483–493. https://doi.org/10.1016/j.envpol.2017.10.070
Marfenina O.E. Anthropogenic ecology of soil fungi. Moscow, 2005 (in Russ.).
Marfenina O.E., Fomicheva G.M. Potentially pathogenic filamentous fungi in the human environment. Modern tendencies. In: Yu.T. Dyakov, Yu.V. Sergeyev (eds.). Mikologiya segodnya. V. 1. Moscow, 2007, pp. 235–266 (in Russ.).
Marfenina O.E., Kolosova E.D., Glagolev M.V. Number of fungal diaspores deposited from surface air layers at the areas with different vegetation cover in Moscow City. Mikologiya i fitopatologiya. 2016. V. 50 (6). P. 379–385 (in Russ.).
Marfenina O.E., Makarova N.V., Ivanova A.E. Opportunistic moulds in soils and upper soil air layers in megalopolis (on an example of region Tushino, Moscow). Mikologiya i fitopatologiya. 2011. V. 45 (5). P. 397–407 (in Russ.).
Morel J.L., Chenu C., Lorenz K. Ecosystems services provided by soil of urban, industrial, traffic, mining, and military areas (SUITMAs). J. Soils Sediments. 2015. V. 15 (8). P. 1659–1666. https://doi.org/10.1007/s11368-014-0926-0
Nagaki M., Narita T., Ichikawa H. et al. Antibacterial and antifungal activities of isoprenoids. Trans. Mater. Res. Soc. Japan. 2011. V. 36 (1). P. 55–58. https://doi.org/10.14723/tmrsj.36.55
Novikov A.I., Shirokaya A.A., Drogobuzhskaya S.V. et al. Elemental analysis of suspended atmospheric particles in the city by inductively coupled plasma atomic emission spectrometry. In: Arctic research: from extensive development to integrated development. Arkhangelsk, 2020. P. 391–395 (in Russ.).
O’Gorman C.M., Fuller H.T. Prevalence of culturable airborne spores of selected allergenic and pathogenic fungi in outdoor air. Atmos. Environ. 2008. V. 42 (18). P. 4355–4368. https://doi.org/10.1016/j.atmosenv.2008.01.009
Perrino C., Marcovecchio F. A new method for assessing the contribution of primary biological atmospheric particles to the mass concentration of the atmospheric aerosol. Environ. Int. 2016. V. 87. P. 108–115. https://doi.org/10.1016/j.envint.2015.11.015
Pyrri I., Tripyla E., Zalachori A. et al. Fungal contaminants of indoor air in the National Library of Greece. Aerobiologia. 2020. V. 36 (3). P. 387–400. https://doi.org/10.1007/s10453-020-09640-0
Report on the state and protection of the environment of the Murmansk Region in 2019. Ministry of Natural Resources and Environment of the Murmansk Region, 2020 (in Russ.).
Resolution of 09.11.1999 No. 1018 On approval of the Rules for the sanitary maintenance of territories, the organization of cleaning and ensuring cleanliness and right in Moscow (as amended on 02.02.2017). The government of Moscow, 1999 (in Russ.).
Ross M.A., Curtis L., Scheff P.A. et al. Association of asthma symptoms and severity with indoor bioaerosols. Allergy. 2000. V. 55 (8). P. 705–711. https://doi.org/10.1034/j.1398-9995.2000.00551.x
Salem H., Gardner D.E. Health aspects of bioaerosols. In: B. Lighthart, A.J. Mohr (eds.). Atmospheric microbial aerosols. Springer, Boston, 1994, pp. 304–330. https://doi.org/10.1007/978-1-4684-6438-2_10
Sarzhanov D.A., Vasenev V.I., Sotnikova Y.L. et al. Short-term dynamics and spatial heterogeneity of CO2 emission from the soils of natural and urban ecosystems in the Central Chernozemic Region. Eurasian Soil Sci. 2015. V. 48 (4). P. 416–424. https://doi.org/10.1134/S1064229315040092
Sazonova O.I., Sokolov S.L., Prisyazhnaya N.V. et al. Epiphytic microorganisms degrading aromatic hydrocarbons from the phyllosphere of urban woody plants. Microbiology. 2017. V. 86 (1). P. 82–88. https://doi.org/10.1134/S0026261717010106
Seifert K., Morgan-Jones G., Gams W. et al. The genera of Hyphomycetes. CBS, Utrecht, 2011.
Steffan J.J., Brevik E.C., Burgess L.C. et al. The effect of soil on human health: an overview. Eur. J. Soil Sci. 2018. V. 69 (1). P. 159–171. https://doi.org/10.1111/ejss.12451
Vasenev V., Kuzyakov Y. Urban soils as hot spots of anthropogenic carbon accumulation: Review of stocks, mechanisms and driving factors. Land. Degrad. Dev. 2018. V. 29 (6). P. 1607–1622. https://doi.org/10.1002/lbr.2944
Weather Online Ltd. Meteorological Services. 2021. https://www.weatheronline.co.uk/. Accessed 15.02.21.
Wu D., Zhang Y., Tian Y. et al. On-site investigation of the concentration and size distribution characteristics of airborne fungi in a university library. Environ. Pollut. 2020. V. 261. P. 114138. https://doi.org/10.1016/j.envpol.2020.114138
Wuyts K., Smets W., Lebeer S. et al. Green infrastructure and atmospheric pollution shape diversity and composition of phyllosphere bacterial communities in an urban landscape. FEMS Microbiol. Ecol. 2020. V. 96 (1). P. fiz173. https://doi.org/10.1093/femsec/fiz173
Zelenskaya M.S., Sidelnikova M.V., Panova E.G. et al. Phylloplane fungi in the urban environment. Biosfera. 2017. V. 9 (2). P. 136–151 (in Russ.). https://doi.org/10.24855/BIOSFERA.V9I2.353
Zhai Y., Li X., Wang T. et al. A review on airborne microorganisms in particulate matters: composition, characteristics and influence factors. Environ. Int. 2018. V. 113. P. 74–90. https://doi.org/10.1016/j.envint.2018.01.007
Zvyagintsev D.G. Methods of soil microbiology and biochemistry. Moscow, 1991 (in Russ.).
Антропова А.Б., Мокеева В.Л., Биланенко Е.Н. и др. (Antropova et al.) Аэромикота жилых помещений г. Москвы // Микология и фитопатология. 2003. Т. 37. № 6. С. 1–11.
Богомолова Е.В., Великова Т.Д., Горяева А.Г. и др. (Bogomolova et al.) Микроскопические грибы в воздушной среде Санкт-Петербурга. СПб.: Химиздат, 2012. 215 с.
Доклад о состоянии и об охране окружающей среды Мурманской области в 2019 году (Report). Министерство природных ресурсов и экологии Мурманской области. Мурманкск, 2020. 177 с.
Евдокимова Г.А. (Evdokimova) Эколого-микробиологические основы охраны почв Крайнего Севера. Апатиты: Кол. научн. центр РАН, 1995. 272 с.
Егорова Л.Н., Климова Ю.А. (Egorova, Klimova) Сапротрофные микромицеты в воздухе различных помещений г. Владивостока // Успехи медицинской микологии. 2005. Т. 5. С. 64–67.
Звягинцев Д.Г. (Zvyagintsev) Методы почвенной микробиологии и биохимии. М.: Изд-во МГУ, 1991. 304 с.
Иванова A.М., Кирцидели И.Ю. (Ivanova, Kirtsideli) Микромицеты в воздушном бассейне Санкт-Петербурга // Новости систематики низших растений. 2005. Т. 39. С. 136–141.
Иванова А.Е., Марфенина О.Е., Данилогорская А.А. (Ivanova et al.) Культивируемые микроскопические грибы в воздухе ряда станций Московского метрополитена и местах наружного воздухозабора // Микология и фитопатология. 2012. Т. 46. №. 1. С. 33–40.
Киреева Н.А., Мифтахова А.М., Бакаева М.Д. и др. (Kireeva et al.) Комплексы почвенных микромицетов в условиях техногенеза. Уфа: Гилем, 2005. 360 с.
Корнейкова М.В., Евдокимова Г.А., Лебедева Е.В. (Korneykova et al.) Комплексы потенциально патогенных микроскопических грибов в антропогенно загрязненных почвах Кольского Севера // Микология и фитопатология. 2012. Т. 46. №. 5. С. 322–328.
Марфенина О.Е. (Marfenina) Антропогенная экология почвенных грибов. М.: Медицина для всех, 2005. 196 с.
Марфенина О.Е., Колосова Е.Д., Глаголев М.В. (Marfenina et al.) Численность грибных диаспор, оседающих из приземного воздуха, на участках с разным растительным покровом в г. Москве // Микология и фитопатология. 2016. Т. 50. № 6. С. 379–385.
Марфенина О.Е., Макарова Н.В., Иванова А.Е. (Marfenina et al.) Оппортунистические грибы в почвах и приземных слоях воздуха мегаполиса (на примере района Тушино г. Москвы) // Микология и фитопатология. 2011. Т. 45. № 5. С. 397–407.
Новиков А.И., Широкая А.А., Дрогобужская С.В. и др. (Novikov et al.) Элементный анализ взвешенных частиц атмосферного воздуха в черте города с применением атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой. Арктические исследования: от экстенсивного освоения к комплексному развитию: материалы II международной научно-практической конференции. Архангельск, 2020. С. 391–395.
Хабибуллина Ф.М. (Khabibullina) Почвенная микобиота естественных и антропогенно нарушенных экосистем Северо-Востока европейской части России: автореф. … докт. биол. наук. Сыктывкар, 2009. 40 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


