Микология и фитопатология, 2021, T. 55, № 4, стр. 297-308
Чувствительность краснодарской популяции Venturia inaequalis к дифеноконазолу, ингибитору деметилирования стеринов
А. И. Насонов 1, *, Г. В. Якуба 1, **, И. Л. Астапчук 1, ***
1 Северо-Кавказский федеральный научный центр садоводства, виноградарства, виноделия
350901 Краснодар, Россия
* E-mail: nasoan@mail.ru
** E-mail: galyayaku@gmail.com
*** E-mail: irina_astapchuk@mail.ru
Поступила в редакцию 16.12.2020
После доработки 29.01.2021
Принята к публикации 27.04.2021
Аннотация
Исследована чувствительность к дифеноконазолу трех популяций возбудителя парши яблони – Venturia inaequalis из Краснодарского края. Одна из популяций являлась исходной, никогда не испытывавшей воздействия фунгицидов, собранной в естественных произрастаниях яблони восточной (Malus orientalis) в предгорьях Северского р-на, две другие – из промышленных насаждений Renet Simirenko в Красноармейском и Динском р-нах, в которых имела место программа фунгицидных обработок, в том числе препаратами, с действующим веществом дифеноконазол. Моноспоровые изоляты возбудителя болезни выделяли из свежих листьев с симптомами болезни или листового опада с плодовыми телами гриба. В серии in vitro экспериментов на 120 изолятах оценена эффективная 50%-я концентрация (ЭК50), при которой происходит двукратное уменьшение роста колонии. Использовали шесть концентраций дифеноконазола (препарат Скор КЭ, 250 мг/л, ООО “Сингента”): 0.005; 0.01; 0.025; 0.05; 0.5 и 1 мг д.в./л. Среднее значение ЭК50 для исходной популяции составило 0.0078, для садовых – 0.12 и 0.25 мг д.в./л. В обеих обрабатываемых популяциях наблюдалось снижение чувствительности к фунгициду, их факторы резистентности составили 16 и 32. Садовые популяции различались соотношением и долей чувствительных изолятов и изолятов со сниженной чувствительностью. Предложена дискриминационная доза или единичная оценочная концентрация в 0.01 мг д.в./л для упрощенного лабораторного мониторинга чувствительности V. inaequalis к дифеноконазолу на основе анализа относительного роста (Relative Growth – RG) мицелия. Получены сопоставимые результаты с использованием значений ЭК50 и RG при этой дискриминационной дозе. Для одной из садовых популяций доля изолятов выше порогового значения RG > 70% составила 97%. Полученные результаты свидетельствуют о развитии резистентности к дифеноконазолу в популяциях возбудителя парши из промышленных садов Краснодарского края.
ВВЕДЕНИЕ
Парша является основным экономически значимым заболеванием промышленных насаждений яблони в мире. Вызывающий ее гриб Venturia inaequalis (Cooke) Winter, анаморфа – Fusicladium dendriticum (Wallr.) Fuckel, поражает только эту культуру и ее диких сородичей и характеризуется высокой внутрипопуляционной изменчивостью и адаптивностью, обусловленной ежегодным половым процессом, приводящим к рекомбинации признаков. После заражения растения-хозяина патоген развивается в субкутикулярном пространстве листа или некоторых других наземных органов яблони (Nasonov, Suprun, 2015). Краснодарский край характеризуется благоприятными погодно-климатическими условиями для эпифитотийного развития парши яблони. С 2004 г. отмечено возрастание агрессивности популяции V. inaequalis и усиление ее паразитической активности в регионе (Yakuba, 2013). Потери от заболевания весьма значительны. Так, в Краснодарском крае увеличение поражения плодов на сорте Ренет Симиренко на каждые 10% приводило к снижению урожая на 8.00–8.82 кг на каждое дерево (Yakuba, 2013). Современная защита яблони от парши представляет собой комплекс мероприятий, включающих как использование устойчивых к заболеванию сортов, так и применение химических и биологических пестицидов. Эффективность химического метода контроля возбудителя по-прежнему остается самой высокой, но требует строгого соблюдения регламентов использования фунгицидов, включающих норму расхода препарата, сроки и кратность опрыскивания, количество инфекционной нагрузки возбудителя, особенности погодных условий и другие. Количество обработок фунгицидами, необходимых для контроля парши яблони, может составлять от 10 до 20 за вегетационный период в зависимости от уровня относительной устойчивости сорта-хозяина, возраста сада, количества первичного инокулюма, температуры воздуха и продолжительности периода увлажнения листьев и плодов (MacHardy et al., 2001). Однако в некоторых случаях все же отмечается снижение эффективности программы защиты, причиной чего является возникновение у патогена практической резистентности к фунгициду.
Первые случаи резистентности к системным фунгицидам, обладавшим лечебными свойствами, зафиксированы в конце 1960-х гг., спустя примерно десять лет после начала их использования. Додин стал первым фунгицидом, у которого было отмечено снижение эффективности в борьбе с паршой яблони (Cox, 2015). Однако к следующему классу фунгицидов – метилбензимидазолакарбаматам – резистентность развилась быстрее, уже спустя пять лет после регистрации препарата (Cox, 2015). При этом фунгициды многосайтового токсического действия на грибы, то есть связанного с нарушением многих биосинтетических процессов у патогенов (Tyuterev, 2010), не снижали своей эффективности в течение длительного времени. Стало понятно, что возникновение резистентности к моносайтовым, имеющим одну мишень действия (один фермент), фунгицидам является их “ахиллесовой пятой”, обусловленной высокоспецифическим механизмом действия.
Фунгициды – ингибиторы деметилирования (DMI), в частности, триазолы, к которым относится дифеноконазол, широко используются для борьбы с V. inaequalis из-за их лечебного действия. Согласно классификации FRAC, по механизму действия они относятся к группе G: вещества, нарушающие биосинтез стерола в мембранах клеток гриба (sterol biosynthesis in membranes), и в системе кодов этой организации они обозначаются цифрой 3 (FRAC Code List, 2018). Поскольку фунгициды DMI представляют собой специфические ингибиторы, препятствующие C-14-деметилированию 24-этилендигидроланостерола в биосинтезе эргостерина, существует риск развития к ним устойчивости (Köller, Scheinpflug, 1987). FRAC определяет такой риск для этих фунгицидов как средний (FRAC Code List, 2018).
В Краснодарском крае применять дифеноконазол в промышленных садах яблони начали с 1991 г., на основной площади насаждений – с 1993 г. Вплоть до 1998 г. препарат с этим действующим веществом – Скор, КЭ (250 г/л) – обеспечивал биологическую эффективность защиты от парши на уровне 91–99%. После 5–6-летнего применения дифеноконазола, в большинстве садов произошло резкое снижение его эффективности: до 70–80% (Smolyakova, 2000). В полевых опытах были получены аналогичные результаты. При применении дифеноконазола в фенофазы яблони “окончание цветения”, “величина плода лещина”, “величина плода грецкий орех” в течение первых трех лет биологическая эффективность защиты от парши была на уровне 99–100% при продолжительности защитного действия до 15 суток. На четвертый год биологическая эффективность снижалась до 89%, на пятый – до 82%, на шестой – до 77%, на седьмой – до 70%. С каждым годом отмечалось уменьшение продолжительности периода защитного действия – на пятый–шестой год до 8–10 суток, что приводило к необходимости сокращения интервалов между обработками (Yakuba, 2013). В настоящее время дифеноконазол по-прежнему широко применяется в насаждениях яблони региона в программах защиты от парши, но высокая эффективность его обеспечивается (при условии соблюдения регламентов применения) за счет сокращения интервалов между опрыскиваниями до 5–6 суток.
Развитие резистентности к фунгицидам из класса триазолов описано: для миклобутанила и флутриафола в США (Cox, 2015), для флутриафола (препарат Импакт) в России (Yakuba, 2013) и др. Для дифеноконазола известны данные М.М. Левитина и Т.Ю. Гакаевой о ее развитии в Краснодарском крае (2000). В другом исследовании, проведенном в 2000 г. на изолятах патогена из четырех точек краснодарской популяции, показано отсутствие сдвига чувствительности к этому действующему веществу у возбудителя парши яблони (Smolyakova, 2000). В целом изоляты V. inaequalis с пониженной чувствительностью к фунгицидам DMI были зарегистрированы в различных частях обширного ареала патогена: в США (Chapman et al., 2011; Pfeufer, Ngugi, 2012; Villani et al., 2015), Чехии (Stevic et al., 2010), Италии (Fiaccadori, 2017), Уругвае (Mondino et al., 2015), Марокко (Lahlali et al., 2019), России (Lobodina et al., 2019) и др.
Феномен устойчивости связан с изменением чувствительности мишени, проницаемости мембран клеток патогена для фунгицида или активацией его детоксицирующих механизмов. Устойчивость формируется под воздействием фунгицида в процессе выживания и размножения изначально редких форм гриба со сниженной чувствительностью к нему. В результате такого селективного преимущества устойчивые клоны в популяции патогена начинают преобладать над чувствительными. Некоторое количество устойчивых к фунгициду биотипов гриба может присутствовать и случайно распределяться в нативной, не контактирующей с фунгицидом, популяции, вследствие мутационного процесса (Dyakov, 1998). Сравнение уровня чувствительности исходной популяции с той, которая контактирует с химическим препаратом, позволяет проследить развитие резистентности в последней (Cox, 2015). Как показано в ряде исследований, исходная чувствительность в региональных популяциях V. inaequalis мира может различаться (Henríquez et al., 2011; Mondino et al., 2015; Fiaccadori, 2017).
Цель работы – оценка чувствительности к дифеноконазолу краснодарских популяций V. inaequalis из промышленных садов или древостоев яблони, различающихся историей контактирования с фунгицидом, а также определение дискриминационной концентрации дифеноконазола для упрощенного метода мониторинга чувствительности к нему патогена.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика мест отбора проб фитопатогена. Для исследования чувствительности к дифеноконазолу в 2019–2020 гг. в Краснодарском крае было отобрано 3 популяции возбудителя парши яблони, представлявшие собой моноспоровые изоляты патогена (получение из листьев яблони описано ниже). Всего было получено 120 изолятов, наибольшей выборкой была представлена популяция Pop3 – 53 моноспоровые культуры, объем двух других популяций был представлен чуть более 30 изолятами в каждой (табл. 1). Популяции различались местом отбора, видом растения-хозяина, типом древостоя и историей применения фунгицидов (табл. 1). Pop1 была выделена из естественных произрастаний яблони восточной (Malus orientalis), широко распространенной в лесах Западного Предкавказья, в двух километрах от станицы Калужская, Северский район Краснодарского края. Pop2 и Pop3 получены из промышленных насаждений яблони домашней (Malus domestica) сорта Renet Simirenko, расположенных в Динском и Красноармейском р-нах края.
Таблица 1.
Характеристика исследованных популяций Venturia inaequalis
| Название | Тип популяции | Кол-во изолятов | Район*** | Геолокация | Схема и год посадки сада, высота деревьев |
|---|---|---|---|---|---|
| Pop1 | исходная (дикая)* | 34 | Северский | 44°44′55.8″ c.ш., 38°59′28.3″ в.д. | – |
| Pop2 | промышленная** | 33 | Динской | 45°08′18.1″ c.ш., 39°12′34.3″ в.д. | 5 × 3 м, 2000 г., 2.5–3.0 м |
| Pop3 | промышленная** | 53 | Красноармейский | 45°13′01.6″ c.ш., 38°31′46.4″ в.д. | 5 × 2 м, 2010 г., 2.0–2.5 м |
Примечание. *Популяция представлена на лесных полянах и вырубках на дикой яблоне Malus orientalis. **Отбор проводили в промышленных насаждениях сорта Ренет Симиренко четырехкратно обрабатываемых дифеноконазолом. ***Все районы являются частью Краснодарского края, максимальное расстояние между точками отбора составило 50 км.
Различия популяций по истории использования фунгицидов, имевших принципиальное значение для исследования, были следующими. Популяция Pop1 являлась исходной или базовой, так как никогда не имела контакта с фунгицидами. При этом исследованные участки леса находились на расстоянии свыше 5 км от промышленных насаждений яблони и на 1.5–2 км от приусадебных участков с плодовыми культурами, в которых могли быть использованы эти вещества. Ранее было показано, что различные пропагулы патогена не распространяются на расстояние свыше 50 м (MacHardy et al., 2001; Holb et al., 2004). Сады, в которых отобрали популяции V. inaequalis Pop2 и Pop3, многократно обрабатывали против патогена фунгицидами, в том числе и препаратами дифеноконазола. Количество обработок за сезон препаратами, содержащими дифеноконазол, составляло 4.
На вероятность развития резистентности к фунгициду у возбудителя парши могут оказывать влияние высота, возраст и плотность посадки деревьев (Yakuba, 2013). Возраст насаждения опосредованно определяет, насколько долго популяция патогена могла контактировать с фунгицидом. Чем больше возраст, тем более длительным был отбор устойчивых форм патогена. Высота деревьев зависит не только от возраста, но и от схемы посадки: чем она плотнее, тем ниже растение, что определяет большую технологичность при обработке деревьев меньшего размера.
В годы проведения исследований – 2019 и 2020 – на динамику парши яблони в течение вегетации оказали влияние экстремальные погодные условия, прежде всего, – повышенный температурный режим и выпадение за короткие промежутки времени (1–4 суток) аномального количества осадков.
В 2019 г. средняя температура воздуха выше нормы была зафиксирована: в апреле – на 1.5°C, в мае – на 2.0–2.8°C, в июне – на 3.8–5.3°C, в июле – на 1.2°C, в августе – на 3.1°C, в сентябре – на 2.5°C. Осадки, существенно превышающие норму, прошли во второй декаде апреля (186% от нормы), во второй (361%) и третьей (395%) декадах июля, в первой (105%) и во второй (136%) декадах августа, в первой декаде сентября (108%). Периоды резкого возрастания распространения и интенсивности развития болезни на листьях были отмечены после аномального повышения температуры воздуха: с 5 по 11 мая (показатели возросли соответственно в 6 и 4.8 раза), с 28 мая по 4 июня (в 8.7 и 9.8 раза), с 11 по 19 июня (соответственно в 1.7 и 1.3 раза). Количество пораженных завязей и интенсивность их поражения возросли с 25 по 27 мая соответственно в 1.5 и 2 раза, с 28 мая по 4 июня – соответственно в 4.0 и 3.5 раза, с 5 по 11 июня соответственно в 1.4 и 1.6 раза. Осадки июля вызвали эпифитотийное развитие заболевания: в первой декаде августа было поражено более половины листового аппарата и около половины плодов. К началу сентября было поражено 74% листьев с интенсивностью 54.4% и 53.0% плодов с интенсивностью 31.8%.
В 2020 г. превышение значений температуры воздуха над среднемноголетними показателями отмечалось в июне (на 1.2–2.8°C), июле (на 4.2°C), августе (на 1.4–1.5°C), сентябре (на 3.0–4.3°C). Значительным недобором осадков или их отсутствием характеризовались апрель (0–18% от нормы), а также вторая декада мая (0%), третья декада июня (3%), август (0–30%). Аномально сухие периоды чередовались с периодами выпадения осадков ливневого характера, значительно превышающих среднемесячную норму: в мае (149–212% от нормы), июне (118–175%), июле (163–359%). Осадки мая вызвали резкое нарастание парши: на контрольных деревьях с 5 по 16 мая количество пораженных листьев и интенсивность их поражения возросли более чем в 10 раз, с 26 мая по 3 июня – соответственно в 1.7 и 1.5 раза. После резкого повышения температуры воздуха в июне и выпадения осадков, существенно выше нормы, количество пораженных листьев и интенсивность их поражения возросли с 3 по 11 июня соответственно в 1.3 и 1.7 раза, с 11 по 22 июня соответственно еще в 1.5 и 1.8 раза. Во второй декаде июня в контроле было поражено 63% листьев с интенсивностью 53.2%. Далее в третьей декаде месяца в условиях аномальной жары и очень незначительного количества осадков парша развивалась слабо: количество пораженных листьев, интенсивность развития болезни возросли незначительно. После ливней в первой, а затем в третьей декадах июля с 30 июля по 11 августа интенсивность развития парши возросла в 1.4 раза. Поражение плодов в контрольном варианте нарастало после аномального количества осадков: с 21 по 26 мая распространение болезни на плодах увеличилось в 6 раз, а интенсивность их поражения – в 11 раз, с 30 июня по 9 июля, соответственно, в 2.7 и 2.5 раза, с 16 по 30 июля, соответственно в 1.5 и 1.9 раза. В первой декаде сентября было поражено 80% листьев при интенсивности развития болезни 71.9% и 70% плодов при интенсивности развития болезни 43.6%.
Испытания в полевых опытах в 2019 и 2020 гг. фунгицидов с действующим веществом дифеноконазол – Скор, КЭ (250 г/л) и Фарди, КЭ (250 г/л) – показали, что в условиях повышенного температурного режима (при средней температуре воздуха на 1.5–2.8°С выше нормы) и выпадении осадков биологическая эффективность этих препаратов против парши обеспечивалась на уровне 97.2–99.3%, период их защитного действия составлял 6–7 суток. В условиях сухой погоды, неблагоприятной для развития парши, при повышенной температуре (на 1.5–2.9°С выше нормы) эффективность на уровне 98.8–99.0% сохранялась в течение 8–10 суток. При температуре воздуха на уровне среднемноголетних значений, или незначительно их превышающей (на 0.9°С выше нормы), эффективность дифеноконазола составляла 90.0–92.9%, продолжительность защитного действия не превышала 5–6 суток. Таким образом, в настоящее время в Краснодарском крае существенно сократилась продолжительность защитного действия дифеноконазола.
Получение моноспоровых изолятов. Моноспоровые изоляты патогена выделяли из листьев яблони по следующей схеме. В каждой точке отбирали случайным образом 50 листовых образцов с симптомами заболевания: либо прошлогодний опад с плодовыми телами гриба, либо свежие листья с хорошо спорулирующими конидиальными поражениями. Отбор опада проводили в период начала интенсивного лёта аскоспор и до его окончания, с середины апреля до середины мая. Из листового опада моноспоровые изоляты выделяли согласно оригинальной методике Насонова (Nasonov, 2019). Суть метода заключается в эмиссии аскоспор из плодовых тел на поверхность агаризованной среды. Прошлогодний листовой опад яблони последовательно стерилизовали в 70%-м р-ре этилового спирта и 3%-м р-ре перекиси водорода, и отмывали стерильной водой. Дезинфицированные листья закладывали в перевернутые вверх дном чашки Петри с 2%-м водным агаром и инкубировали ночь при 20°С. Далее под контролем стереомикроскопа при 40× увеличении с поверхности среды с помощью заостренной энтомологической иглы осуществляли перенос единичных проросших аскоспор на свежую питательную среду КГА (картофельно-глюкозный агар), содержащую 25 мг/л тетрациклина. Среду КГА готовили следующим образом: картофельный отвар (200 г очищенных клубней варили 1 ч на медленном огне), 20 г глюкозы, 20 г агар-агара на 1 литр воды. Спиртовой раствор тетрациклина (Sigma Aldrich) добавляли после стерилизации среды, когда она остывала до 50°C.
Моноспоровые изоляты из конидиальных поражений получали, как описано в работе Кёллера (Köller et al., 2004). С каждого дерева отбирали один лист с поражениями, с каждого листа вырезали одно спорулирующее пятно и помещали в пробирку Эппендорф объемом 1.5 мл. В пробирку добавляли стерильную воду и осуществляли смыв конидий, полученную суспензию наносили на поверхность 2%-й водной агаровой среды в чашке Петри и инкубировали ночь при 20°С. Далее осуществляли перенос единичных проросших конидий на свежую питательную среду КГА с тетрациклином, как описано выше. Моноспоровый посев инкубировали в течение 30 сут при 20°С в темноте и оценивали на штаммовую чистоту по морфолого-культуральным признакам. Изоляты, имевшие неоднородности в культуре, выражавшейся в наличии секторов, отличавшихся как макроскопическими, так и микроскопическими признаками от основной части колонии, исключали из исследования. С каждого листового образца получали 3 изолята. Различающиеся морфолого-культуральными характеристиками изоляты отдельных образцов получали индивидуальную маркировку.
Оценка чувствительности изолятов к дифеноконазолу. Чувствительность изолятов V. inaequalis определяли в лабораторных условиях в чашках Петри на КГА, содержащей различные концентрации дифеноконазола: 0.005; 0.01; 0.025; 0.05; 0.5 и 1 мг д.в./л. В качестве источника действующего вещества использовали коммерческий препарат Скор КЭ, 250 мг/л, производства ООО “Сингента”, Швейцария. Во все варианты опыта, включая контроль, добавляли тетрациклин – 25 мг/л. Препарат фунгицида и раствор антибиотика вносили после стерилизации в остывшую до 50°С питательную среду в стерильных условиях. Контрольный вариант питательной среды не содержал фунгицида. Полученные среды инокулировали чистыми культурами патогена следующим образом: из каждого моноспорового изолята вырезали стерильным пробковым сверлом блок мицелия с агаром диаметром 5 мм и переносили на среду с фунгицидом или без него. Повторность двукратная. Посевы инкубировали при 20°С в темноте. Через 30 суток измеряли диаметр роста мицелия культуры в двух взаимно перпендикулярных направлениях и выражали его в процентах от среднего диаметра контрольного образца (Köller et al., 2004). В расчетах не учитывали размер посевного блока.
С помощью пробит-регрессионного анализа (Finney, 1971) определяли 50% эффективную концентрацию – ЭК50, представляющую собой концентрацию дифеноконазола в мг/л, которая ингибировала радиальный рост чистой культуры патогена в два раза. Фактор резистентности (RF) популяции рассчитывали путем деления средних значений ЭК50 агроценотических популяций на среднее значение ЭК50 исходной популяции. Рассчитываемый показатель определяет уровень развития устойчивости (резистентности) к фунгициду в регулярно обрабатываемой им популяции относительно исходной (чувствительной к нему) популяции.
Поиск и апробация единичной оценочной концентрации. Проводилась отработка упрощенного теста на чувствительность к фунгицидам, основанного на относительном росте (RG) чистых культур при единичной оценочной концентрации фунгицида (SAC; Mondino et al., 2015). Для получения значения этой концентрации вычисляли линейные регрессии между ЭК50 и RG исходной популяции (Pop1) при каждой оцениваемой концентрации. Единичная концентрация выбиралась путем визуальной оценки линейного соответствия регрессий и сравнения их коэффициентов детерминации (R2). Концентрация, показавшая самое высокое значение корреляции (R2) между ЭД50 и относительным ростом, считалась наиболее подходящей в качестве SAC. Три популяции V. ina-equalis были дополнительно проанализированы на чувствительность к дифеноконазолу с использованием значений RG в выбранном SAC. Для этого агаровый блок чистой культуры патогена диаметром 5 мм переносили на среду КГА с внесенной в нее SAC дифеноконазола. Посев инкубировали при 20°С в темноте. Через 30 суток измеряли диаметр роста мицелия культуры в двух взаимно перпендикулярных направлениях и выражали его в процентах от среднего диаметра контрольного образца (Köller et al., 2004). В дальнейшем вместо SAC мы стали использовать более употребляемый термин “дискриминационная концентрация”.
Статистическая обработка результатов. Все лабораторные анализы проводили не менее чем в двухкратной повторности. Поскольку размеры выборки отдельных популяций были меньше 50 и не соблюдалось условие нормальности распределения и однородности (гомоскедастичности) дисперсий во всех сравниваемых группах, для сравнения средних значений ЭК50 и RG применяли непараметрическую статистику: тест Краскела–Уоллиса (Kruskal–Wallis rank sum test) для трех отдельных популяций и U-критерий Манна–Уитни (Mann–Whitney U-test) для попарного сравнения популяций в программе Stat. Soft. inc., Statistica Base. Различия считали достоверными при уровне значимости p ≤ 0.05.
РЕЗУЛЬТАТЫ
Оценка чувствительности изолятов к дифеноконазолу. Общепринято, что изменение чувствительности фитопатогенов к фунгицидам определяют путем установления доли изолятов в популяции, которые проявляют нечувствительность к ним, превышающую показатели, характерные для чувствительных изолятов.
В проведенном исследовании частотное распределение значений ЭК50 (EC50) было логонормальным для всех изученных популяций (рис. 1). На основе теста Краскела–Уоллиса различия между средними значениями ЭК50 для трех исследованных популяций оказались существенными на высоком уровне значимости (P < 0.001). Попарная оценка значимости различий между популяциями с помощью U-критерия Манна–Уитни показала, что среднее значение ЭК50 для первой исходной популяции патогена, никогда не контактировавшей с фунгицидами (Pop1), значительно ниже (P < 0.001), чем средние значения этого показателя для обрабатываемых фунгицидом популяций. При этом различия между популяциями Pop2 и Pop3 оказались значимы на более низком уровне (P < 0.05), что указывает на их большее сходство между собой в чувствительности к исследованному препарату.
Рис. 1.
Распределение значений ЭК50 для дифеноконазола среди изолятов Venturia inaequalis различных популяций.
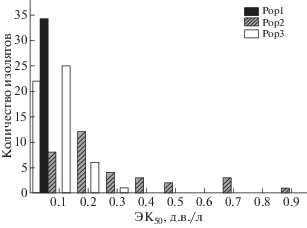
Ожидаемо наименьшее значение среднего ЭК50 было характерно для более чувствительной исходной популяции Pop1, никогда не контактировавшей с фунгицидами (табл. 2). На гистограмме видно, что вся выборка изолятов дикой популяции компактно представлена в левой части рис. 1. Две другие популяции патогена, испытывавшие влияние дифеноконазола, имели более высокие значения показателя. При этом уровень этих значений различался. Так, фактор резистентности для популяции Pop2 был в 2 раза выше, чем в популяции Pop3.
Таблица 2.
Чувствительность популяций Venturia inaequalis, оцененная на основе ЭК50, мг д.в./л
| Популяция | Обработка фунгицидом | Среднее ЭК50** | Диапазон ЭК50 | RF*** |
|---|---|---|---|---|
| Pop1 | – | 0.0078 | 0.0015–0.0210 | – |
| Pop2 | +* | 0.2500 | 0.03–0.81 | 32 |
| Pop3 | +* | 0.1242 | 0.0027–0.300 | 16 |
Примечание. *Кратность обработок дифеноконазолом в комплексной программе защиты сада за сезон составляла 4. **Различия между средними значениями ЭК50 на основе теста Краскела–Уоллиса значимы при p < 0.0001. ***Resistance factor – фактор резистентности, показывающий разницу между средними ЭК50 исходной популяции и ЭК50, обрабатываемой фунгицидом.
Размах варьирования показателя ЭК50 позволяет оценить структуру популяции патогена по восприимчивости к фунгициду. Чувствительность исходной популяции (Pop1) к дифеноконазолу варьировала в широком диапазоне значений ЭК50 с фактором разделения 14 (соотношение между наименее и наиболее чувствительным изолятом популяции). Для популяций из агроценозов (Pop2 и Pop3) наблюдалось увеличение амплитуды коэффициента разделения, но в разной степени (табл. 2). Так, для Pop3 происходило почти десятикратное увеличение фактора, что отражает накопление новых менее чувствительных изолятов, отсутствующих в исходной популяции патогена, в то время как для популяции Рор2 – только в два раза. При этом нижняя и верхняя границы диапазона этой популяции были выше, чем у популяции Pop3. В Pop2 отмечено не только возрастание количества относительно устойчивых изолятов, которое было характерно и для предыдущей популяции, но и значительное уменьшение доли чувствительных, чем и обусловлен более низкий уровень фактора разделения, по сравнению с Pop3. Это особенно четко проявляется в сравнениях крайних численных значений диапазона ЭК50. Так, сравнивая крайние значения диапазона ЭК50 Рор3 с исходной популяцией, можно увидеть, что разница между нижними значениями была всего в 3 раза, в то время как в верхних значениях – уже 14. Сравнение популяций Рор3 и Рор2 показывает несколько другую картину изменения структуры их чувствительности. Если разница между самыми высокими значениями диапазона ЭК50 в двух промышленных популяциях была в 2.7 раза, то между наименьшими – 111 раз. На гистограмме это проявляется в увеличении доли изолятов популяции Pop2 в правой ее части (рис. 1).
Определение и апробация дискриминационной концентрации. В рамках проведенного исследования также определена дискриминационная концентрация дифеноконазола для оценки чувствительности V. inaequalis.
Все шесть проверенных концентраций дифеноконазола обеспечивали линейное соответствие между ЭК50 и относительным ростом изолятов (RG) первой исходной популяции (рис. 2). Однако концентрация 0.01 мг д.в./л показала самое высокое значение R2 (0.62), поэтому эта концентрация была выбрана в качестве единичной оценочной концентрации. R2 – это показатель качества регрессионной модели и чем он выше, тем лучше прогностические свойства модели. R2 не может быть больше 1, однако при его значениях меньше 0.5 адекватность такой модели следует ставить под вопрос.
Рис. 2.
Линейные регрессионные зависимости между ЭК50 и относительным ростом мицелия (RG) изолятов базовой популяции Venturia inaequalis, оцененные для шести концентраций дифеноконазола.
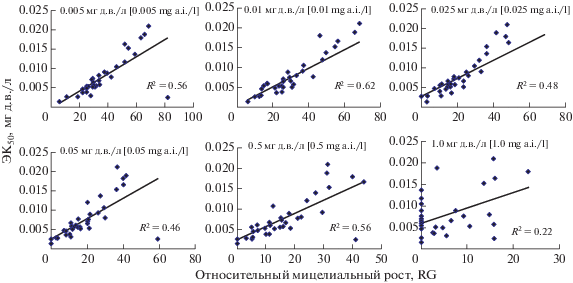
Полученные на основе подобранной в нашем исследовании диагностической концентрации значения RG статистически значимо различались (P < 0.001) среди трех изученных популяций (табл. 3). Изоляты с RG ≥ 70% присутствовали только в популяциях патогена Рор2 и Рор3, выделенных из садов с использованием дифеноконазола. Причем уровень устойчивых изолятов по этому показателю был выше в популяции Рор2, по сравнению с Рор3, в 1.8 раза. По средним значениям RG исходная популяция отличалась от популяций Рор2 и Рор3 в 2.8 и 2.4 раза, а между собой они различались только в 1.2 раза. В целом, ранжирование популяций по чувствительности к дифеноконазолу, оцененное с помощью диагностической концентрации и ЭК50, совпало. Исходная популяция была наиболее чувствительной к дифеноконазолу, популяция Рор2 – наименее, в то время как Рор3 заняла промежуточное положение. Таким образом, концентрация дифеноконазола в 0.01 мг/л может быть использована для мониторинга развития к нему устойчивости возбудителя парши яблони в садах Краснодарского края.
ОБСУЖДЕНИЕ
Практика использования фунгицидов DMI, показала, что полевая устойчивость к ним может развиваться и возрастать после нескольких лет их интенсивного использования (Kuck, 2002). По данным Г.В. Якубы, использование препарата Скор, КЭ в течение семи лет для обработки яблони в фенофазы “окончание цветения”, “величина плода лещина” и “величина плода грецкий орех” приводило к постепенному снижению биологической эффективности защиты от парши до 70%, а препарата Импакт, КЭ (д.в. флутриафол) – до 30% (Yakuba, 2013).
В основе резистентности к пестицидам лежит общебиологический принцип приспособления живых организмов. Развитие устойчивости происходит под воздействием фунгицида в результате отбора им резистентных фенотипов и элиминации чувствительных; чем сильнее воздействие токсиканта на патоген, тем интенсивнее протекает отбор. Постепенно происходит снижение его действия на объект борьбы. Как только частота встречаемости таких фенотипов в популяции достигнет достаточно высокой величины, наблюдается потеря эффективности препарата или снижение длительности его токсического действия (Dyakov, 1998). Проследить развитие резистентности к фунгициду в контактирующей с ним популяции можно, оценив ее чувствительность относительно исходной популяции патогена (Cox, 2015).
В нашем исследовании в качестве исходной использовалась популяция V. inaequalis, паразитирующая на дикой яблоне восточной в естественных ее произрастаниях в предгорьях Западного Кавказа. Полученное в текущей работе среднее значение ЭК50 для не испытывавшей воздействие дифеноконазола популяции составило 0.0078 мг/л. Это значение было выше полученного для такого типа популяции из Восточного побережья США – 0.002 мг/л (Villani et al., 2015), но ниже значений для чилийской, уругвайской и немецкой популяций – 0.017, 0.0286, 0.090 мг/л (Kunz, 1998; Henríquez et al., 2011; Mondino et al., 2015). Наиболее близким к полученному результату было среднее ЭК50 для итальянской исходной популяции патогена – 0.0075 мг/л (Fiaccadori, 2017). Как отмечали Виллани и соавторы (Villani et al., 2015), частота изолятов с пониженной чувствительностью к фунгициду в исходной популяции может иметь значение для скорости развития устойчивости к дифеноконазолу в регионе. Изоляты со значением ЭК50 выше среднего для популяции должны иметь более высокую вероятность выживания при применении фунгицида, по сравнению с чувствительными к нему изолятами.
Фактор разделения, показывающий размах вариации значений ЭК50 для оцененной нами исходной популяции, составил 14 и был ниже этого показателя в популяциях из США и Чили (Henríquez et al., 2011; Villani et al., 2015). При этом нами было отмечено увеличение разброса значений ЭК50 в популяциях, контактировавших с дифеноконазолом. Анализ результатов показал, что увеличение размаха этих значений в популяции Рор3 происходило, в основном, за счет возрастания доли устойчивых изолятов, тогда как в популяции Рор2 – за счет снижения количества чувствительных. Такие же особенности были отмечены для двух уругвайских популяций патогена (Mondino et al., 2015). В другой работе фактор разделения в исходной популяции, наоборот, был выше, чем в обрабатываемых популяциях (Henríquez et al., 2011).
В целом, нами было выявлено повышение средних значений ЭК50 в обрабатываемых популяциях, по сравнению с исходной, показывающее снижение чувствительности к фунгициду. Так, для популяции Рор2 оно составило 0.2500 мг/л, а для Рор3 – 0.1242 мг/л. Степень снижения или сдвиг чувствительности популяции, испытывающих фунгицидный прессинг, относительно исходной, выражают в виде показателя резистентности (RF). Ожидаемо он для второй популяции оказался выше, чем для третьей, составив 32 и 16 соответственно. Сдвиг чувствительности в популяциях, контактировавших с фунгицидом, был показан во многих исследованиях. Показанные нами RF оказались на уровне или выше продемонстрированных в ряде работ: 4.7 (Henríquez et al., 2011); 6.6 и 11.74 (Mondino et al., 2015); 9.2 и 24.0 (Fiaccordi, 2017).
Какие-то конкретные величины RF не являются условием того, что популяция будет устойчива. Для выявления такой величины в каждом случае для определенного фунгицида необходимо сопоставление реальной его эффективности в саду с показателем RF. В исследованных нами садах ранее проведенная оценка эффективности дифеноконазола в течение семи лет использования показала снижение его токсического действия с 15 суток до пяти–шести суток (Yakuba, 2013), что проявилось в полученных нами значениях коэффициента резистентности, показывающего значительное увеличение доли устойчивых фенотипов в краснодарской популяции V. inaequalis. Между тем, сокращение интервалов между опрыскиваниями фунгицидом позволяет поддерживать его эффективность на достаточном уровне для контроля заболевания: около 90%. В опытном саду Нью-Йоркской сельскохозяйственной экспериментальной станции, который характеризовался стабильной практической устойчивостью к миклобутанилу, дифеноконазол обеспечивал высокий уровень контроля парши (> 90%) после четырех ежегодных применений фунгицида в течение семи лет (Cox et al., 2008). Смит и соавторы (Smith et al., 1991) сообщали, что потеря активности фунгицидов группы деметилирования стеринов в популяциях возбудителя парши яблони происходила при RF более 3, однако это не касалось дифеноконазола. Предполагается, что устойчивость некоторых DMI-фунгицидов является количественной или дозозависимой, например, дифеноконазол и фенбуконазол обладают более высокой внутренней активностью в отношении V. inaequalis, чем флутриафол или миклобутанил (Cox, 2015).
Отличия в значениях RF полученные нами для двух “фунгицидных” популяций, могут быть обусловлены различиями в агротехнических характеристиках садов, в которых они отбирались. Так популяция Pop2, которая имела наибольший сдвиг чувствительности, была отобрана из более старого сада с менее плотной схемой посадки. Такие характеристики сада могут иметь более высокие риски развития резистентности патогена к фунгициду в силу более длительного контакта его популяции с ним и меньшей технологичности при обработке препаратом деревьев большего размера. В исследованиях американских ученых была показана зависимость между возрастом сада и уровнем сдвига чувствительности возбудителя парши яблони к фунгицидам DMI (Pfeufer, Ngugi, 2012).
Мониторинг устойчивости к фунгицидам на основе значений ЭК50 очень трудоемок и предполагает проверку чувствительности большого количества изолятов к нескольким концентрациям пестицида, что затрудняет использование данного подхода для широкого скрининга признака в промышленных садах. В связи с этим в ряде исследований был использован упрощенный тест на чувствительность, основанный на относительном росте мицелия (RG) на дискриминантной дозе фунгицида (Köller et al., 1991; Smith et al., 1991; Seyran et al., 2010). Величина RG позволяет оценивать чувствительность к фунгицидам у штаммов V. inaequalis с использованием всего одной концентрации антимикотика. На данный момент не существует определенного стандартизированного метода выбора подходящей единичной концентрации (дискриминантной дозы) для выявления устойчивых штаммов в популяции. В первых исследованиях с использованием дискриминантной концентрации таковой считали концентрацию, близкую, но немного превышающую, среднее значение ЭК50 базовой популяции (Köller et al., 1991; Smith et al., 1991). В работе Мондино и соавторов (Mondino et al., 2015) единичная оценочная концентрация (SAC) определялась путем подбора линейной регрессии между ЭК50 и RG изолятов при каждой концентрации и оценки соответствия линий регрессии. С использованием второго подхода нами была определена концентрация 0.01 мг д.в./л, имевшая самый высокий показатель качества регрессионной модели – R2. Полученная концентрация была близка к среднему значению ЭК50 изученной нами исходной популяции, немного его превышая. Таким образом, она соответствовала величине при эмпирическом подборе в первом подходе.
В научной литературе сообщается о более высоких значениях дискриминационной концентрации, чем были получены нами. Так, Хенрикес и соавтоы (Henrıquez et al., 2011) предложили концентрацию 0.04 мг д.в./л, а Мондино и соавторы (Mondino et al., 2015) – 0.05 мг д.в./л. Разные авторы называют описанную выше дозировку для оценки чувствительности к фунгицидам: дискриминационной дозой (DD), единичной оценочной (SAC) или мониторинговой концентрациями (Köller et al., 1991; Smith et al., 1991; Seyran et al., 2010; Henrıquez et al., 2011). Как резонно отмечают Мондино и соавторы (Mondino et al., 2015), этот подход не позволяет определить критические значения чувствительности, обусловленные нарушением контроля патогена, и используемые концентрации не являются по сути дискриминационными. Однако сопоставление результатов чувствительности in vitro с данными полевой устойчивости дает необходимую информацию для выбора дискриминационного порога. В качестве такого порога нами было выбрано значение RG в 70%. Это значение позволило разделить изученные популяции по чувствительности к фунгициду. В исходной популяции изоляты с RG > 70% не встречались, тогда как доля таких изолятов в “фунгицидных” популяциях составила 97% для популяции Pop2 и 54.7% для популяции Pop3 (табл. 3). Сходные результаты при этом пороге получили уругвайские исследователи: доля изолятов с RG > 70% в двух коммерческих садах составляла 39.4 и 63.6% (Mondino et al., 2015). То же пороговое значение ранее использовали Пфейфер и Нгуги (Pfeufer, Ngugi, 2012). Кёллер и соавторы (Köller et al., 1997), используя более высокий функциональный порог (RG = 80%), наблюдали увеличение доли устойчивых изолятов в садах с практической резистентностью к DMI фунгицидам в сравнении с эффективно контролируемой популяцией.
Проведенное нами исследование показало снижение чувствительности популяций возбудителя парши из промышленных насаждений яблони в двух точках Краснодарского края, в сравнении с базовой чувствительностью дикой популяции патогена, собранной в предгорьях Западного Кавказа.
ЗАКЛЮЧЕНИЕ
Впервые для Краснодарского края в экспериментах in vitro путем оценки показателя ЭК50 была оценена чувствительность исходной популяции возбудителя парши яблони. В 2019–2020 гг. установлено развитие резистентности к дифеноконазолу в популяциях V. inaequalis из промышленных садов относительно исходной популяции, благодаря увеличению в них доли резистентных фенотипов. Предложена дискриминационная концентрация этого фунгицида, основанная на анализе относительного роста (RG) мицелия гриба, которая позволяет упростить мониторинг чувствительности V. inaequalis к дифеноконазолу в садах: 0.01 мг д.в./л. Получены сопоставимые результаты использования значений ЭК50 и RG при этой дискриминационной дозе. Повышение доли изолятов V. inaequalis со сниженной чувствительностью к дифеноконазолу согласуется с данными мониторинга его эффективности в саду, которая снизилась с 99 до 90% за семилетний период использования фунгицида. Также имеются данные об уменьшении периода его токсического действия до пяти–шести суток. Проведенное исследование показывает необходимость дальнейшего мониторинга чувствительности к дифеноконазолу более значительного объёма популяции возбудителя заболевания в садах Краснодарского края.
Исследование выполнено при частичной финансовой поддержке РФФИ и администрации Краснодарского края, грант № 19-416-230070 р_а, в рамках государственного задания № АААА-А19-119051490016-9.
Список литературы
Chapman K.S., Sundin G.W., Beckerman J.L. Identification of resistance to multiple fungicides in field populations of Venturia inaequalis. Plant Dis. 2011. V. 95. P. 921–926. https://doi.org/10.1094/PDIS-12-10-0899
Cox K.D. Fungicide resistance in Venturia inaequalis, the causal agent of apple scab, in the United States. Fungicide Resistance in Plant Pathogens. Springer, Tokyo, 2015. P. 433–447. https://doi.org/10.1007/978-4-431-55642-8_27
Cox K.D., Russo N.L., Villani S.M. et al. QoI qualitative resistance and CYP51A1 upstream anomalies in NY populations of the apple scab pathogen Venturia inaequalis. Phytopathology. 2008. V. 98 (6). P. S42. https://apsjournals.apsnet.org/doi/pdf/10.1094/ PDIS.2001.85.10.1036
Dyakov Yu.T. Population biology of phytopathogenic fungi. Muravey, Moscow, 1998.
Fiaccadori R. Researches on methodologies to verify reduced sensitivities of Venturia inaequalis in field to difenoconazole and first indications of a survey in Italy. Am. J. Plant Sciences. 2017. V. 8 (09). P. 2056–2068. https://doi.org/10.4236/ajps.2017.89138
Finney D.J. Probit analysis. Cambridge, 1971.
FRAC Code List. Fungicides sorted by mode of action (including FRAC Code numbering). 2018. P. 1–14. http://www.phi-base.org/images/fracCodeList.pdf
Gouot J.M. Characteristics and population dynamics of Botrytis cinerea and other pathogens resistant to dicarboximides. In: Fungicide Resistance in North America. St. Paul, Minnesota, 1994. P. 53–55.
Henríquez Sáez J., Sarmiento O., Alarcón P. Sensitivity of Venturia inaequalis Chilean isolates to difenoconazole, fenarimol, mancozeb, and pyrimethanil. Chilean J. Agric. Res. 2011. V. 71 (1). P. 39–44. https://doi.org/10.4067/S0718-58392011000100005
Holb I.J., Heijne B., Withagen J.C.M. et al. Dispersal of Venturia inaequalis ascospores and disease gradients from a defined inoculum source. J. Phytopathol. 2004. V. 152. P. 639–646. https://doi.org/10.1111/j.1439-0434.2004.00910.x
Köller W., Parker D.M., Reynolds K.L. Baseline sensitivities of Venturia inaequalis to sterol demethylation inhibitors. Plant Dis. 1991. V. 75. P. 726–728. https://www.apsnet.org/publications/PlantDisease/ BackIssues/Documents/1991Articles/PlantDisease75n07_ 726.PDF
Köller W., Parker D.M., Turechek W.W. et al. A two-phase resistance response of Venturia inaequalis populations to the QoI fungicides kresoxim-methyl and trifloxystrobin. Plant Dis. 2004. V. 88. P. 537–544. https://doi.org/10.1094/PDIS.2004.88.5.537
Köller W., Scheinpflug H. Fungal resistance to sterol biosynthesis inhibitors: A new challenge. Plant Disease. 1987. V. 71. P. 1066–1074.
Köller W., Wilcox W.F., Barnard J. et al. Detection and quantification of resistance of Venturia inaequalis populations to sterol demethylation inhibitors. Phytopathology. 1997. V. 87. P. 184–190. https://doi.org/10.1094/PHYTO.1997.87.2.184
Kuck K.H. DMI Fungicides: 20 Years of experience with resistance development and resistance management. In: Modern fungicides and antifungal compounds III. Verlag Th. Mann GmbH and Co. KG, Gelsenkirchen, 2002, pp. 21–28.
Kunz S., Deising H., Mendgen K. Acquisition of resistance to sterol demethylation inhibitors by populations of Venturia inaequalis. Phytopathology. 1997. V. 87 (12). P. 1272–1278. https://doi.org/10.1094/PHYTO.1997.87.12.1272
Lahlali R., Moinina A., Ezrari S. et al. Apple scab disease severity in the Sais Region of Morocco and its sensitivity to three commercial fungicides. Notulae Scientia Biologicae. 2019. Vol. 11 (2). P. 249–257. https://doi.org/10.15835/nsb11210434
Levitin M.M., Gagkaeva T.Yu. On the sensitivity of the fungus Venturia inaequalis to the fungicide Scor. In: The current state of the problem of resistance of pests, pathogens and weeds to pesticides in Russia and neighboring countries at the turn of the XXI century: Proceedings of the 9th meeting. SPb., 2000. P. 58–59 (in Russ.).
Lobodina E.V., Astapchuk I.L., Nasonov A.I. The sensitivity of the population of the causative agent of apple scab Venturia inaequalis to difenoconazole. Nauchnyye trudy Severo-Kavkazskogo federalnogo nauchnogo tsentra sadovodstva, vinogradarstva, vinodeliya. 2019. V. 26. P. 165–169 (in Russ.). https://www.kubansad.ru/media/uploads/files/ nauchnye_trudy_skzniisiv/tom_26/31.pdf
MacHardy W.E., Gadoury D.M., Gessler C. Parasitic and biological fitness of Venturia inaequalis: relationship to disease management strategies. Plant Disease. 2001. V. 85 (10). P. 1036–1051.
Mondino P., Casanova L., Celio A. et al. Sensitivity of Venturia inaequalis to Trifloxystrobin and Difenoconazole in Uruguay. Jю Phytopathol. 2015. Vol. 163 (1). P. 1–10. https://doi.org/10.1111/jph.12274
Nasonov A.I. New method of producing of Venturia inaequalis culture from ascospores. Mikologiya i fitopatologiya. 2019. V. 53 (1). P. 46–48 (in Russ.). https://doi.org/10.1134/S0026364819010094
Nasonov A.I., Suprun I.I. Apple scab: peculiarities of the causal agent and the pathogenesis. Mikologiya i fitopatologiya. 2015. V. 49 (5). P. 275–285 (in Russ.).
Pfeufer E.E., Ngugi H.K. Orchard factors associated with resistance and cross resistance to sterol demethylation inhibitor fungicides in populations of Venturia inaequalis from Pennsylvania. Phytopathology. 2012. V. 102 (3). P. 272–282. https://doi.org/10.1094/PHYTO-04-11-0117
Seyran M., Brenneman T.B., Stevenson K.L. A rapid method to monitor fungicide sensitivity in the pecan scab pathogen Fusicladium effusum. Crop Prot. 2010. V. 29. P. 1257–1263. https://doi.org/10.1016/j.cropro.2010.07.016
Smith F.D., Parker D.M., Köller W. Sensitivity distribution of Venturia inaequalis to flusilazole: Baseline sensitivity and implications for resistance monitoring. Phytopathology. 1991. V. 81. P. 392–396.
Stevic M., Vuksa P., Elezovic I. Resistance of Venturia inaequalis to dimethylation inhibiting (DMI) fungicides. Žemdirbystė=Agriculture. 2010. V. 97. P. 65–72.
Smolyakova V.M. Diseases of fruit trees in the south of Russia. Krasnodar, 2000 (in Russ.).
Tyuterev S.L. Mechanisms of action of fungicides on phytopathogenic fungi. SPb., 2010 (in Russ.).
Villani S.M., Biggs A.R., Cooley D.R. et al. Prevalence of myclobutanil resistance and difenoconazole insensitivity in populations of Venturia inaequalis. Plant Dis. 2015. V. 99. P. 1526–1536. https://doi.org/10.1094/PDIS-01-15-0002-RE
Yakuba G.V. Ecologized protection of apple scab in the face of climate change: monografiya. Krasnodar, 2013 (in Russ.).
Дьяков Ю.Т. (Dyakov) Популяционная биология фитопатогенных грибов. Москва: Муравей, 1998. 381 с.
Левитин М.М., Гагкаева Т.Ю. (Levitin, Gagkaeva) О чувствительности гриба Venturia inaequalis к фунгициду скор // Материалы девятого совещания: Современное состояние проблемы резистентности вредителей, возбудителей болезней и сорняков к пестицидам в России и сопредельных странах на рубеже XXI века. СПб, 2000. С. 58–59.
Лободина Е.В., Астапчук И.Л., Насонов А.И. (Lobodina et al.) Чувствительность популяции возбудителя парши яблони Venturia inaequalis к дифеноконазолу // Научные труды Северо-Кавказского федерального научного центра садоводства, виноградарства, виноделия. 2019. Т. 26. С. 165–169.
Насонов А.И. (Nasonov) Новый способ получения культуры Venturia inaequalis из аскоспор. Микология и фитопатология. 2019. Т. 53. № 1. С. 46–48. https://doi.org/10.1134/S0026364819010094
Насонов А.И., Супрун И.И. (Nasonov, Suprun) Парша яблони: особенности возбудителя и патогенеза // Микология и фитопатология. 2015. Т. 49. № 5. С. 275–285.
Смольякова В.М. (Smolyakova) Болезни плодовых пород юга России. Краснодар: Весть, 2000. 192 с.
Тютерев С.Л. (Tyuterev) Механизмы действия фунгицидов на фитопатогенные грибы. СПб., Нива, 2010. 172 с.
Якуба Г.В. (Yakuba) Экологизированная защита яблони от парши в условиях климатических изменений: Монография. Краснодар: ГНУ СКЗНИИСиВ, 2013. 213 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


