Молекулярная биология, 2019, T. 53, № 2, стр. 349-352
Коррекция биосинтеза белка тесно связана с наличием бесфакторного рибосомного синтеза
А. В. Финкельштейн a, b, *, Л. П. Гаврилова a
a Институт белка Российской академии наук
142290 Московская обл, Пущино, Россия
b Биологический факультет Московского государственного университета
им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: afinkel@vega.protres.ru
Поступила в редакцию 19.07.2018
После доработки 14.08.2018
Принята к публикации 16.08.2018
Аннотация
Несмотря на то, что биосинтез белка изучался в течение десятилетий, все еще возникают некоторые важные вопросы, касающиеся этого процесса. В данной работе выявлена тесная связь между контролем качества синтезируемой рибосомой аминокислотной последовательности при нормальном, зависящем от факторов элонгации биосинтезе белка рибосомой, и существованием бесфакторного процесса синтеза полипептидной цепи на рибосоме: биологическую роль контроля качества играет процесс, обратный бесфакторному присоединению Аа–тРНК к рибосоме – удаление по тому же пути Аа-тРНК, некомплементарной экспонируемому рибосомой кодону мРНК.
Необходимость “контроля качества” (proofreading) синтезируемой аминокислотной последовательности была предсказана еще в 1950-х годах Л. Полингом. Сейчас известно, что такой контроль действует на двух ключевых этапах [1, 2]:
(1) При получении только “правильных” молекул аминоацил-тРНК (Аа-тРНК) путем контроля “зарядки” каждой тРНК соответствующей ей аминокислотой; этот этап, рассмотрен в многочисленных публикациях (см., например, [1, 3, 4]) и нами обсуждаться не будет.
(2) На стадии включения в растущую на рибосоме полипептидную цепь только тех аминокислот, которые строго соответствуют экспонируемым рибосомой кодонам мРНК [2, 5, 6].
В нашей работе будет рассмотрена тесная связь именно второго этапа контроля качества полипептидной цепи с существованием – наряду с классическим биосинтезом in vivo, осуществляемым рибосомой с помощью факторов элонгации (EF-Tu, EF-G) и молекул GTP [1] – возможности бесфакторного синтеза полипептида рибосомой [2, 7‒12].
Точнее, мы рассмотрим связь контроля качества биосинтеза с существованием двух путей посадки Аа-тРНК на экспонируемый рибосомой кодон мРНК (рис. 1): факторзависимого пути, на котором при помощи фактора элонгации Tu (т.е. EF-Tu) расщепляется высокоэнергетическая молекула GTP, стимулирующая ход по этому пути, и бесфакторного, не поддержанного дополнительной свободной энергией гидролиза GTP.
Рис. 1.
Схема двух параллельных путей включения новой, приносимой аминоацил-тРНК (Аа-тРНК) аминокислоты в растущую на рибосоме (Rs) полипептидную цепь. Факторзависимый путь (внизу) поддержан, а бесфакторный (вверху) – не поддержан свободной энергией гидролиза GTP, осуществляемой с помощью фактора элонгации Tu.

Как известно, каждой реакции соответствует обратная ей. Связывание Аа-тРНК с рибосомой в присутствии несущего GTP фактора элонгации Tu практически необратимо, так как оно сопровождается гидролизом GTP, при котором стандартная свободная энергия падает на ≈7 ккал/моль [1] (что много больше характерной энергии спонтанной тепловой флуктуации, kT ≈ 0.6 ккал/моль при комнатной температуре, и это исключает спонтанную обратную реакцию Tu : GDP + P-зависимого распада комплекса Аа-тРНК с рибосомой). Реакция же бесфакторного присоединения Аа-тРНК к рибосоме обратима, так как она не сопровождается столь высокоэнергетическим эффектом (рис. 2).
Рис. 2.
Обратимость бесфакторного пути, не связанного с гидролизом GTP, и вызванная гидролизом GTP необратимость факторного пути присоединения Аа-тРНК к рибосоме.

Более того, если комплекс рибосома : Аа-тРНК нестабилен, то бесфакторный путь является естественным путем его распада.
Поэтому, в принципе, комплекс рибосома : Аа-тРНК может образовываться по факторному пути (что и происходит in vivo), а распадаться (если комплекс рибосома : Аа-тРНК нестабилен) – по бесфакторному.
Распад комплекса рибосома : Аа-тРНК по бесфакторному пути не происходит, когда Аа-тРНК комплементарна экспонируемому рибосомой кодону мРНК, т.е. сильно связана с ним. Но связывание рибосомы (и сидящей на ней мРНК) с Аа-тРНК, не комплементарной экспонируемому рибосомой кодону мРНК, значительно слабее. И такой некомплементарный комплекс рибосомы с Аа-тРНК может с высокой вероятностью распадаться по бесфакторному пути (рис. 3). Это должно приводить к уменьшению скорости включения не кодируемых мРНК аминокислот в синтезируемый полипептид и, как следствие, к резкому уменьшению числа ошибок трансляции. Оба эти явления наблюдаются на опыте [13, 14].
Рис. 3.
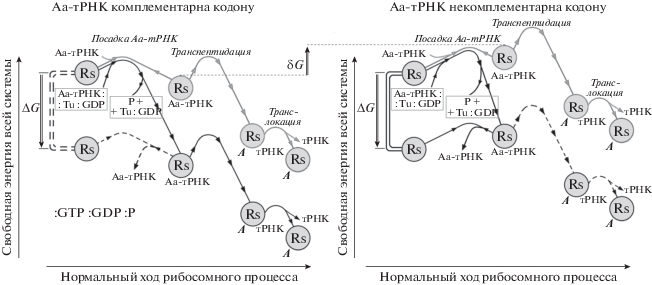
Схема изменения свободной энергии при бесфакторном (серая сплошная линия) и факторзависимом (черная сплошная линия) синтезе полипептида. Пунктирные черные линии показывают менее вероятные (из-за более высоких свободно-энергетических барьеров), но все же возможные пути реакции. Двойной линией показано замыкание футильного цикла. δG – разность свободных энергий между связыванием рибосомой (и мРНК) некомплементарной и комплементарной Аа-тРНК. ∆G – свободная энергия распада комплекса Аа-тРНК : Tu : GTP на Аа-тРНК + Tu : GDP + P. А – аминокислотный остаток, принесенный Аа-тРНК и включенный в растущий пептид.
Следует заметить, что факторзависимое формирование комплекса Аа-тРНК : Rs (и для комплементарной, и для некомплементарной Аа-тРНК) и последующее бесфакторное исторжение некомплементарной Аа-тРНК были отмечены еще Хопфилдом [5]. Селективность этих процессов была изучена экспериментально [6] и методами молекулярной динамики [15], но связь пути удаления некомплементарной Аа-тРНК с частью пути бесфакторного синтеза полипептида во всех этих работах не рассматривалась.
Таким образом, бесфакторный (не требующий гидролиза GTP) путь присоединения Аа-тРНК к рибосоме играет важную биологическую роль – при его помощи осуществляется редактирование (proofreading) аминокислотной последовательности. Точнее, биологическую роль играет процесс, обратный бесфакторному присоединению Аа-тРНК к рибосоме, – удаление по тому же пути Аа-тРНК, некомплементарной экспонируемому рибосомой кодону мРНК.
При этом (см. рис. 2) появляется возможность возникновения катализируемого рибосомой футильного (т.е. “холостого”, в котором только высвобождается тепловая энергия гидролиза GTP) цикла образования комплекса некомплементарная_Аа-тРНК : Tu : GTP и его распада на части – некомплементарная_Аа-тРНК + Tu : GDP + P. Такой футильный цикл с многократным увеличением расхода GTP при использовании некомплементарных Аа-тРНК обнаружен в работах [16, 17].
Контроль качества растущей аминокислотной последовательности, как показывает рис. 3, может осуществляться как (1) за счет различной скорости посадки на рибосому + мРНК комплементарной и некомплементарной Аа-тРНК, так и, далее (2), за счет отторжения рибосомой + мРНК некомплементарной Аа-тРНК. Первый из этих процессов – факторзависимый, а второй – факторнезависимый, что соответствует результатам, описанным в работе [6].
В заключение отметим, что если бы существовал только один, факторный, путь присоединения Аа-тРНК к рибосоме, то при удалении некомплементарной Аа-тРНК должна была бы синтезироваться GTP из GDP и фосфата, что термодинамически практически невозможно (при заданных концентрациях GDP и фосфата в клетке). Тогда попадание в рибосому некомплементарной Аа-тРНК вело бы к необратимому сбою биосинтеза. Наличие же бесфакторного, не вовлекающего GTP, пути присоединения (а значит, и удаления) Аа-тРНК делает возможным удаление некомплементарной (и потому плохо связанной с рибосомой) Аа-тРНК без синтеза GTP (рис. 3). Так что путь, используемый in vivo для предотвращения ошибок биосинтеза, может использоваться in vitro для бесфакторного (точнее, без–EF-Tu) синтеза полипептидов.
Авторы благодарят А.С. Спирина и В.И. Агола за критическое чтение рукописи.
Работа выполнена при поддержке Российского научного фонда (№ 14–24–00157).
Список литературы
Fersht A. (2017) Structure and Mechanism in Protein Science: A Guide to Enzyme Catalysis and Protein Folding. NJ: World Scientific.
Spirin A.S. (1999) Ribosomes. New York: Kluwer Acad. Publ./Plenum Press.
Moras D. (2010) Proofreading in translation: Dynamics of the double-sieve model. Proc. Natl. Acad. Sci. USA. 107, 21949‒21950.
Hussain T., Kamarthapu V., Kruparani S.P., Desh-mukh M.V., Sankaranarayanan R. (2010) Mechanistic insights into cognate substrate discrimination during proofreading in translation. Proc. Natl. Acad. Sci. USA. 107, 22117‒22121.
Hopfield J.J. (1974) Kinetic proofreading: a new mechanism for reducing errors in biosynthetic processes requiring high specificity. Proc. Natl. Acad. Sci. USA. 71, 4135‒4139.
Leong K.-W., Uzun Ü., Selmer M., Ehrenberg M. (2016) Two proofreading steps amplify the accuracy of genetic code translation. Proc. Natl. Acad. Sci. USA. 113, 13744‒13749.
Pestka S. (1968) Studies on the formation of transfer ribonucleic acid–ribosome complexes. III. The formation of peptide bonds by ribosomes in the absence of supernatant enzymes. J. Biol. Chem. 243, 2810‒2820.
Pestka S. (1969) Studies on the formation of transfer ribonucleic acid–ribosome complexes. VI. Oligopeptide synthesis and translocation on ribosomes in the presence and absence of soluble transfer factors. J. Biol. Chem. 244, 1533‒1539.
Гаврилова Л.П., Смолянинов В.В. (1971) Изучение механизма транслокации в рибосоме. I. Синтез полифенилаланина в рибосомах E. coli без участия GTP и белковых факторов трансляции. Молекуляр. биология. 5, 883‒891.
Gavrilova L.P., Spirin A.S. (1971) Stimulation of “non-enzymic” translocation in ribosomes by p-chloromercuribenzoate. FEBS Lett. 17, 324‒326.
Lucas–Lenard J., Lipmann F. (1971) Protein biosynthesis. Annu. Rev. Biochem. 40, 409‒448.
Gavrilova L.P., Spirin A.S. (1972) A modification of the 30S ribosomal subparticle is responsible for stimulation of “non-enzymatic” translocation by p-chloromercuribenzoate. FEBS Lett. 22, 91‒92.
Gavrilova L.P., Rutkevitch N.M. (1980) Ribosomal synthesis of polyleucine on polyuridylic acid as a template: contribution of the elongation factors. FEBS Lett. 120, 135‒140.
Gavrilova L.P., Perminova I.N., Spirin A.S. (1981) Elongation factor Tu can reduce translation errors in poly(U)-directed cell-free systems. J. Mol. Biol. 149, 69‒78.
Noel J.K., Whitford P.C. (2016) How EF-Tu can contribute to efficient proofreading of aa-tRNA by the ribosome. Nat. Commun. 7, 13314.
Gavrilova L.P., Kakhniashvili D.G., Smailov S.K. (1984) Stoichiometry of GTP hydrolysis in a poly(U)-dependent cell-free translation system. Determination of GTP/peptide bond ratios during codon-specific elongation and misreading. FEBS Lett. 178, 283‒287.
Kakhniashvili D.G., Smailov S.K., Gavrilova L.P. (1986) The excess GTP hydrolyzed during mistranslation is expended at the stage of EF-Tu-promoted binding of non-cognate aminoacyl-tRNA. FEBS Lett. 196, 103‒107.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


