Молекулярная биология, 2019, T. 53, № 2, стр. 339-348
Эпигенетические механизмы пептидной регуляции и нейропротекторный белок FKBP1b
Б. И. Кузник a, b, С. О. Давыдов a, b, Е. С. Поправка c, Н. С. Линькова c, d, *, Л. С. Козина c, В. Х. Хавинсон c, e
a Читинская государственная медицинская академия
672090 Чита, Россия
b Инновационная клиника Академия здоровья
672000 Чита, Россия
c Санкт-Петербургский институт биорегуляции и геронтологии
197110 Санкт-Петербург, Россия
d Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
e Институт физиологии им. И.П. Павлова Российской академии наук
199034 Санкт-Петербург, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 02.05.2018
После доработки 11.06.2018
Принята к публикации 11.06.2018
Аннотация
Кортексин ‒ полипептидный комплекс коры головного мозга телят, прошедший клинические испытания. Механизм действия кортексина в настоящее время изучен недостаточно. Синтезированы два производных кортексина – короткие пептиды EDR и DS, обладающие нейропротекторной активностью. По данным молекулярного моделирования эти пептиды способны связываться с гистоновым белком H1.3. Это может повлиять на конформацию гистона H1.3, что приведет к изменению структуры хроматина в локусах некоторых генов, в частности Fkbp1b, кодирующего FK506-связывающий белок. При старении головного мозга в пирамидных нейронах гиппокампа нарушаются электрофизиологические процессы, сопряженные с обменом Ca2+. Ген Fkbp1b кодирует пептидилпролил-цис-транс-изомеразу, регулирующую выделение ионов кальция из саркоплазматического и эндоплазматического ретикулума нейронов. Активация транскрипции гена Fkbp1b под действием коротких пептидов может способствовать синтезу его белкового продукта и активации выделения Ca2+ из органелл саркоплазматического и эндоплазматического ретикулума нейронов, что, в свою очередь, может вести к повышению функциональной активности нейронов.
В течение 1973‒2017 гг. из организма телят нами были выделены более 20 физиологически активных полипептидных комплексов, а затем на их основе созданы 17 коротких пептидов, запатентованных во многих странах мира (США, Канада, Австралия, Европа, Япония, Корея, Израиль и др.) [1, 2]. Проведены клинические испытания полипептидных комплексов тимуса, эпифиза, головного мозга (кортексина), предстательной железы и сетчатки [3, 4]. На основе полипептидного комплекса тимуса синтезирован дипептид EW, регулятор иммунитета, который также успешно прошел клинические испытания [1]. При аминокислотном анализе кортексина найдено несколько коротких пептидов, обладающих нейропротекторными свойствами, в частности пинеалон (EDR) и Asp-Ser (DS). Нейропротекторные свойства пептидов EDR и DS изучали в основном на животных и клеточных культурах, однако в настоящее время молекулярный механизм их действия выяснен не до конца. В представленной работе методом молекулярного моделирования показано, что пептиды EDR и DS способны связываться с гистоновым белком H1.3. Такое взаимодействие может привести к изменению конформации гистона, что повлечет за собой изменение хроматина в локусах некоторых генов, в частности Fkbp1b, кодирующего FK506-связывающий белок.
ПЕПТИДНЫЕ НЕЙРОПРОТЕКТОРЫ
Пинеалон ‒ нейропротекторный пептид Glu-Asp-Arg с молекулярной массой около 418 Да [5]. В клиническом исследовании 72 пациента 30–74 лет с последствиями черепно-мозговой травмы и церебрастенией в дополнение к стандартной терапии ежедневно в течение 20–30 дней получали перорально пептид EDR. Отмечено улучшение памяти, снижение длительности и интенсивности головных болей, а также появление эмоциональной уравновешенности. У пациентов с последствиями черепно-мозговой травмы наблюдали регресс очаговой симптоматики и улучшение речевой функции при моторной и сенсорной афазии. У пациентов с церебрастенией под влиянием пептида EDR уменьшалось число ошибок при выполнении корректурной работы, повышался интегральный показатель работоспособности [6].
Пероральное применение пептида EDR для коррекции психоэмоционального и функционального состояния ЦНС у 75 лиц пожилого возраста привело к повышению кратковременной и долговременной памяти, а также к снижению индекса тяжести состояния [7].
Влияние пептида EDR на функциональную активность ЦНС изучено также на крысах с экспериментальной пренатальной гипергомоцистеинемией. Известно, что индукция окислительного стресса in vivo сопряжена с повышением содержания гомоцистеина в крови животных, со снижением когнитивных способностей и нарушениями глутаматергической системы мозга. Внутримышечное введение пептида EDR способствовало улучшению пространственной ориентации и обучаемости потомства крыс в тесте “водный лабиринт Морриса”. Можно полагать, что защитное действие трипептида связано с его способностью подавлять накопление активных форм кислорода (АФК) в нейронах, повышая их устойчивость к окислительному стрессу и предотвращая взаимодействие гомоцистеина и его производных с рецепторами глутамата [8]. Оценено также влияние пептида EDR на активацию МАР-киназы в культурах гранулярных клеток мозжечка. Профиль активации МАР-киназы определяет, какие гены, связанные с адаптацией или апоптозом, будут экспрессироваться в данный период времени. Добавление трипептида в культуры клеток приводило к удлинению лаг-периода активации МАР-киназы, что можно рассматривать как защиту от токсического действия гомоцистеина [9, 10].
Обнаружена способность пептида EDR восстанавливать морфологию шипиков в нейронах стриатума мышей, на которых моделировали болезнь Хантингтона [11]. Кроме того, в первичной культуре нейронов гиппокампа мышей в условиях амилоидной синаптотоксичности (модель болезни Альцгеймера) пептид EDR в концентрации 200 нг/мл повышал количество грибовидных шипиков нейронов на 71%, доводя их содержание до нормального уровня [12].
Пептид DS (Asp-Ser) нормализует среднесрочную память и способность мух линии agnts3 Drosophila melanogaster к обучению. У мух этой линии мутирован ген limk1, кодирующий ключевой фермент ремоделирования актина (LIMK1), нарушение синтеза которого приводит к развитию болезни Паркинсона. Таким образом, пептид DS может изучаться на моделях болезни Паркинсона и других нейродегенеративных заболеваний.
В органотипической культуре ткани сетчатки цыплят и крыс мишенью пептида DS служат белки Brn3 (дифференцировка ганглиозных клеток сетчатки), Pax6 (начальные стадии дифференцировки клеток сетчатки), Math1 (дифференцировка амакриновых нейронов сетчатки), TTR (транс-тиретин – маркер пигментного эпителия сетчатки), Prox1 (дифференцировка амакриновых и ганглиозных нейронов сетчатки), Ki67 (пролиферативный белок). Пептид DS стимулирует синтез белков Brn3, Pax6, Math1, TTR, Prox1, CXCL12, Ki67 и снижает синтез проапоптотического белка р53 в ткани сетчатки. Таким образом, пептид DS стимулирует пролиферацию, дифференцировку, функциональную активность, снижает уровень апоптоза клеток пигментного эпителия и нейронов в органотипической культуре ткани сетчатки.
Данная работа направлена на проверку предположения о возможной связи нейропротекторного действия перечисленных пептидов с их воздействием на экспрессию гена Fkbp1b, продукт которого способствует восстановлению функции кальциевых каналов нейронов головного мозга.
Мы предположили, что пептиды EDR и DS влияют на экспрессию гена Fkbp1b. Показано, что короткие биологически активные пептиды, в том числе EDR, связываются с FITC-мечеными гистонами пшеницы. В случае гистона Н1 пептиды связываются с N-концевыми областями гистонов, которые содержат гомологичные пептидсвязывающие мотивы. Связывание пептидов с гистонами и комплексами гистон-дезоксирибоолигонуклеотид зависит от природы гистона, первичной структуры пептида и олигонуклеотида, т.е. существует сайт-специфическое взаимодействие коротких пептидов с гистонами и комплексами гистон-олигонуклеотид. Гистон Н1 предпочтительно связывается с одноцепочечными олигонуклеотидами через гомологичные участки в С-концевой области белка. В отличие от гистона Н1 коровые гистоны связываются преимущественно с двухцепочечными метилированными олигонуклеотидами и метилированной ДНК. Величины констант Штерна‒Фольмера взаимодействия гистонов Н1 и кор-гистонов с двухцепочечными полуметилированными олигонуклеотидами выше, чем с неметилированными. ДНК или дезоксирибоолигонуклеотиды в составе комплекса с гистонами могут усиливать или препятствовать связыванию пептидов. Предполагается, что сайт-специфические взаимодействия коротких биологически активных пептидов с гистонами в составе хроматина могут служить контрольным механизмом регуляции активности генов и клеточной дифференцировки [13].
Для подтверждения этого предположения с помощью методов молекулярного докинга и минимизации геометрии с использованием программного обеспечения Molecular Operating Environment 2016.08 нами определены специфические сайты связывания гистонов, с которыми взаимодействуют короткие пептиды EDR и DS.
МЕТОДОЛОГИЯ АНАЛИЗА ГИСТОН‒ПЕПТИДНЫХ ВЗАИМОДЕЙСТВИЙ
Расчет пространственной конформации ди-, три- и тетрапептидов проводили методом молекулярной механики. Данный подход позволяет вычислять потенциальную энергию заданной системы по закону Гука: атомы в молекуле рассматривали как упругие шарики различных размеров (по типу атома), соединенные пружинками различной длины. Пептиды строили в левовращающей конформации. В расчетах полную энергию минимизировали относительно начала координат:
Угловые деформации описывали уравнением:
Где kθ ‒ силовая константа деформации валентных углов; θ0 ‒ равновесное значение валентного угла; θ ‒ текущее значение валентного угла.Вклад в потенциальную энергию вращения вокруг двугранных углов рассчитывали с использованием уравнения:
где kφ ‒ торсионный барьер (барьер вращения); φ ‒ текущее значение торсионного угла; n – период (число минимумов энергии на один полный цикл); φ0 ‒ стандартное значение торсионного угла.Вандерваальсовы взаимодействия между непосредственно связанными атомами обычно выражаются потенциалом Леннард-Джонса:
Электростатические силы описываются функцией, представляющей собой выражение для кулоновского взаимодействия:
где ε ‒ диэлектрическая проницаемость; Q1 и Q2 ‒ заряды на взаимодействующих атомах; d – межатомное расстояние.При расчете конформаций молекулы важной задачей было правильное определение силового поля [14]. Существует несколько способов задания силового поля: MMFF94x, Amber12EHT, BIO+, OPLS, каждый из которых различается степенью возможных приближений и допущений. При использовании поля MMFF94x учитываются потенциальные поля, формируемые всеми атомами молекулярной системы. Метод обеспечивает достаточно высокую точность и подходит для малых молекул. Amber12EHT – это полноатомное силовое поле, разработанное для расчета конформаций белков, нуклеиновых кислот и малых молекул [15]. В данной работе конформации молекул коротких пептидов рассчитывали с использованием силового поля Amber12EHT. После построения компьютерных моделей пептидов важным этапом была геометрическая оптимизация их структур путем минимизации энергии методами скорейшего спуска и сопряженных градиентов. Метод скорейшего спуска основан на постепенном сдвиге атомов молекулы пептида вдоль координатных осей для нахождения нового положения с более низкой потенциальной энергией. Когда заданное условие энергетического минимума достигнуто, минимизация прекращается. Этот метод используется для структур, находящихся вдали от энергетического минимума. Для более точного расчета используется метод сопряженных градиентов, основная идея которого заключается в постепенном накоплении информации о минимизированной функции от итерации к итерации. Также учитывается градиент энергии на каждой стадии минимизации, который далее используется в качестве дополнительной информации для расчета нового вектора направления процедуры минимизации. Так, каждая последующая стадия непрерывно уточняет направление к минимуму.
Молекула, полученная после геометрической оптимизации, имеет множество изомеров, которым соответствуют различные значения энергии. Важной задачей является поиск наиболее энергетически выгодных изомеров молекулы, которые имеют схожие значения полной потенциальной энергии (Etot) в пределах определенных минимумов.
В нашей работе конформационный поиск проводили с использованием методов молекулярной динамики, цель которых – воспроизведение движения молекулы в заданный интервал времени, в данном случае 1 фс. Метод основан на классическом уравнении движения Ньютона:
где Fi(t) ‒ сила, действующая на атом i в момент времени t; mi ‒ масса i-го атома; ai(t) ‒ ускорение атома i в момент времени t.На заключительном этапе конформационного поиска оценили физико-химические особенности конформеров пептидов, рассчитали длину пептидной цепи молекулы, заряды и среднюю потенциальную энергию. Поскольку в работе исследовали пептиды, состоящие из четырех аминокислотных остатков, измеряли только три торсионных угла. Число найденных конформаций в пептидах показало насколько молекулы пространственно стабильны или нестабильны. Предполагалось, что энергетически наиболее выгодные стереоизомеры молекул обладают биологической активностью и именно в такой конформации выполняют свои функции.
Для построения компьютерной модели взаимодействия пептидов с гистонами пшеницы необходимо создать их гомологичные модели, так как пространственные структуры гистонов пшеницы ранее не были расшифрованы. Для создания таких моделей гистонов H1, H2b, H3 и H4 использовали их структуры из базы данных белковых структур (Protein Data Bank, PDB) 5NL0, цепь Z; 1KX5 цепь A и цепь H; 1EQZ, цепь D.
В таблице представлены аминокислотные последовательности гистонов пшеницы и соответствующие им последовательности гистонов, полученные из базы данных PDB.
Таблица 1.
Аминокислотные последовательности гистонов
| Гистон пшеницы Triticum aestivum, FASTA | Структура из PDB и ее аминокислотная последовательность, использованная для построения гомологичных моделей гистонов, FASTA | Идентичность исходной последовательности и шаблона, % |
|---|---|---|
| >H1.1 MSTDVVADVPAPEVAAAADPVVE TTAEPAAGDANAAKETKAKAAKA KKPSAPRKPRAAPAHPTYAEMVSE AITALKERTGSSPYAIAKFVEDKH KAHLPANFRKILSVQLKKLVASG KLTKVKASYKLSAAAAKPKPAAK KKPAAKKKAPAKKTATKTKAKAP AKKSAAKPKAKAPAKTKAAAKPK AAAKPKAKAPAKTKAAAKPKAAA KPKGPPAKAAKTSAKDAPGKNAG AAAPKKPAARKPPTKRSTPVKKAA PAKKAAPAKKAPAAKKAKK |
>5NL0_Z HPKYSDMILAAVQAEKSRS GSSRQSIQKYIKNHYKVGEN ADSQIKLSIKRLVTSGALKQ TKGVGASGSFRLAK |
34 |
| >H1.3 MSTEVAAADIPVPQVEVAADAAVD TPAANAKAPKAAKAKKSTGPKKPR VTPAHPSYAEMVSEAIAALKERSGS STIAIGKFIEDKHKAHLPANFRKI LLTQIKKLVAAGKLTKVKGSYKL AKAPAAVKPKTATKKKPAAKPKA KAPAKKTAAKSPAKKAAAKPKAK PAKAKAVAKPKAAAKPKAAAKP KAKAAAKKAPAAATPKKPAARKPP TKRATPVKKAAPAKKPAAKKAKK |
>5NL0_Z HPKYSDMILAAVQAEKSRS GSSRQSIQKYIKNHYKVGEN ADSQIKLSIKRLVTSGALKQ TKGVGASGSFRLAK |
36 |
| >H1.6 PVPQVEVAADAAVDTPAASAKAPK AAKAKKSTGPKKPRVTPAHPSYAE MVSEAIAALKERSGSSTIAIAKFIE DKHKAHLPANFRKILLTQIKKLV AAGKLTKVKGSYKLAKAPAAVK PKTATKKKPAAKPKAKAPAKKTAA KSPAKKAAAKPKAKAPAKAKAVA KPKAASKPKAAAKPKAKAAAKKA PAAATPKKPAAARKPPTKRATPVK KAAPAKKPAAKKAKK |
>5NL0_Z HPKYSDMILAAVQAEKSRS GSSRQSIQKYIKNHYKVGEN ADSQIKLSIKRLVTSGALKQ TKGVGASGSFRLAK |
36 |
| >H2b MAPKAAKKPAAKKPAEEEPAAEK AEKTPAGKKPKAERRIPAGKSAA KAGGDKKGKKKAKKSVETYKKY IFKVIKQVHPDIGISSKAMSIMNSF INDIFEKLAGEAAKIARYNKKPYI TSREIQTSVRLVLPGELAKHAVSE GTKAVTKFTSAS |
>1KX5_H PEPAKSAPAPKKGSKKAVT KTQKKDGKKRRKTRKESY AIYVYKVLKQVHPDTGISSK AMSIMNSFVNDVFERIAGEA SRLAHYNKRSTITSREIQTA VRLLLPGELAKHAVSEGTK AVTKYTSAK |
65 |
| > H3 ARTKQTARKSTGGKAPRKQLAT KAARKSAPATGGVKKPHRERPG TVALREIRKYQKSTELLIRKLPFQ RLVREIAQDFKTDLRFQSSAVAAL QEAAEAYLVGLFEDTNLCAIHAK RVTIMPKDIQLARRIRGERA |
>1KX5_A ARTKQTARKSTGGKAPRKQ LATKAARKSAPATGGVKKP HRYRPGTVALREIRRYQKS TELLIRKLPFQRLVREIAQD FKTDLRFQSSAVMALQEAS EAYLVALFEDTNLCAIHAKR VTIMPKDIQLARRIRGERA |
96 |
| > H4 SGRGKGGKGLGKGGAKRHRKVL RDNIQGITKPAIRRLARRGGVKRI SGLIYEETRGVLKIFLENVIRDAV TYTEHARRKTVTANDVVYALKR QGRTLYGFGG |
>1EQZ_D GAKRHRKVLRDNIQGITKP AIRRLARRGGVKRISGLIYE ETRGVLKVFLENVIRDAVTY TEHAKRKTVTAMDVVYAL KRQGRTLYGFGG |
97 |
Примечание. Жирным шрифтом выделены аминокислотные последовательности гистонов с расшифрованной вторичной структурой, взятой из PDB. Идентичность последовательностей рассчитывали с помощью программы BLASTp (https://blast.ncbi.nlm.nih.gov).
Для построения моделей гистонов использовали метод гомологического моделирования, который позволяет оценивать степень гомологии первичной структуры исследуемых белков с трехмерными структурами из базы данных PDB, расшифрованными с помощью рентгеноструктурного анализа или ядерно-магнитного резонанса.
Активные сайты связывания пептидов в молекулах гистонов находили по методу Edelsbrunner [16]. Этот метод основан на поиске энергетически наиболее предпочтительных участков связывания пептида, выделенных в структуре гистона альфа-сферами. Этот метод позволяет определить регионы жесткой атомной упаковки, но не учитывает сайты, “слишком подверженные” растворителю (сайты, находящиеся на поверхности молекулы). Найденные сайты ранжировали по склонности к связыванию лиганда (PLB), основанной на аминокислотном составе кармана [16, 17].
Докинг ‒ компьютерное моделирование взаимодействий между лигандом (пептидом) и активным сайтом рецептора (гистона). Метод докинга включает подстановку лиганда в различных конформациях в сайт связывания, а также расчет оптимальной взаимной ориентации молекул пептида и гистона при их связывании и энергии связи (ккал/моль). Использовали “полугибкий” докинг, где учитывали конформационную подвижность только пептида, а боковые группы гистонов были жесткими. При расчете оптимальных пространственных конформаций взаимодействия пептидов и гистонов учитывали площадь контакта, число водородных связей, параметры гидрофобных и электростатических взаимодействий. Использовали силовое поле Amber12EHT и генетический алгоритм поиска GBVI/WSA. Решения докинга ранжировали по величинам оценочной функции (∆G), которую рассчитывали по следующей формуле:
Решения докинга ранжировали по убыванию от энергетически наиболее выгодного до наименее выгодного. После анализа данных докинга подбирали энергетически наиболее выгодный комплекс пептида и гистона.
Модуль Ligand Interactions, предоставляющий возможность визуализировать активный сайт комплекса в виде диаграммы, реализован в программе Molecular Operating Environment 2016. Аминокислотные остатки в активном сайте идентифицируют в два этапа: (1) аминокислоты рецептора, ионы и молекулы растворителя, которые сильно взаимодействуют с лигандом (взаимодействия при образовании водородной связи); (2) аминокислоты рецептора и ионы, которые близки к лиганду, но их взаимодействия с лигандом слабые или диффузные, такие как коллективные гидрофобные или электростатические взаимодействия.
РЕЗУЛЬТАТЫ АНАЛИЗА ГИСТОН-ПЕПТИДНЫХ ВЗАИМОДЕЙСТВИЙ
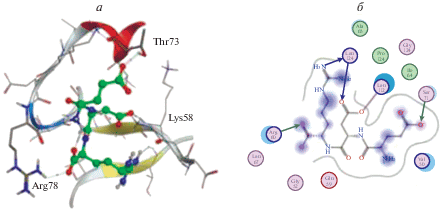
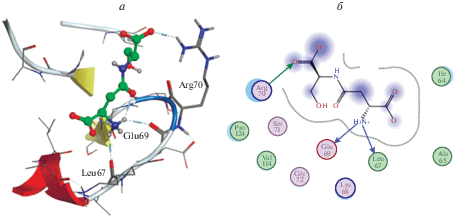
В нашей работе пептиды связывались преимущественно с гистонами H1.1, H1.3 и H1.6 в участке, образованном остатками Tyr, His, Arg и Lys, локализованными в петлях. На рис. 1 и 2 показаны энергетически наиболее выгодные варианты гистон‒пептидных взаимодействий.
Нами показано, что пептиды предпочтительно связываются с гистонами по сайтам, богатым положительно заряженными остатками аргинина и лизина, которые в большом количестве содержатся в N-концевых участках гистонов. Мы предполагаем, что в этих сайтах происходит конкурентное связывание пептидов и других регуляторных факторов с гистонами. В связи с этим предполагается, что связывание пептида с гистонами может служить дополнительным механизмом, через который реализуется биологический эффект.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изменение концентрации ионов кальция в нейронах млекопитающих считается признаком старения головного мозга. Дисрегуляцию функций Са2+-зависимых нейронов при старении, во многом связанную с типом клеток и отделом ЦНС, в котором они локализованы, обнаружили еще в прошлом веке [18, 19]. Один из наиболее существенных признаков старения CA1-пирамидных нейронов дорсального гиппокампа, отвечающего за обучение и память, ‒ повышение Ca2+-зависимого потенциала с последующей K+-зависимой медленной гиперполяризацией (sAHP) [20‒22]. Доказано, что sAHP генерируется гиперполяризующими Ca2+-чувствительными K+-каналами, которые активируются Ca2+-индуцированным потенциалом действия и характеризуются выходом Са2+ из рианодинчувствительных (RYR) кальциевых депо [23‒25].
При старении в пирамидных нейронах гиппокампа наблюдается увеличение амплитуды и развитие медленной постгиперполяризации электрофизиологических процессов, связанных с обменом Са2+. Более того, выявлены изменения конформации L-образных рианодиновых Са2+-каналов, коррелирующие со снижением пластичности нейронов, что сопровождается нарушением процессов обучения и запоминания [26, 27]. Обнаружено также возрастное снижение экспрессии гена, кодирующего FK506-связывающий белок 12.6/1b (FKBP1b, пептидилпролил-цис-транс-изомераза, ингибирующая выход Ca2+ из RyR-каналов саркоплазматического и эндоплазматического ретикулума нейронов) [28]. Белки FKBP1a/1b, или FKBP12/12.6 относятся к классу иммунофилинов, связывающих иммунодепрессант рапамицин. В мышечных клетках FKBP1a/1b также взаимодействует с RyR и препятствует выходу Ca2+ [22]. При старении в нейронах гиппокампа снижается синтез белка FKBP1b, тогда как синтез RyR2 и FRAP/mTOR (мишень рапамицина) активируется [22]. Нарушение функции белка FKBP1b, дестабилизирующее гомеостаз Ca2+ в нейронах гиппокампа, приводит к появлению признаков старения ЦНС у молодых животных. Подавление активности гена Fkbp1b в нейронах гиппокампа молодых крыс усиливает ток Ca2+, что нарушает возбудимость клеток, вызывая ускоренное старение нервной системы [29, 30].
Цитоплазматический белок FKBP1a является рецептором иммунодепрессанта рапамицина, применяемого для подавления реакции отторжения при трансплантации. Рапамицин предотвращает активацию T- и B-клеток интерлейкином-2 (IL-2) и широко используется при стентировании [31]. На мышиных моделях показана эффективность рапамицина при аутоиммунных заболеваниях [32]. Рапамицин связывается с белком FKBP1a, после чего комплекс (FKBP1a)/рапамицин распознает домен FRB (Rapamycin Binding domain) mTOR и ингибирует комплекс 1 mTOR (mTORC1). Связывание рапамицина с белком FKBP1a приводит к дестабилизации mTORC1 [33], который регулирует аутофагию, рост и выживание клеток. Рапамицин подавляет также реакцию на IL-2, благодаря чему препятствует развитию иммунного ответа.
Рапамицин вытесняет белок FKBP1b из RyR в миоцитах, увеличивает sAHP, а также повышает высвобождение Ca2+. Более того, нокаут FKBP1b in vivo ассоциирован с повышением синтеза RyR2 и mTOR, связанных с регуляцией трансляции белков, отвечающих за пролиферацию. Таким образом, нарушение функции FKBP1b может ускорить процесс старения, влияя на регуляцию работы Са2+-каналов в нейронах гиппокампа [29, 30, 34].
Селективное нарушение функции белка FKBP1b в нейронах гиппокампа молодых крыс, вызванное микроинъекцией векторов на основе аденоассоциированных вирусов, экспрессирующих малые интерферирующие РНК к FKBP1b, или введением рапамицина, увеличивает sAHP и способствует Ca2+-дисрегуляции гиппокампа. Более того, экспрессия гена Fkbp1b снижена в гиппокампе крыс с ранней стадией болезни Альцгеймера. Все это позволяет предположить, что снижение экспрессии FKBP1b можно рассматривать как ключевой фактор, связанный со старением и развитием нейродегенеративных заболеваний, обусловленных нарушением кальциевой сигнализации в нейронах головного мозга, и как новую терапевтическую мишень [30].
Показано, что cверхэкспрессия белка FKBP1b в гиппокампе предупреждает вызванное старением снижение памяти и дисфункцию Ca2+-зависимых нейронов. Чтобы установить это, вставить в гиппокамп 13- и 19-месячных самцов крыс вводили вектор, экспрессирующий Fkbp1b. Когда животные достигали возраста 21 мес., оценивали их работоспособность и состояние памяти в водном лабиринте Морриса [35]. Оказалось, что повышение активности FKBP1b сопровождается улучшением пространственной памяти у старых крыс. Они выбирали более короткий путь для выхода из водного лабиринта и делали это быстрее, чем контрольные крысы, которым вводили ген зеленого флуоресцентного белка. После этого сравнивали изменение экспрессии 2342 генов в клетках гиппокампа старых и молодых животных. Полученные результаты позволили сделать вывод о том, что старение нервной системы коррелирует со снижением экспрессии гена Fkbp1b. Гены, экспрессия которых снижается при старении и восстанавливается при активации гена Fkbp1b, связаны преимущественно с различными структурами нейронов, включая цитоскелет и мембранные каналы. Напротив, гены, активность которых усиливается при старении и не восстанавливается при активации гена Fkbp1b, связаны прежде всего с нарушением функций рибосом и лизосом глии. Восстановление структуры микротрубочек нейронов подтверждено иммуногистохимическими методами. По-видимому, в гиппокампе и других структурах головного мозга, ответственных за поведение, кратковременную и долговременную память, существует сеть генов, модулирующих функции нейронов. При старении в этой сети развиваются дисрегуляторные процессы, приводящие к нарушениям памяти, которые можно восстановить с помощью сверхэкспрессии Fkbp1b [35].
Согласно нашей гипотезе, пептиды EDR и DS, проникая в ядро и ядрышко [36], способны связываться с гистоном H1.3, что должно привести к изменению конформации гистона и повлечь за собой изменение доступности генов, в частности Fkbp1b, для транскрипции. В свою очередь, активация транскрипции Fkbp1b должна способствовать синтезу белка FKBP1b и активации выхода Ca2+ из саркоплазматического и эндоплазматического ретикулума нейронов, что приведет к нормализации функциональной активности нейронов. В пользу этой гипотезы свидетельствуют нейропротекторные эффекты пептидов EDR и DS [1‒3, 5‒13, 36]. Эта гипотеза нуждается в экспериментальном подтверждении, которое мы предполагаем получить в дальнейших исследованиях.
Работа выполнена за счет благотворительных взносов, полученных Санкт-Петербургским институтом биорегуляции и геронтологии.
Авторы заявляют об отсутствии потенциального конфликта интересов.
Список литературы
Anisimov V.N., Khavinson V.Kh. (2010) Peptide bioregulation of aging: results and prospects. Biogerontology. 11(2), 139‒149.
Хавинсон В.Х. (2014) Пептиды, геном, старение. Успехи геронтологии. 27(2), 257‒264.
Хавинсон В.Х., Куник Б.И., Рыжак Г.А. (2012) Пептидные биорегуляторы – новый касс геропротекторов. Сообщение 1. Результаты экспериментальных исследований. Успехи геронтологии. 25(4), 696‒708.
Хавинсон В.Х., Коркушко О.В., Шатило Б.В., Антонюк-Щеглова И.А. (2011) Пептидный геропротектор из эпифиза замедляет ускоренное старение пожилых людей: результаты 15-летнего наблюдения. Бюл. эксп. биологии медицины. 151(3), 366‒369.
Khavinson V.Kh., Grigoriev E.I., Malinin V.V., Ryzhak G.A. (2008) Peptide stimulating neurones regeneration, pharmacological substance based thereon and method of its application: Eurasia Patent. EA 010157.
Морозов В.Г., Рыжак Г.А., Малинин В.В., Рутковская В.Н. (2011) Цитогены. Биологически активные добавки к пище: Метод. рекомендации. СПб.: Коста.
Балашова С.Н., Жернаков Г.Л., Дудков А.В. (2008) Применение пептидных биорегуляторов у лиц пожилого возраста с нарушениями психоэмоционального состояния. Успехи геронтологии. 3(21), 448–452.
Arutjunyan A., Kozina L., Stvolinskiy S. (2012) Pinealon protects the rat offspring from prenatal hyperhomocysteinemia. Int. J. Clin. Exper. Med. 2(5), 179–185.
Khavinson V., Ribakova Y., Kulebiakin K. (2011) Pinealon increases cell viability by supression of free radical levels and activating proliferative processes. Rejuvenation Res. 5, 535–541.
Умнов Р.С., Линькова Н.С., Хавинсон В.Х. (2013) Нейропротекторные эффекты пептидных биорегуляторов у людей разного возраста: обзор литературы. Успехи геронтологии. 4(26), 671‒678.
Khavinson V., Linkova N., Kukanova E., Bolshakova A., Gainullina A., Tendler S., Morozova E., Tarnovskaya S., Vinski D.S.P., Bakulev V., Kasyanenko N. (2017) Neuroprotective effect of EDR peptide in mouse model of Huntington’s disease. J. Neurol. Neurosci. 1(8), 1‒11.
Красковская Н.А., Куканова Е.О., Линькова Н.С., Попугаева Е.А., Хавинсон В.Х. (2017) Трипептиды восстанавливают количество шипиков нейронов в модели болезни Альцгеймера in vitro. Клеточные технологии в биологии и медицине. 2, 101‒104.
Федореева Л.И., Смирнова Т.А., Коломийцева Г.Я., Хавинсон В.Х., Ванюшин Б.Ф. (2013) Взаимодействие коротких пептидов с FITC-мечеными гистонами пшеницы и их комплексами с дезоксирибоолигонуклеoтидами. Биохимия. 2(78), 230‒242.
Labute P. (2010) LowModeMD ‒ Implisit Low-Mode velosity filtering applied to conformational search of macrocycles and protein loops. J. Chem. Inf. Model. 50, 792‒800.
Case D.A., Darden T.A., Cheatham T.E. (2012) AMBER 12, University of California, San Francisco.
Edelsbrunner H., Facello M., Fu R., Liang J. (1995) Measuring proteins and voids in proteins. Proc. 28th Hawaii Internat. Conf. on Systems. Science. 256–264.
Soga S., Shirai H., Kobori M., Hirayama N. (2007) Use of amino acid composition to predict ligand-binding sites. J. Chem. Inf. Model. 47, 400‒406.
Khachaturian Z.S. (1989) The role of calcium regulation in brain aging: reexamination of a hypothesis. Aging (Milano). 1, 17–34.
Disterhoft J.F., Thompson L.T., Moyer J.R., Mogul D.J. (1996) Calcium-dependent afterhyperpolarization and learning in young and aging hippocampus. Life Sci. 59, 413–420.
Landfield P.W., Pitler T.A. (1984) Prolonged Ca2+-dependent after hyperpolarization in hippocampal neurons of aged rats. Science. 226, 1089–1092.
Moyer J.R., Thompson L.T., Black J.P., Disterhoft J.F. (1992) Nimodipine increases excitability of rabbit CA1 pyramidal neurons in an age- and concentration-dependent manner. J. Neurophysiol. 68, 2100–2109.
Gant J.C., Sama M.M., Landfield P.W., Thibault O. (2006) Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J. Neurosci. 26, 3482–3490.
Lancaster B., Hu H., Ramakers G.M., Storm J.F. (2001) Interaction between synaptic excitation and slow afterhyperpolarization current in rat hippocampal pyramidal cells. J. Physiol. 536, 809–823.
Andrade R., Foehring R.C., Tzingounis A.V. (2012) The calcium-activated slow AHP: cutting through the Gordian knot. Front Cell Neurosci. 6, 47.
Voglis G., Tavernarakis N. 2006. The role of synaptic ion channels in synaptic plasticity. EMBO Repts. 7, 1104‒1110
Tombaugh G.C., Rowe W.B., Rose G.M. (2005) The slow afterhyperpolarization in hippocampal CA1 neurons covaries with spatial learning ability in aged Fisher 344 rats. J. Neurosci. 25, 2609–2616.
Luebke J.I., Amatrudo J.M. (2012) Age-related increase of sI(AHP) in prefrontal pyramidal cells of monkeys: relationship to cognition. Neurobiol. Aging. 33, 1085–1095.
Zalk R., Lehnart S.E., Marks A.R. (2007) Modulation of the ryanodine receptor and intracellular calcium. Annu. Rev. Biochem. 76, 367–385.
Gant J.C., Chen K.C., Norris C.M., Kadish I., Thibault O., Blalock E.M., Porter N.M., Landfield P.W. (2011) Disrupting function of FK506-binding protein 1b/12.6 induces the Ca2+-dysregulation aging phenotype in hippocampal neurons. J. Neurosci. 5, 1693‒1703.
Gant J.C., Blalock E.M., Chen K.C., Kadish I., Porter N.M., Norris C.M., Thibault O., Landfield P.W. (2014) FK506-binding protein 1b/12.6: a key to aging-related hippocampal Ca2+ dysregulation? Eur. J. Pharmacol. 739, 74‒82.
Anwer H., Vinit K., Rohini P., Hirokuni A., Qi C. (2013) Sirolimus-FKBP12.6 impairs endothelial barrier function through protein kinase C-α activation and disruption of the p120-vascular endothelial cadherin interaction. Arteriosclerosis, Thromb., Vasc. Biol. 10, 2425‒2431.
Prevel N., Allenbach Y., Klatzmann D., Salomon B., Benveniste O. (2013) Beneficial role of rapamycin in experimental autoimmune myositis. PLoS One. 8, 11.
Oshiro N., Yoshino K., Hidayat S., Tokunaga C., Hara K. (2004) Dissociation of raptor from mTOR is a mechanism of rapamycin-induced inhibition of mTOR function. Genes Cells. 4, 359‒366.
Gant J.C., Chen K.C., Kadish I., Blalock E.M., Thibault O., Porter N.M., Landfield P.W. (2015) Reversal of aging-related neuronal Ca2+ dysregulation and cognitive impairment by delivery of a transgene encoding FK506-binding protein 12.6/1b to the hippocampus. J. Neurosci. 35, 30.
Gant J.C., Blalock E.M., Chen K.C., Kadish I., Thibault O., Porter N.M., Landfield P.W. (2017) FK506-binding protein 12.6/1b, a negative regulator of [Ca2+], rescues memory and restores genomic regulation in the hippocampus of aging rats. Neurosci. 17, 22‒34.
Федореева Л.И., Киреев И.И., Хавинсон В.Х., Ванюшин Б.Ф. (2011) Проникновение коротких флуоресцентно меченных пептидов в ядро в клетках HeLa и специфическое взаимодействие пептидов с дезоксирибоолигонуклеотидами и ДНК in vitro. Биохимия. 11(76), 1505–1516.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология