Молекулярная биология, 2019, T. 53, № 2, стр. 290-302
Рецептор интерлейкина-1 второго типа (IL-1R2) пятнистого палтуса (Verasper variegatus): пространственная структура и роль в иммунном ответе
Z. Li a, b, *, X. M. Liu b, A. Y. Li b, X. X. Du b, X. B. Wang b, J. X. Liu b, Z. G. Wang b, Q. Q. Zhang b, H. Y. Yu b, **
a School of Agriculture, Ludong University
026402 Yantai, P. R. China
b Key Laboratory of Marine Genetics and Breeding, Ministry of Education, College of Marine Life Science,
Ocean University of China
266003 Qingdao, P. R. China
* E-mail: lizanlxm@163.com
** E-mail: yuhaiyang@ouc.edu.cn
Поступила в редакцию 27.01.2018
После доработки 07.06.2018
Принята к публикации 13.07.2018
Аннотация
Рецептор интерлейкина-1 типа 2 (IL-1R2) – один из природных ингибиторов сигнального каскада IL-1β млекопитающих. Нами клонирован ген IL-1R2 пятнистого палтуса Verasper variegatus (VvIL-1R2), и определена его нуклеотидная последовательность. С помощью филогенетического анализа выявлено структурное сходство VvIL-1R2 и его ортологов у других позвоночных. Уровень экспрессии VvIL-1R2 относительно высок в лейкоцитах периферической крови, жабрах и селезенке. Кроме того, экспрессия гена VvIL-1R2 зависит от стадии развития и типа ткани, что подразумевает важную роль IL-1R2 в эмбриональном развитии и метаморфозе камбалообразных. Инкубация лейкоцитов периферической крови с патогенассоциированными молекулярными паттернами приводила к быстрому и сильному увеличению экспрессии гена VvIL-1R2, что указывает на его участие в иммунном ответе на бактерии и вирусы.
ВВЕДЕНИЕ
Интерлейкин (IL)-1β, который входит в семейство IL-1 [1], играет центральную роль в воспалительных реакциях и связанных с ними заболеваниях. Все известные биологические активности IL-1β связаны с рецептором IL-1 типа 1 (IL-1R1) [2]. В процессе воспаления IL-1β индуцирует экспрессию большого числа провоспалительных генов и продукцию кодируемых ими белков, усиливая таким образом воспалительный ответ. мРНК этих генов и соответствующие белки, включая сам IL-1β, IL-6, IL-8, хемоаттрактантный белок моноцитов 1 (MCP-1, или CCL2) и циклооксигеназу 2, в здоровом организме обычно отсутствуют [3]. Повреждение тканей, связанное с активностью избыточно продуцируемых цитокинов, вредно для организма [1, 2]. Соответственно, сверхпродукция IL-1β индуцирует синтез нескольких природных ингибиторов IL-1β, особенно антагониста IL-1R (IL-1Ra) и рецептора типа 2 IL-1 (IL-1R2) [4]. У млекопитающих IL-1Ra конкурирует с IL-1R1 за связывание с IL-1β. Более того, для блокирования эффекта IL-1β применяют Anakinra ‒ рекомбинантный аналог IL-1Ra человека [4]. IL-1R2, который не содержит домен ТIR (Toll/interleukin-1 receptor) и поэтому не передает сигнал, также конкурирует с IL-1R1, действуя как рецептор-ловушка для IL-1β [5].
IL-1R1 в небольших количествах представлен в клетках практически всех видов [6, 7], в то время как IL-1R2 синтезируется преимушественно нейтрофилами, В-клетками и моноцитами [8], что указывает на IL-1R2 как на ингибитор сигнала, передаваемого IL-1β, в клетках млекопитающих.
Первой из кДНК IL-1R2 костистых рыб была получена кДНК форели Oncorhynchus mykiss, в клетках которой также обнаружена индуцируемая липополисахаридами (LPS) и фактором некроза опухолей-α (TNF-α) экспрессия гена IL-1R2 [9]. Затем кДНК IL-1R2 выделили у дорадо Sparus aurata [10], ложного палтуса Paralichthys olivaceus [11], семги Salmo salar [12] и белого амура Ctenopharyngodon idella [13]. Бактериальная инфекция сильно повышала уровень мРНК IL-1R2 в тканях S. aurata и P. olivaceus, вовлеченных в развитие иммунного ответа [10, 11], что также свидетельствует об участии IL-1R2 в воспалительных реакциях. Важно, что предсказанные первичные структуры IL-1R2 разных рыб не содержат внутриклеточного TIR-домена, что подразумевает его функционирование в качестве ловушки для IL-1β.
Благодаря высокой рыночной стоимости, Verasper variegatus представляет интерес для рыболовства и разведения в аквакультуре в Азии. Однако до сих пор не удалось добиться созревания и нереста взрослых особей в садках [14]. Более того, V. variegatus, находящийся под угрозой уничтожения, восприимчив к бактериальным и вирусным инфекциям. Выживаемость V. variegatus при разведении в садках можно увеличить, если детально изучить функции генов, принимающих участие в иммунном ответе. Для определения функции VvIL-1R2 полноразмерную кДНК этого гена клонировали из пула мРНК селезенки, используя обратную транскрипцию. Уровень экспрессии гена VvIL-1R2 измеряли в тканях взрослых рыб, а также на разных стадиях развития, включая метаморфоз. Показано, что стимуляция лейкоцитов периферической крови (PBL) V. variegatus патогенассоциированными молекулярными паттернами (PAMP) индуцирует иммунный ответ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сбор эмбрионов и тканей взрослых рыб. Образцы рыб V. variegatus получены в рыбоводческом хозяйстве в Вейхае, Шаньдунь, Китай. Ткани взрослых рыб (сердце, печень, селезенка, почки, мозг, жабры, мышцы и кишечник) и PBL взяты у пяти годовиков. Ткани взрослых рыб и PBL замораживали сразу после извлечения и хранили при –80°С до использования. Получали по три образца каждый ткани. Эмбрионы происходили из того же хозяйства, что и взрослые рыбы. Икру оплодотворяли в лаборатории и инкубировали при температуре 11 ± 1°C в стерильной морской воде в открытой системе циркуляции воды при достаточном уровне аэрации. Эмбрионы на разных стадиях развития отбирали с помощью стереомикроскопа. Три набора образцов эмбрионов (неоплодотворенная икра, одна клетка, четыре клетки, морула, бластула, гаструла, нейрула, сомит, хвостовая почка, стадия вылупления) отбирали по отдельности из смешанных образцов икры с помощью нейлоновой сетки (100 ячеек). Эмбрионы инкубировали в 1.5 мл жидкости RNAwait (“Solarbio”, КНР) в течение ночи при температуре 4°C, а затем замораживали при –80°С и хранили до использования.
Выделение РНК и синтез первой цепи кДНК VvIL-1R2. Суммарную РНК экстрагировали с помощью TRIzol Reagent (“Invitrogen”, CША) в соответствии с инструкциями производителя. Выделенную РНК обрабатывали ДНКазой I, свободной от РНКаз (“TaKaRa”, КНР), чтобы избавиться от загрязнения ДНК, после чего хранили при температуре –80°С. Для обратной транскрипции использовали пробы, содержащие 1 мкг суммарной РНК и случайные шестинуклеотидные праймеры, добавляли обратную транскриптазу M-MLV и соответствующий буфер в соответствии с инструкциями производителя (“TaKaRa”). Количество и качество образцов суммарной РНК определяли с помощью электрофореза в 1.5%-ном агарозном геле и спектрофотометрически с помощью прибора NanoPhotometer Pearl (“Implen”, США).
Молекулярное клонирование и анализ нуклеотидной последовательности гена VvIL-1R2. Информация о геноме V. variegatus в настоящий момент отсутствует. Поэтому, чтобы найти консервативный район VvIL-1R2, мы использовали пару вырожденных праймеров (табл. 1), подобранных на основе консервативных участков IL-1R2 других костистых рыб. ПЦР проводили в следующем режиме: исходная денатурация 95°С, 5 мин; 30 циклов ‒ 95°C, 30 с, 55°C, 30 с и 72°C, 1 мин; конечная элонгация ‒ 72°C, 7 мин. Быструю амплификацию 5'- и 3'-концов кДНК (RACE) с целью получения полноразмерной кДНК IL-1R2 из селезенки V. variegatus проводили с помощью набора SMART RACE cDNA Amplification (“Clontech”, США) в соответствии с методикой производителя. Специфичные к гену праймеры (GSP – gene specific primers) подбирали, используя известную кДНК. Следующие пары GSP использовали для вложенной ПЦР: 5′RACE1 и 5′RACE2 для 5′-RACE; и 3′RACE1 и 3′RACE2 для 3′-RACE (таблица). Продукты амплификации разделяли путем электрофореза в 1.5%-ном агарозном геле, ДНК выделяли из геля, используя набор Zymoclean Gel DNA Recovery (“Zymo Research”, CША). Очищенные фрагменты ДНК клонировали в вектор pMD-18T (“TaKaRa”), а затем секвенировали. Нуклеотидные последовательности белоккодирующего участка и открытой рамки считывания предсказывали с помощью программы ORF Finder (http:// www.ncbi.nlm.nih.gov/gorf/gorf.html).
Таблица 1.
Праймеры, использованные в работе
| Праймер | Нуклеотидная последовательность (5′ → 3′) |
Tm, °C | Применение |
|---|---|---|---|
| IL-1R2-Fw | GAAAGAYGGCTGCTWMCTGG | 57.4 | Вырожденная ПЦР |
| IL-1R2-Rv | HGCYKKKTGACATYCGGTGA | 57.8 | Вырожденная ПЦР |
| IL-1R2-5′Rv1 | CCAGTGATACAGTAGGTGTCATTCC | 59.7 | 5′-RACE1 |
| IL-1R2-5′Rv2 | TCTGTGGGTCTGGTTCTTGC | 58 | 5′-RACE2 |
| IL-1R2-3′Fw1 | AGTACAAAGTCAGCAGGGTCG | 57 | 3′-RACE1 |
| IL-1R2-3′Fw2 | GATTGAGTTGAGGCTGGTTGT | 56.6 | 3′-RACE2 |
| IL-1R2-RT-Fw | TCATGGCGATAACGGAAGAAG | 60 | qRT-PCR |
| IL-1R2-RT-Rv | TGGGTTTGAAGAGGACGTAAAG | 60 | qRT-PCR |
Количественная ПЦР в реальном времени для определения содержания мРНК VvIL-1R2 в разных тканях на разных стадиях эмбрионального развития. На основании характеристик гена IL-1R2 была подобрана и синтезирована пара специфических праймеров (IL-1R2-RT-FW/RV, табл. 1). Возможность амплификации одиночного продукта ПЦР с использованием этой пары праймеров подтверждали с помощью предварительных экспериментов. В качестве референтных для определения относительного уровня экспрессии VvIL-1R2 использовали гены “домашнего хозяйства” β-актина и 18S рРНК, которые характеризуются наиболее стабильной экспрессией в разных тканях и на разных стадиях развития V. variegatus.
Суммарную РНК экстрагировали из различных тканей взрослых рыб и эмбрионов на разных стадиях развития, кДНК синтезировали на матрице суммарной РНК. Всего использовали по три биологических повтора каждого образца, каждый из которых анализировали трижды (в трипликатах). Количественную ПЦР с детекцией в реальном времени (ОТ-ПЦР) проводили в 20 мкл реакционной смеси, содержащей 10 нг матрицы кДНК и SYBR Premix Ex Taq II (“TaKaRa”), используя LightCycler 480 и температурный режим: преинкубация ‒ 95°C, 5 мин; 45 циклов ‒ 95°C, 15 с, затем 60°C, 45 с. После окончания ПЦР проводили анализ кривой плавления продукта, чтобы убедиться, что амплифицирован одиночный продукт. Сигнал флуоресценции записывали на стадии 60°C, 45 с каждого температурного цикла с помощью LightCycler 480 Software 1.5. Относительный уровень транскрипции гена VvIL-1R2 определяли как кратность изменения значений 2–ΔΔCt, рассчитанных по сравнительному методу Ct и нормированных на аналогичные значения для β-актина и 18S рРНК.
Выравнивание последовательносей и построение филогенетического дерева. Степень гомологии нуклеотидных и аминокислотных последовательностей определяли, используя BLAST и базы данных NCBI и Ensembl. Выравнивание множественных последовательностей проводили с помощью ClustalX 2.1 и DNAMAN 7.0. Филогенетическое дерево строили с помощью программы MrBayes 3.2.3.
Экспрессия гена VvIL-1R2 в PBL, индуцированная PAMP. Кровь собирали из хвостовой вены V. variegatus, PBL выделяли центрифугированием в градиенте Percoll согласно [15]. PBL культивировали при 24°C в 24-луночных планшетах (“Thermal Scientific”, 3.6 × 104 клеток на лунку) в течение ночи, а затем стимулировали липополисахаридом (LPS, 50 мкг/мл) и полиинозиновой : полицитидиловой кислотой (poly(I : C), “Sigma”, 50 мкг/мл). В качестве контроля использовали PBS. Клетки собирали через 0, 0.5, 1, 2, 4, 6, 12 и 24 ч после добавления PAMP. Выделяли РНК и синтезировали кДНК в соответствии с описанным ранее методом. Изменения экспрессии VvIL-1R2 в ответ на LPS, poly(I : C) и инкубацию с PBS определяли с помощью количественной ОТ-ПЦР, используя гены β-актина и18S рРНК в качестве референтных.
Анализ пространственной структуры VvIL-1R2. Для поиска структурных мотивов в первичной структуре VvIL-1R2 и IL-IR2 других позвоночных использовали базы данных Pfam и CCD. Вторичную и пространственную структуру VvIL-1R2 предсказывали с помощью открытых биоинформатических ресурсов Phyre2 (http:// www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index) и PDBsum Generate (http://www.ebi.ac.uk/thornton-srv/databases/pdbsum/Generate.html). Моделирование докинга белков осуществляли, используя сервер ZDOCK (http://zdock.umassmed.edu/).
Статистический анализ. Статистический анализ данных qRT-PCR проводили с помощью однофакторного дисперсионного анализа (one-way ANOVA) с последующим анализом LSD (логарифмического разложения рядов) в программе SPSS 20.0 (IBM, New York, США). При p < 0.05 различия между образцами считали статистически значимыми. Данные представляли как средние значения ± стандартное отклонение (mean ± SD), количество биологических повторностей n = 3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
VvIL-1R2 является высоскоконсервативным геном позвоночных
Учитывая отсутствие данных полногеномного секвенирования V. variegatus, мы начали работу с того, что подобрали пару вырожденных праймеров (табл. 1) к консервативному участку гена VvIL-1R2, используя множественное выравнивание последовательностей IL-1R2 других позвоночных. 5'- и 3'-концевые фрагменты кДНК VvIL-1R2 клонировали, используя RACE-ПЦР. Полная нуклеотидная последовательность кДНК VvIL-1R2 получена путем объединения последовательностей всех клонированных фрагментов в программе SeqMan (идентификационный номер NCBI KY038172). Полноразмерная мРНК VvIL-1R2 состоит из 1852 н., включая 106 н. 5'-нетранслируемой части (UTR), 471 н. 3'-нетранслируемой части с “довеском” поли(А) и открытую рамку считывания (ORF) длиной 1275 н. (рис. 1). Ген VvIL-1R2 содержит сигнал полиаденилирования (AATAAA) и ТА-богатый мотив (ATTTA) в составе 3′-UTR (рис. 1) [10, 11]. Ранее показано, что консенсусная последовательность ATTTA присутствует в 3′‑UTR мРНК IL-1 мыши и человека, наряду с мРНК TNF человека и мыши, CSF и лимфотоксина человека, фибронектина человека и крысы, а также большинства интерферонов мыши и человека [16]. Все эти мРНК не имеют значительной гомологии с мРНК IL-1R в белоккодирующей части [16]. TA-богатые мотивы особенно часто встречаются в мРНК белков, участвующих в иммунном ответе [16]. Дестабилизирующий мотив ATTTA является характерной чертой генов медиаторов воспаления [17], присутствие этого мотива говорит о коротком времени жизни медиатора воспаления VvIL-1R2.
Рис. 1.
Структура мРНК VvIL-1R2. Последовательность нетранслируемых участков (UTR) представлена строчными буквами, прописными буквами выделена белоккодирующая последовательность. Предсказанная аминокислотная последовательность белка показана в однобуквенном коде под белоккодирующей последовательностью. Старт- и стоп-кодоны выделены рамкой. Дестабилизирующий мотив (ATTTA) подчеркнут, два Ig-подобных домена отмечены волнистой линией, трансмембранный домен маркирован серым фоном, а сигнал полиаденилирования (AATAAA) ‒ двойным подчеркиванием. Сигнальный пептид на N-конце выделен буквами серого цвета.

Открытая рамка считывания VvIL-1R2 кодирует полипептид длиной 424 аминокислотных остатка с молекулярной массой 47.38 кДа и предсказанной изоэлектрической точкой 5.78. Подобно ортологам других позвоночных, VvIL-1R2 содержит на С-конце предсказанный с помощью классификации мембранной топологии белков по Зингеру одиночный предполагаемый трансмембранный участок длиной 32 аминокислотных остатка (остатки 382‒405, рис. 1) [18]. Этот трансмембранный домен разделяет внеклеточный домен из 364 аминокислотных остатков и короткий внутриклеточный домен из 19 остатков. Предсказание доменной организации позволяет выявить потенциальный сигнальный пептид из 18 аминокислотных остатков на N-конце белка, сайт сплайсинга между остатками 18 и 19 (VCP-KP) и зрелый полипептид из 406 остатков (рис. 1). VvIL-1R2 на 91, 80, 74, и 46%, идентичен IL-1R2 ложного палтуса P. olivaceus, нильской тиляпии Oreochromis niloticus, морского языка Cynoglossus semilaevis и Homo sapiens соответственно. Эти результаты свидетельствуют о возможной высокой консервативности IL-1R2 у позвоночных.
Доменная организация белка VvIL-1R2 сходна со строением IL-1R2 других костистых рыб
Сравнение VvIL-1R2 и IL-1R2 других позвоночных показывает, что VvIL-1R2 обладает особенностями, характерными для членов семейства IL-1R рыб и высших позвоночных. К этим особенностям относятся два иммуноглобулиновых домена во внеклеточной части, N-концевой сигнальный пептид, одиночный трансмембранный домен, короткий цитоплазматический домен из 17 остатков аминокислот, четыре консервативных остатка пролина и шесть консервативных остатков цистеина [11]. Два Ig-подобных домена VvIL-1R2 находятся во внеклеточной части, но к ним не присоединен внутриклеточный домен TIR. Аналогичный набор доменов присущ IL-1R2 S. salar, P. olivaceus, S. aurata и O. mykiss [9‒12]. Следует заметить, что IL-1R2 человека и мыши также лишены внутриклеточных сигнальных доменов TIR, а во внеклеточной части они содержат три Ig-подобных участка. IL-1R1 человека в отличие от IL-1R2 сравниваемых видов содержит протяженный внутриклеточный сигнальный домен TIR и три Ig-подобных домена во внеклеточной части. Учитывая это, мы полагаем, что дальнейшее изучение IL-1R2 костистых рыб позволит подтвердить, что IL-1R2 всех костистых рыб содержат два Ig-подобных домена. Во внеклеточной части IL-1R2 сравниваемых видов присутствуют шесть консервативных остатков цистеина в положениях 112, 120, 156, 210, 290 и 358. Однако четыре из этих остатков играют структурную роль, формируя дисульфидные мостики Ig-подобных (C-x*-C) доменов, причем оба домена образуют стабильные антипараллельные β-шпилечные структуры c помощью дисульфидных связей [19]. Помимо этого, четыре пролина в положениях 101, 157, 267 и 272 консервативны у всех исследованных видов.
Биологическим функциям IL-1R2 посвящены немногочисленные сообщения. Поскольку IL-1R2 лишен TIR-домена, представленного в IL-1R1, и участвует в передаче сигнала, принято считать, что он действует как рецептор-ловушка для IL-1 [5]. Однако исключить участие IL-1R2 в проведении сигнала невозможно. Ранее было установлено, что моноклональное антитело к IL-1R2 может ингибировать термо- и пирогенез в ответ на высвобождение IL-1β в мозге крыс [20]. Это же антитело негативно влияет на вызванное IL-1β выделение простагландина E2 в культуре ткани гипоталамуса Rattus norvegicus [21]. Эти данные подразумевают, что IL-1R2 участвует в передаче сигнала от IL-1β в мозге, и способен регулировать этот процесс. Более того, участие IL-1R2 в передаче сигнала подтверждено результатами ряда исследований [22, 23]. Механизм передачи сигнала от IL-1β, опосредованный IL-1R2, может быть схож с механизмом, предложенным для IL-1R1. Он может реализоваться за счет связывания IL-1R2 с другими трансмембранными белками [24]. Мы обнаружили, что VvIL-1R2 содержит четыре консервативных остатка пролина, вовлеченных в передачу сигнала IL-1R1. Способность IL-1R1 передавать сигнал значительно понижается при мутагенезе этих консервативных пролинов [25, 26]. Мы полагаем, что IL-1R2 рыб может, вероятно, передавать сигнал, однако для подтверждения этой гипотезы необходимы дополнительные исследования.
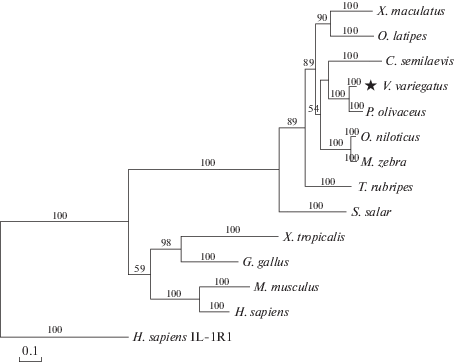
Анализ филогенетического дерева, построенного в программе MrBayes, показывает, что IL-1R2 позвоночных образуют одну группу, которая отделена от неродственного IL-1R1 (рис. 2). Это указывает на дупликацию родительского гена, от которого произошел IL-1R1, что привело к образованию IL-1R1 и IL-1R2 до формирования разных видов позвоночных. Гены, кодирующие IL-1R2, кластеризованы в отдельной группе, в которой можно выделить IL-1R2 V. variegatus, C. semilaevis, и P. olivaceus, формирующие отдельную подгруппу. Это результат подразумевает эволюционную близость камбалообразных рыб.
Рис. 2.
Филогенетическое дерево первичных структур рецепторов IL-1 (IL-1R). Филогенетическое дерево показывает степень родства между IL-1R2 V. variegatus и других позвоночных. Филограмма построена с помощью программы MyBayes (mcmc = 200 000 поколений, samplefreq = 10). Последовательность IL-1R1 H. sapiens использована как пример неродственного белка. Анализировали аминокислотные последовательности белков следующих видов с соответствующими кодами доступа в GenBank: H. sapiens IL-1R2 (NP_004624.1); M. musculus IL-1R2 (NP_034685.1); G. gallus IL-1R2 (XP_416914.3); X. tropicalis IL-1R2 (NP_001015713.1); P. olivaceus IL-1R2 (ABP99035.1); C. semilaevis IL-1R2 (XP_008326152.1); O. latipes IL-1R2 (XP_011487540.1); S. salar IL-1R2 (NP_001138892.1); X. maculatus IL-1R2 (XP_014329400.1); T. rubripes IL-1R2 (XP_003962211.1); O. niloticus IL-1R2 (XP_013132819.1); M. zebra IL-1R2 (XP_004569045.1); H. sapiens IL-1R1 (NP_000868.1). Ig-подобные домены и другие домены рецепторов IL-1 найдены с помощью сервера CDD [27‒30].
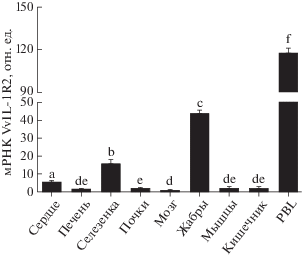
Экспрессия гена VvIL-1R2 существенно повышена в PBL, жабрах и селезенке, а также в эмбрионах на стадии вылупления из икры
Экспрессия IL-1R2 может регулироваться на уровне транскрипции [31], поэтому методом qRT-PCR мы определили уровень экспрессии VvIL-1R2 в разных тканях и на разных стадиях эмбрионального развития. Уровень экспрессии гена нормировали по уровню транскрипции генов “домашнего хозяйства”, а именно 18S рРНК и β-актина. В соответствии с данными по распределению VvIL-1R2 в тканях P. olivaceus, C. idella и S. aurata [10, 11, 13], экспрессия VvIL-1R2 выявлена во всех исследованных тканях (pис. 3). Самый высокий уровень мРНК VvIL-1R2 выявлен в PBL, чуть меньше ‒ в жабрах и селезенке. В других тканях ‒ сердце, печени, почках, мышцах и кишечнике ‒ ген VvIL-1R2 экспрессировался на среднем уровне. Этот результат сходен с данными, полученными на C. idella и O. mykiss [9, 13]. Особый интерес представляет присутствие транскрипта VvIL-1R2 в мозге, поскольку моноклональные антитела к IL-1R2 могут ингибировать термогенный и пирогенный ответ на IL-1β в мозге R. norvegicus [20]. Однако согласно нашим данным, уровень транскрипции VvIL-1R2 в мозге минимален среди всех проанализированных тканей. Наши данные говорят о том, что VvIL-1R2 может быть крайне важен для поддержания иммунологических функций ключевых иммунных органов рыб, например селезенки, жабр и PBL.
Рис. 3.
Количественный анализ экспрессии VvIL-1R2 в тканях взрослой рыбы. Представлены различия в относительном уровне экспрессии VvIL-1R2 в разных тканях (количество мРНК IL-2R V. variegatus нормировано по уровню экспрессии генов 18S РНК и β-актина). Данные представлены в виде средних значений ± стандартное отклонение (SD, n = 3). Буквами a‒f отмечены статистически значимые различия (p < 0.05).
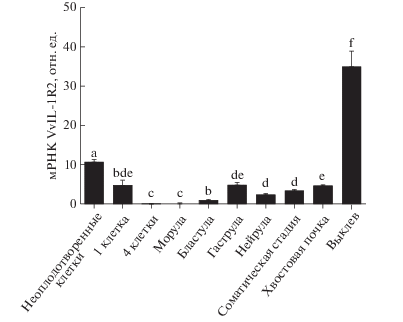
Эмбрионы рыб защищены оболочкой икры до момента вылупления и контакта с внешней средой. В настоящее время наши знания о механизмах защиты рыб от воздействия патогенов во враждебной водной среде на самых ранних этапах жизни весьма ограничены. Поэтому мы изучали изменения экспрессии VvIL-1R2 на разных стадиях эмбрионального развития. Уровень мРНК определяли в неоплодотворенных икринках V. variegates и установили, что он постепенно снижается до недетектируемого при переходе на стадию бластулы (рис. 4). Это наблюдение указывает на то, что мРНК VvIL-1R2 синтезируется еще в организме матери. Согласно опубликованным данным, IL-1β может играть разные роли в процессе развития [32, 33]. IL-1R2 также играет важную роль в качестве рецептора IL-1β в процессах деления клеток и их апоптотической гибели [34‒36]. После стадии бластулы эмбриональные клетки получают стимул к дифференцировке. Поэтому мы выдвинули гипотезу, что IL-1R2 может участвовать в дифференцировке эмбриональных клеток. Экспрессия гена IL-R2 сохраняется на относительно низком уровне до вылупления из икринок. Интересно, что именно на стадии вылупления уровень экспрессии VvIL-1R2 достигает максимальных значений по сравнению с другими стадиями эмбрионального развития (рис. 4). Эмбрионы и мальки большинства рыб до формирования полноценной иммунной системы живут в водной среде, которая содержит тысячи разновидностей микроорганизмов, включая патогенные [37]. Более того, на стадии вылупления эмбрионы теряют защитную оболочку икринки, соответственно, выходя наружу, они более чувствительны к воздействию патогенов. Поэтому повышенная экспрессия VvIL-1R2 в этот момент подразумевает, что этот ген важен для защиты от патогенов. Экспрессия гена IL-1R2 не обнаружена в икре других рыб, поэтому его роль на ранних стадиях развития пока неясна. В данной работе мы показали, что мРНК VvIL-1R2 – это фактор, передаваемый от матери и хранящийся в икре V. variegatus. Более того, уровень мРНК постепенно возрастает и достигает макимума на стадии вылупления. Эти результаты сходны с результатми изучения лектина икры (FEL), важного для иммунитета рыб, таких как полосатый данио и полосатый оплегнат [37, 38].
Рис. 4.
Количественный анализ экспрессии гена VvIL-1R2 на разных стадиях эмбрионального развития V. variegatus. Различия в уровне экспрессии представлены в относительных единицах (количество мРНК IL-2R нормировано на уровень экспрессии генов 18S РНК и β-актина соответственно). Данные представлены в виде средних значений ± стандартное отклонение (SD, n = 3). Статистически значимые различия отмечены разными буквами (p < 0.05).
Представленные результаты показывают, что экспрессия гена VvIL-1R2, который может участвовать в воспалительном ответе, тканеспецифична и зависит от стадии развития.
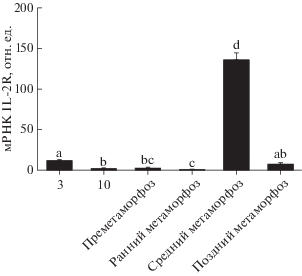
Наибольшая экспрессия VvIL-1R2 характерна для середины метаморофоза
Метаморфоз является ключевой фазой развития рыб при переходе от личинки к ювенальной стадии. Камбалообразные это необычная группа костистых рыб, поскольку на стадии метаморфоза представители этого порядка претерпевают очень сильные морфологические перестройки, превращаясь из цилиндрической личинки в несимметричную молодь. V. variegatus эволюционно близок к P. olivaceus [14, 39, 40], оба эти вида подвергаются метаморфозу. Интересно было понять, связан ли характер экспрессии VvIL-1R2 с содержанием трийодтиронина (Т3), тироксина (Т4) и рецепторов тиреоидных гормонов (TR) на этой стадии развития. Экспрессия VvIL-1R2 постепенно снижается в течение метаморфоза, затем резко и кратковременно возрастает и снова снижается в конце метаморфоза (рис. 5). Экспрессию VvIL-1R2 детектируют преимущественно в середине метаморфоза, т.е. на стадии наиболее существенных перестроек (рис. 5).
Рис. 5.
Количественный анализ экспрессии VvIL-1R2 на разных стадиях эмбрионального развития V. variegatus. Уровень экспрессии мРНК VvIL-1R2 представлен в относительных единицах (количество мРНК IL-2R нормировано на уровень экспрессии генов 18S РНК и β-актина соответственно). Данные представлены в виде средних значений ± стандартное отклонение (SD, n = 3). Разными буквами отмечены статистически значимые различия (p < 0.05). На оси абсцисс указаны дни после вылупления (3 и 10) и стадии метаморфоза (пре-, ранняя, средняя и поздняя)
Метаморфоз определяется серией регулируемых процессов, к которым относятся дифференцировка клеток, апоптоз, биохимические, молекулярный и физиологические изменения [41]. Метаморфоз у рыб запускается и контролируется тиреоидными гормонами (T3 и T4) и рецептором тиреоидных гормонов, которые связаны также с апоптозом и дифференцировкой клеток [41‒49]. Важную роль в пролиферации клеток и апоптозе играет также IL-1R2 [34‒36]. Еще более важно, что IL-1R2 взаимодействует с T3, T4 и TR [50‒52].
Полученные нами результаты, а также ранее опубликованные данные показывают, что паттерн экспрессии VvIL-1R2 практически совпадает с паттернами экспрессии T3, T4 и TR Scophthalmus maximus и P. olivaceus на стадии метаморфоза [43, 44]. Более того, наши результаты в значительной степени поддерживают предположение, что VvIL-1R2 может участвовать в ряде процессов при метаморфозе камбалообразных рыб. По нашей информации, это первое исследование, доказывающее связь между геном IL-1R2, тиреоидными гормонами, и метаморфозом камбалообразных. Эти результаты существенно дополняют наше понимание молекулярных механизмов, отвечающих за метаморфоз камбалообразных.
Poly(I : C) и LPS индуцируют сильное и быстрое повышение экспрессии VvIL-1R2
IL-1R2 – это ген, участвующий в иммунном ответе на патогены. Экспериментальные доказательства указывают на то, что IL-1β – это цитокин, критически важный для иммунного ответа на разные патогены, такие как Listeria monocytogenes, Mycobacterium bovis и M. tuberculosis [53‒55]. IL-1β, как известно, секретируется макрофагами, моноцитами, нейтрофилами, естественными киллерами (NK) и Т-клетками [56]. Поэтому мы определяли изменения экспрессии гена IL-1R2 (рецептор IL-1β) после инкубации PBL с PAMP. PBL V. variegatus обрабатывали LPS или poly(I : C). Уровень транскрипции VvIL-1R2 не менялся существенно при обработке клеток PBS в течение 24 ч (рис. 6). Напротив, обработка PBL LPS или poly(I : C) приводила к изменению экспрессии VvIL-1R2, о чем свидетельствует разница между контрольной и экспериментальной группами. Данные, полученные при нормировании экспрессии VvIL-1R2 по контрольным значениям, показывают, что кратность изменения уровня транскрипции гена VvIL-1R2 значительно и быстро возрастает между 0.5 и 1 ч после обработки LPS и poly(I : C) соответственно. Наши результаты показывают, что экспрессия IL-1R2, по-видимому, более чувствительна к LPS, чем poly(I : C).
Рис. 6.
Количественный анализ экспрессии VvIL-1R2 в лейкоцитах периферической крови, обработанных 50 мкг/мл (конечная концентрация) LPS или poly(I : C). Суммарную РНК экстрагировали через 0, 0.5, 1, 4, 6, 12 и 24 ч после начала стимуляции. Различия в относительном уровне экспрессии представлены в относительных единицах (количество мРНК IL-2R нормировано на уровень экспрессии генов 18S РНК и β-актина соответственно). Данные представлены в виде средних значений ± стандартное отклонение (SD, n = 3). Столбцы, отмеченные разными буквами, различаются статистически значимо (p < 0.05).
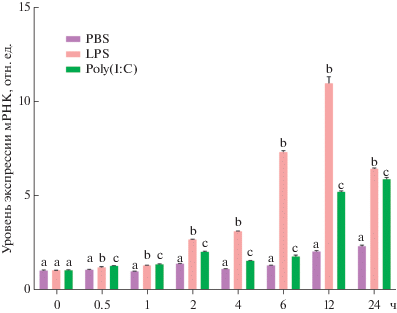
Исследования на клетках человека показали, что PAMP стимулируют экспрессию IL-1R2 в мононуклеарных клетках периферической крови, моноцитах/макрофагах и лимфоцитах [57]. Недавно обнаружили, что LPS, poly(I : C), бактерии, вирусы и паразиты мощно индуцируют транскрипцию IL-1R2 у разных рыб [9‒11, 13]. В соответствии с этими данными мы выявили экспрессию VvIL-1R2 в большом числе тканей в нормальных условиях, в то время как ее уровень быстро и сильно повышался при обработке клеток LPS или poly(I : C). Это указывает на возможное участие VvIL-1R2 в иммунном ответе на бактериальные и вирусные патогены. Экспрессия этого гена начинает снижаться после того, как достигает пиковых значений через 24 ч после инкубации с PAMP. IL-1R2 также может вызывать апоптоз [34]. Поэтому мы предполагаем, что снижение уровня экспрессии IL-1R2 может указывать на защиту PBL от повреждения.
Анализ простанственной структуры и моделирование докинга VvIL-1R2 и VvIL-1β предсказывает их возможные функции
Учитывая, что IL-1β является лигандом IL-1R2, мы проверили, могут ли VvIL-1R2 и VvIL-1β взаимодействовать друг с другом. Сначала мы предсказали вторичные сктруктуры VvIL-1R2 и VvIL-1β с помощью программы Phyre2. Используя аминокислотные последовательности VvIL-1R2 и VvIL-1β, мы предсказали пространственные структуры VvIL-1R2 и VvIL-1β в программе SWISS-MODEL и создали изображения в Phyre2 (рис. 7a, б). Охват последовательности шаблонов IL-1R2 и IL-1β, соответственно, составил 72 и 60%. Программу PDBsum Generate использовали для создания диаграммы Рамачандрана и предсказания стабильности модели. Только несколько остатков аминокислот попали в запрещенную область. Оценка свидетельствует о высокой достоверности предсказания 3D структуры.
Рис. 7.
Пространственные структулы и моделирование докинга белков VvIL-1β и VvIL-1R2. а ‒ Пространственная организация VvIL-1R2. б ‒ Пространственная структура VvIL-1β. в ‒ Моделирование связывания VvIL-1R2 (желтый) и VvIL-1β (серый).
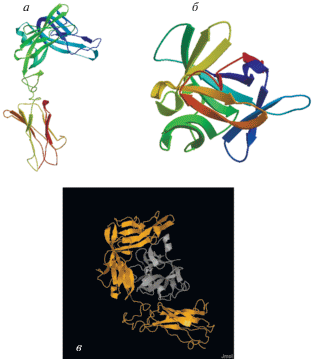
IL-1β может связывать IL-1R2 и IL-1R1, и это взаимодействие важно для иммуного ответа. IL-1R1 отвечает за все известные биологические функции IL-1 [58], в то время как IL-1R2 действует как рецептор-ловушка IL-1, ингибируя активность этого цитокина [59, 60]. Хотя IL-1R2 структурно сходен с IL-1R1, передающим сигнал от IL-1, укороченный цитоплазматический домен и отсутствие домена TIR приводят к неспособности IL-1R2 передавать сигнал через плазматическую мембрану [61]. Поэтому мы проверили возможность взаимодействия между предсказанными структурами VvIL-1R2 и VvIL-1β с помощью моделирования связывания этих двух белков. На рис. 7в видно, что VvIL-1R2 может взаимодействовать с VvIL-1β с помощью предсказанного участка связывания цитокина. Эти результаты показывают, что пространственная структура VvIL-1R2 похожа на структуры IL-1R2 других позвоночных, а также говорят о том, что связывание VvIL-1R2 и VvIL-1β отвечает, по-видимому, за снижение иммунологических реакций, опосредованных лиганд-рецепторным взаимодействием между VvIL-1β и VvIL-1R1 [62].
ЗАКЛЮЧЕНИЕ
В данной работе клонирована кДНК VvIL-1R2 V. variegates, и определена структура доменов его белкового продукта. Шесть консервативных остатков цистеина, четыре пролина, два иммуноглобулиновых домена, N-концевой сигнальный пептид и трансмембранный домен полипептида VvIL-1R2, а также TA-богатый дестабилизирующий мотив в мРНК, которые свидетельствуют об участии в иммунном ответе, схожи с подобными доменами IL-1R2 других рыб и позвоночных. Интересно, что изменение уровня экспрессии гена VvIL-1R2 в эмбриогенезе, а также его зависимость от типа клеток свидетельствуют о том, что VvIL-1R2 выполняет важную универсальную функцию в иммунном ответе, а также обладает неисследованной ранее активностью в эмбриогенезе и на стадии метаморфоза. Уровень экспрессии VvIL-1R2 быстро и сильно увеличивается при ответе на такие PAMP, как LPS или poly(I:C), указывая, на участие гена в иммунном ответе на бактерии и вирусы. Предсказание пространственной организации и компьютерное моделирование потенциального связывания позволяют предположить как именно происходит связывание VvIL-1R2 с VvIL-1β, необходимое для осуществления его функции. Этот результат согласуется с данными, полученными ранее для IL-1R2 других видов, которые подтверждают, что для своего функционирования IL-1R2 должен связаться с IL-1β.
Данное исследование поддержано Национальным фондом естественных наук Китая (National Natural Sciences Foundation of China, Grant № 31101891) и Программы развития и высоких технологий Китая (Hitech Research and Development Program of China, Grant № 2012AA10A408).
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Netea M.G., Nold-Petry C.A., Nold M.F., Joosten L.A.B., Opitz B., van der Meer J.H.M., van de Veerdonk F.L., Ferwerda G., Heinhuis B., Devesa I., Funk C.J., Mason R.J., Kullberg B.J., Rubartelli A., van der Meer J.W.M., Dinarello C.A. (2009) Differential requirement for the activation of the inflammasome for processing and release of IL-1beta in monocytes and macrophages. Blood. 113, 2324‒2335.
Farasat S., Aksentijevich I., Toro J.R. (2008) Autoinflammatory diseases: clinical and genetic advances. Arch. Dermatol. 144, 392‒402.
Buss H., Dorrie A., Schmitz M.L., Hoffmann E., Resch K., Kracht M. (2004) Constitutive and interleukin-1-inducible phosphorylation of p65 NF-κB at serine 536 is mediated by multiple protein kinases including IκB kinase IKKα, IKKβ, IKKε, TRAF family member-associated (TANK)-binding kinase 1 (TBK1), and an unknown kinase and couples p65 to TATA-binding protein-associated factor II31-mediated interleukin-8 transcription. J. Biol. Chem. 279, 55633‒55643.
Molto A., Olive A. (2010) Anti-IL-1 molecules: new comers and new indications. Joint Bone Spine. 77, 102‒107.
Li X., Qin J. (2005) Modulation of Toll-interleukin 1 receptor mediated signaling. J. Mol. Med. 83, 258‒266.
Dower S.K., Kronheim S.R., March C.J., Conlon P.J., Hopp T.P., Gillis S., Urdal D.L. (1985) Detection and characterization of high affinity plasma membrane receptors for human interleukin 1. J. Exp. Med. 162, 501‒515.
Chin J., Cameron P.M., Rupp E., Schmidt J.A. (1987) Identification of a high-affinity receptor for native human interleukin 1 beta and interleukin 1 alpha on normal human lung fibroblasts. J. Exp. Med. 165, 70‒86.
McMahan C.J., Slack J.L., Mosley B., Cosman D., Lupton S.D., Brunton L.L., Grubin C.E., Wignall J.M., Jenkins N.A., Brannan C.I. (1991) A novel IL-1 receptor, cloned from B cells by mammalian expression, is expressed in many cell types. EMBO J. 10, 2821‒2832.
Sangrador-Vegas A., Martin S.A., O’Dea P.G., Smith T.J. (2000) Cloning and characterization of the rainbow trout (Oncorhynchus mykiss) type II interleukin-1 receptor cDNA. Eur. J. Biochem. 267, 7031‒7037.
Lopez-Castejon G., Sepulcre M.P., Roca F.J., Castellana B., Planas J.V., Meseguer J., Mulero V. (2007) The type II interleukin-1 receptor (IL-1RII) of the bony fish gilthead seabream Sparus aurata is strongly induced after infection and tightly regulated at transcriptional and post-transcriptional levels. Mol. Immunol. 44, 2772‒2780.
Fan Y., Li S., Qi J., Zeng L., Zhong Q., Zhang Q. (2010) Cloning and characterization of type II interleukin-1 receptor cDNA from Japanese flounder (Paralichthys olivaceus). Comp. Biochem. Physiol. P B: Biochem. Mol. Biol. 157, 59‒65.
Morrison R.N., Young N.D., Nowak B.F. (2012) Description of an Atlantic salmon (Salmo salar L.) type II interleukin-1 receptor cDNA and analysis of interleukin-1 receptor expression in amoebic gill disease-affected fish. Fish Shellfish Immunol. 32, 1185‒1190.
Yang X., Wang S., Du L., Yang K., Wang X., Zhang A., Zhou H. (2013) Molecular and functional characterization of IL-1 receptor type 2 in grass carp: A potent inhibitor of IL-1β signaling in head kidney leukocytes. Dev. Comp. Immunol. 41, 738‒745.
Xu Y., Liu X., Liao M., Wang H., Wang Q. (2012) Molecular cloning and differential expression of three GnRH genes during ovarian maturation of spotted halibut, Verasper variegatus. J. Exp. Zool. P A: Ecolog. Genet. Physiol. 317, 434‒446.
Zhou Z., Zhang B., Sun L. (2014) Poly(I:C) induces antiviral immune responses in Japanese flounder (Paralichthys olivaceus) that require TLR3 and MDA5 and is negatively regulated by Myd88. PLos One. 9, e112918.
Caput D., Beutler B., Hartog K., Thayer R., Brown-Shimer S., Cerami A. (1986) Identification of a common nucleotide sequence in the 3'-untranslated region of mRNA molecules specifying inflammatory mediators. Proc. Natl. Acad. Sci. USA. 83, 1670‒1674.
Sachs A.B. (1993) Messenger RNA degradation in eukaryotes. Cell. 74, 413‒421.
Singer S.J. (1990) The structure and insertion of integral proteins in membranes. Annu. Rev. Cell Biol. 6, 247‒296.
Kishimoto T., Taga T., Akira S. (1994) Cytokine signal transduction. Cell. 76, 253‒262.
Luheshi G., Hopkins S.J., Lefeuvre R.A., Dascombe M.J., Ghiara P., Rothwell N.J. (1993) Importance of brain IL-1 type II receptors in fever and thermogenesis in the rat. Am. J. Physiol. 265, 585‒591.
Mirtella A., Tringali G., Guerriero G., Ghiara P., Parente L., Preziosi P., Navarra P. (1995) Evidence that the interleukin-1 beta-induced prostaglandin E2 release from rat hypothalamus is mediated by type I and type II interleukin-1 receptors. J. Neuroimmunol. 61, 171‒177.
Giri J.G., Kincade P.W., Mizel S.B. (1984) Interleukin 1-mediated induction of kappa-light chain synthesis and surface immunoglobulin expression on pre-B cells. J. Immunol. 132, 223‒228.
Horuk R., McCubrey J.A. (1989) The interleukin-1 receptor in Raji human B-lymphoma cells. Molecular characterization and evidence for receptor-mediated activation of gene expression. Biochem. J. 260, 657‒663.
Greenfeder S.A., Nunes P., Kwee L., Labow M., Chizzonite R.A., Ju G. (1995) Molecular cloning and characterization of a second subunit of the interleukin 1 receptor complex. J. Biol. Chem. 270, 13757‒13765.
Heguy A., Baldari C.T., Macchia G., Telford J.L., Melli M. (1992) Amino acids conserved in interleukin-1 receptors (IL-1Rs) and the Drosophila Toll protein are essential for IL-1R signal transduction. J. Biol. Chem. 267, 2605‒2609.
Kuno K., Okamoto S., Hirose K., Murakami S., Matsushima K. (1993) Structure and function of the intracellular portion of the mouse interleukin 1 receptor (type I). Determining the essential region for transducing signals to activate the interleukin 8 gene. J. Biol. Chem. 268, 13510‒13518.
Marchler-Bauer A., Derbyshire M.K., Gonzales N.R., Lu S., Chitsaz F., Geer L.Y., Geer R.C., He J., Gwadz M., Hurwitz D.I., Lanczycki C.J., Lu F., Marchler G.H., Song J.S., Thanki N., Wang Z., Yamashita R.A., Zhang D., Zheng C., Bryant S.H. (2015) CDD: NCBI’s conserved domain database. Nucl. Acids Res. 43, 222‒226.
Marchler-Bauer A., Lu S., Anderson J.B., Chitsaz F., Derbyshire M.K., DeWeese-Scott C., Fong J.H., Geer L.Y., Geer R.C., Gonzales N.R., Gwadz M., Hurwitz D.I., Jackson J.D., Ke Z., Lanczycki C.J., Lu F., Marchler G.H., Mullokandov M., Omelchenko M.V., Robertson C.L., Song J.S., Thanki N., Yamashita R.A., Zhang D., Zhang N., Zheng C., Bryant S.H. (2011) CDD: a Conserved Domain Database for the functional annotation of proteins. Nucl. Acids Res. 39, 225‒229.
Marchler-Bauer A., Anderson J.B., Chitsaz F., Derbyshire M.K., DeWeese-Scott C., Fong J.H., Geer L.Y., Geer R.C., Gonzales N.R., Gwadz M., He S., Hurwitz D.I., Jackson J.D., Ke Z., Lanczycki C.J., Liebert C.A., Liu C., Lu F., Lu S., Marchler G.H., Mullokandov M., Song J.S., Tasneem A., Thanki N., Yamashita R.A., Zhang D., Zhang N., Bryant S.H. (2009) CDD: specific functional annotation with the Conserved Domain Database. Nucl. Acids Res. 37, 205‒210.
Marchler-Bauer A., Bryant S.H. (2004) CD-Search: protein domain annotations on the fly. Nucl. Acids Res. 32, 327‒331.
Hawiger J. (2001) Innate immunity and inflammation: a transcriptional paradigm. Immunol. Res. 23, 99‒109.
Moro J.A., Carretero J., Alonso M.I., Martin C., Gato A., Mano A.D.L. (2008) Prenatal expression of interleukin 1beta and interleukin 6 in the rat pituitary gland. Cytokine. 44, 315‒322.
Bagu E.T., Gordon J.R., Rawlings N.C. (2010) Post-natal changes in testicular concentrations of interleukin-1 alpha and beta and interleukin-6 during sexual maturation in bulls. Reprod. Domest. Anim. 45, 336‒341.
West D.A., James N.H., Cosulich S.C., Holden P.R., Brindle R., Rolfe M., Roberts R.A. (1999) Role for tumor necrosis factor alpha receptor 1 and interleukin-1 receptor in the suppression of mouse hepatocyte apoptosis by the peroxisome proliferator nafenopin. Hepatol. 30, 1417‒1424.
Liu X., Min L., Duan H., Shi R., Zhang W., Hong S., Tu C. (2015) Short hairpin RNA (shRNA) of type 2 interleukin-1 receptor (IL1R2) inhibits the proliferation of human osteosarcoma U-2 OS cells. Med. Oncol. 32, 364.
Zieleniewski W., Zieleniewski J., Stepien H. (1995) Effect of interleukin-1a, IL-1b and IL-1 receptor antibody on the proliferation and steroidogenesis of regenerating rat adrenal cortex. Exp. Clin. Endocrinol. Diabetes. 103, 373‒377.
Wang Y., Bu L., Yang L., Li H., Zhang S. (2016) Identification and functional characterization of fish-egg lectin in zebrafish. Fish Shellfish Immunol. 52, 23‒30.
Kim B., Nam B., Kim J., Park H., Song J., Park C. (2011) Molecular characterisation and expression analysis of a fish-egg lectin in rock bream, and its response to bacterial or viral infection. Fish Shellfish Immunol. 31, 1201‒1207.
Li H., Fan J., Liu S., Yang Q., Mu G., He C. (2012) Characterization of a myostatin gene (MSTN1) from spotted halibut (Verasper variegatus) and association between its promoter polymorphism and individual growth performance. Comp. Biochem. Physiol. B Biochem. Mol. Biol. 161, 315‒322.
Li H., Jiang L., Han J., Su H., Yang Q., He C. (2011) Major histocompatibility complex class IIA and IIB genes of the spotted halibut Verasper variegatus: genomic structure, molecular polymorphism, and expression analysis. Fish Physiol. Biochem. 37, 767‒780.
Power D.M., Llewellyn L., Faustino M., Nowell M.A., Bjornsson B.T., Einarsdottir I.E., Canario A.V., Sweeney G.E. (2001) Thyroid hormones in growth and development of fish. Comp. Biochem. Physiol. P C: Toxicol. Pharmacol. 130, 447‒459.
Campinho M.A., Silva N., Sweeney G.E., Power D.M. (2006) Molecular, cellular and histological changes in skin from a larval to an adult phenotype during bony fish metamorphosis. Cell Tissue Res. 327, 267‒284.
Marchand O., Duffraisse M., Triqueneaux G., Safi R., Laudet V. (2004) Molecular cloning and developmental expression patterns of thyroid hormone receptors and T3 target genes in the turbot (Scophtalmus maximus) during post-embryonic development. Gen. Comp. Endocrinol. 135, 345‒357.
Yamano K., Miwa S. (1998) Differential gene expression of thyroid hormone receptor alpha and beta in fish development. Gen. Comp. Endocrinol. 109, 75‒85.
Yamano K., Araki K., Sekikawa K., Inui Y. (1994) Cloning of thyroid hormone receptor genes expressed in metamorphosing flounder. Dev. Genetics. 15, 378‒382.
Inui Y., Miwa S. (1985) Thyroid hormone induces metamorphosis of flounder larvae. Gen. Comp. Endocrinol. 60, 450‒454.
de Jesus E.G., Hirano T., Inui Y. (1991) Changes in cortisol and thyroid hormone concentrations during early development and metamorphosis in the Japanese flounder, Paralichthys olivaceus. Gen. Comp. Endocrinol. 82, 369‒376.
Liu Y., Chan W. (2002) Thyroid hormones are important for embryonic to larval transitory phase in zebrafish. Differentiation. 70, 36‒45.
Klaren P.H.M., Wunderink Y.S., Yufera M., Man-cera J.M., Flik G. (2008) The thyroid gland and thyroid hormones in Senegalese sole (Solea senegalensis) during early development and metamorphosis. Gen. Comp. Endocrinol. 155, 686‒694.
Svenson M., Kayser L., Hansen M.B., Rasmussen Å.K., Bendtzen K. (1991) Interleukin-1 receptors on human thyroid cells and on the rat thyroid cell line FRTL-5. Cytokine. 3, 125‒130.
Van der P. T., Van Zee K.J., Endert E., Coyle S.M., Stiles D.M., Pribble J.P., Catalano M.A., Moldawer L.L., Lowry S.F. (1995) Interleukin-1 receptor blockade does not affect endotoxin-induced changes in plasma thyroid hormone and thyrotropin concentrations in man. J. Clin. Endocrinol. Metabolism. 80, 1341‒1346.
Zerek-Melen G., Zylinska K., Fryczak J., Mucha S., Stepien H. (1994) Influence of interleukin 1 and antihuman interleukin 1 receptor antibody on the growth and function of the thyroid gland in rats. Eur. J. Endocrinol. 131, 531‒534.
Meixenberger K., Pache F., Eitel J., Schmeck B., Hippenstiel S., Slevogt H., N’Guessan P., Witzenrath M., Netea M.G., Chakraborty T., Suttorp N., Opitz B. (2010) Listeria monocytogenes-infected human peripheral blood mononuclear cells produce IL-1beta, depending on listeriolysin O and NLRP3. J. Immunol. 184, 922‒930.
Bourigault M., Segueni N., Rose S., Court N., Vacher R., Vasseur V., Erard F., Le Bert M., Garcia I., Iwakura Y., Jacobs M., Ryffel B., Quesniaux V.F.J. (2013) Relative contribution of IL-1alpha, IL-1beta and TNF to the host response to Mycobacterium tuberculosis and attenuated M. bovis BCG. Immun. Infl. Disease. 1, 47‒62.
Zhou Y., Zhao D., Yue R., Khan S.H., Shah S.Z.A., Yin X., Yang L., Zhang Z., Zhou X. (2015) Inflammasomes-dependent regulation of IL-1beta secretion induced by the virulent Mycobacterium bovis Beijing strain in THP-1 macrophages. Antonie van Leeuwenhoek. 108, 163‒171.
Covello J.M., Bird S., Morrison R.N., Battaglene S.C., Secombes C.J., Nowak B.F. (2009) Cloning and expression analysis of three striped trumpeter (Latris lineata) pro-inflammatory cytokines, TNF-alpha, IL-1beta and IL-8, in response to infection by the ectoparasitic, Chondracanthus goldsmidi. Fish Shellfish Immunol. 26, 773‒786.
Jang C., Choi J., Byun M., Jue D. (2006) Chloroquine inhibits production of TNF-alpha, IL-1beta and IL-6 from lipopolysaccharide-stimulated human monocytes/macrophages by different modes. Rheumatology. 45, 703‒710.
Stylianou E., O’Neill L.A., Rawlinson L., Edbrooke M.R., Woo P., Saklatvala J. (1992) Interleukin 1 induces NF-kappa B through its type I but not its type II receptor in lymphocytes. J. Biol. Chemistry. 267, 15836‒15841.
Colotta F., Re F., Muzio M., Bertini R., Polentarutti N., Sironi M., Giri J.G., Dower S.K., Sims J.E., Mantovani A. (1993) Interleukin-1 type II receptor: a decoy target for IL-1 that is regulated by IL-4. Science. 261, 472‒475.
Sims J.E., Gayle M.A., Slack J.L., Alderson M.R., Bird T.A., Giri J.G., Colotta F., Re F., Mantovani A., Shanebeck K. (1993) Interleukin 1 signaling occurs exclusively via the type I receptor. Proc. Natl. Acad. Sci. USA. 90, 6155‒6159.
Peters V.A., Joesting J.J., Freund G.G. (2013) IL-1 receptor 2 (IL-1R2) and its role in immune regulation. Brain Behavior. Immunity. 32, 1‒8.
Schreuder H., Tardif C., Trump-Kallmeyer S., Soffientini A., Sarubbi E., Akeson A., Bowlin T., Yanofsky S., Barrett R.W. (1997) A new cytokine-receptor binding mode revealed by the crystal structure of the IL-1 receptor with an antagonist. Nature. 386, 194‒200.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


