Молекулярная биология, 2019, T. 53, № 3, стр. 367-379
Вирусоподобные частицы как инструмент для производства вакцин
Б. В. Сёмин a, *, Ю. В. Ильин b
a Институт статистических исследований и экономики знаний (ИСИЭЗ),
Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: bsyomin@hse.ru
Поступила в редакцию 28.09.2018
После доработки 19.12.2018
Принята к публикации 24.12.2018
Аннотация
Представлен обзор технологий, используемых для производства вакцин на основе вирусоподобных частиц (virus-like particles, VLP). Детализированы факторы, определяющие особенности сборки мономеров VLP. В результате проведенного анализа литературы показано, что развитие технологий создания VLP и иммобилизации на их поверхности необходимых антигенов привело к созданию универсальных платформ, которые позволяют представлять практически любые антигены в высокой концентрации на поверхности частицы. В результате центр внимания сместился от способов образования VLP к созданию высокоточного интерфейса между иммунной системой организма и пептидами, вызывающими сильный индуцированный иммунный ответ на патогены или собственные патологичные клетки. Обсуждаются определяемые иммуномом способы проектирования вакцин и перспективы иммунопрофилактики. Рассмотрены конкретные примеры вакцин против вирусных и онкологических заболеваний.
Иммунопрофилактика давно используется в борьбе с инфекционными болезнями, оказывая огромное влияние не только на мировое здравоохранение, но и на благополучие многочисленных популяций сельскохозяйственных животных. В последние десятилетия фокус в технологиях производства вакцин сместился от обработки целых патогенов на создание рекомбинантных субъединичных вакцин на основе отдельно взятого определенного антигена [1]. Активная разработка рекомбинантных вакцин началась с 80-х годов прошлого века, когда появилась возможность клонировать конкретные последовательности ДНК в экспрессионные плазмиды и получать целевые белки. Конструирование рекомбинантной вакцины основывается на знании нуклеотидной последовательности генов патогена, определении антигенной детерминанты, синтезе кодирующей антиген нуклеотидной последовательности, ее клонировании в экспрессионный вектор и синтезе целевого пептида в той или иной системе экспрессии. На основе клеток прокариот и эукариот разработаны системы экспрессии индивидуальных гетерологичных белков, которые позволяют получать продукт не только в лабораторных, но и в промышленных масштабах [2].
Интерес к рекомбинантным вакцинам обусловлен появлением новых инфекционных заболеваний, как правило, зоонозного характера. Это вспышки заболеваний человека, вызванные вирусами Эбола, Зика, Марбург, короновирусами ближневостчного и тяжелого респираторного синдромов и др. [3]. Не меньшие надежды на рекомбинантные вакцины возлагают и в онкологии – для преодоления иммунной толерантности при терапии онкозаболеваний [4]. Кроме того, существует постоянная угроза появления новых высоковирулентных штаммов распространенных вирусов из-за непрерывного процесса мутаций вирусного генома [5]. На этом фоне активно развивается новая научная концепция – вакциномика [6], основанная на определении минимального набора антигенов, которые способны вызывать компетентный иммунный ответ на патоген или новообразование за счет специфичного взаимодействия с В- и Т-клетками иммунной системы. В рамках такого подхода возможно проектировать вакцины на основе минимального набора антигенов, которые наиболее специфично характеризуют патоген через взаимодействие с иммуномом (набором всех последовательностей иммунных рецепторов, которые встречаются в отдельно взятом организме) [7].
Непосредственное выявление участков белка, локализованных на поверхности, эпитопов, возможно с помощью рентгеноструктурного анализа, но это очень трудоемкая процедура из-за необходимости получать кристаллы белка. В настоящее время широко распространено моделирование трехмерной структуры белков. В основе такого подхода лежит установление физико-химических и электростатических характеристик участков полипептидной цепи и корреляции их с антигенностью. Моделирование базируется на двух стратегиях: гомологическом моделировании и de novo моделировании. В первом случае для создания модели используют базу данных трехмерных структур, Protein Data Bank (https://www.ncbi. nlm.nih.gov/genbank/). Популярная программа MODELLER [8] и другие, такие как I-TASSER [9], SWISS-MODEL [10], ESyPred3D [11], 3D-JIGSAW [12], Phyre [13], CPHmodels [14], служат инструментами для реализации гомологичного моделирования. Этот подход ограничен тем, что структуры гомологичных белков должны быть идентичны более чем на 30% [15]. Стратегия моделирования de novo основана на компьютерной симуляции процесса сворачивания белка (программы Rosetta [16] и TASSER [17]). В этом случае рассматривают все возможные варианты фолдинга полипептидной цепи и выбирают наиболее энергетически выгодную ее конформацию – с наиболее низкой потенциальной энергией.
Предсказанные антигенные детерминанты получают, используя генно-инженерные векторные технологии и системы экспрессии гетерологичных белков, а затем проводят их экспериментальную проверку, например, в реакции нейтрализации с антителами. Используя системы экспрессии белка, можно также получать вирусоподобные частицы (VLP), которые состоят из мономеров, способных к мультимеризации в VLP, а на поверхности таких частиц экспонирована антигенная детерминанта патогена. Этому вопросу мы уделим внимание ниже, констатируя, что даже сложные эпитопы, состоящие из тримеров можно получить в гетерологичных системах экспрессии. Это показано, например, для тримеров гликопротеина оболочки вируса иммунодефицита человека (ВИЧ-1) [18, 19] и гемагглютинина вируса гриппа [20].
В процессе расчета наиболее специфичных антигенов возбудителя нового инфекционного заболевания неизбежно приходится использовать зараженный материал, хотя бы для выделения и секвенирования нуклеиновых кислот, несущих генетическую информацию патогена. Однако при производстве вакцины, основанной на наиболее характерных для данного патогена эпитопах, нет необходимости его использовать. Соответственно, помимо прочих выгод, при производстве таких вакцин возникает оптимизация по условиям биологической безопасности. Вакцины, основанные на презентации набора антигенных детерминант инфекционного агента, хорошо воспроизводимы при промышленном производстве и высокоэффективны [21], поскольку в этом случае иммунный ответ фокусируется исключительно на наиболее существенных антигенных элементах патогенного микроорганизма или новообразования.
ПЕПТИДЫ КАК ПРОТЕКТИВНЫЕ АНТИГЕНЫ
К настоящему времени испытан ряд вакцин, специфично взаимодействующих с определенными рецепторами иммунной системы. Например, для профилактики мононуклеоза человека предложена вакцина, состоящая всего из одного эпитопа вируса Эпштейна–Барр – специфичного к T-клеткам CD8+ [22]. Такая вакцина не защищает от проникновения вируса в организм, но препятствует развитию заболевания. Другой пример – вирус классической чумы свиней (CSFV). Показано, что вирусный белок Е2, полученный в бакуловирусной системе экспрессии, индуцирует синтез антител, нейтрализующих CSFV у свиней. [23].
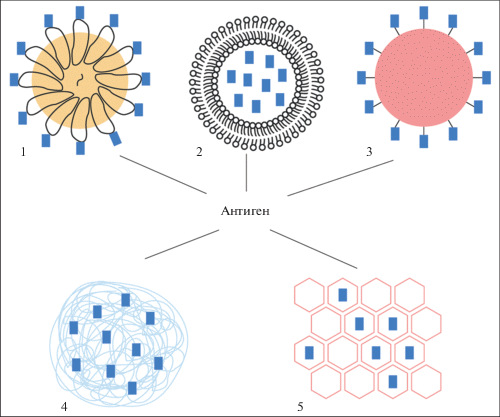
Вакцины предназначены для создания иммунитета к заболеванию. Несмотря на то, что отдельный эпитоп может индуцировать сильный иммунный ответ, как правило, этого недостаточно для развития протективного иммунитета. Синтезированный пептид, корректно представляющий главную антигенную детерминанту патогена, с высокой вероятностью сам по себе не будет сильным иммуногеном, прежде всего, из-за малого размера (<10 нм) и подверженности протеолитической деградации. Обойти эту проблему можно при помощи наночастиц. Во многих исследованиях показано, что для создания сильного иммунного ответа антигенные детерминанты патогена лучше экспонировать на поверхности наночастиц, формой и размером (20–150 нм) имитирующих вирус (рис. 1). И в этом плане VLP – наночастицы из вирусных белков, способных к самосборке (мультимеризации) в структуру морфологически схожую с вирусом, – главный претендент на роль сильного иммуногена. Многократное ‘повторение’ антигенной детерминанты на поверхности VLP облегчает фиксацию комплемента и кластеризацию рецепторов В-лимфоцитов для активации иммунного ответа. Кроме того, многократно повторяющееся экспонирование одного и того же антигена на поверхности частицы способствует мультипликации популяции аутореактивных В-клеток, что часто является первостепенной задачей при проектировании вакцин против аутоиммунных заболеваний и опухолей [29].
Рис. 1.
Схематичное представление основных типов наночастиц, предлагаемых для вакцинации: (1) вирусоподобные частицы (VLP), (2) частицы на основе липосом [24], (3) недеградируемые сферические наночастицы (например, на основе металлов) [25], (4) полимерные наночастицы [26], (5) нанолисты [27] и нанотрубки [28] на основе графена.
ПРИРОДНЫЙ ИСТОЧНИК ДЛЯ БИОИНЖЕНЕРИИ VLP И ОСОБЕННОСТИ ИХ СБОРКИ
Способностью к автономной самосборке в VLP обладают структурные белки различных вирусов. Они могут взаимодействовать между собой с образованием глобулярных, икосаэдрических или стержнеобразных структур. К настоящему времени в гетерологичных системах экспрессии синтезированы структурные белки нескольких десятков вирусов и практически все из них способны образовывать VLP. Размер VLP варьирует от 20 до 200 нм и схож с размерами соответствующих вирусов [30]. Сходство с вирусами позволяет VLP проникать в лимфу, а также эффективно поглощаться антигенпрезентирующими клетками [31].
К настоящему времени разработано несколько гетерологичных систем экспрессии и работающие в них экспрессионные векторы. Эти системы основаны как на бактериальных (часто используют pET-систему, основанную на клетках Escherichia coli), так и на разных эукариотических клетках. В случае эукариотических клеток наиболее популярна дрожжевая система экспрессии и системы, основанные на клетках насекомых: дрозофилы [32] и хлопковой совки [33]. Используются также клетки млекопитающих, наиболее популярны из которых клеточные линии CHO и HEK293 [34]. Себестоимость синтеза гетерологичных белков в бактериальных системах ниже, чем в эукариотических клетках. Однако при исследовании функциональной активности белка или VLP, обусловленной, скажем, потенциальным сайтом гликозилирования или взаимодействием с убиквитином или другими убиквитинподобными пептидами [35], использование эукариотических систем экспрессии не имеет альтернатив. Заметим, что выбор той или иной системы экспрессии субъективен и определяется поставленной задачей и собственно исследователем. Например, при работе с VLP, предназначенными для вакцинации против вируса гепатита С (HCV), в разных лабораториях используют разные эукариотические системы экспрессии вирусных белков, в том числе и растительные клетки [36].
В большинстве случаев VLP, собранные из определенного вирусного белка, рассматриваются в качестве потенциальной вакцины против этого вируса, так как мономеры белка, организованные в мультимерную форму, VLP, индуцируют более мощный иммунный ответ, чем мономер [29, 30]. Повышенная иммуногенность VLP обусловлена несколькими факторами: во-первых, в составе частицы экспонируется доминантный эпитоп структурного белка, который, как и на вирионе, представлен в мультимерной форме [21]; во-вторых, VLP стимулируют В-лимфоциты и индуцируют Т-лимфоциты, подобно вирусу, попавшему в организм хозяина [30]. Например, препараты VLP, образованные главным капсидным белком L1 вируса папилломы человека нескольких серотипов успешно используют как вакцины против рака шейки матки [37]. Создана вакцина против вируса гепатита B, представляющая собой VLP, заключенные в липидную мембрану [38]. Вакцина, разрабатываемая против вируса Коксаки А6, состоит из VLP, собирающихся из белков вирусного капсида, синтезируемых в бакуловирусной системе экспрессии [39]. Китайские исследователи показали, что капсидный белок (VP60) вируса геморрагической болезни кроликов (RHDV) успешно мультимеризуется в VLP; причем однократная внутримышечная инъекция препарата таких VLP полностью защищает кроликов от заражения RHDV в течение, как минимум, 180 суток [40]. Успешно мультимеризуется в VLP и капсидный белок цирковируса свиней – как синтезированный в культуре клеток почки человека (HEK293) [41], в дрожжевой [42] и бакуловирусной [43] системах экспрессии, так и в бактериальной системе [44]. VLP вируса ящура собирают из 3 структурных полипептидов: VP0, VP1 и VP3 (в природе образуются в результате процессинга полипептида-предшественника P1-2A), – одновременно синтезируемых в E. coli [45]. Недавно показано, что полипротеин гепатита А утки, синтезируемый в бакуловирусной системе экспрессии, собирается в VLP непосредственно в культивируемых клетках Spodoptera frugiperda (sf9), а иммунизация утят этими VLP индуцирует высокий гуморальный иммунный ответ и защищает от заболевания [46]. Способность VLP, образованных в результате мультимеризации клонированного вирусного белка, играть роль иммуногена не ограничена представлением только собственных антигенов, но может быть использована для экспонирования гетерологичных белков.
Для мультимеризации капсидных белков в частицу требуется нуклеиновая кислота, но при сборке in vitro достаточно короткого олигонуклеотида (7–10 н.) [47]. Таким образом, VLP капсидных белков свободны от инфекционных вирусных РНК или ДНК. Кроме того, эта особенность – запуск мультимеризации мономеров белка нуклеиновой кислотой – может быть использована для упаковки РНК или ДНК внутрь частицы, осуществляя при этом 2 разные цели. Так, антисмысловую РНК используют для подавления экспрессии вируса. В частности, при разработке вакцины против ящура китайские исследователи не только экспонировали на поверхности VLP эпитоп VP1 вируса ящура, но и упаковали в частицу антисмысловую РНК, комплементарную фрагменту последовательности геномной РНК вируса [48].
Другая цель упаковки нуклеиновых кислот в частицу связана с презентацией вирусных нуклеиновых кислот для активации специфических иммунных рецепторов, которые активируют выработку интерферонов (IFN) типа I и других цитокинов, запускающих противовирусный ответ клетки [49]. Показано, что внутрь VLP можно инкорпорировать протяженные ДНК и РНК. Например, в частицы, образованные капсидом вируса гепатита E, интегрировали мРНК репортера – красного флуоресцентного белка [50]. В собираемые in vitro VLP главного капсидного белка полиомавируса хомяка интегрировали плазмиду, содержащую ген зеленого флуоресцентного белка (GFP) [51]. На основе структурного белка ретровируса обезьян SV40, экспрессированного в бакуловирусной системе, разработана стратегия упаковки в частицу двухцепочечной кольцевой ДНК, размером до 17 т.п.н. [52].
Существует два принципиально различных способа включения нуклеиновых кислот в VLP: 1) сборка VLP in vitro из отдельных мономеров в присутствии РНК или ДНК, которые необходимо интегрировать в VLP, и 2) осмотический шок уже созданных VLP в присутствии нуклеиновых кислот. При осмотическом шоке используют раствор низкий ионный силы; в результате сдвига поверхностных структур нуклеиновая кислота проникает внутрь VLP [53]. Впрочем, если просто инкубировать VLP в присутствии нуклеиновых кислот без осмотического шока, часть нуклеиновых кислот будет ассоциирована с частицами [54]. Гораздо более прогнозируем способ – in vitro сборка VLP в смеси мономеров и нуклеиновых кислот, которые требуется упаковать. В этом случае после синтеза в гетерологичной системе экспрессии мономеры белка очищают, добиваясь полной очистки препарата белка от контаминирующих нуклеиновых кислот, затем белок денатурируют в 7–8 М мочевине, добавляют необходимые для упаковки нуклеиновые кислоты и ассоциируют белки в частицу, удаляя из раствора мочевину. Такая стратегия продемонстрирована, например, в работах [47, 55, 56].
Ассоциация белков в частицу обратима. Довольно легко добиться диссоциации VLP, добавляя к ним денатурирующий агент, а затем, удалив его, вновь собирать VLP in vitro [47] и инкорпорировать необходимую РНК или ДНК в частицу. Такой подход использован для белка Р21 вируса гепатита В: полученный в гетерологичной системе экспрессии вирусный белок денатурировали в растворе 7 М мочевины, а затем индуцировали его сборку в VLP в присутствии нуклеиновой кислоты [57].
Протективный иммунитет определяется специфическими гуморальными и клеточными механизмами, запускаемыми антигеном. Посттрансляционные модификации белков, ковалентная связь модифицирующих молекул с функциональными группами полипептидных цепей имеют важное значение для иммунного гомеостаза в противовирусных реакциях. От баланса реакций фосфорилирования, убиквитинирования, метилирования, ацетилирования, сумоилирования, ADP-рибозилирования и глутамилирования того или иного антигена зависит тонкая настройка противовирусного ответа хозяина [49, 58]. Структурные белки, используемые для создания VLP, синтезируемые в эукариотических системах экспрессии, подвергаются ряду посттрансляционных модификаций. В частности, мономер Gag gypsy оказался природным субстратом казеиновой киназы типа 2 [59]. Кроме того, во время синтеза в эукариотической клетке мономеры Gag gypsy ассоциируются с убиквитином и SUMO – клеточными белками-партнерами структурного белка [33].
В общем случае убиквитин и SUMO могут связаться с любым остатком лизина в молекуле белка, хотя существуют предпочтительные сайты связывания; причем фосфорилирование белка определяет, с каким из этих партнеров произойдет связывание белка [60, 61]. Кроме того, ограниченное связывание белка с упомянутыми сигнальными пептидами, например моноубиквитинилирование [62], как правило, необходимо для регуляторных функций и определяет транспорт либо белка, либо образуемых им частиц. В случае полиубиквитинирования белок ожидает протеасомная деградация [60, 63].
РЕКОМБИНАНТНЫЕ VLP ДЛЯ ПРЕЗЕНТАЦИИ ЧУЖЕРОДНОЙ АНТИГЕННОЙ ДЕТЕРМИНАНТЫ
Конструируя рекомбинантные полипептиды на основе капсидных белков вирусов, можно добиться образования VLP с несколькими антигенами. Так, к ДНК, кодирующей капсидный белок парвовируса свиней VP2, присоединили ДНК-фрагмент, кодирующий 35 аминокислотных остатков главного антигена нуклеопротеина цирковируса свиней (PCV2). В результате с такой составной ДНК в гетерологичных клетках синтезировался белок, образовывавший VLP. Эти VLP индуцировали у животных гораздо более сильный иммунный ответ против PCV2, чем рекомбинантный аденовирус, кодирующий открытую рамку считывания (ORF) 2 генома PCV2 [41]. Другой интересный пример – VLP, образованные матриксным белком вируса гриппа и экспонирующие на своей поверхности антиген Toxoplasma gondii [64]. Есть и другой подход – создания терапевтических вакцин на основе VLP; в этом случае на поверхности VLP экспонирован вариабильный фрагмент антитела, специфичный к определенному вирусному антигену [65]. Кроме того, зная рецепторсвязывающую специфичность вирусных белков, можно обеспечивать тропность частиц к клеткам определенных тканей. Например, пре-S-белок вируса гепатита B, экспонированный на поверхности VLP в качестве лиганда, обеспечивал специфичность их взаимодействия с гепатоцитами [66].
Собранные из структурного белка бактериофагов VLP также рассматривают в качестве носителя для производства вакцин, предназначенных для животных и человека. Например, в участок ДНК, кодирующий N-концевую β-шпильку белка оболочки фага MS2 E. coli встроили фрагмент ДНК, кодирующий чужеродный белок. Показано, что при экспрессии такой конструкции в бактериальных клетках синтезируются рекомбинантные белки, в которых чужеродный пептид представлен в центральной части шпильки. Такие химерные мономеры способны собираться в частицы, морфологически сходные с капсидом фага как in vivo, так и in vitro [67]. Используя указанную особенность белка оболочки фага MS2, создали VLP, на поверхности которых экспонирован эпитоп EP141–160 структурного белка VP1 вируса ящура. Эти химерные VLP индуцировали сильный иммунный ответ в организме животных, что позволяет рассматривать их в качестве перспективного инструмента для создания профилактической вакцины [68]. Уместно подчеркнуть, что экспонирование EP141–160 на поверхности VLP позволило разрешить давнюю проблему использования свойств этого пептида. Исследователи нескольких лабораторий доказали, что эта антигенная детерминанта вируса ящура индуцирует не только нейтрализующие антитела, но и стимулирует Т-лимфоциты [69]. Однако, взятый сам по себе, EP141–160 не индуцирует иммунный ответ, защищающий животных от заражения вирусом ящура [70]. Много попыток было предпринято, чтобы преодолеть эту проблему, в том числе комбинировали антигенную детерминанту с большими молекулами, например, специфичными к Т-клеткам [71]. Но только интеграция EP141–160 в состав VLP дала результат – возможность использовать эту антигенную детерминанту как сильный иммуноген для создания вакцины [68].
Свойством автономно образовывать VLP обладают едва ли не все структурные белки фагов разных видов бактерий. Например, фаги Salmonella typhimurium способны автономно мультимеризоваться в VLP, а на поверхности таких частиц могут быть экспонированы эпитопы вирусов эукариот, включая эпитопы вируса гриппа человека [72]. Вместе с тем, по-видимому, бактериофаги не способны экспонировать протяженный эпитоп, размер которого превышает 24 аминокислотных остатка [67].
Структурные белки ретровирусов и ретротранспозонов обладают большей емкостью, по сравнению с белками бактериофагов. Это значит, что к мономеру белка, образующему частицу, можно подшить протяженный пептид и при этом сохранить способность такого белка к мультимеризации. В частности, для капсидного белка Gag gypsy [73] выявлено, что, по крайней мере, 26% его аминокислотной последовательности (более 100 аминокислотных остатков) несущественно для мультимеризации в VLP [55]. Следовательно, в делетированную форму этого белка можно ввести гетерологичный пептид, по размеру близкий удаленным участкам, и получить рекомбинантный белок, который не утратил способность к самосборке в VLP. Так, делетированный мутант Gag gypsy, в который встроен гетерологичный пептид, образовывал частицы во время синтеза в бактериальной клетке, также мы успешно собирали частицы in vitro из очищенных мономеров белка [47, 55, 74]. Эти частицы были морфологически сходны с нативным вирусом gypsy [75]. Замена делетированного участка в ДНК, кодирующей Gag gypsy, на последовательность, кодирующую главную антигенную детерминанту белка VP1 (EP141-160) вируса ящура и 6‑гистидиновый тег (His6-tag), привела к образованию частиц, на которых был экспонирован EP141–160 как целевой антиген. Преимущество такой методологии состоит в том, что VLP, сформированные из белка, содержащего His6-tag, легко выделять и очищать с помощью аффинной хроматографии [76].
Химерные VLP можно конструировать через создание рекомбинантной ДНК, кодирующей как белок соответствующего вируса, так и чужеродный пептид или белок. А можно псевдотипировать VLP. Этот прием детально разработан на полиомавирусе хомяка. Капсидный белок этого вируса V1 вначале образует пентамеры, которые затем собираются в VLP, состоящие из 72 пентамеров. При совместной экспрессии V1 с минорным капсидным белком V2 последний связывается с каждым пентамером V1 в центральной его части. Показано, что N-концевая часть V2 не влияет на это взаимодействие, так что может быть удалена и заменена необходимым эпитопом [77].
Известен и другой подход. Антиген иммобилизуют на поверхности VLP за счет ковалентного связывания между реакционноспособными группами аминокислотных остатков антигена и VLP. Реализация такой стратегии не привела к успеху из-за нарушения нативной конформации антигена, “пришитого” к поверхности частицы [77, 78]. Эту проблему удалось обойти следующим образом. В субъединицы мономера для сборки VLP встроили последовательность GlyGlyLysGlyGly. В таком окружении Lys реакционноспособная ε-аминогруппа Lys экспонирована и “готова” к взаимодействию с Сys-группой любого белка в присутствии сшивающего агента, например, сульфосукцинимидилового эфира малеимидобензойной кислоты (Sulfo-MBS) [79] или сукцинимидил-6-[(β-малеимидопропионамидо)гексаноата] (SMPH) [80]. Несмотря на утверждения авторов о том, что такая система молекулярной сборки может быть использована для индукции сильного ответа В-лимфацитов против большинства антигенов, и даже были предложены прототипы перспективных вакцин, эта платформа стала прототипом всего для одного перспективного препарата на основе VLP – для снижения артериального давления у гипертоников [80], поскольку появились более совершенные стратегии иммобилизации антигена на поверхности VLP, на которых остановимся ниже.
Одна из них основана на использовании способности His6-tag связываться с мультивалентной трис-нитрилотриуксусной кислотой (trisNTA), которая, в свою очередь, способна связываться с широким спектром молекул, в частности, биотином. Так, на VLP, образованных структурным белком норовируса (NoV), продемонстрированы возможности этой элегантной технологии по функционализации неинфекционных вирусных наночастиц. Используя бакуловирусную систему экспрессии, авторы получили NoV VLP, на поверхности которых экспонирован His6-tag, который сначала использовали для очистки VLP, а затем для связывания молекул trisNTA, конъюгированных с флуоресцентным красителем или биотином, с которым затем успешно связали стрептавидин [81]. Несмотря на то, что несколько авторов указывает на перспективность такого подхода для производства VLP вакцин, данная технология остаётся пока только прототипом, не продвинувшись далее модельных экспериментов.
Поиск технологий эффективной и стабильной иммобилизации антигена на поверхности VLP привел к созданию универсальной платформы, которая позволяет ковалентно присоединять большие антигены к поверхности VLP [82]. В этой молекулярной сборке используется конъюгационная система “метка–ловушка” (tag–catcher), которая была вычленена из CnaB2-домена фибронектинсвязывающего белка FbaB Streptococcus pyogenes. В результате получен высоко реакционноспособный пептид SpyTag (13 аминокислотных остатков), который эффективно взаимодействует с белком SpyCatcher с образованием изопептидных связей в широком диапозоне буферных растворов [83]. Пептид SpyTag встроили в состав VLP-образующего полипепептида фага Acinetobacter (эти частицы получили название AP205), так что каждый мономер, образующий AP205, экспонировал 2 пептида SpyTag. Рекомбинантный антиген, состоящий из целевого белка и пептида SpyCatcher, получали в бактериальных или бакуловирусных системах экспрессии [84]. Полученный антиген эффективно связывался с поверхностью VLP и вызывал сильнейший иммунный ответ. Практически тот же самый эффект выявлен при обратной комбинации конъюгирующих пептидов – то есть, SpyCatcher инкорпорировали в VLP, а SpyTag был сшит с антигеном. Эта система уже используется для разработки различных вакцин, в том числе против туберкулеза и малярии [84, 85]. Недавно появилось сообщение о ее успешном применении в работе по созданию вакцины против рака молочной железы [86]. Эта работа интересна тем, что на поверхности VLP AP205 создали высокую плотность антигена HER2 (рецептор 2 эпидермального фактора человека), синтезированного в культивируемых клетках Drosophila melanogaster [32]. Такие частицы индуцировали сильный иммунный ответ на антиген у пациентов и это позволило преодолеть иммунную толерантность к HER2, характерную для больных HER2-зависимым раком молочной железы [85, 86].
Таким образом, из анализа рассмотренных литературных данных можно сделать вывод, что для функционализации VLP не столь важна природа белка, их образующего, как технология, использование которой позволяет создать высокую концентрацию антигена на поверхности VLP (табл. 1).
Таблица 1.
Примеры универсальных VLP-платформ для презентации антигена
| Стратегия иммобилизации антигена на поверхности частицы | Примеры использования для экспонирования антигена | Cсылка |
|---|---|---|
| Создание ковалентной связи между ε-аминогруппой Lys и антигеном, содержащим свободную Сys-группу, при помощи сшивающего агента | Токсин дифтерии, фактор некроза опухоли (TNFα), модельные вакцины против ряда заболеваний: ревматоидного артрита, остеопороза, аутоиммунного энцефалита, миокардита, гипертонии, болезни Альцгеймера, ожирения, атеросклероза и др. | [79, 80] |
| Связывание His6-tag на поверхности VLP c антигеном через trisNTA адаптерную молекулу | Модельные молекулы: биотин, Alexa 488 (флуоресцентный краситель) и белок GFP, конъюгированные с trisNTA | [81, 87] |
| Образование изопептидных связей между пептидами SpyTag (встроен в мономеры VLP) и SpyCatcher (слит с антигеном) | Вакцина против рака молочной железы (презентация антигена HER2). Используется для разработки вакцины против малярии и туберкулеза | [82–86] |
КОММЕРЧЕСКИЕ ВАКЦИНЫ НА ОСНОВЕ VLP И ПЕРСПЕКТИВЫ РАСШИРЕНИЯ АССОРТИМЕНТА
Несколько VLP-вакцин против заболеваний человека уже есть на фармацевтических рынках многих стран мира. Наиболее известны вакцины против рака шейки матки Cervarix® и Gardasil®, которые успешно используют для профилактики этого заболевания у девочек уже более десяти лет. Оба препарата состоят из VLP, образованных основным капсидным белком L1 вируса папилломы человека нескольких серотипов [37]. Созданы и коммерциализованы препараты Engerix и Recombivax HB – вакцины против вируса гепатита В, представляющие собой VLP, заключенные в липидную мембрану [38], а также Hecolin и Xiamen Innovax – вакцины против гепатита E [88]. Разрешена к использованию противомалярийная вакцина Malaria RTS, состоящая из С-концевой части CS-белка Plasmodium falciparum, просоединенного к поверхностному антигену вируса гепатита B (HBsAg), также используемого в лицензированных вакцинах против гепатита В. Для стабилизации рекомбинантных VLP слитный белок совместно экспрессируют с белком HBsAg в Saccharomyces cerevisiae [89]. Коммерциализирована также вакцина против цирковирусной болезни свиней, представляющая собой VLP, собранные из синтезированного в гетерологичной системе экспрессии капсидного белка VP2 PCV2 [41].
Появляется все больше работ по разработке вакцин на основе наночастиц, включая VLP и/или репликационно неактивные вирусы. К бесспорным преимуществам таких вакцин относится их высокая специфичность, эффективность и хорошие фармакокинетические показатели. Показано, что при попадании в организм VLP достигают лимфатических узлов менее чем за 10 мин, а смесь частиц, несущих разные антигены, может обрабатываться одними и теми же антигенпредставляющими клетками одновременно [90].
Стоит подчеркнуть, что вакцины на основе наночастиц открывают новые возможности в стратегиях иммунопрофилактики, и прежде всего это относится к безынъекционным лекарственным формам, в частности интраназальным и ингаляционным. Использование таких вакцин не будет зависеть от человеческого фактора, что особенно важно при промышленном разведении животных на крупных агропредприятиях, характерных для современной России [91], поскольку крайне сложно организовать одинаковые инъекции вакцины одновременно большому числу животных. Решить эту проблему можно, если распылять вакцину в виде аэрозоля в помещении, где содержатся животные. Впервые возможность такого метода была продемонстрирована на мышах в далеком 1947 году [92]; затем, в 50–70 годы прошлого века в разных странах мира пытались внедрить этот метод в животноводческих и птицеводческих хозяйствах. Такие попытки предпринимались и в Советском Союзе, начиная с 60-х годов [93]. Однако в то времена метод ингаляционного введения вакцины не нашел применения, так как протективный иммунитет достигался только при многократном превышении переносимой дозы. Так, ингаляционное введении вакцины против болезни Ньюкасла приводило к 10–20%-ной смертности птицы [94]. Однако, благодаря появлению вакцин, основанных на экспонировании эпитопов патогена на поверхности наночастиц, в том числе рекомбинантных VLP, наряду с разработками инновационных способов создания аэрозоля, ингаляционная вакцинация стала вновь актуальной темой. Например, биоразлагаемые полимерные наночастицы поли(глицероладипат-со-ω-пентадекалактона, PGA-co-PDL, хорошо зарекомендовали себя как носители антигена при ингаляционной вакцинации [95], а вакцинный препарат на основе аденовируса, с размером частиц от 4 до 10 мкм, при ингаляционном способе введения индуцировал устойчивый протективный иммунитет у обезьян [96]. Наконец, недавно предложена методика аэрозольной VLP-вакцинации против вируса папилломы человека [97].
Одна из важнейших характеристик VLP – имитация вирусной частицы и, как следствие, способность индуцировать сильный иммунный ответ на антиген, который они представляют вне зависимости от источника мономеров, мультимеризующихся в VLP, будь то вирусы насекомых, в частности gypsy [56, 61], или растений [98]. VLP на основе структурных белков вирусов растений, создаваемые в растениях [99], представляют еще одну возможность нетрадиционной вакцинации – “съедобную” [100]. Эти вакцины можно синтезировать непосредственно в растительном корме для животных, и такая оральная вакцинация индуцирует иммунный ответ. На основе вирусов растений разработаны векторы для экспрессии чужеродных белков в растениях, что позволяет создавать растения, продуцирующие рекомбинантные вирусы или VLP, на поверхности которых экспонирован целевой антиген [101, 102]. Также на основе VLP, собранных из структурных белков вирусов растений, создают платформы функционализации – для прикрепления антигенов. Такие платформы основаны на стратегиях, описанных выше. В частности, используют реакционную способность ε-аминогруппы Lys для иммобилизации антигена на поверхности “растительной” VLP [102–105]. На вирусе табачной мозаики [106] и вирусе Х картофеля [104] показано, что стратегия по образованию комплекса стрептавидин-биотин позволяет иммобилизовать достаточно большие антигены на поверхности соответствующих VLP. Наконец, на основе структурного белка растительного вируса разрабатывают платформу по иммобилизации антигена в конъюгационной системе “метка–ловушка” [107]. Стоит отметить, что к недостаткам VLP-вакцин, создаваемых на основе белков, не свойственных млекопитающим, например, взятых из вирусов растений, можно отнести возникновение иммунного ответа организма на структурную компоненту частицы, то есть на белок растительного вируса. Несомненно, что нет терапевтической пользы в создании такого иммунитета, а может ли быть вред – покажут дальнейшие исследования.
Использование VLP для вакцинации в медицине стремительно расширяется. Подтверждает этот тезис перечень клинических испытаний VLP-вакцин, который отслеживается Национальными институтами здравоохранения США (National Institutes of Health). В настоящее время клинические испытания проходят более сотни препаратов VLP-вакцин (https://clinicaltrials.gov/ct2/search/index), которые нацелены на вирусы гриппа человека и птиц, вирус Норфолк, норовирус, ВИЧ-1, вирус Чикунгунья, вирус ящура, а также направлены против меланомы, аденокарциномы, папилломатозов и рака шейки матки. Можно прогнозировать, что ассортимент вакцин на основе наночастиц против различных онкологических заболеваний и вирусных инфекций будет неуклонно расширяться, а также появятся VLP, предназначенные для иммунизации против микроорганизмов различных таксонов и гельминтов.
Авторы благодарят дизайнеров ИСИЭЗ НИУ ВШЭ Олега Васильева и Галину Подзолкову за квалифицированную помощь в подготовке иллюстраций к этому обзору.
Статья подготовлена в ходе проведения исследования в рамках Программы фундаментальных исследований Национального исследовательского университета “Высшая школа экономики” (НИУ ВШЭ) и с использованием средств субсидии в рамках государственной поддержки ведущих университетов Российской Федерации “5-100”.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lu Y., Chan W., Ko B.Y., Van Lang C.C., Swartz J.R. (2015) Assessing sequence plasticity of a virus-like nanoparticle by evolution toward a versatile scaffold for vaccines and drug delivery. Proc. Natl. Acad. Sci. USA. 112, 12360–12365.
Ho S.C., Yang Y. (2014) Identifying and engineering promoters for high level and sustainable therapeutic recombinant protein production in cultured mammalian cells. Biotechnol. Lett. 36, 1569–1579.
Mandl J.N., Schneider C., Schneider D.S., Baker M.L. (2018) Going to bat(s) for studies of disease tolerance. Front. Immunol. 9, 2112. doi https://doi.org/10.3389/fimmu.2018.02112
Zhang S., Yong L.K., Li D., Cubas R., Chen C., Yao Q. (2013) Mesothelin virus-like particle immunization controls pancreatic cancer growth through CD8+ T cell induction and reduction in the frequency of CD4+ foxp3+ ICOS- regulatory T cells. PLoS One. 8, e68303. doi https://doi.org/10.1371/journal.pone.0068303
Domingo E., Perales C. (2018) Quasispecies and virus. EurBiophys J. 47, 443–457.
Contreras M., Villar M., Alberdi P., de la Fuente J. (2016) Vaccinomics approach to tick vaccine development. Methods Mol. Biol. 1404, 275–286.
De Groot A.S. (2004) Immunome-derived vaccines. Exp. Opin. Biol. Ther. 4, 767–772.
Fiser A., Sali A. (2003) Modeller: generation and refinement of homology-based protein structure models. Methods Enzymol. 374, 461–491.
Zhang Y. (2007) Template-based modeling and free modeling by I-TASSER in CASP7. Proteins. 69(Suppl. 8), 108–117.
Reber H. (1973) Proceedings: basic considerations on the requirements to be met by disinfection procedures: the Swiss model. Zentralbl. Bakteriol. Orig. B. 157, 478–494.
Lambert C., Léonard N., De Bolle X., Depiereux E. (2002) ESyPred3D: prediction of proteins 3D structures. Bioinformatics. 18, 1250–1256.
Bates P.A., Kelley L.A., MacCallum R.M., Sternberg M.J. (2001) Enhancement of protein modeling by human intervention in applying the automatic programs 3D-JIGSAW and 3D-PSSM. Proteins. 5, 39–46.
Bennett-Lovsey R.M., Herbert A.D., Sternberg M.J., Kelley L.A. (2008) Exploring the extremes of sequence/structure space with ensemble fold recognition in the program Phyre. Proteins. 70, 611–625.
Lund O., Frimand K., Gorodkin J., Bohr H., Bohr J., Hansen J., Brunak S. (1997) Protein distance constraints predicted by neural networks and probability density functions. Protein Eng. 10, 1241–1248.
Guo J.T., Ellrott K., Xu Y. (2008) A historical perspective of template-based protein structure prediction. Methods Mol. Biol. 413, 3–42.
Qian B., Raman S., Das R., Bradley P., McCoy A.J., Read R.J., Baker D. (2007) High-resolution structure prediction and the crystallographic phase problem. Nature. 450, 259–264.
Zhang Y, Skolnick J. (2004) Scoring function for automated assessment of protein structure template quality. Proteins. 57, 702–710.
Crooks E.T., Moore P.L., Franti M., Cayanan C.S., Zhu P., Jiang P., de Vries R.P., Wiley C., Zharkikh I., Schülke N., Roux K.H., Montefiori D.C., Burton D.R., Binley J.M. (2007) A comparative immunogenicity study of HIV-1 virus-like particles bearing various forms of envelope proteins, particles bearing no envelope and soluble monomeric gp120. Virology. 366, 245–262.
Medina-Ramírez M., Sanders R.W., Sattentau Q.J. (2017) Stabilized HIV-1 envelope glycoprotein trimers for vaccine use. Curr. Opin. HIV AIDS. 12, 241–249.
Maegawa K., Shibata T., Yamaguchi R., Hiroike K., Izzati U.Z., Kuroda K., Sugita S., Kawasaki K., Nero-me R., Nerome K. (2018) Overexpression of a virus-like particle influenza vaccine in Eri silkworm pupae, using Autographa californica nuclear polyhedrosis virus and host-range expansion. Arch. Virol. 163, 2787–2797.
Ding X., Liu D., Booth G., Gao W., Lu Y. (2018) Virus-like particle engineering: from rational design to versatile applications. Biotechnol. J. 13, e1700324. doi https://doi.org/10.1002/biot.201700324
Elliott S.L., Suhrbier A., Miles J.J., Lawrence G., Pye S.J., Le T.T., Rosenstengel A., Nguyen T., Allworth A., Burrows S.R., Cox J., Pye D., Moss D.J., Bharadwaj M. (2008) Phase I trial of a CD8+ T cell peptide epitope-based vaccine for infectious mononucleosis. J. Virol. 82, 1448–1457.
Madera R., Gong W., Wang L., Burakova Y., Lleellish K., Galliher-Beckley A., Nietfeld J., Henningson J., Jia K., Li P., Bai J., Schlup J., McVey S., Tu C., Shi J. (2016) Pigs immunized with a novel E2 subunit vaccine are protected from subgenotype heterologous classical swine fever virus challenge. BMC Vet. Res. 12(1), 197. doi https://doi.org/10.1186/s12917-016-0823-4
Ahmed K.S., Hussein S.A., Ali A.H., Korma S.A., Lipeng Q., Jinghua C. (2018) Liposome: composition, characterisation, preparation, and recent innovation in clinical applications. J. Drug Target. 1–20. doi https://doi.org/10.1080/1061186X.2018.1527337
Gregory A.E., Titball R., Williamson D. (2013) Vaccine delivery using nanoparticles. Front. Cell. Infect. Microbiol. 3, 13. doi https://doi.org/10.3389/fcimb.2013.00013
Mustafaeva Z. (2016) Polymers in vaccine formulation. Sigma J. Eng. Nat. Sci. 34, 439–451.
Wang X., Cao F., Yan M., Liu Y., Zhu X., Sun H., Ma G. (2019) Alum-functionalized graphene oxide nanocomplexes for effective anticancer vaccination. Acta Biomater. 83, 390–399.
Fadel T.R., Fahmy T.M. (2014) Immunotherapy applications of carbon nanotubes: from design to safe applications. Trends Biotechnol. 32, 198–209.
Chackerian B., Frietze K.M. (2016) Moving towards a new class of vaccines for non-infectious chronic diseases. Expert. Rev. Vaccines. 15, 561–563.
Bachmann M.F., Jennings G.T. (2010) Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns. Nat. Rev. Immunol. 10, 787–96.
Mohsen M.O., Gomes A.C., Vogel M., Bachmann M.F. (2018) Interaction of viral capsid-derived virus-like particles (VLPs) with the innate immune system. Vaccines (Basel). 6, pii: E37. doi https://doi.org/10.3390/vaccines6030037
Moraes A.M., Jorge S.A., Astray R.M., Suazo C.A., CalderónRiquelme C.E., Augusto E.F., Tonso A., Pamboukian M.M., Piccoli R.A., Barral M.F., Pereira C.A. (2012) Drosophila melanogaster S2 cells for expression of heterologous genes: from gene cloning to bioprocess development. Biotechnol. Adv. 30, 613–628.
Syomin B.V, Pelisson A., Ilyin Y.V, Bucheton A. (2004) Expression of the retrovirus Gypsy Gag in Spodoptera frugiperda cell culture with the recombinant baculovirus. Dokl. Biochem. Biophys. 398, 310–312.
Ren J., Bell G., Coy D.H., Brunicardi F.C. (1997) Activation of human somatostatin receptor type 2 causes inhibition of cell growth in transfected HEK293 but not in transfected CHO cells. J. Surg. Res. 71, 13–18.
Li K., Zhong B. (2018) Regulation of cellular antiviral signaling by modifications of ubiquitin and ubiquitin-like molecules. Immune Netw. 18, e4. doi https://doi.org/10.4110/ in.2018.18.e4
Masavuli M.G., Wijesundara D.K., Torresi J., Gowans E.J., Grubor-Bauk B. (2017) Preclinical development and production of virus-like particles as vaccine candidates for hepatitis C. Front. Microbiol. 8, 2413. doi https://doi.org/10.3389/fmicb.2017.02413
Godi A., Bissett S.L., Miller E., Beddows S. (2015) Relationship between humoral immune responses against HPV16, HPV18, HPV31 and HPV45 in 12-15 year old girls receiving Cervarix® or Gardasil® Vaccine. PLoS One. 10, e0140926. doi https://doi.org/10.1371/journal.pone.0140926
Rustandi R.R., Wang F., Hamm C., Cuciniello J.J., Marley M.L. (2014) Development of imaged capillary isoelectric focusing method and use of capillary zone electrophoresis in hepatitis B vaccine RECOMBIVAX HB®. Electrophoresis. 35, 1072–1078.
Shen C., Ku Z., Zhou Y., Li D., Wang L., Lan K., Liu Q., Huang Z. (2016) Virus-like particle-based vaccine against coxsackievirus A6 protects mice against lethal infections. Vaccine. 34, 4025–4031.
Zheng X., Wang S., Zhang W., Liu X., Yi Y., Yang S., Xia X., Li Y., Zhang Z. (2016) Development of a VLP-based vaccine in silkworm pupae against rabbit hemorrhagic disease virus. Int. Immunopharmacol. 40, 164–169.
Pan Q., He K., Huang K. (2008) Development of recombinant porcine parvovirus-like particles as an antigen carrier formed by the hybrid VP2 protein carrying immunoreactive epitope of porcine circovirus type 2. Vaccine. 26, 2119–2126.
Patterson R., Eley T., Browne C., Martineau H.M., Werling D. (2015) Oral application of freeze-dried yeast particles expressing the PCV2b Cap protein on their surface induce protection to subsequent PCV2b challenge in vivo. Vaccine. 33, 6199–6205.
Zhang H., Qian P., Liu L., Qian S., Chen H., Li X. (2014) Virus-like particles of chimeric recombinant porcine circovirus type 2 as antigen vehicle carrying foreign epitopes. Viruses. 6, 4839–4855.
Li P.C., Qiao X.W., Zheng Q.S., Hou J.B. (2016) Immunogenicity and immunoprotection of porcine circovirus type 2 (PCV2) Cap protein displayed by Lactococcus lactis. Vaccine. 34, 696–702.
Xiao Y., Chen H.Y., Wang Y., Yin B., Lv C., Mo X., Yan H., Xuan Y., Huang Y., Pang W., Li X., Yuan Y.A., Tian K. (2016) Large-scale production of foot-and-mouth disease virus (serotype Asia1) VLP vaccine in Escherichia coli and protection potency evaluation in cattle. BMC Biotechnol. 16(1), 56. doi https://doi.org/10.1186/ s12896-016-0285-6
Wang A., Gu L., Wu S., Zhu S. (2018) Duck hepatitis A virus structural proteins expressed in insect cells self-assemble into virus-like particles with strong immunogenicity in ducklings. Vet. Microbiol. 215, 23–28.
Syomin B.V., Leonova O.G., Trendeleva T.A., Zviagil’skaia R.A., Ilyin Y.V., Popenko V.I. (2012) Effect of nucleocapsid on multimerization of gypsy structural protein Gag. Mol. Biol. (Mosk.). 46, 270–278.
Dong Y., Cai J., Chen H., Chen L. (2016) Protection of a novel epitope-RNA VLP double-effective VLP vaccine. Antiviral Res. 134, 108–116.
Zhou Y., He C., Wang L., Ge B. (2017) Post-translational regulation of antiviral innate signaling. Eur. J. Immunol. 47, 1414–1426.
Panda S.K., Kapur N., Paliwal D., Durgapal H. (2015) Recombinant hepatitis E virus like particles can function as RNA nanocarriers. J. Nanobiotechnol. 13, 44. doi https://doi.org/10.1186/s12951-015-0101-9
Voronkova T., Kazaks A., Ose V., Scherneck S., Pumpens P., Ulrich R. (2007) Hamster polyomavirus-derived virus-like particles are able to transfer in vitro encapsidated plasmid DNA to mammalian cells. Virus Genes. 34, 303–314.
Kimchi-Sarfaty C., Arora M., Sandalon Z., Oppenheim A., Gottesman M.M. (2003) High cloning capacity of in vitro packaged SV40 vectors with no SV40 virus sequences. Hum. Gene Ther. 14, 167–177.
Barr S.M., Keck K., Aposhian H.V. (1979) Cell-free assembly of a polyoma-like particlefrom empty capside and DNA. Virology. 96, 656–659.
Touzé A., Bousarghin L., Ster C., Combita A.L., Roingeard P., Coursaget P. (2001) Gene transfer using human polyomavirus BK virus-like particles expressed in insect cells. J. Gen. Virol. 82, 3005–3009.
Syomin B.V., Ivanova L.A., Popenko V.I., Ilyin Y.V. (2011) The structural protein Gag of the gypsy retrovirus forms virus-like particles in the bacterial cell. Mol. Biol. (Mosk). 45, 472–478.
Bush D.L., Vogt V.M. (2014) In vitro assembly of retroviruses. Annu. Rev. Virol. 1, 561–580.
Strods A., Ose V., Bogans J., Cielens I., Kalnins G., Radovica I., Kazaks A., Pumpens P., Renhofa R. (2015) Preparation by alkaline treatment and detailed characterisation of empty hepatitis B virus core particles for vaccine and gene therapy applications. Sci. Rep. 5, 11639. doi https://doi.org/10.1038/srep11639
Sarkar K., Sadhukhan S., Han S.S., Vyas Y.M. (2015) SUMOylation-disrupting WAS mutation converts WASp from a transcriptional activator to a repressor of NF-κB response genes in T cells. Blood. 126, 1670–1682.
Syomin B.V., Malikova M.A., Stepanov A.S, Ilyin Y.V. (2002) Homologous and heterologous type 2 casein kinases have the same effect on the affinity for RNA of the Gag structural protein of gypsy (mdg4). Mol. Biol. (Mosk). 36, 28–29.
Melchior F. (2000) SUMO – nonclassical ubiquitin. Annu. Rev. Cell Dev. Biol. 16, 591–626.
Syomin B.V., Ilyin Y.V. (2004) The functional motifs that are revealed in the Gypsy gag amino acid sequence. Dokl. Biochem. Biophys. 398, 291–293.
Gottwein E., Kräusslich H.G. (2005) Analysis of human immumodeficiency virus type 1 Gag ubiquitination. J. Virol. 79, 9134–9144.
Jäger S., Cimermancic P., Gulbahce N., Johnson J.R., McGovern K.E., Clarke S.C., Shales M., Mercenne G., Pache L., Li K., Hernandez H., Jang G.M., Roth S.L., Akiva E., Marlett J., Stephens M., D’Orso I., Fernandes J., Fahey M., Mahon C., O’Donoghue A.J., Todorovic A., Morris J.H., Maltby D.A., Alber T., Cagney G., Bushman F.D., Young JA, Chanda S.K., Sundquist W.I., Kortemme T., Hernandez R.D., Craik C.S., Burlingame A., Sali A., Frankel A.D., Krogan N.J. (2011) Global landscape of HIV-human protein complexes. Nature. 481, 365–370.
Lee D.H., Lee S.H., Kim A.R., Quan F.S. (2016) Virus-like nanoparticle vaccine confers protection against Toxoplasma gondii. PLoS One. 11, e0161231. doi https://doi.org/10.1371/journal.pone.0161231
Pleckaityte M., Bremer C.M., Gedvilaite A., Kucin-skaite-Kodze I., Glebe D., Zvirbliene A. (2015) Construction of polyomavirus-derived pseudotype virus-like particles displaying a functionally active neutralizing antibody against hepatitis B virus surface antigen. BMC Biotechnology. 15, 85. doi https://doi.org/10.1186/s12896-015-0203-3
Sominskaya I., Skrastina D., Dislers A., Vasiljev D., Mihailova M., Ose V., Dreilina D., Pumpens P. (2010) Construction and immunological evaluation of multivalent hepatitis B virus (HBV) core virus-like particles carrying HBV and HCV epitopes. Clin. Vaccine Immunol. 17, 1027–1033.
Mastico R.A., Talbot S.J., Stockley P.G. (1993) Multiple presentation of foreign peptides on the surface of an RNA-free spherical bacteriophage capsid. J. Gen. Virol. 74, 541–548.
Dong Y., Zhang G., Huang X.J., Chen L., Chen H.T. (2015) Promising MS2 mediated virus-like particle vaccine against foot-and-mouth disease. Antiviral Res. 117, 39–43.
Wong H.T., Cheng S.C., Chan E.W., Sheng Z.T., Yan W.Y., Zheng Z.X., Xie Y. (2000) Plasmids encoding foot-and-mouth disease virus VP1 epitopes elicited immune responses in mice and swine and protected swine against viral infection. Virology. 278, 27–35.
Chen W., Liu M., Jiao Y., Yan W., Wei X., Chen J., Fei L., Liu Y., Zuo X., Yang F., Lu Y., Zheng Z. (2006) Adenovirus-mediated RNA interference against foot-and-mouth disease virus infection both in vitro and in vivo. J. Virol. 80, 3559–3566.
Shao J.J., Wong C.K., Lin T., Lee S.K., Cong G.Z., Sin F.W., Du J.Z., Gao S.D., Liu X.T., Cai X.P., Xie Y., Chang H.Y., Liu J.X. (2011) Promising multipleepitope recombinant vaccine against foot-and-mouth disease virus type O in swine. Clin. Vaccine Immunol. 18, 143–149.
Schwarz B., Madden P., Avera J., Gordon B., Larson K., Miettinen H.M., Uchida M., LaFrance B., Basu G., Rynda-Apple A., Douglas T. (2015) Symmetry controlled, genetic presentation of bioactive proteins on the p22 virus-like particle using an external decoration protein. ACS Nano. 9, 9134–9147.
Syomin B.V., Fedorova L.I., Surkov S.A., Ilyin Y.V. (2001) Drosophila melanogaster endogenous retrovirus gypsy can propagate in Drosophila hydei cells. Mol. Gen. Genet. 264, 588–594.
Syomin B.V., Popenko V.I., Malikova M.A., Stepa-nov A.S., Ilyin Y.V. (2001) Bacterially expressed polyprotein Gag of retroelement gypsy (MDG 4) is able to form multimeric complexes. Dokl. Biochem. Biophys. 380, 322–324.
Syomin B.V., Kandror K.V., Semakin A.B., Tsuprun V.L., Stepanov A.S. (1993) Presence of gypsy (mdg4) retrotransposon in the extracellular virus like particles. FEBS Lett. 323, 285–288.
Сёмин Б.В. Самуйленко А.Я. (2017) Новейшая стратегия создания вакцин в ветеринарии, определенная развитием вакциномики. Эпизоотология, иммунобиология, фармакология, санитария. 1, 48–56.
Dorn D.C., Lawatscheck R., Zvirbliene A., Aleksaite E., Pecher G., Sasnauskas K., Ozel M., Raftery M., Schönrich G., Ulrich R.G., Gedvilaite A. (2008) Cellular and humoral immunogenicity of hamster polyomavirusderived virus-like particles harboring a mucin 1 cytotoxic T-cell epitope. Viral Immunol. 21, 12–27.
Smith M.T., Hawes A.K., Bundy B.C. (2013) Reengineering viruses and virus-like particles through chemical functionalization strategies. Curr. Opin. Biotechnol. 24, 620–626.
Sapsford K.E., Algar W.R., Berti L., Gemmill K.B., Casey B.J., Oh E., Stewart M.H., Medintz I.L. (2013) Functionalizing nanoparticles with biological molecules: developing chemistries that facilitate nanotechnology. Chem. Rev. 113, 1904–2074.
Jennings G.T., Bachmann M.F. (2009) Immunodrugs: therapeutic VLP-based vaccines for chronic diseases. Annu. Rev. Pharmacol. Toxicol. 49, 303–326. doi https://doi.org/10.1146/annurev-pharmtox-061008-103129
Koho T., Ihalainen T.O., Stark M., Uusi-Kerttula H., Wieneke R., Rahikainen R., Blazevic V., Marjomäki V., Tampé R., Kulomaa M.S., Hytönen V.P. (2015) His-tagged norovirus-like particles: a versatile platform for cellular delivery and surface display. Eur. J. Pharm. Biopharm. 96, 22–31. doi https://doi.org/10.1016/j.ejpb.2015.07.002
Jegerlehner A., Tissot A., Lechner F., Sebbel P., Erdmann I., Kündig T., Bächi T., Storni T., Jennings G., Pumpens P., Renner W.A., Bachmann M.F. (2002) A molecular assembly system that renders antigens of choice highly repetitive for induction of protective B cell responses. Vaccine. 20, 3104–3112.
Thrane S., Janitzek C.M., Matondo S., Resende M., Gustavsson T., de Jongh W.A., Clemmensen S., Roeffen W., van de Vegte-Bolmer M., van Gemert G.J., Sauerwein R., Schiller J.T., Nielsen M.A., Theander T.G., Salanti A., Sander A.F. (2016) Bacterial superglue enables easy development of efficient virus-like particle based vaccines. J. Nanobiotechnol. 14, 30. doi https://doi.org/10.1186/s12951-016-0181-1
Zakeri B., Fierer J.O., Celik E., Chittock E.C., Schwarz-Linek U., Moy V.T., Howarth M. (2012) Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin. Proc. Natl. Acad. Sci. USA. 109(12), E690–E697. doi https://doi.org/10.1073/ pnas.1115485109
Singh S.K., Thrane S., Janitzek C.M., Nielsen M.A., Theander T.G., Theisen M., Salanti A., Sander A.F. (2017) Improving the malaria transmission-blocking activity of a Plasmodium falciparum 48/45 based vaccine antigen by SpyTag/SpyCatcher mediated virus-like display. Vaccine. 35(30), 3726–3732.
Palladini A., Thrane S., Janitzek C.M., Pihl J., Clemmensen S.B., de Jongh W.A, Clausen T.M., Nicoletti G., Landuzzi L., Penichet M.L., Balboni T., Ianzano M.L., Giusti V., Theander T.G., Nielsen M.A., Salanti A., Lollini P.L., Nanni P., Sander A.F. (2018) Virus-like particle display of HER2 induces potent anti-cancer responses. Oncoimmunology. 7(3), e1408749. doi https://doi.org/10.1080/ 2162402X.2017.1408749
Xie J., Li K., Gao Y., Huang R., Lai Y., Shi Y., Yang S., Zhu G., Zhang Q., He J. (2016) Structural analysis and insertion study reveal the ideal sites for surface displaying foreign peptides on a betanodavirus-like particle. Vet. Res. 47, 16. doi https://doi.org/10.1186/s13567-015-0294-9
Wu T., Li S.W., Zhang J., Ng M.H., Xia N.S., Zhao Q. (2012) Hepatitis E vaccine development: a 14 year odyssey. Hum. Vaccin. Immunother. 8, 823–827.
Vandoolaeghe P., Schuerman L. (2016) The RTS, S/AS01 malaria vaccine in children 5 to 17 months of age at first vaccination. Expert Rev. Vaccines. 15, 1481–1493.
Mohsen M.O., Gomes A.C., Cabral-Miranda G., Krueger C.C., Leoratti F.M., Stein J.V., Bachmann M.F. (2017) Delivering adjuvants and antigens in separate nanoparticles eliminates the need of physical linkage for effective vaccination. J. Control. Release. 251, 92–100.
Dranev Y., Kotsemir M., Syomin B. (2018) Diversity of research publications: relation to agricultural productivity and possible implications for STI policy. Scientometrics. 116, 1565–1587.
Bryson V., Swanstrom M. (1947) Immunization of mice against pneumococcal pneumonia by inhaled polysaccharide. J. Bacteriol. 54, 87.
Писаревский Ю.С. (1963) Анатомо-физиологические особенности дыхательной системы человека и животных в генезе иммунитета после вакцинации аэрозольным методом. I. Роль строения дыхательных путей в механическом удержании вдыхаемого материала. Журн. микробиол. эпидемиол. иммунобиологии. 40, 57–61.
Fournier J.M., Gaudry D., Moreau Y., Balençon, Fontanges R. (2076) Dry aerosol vaccination against Newcastle disease. I. Safety and activity controls on chickens. Dev. Biol. Stand. 33, 269–272.
Kunda N.K., Alfagih I.M., Dennison S.R., Tawfeek H.M., Somavarapu S., Hutcheon G.A., Saleem I.Y. (2015) Bovine serum albumin adsorbed PGA-co-PDL nanocarriers for vaccine delivery via dry powder inhalation. Pharmacol. Res. 32, 1341–1353.
Bolton D.L., Song K., Tomaras G.D., Rao S., Roederer M. (2017) Unique cellular and humoral immunogenicity profiles generated by aerosol, intranasal, or parenteral vaccination in rhesus macaques. Vaccine. 35, 639–646.
Ilic V., Dunet V., Le Pape A., Buchs M., Kosinski M., Bischof Delaloye A., Gerber S., Prior J.O. (2016) SPECT/CT study of bronchial deposition of inhaled particles. A human aerosol vaccination model against HPV. Nuklearmedizin. 55, 203–208.
Bachmann M.F., Zabel F. (2016) Immunology of virus-like particles. In: Viral Nanotechnology. Eds Khudyakov Y.E., Pumpens P. Boca Raton, CRC Press. pp. 121–128.
Shirbaghaee Z., Bolhassani A. (2016) Different applications of virus-like particles in biology and medicine: vaccination and delivery systems. Biopolymers. 105, 113–132. doi https://doi.org/10.1002/bip.22759
Wesołowska A., Kozak Ljunggren M., Jedlina L., Basałaj K., Legocki A., Wedrychowicz H., Kesik-Brodacka M. (2018) A preliminary study of a lettuce-based edible vaccine expressing the cysteine proteinase of fasciola hepatica for fasciolosis control in livestock. Front. Immunol. 9, 2592. doi https://doi.org/10.3389/fimmu.2018.02592
Musiychuk K., Stephenson N., Bi H., Farrance C.E., Orozovic G., Brodelius M., Brodelius P., Horsey A., Ugulava N., Shamloul A.M., Mett V., Rabindran S., Streatfield S.J., Yusibov V. (2006) A launch vector for the production of vaccine antigens in plants. Influenza Other Respir. Viruses. 1, 19–25.
O'Brien G.J., Bryant C.J., Voogd C., Greenberg H.B., Gardner R.C., Bellamy A.R. (2000) Rotavirus VP6 expressed by PVX vectors in Nicotiana benthamiana coats PVX rods and also assembles into virus-like particles. Virology. 270, 444–453.
McCormick A.A., Corbo T.A., Wykoff-Clary S., Palmer K.E., Pogue G.P. (2006) Chemical conjugate TMV-peptide bivalent fusion vaccines improve cellular immunity and tumor protection. Bioconjug. Chem. 17, 1330–1338.
Steinmetz N.F., Mertens M.E., Taurog R.E., Johnson J.E., Commandeur U., Fischer R., Manchester M. (2010) Potato virus X as a novel platform for potential biomedical applications. Nano Lett. 10, 305–312.
Zeltins A., West J., Zabel F., El Turabi A., Balke I., Haas S., Maudrich M., Storni F., Engeroff P., Jennings G.T., Kotecha A., Stuart D.I., Foerster J., Bachmann M.F. (2017) Incorporation of Tetanus-epitope into virus-like particles achieves vaccine responses even in older recipients in models of psoriasis, Alzheimer’s and cat allergy. NPJ Vaccines. 2, 30. doi https://doi.org/10.1038/s41541-017-0030-8
Smith M.L., Lindbo J.A., Dillard-Telm S., Brosio P.M., Lasnik A.B., McCormick A.A., Nguyen L.V., Palmer K.E. (2006) Modified tobacco mosaic virus particles as scaffolds for display of protein antigens for vaccine applications. Virology. 348, 475–788.
Balke I., Zeltins A. (2018) Use of plant viruses and virus-like particles for the creation of novel vaccines. Adv. Drug Deliv. Rev. pii: S0169-409X(18)30204-7. doi https://doi.org/10.1016/j.addr.2018.08.007
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


