Молекулярная биология, 2019, T. 53, № 4, стр. 648-653
Соматические мутации, вносящие вклад в метастазирование акральной меланомы
И. С. Абрамов a, М. А. Емельянова a, О. О. Рябая b, Г. С. Краснов a, А. С. Заседателев a, Т. В. Наседкина a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
199991 Москва, Россия
b Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации
115478 Москва, Россия
* E-mail: nased@biochip.ru
Поступила в редакцию 30.11.2018
После доработки 10.12.2018
Принята к публикации 10.12.2018
Аннотация
Одна из наиболее агрессивных быстрорастущих форм меланомы – акральная меланома, характеризуется локализацией преимущественно на ладонях и ступнях. Методом массового параллельного секвенирования изучены образцы опухолей, метастазов и нормальной ткани пяти пациентов с акральной формой меланомы. Проанализированы кодирующие участки 4100 генов, ответственных за возникновение и развитие наследственных и онкологических заболеваний. Выявлены изменения в генах-регуляторах клеточного деления, пролиферации и апоптоза (BRAF, NRAS, VAV1, GATA1, GCM2), в генах, кодирующих белки клеточной адгезии (CTNND2, ITGB4) и ангиогенеза (VEGFA), а также в генах, ответственных за регуляцию энергетического обмена (BCS1L). С помощью сравнительного секвенирования целевых ДНК, выделенных из морфологически нормальной и опухолевой ткани, включая метастазы, выявлены гены-кандидаты, ответственные за быстрое метастазирование акральной меланомы.
Меланома – одно из самых агрессивных злокачественных новообразований. Меланома кожи характеризуется частыми рецидивами и высоким риском появления метастазов, в том числе отдаленных. Частота данного заболевания в России составляет около 60 на каждые 100 000 населения, а рост заболеваемости в период с 2004 по 2014 год – 20.37%11. Выделяют несколько типов меланомы, которые различаются по прохождению определенной фазы роста и локализации. К основным подтипам меланомы относятся: поверхностно-распространенная меланома (80% случаев), злокачественное лентиго (10–13%), акрально-лентигиозная (8%), лентигиозная, или мукозальная меланома слизистых оболочек (1.2%), узловая меланома (15–30%). Крайне редко встречается меланома слизистых оболочек дыхательного и желудочно-кишечного тракта [1‒3].
Акрально-лентигиозная меланома – особый подтип меланомы с уникальными гистологическими и клиническими характеристиками, занимающий промежуточное положение между поверхностно-распространенной и узловой формами. Акрально-лентигиозная меланома локализуется в области стоп и кистей, т.е. на участках кожи, которые в меньшей степени подвергаются действию УФ-излучения [4, 5].
Эта форма меланомы отличается наиболее неблагоприятным прогонозом, быстрым прогрессированием и высоким метастатическим потенциалом. Акральная меланома обладает рядом молекулярно-генетических особенностей. Согласно опубликованным данным, этот подтип меланомы отличается от поверхностно-распространенной формы частотой мутаций в генах NRAS, BRAF. В целом, изучение экспрессии генов показывает, что в патогенез акральной формы меланомы вовлечено больше генов, чем при других формах меланомы [3, 6].
Для изучения вероятных механизмов опухолевой прогрессии и ее метастатического потенциала с целью выбора дальнейшей терапии требуется метод, с помощью которого можно проанализировать большое количество генов, вовлеченных в патогенез данного заболевания. Наиболее распространен анализ кодирующих участков генов методом массового параллельного секвенирования. Использование этого подхода позволяет получить полную информацию о нуклеотидной последовательности генома или отдельных его участков. Цель данной работы состояла в проведении анализа драйверных соматических мутаций в образцах акральной меланомы. В ходе этой работы нами обнаружен достаточно широкий спектр соматических нарушений в генах регуляторных каскадов, маркеров адгезии, ангиогенеза и метаболизма.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пациенты. В данное исследование вошли пять пациентов. У двух из них анализировали образцы первичной опухоли, метастазов и периферической крови, у одного – два образца метастазов, возникших до лечения и в процессе таргетной терапии, а также образец периферической крови. У двух пациентов анализировали образцы первичной опухоли и периферической крови.
Выделение ДНК. Геномную ДНК выделяли из образцов замороженной ткани и крови с использованием набора QIAampDNAMiniKit (“Qiagen”, Германия). Концентрацию ДНК измеряли с помощью флуориметра Qubit 2 (“Invitrogen”, США), набора реагентов Qubit® dsDNAHS (“Invitrogen”). Степень фрагментации и чистоту ДНК оценивали с помощью микроспектрофотометра NanoDrop™ 3300 (“Thermo Scientific”, США), а также гель-электрофореза.
Массовое параллельное секвенирование. Целевые последовательности ДНК отбирали с использованием панели жидких зондов Inherited Disease Panel (IDP) (“Roche”, Швейцария). Олигонуклеотиды конструировали в виде последовательностей, комплементарных кодирующей части 4100 генов, ответственных за возникновение и развитие наследственных и онкологических заболеваний (“медицинский экзом”). Подготовку образцов проводили по стандартному протоколу для приготовления быстрых библиотек KAPA Library Preparation Kit (“Roche”). Образцы ДНК фрагментировали c помощью ультразвука (технология Covaris), затем с помощью набора экзонуклеаз и ДНК-полимераз получали фрагменты с тупыми концами и лигировали их с адаптерами. Адаптеры содержали последовательности для отжига универсальных праймеров и молекулярные баркоды. Фрагментацию ДНК контролировали с помощью системы капиллярного электрофореза (“Agilent” США). Далее полученные библиотеки ДНК амплифицировали и гибридизовали с зондами IDP. После отбора целевых последовательностей проводили загрузку секвенатора по стандартному протоколу (“Illumina”, США). Секвенирование проводили на платформе NextSeq 500 (“Illumina”).
Анализ результатов секвенирования и использованные базы данных. После вырезания из прочтений последовательностей адаптеров [7] оценивали бактериальное загрязнение ридов. Затем все прочтения сопоставляли с референсным геномом человека GRCh37.75 (Ensembl). Далее из анализа исключали ПЦР-клоны и проводили калибровку оценки базового качества с использованием GATK4 (версия 4.0.8.1) [8]. Для определения соматических мутаций (SNV и indels) использовали программу Mutect2 [9] из GATK4. Перед определением соматических вариантов запускали Mutect2 в режиме “только для опухоли” на всех пяти образцах ДНК из нормальной ткани для создания панели нормы (PoN). Затем использовали производный PoN для выявления соматических мутаций с Mutect2 в режиме “опухоль против нормального”. Полученные VCF-файлы анализировали с помощью GATK Filter Mutect Calls. В дальнейшем анализировали только соматические варианты, прошедшие фильтры.
Полученный список вариантов аннотировали с помощью Annovar [9]. Использовали базы данных о популяционных частотах аллелей (gеnomAD, 1000 GenomesProject, Kaviar, ESP 6500, ExAC), dbSNP, ClinVar, COSMIC, локализацию в домене белка (Interpro), информацию о консервативных сайтах (позвоночные животные phastCons и млекопитающие). Кроме того, для оценки патогенности полиморфного варианта в анализ включали аннотации SIFT [10], PolyPhen2 [11], Mutation Taster [12], LRT [13], PROVEAN, M-CAP, DANN, MetaSVM и MetaLR.
Варианты с популяционной частотой более 1% из анализа исключали. Стоит отметить, что количество таких вариантов не превышало 5% от всех соматических полиморфных вариантов, локализованных в кодирующих областях, и 10% – от всех соматических вариантов, которые прошли FilterMutectCalls, включая интронные и межгенные. Кроме того, список соматических вариантов был отфильтрован в соответствии с минимальным порогом покрытия считывания (минимум 20 считываний для объединенного нормального образца и минимум 10 для образца опухоли). Из анализа исключали также SNV-мотивы polyN, в частности GGGTG>GGGGG, CCCCG>CCCCC.
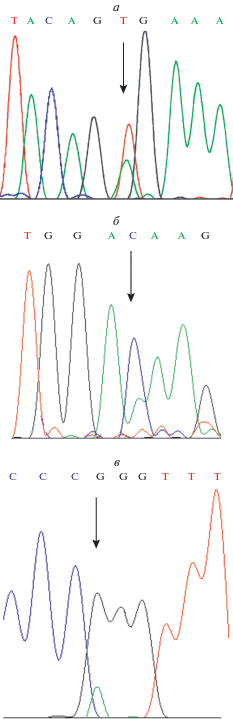
Верификация мутаций методом секвенирования по Сэнгеру. Выявленные соматические мутации и редкие герминальные полиморфизмы изучали с помощью прямого секвенирования по Сэнгеру c использованием специфичных праймеров, подобранных для каждой мутации. Результаты анализировали с помощью программы Chromas Lite (рис. 1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В каждом из образцов опухолевой ДНК обнаружено не менее 100 различных структурных изменений, отличающих эту ДНК от геномной ДНК, выделенной из лейкоцитов периферической крови. Однако большинство этих изменений не относятся к клинически значимым, так как представляют собой либо синонимические замены, не влияющие на функционирование доменов белка, либо расположены в некодирующих областях генов – в 3'‑нетранслируемых участках, интронных областях. Эти участки включены в нашу панель зондов, поскольку из-за близости к кодирующим и регуляторным последовательностям они могут быть клинически значимыми. Предполагаемые клинически значимые нарушения проанализировали с учетом стандартных критериев патогенности, применяемых для аннотации данных NGS. В первую очередь анализировали их частоту в популяции (менее 1%) и влияние на структуру белка в результате формирования преждевременного стоп-кодона, сдвига рамки считывания из-за делеции/инсерции, замены аминокислоты в функциональном домене, нарушения в сайте сплайсинга. Анализировали и другие описанные ранее значимые замены в этом и соседних кодонах, опубликованные клинические случаи, суммировали данные, полученные с помощью нескольких предсказательных сервисов: Sift, PolyPhen, MutationTaster (табл. 1).
Таблица 1.
Мутации в образцах акральной меланомы
| Ген | Аминокислотная замена | Образец |
|---|---|---|
| Регуляторы пролиферации и апоптоза | ||
| VAV1 | E556Q | 1t |
| GATA1 | T402P | 1t |
| WASHC5 | Q78H | 1m |
| BRAF | V600E | 2m1 |
| NIN | V294F | 2m1 |
| DOCK6 | T330I | 2m1 |
| GCM2 | N24K | 3t |
| PLA2R1 | W1198L | 4t |
| NRAS | Q61K | 4m |
| ATXN3 | G73V | 4m |
| SOX10 | T240P | 4m, 5t |
| MAPK8IP1 | D98A | 5t |
| TTN | P21957L | 5t |
| Система клеточной адгезии | ||
| ITGB4 | I1285F | 1m |
| CTNND2 | R720K | 5t |
| KRIT1 | R452C | 5t |
| Факторы энергетического обмена | ||
| ABCC8 | T694P | 2m2 |
| BCS1L | R177C | 3t |
| LPIN1 | G312R | 4t |
| Стимуляторы ангиогенеза | ||
| VEGFA | S157R | 2m1 |
| Компоненты иммунной системы | ||
| CD96 | M1I | 1t/m |
| MEFV | G185W | 2m1 |
| Герминальные нарушения | ||
| TAP1 | P315L | 3 |
| DCHS1 | S812C | 4 |
| CX3CR1 | T280M | 5 |
В образце первичной опухоли 1t пациента 1 обнаружены три условно патогенных мутации в генах VAV1 (E556Q), CD96 (M1I), GATA1 (T402P). Ген VAV1 кодирует GTPазу, вовлеченную в механизмы гемопоэза и ассоциированную с сигнальным путем JNK/SAPK. Мутация E556Q обнаружена в домене, который отвечает за активацию протеинкиназ семейства Rho [14]. Фактор транскрипции GATA1, играет ключевую роль в гемопоэзе [15].
В метастазе 1m пациента 1 обнаружены три клинически значимые мутации в генах ITGB4 (I1285F), CD96 (M1I), WASHC5 (Q78H). Однако и в первичной опухоли, и в метастазе встречается лишь одна из этих трех мутаций, локализованная в гене CD96. Ген WASHC5 кодирует убиквитарный трансмембранный белок, играющий ключевую роль в иннервации мускулатуры [16]. Особый интерес представляет мутация в гене ITGB4. Белковый продукт данного гена участвует в клеточной адгезии, запускает механизмы пролиферации, он описан как один из ключевых факторов инвазии опухолей. Этот фактор может быть вовлечен в активный метастатический процесс [17].
В метастазе 2m1 пациента 2 обнаружено пять соматических мутаций в генах BRAF (V600E), NIN (V294F), MEFV (G185W), DOCK6 (T330I), VEGFA (S157R). Характерная для меланомы кожи драйверная мутация V600E в гене BRAF обусловливает чувствительность опухоли к некоторым таргетным препаратам. Эта мутация чаще встречается в опухолях, которые локализуются на участках, не подверженных постоянному УФ-облучению, подобно акральной меланоме [3]. Белок NIN является ключевым в структуре центросомы, поэтому его функциональные изменения влияют на деление клеток и малигнизацию. Белок MEFV отвечает за модуляцию врожденного иммунного ответа. Белковый продукт гена DOCK6 вовлечен в регуляцию обмена гуаниновых нуклеотидов, опосредованно влияя на активацию внутриклеточных сигнальных путей. Особый интерес представляет активация гена VEGFA. Белок, кодируемый этим геном, входит в семейство факторов роста тромбоцитов/сосудистого эндотелия (PDGF/VEGF). Фактор роста VEGF индуцирует пролиферацию и миграцию клеток эндотелия сосудов и имеет важное значение как для физиологического, так и для патологического ангиогенеза. Ген VEGFA активируется во многих известных опухолях, и его экспрессия коррелирует со стадией прогрессии заболевания. Можно предположить связь мутации S157R с активацией гена VEGFA.
В метастазе 2m2 пациента 2, получавшего таргетную терапию, обнаружена всего одна клинически значимая мутация в гене ABCC8 (T694P). Белковый продукт этого гена действует как модулятор АТР-чувствительных каналов, участвует в выделении инсулина, влияет на энергетический обмен. Мутации, характерные для первого метастаза 2m1, не обнаружены. Данный факт может быть связан с успешным применением таргетных препаратов и элиминацией опухолевого клона.
В первичной опухоли 3t пациента 3 обнаружены нарушения в двух генах – BCS1L (R177C) и GCM2 (N24K). Ген BCS1L связан с функционированием дыхательной цепи митохондрий. Мутации в этом гене могут приводить к различным нарушениям энергетического обмена. Ген GCM2 кодирует фактор транскрипции, важный для развития нейронов, глии и паращитовидной железы, а также регулирует клеточную дифференцировку. Кроме того, у пациента 3 обнаружена герминальная мутация в гене TAP1 (P315L). Белковый продукт гена ТАР1 ответственен за транспорт крупных молекул через мембрану клеток, мутации в нем ассоциированы с устойчивостью к терапии при ряде заболеваний. Ряд исследователей рассматривает его в качестве онкогена [18, 19].
В первичной опухоли 4t пациента 4 найдены мутации в генах LPIN1 (G312R) и PLA2R1 (W1198L). Белковый продукт гена LPIN1 участвует в биосинтезе триглицеридов, мутации в нем приводят к нарушению энергетического метаболизма. Белок PLA2R1 является рецептором фосфолипазы А2 и первым звеном регуляторных внутриклеточных каскадов [20].
В метастазе 4m обнаружены мутации в генах NRAS (Q61K), ATXN3 (G73V), SOX10 (T240P). Мутация NRAS в кодоне 61 хорошо изучена, показана ее клиническая значимость при меланоме кожи. Известно, что эта мутация реже встречается при акральной форме меланомы, так как она ассоциирована с воздействием УФ-излучения (локализация на открытых участках кожи) [4]. Продукт гена ATXN3 вовлечен в функционирование нейронов. Белок SOX10 – важный транскрипционный фактор, участвующий в развитии клеток нервного гребня. Обнаруженные нами мутации указывают, что клетки образца 4m отделились от первичной опухоли на ранних этапах метастазирования и накапливали соматические мутации независимо, либо произошли из минорной популяции опухолевых клеток. Возможно, данный случай относится к первично-множественной форме меланомы с невыясненным вторым очагом.
Кроме того, у пациента 4 обнаружена герминальная мутация в гене белка клеточной адгезии DCHS1 (S812C). Его экспрессия повышена в клетках ресничного эпителия при раке легкого, но при этом он не экспрессируется в меланоцитах [19].
В образце 5t опухолевой ткани пациента 5 обнаружены мутации в генах MAPK8IP1 (D98A), TTN (P21957L), SOX10 (T240P), CTNND2 (R720K), KRIT1 (R452C). Белок MAPK8IP1 является важным фактором регуляции апоптоза в клетках поджелудочной железы, секретирующих инсулин [21]. Белок TTN играет роль в формировании мускулатуры. Это один из структурных белков, участвующих в сборке хроматина. Одну из первостепенных ролей в онкогенезе и метастазировании различных опухолей играют нарушения в генах механизмов клеточной адгезии. К этому семейству относится ген CTNND2. Белковый продукт данного гена нарушает адгезию клеток, способствует повышению их подвижности и обусловливает метастазирование. Белок KRIT1 также связан с системой межклеточных контактов, кроме того он регулирует пролиферацию клеток, воздействуя на RAS-каскад. В гене SOX10 пациента 5 найдена такая же мутация, как и у пациента 4. У пациента 5 обнаружена также герминальная мутация в гене CX3CR1 (T280M). Кодируемый этим геном белок вовлечен в клеточную адгезию, пролиферацию клеток и апоптоз [22]. Мутации гена CX3CR1 описаны при аденокарциноме поджелудочной железы [23, 24]. Спектр мутаций, найденных в опухоли данного пациента, позволяет предположить ее активное метастазирование и прогрессию, так как генетические изменения затрагивают факторы иммортализации и активируют белки, влияющие на адгезию и межклеточные контакты.
В целом, обнаруженные соматические нарушения затрагивают гены нескольких функциональных групп. Самую большую группу образуют гены, ответственные за пролиферацию, деление клеток, регуляцию апоптоза. К ним относятся BRAF, NRAS, MAPK8IP1, PLA2R1, VAV1, DOCK6. Кроме того, можно выделить группу генов, повреждения которых нарушают структуру хромосом, веретена деления и митоз (TTN, NIN). Особый интерес для нас представляют мутации в генах, играющих большую роль в функционировании нейронов, и, самое главное, в дифференцировке из эмбриональных клеток нервного гребня (SOX10, GCM2, ATXN3) нейронов и меланоцитов. Активация данного сигнального каскада зародышевых факторов у взрослого организма может приводить к малигнизации. Эти данные могут свидетельствовать о том, что драйверные мутации при меланоме могут возникать не только в классическом каскаде эпидермального фактора роста, но и в других путях, связанных с филогенезом данных клеток.
Следующая группа генов отвечает за целостность клеточных контактов и хорошо изучена в контексте метастатического потенциала опухоли (CTNND2, KRIT1, ITGB4). Описан также блок генов, мутации в которых приводят к серьезным нарушениям энергетического метаболизма (BCS1L, ABCC8, LPIN1). Процесс малигнизации практически всегда приводит к кардинальным изменениям клеточного метаболизма, что может способствовать прогрессии заболевания и активировать мутагенез. Отдельно стоит отметить ген VEGFA, участвующий в ангиогенезе, аномальная активация которого зачастую наблюдается при опухолевой прогрессии. Закономерным представляется также обнаружение мутаций в генах, кодирующих белки, участвующие в функционировании иммунной системы (MEFV, CD96).
Полученные пилотные данные могут стать основой для дальнейшего изучения мутационного спектра клеток акральной меланомы. В результате этих исследований возможна разработка таргетной панели генов как инструмента для предиктивной клинической диагностики.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 14-35-00107).
Проведение исследования одобрено этическим комитетом “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России. Все образцы получены от пациентов, которые дали письменное информированное согласие на использование своей ткани в исследовательских целях.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Гребенникова О.П., Прилепо В.Н. (2009) Меланома. Онкология для практикующих врачей. Под ред. Чистякова С.С. Москва: Товарищество научных изданий КМК, 548–563.
Bertolotto C. (2013) Melanoma: from melanocyte to genetic alterations and clinical options. Scientifica (Cairo). 2013, 1–22.
Мазуренко Н.Н. (2014) Генетические особенности и маркеры меланомы кожи. Успехи молекуляр. онкологии. 2, 26–35.
Feibleman C.E., Stoll H., Maize J.C. (1980) Melanomas of the palm, sole, and nailbed: a clinicopathologic study. Cancer. 46(11), 2492–2504.
Борисова Т.Н., Кудрявцева Г.Т. (2005) Комбинированное лечение метастатической формы акральной меланомы кожи. Сибирский онкологический журн. 7(14), 39–41.
Curtin J.A., Fridlyand J., Kageshita T., Patel H.N., Busam K.J., Kutzner H., Cho K.H., Aiba S., Brö-cker E.B., LeBoit P.E., Pinkel D., Bastian B.C. (2005) Distinct sets of genetic alterations in melanoma. N. Engl. J. Med. 353(20), 2135–2147.
Bolger A.M., Lohse M., Usadel B. (2014) Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30(15), 2114–2120.
McKenna A., Hanna M., Banks E., Sivachenko A., Cibulskis K., Kernytsky A., Garimella K., Altshuler D., Gabriel S., Daly M., DePristo M.A. (2010) The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20(9), 1297–1303.
Cibulskis K., Lawrence M.S., Carter S.L., Sivachenko A., Jaffe D., Sougnez C., Gabriel S., Meyerson M., Lan-der E.S., Getz G. (2013) Sensitive detection of somatic point mutations in impure and heterogeneous cancer samples. Nat. Biotechnol. 31(3), 213–219.
Vaser R., Adusumalli S., Leng S.N., Sikic M., Ng P.C. (2016) SIFT missense predictions for genomes. Nat. Protoc. 11(1), 1–9.
Adzhubei I.A., Schmidt S., Peshkin L., Ramensky V.E., Gerasimova A., Bork P., Kondrashov A.S., Sunyaev S.R. (2010) A method and server for predicting damaging missense mutations. Nat. Methods. 7(4), 248–249.
Schwarz J.M., Cooper D.N., Schuelke M., Seelow D. (2014) MutationTaster2: mutation prediction for the deep-sequencing age. Nat. Methods. 11(4), 361–362.
Chun S., Fay J.C. (2009) Identification of deleterious mutations within three human genomes. Genome Res. 19(9), 1553–1561.
Zhu X., Jin H., Xia Z., Wu X., Yang M., Zhang H., Shang X., Cheng R., Zhan Z., Yu Z. (2017) Vav1 expression is increased in esophageal squamous cell carcinoma and indicates poor prognosis. Biochem. Biophys. Res. Commun. 486(2), 571–576.
Ling T., Crispino J.D., Zingariello M., Martelli F., Migliaccio A.R. (2018) GATA1 insufficiencies in primary myelofibrosis and other hematopoietic disorders: consequences for therapy. Expert Rev. Hematol. 11(3), 169–184.
Bot S.T., Vermeer S., Buijsman W., Heister A., Voo-rendt M., Verrips A., Scheffer H., Kremer H.P., Warrenburg B.P., Kamsteeg E.J. (2013) Pure adult-onset Spastic Paraplegia caused by a novel mutation in the KIAA0196 (SPG8) gene. J. Neurol. 260(7), 1765–1769.
Bierie B., Pierce S.E., Kroeger C., Stover D.G., Pattabiraman D.R., Thiru P., Liu Donaher J., Reinhardt F., Chaffer C.L., Keckesova Z., Weinberg R.A. (2017) Integrin-β4 identifies cancer stem cell-enriched populations of partially mesenchymal carcinoma cells. Proc. Natl. Acad. Sci. USA. 114(12), E2337–E2346.
Tahara H., Naito H., Kise K., Wakabayashi T., Kamoi K., Okihara K., Yanagisawa A., Nakai Y., Nonomura N., Morii E., Miki T., Takakura N. (2015) Evaluation of PSF1 as a prognostic biomarker for prostate cancer. Prostate Cancer Prostatic Dis. 18(1), 56–62.
Zhang J., Wu Q., Wang Z., Zhang Y., Zhang G., Fu J., Liu C. (2015) Knockdown of PSF1 expression inhibits cell proliferation in lung cancer cells in vitro. Tumor Biol. 36(3), 2163–2168.
Temprano A., Sembongi H., Han G.S., Sebastián D., Capellades J., Moreno C., Guardiola J., Wabitsch M., Richart C., Yanes O., Zorzano A., Carman G.M., Siniossoglou S., Miranda M. (2016) Redundant roles of the phosphatidate phosphatase family in triacylglycerol synthesis in human adipocytes. Diabetologia. 59(9), 1985–1994.
Beeler N., Riederer B.M., Waeber G., Abderrahmani A. (2009) Role of the JNK-interacting protein 1/islet brain 1 in cell degeneration in Alzheimer disease and diabetes. Brain Res. Bull. 80(4–5), 274–281.
Sun Y., Wang F., Sun X., Wang X., Zhang L., Li Y. (2017) CX3CR1 regulates osteoarthrosis chondrocyte proliferation and apoptosis via Wnt/β-catenin signaling. Biomed. Pharmacother. 96, 1317–1323.
Wang H., Cai J., Du S., Guo Z., Xin B., Wang J., Wei W., Shen X. (2017) Fractalkine/CX3CR1 induces apoptosis resistance and proliferation through the activation of the AKT/NF-κB cascade in pancreatic cancer cells. Cell Biochem. Funct. 35(6), 315–326.
Stout M.C., Narayan S., Pillet E.S., Salvino J.M., Campbell P.M. (2018) Inhibition of CX3CR1 reduces cell motility and viability in pancreatic adenocarcinoma epithelial cells. Biochem. Biophys. Res. Commun. 495(3), 2264–2269.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология