Молекулярная биология, 2019, T. 53, № 5, стр. 774-789
Интерлейкин-33: друг или враг в борьбе против опухоли?
А. М. Горбачева a, b, *, Н. А. Митькин a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Кафедра иммунологии биологического факультета Московского государственного университета
им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: alisamur93@mail.ru
Поступила в редакцию 22.03.2019
После доработки 05.04.2019
Принята к публикации 15.04.2019
Аннотация
Интерлейкин-33 (IL-33) ‒ цитокин суперсемейства IL-1, выделяемый клетками под воздействием стресса либо в результате некроза, функционирует как сигнал опасности. Первоначально IL-33 был описан как индуктор гуморального иммунного ответа, активирующий T-хелперные клетки типа 2, поддерживающие продукцию антител В-клетками, и тучные клетки, участвующие в воспалении и аллергических реакциях. IL-33 стимулирует Th1-, NK- и CD8 T-клетки, поддерживающие цитотоксический иммунный ответ, направленный на защиту от внутриклеточных патогенов. Недавно стало известно, что, выполняя про- и противоопухолевые функции, IL-33 принимает участие в развитии многих злокачественных новообразований. IL-33 способен направленно воздействовать на опухолевые клетки, активируя их пролиферацию, выживание и метастазирование. Кроме того, IL-33 ремоделирует микроокружение опухолей и индуцирует ангиогенез, способствуя созданию иммуносупрессорных условий, и стимулирует таким образом канцерогенез. В то же время, цитокин провоцирует инфильтрацию опухоли цитотоксическими CD8 T-лимфоцитами и NK-клетками, вызывающими гибель раковых клеток посредством контактного цитолиза. Представленный обзор посвящен рассмотрению роли каскада IL-33/ST2 в развитии экспериментальных и клинических опухолей. Обсуждены перспективы использования IL-33 и ST2 в качестве диагностических биомаркеров, а также в роли мишеней в иммунотерапии опухолей.
ВВЕДЕНИЕ
Развитие опухоли основано на таких ключевых факторах, как способность к самоподдержанию и пролиферации, устойчивость к апоптозу, избегание иммунного ответа, стимуляция ангиогенеза, инвазия и метастазирование [1]. Кроме того, прогрессия опухоли во многом определяется взаимодействием с клетками микроокружения, к которым относятся фибробласты, перициты, эндотелиальные, гладкомышечные и иммунные клетки. В результате миграции в строму опухоли иммунные клетки становятся непосредственными участниками канцерогенеза [2, 3]. Стоит отметить, что в последнее время одну из ключевых ролей в развитии опухоли отводят воспалению [3]. Например, с микробной инфекцией и последующим развитием хронического воспаления ассоциированы около 15% злокачественных новообразований [4]. В частности, Helicobacter pylori, вирус папилломы человека, вирусы гепатита В и С, а также цитомегаловирус и вирус Эпштейна–Барр связаны с развитием рака желудка, опухолей шейки матки, гепатоцеллюлярной карциномы и злокачественных заболеваний крови соответственно [5].
Важную роль в развитии опухоли играют не только отдельные клетки, но и компоненты матрикса, хемокины и цитокины, обеспечивающие взаимодействие между клетками воспалительного микроокружения опухоли [6]. Один из таких посредников ‒ цитокин интерлейкин-33 (IL-33), входящий в суперсемейство IL-1 и хорошо известный своим участием в процессах врожденного и приобретенного иммунитета, поддержания тканевого гомеостаза и ответной реакции на стресс, в том числе и на инвазию опухоли.
МОЛЕКУЛЯРНАЯ ХАРАКТЕРИСТИКА ИНТЕРЛЕЙКИНА-33
IL-33 был идентифицирован в 2003 году как ядерный белок, экспрессирующийся в венулах с высоким эндотелием, в связи с чем и получил свое первое название “NF-HEV” (Nuclear Factor from High Endothelial Venules) [7]. Примерно в то же время он был описан в качестве лиганда рецептора ST2 (Suppression of Tumorigenicity 2) [8]. Этот цитокин синтезируется в виде предшественника с молекулярной массой 30 кДа, состоящего из 270 аминокислотных остатков у человека и 266 у мыши [8]. Белок человека состоит из трех доменов: N-концевого (аминокислоты 1‒65), включающего хроматинсвязывающую последовательность и сигнал ядерной локализации, С-концевого IL-1-подобного цитокинового домена (остатки 112‒270), взаимодействующего с ST2, а также центрального домена (аминокислоты 66‒111), расположенного между ними [9]. IL-1-подобный домен содержит сайты расщепления каспазами, а центральный – сайты расщепления воспалительными протеазами [10].
IL-33 конститутивно экспрессируется различными клетками мыши и человека, в основном эпителиальными и эндотелиальными, а также миофибробластами и фибробластоподобными клетками, причем продукция цитокина может усиливаться при воспалении [10, 11]. Экспрессия IL-33 характерна также для тучных и дендритных клеток, моноцитов и макрофагов, кератиноцитов и адипоцитов [12]. После синтеза IL-33 мигрирует в ядро, где может связываться с хроматином и модулировать экспрессию других генов [13, 14]. Однако в настоящее время способность цитокина регулировать транскрипцию ставится под сомнение [10]. В отличие от классических цитокинов IL-33 не секретируется традиционным путем через эндоплазматический ретикулум и аппарат Гольджи, а пассивно выделяется клетками под влиянием механического стресса и повреждения [15], в результате некроза [11] и некроптоза [16], а также в ходе патологического заживления ран и фиброза [17, 18]. Таким образом, внеклеточный IL-33 предупреждает иммунную систему о повреждении клеток и тканей, функционируя как эндогенный сигнал опасности (алармин от англ. alarm ‒ тревога) [11].
В ходе некротической гибели клеток IL-33 выделяется в виде белка-предшественника. Полноразмерный цитокин обладает функциональной активностью, однако в условиях воспаления его активность возрастает в десятки раз в результате расщепления протеазами нейтрофилов (протеиназа 3, катепсин G и эластаза) [19] и тучных клеток (химаза, триптаза и гранзим В) [20], а также под воздействием протеаз, обнаруженных в грибах, насекомых, растениях и бактериях (трипсин, папаин, субтилизин) [21]. При этом образуются зрелые гиперактивные формы белка массой 18‒21 кДа, которые утратили сигнал ядерной локализации [22]. Подобное разнообразие протеаз, способных к расщеплению и активации предшественника IL-33, позволяет рассматривать процессинг как ключевой этап регуляции биологической активности цитокина. Кроме того, этот механизм образования гиперактивных форм IL-33 может играть ключевую роль, когда полноразмерный цитокин присутствует в среде в низкой концентрации либо имеет пониженную активность.
Для ограничения воспалительной реакции, вызванной повреждением клеток, биологическая активность IL-33, как и других аларминов, должна надежно контролироваться. Одним из главных механизмов регуляции этого цитокина считаются такие посттрансляционные модификации, как ограниченный протеолиз и окисление остатков цистеина. Изначально предполагалось, что полноразмерный IL-33, как и другие члены семейства IL-1 (IL-1β, IL-18), созревает в результате расщепления каспазой-1, которая функционирует в составе инфламмасомы (белкового комплекса, обеспечивающего протеолитическую активацию провоспалительных цитокинов) [8]. Позднее оказалось, что цитокин способен полноценно функционировать в виде молекулы-предшественника [19], как и IL-1α [23], и не является субстратом ни каспазы-1, ни других провоспалительных каспаз (4 и 5) [24, 25]. При этом в ходе апоптоза IL-33 расщепляется эффекторными каспазами-3 и -7 с образованием двух неактивных фрагментов [25, 26]. Стоит отметить, что при IgE-опосредованной стимуляции антигеном активированные тучные клетки способны выделять каспазу-3 [27]. Таким образом, эта каспаза может стимулировать деградацию IL-33 и во внеклеточном пространстве, подавляя избыточную активность цитокина при воспалении [28].
Относительно недавно обнаружили еще один способ ингибирования активности IL-33. Оказалось, что внеклеточный цитокин может инактивироваться в результате окисления четырех остатков цистеина в С-концевом домене. Эта реакция приводит к образованию дисульфидных мостиков, вызывающих конформационные изменения, которые предотвращают связывание цитокина со своим рецептором [29]. В аналогичных условиях в С-концевом домене некоторых членов семейства IL-1 (IL-18, IL-1β, IL-36α и IL-36γ) также образуются дисульфидные связи [29, 30]. Логично предположить, что окисление остатков цистеина может быть важным механизмом регуляции активности цитокинов семейства IL-1.
Основная функциональная активность IL-33 реализуется путем взаимодействия с рецептором ST2 на поверхности клеток-мишеней. IL-33 способен также локализоваться в ядре и связываться с хроматином, что способствовало присвоению ему функций прямого регулятора транскрипции [13, 14]. В более поздних исследованиях подобные предположения по большей части не подтвердились. Оказалось, что статус внутриклеточного IL-33 не влияет существенно на протеом клеток [10]. При этом в ряде новых работ высказано предположение, что процесс ассоциации IL-33 с гистонами можно рассматривать как своего рода посттрансляционный механизм регуляции высвобождения самого IL-33 и контроля его доступности для рецептора ST2 [31].
СИГНАЛЬНЫЙ ПУТЬ IL-33/ST2
Все члены семейства IL-1-подобных цитокинов, включая IL-33, связываются с высокоспецифичными гетеродимерными рецепторными комплексами [32]. Минимальный комплекс рецептора IL-33 (IL-33R) состоит из трансмембранных молекул ST2 (известного также, как IL-33Rα, IL1RL1, Т1, IL-1R4) [8] и IL-1RAcP (от “interleukin-1 receptor accessory protein”) [33]. В результате лигандзависимой активации ST2 подвергается конформационным изменениям, которые способствуют связыванию с IL-1RAcP и образованию комплекса IL-33R [34]. Гетеродимеризация этих молекул сопровождается сближением цитоплазматических TIR-доменов, имеющихся у всех представителей семейства рецепторов IL-1 (IL-1R). Последующая передача сигнала внутрь клетки у рецепторов данного семейства происходит благодаря гомотипическому взаимодействию TIR-домена с адаптерным белком MyD88, а также привлечению киназ IRAK1, IRAK4 и фактора TRAF6 [8, 35]. В клетках определенного типа возможна активация дополнительных сигнальных путей, включающих киназы mTOR, Syk и JAK2 [35].
Наряду с мембраносвязанными вариантами ST2 и IL-1RAcP существуют и их растворимые изоформы (sST2 и sIL-1RAcP), играющие роль “ловушки” IL-33 [36, 37]. Связывание sST2 и sIL-1RAcP со свободным цитокином во внеклеточном пространстве блокирует его функцию, что позволяет считать данный механизм еще одним способом регуляции активности IL-33. Установлено также, что молекула SIGIRR (TIR8, IL-1R8), входящая в суперсемейство рецепторов IL-1R/TLR, подавляет IL-33-зависимый ответ in vitro и in vivo посредством физического взаимодействия с ST2 [38].
Рецептор ST2 конститутивно экспрессируется на поверхности лимфоидных клеток врожденного иммунитета типа 2 (ILС2) и регуляторных Т-клеток, Т-хелперных клеток типа 2 (Th2), естественных киллерных клеток (natural killers, NK), эозинофилов, базофилов и тучных клеток, а также дендритных клеток (ДК) и макрофагов [39‒41]. В то же время, растворимая изоформа sST2 экспрессируется преимущественно эпителиальными клетками [42] и фибробластами [43].
Главными клетками-мишенями IL-33 считаются клетки ILС2, которые участвуют в восстановлении тканей, аллергическом воспалении и обеспечивают защиту от гельминтов. Распознавание цитокина этими клетками приводит к их активации, повышению продукции IL-4, IL-5, IL-6, IL-9 и IL-13, а также гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и амфирегулина [44]. Кроме того, активированные таким образом ILС2 стимулируют экспансию эозинофилов, обеспечивают поддержание альтернативно активируемых макрофагов и контролируют миграцию регуляторных Т-клеток в нормальных условиях и при воспалении [45, 46]. IL-33 также способен стимулировать развитие тканерезидентных регуляторных Т-клеток и инициировать их экспансию [47]. Опосредованная IL-33 активация способствует дифференцировке Th2-клеток и повышает продукцию ими цитокинов (IL-4, -5, -9, -13) [48, 49]. IL-33 (в присутствии IL-12) может повышать цитотоксическую активность NK-клеток, индуцируя выработку ими IFN-γ [50]. IL-33-зависимая активация эозинофилов и базофилов повышает их выживаемость и продукцию IL-4, IL-13 и GM-CSF [51‒54].
IL-33 способствует созреванию и дегрануляции тучных клеток, повышает выработку IL-5 и IL-13 и провоспалительных медиаторов IL-1β, IL-6, IL-12, IFN-γ и TNF [55, 56], а также стимулирует продукцию IL-6 и экспрессию молекул MHC-II и CD86 в ДК, что положительно влияет на их способность направлять поляризацию Th2-клеток [57]. Кроме того, цитокин может способствовать развитию толерогенных ДК, вырабатывающих IL-2, вызывая последующую экспансию регуляторных Т-клеток [58].
IL-33 повышает экспрессию мРНК IL-13 в макрофагах, обеспечивая их активацию по альтернативному механизму (фенотип М2) [59]. Альтернативно активируемые макрофаги обладают противовоспалительной и ангиогенной активностью, а также могут вызывать проопухолевый эффект.
Активируемая экспрессия ST2 в ответ на воздействие IL-33 in vivo обнаружена во многих клетках, не вовлеченных в иммунные реакции (нейроны, астроциты, фибробласты, эпителиальные и эндотелиальные клетки), однако последствия передачи сигнала в этих случаях недостаточно охарактеризованы [60‒64].
Таким образом, сигнальный путь IL-33/ST2 в норме стимулирует продукцию IL-4, IL-5 и IL-13 Th2-клетками, вызывая накопление и активацию клеток, вовлеченных в развитие гуморального иммунного ответа. Чрезмерная активация пути IL-33/ST2 провоцирует обострение воспалительных заболеваний суставов и дыхательных путей, а также обуславливает фиброзные изменения в пищеварительном тракте [65, 66]. Тем не менее, на данный момент очевидно, что роль IL-33 не ограничивается индукцией гуморального ответа. Известно, что этот цитокин принимает участие и в реакциях клеточного иммунного ответа, усиливая экспрессию TNF и IFN-γ CD8+ T-клетками, NK- и NKT-клетками, а также активируя лимфоциты Th1 [50, 67‒69]. Наконец, результаты исследований указывают на двойственную роль IL-33 в канцерогенезе, которая заключается либо в стимуляции опухолевого роста, либо в подавлении прогрессии опухоли.
РОЛЬ СИГНАЛЬНОГО ПУТИ IL-33/ST2 В РАЗВИТИИ ОПУХОЛЕЙ
Опубликовано множество данных, указывающих на важную роль сигнального пути IL-33/ST2 как в противоопухолевом иммунном ответе, так и в стимуляции прогрессии опухоли (табл. 1). Предполагается, что эффект, оказываемый IL-33 на развитие опухоли, определяется ее типом, а также зависит от клеток-мишеней цитокина и взаимодействия факторов микроокружения опухоли [70].
Таблица 1.
Экспрессия и влияние IL-33 и ST2 на прогрессию злокачественных опухолей различного типа
| Опухоль | Организм | IL-33 | ST2 | Ключевые ссылки | ||
|---|---|---|---|---|---|---|
| экспрессия | прогрессия опухоли | экспрессия | прогрессия опухоли | |||
| Колоректальный рак | Человек | + | да | + | да | [71‒74] |
| – | да | – | да | [75] | ||
| Мышь | + | да | + | да | [60, 71, 73, 76, 77] | |
| – | нет | – | нет | [75, 78, 79] | ||
| Рак легкого | Человек | + | да | + | да | [80‒83] |
| Мышь | + | нет | нет данных | нет данных | [84‒86] | |
| Рак молочной железы | Человек | + | да | + | нет данных | [87‒89] |
| Мышь | + | да | + | да | [90‒93] | |
| + | нет | + | нет | [94] | ||
| Меланома | Мышь | + | нет | нет данных | нет данных | [94‒99] |
| Рак желудка | Человек | + | да | + | да | [100‒102] |
| Холангиокарцинома | Мышь | да | + | да | [103, 104] | |
| Плоскоклеточный рак головы и шеи | Человек | + | да | + | да | [105, 106] |
Колоректальный рак
Колоректальный рак (КРР) – это злокачественная опухоль, развивающаяся из эпителия толстого кишечника и прямой кишки. Считается, что вероятность развития данной опухоли, ассоциированной с “западным образом жизни”, увеличивается с возрастом (средний возраст диагностирования КРР в развитых странах составляет 70 лет) [107]. Одним из ключевых факторов, провоцирующих развитие КРР, является хроническое воспаление [3]. Возможно, по этой причине у пациентов с воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит), с большей вероятностью развивается КРР [108, 109].
За последние годы накоплено множество данных, подтверждающих участие сигнального пути IL-33/ST2 в патогенезе КРР [12, 60]. Известно, что экспрессия IL-33 и ST2 повышена в ткани КРР, причем самый высокий уровень экспрессии характерен для слабодифференцированных клеток [71]. Кроме того, повышенная экспрессия IL-33 клетками КРР человека активирует их рост и метастазирование in vivo, а также снижает выживаемость бестимусных мышей-реципиентов [71]. Показано, что у получавших канцероген азоксиметан и провоспалительный агент декстрансульфат натрия мышей с нокаутом гена ST2, развивается гораздо меньше КРР [73]. Эксперименты на мышах линии ApcMin/+, используемой в качестве модели семейного аденоматозного полипоза, показали, что нокаут IL33 [60] и ST2 [77] способствует уменьшению размера и количества аденом в результате подавления клеточной пролиферации, а также индукции апоптоза внутри полипов.
Опосредованная IL-33 прогрессия КРР может быть обусловлена способностью цитокина ремоделировать строму опухоли и активировать ангиогенез [76]. В частности, IL-33 стимулирует синтез компонентов внеклеточного матрикса (MMP2, ММР3, MMP9) и факторов роста, ассоциированных с прогрессией и метастазированием КРР, клетками опухоли и ее микроокружения [71, 73, 74]. Кроме того, in vitro IL-33 повышает продукцию фактора роста эндотелия сосудов (VEGF) [110] и IL-8 [111] – хорошо известных ангиогенных стимуляторов, вовлеченных в патогенез КРР [112, 113].
IL-33 также способен модулировать активность других факторов, принимающих участие в развитии колоректальных опухолей, например, циклооксигеназы-2 (СОХ-2), IL-6 и IL-17А [114–116]. Недавно показали, что стимуляция роста клеток КРР in vitro этим цитокином определяется активацией каскада СОХ-2/PGE2 (простагландин Е2) [117]. Установлено, что IL-33, вырабатываемый кишечным эпителием, вызывает накопление Тh17-клеток (главных источников IL-17А) в тонком кишечнике [118]. Кроме того, цитокин IL-6 действует как важный посредник IL-33-зависимой прогрессии КРР у мышей с дефицитом ST2 [73]. Так как IL-6 стимулирует продукцию IL-17А клетками Th17, сигнальный путь IL-33–IL-6–IL-17A может играть ключевую роль в патогенезе КРР. Тем не менее, важно отметить, что лимфоциты Th17 могут подавлять развитие КРР, участвуя в противоопухолевом иммунном ответе [119, 120].
Известно, что запуск каскада IL-33/ST2 способствует прогрессии КРР, обусловленной изменением состава микроокружения опухоли [74]. В частности, введение рекомбинантного IL-33 стимулирует миграцию регуляторных Т-клеток в строму опухоли [121]. Сверхэкспрессия IL-33 стимулирует пролиферацию клеток КРР мышей линии MC-38 in vitro, а также, благодаря индукции ангиогенеза и привлечению супрессорных CD11b+GR1+ и CD11b+F4/80+ миелоидных клеток, провоцирует рост и метастазирование опухоли после ее трансплантации сингенным мышам [76]. Кроме того, IL-33 способен стимулировать прогрессию КРР посредством активации каскада JNK-c-Jun, усиливая экспрессию опухолевыми клетками ключевых генов плюрипотентности (NANOG, NOTCH3, OCT3/4) и привлекая макрофаги, вырабатывающие PGE2 [72]. При этом известно, что растворимый рецептор sST2 ингибирует IL-33-опосредованный ангиогенез, развитие Th2 иммунного ответа, инфильтрацию опухоли макрофагами и их поляризацию по М2-фенотипу, стимулируя подавление роста и метастазирования опухоли [74]. Таким образом, негативная роль каскада IL-33/ST2 обусловлена его участием в индукции ангиогенеза, ремоделировании микроокружения опухоли и регуляции противоопухолевого иммунного ответа [121].
Однако результаты других исследований, выполненных на моделях КРР, указывают на противоопухолевую роль данного каскада. Так, нокдаун ST2 в клетках линии СТ26 аденокарциномы мыши усиливает рост опухоли, трансплантируемой сингенным мышам BALB/c [75]. На примере КРР, индуцируемого азоксиметаном и декстрансульфатом натрия, показано, что у мышей с нокаутом гена IL33 чаще развиваются колит и опухоль, ассоциированная с колитом [78]. Наконец, установлено, что IL-33 стимулирует экспрессию IFN-γ опухоль-инфильтрирующими Т-клетками, подавляя канцерогенез в модели спорадического (ненаследственного) КРР у мышей [79].
Рак легкого
Каскад IL-33/ST2 хорошо известен своим участием в патогенезе воспалительных заболеваний дыхательной системы [13, 122], однако его роль в развитии рака легкого охарактеризована недостаточно. На основе имеющихся данных можно утверждать, что активация каскада оказывает как стимулирующий, так и ингибирующий эффект на рост опухолей легкого. Показано, что in vitro стимуляция клеток линии А549 рака легкого человека цитокином IL-33 способствует их метастазированию за счет активации киназы АКТ и роста экспрессии металлопротеаз ММР2 и ММР9 [82]. Также установлено, что IL-33 повышает экспрессию мембранного транспортера глюкозы GLUT1 клетками немелкоклеточного рака легкого, стимулируя in vitro рост и in vivo метастазирование опухолевых клеток посредством активации гликолиза [80]. В согласии с этими наблюдениями в доклинических исследованиях показано, что блокада IL-33 значительно подавляет рост ксенографтов немелкоклеточного рака легкого за счет уменьшения популяции макрофагов М2 и регуляторных Т-клеток в строме опухоли [85].
Интересный результат, подтверждающий важную роль IL-33 в прогрессии рака легкого, получен на клетках карциномы Льюиса (в in vitro эксперименте смоделированы условия, характерные для опухоли) [83]. Установлено, что IL-33 регулирует гибель ST2-позитивных опухолевых клеток с низким метастатическим потенциалом, способствуя селекции и экспансии ST2-негативных клеток, отличающихся высокой степенью метастазирования.
Тем не менее, существуют примеры противоопухолевого воздействия IL-33. В мышиных моделях рака легкого присутствие трансгена IL33 подавляет рост и метастазирование опухолевых клеток in vivo [84, 94]. Считается, что ингибирующий эффект цитокина, по крайней мере частично, обусловлен активацией CD8+ Т-лимфоцитов и NK-клеток, инфильтрирующих опухоль [123]. Стоит отметить, что в линии А9 рака легкого, отличающейся низким уровнем МНС-I, сверхэкспрессия IL-33 коррелирует с повышением продукции МНС-I, что способствует восстановлению эффективной презентации опухолевых антигенов и их распознаванию иммунной системой [84].
Рак молочной железы
Рак молочной железы (РМЖ) – один из самых распространенных видов рака у женщин [124]. На различных моделях РМЖ получено множество данных, свидетельствующих о проопухолевой роли каскада IL-33/ST2. Результаты экспериментов на мышах показали, что делеция ST2 приводит к подавлению роста и метастазирования РМЖ, ассоциированному с экспансией NK-клеток и повышением системного уровня цитокинов Th1/Th17 [90]. При этом передача сигнала через функционально активный рецептор стимулирует рост и метастазирование линии 4Т1 РМЖ, обусловленный снижением цитотоксичности NK-клеток и миграцией в опухолевый сайт иммуносупрессорных клеток (CD11b+Gr-1+TGF-β+ MDSCs (от “myeloid derived suppressor cells”), CD11c+IL-10+ ДК и альтернативно активированных макрофагов), Lin−Sca-1+ ILС2 и IL-10+Foxp3+ регуляторных Т-клеток [92, 125]. Однако показано, что сверхэкспрессия трансгена IL-33 в клетках 4Т1 приводит к снижению роста и метастазирования опухоли in vivo [94]. Причина подобного расхождения в результатах еще не установлена. Установлено также, что передача сигнала через ST2 стимулирует рост РМЖ, вызывая повышение экспрессии ангиогенного фактора VEGF и подавление некроза опухолевых клеток [93].
IL-33 способствует росту РМЖ, стимулируя пролиферацию клеток эпителия посредством активации сигнальных путей JNK–c-Jun, MEK–ERK и STAT3 [126]. Кроме того, повышенный уровень IL-33 в клетках РМЖ, вырабатывающих эстрогеновые рецепторы (ER+), делает их устойчивыми к воздействию тамоксифена, стимулируя появление у опухоли свойств, характерных для стволовых клеток [89]. Таким образом, большая часть исследований указывает на ассоциацию функциональной активности каскада IL-33/ST2 с прогрессией РМЖ и подавлением противоопухолевого иммунитета.
Меланома
Многочисленные доказательства противоопухолевой активности IL-33, обусловленной влиянием на микроокружение опухоли, получены на мышиной модели меланомы В16 – агрессивной опухоли, отличающейся высокой устойчивостью к иммунотерапии. На мышах с подкожно привитой меланомой В16F10 [95, 127] и с BRAFV600EPTEN-индуцибельной меланомой, развивающейся de novo [128], показано, что введение IL-33 значительно подавляет рост опухоли. Цитокин, как полагают, повышает выработку IFN-γ CD8+ T-лимфоцитами и активирует миелоидные ДК, стимулируя кросс-презентацию антигенов в опухолевом сайте [95]. В свою очередь, подавляющий эффект вызван накоплением в строме опухоли CD8+ T-лимфоцитов и эозинофилов, а также уменьшением популяции супрессорных миелоидных клеток [127]. Кроме того, активация каскада IL-33/ST2 провоцирует миграцию эозинофилов в легкие, препятствуя метастазированию клеток меланомы в данную область. Полученные результаты согласуются с ранее опубликованными данными о подавлении метастазирования меланомы В16 у мышей, несущих трансген IL33 [123]. Известно также, что сверхэкспрессия IL-33 приводит к ингибированию роста и метастазирования клеток В16 in vivo посредством активации NK-клеток и CD8+ T-лимфоцитов [94]. Однако опосредованное IL-33 подавление роста опухоли В16 может не зависеть от присутствия упомянутых клеток [97]. Как оказалось, локальная экспрессия IL-33 вызывает обширную экспансию клеток ILС2 внутри опухоли, способствуя выработке ими лигандов рецептора CXCR2 ‒ CXCL1 и CXCL2. Эти молекулы поддерживают экспрессию CXCR2 раковыми клетками, а также стимулируют их апоптоз и дальнейшую регрессию опухоли [97]. Также известно, что опосредованная IL-33 активация повышает продукцию IL-5 клетками ILС2 и вызывает миграцию эозинофилов, подавляя прогрессию опухоли [98]. На модели меланомы В16 показано, что IL-33 способствует индукции лимфоцитов Th9 посредством активации ДК, продуцирующих Ox40L [99]. В свою очередь, Th9-клетки, вырабатывающие IL-9, подавляют развитие опухоли in vivo [129, 130].
Рак желудка
Рак желудка, отличающийся высокой агрессивностью, остается одним из самых распространенных видов рака в мире [131]. К факторам риска, ассоциированным с развитием данной опухоли, относятся инфицирование H. pylori, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), особенности питания, ожирение, а также хроническое воспаление [132].
Результаты немногочисленных исследований, выполненных на клеточных моделях рака желудка, свидетельствуют о проопухолевой роли IL-33. В частности, в стимулированных цитокином клеточных линиях рака желудка человека MGC-803, BGC-823 и SGC-7901 выявлен дозозависимый рост инвазивной активности [133], тогда как нокдаун рецептора ST2 приводит к исчезновению этого эффекта. Как оказалось, запуск каскада IL-33/ST2 активирует сигнальный путь ERK1/2, известного своим участием в инвазии и метастазировании опухоли [101]. Кроме того, IL-33 способствует активации JNK-каскада, вызывая устойчивость клеток MGC-803 к химиотерапии in vitro [102]. Показано также, что IL-33 стимулирует усиленную выработку клетками MGC-803 таких важных факторов, обладающих проопухолевым действием, как IL-6 и MMP-3 [133‒135].
Холангиокарцинома
Холангиокарцинома ‒ второй по распространенности вид рака печени, поражающий эпителий желчных протоков [136]. К факторам риска холангиокарциномы относятся токсины, паразитарные инфекции, фиброз, а также наличие кист и камней в желчных протоках [136].
Установлено, что каскад IL-33/ST2 стимулирует развитие холангиокарциномы. На мышиной модели холангиокарциномы показано, что введение IL-33 способствует прогрессии опухоли за счет повышения экспрессии цитокина IL-6 раковыми клетками и опухолеассоциированными фибробластами [103]. При этом IL-6 стимулирует рост опухоли, активируя митогенные сигналы в клетках холангиокарциномы [137, 138]. Введение IL-33 мышам также усиливает пролиферацию холангиоцитов (клеток, выстилающих желчные протоки) посредством индукции клеток ILС2, вырабатывающих IL-13. В свою очередь, активация каскада IL-33/ILC2/IL-13 в клетках желчных протоков стимулирует рост и метастазирование холангиокарциномы [104].
Плоскоклеточный рак головы и шеи
Плоскоклеточный рак головы и шеи входит в шестерку самых распространенных типов рака. Главными факторами риска данного заболевания считаются табачный дым, алкоголь, а также папиломавирусная инфекция [139].
Важнейшими клетками в составе опухолевого микроокружения при плоскоклеточном раке головы и шеи являются опухолеассоциированные фибробласты. Секреция IL-33 этими клетками провоцирует эпителиально-мезенхимальный переход, поддерживающий миграционную активность опухоли [105]. Кроме того, IL-33 стимулирует экспрессию собственного гена клетками плоскоклеточного рака головы и шеи по механизму положительной обратной связи. Известно, что повышенный уровень цитокина в опухолеассоциированных фибробластах и раковых клетках коррелирует с образованием микрососудов в строме опухоли и ассоциирован с низкой выживаемостью пациентов [105, 106].
IL-33 И ST2 КАК ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ПРОГРЕССИИ ОПУХОЛИ И ВЫЖИВАНИЯ ПАЦИЕНТА
IL-33 считается перспективным биомаркером некоторых онкологических заболеваний, позволяющим обнаружить опухоль, а также предсказать течение заболевания и ответ на терапию. Результаты большинства исследований указывают на ассоциацию повышенной экспрессии IL-33 с ухудшением выживаемости онкобольных. Например, высокий уровень IL-33 в сыворотке крови и опухолевой ткани является основанием для плохого прогноза при КРР [71], глиомах [140], раке желудка [141], гепатоцеллюлярной карциноме [142], раке легкого [80, 81], лейомиоме матки [143], плоскоклеточном раке головы и шеи [105], а также при РМЖ [87]. Важным источником IL-33 в микроокружении опухоли могут быть опухолеассоциированные фибробласты и клетки костно-мозговой стромы [105, 144]. Однако повышенный уровень IL-33 в тканях наблюдается и при многих воспалительных заболеваниях [145‒147], что ограничивает его клиническое применение в качестве специфичного опухолевого маркера.
Известно, что у пациентов с опухолями желудка и почки наблюдается аномально высокий уровень сывороточного IL-33 [141, 142, 149]. При раке почки подобная сверхэкспрессия ассоциирована с ростом метастазов в лимфатические узлы и повышенным риском рецидивов. Установлено, что IL-33 стимулирует рост клеток рака почки in vivo, а также подавляет их апоптоз in vitro посредством активации JNK-каскада [149]. Повышенная экспрессия IL-33 и ST2 в клетках опухоли яичника коррелирует с экспрессией Ki-67 ‒ маркера пролиферативной активности, и ассоциирована с плохим прогнозом [150, 151]. Предполагается, что активация сигнального пути IL-33/ST2 способствует прогрессии рака яичника посредством запуска каскадов ERK и JNK [152]. Более того, в большинстве случаев низкоинвазивного плоскоклеточного рака головы и шеи экспрессия IL-33 либо отсутствует, либо ее уровень очень низок, в то время как опухоли с высокой метастатической активностью ассоциированы с интенсивной экспрессией цитокина раковыми клетками и опухолеассоциированными фибробластами. По всей видимости, сверхэкспрессия IL-33 стимулирует эпителиально-мезенхимальный переход, вызывая прогрессию опухоли [105]. Повышенный уровень IL-33 и sST2 у пациентов с РМЖ коррелирует с экспрессией факторов VEGF и ММР11, ассоциированных с неблагоприятным прогнозом заболевания [153]. Высокий уровень мРНК и белка IL-33 характерен для клеток глиомы, причем повышение экспрессии коррелирует со сниженной выживаемостью [140, 154]. Предполагается, что IL-33 активирует рост и миграцию опухолевых клеток, запуская каскад ST2/NF-κB и усиливая выработку ММР2/MMP9 [155]. Экспрессия IL-33 и ST2 (в том числе и sST2) в клетках КРР повышена по сравнению с нормальной тканью [71] и коррелирует с плохой выживаемостью пациентов с метастазирующим раком толстой кишки [72]. Наконец, уровень sST2 повышен в плазме крови пациентов с миелопролиферативными неоплазиями, в то время как у здоровых лиц sST2 практически не детектируется [156].
С другой стороны, некоторые исследования указывают на существование обратной корреляции между уровнем IL-33 и прогрессией опухоли. Пониженная экспрессия IL-33 и ST2 ассоциирована с прогрессией рака легкого и считается основанием для неблагоприятного прогноза [157‒159]. Кроме того, подавление экспрессии IL-33 при раке предстательной железы и раке почки может ослаблять иммунный надзор и способствовать опухолевой прогрессии за счет снижения функциональности молекул MHC-I [84], тогда как высокий уровень экспрессии IL-33 коррелирует с хорошим прогнозом у пациентов с остеосаркомой [160] и опухолями слюнных желез [161]. Установлено, что повышенная экспрессия IL-33 внутриопухолевыми CD8+ T-клетками памяти наряду с высоким уровнем sST2 в сыворотке коррелирует с ростом выживаемости пациентов с гепатоцеллюлярной карциномой [162, 163]. Таким образом, возможность использования IL-33 и ST2 в качестве диагностических и прогностических маркеров во многом определяется видом опухоли и стадией ее прогрессии.
IL-33/ST2 КАК МИШЕНЬ В ИММУНОТЕРАПИИ ОПУХОЛЕЙ
Наряду с другими цитокинами, способными модулировать иммунный ответ, IL-33 используется в качестве мишени для иммунотерапии опухолей. Однако двойственная природа влияния IL-33 на канцерогенез накладывает ограничения на его клиническое применение, требуя большой осторожности. В большинстве случаев стратегия лечения предполагает введение рекомбинантного цитокина. Этот подход направлен на активацию клеток, вовлеченных в реакции иммунного ответа [96, 164‒166]. Кроме того, IL-33 способен ненаправленно активировать эффекторные Т-клетки. Например, используемые в иммунотерапии вирусные векторные системы, доставляющие опухолеассоциированные антигены ДК для эффективного праймирования CD8+ Т-лимфоцитов, зависят от передачи сигнала IL-33 [167]. Опосредованная IL-33 активация Т-клеток может стимулировать реакции “трансплантат против опухоли”, подавляя при этом реакции “трансплантат против хозяина” [130].
Другой стратегический подход, основанный на иммуносупрессивной проопухолевой роли IL-33, ‒ блокада цитокина [74, 85, 88, 105]. Однако целесообразность такого подхода нуждается в большем количестве экспериментальных доказательств. Альтернативным способом может быть применение других методов иммунотерапии в сочетании с блокадой IL-33. Поскольку цитокин чаще проявляет провоспалительные свойства [66], его блокада может подавлять воспаление в строме опухоли, улучшая ответ иммунной системы на применение более традиционных методов. Например, при хроническом миелоидном лейкозе комбинация иматиниба (противолейкозного цитостатического препарата) и блокады IL-33 может снижать количество цитокинзависимых стволовых клеток опухоли [168], а также предотвращать развитие устойчивости к лекарственным препаратам [156].
ЗАКЛЮЧЕНИЕ
Противоречивая роль сигнального пути IL-33/ST2 в канцерогенезе, рассмотренная в обзоре, во многом обусловлена функциональной активностью клеток-мишеней IL-33. С одной стороны, связывание IL-33 с рецептором способствует воспалению, провоцирующему прогрессию опухоли, а с другой, приводит к запуску противоопухолевого иммунного ответа. Возможные последствия IL-33-опосредованной активации для клеток опухоли и ее микроокружения суммированы на рис. 1. Вырабатываемый в опухолевом очаге IL-33 стимулирует клетки, реализующие проопухолевые функции, а также клетки, способные подавлять канцерогенез. Для каждой из описанных популяций клеток характерна выработка специфических цитокинов, хемокинов и других факторов, модулирующих развитие опухоли.
Рис. 1.
Влияние IL-33 на клетки опухоли и ее микроокружение. IL-33 выделяется фибробластами, а также эпителиальными и эндотелиальными клетками в ответ на стресс или повреждение. Попадая во внеклеточное пространство, IL-33 воздействует на клетки опухоли и ее микроокружения: альтернативно активируемые макрофаги (ААМ), миелоидные супрессоры (MDSCs), фибробласты (ФБ), лимфоидные клетки врожденного иммунитета типа 2 (ILС2), регуляторные Т-клетки (Трег), T-хелперы типа 17, 9 и 1 (Th17, Th9, Th1), дендритные клетки (ДК), CD8 T-лимфоциты (CD8 T), естественные киллерные клетки (NK), Т-лимфоциты популяции NKT (NKT), эозинофилы (ЭО). Активация перечисленных клеток приводит к повышению продукции молекул, стимулирующих либо подавляющих развитие опухоли. Проопухолевый эффект обозначен красными стрелками (левая часть рисунка), противоопухолевый ‒ зелеными (правая часть).
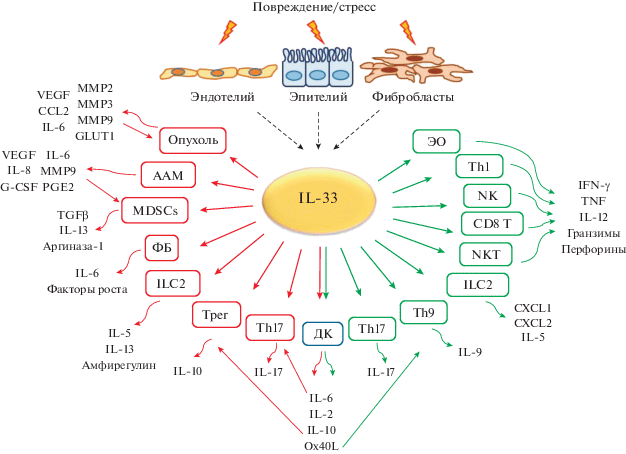
Таким образом, взаимодействуя с рецептором ST2 на поверхности клеток опухоли и других клеток-мишеней, цитокин IL-33 реализует свою функциональную активность. Важно отметить, что внутриклеточный IL-33 также способен влиять на рост раковых клеток, играя роль фактора транскрипции и модулируя экспрессию генов, важных для прогрессии опухоли. Однако в настоящее время подобный механизм воздействия IL-33 недостаточно изучен.
Сигнальный путь IL-33/ST2 принимает участие в патогенезе многих видов рака, что делает его перспективным прогностическим маркером, а также привлекательной иммунотерапевтической мишенью. Однако, учитывая двойственную роль описанного каскада в прогрессии опухоли, следует с осторожностью относиться к возможности его широкого применения в клинике и тщательно исследовать характер данного взаимодействия в каждом конкретном случае.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (№ 18-34-01004).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Hanahan D., Weinberg R.A. (2011) Hallmarks of cancer: the next generation. Cell. 144, 646–674.
Hanahan D., Coussens L.M. (2012) Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell. 21, 309–322.
Grivennikov S.I., Greten F.R., Karin M. (2010) Immunity, inflammation, and cancer. Cell. 140, 883–899.
Kuper H., Adami H.O., Trichopoulos D. (2000) Infections as a major preventable cause of human cancer. J. Intern. Med. 248, 171–183.
Kim S., Karin M. (2011) Role of TLR2-dependent inflammation in metastatic progression. Ann. N. Y. Acad. Sci. 1217, 191–206.
Leibovici J., Itzhaki O., Huszar M., Sinai J. (2011) The tumor microenvironment: Part 1. Immunotherapy. 3, 1367–1384.
Girard J.-P., Amalric F., Jahnsen F.L., Erard M., Baekkevold E.S., Yamanaka T., Haraldsen G., Brandtzaeg P., Johansen F.-E., Roussigné M. (2011) Molecular characterization of NF-HEV, a nuclear factor preferentially expressed in human high endothelial venules. Am. J. Pathol. 163, 69–79.
Schmitz J., Owyang A., Oldham E., Song Y., Murphy E., McClanahan T.K., Zurawski G., Moshrefi M., Qin J., Li X., Gorman D.M., Bazan J.F., Kastelein R.A. (2005) IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines. Immunity. 23, 479–490.
Carriere V., Roussel L., Ortega N., Lacorre D., Americh L., Aguilar L., Girard J. (2007) IL-33, the IL-1-like cytokine for ST2 receptor, is a chromatin-associated nuclear factor in vivo. Proc. Natl. Acad. Sci. USA. 104, 2–7.
Cayrol C., Girard J.P. (2018) Interleukin-33 (IL-33): a nuclear cytokine from the IL-1 family. Immunol. Rev. 281, 154–168.
Moussion C., Ortega N., Girard J.-P. (2008) The IL-1-Like cytokine IL-33 is constitutively expressed in the nucleus of endothelial cells and epithelial cells in vivo: A novel ‘alarmin’? PLoS One. 3, 1–8.
Akimoto M., Takenaga K. (2018) Role of the IL-33/ST2L axis in colorectal cancer progression. Cell. Immunol. pii S0008-8749(17) 30241-1 doi. 10.1016
Liew F.Y., Pitman N.I., McInnes I.B. (2010) Disease-associated functions of IL-33: the new kid in the IL-1 family. Nat. Rev. Immunol. 10, 103–110.
Pichery M., Mirey E., Mercier P., Lefrancais E., Dujardin A., Ortega N., Girard J.-P. (2012) Endogenous IL-33 is highly expressed in mouse epithelial barrier tissues, lymphoid organs, brain, embryos, and inflamed tissues: in situ analysis using a novel Il-33-LacZ gene trap reporter strain. J. Immunol. 188, 3488–3495.
Kakkar R., Hei H., Dobner S., Lee R.T. (2012) Interleukin 33 as a mechanically responsive cytokine secreted by living cells. J. Biol. Chem. 287, 6941–6948.
Metcalf D., Rickard J.A., Vaux D.L., Hall C., Masters S.L., Ekert P.G., Ernst M., Roberts A.W., Lalaoui N., Mifsud S., Anderton H., Croker B.A., et al. (2014) RIPK1 regulates RIPK3-MLKL-Driven systemic inflammation and emergency hematopoiesis. Cell. 157, 1175–1188.
Mchedlidze T., Waldner M., Zopf S., Walker J., Rankin A.L., Schuchmann M., Voehringer D., McKenzie A.N.J., Neurath M.F., Pflanz S., Wirtz S. (2013) Interleukin-33-dependent innate lymphoid cells mediate hepatic fibrosis. Immunity. 39, 357–371.
Molofsky A.B., Van Gool F., Liang H.-E., Van Dyken S.J., Nussbaum J.C., Lee J., Bluestone J.A., Locksley R.M. (2015) Interleukin-33 and IFN-γ counter-regulate group 2 innate lymphoid cell activation during immune perturbation. Immunity. 43, 161–174.
Lefrancais E., Roga S., Gautier V., Gonzalez-de-Peredo A., Monsarrat B., Girard J.-P., Cayrol C. (2012) IL-33 is processed into mature bioactive forms by neutrophil elastase and cathepsin G. Proc. Natl. Acad. Sci. USA. 109, 1673–1678.
Lefrancais E., Duval A., Mirey E., Roga S., Espinosa E., Cayrol C., Girard J.-P. (2014) Central domain of IL-33 is cleaved by mast cell proteases for potent activation of group-2 innate lymphoid cells. Proc. Natl. Acad. Sci. USA. 111, 15502–15507.
Cayrol C., Duval A., Schmitt P., Roga S., Camus M., Stella A., Burlet-Schiltz O., Gonzalez-De-Peredo A., Girard J.P. (2018) Environmental allergens induce allergic inflammation through proteolytic maturation of IL-33. Nat. Immunol. 19, 375–385.
Bartemes K.R., Iijima K., Kobayashi T., Kephart G.M., McKenzie A.N., Kita H. (2012) IL-33-responsive lineage-CD25+CD44hi lymphoid cells mediate innate type 2 immunity and allergic inflammation in the lungs. J. Immunol. 188, 1503–1513.
Dinarello C.A. (2009) Immunological and Inflammatory functions of the interleukin-1 family. Annu. Rev. Immunol. 27, 519–550.
Talabot-Ayer D., Lamacchia C., Gabay C., Palmer G. (2009) Interleukin-33 is biologically active independently of caspase-1 cleavage. J. Biol. Chem. 284, 19420–19426.
Brumatti G., Vandenabeele P., Lüthi A.U., Afonina I.S., Martin S.J., Kersse K., Taylor R.C., McNeela E.A., Cullen S.P., Sheridan C., Duriez P.J., Lavelle E.C. (2009) Suppression of interleukin-33 bioactivity through proteolysis by apoptotic caspases. Immunity. 31, 84–98.
Lamkanfi M., Dixit V.M. (2009) IL-33 raises alarm. Immunity. 31, 5–7.
Garcia-Faroldi G., Melo F.R., Ronnberg E., Grujic M., Pejler G. (2013) Active caspase-3 is stored within secretory compartments of viable mast cells. J. Immunol. 191, 1445–1452.
Zorn C.N., Pardo J., Martin P., Simon M.M., Kuhny M., Huber M. (2013) Secretory lysosomes of mouse mast cells store and exocytose active caspase-3 in a strictly granzyme B dependent manner. Eur. J. Immunol. 43, 3209–3218.
Cohen E.S., Scott I.C., Majithiya J.B., Popovic B., Xu J., Higazi D.R., Lowe D.C., Huntington C.E., England E., Woods J., Rees D.G., Corkill D.J., Butler R., Sleeman M.A., Rapley L., Carmen S., et al. (2015) Oxidation of the alarmin IL-33 regulates ST2-dependent inflammation. Nat. Commun. 6, 1–10.
Yamamoto Y., Kato Z., Matsukuma E., Li A., Omoya K., Hashimoto K., Ohnishi H., Kondo N. (2004) Generation of highly stable IL-18 based on a ligand-receptor complex structure. Biochem. Biophys. Res. Commun. 317, 181–186.
Travers J., Rochman M., Miracle C.E., Habel J.E., Brusilovsky M., Caldwell J.M., Rymer J.K., Rothenberg M.E. (2018) Chromatin regulates IL-33 release and extracellular cytokine activity. Nat. Commun. 9, 1–15.
Boraschi D., Tagliabue A. (2013) The interleukin-1 receptor family. Semin. Immunol. 25, 394–407.
Palmer G., Lipsky B.P., Smithgall M.D., Meininger D., Siu S., Talabot-Ayer D., Gabay C., Smith D.E. (2008) The IL-1 receptor accessory protein (AcP) is required for IL-33 signaling and soluble AcP enhances the ability of soluble ST2 to inhibit IL-33. Cytokine. 42, 358–364.
Lingel A., Weiss T.M., Niebuhr M., Pan B., Appleton B.A., Wiesmann C., Bazan J.F., Fairbrother W.J. (2009) Structure of IL-33 and its interaction with the ST2 and IL-1RAcP receptors-insight into heterotrimeric IL-1 signaling complexes. Structure. 17, 1398–1410.
Martin M.U. (2013) Special aspects of interleukin-33 and the IL-33 receptor complex. Semin. Immunol. 25, 449–457.
Hayakawa H., Hayakawa M., Kume A., Tominaga S.I. (2007) Soluble ST2 blocks interleukin-33 signaling in allergic airway inflammation. J. Biol. Chem. 282, 26369–26380.
Jensen L.E., Whitehead A.S. (2003) Expression of alternatively spliced interleukin-1 receptor accessory protein mRNAs is differentially regulated during inflammation and apoptosis. Cell. Signal. 15, 793–802.
Bulek K., Swaidani S., Qin J., Gulen M.F., Lu Y., Min B., Aronica M., Kosz-Vnenchak M., Kastelein R.A., Herjan T., Li X. (2009) The essential role of single Ig IL-1 receptor-related molecule/Toll IL-1R8 in regulation of Th2 immune response. J. Immunol. 182, 2601–2609.
Cayrol C., Girard J. (2014) IL-33 : an alarmin cytokine with crucial roles in innate immunity, inflammation and allergy. Curr. Opin. Immunol. 31, 31–37.
Molofsky A.B., Savage A.K., Locksley R.M. (2015) Interleukin-33 in tissue homeostasis, injury, and inflammation. Immunity. 42, 1005–1019.
Liew F.Y., Girard J.P., Turnquist H.R. (2016) Interleukin-33 in health and disease. Nat. Rev. Immunol. 16, 676–689.
Robler U., Thomassen E., Hultner L., Baier S., Danescy J., Werenskiold A. (1995) Secreted and membrane-bound isoforms of T1, an orphan receptor related to IL-1-binding proteins, are differently expressed in vivo. Dev. Biol. 168, 86–97.
Oshikawa K., Yanagisawa K., Tominaga S., Sugiyama Y. (2002) Expression and function of the ST2 gene in a murine model of allergic airway inflammation. Clin. Exp. Allergy. 32, 1520–1526.
McKenzie A.N.J., Spits H., Eberl G. (2014) Innate lymphoid cells in inflammation and immunity. Immunity. 41, 366–374.
Thornton E.E., Nussbaum J.C., Cheng L.E., Mohapatra A., Liang H.-E., Van Dyken S.J., Chawla A., Molofsky A.B., Krummel M.F., Locksley R.M., von Moltke J. (2013) Type 2 innate lymphoid cells control eosinophil homeostasis. Nature. 502, 245–248.
Molofsky A.B., Nussbaum J.C., Liang H.-E., Mohapatra A., Van Dyken S.J., Chawla A., Cheng L.E., Locksley R.M. (2013) Innate lymphoid type 2 cells sustain visceral adipose tissue eosinophils and alternatively activated macrophages. J. Exp. Med. 210, 535–549.
Vasanthakumar A., Moro K., Xin A., Liao Y., Gloury R., Kawamoto S., Fagarasan S., Mielke L. a, Afshar-Sterle S., Masters S.L., Nakae S., Saito H., Wentworth J.M., Li P., Liao W., Leonard W.J., Smyth G.K., Shi W., Nutt S.L., Koyasu S., Kallies A. (2015) The transcriptional regulators IRF4, BATF and IL-33 orchestrate development and maintenance of adipose tissue-resident regulatory T cells. Nat. Immunol. 16, 276–285.
Kurowska-Stolarska M., Kewin P., Murphy G., Russo R.C., Stolarski B., Garcia C.C., Komai-Koma M., Pitman N., Li Y., McKenzie A.N.J., Teixeira M.M., Liew F.Y., Xu D. (2008) IL-33 induces antigen-specific IL-5+ T cells and promotes allergic-induced airway inflammation independent of IL-4. J. Immunol. 181, 4780–4790.
Guo L., Wei G., Zhu J., Liao W., Leonard W.J., Zhao K., Paul W. (2009) IL-1 family members and STAT activators induce cytokine production by Th2, Th17, and Th1 cells. Proc. Natl. Acad. Sci. USA. 106, 13463–13468.
Bourgeois E., van L.P., Samson M., Diem S., Barra A., Roga S., Gombert J.M., Schneider E., Dy M., Gourdy P., Girard J.P., Herbelin A. (2009) The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-γ production. Eur. J. Immunol. 39, 1046–1055.
Bouffi C., Rochman M., Stucke E.M., Barski A., Zust C.B., Kartashov A., Fulkerson P.C., Rothenberg M.E. (2013) IL-33 markedly activates murine eosinophils by an NF- B-dependent mechanism differentially dependent upon an IL-4-driven autoinflammatory loop. J. Immunol. 191, 4317–4325.
Schneider E., Petit-Bertron A.-F., Bricard R., Levasseur M., Ramadan A., Girard J.-P., Herbelin A., Dy M. (2009) IL-33 activates unprimed murine basophils directly in vitro and induces their in vivo expansion indirectly by promoting hematopoietic growth factor production. J. Immunol. 183, 3591–3597.
Kroeger K.M., Sullivan B.M., Locksley R.M. (2009) IL-18 and IL-33 elicit Th2 cytokines from basophils via a MyD88- and p38α-dependent pathway. J. Leukoc. Biol. 86, 769–778.
Toes R.E.M., Marone G., Huizinga T.W.J., Rivellese F., de Paulis A., Suurmond J. (2014) IgE and IL-33−mediated triggering of human basophils inhibits TLR4−induced monocyte activation. Eur. J. Immunol. 44, 3045–3055.
Lunderius-Andersson C., Enoksson M., Nilsson G., Fallon P.G., Moller-Westerberg C., Lyberg K. (2011) Mast cells as sensors of cell injury through IL-33 recognition. J. Immunol. 186, 2523–2528.
Saluja R., Khan M., Church M.K., Maurer M. (2015) The role of IL-33 and mast cells in allergy and inflammation. Clin. Transl. Allergy. 5, 1–8.
Rank M.A., Kobayashi T., Kozaki H., Bartemes K.R., Squillace D.L., Kita H. (2009) IL-33-activated dendritic cells induce an atypical TH2-type response. J. Allergy Clin. Immunol. 123, 1047–1054.
Blazar B.R., Rosborough B.R., Matta B.M., Liu Q., Mathews L.R., Lott J.M., Turnquist H.R. (2014) IL-33 is an unconventional alarmin that stimulates IL-2 secretion by dendritic cells to selectively expand IL-33R/ST2+ regulatory T cells. J. Immunol. 193, 4010–4020.
Yan S., Zhao A., Keegan A.D., Sun R., Shea-Donohue T., Grinchuk V., Yang Z., Ramalingam T., Notari L., Wynn T.A., Bohl J., Urban J.F. (2013) Macrophages as IL-25/IL-33-responsive cells play an important role in the induction of type 2 immunity. PLoS One. 8, e59441.
Maywald R.L., Doerner S.K., Pastorelli L., De Salvo C., Benton S.M., Dawson E.P., Lanza D.G., Berger N.A., Markowitz S.D., Lenz H.-J., Nadeau J.H., Pizarro T.T., Heaney J.D. (2015) IL-33 activates tumor stroma to promote intestinal polyposis. Proc. Natl. Acad. Sci. USA. 112, E2487–E2496.
Gadani S.P., Walsh J.T., Smirnov I., Zheng J., Kipnis J. (2015) The glia-derived alarmin IL-33 orchestrates the immune response and promotes recovery following CNS injury. Neuron. 85, 703–709.
Kindermann M., Danese S., Vetrano S., Günther C., Mahapatro M., Foersch S., Hefele M., Wirtz S., Mchedlidze T., He G.-W., Neurath M.F., Giner-Ventura E., Becker C. (2016) Programming of intestinal epithelial differentiation by IL-33 derived from pericryptal fibroblasts in response to systemic infection. Cell Rep. 15, 1743–1756.
Gautier V., Cayrol C., Farache D., Roga S., Monsarrat B., Burlet-Schiltz O., Gonzalez De Peredo A., Girard J.P. (2016) Extracellular IL-33 cytokine, but not endogenous nuclear IL-33, regulates protein expression in endothelial cells. Sci. Rep. 6, 1–12.
Fang J., Achanta S., Caceres A.I., Jordt S.-E., Tai Y., Liu B., Kaelberer M.M., Shao X. (2016) IL-33/ST2 signaling excites sensory neurons and mediates itch response in a mouse model of poison ivy contact allergy. Proc. Natl. Acad. Sci. USA. 113, E7572–E7579.
Liew F.Y. (2012) IL-33: a Janus cytokine. Ann. Rheum. Dis. 71, i101–i104.
Oboki K., Ohno T., Kajiwara N., Kiyonari H., Morita H., Nambu A., Arae K., Matsumoto K., Sudo K., Abe T., Okumura K., Saito H., Ishii A., Nakae S. (2010) IL-33 is a crucial amplifier of innate rather than acquired immunity. Proc. Natl. Acad. Sci. USA. 107, 18581–18586.
Yang Q., Li G., Zhu Y., Liu L., Finn O.J., Turnquist H., Zhang X., Chen X., Chen E., Lu B. (2011) IL-33 synergizes with TCR and IL-12 signaling to promote the effector function of CD8 + T cells. Eur. J. Immunol. 41, 3351–3360.
Smithgall M.D., Comeau M.R., Park Yoon B.R., Kaufman D., Armitage R., Smith D.E. (2008) IL-33 amplifies both Th1- and Th2-type responses through its activity on human basophils, allergen-reactive Th 2 cells, iNKT and NK cells. Int. Immunol. 20, 1019–1030.
Baumann C., Bonilla W. V., Fröhlich A., Helmstetter C., Peine M., Hegazy A.N., Pinschewer D.D., Löhning M. (2015) T-bet– and STAT4–dependent IL-33 receptor expression directly promotes antiviral Th1 cell responses. Proc. Natl. Acad. Sci. USA. 112, 4056–4061.
Lu B., Yang M., Wang Q. (2016) Interleukin-33 in tumorigenesis, tumor immune evasion, and cancer immunotherapy. J. Mol. Med. 94(5), 535‒543.
Liu X., Zhu L., Lu X., Bian H., Wu X., Yang W., Qin Q. (2014) IL-33/ST2 pathway contributes to metastasis of human colorectal cancer. Biochem. Biophys. Res. Commun. 453, 486–492.
Fang M., Li Y., Huang K., Qi S., Zhang J., Zgodzinski W., Majewski M., Wallner G., Gozdz S., Macek P., Kowalik A., Pasiarski M., Grywalska E., Vatan L., Nagarsheth N., Li W., Zhao L., Kryczek I., Wang G., Wang Z., Zou W., Wang L. (2017) IL33 promotes colon cancer cell stemness via JNK activation and macrophage recruitment. Cancer Res. 77, 2735–2745.
Mertz K.D., Mager L.F., Wasmer M.H., Thiesler T., Koelzer V.H., Ruzzante G., Joller S., Murdoch J.R., Brümmendorf T., Genitsch V., Lugli A., Cathomas G., Moch H., Weber A., Zlobec I., Junt T., Krebs P. (2016) The IL-33/ST2 pathway contributes to intestinal tumorigenesis in humans and mice. Oncoimmunology. 5, 1–11.
Akimoto M., Maruyama R., Takamaru H., Ochiya T., Takenaga K. (2016) Soluble IL-33 receptor sST2 inhibits colorectal cancer malignant growth by modifying the tumour microenvironment. Nat. Commun. 7, 1–15.
O’Donnell C., Mahmoud A., Keane J., Murphy C., White D., Carey S., O’Riordain M., Bennett M.W., Brint E., Houston A. (2016) An antitumorigenic role for the IL-33 receptor, ST2L, in colon cancer. Br. J. Cancer. 114, 37–43.
Zhang Y., Davis C., Shah S., Hughes D., Ryan J.C., Altomare D., Peña M.M.O. (2018) IL-33 promotes growth and liver metastasis of colorectal cancer in mice by remodeling the tumor microenvironment and inducing angiogenesis. Mol. Carcinog. 56, 272–287.
He Z., Chen L., Souto F.O., Canasto-Chibuque C., Bongers G., Deshpande M., Harpaz N., Ko H.M., Kelley K., Furtado G.C., Lira S.A. (2017) Epithelial-derived IL-33 promotes intestinal tumorigenesis in ApcMin/+mice. Sci. Rep. 7, 1–14.
Malik A., Sharma D., Zhu Q., Karki R., Guy C.S., Vogel P., Kanneganti T.-D. (2016) IL-33 regulates the IgA-microbiota axis to restrain IL-1a-dependent colitis and tumorigenesis. J. Clin. Invest. 126, 4469–4481.
Eissmann M.F., Dijkstra C., Wouters M.A., Baloyan D., Mouradov D., Nguyen P.M., Davalos-Salas M., Putoczki T.L., Sieber O.M., Mariadason J.M., Ernst M., Masson F. (2018) Interleukin 33 signaling restrains sporadic colon cancer in an interferon-γ–dependent manner. Cancer Immunol. Res. 6(4), 409‒421. https://doi.org/10.1158/2326-6066
Wang C., Chen Z., Bu X., Han Y., Shan S., Ren T., Song W. (2016) IL-33 signaling fuels outgrowth and metastasis of human lung cancer. Biochem. Biophys. Res. Commun. 479, 461–468.
Hu L., Fu Y., Zhang D., Zhang J. (2013) Serum IL-33 as a diagnostic and prognostic marker in non-small cell lung cancer. Asian Pac. J. Cancer Prev. 14, 2563–2566.
Yang Z., Gao X., Wang J., Xu L., Zheng Y., Xu Y. (2018) Interleukin-33 enhanced the migration and invasiveness of human lung cancer cells. Onco. Targets. Ther. 11, 843–849.
Akimoto M., Hayashi J.I., Nakae S., Saito H., Takenaga K. (2016) Interleukin-33 enhances programmed oncosis of ST2L-positive low-metastatic cells in the tumour microenvironment of lung cancer. Cell Death Dis. 7, e2057.
Saranchova I., Han J., Huang H., Fenninger F., Choi K.B., Munro L., Pfeifer C., Welch I., Wyatt A.W., Fazli L., Gleave M.E., Jefferies W.A. (2016) Discovery of a metastatic immune escape mechanism initiated by the loss of expression of the tumour biomarker Interleukin-33. Sci. Rep. 6, 1–14.
Wang K., Shan S., Yang Z., Gu X., Wang Y., Wang C., Ren T., Wang K., Shan S., Yang Z., Gu X., Wang Y., Wang C., Ren T. (2017) IL-33 blockade suppresses tumor growth of human lung cancer through direct and indirect pathways in a preclinical model. Oncotarget. 8, 68571–68582.
Gao K., Li X., Zhang L., Bai L., Dong W., Gao K., Shi G., Xia X., Wu L., Zhang L. (2018) Transgenic expression of IL-33 activates CD8 + T cells and NK cells and inhibits tumor growth and metastasis in mice. Cancer Lett. 1640, 1–9.
Liu J., Shen J., Hu J., Huang W., Zhang G. (2014) Significance of interleukin-33 and its related cytokines in patients with breast cancers. Front. Immunol. 5, 1–7.
Kim J.Y., Lim S.-C., Kim G., Yun H.J., Ahn S.-G., Choi H.S. (2015) Interleukin-33/ST2 axis promotes epithelial cell transformation and breast tumorigenesis via upregulation of COT activity. Oncogene. 34, 4928–4938.
Hu H., Sun J., Wang C., Bu X., Liu X., Mao Y., Wang H. (2017) IL-33 facilitates endocrine resistance of breast cancer by inducing cancer stem cell properties. Biochem. Biophys. Res. Commun. 485, 643–650.
Jovanovic I., Radosavljevic G., Mitrovic M., Lisnic Juranic V., Mckenzie A.N.J., Arsenijevic N., Jonjic S., Lukic M.L. (2011) ST2 deletion enhances innate and acquired immunity to murine mammary carcinoma. Eur. J. Immunol. 41, 1902–1912.
Jovanovic I.P., Pejnovic N.N., Radosavljevic G.D., Pantic J.M., Milovanovic M.Z., Arsenijevic N.N., Lukic M.L. (2014) Interleukin-33/ST2 axis promotes breast cancer growth and metastases by facilitating intratumoral accumulation of immunosuppressive and innate lymphoid cells. Int. J. Cancer. 134, 1669–1682.
Xiao P., Wan X., Cui B., Liu Y., Qiu C., Rong J., Zheng M., Song Y., Chen L., He J., Tan Q., Wang X., Shao X., Liu Y., Cao X., Wang Q. (2016) Interleukin 33 in tumor microenvironment is crucial for the accumulation and function of myeloid-derived suppressor cells. Oncoimmunology. 5, e1063772.
Milosavljevic M.Z., Jovanovic I.P., Pejnovic N.N., Mitrovic S.L.J., Arsenijevic N.N., Markovic B.J.S., Lukic M.L. (2016) Deletion of IL-33R attenuates VEGF expression and enhances necrosis in mammary carcinoma. Oncotarget. 7(14), 18106‒18115. https://doi.org/10.18632/oncotarget
Gao X., Wang X., Yang Q., Zhao X., Wen W., Li G., Lu J., Qin W., Qi Y., Xie F., Jiang J., Wu C., Zhang X., Chen X., Turnquist H., Zhu Y., Lu B. (2015) Tumoral expression of IL-33 inhibits tumor growth and modifies the tumor microenvironment through CD8 + T and NK cells. J. Immunol. 194, 438–445.
Dominguez D., Ye C., Geng Z., Chen S., Fan J., Qin L., Long A., Wang L., Zhang Y., Zhang Z., Fang D., Kuzel T.M., Zhang B. (2016) Exogenous IL-33 restores dendritic cell activation and maturation in established cancer. J. Immunol. 198, 1365–1375.
Lucarini V., Ziccheddu G., Macchia I., La Sorsa V., Peschiaroli F., Buccione C., Sistigu A., Sanchez M., Andreone S., D’Urso M.T., Spada M., Macchia D., Afferni C., Mattei F., Schiavoni G. (2017) IL-33 restricts tumor growth and inhibits pulmonary metastasis in melanoma-bearing mice through eosinophils. Oncoimmunology. 6, 1–14.
Kim H.J., Park N.H., Sin J.-I., Moon U.J., Kim J., Kwon B., Kim W., Cho H.R., Choi H.-J. (2016) Intratumorally establishing type 2 innate lymphoid cells blocks tumor growth. J. Immunol. 196, 2410–2423.
Ikutani M., Yanagibashi T., Ogasawara M., Takaki S., Hattori Y., Nagai Y., Kouro T., Itakura A., Tsuneyama K., Yamamoto S., Takatsu K. (2011) Identification of innate IL-5-producing cells and their role in lung eosinophil regulation and antitumor immunity. J. Immunol. 188, 703–713.
Chen J., Zhao Y., Jiang Y., Gao S., Wang Y., Wang D., Wang A., Yi H., Gu R., Yi Q., Wang S. (2018) Interleukin-33 contributes to the induction of Th9 cells and antitumor efficacy by Dectin-1-activated dendritic cells. Front. Immunol. 9, 1–11.
Yu X.X., Hu Z., Shen X., Dong L.Y., Zhou W.Z., Hu W.H. (2015) IL-33 promotes gastric cancer cell invasion and migration via ST2–ERK1/2 pathway. Dig. Dis. Sci. 60, 1265–1272.
Dhillon A.S., Hagan S., Rath O., Kolch W. (2007) MAP kinase signalling pathways in cancer. Oncogene. 26, 3279–3290.
Ye X., Zhao Y., Weng G., Chen Y., Wei X., Shao J., Ji H. (2015) IL-33-induced JNK pathway activation confers gastric cancer chemotherapy resistance. Oncol. Rep. 33, 2746–2752.
Yamada D., Rizvi S., Razumilava N., Bronk S.F., Davila J.I., Champion M.D., Borad M.J., Bezerra J.A., Chen X., Gores G.J. (2015) IL-33 facilitates oncogene-induced cholangiocarcinoma in mice by an interleukin-6-sensitive mechanism. Hepatology. 61, 1627–1642.
Li J., Razumilava N., Gores G.J., Walters S., Mizuochi T., Mourya R., Bessho K., Wang Y.-H., Glaser S.S., Shivakumar P., Bezerra J.A. (2014) Biliary repair and carcinogenesis are mediated by IL-33–dependent cholangiocyte proliferation. J. Clin. Invest. 124, 3241–3251.
Chen S.-F., Nieh S., Jao S.-W., Wu M.-Z., Liu C.-L., Chang Y.-C., Lin Y.-S. (2013) The paracrine effect of cancer-associated fibroblast-induced interleukin-33 regulates the invasiveness of head and neck squamous cell carcinoma. J. Pathol. 231, 180–189.
Ishikawa K., Yagi-Nakanishi S., Nakanishi Y., Kondo S., Tsuji A., Endo K., Wakisaka N., Murono S., Yoshizaki T. (2014) Expression of interleukin-33 is correlated with poor prognosis of patients with squamous cell carcinoma of the tongue. Auris Nasus Larynx. 41, 552–557.
Brenner H., Kloor M., Peter Pox C. (2014) Colorectal cancer. Lancet. 383, 1490–1502.
Grivennikov S.I., Cominelli F. (2016) Colitis-associated and sporadic colon cancers: different diseases, different mutations? Gastroenterology. 150, 808–810.
Robles A.I., Traverso G., Zhang M., Roberts N.J., Khan M.A., Joseph C., Lauwers G.Y., Selaru F.M., Popoli M., Pittman M.E., Ke X., Hruban R.H., Meltzer S.J., Kinzler K.W., Vogelstein B., Harris C.C., Papadopoulos N. (2016) Whole-exome sequencing analyses of inflammatory bowel disease-associated colorectal cancers. Gastroenterology. 150, 931–943.
Theoharides T.C., Zhang B., Kempuraj D., Tagen M., Vasiadi M., Angelidou A., Alysandratos K.-D., Kalogeromitros D., Asadi S., Stavrianeas N., Peterson E., Leeman S., Conti P. (2010) IL-33 augments substance P-induced VEGF secretion from human mast cells and is increased in psoriatic skin. Proc. Natl. Acad. Sci. USA. 107, 4448–4453.
Tanabe T., Shimokawaji T., Kanoh S., Rubin B. (2014) IL-33 stimulates CXCL8/IL-8 secretion in goblet cells but not normally differentiated airway cells. Clin. Exp. Allerg. 44, 540–552.
Staton C.A., Chetwood A.S.A., Cameron L.C., Cross S.S., Brown N.J., Reed M.W.R. (2007) The angiogenic switch occurs at the adenoma stage of the adenoma-carcinoma sequence in colorectal cancer. Gut. 56, 1426–1432.
Cui G., Yuan A., Goll R., Vonen B., Florholmen J. (2009) Dynamic changes of interleukin-8 network along the colorectal adenoma-carcinoma sequence. Cancer Immunol. Immunother. 58, 1899–1907.
Abdullah M., Rani A.A., Sudoyo A.W., Makmun D., Handjari D.R., Hernowo B.S. (2013) Expression of NF-kB and COX2 in colorectal cancer among native Indonesians: the role of inflammation in colorectal carcinogenesis. Acta Med. Indones. 45, 187–192.
Cui G., Yuan A., Sun Z., Zheng W., Pang Z. (2018) IL-1β/IL-6 network in the tumor microenvironment of human colorectal cancer. Pathol. Res. Pract. 214, 986–992.
Qi H., Yang H., Xu G., Ren J., Hua W., Shi Y., Torsvik M., Florholmen J., Cui G. (2015) Therapeutic efficacy of IL-17A antibody injection in preventing the development of colitis associated carcinogenesis in mice. Immunobiology. 220, 54–59.
Li Y., Shi J., Qi S., Zhang J., Peng D., Chen Z., Wang G., Wang Z., Wang L. (2018) IL-33 facilitates proliferation of colorectal cancer dependent on COX2/PGE2. J. Exp. Clin. Cancer Res. 37, 1–12.
Pascual-Reguant A., Bayat Sarmadi J., Baumann C., Noster R., Cirera-Salinas D., Curato C., Pelczar P., Huber S., Zielinski C.E., Löhning M., Hauser A.E., Esplugues E. (2017) Th17 cells express ST2 and are controlled by the alarmin IL-33 in the small intestine. Mucosal Immunol. 10, 1431–1442.
Song Y., Yang J.M. (2017) Role of interleukin (IL)-17 and T-helper (Th)17 cells in cancer. Biochem. Biophys. Res. Commun. 493, 1–8.
Asadzadeh Z., Mohammadi H., Safarzadeh E., Azizi G., Jadidi-Niaragh F., Mahdian-shakib A., Hemmatzadeh M., Baradaran B. (2017) The paradox of Th17 cell functions in tumor immunity. Cell. Immunol. 322, 15–25.
Cui G., Yuan A., Pang Z., Zheng W., Li Z., Goll R. (2018) Contribution of IL-33 to the pathogenesis of colorectal cancer. Front. Oncol. 8, 1–8.
Yin L., Hirohito D. (2017) IL-33 : biological properties, functions, and roles in airway disease. Immunol. Rev. 278, 173–184.
Gao K., Li X., Zhang L., Bai L., Dong W., Gao K., Shi G., Xia X., Wu L., Zhang L. (2013) Transgenic expression of IL-33 activates CD8+ T cells and NK cells and inhibits tumor growth and metastasis in mice. Cancer Lett. 1640, 1–9.
Ferlay J., Parkin D.M., Steliarova-Foucher E. (2010) Estimates of cancer incidence and mortality in Europe in 2008. Eur. J. Cancer. 46, 765–781.
Jovanovic I.P., Pejnovic N.N., Radosavljevic G.D., Pantic J.M., Milovanovic M.Z., Arsenijevic N.N., Lukic M.L. (2014) Interleukin-33/ST2 axis promotes breast cancer growth and metastases by facilitating intratumoral accumulation of immunosuppressive and innate lymphoid cells. Int. J. Cancer. 134, 1669–1682.
Kim J.Y., Lim S., Kim G., Yun H.J., Ahn S., Choi H.S. (2014) Interleukin-33 / ST2 axis promotes epithelial cell transformation and breast tumorigenesis via upregulation of COT activity. Oncogene. 1–11.
Lucarini V., Ziccheddu G., Macchia I., La Sorsa V., Peschiaroli F., Buccione C., Sistigu A., Sanchez M., Andreone S., D’Urso M.T., Spada M., Macchia D., Afferni C., Mattei F., Schiavoni G. (2017) IL-33 restricts tumor growth and inhibits pulmonary metastasis in melanoma-bearing mice through eosinophils. Oncoimmunology. 6, 1–14.
Zhang Y., Zhang Z., Zhang B., Ye C., Long A., Dominguez D., Kuzel T.M., Wang L., Fan J., Fang D., Geng Z., Chen S., Qin L. (2016) Exogenous IL-33 restores dendritic cell activation and maturation in established cancer. J. Immunol. 198, 1365–1375.
Lu Y., Hong S., Wang L., He J., Qian J., Park J., Yang J., Li H., Hong B., Liu Z., Xu J., Zheng Y., Yi Q. (2012) Th9 cells promote antitumor immune responses in vivo. J. Clin. Invest. 122, 4160–4171.
Ramadan A., Griesenauer B., Adom D., Hanenberg H., Kapur R., Liu C., Kaplan M.H., Paczesny S. (2017) Specifically differentiated T cell subset promotes tumor immunity over fatal immunity. J. Exp. Med. 214, 3577–3596.
Siegel R.L., Miller K.D., Jemal A. (2016) Cancer statistics. CA. Cancer J. Clin. 69, 7–34.
Nagini S. (2012) Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J. Gastrointest. Oncol. 4, 156.
Yu X.X., Hu Z., Shen X., Dong L.Y., Zhou W.Z., Hu W.H. (2015) IL-33 promotes gastric cancer cell invasion and migration via ST2–ERK1/2 Pathway. Dig. Dis. Sci. 60, 1265–1272.
Dong L., Wang Z., Meng X., Gao S., Zhu L., Si X., Xu A., Li T., Li W., Qi Y. (2013) Activation of STAT3 in human gastric cancer cells via interleukin (IL)-6-type cytokine signaling correlates with clinical implications. PLoS One. 8, e75788.
Verma S. (2014) Matrix metalloproteinases and gastrointestinal cancers: Impacts of dietary antioxidants. World J. Biol. Chem. 5, 355.
Tyson G.L., El-Serag H.B. (2011) Risk factors for cholangiocarcinoma. Hepatology. 54, 173–184.
Kaufmann S.H., Kobayashi S., Gores G.J., Bronk S.F., Werneburg N.W. (2005) Interleukin-6 contributes to Mcl-1 up-regulation and TRAIL resistance via an Akt-signaling pathway in cholangiocarcinoma cells. Gastroenterology. 128, 2054–2065.
Wehbe H., Henson R., Meng F., Mize-Berge J., Patel T. (2006) Interleukin-6 contributes to growth in cholangiocarcinoma cells by aberrant promoter methylation and gene expression. Cancer Res. 66, 10517–10524.
Leemans C.R., Braakhuis B.J.M., Brakenhoff R.H. (2011) The molecular biology of head and neck cancer. Nat. Rev. Cancer 11, 9–22.
Zhang J., Ji W., Wang P., Lu X., Ding Y. (2016) Overexpression of interleukin-33 is associated with poor prognosis of patients with glioma. Int. J. Neurosci. 127, 210–217.
Sun P., Ben Q., Tu S., Dong W., Qi X., Wu Y. (2011) Serum interleukin-33 levels in patients with gastric cancer. Dig. Dis. Sci. 56, 3596–3601.
Zhang P., Liu X.K., Chu Z., Ye J.C., Li K.L., Zhuang W.L., Jiang Y.F., Jiang Y.F. (2012) Detection of interleukin-33 in serum and carcinoma tissue from patients with hepatocellular carcinoma and its clinical implications. J. Int. Med. Res. 40, 1654–1661.
Santulli P., Even M., Chouzenoux S., Millischer A.E., Borghese B., De Ziegler D., Batteux F., Chapron C. (2013) Profibrotic interleukin-33 is correlated with uterine leiomyoma tumour burden. Hum. Reprod. 28, 2126–2133.
Mager L.F., Riether C., Schürch C.M., Banz Y., Wasmer M.-H., Stuber R., Theocharides A.P., Li X., Xia Y., Saito H., Nakae S., Baerlocher G.M., Manz M.G., McCoy K.D., Macpherson A.J., Ochsenbein A.F., Beutler B., Krebs P. (2015) IL-33 signaling contributes to the pathogenesis of myeloproliferative neoplasms. J. Clin. Invest. 125, 2579–2591.
Glück J., Rymarczyk B., Rogala B. (2012) Serum IL-33 but not ST2 level is elevated in intermittent allergic rhinitis and is a marker of the disease severity. Inflamm. Res. 61, 547–550.
Tamagawa-Mineoka R., Okuzawa Y., Masuda K., Katoh N. (2014) Increased serum levels of interleukin 33 in patients with atopic dermatitis. J. Am. Acad. Dermatol. 70, 882–888.
Xia J., Zhao J., Shang J., Li M., Zhao J., Zeng Z., Wang J., Xu Y., Xie J. (2015) Increased IL-33 expression in chronic obstructive pulmonary disease. Am. J. Physiol. Cell. Mol. Physiol. 308, 619–627.
Wang Z., Xu L., Zhou L., Zhang W., Chang Y., Fu H., Yang Y., Xu J. (2016) IL-33 is associated with unfavorable postoperative survival of patients with clear-cell renal cell carcinoma. Tumor Biol. 37, 11127–11134.
Wu C.W., Wu Y.G., Cheng C., Hong Z.D., Shi Z.M., Lin S.Q., Li J., He X.Y., Zhu A.Y. (2018) Interleukin-33 predicts poor prognosis and promotes renal cell carcinoma cell growth through its receptor ST2 and the JNK signaling pathway. Cell. Physiol. Biochem. 47, 191–200.
Saied E.M., El-Etreby N.M. (2017) The role and prognostic value of inducible nitric oxide synthase (iNOS) and interleukin-33 (IL-33) in serous and mucinous epithelial ovarian tumours. Ann. Diagn. Pathol. 27, 62–68.
Tong X., Barbour M., Hou K., Gao C., Zhao Y., Mu R., Cao S., Zheng J., Jiang H.-R. (2016) Interleukin-33 predicts poor prognosis and promotes ovarian cancer cell growth and metastasis through regulating ERK and JNK signaling pathways. Mol. Oncol. 10, 113–125.
Tong X., Barbour M., Hou K., Gao C., Zhao Y., Mu R., Cao S., Zheng J., Jiang H.-R. (2015) Interleukin-33 predicts poor prognosis and promotes ovarian cancer cell growth and metastasis through regulating ERK and JNK signaling pathways. Mol. Oncol. 10, 113–125.
Yang Z.-P., Ling D.-Y., Xie Y.-H., Wu W.-X., Li J.-R., Jiang J., Zheng J.-L., Fan Y.-H., Zhang Y. (2015) The Association of serum IL-33 and sST2 with breast cancer. Dis. Markers 2015, 1–6.
Gramatzki D., Frei K., Cathomas G., Moch H., Weller M., Mertz K.D. (2016) Interleukin-33 in human gliomas: expression and prognostic significance. Oncol. Lett. 12, 445–452.
Zhang J.-F., Wang P., Yan Y.-J., Guan M.-W., Li Y., Yu J.-J., Wang X.-D. (2017) IL-33 enhances glioma cell migration and invasion by upregulation of MMP2 and MMP9 via the ST2-NF-κB pathway. Oncol. Rep. 38, 2033–2042.
Levescot A., Flamant S., Turhan A., Basbous S., Barra A., Bonnet M.-L., Giraud C., Chomel J.-C., Guilhot F., Roy L., Feraud O., Girard J.-P., Jacomet F., Gombert J.-M., Anne Bourgeois E., Herbelin A. (2014) BCR-ABL-induced deregulation of the IL-33/ST2 pathway in CD34+ progenitors from chronic myeloid leukemia patients. Cancer Res. 74, 2669–2676.
Yang M., Feng Y., Yue C., Xu B., Chen L., Jiang J., Lu B., Zhu Y. (2018) Lower expression level of IL-33 is associated with poor prognosis of pulmonary adenocarcinoma. PLoS One 13, 1–13.
Kim M.S., Kim E., Heo J.S., Bae D.J., Lee J.U.W., Lee T.H., Lee H.J., Chang H.S., Park J.S., Jang A.S., Koh E.S., Hwang H.G., Lim G., Kim S., Park C.S. (2015) Circulating IL-33 level is associated with the progression of lung cancer. Lung Cancer. 6–11.
Hsu Y.-L., Hung J.-Y., Lee Y.-L., Chang W.-A., Chong I.-W., Chen F.-W., Chang K.-F., Tsai Y.-M., Kuo P.-L. (2017) Identification of novel gene expression signature in lung adenocarcinoma by using next-generation sequencing data and bioinformatics analysis. Oncotarget. 8, 104831–104854.
Koster R., Panagiotou O., Wheeler W., Karlins E., Gastier-Foster M., Caminada de Toledo S., Petrilli A., Flanagan A., Tirabosco R., Andrulis I., Wunder J., Savage S., Mirabello L. (2013) Genome-wide association study identifies the GLDC/IL33 locus associated with survival of osteosarcoma patients. Int. J. Cancer. 142, 1594–1601.
Rössle M., Cathomas G., Bonapace L., Sachs M., Dehler S., Storz M., Huber G., Moch H., Junt T., Mertz K.D. (2016) Interleukin-33 expression indicates a favorable prognosis in malignant salivary gland tumors. Int. J. Surg. Pathol. 24, 394–400.
Brunner S.M., Rubner C., Kesselring R., Martin M., Griesshammer E., Ruemmele P., Stempfl T., Teufel A., Schlitt H.J., Fichtner-Feigl S. (2015) Tumor-infiltrating, interleukin-33-producing effector-memory CD8+ T cells in resected hepatocellular carcinoma prolong patient survival. Hepatology. 61, 1957–1967.
Bergis D., Kassis V., Ranglack A., Koeberle V., Piiper A., Kronenberger B., Zeuzem S., Waidmann O., Radeke H.H. (2013) High serum levels of the Interleukin-33 receptor soluble ST2 as a negative prognostic factor in hepatocellular carcinoma. Transl. Oncol. 6, 311–318.
Qin L., Dominguez D., Chen S., Fan J., Long A., Zhang M., Fang D., Zhang Y., Kuzel T.M., Zhang B. (2016) Exogenous IL-33 overcomes T cell tolerance in murine acute myeloid leukemia. Oncotarget. 7, 61069-61080.
Duault C., Franchini D.M., Familliades J., Cayrol C., Roga S., Girard J.-P., Fournié J.-J., Poupot M. (2015) TCRVγ9 γδ T cell response to IL-33: a CD4 T cell–dependent mechanism. J. Immunol. 196, 493–502.
Villarreal D.O., Weiner D.B. (2015) IL-33 isoforms: Their future as vaccine adjuvants? Expert Rev. Vaccines. 14, 489–492.
Kallert S.M., Darbre S., Kreppel F., Bonilla W. V., Kreutzfeldt M., Page N., Löhning M., Lu M., Favre S., Zippelius A., Merkler D., Kreuzaler M., Müller P., Luther S.A., Pinschewer D.D. (2017) Replicating viral vector platform exploits alarmin signals for potent CD8+ T cell-mediated tumour immunotherapy. Nat. Commun. 8, 15327.
Corbin A.S., Agarwal A., Loriaux M., Cortes J., Deininger M.W., Druker B.J. (2011) Human chronic myeloid leukemia stem cells are insensitive to imatinib despite inhibition of BCR-ABL activity. J. Clin. Invest. 121, 1222–1222.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


