Молекулярная биология, 2019, T. 53, № 5, стр. 830-837
Механизмы активации прокаспазы-8 при инициации внешнего пути программируемой клеточной гибели
Н. В. Иванисенко a, И. Н. Лаврик a, *
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: ilav3103@gmail.com
Поступила в редакцию 02.04.2019
После доработки 02.05.2019
Принята к публикации 04.05.2019
Аннотация
Каспаза-8 выполняет инициаторные функции при индукции апоптоза посредством внешнего пути. Апоптоз – один из типов программируемой клеточной гибели, играет важную роль в регуляции эмбриогенеза, поддержании гомеостаза тканей взрослого организма, дифференцировке и удалении поврежденных клеток. Нарушение регуляции механизмов апоптоза связано с патогенезом и прогрессией ряда онкологических и нейродегенеративных заболеваний. Каспаза-8 (называемая также СAP4, FLICE, MACH, MCH5) ‒ один из двух представителей DED(death effector domain)-содержащих каспаз. Несмотря на то, что роль каспазы-8 в апоптозе известна с середины 90-х годов, лишь недавно получены данные, позволяющие понять тонкие механизмы ее активации и регуляции в ответ на активацию рецепторов гибели. В частности показано, что для активации каспазы-8 необходимо образование специфических олигомерных структур, так называемых DED-филаментов. В представленном обзоре рассмотрены последние данные о механизмах активации инициаторной каспазы-8 в DED-филаментах, которые позволяют глубже понять тонкие механизмы инициации программируемой клеточной гибели.
ВВЕДЕНИЕ
Апоптоз – это высококонсервативная программа клеточной гибели, присущая всем многоклеточным организмам. Апоптоз играет центральную роль в регуляции эмбриогенеза, поддержании гомеостаза тканей взрослого организма, дифференцировке и удалении поврежденных клеток [1]. Нарушение регуляции механизмов апоптоза ассоциировано с рядом онкологических и нейродегенеративных заболеваний, в том числе с болезнями Альцгеймера и Паркинсона, а также c большинством аутоиммунных заболеваний [1, 2].
К настоящему моменту выделяют два основных сигнальных пути, по которым происходит инициация апоптоза: внутренний, или митохондриальный, индуцируемый при дефиците факторов роста, окислительном стрессе или повреждениях ДНК; и внешний, передаваемый через активацию так называемых рецепторов смерти ((DR), от англ. Death Receptor) [3]. В обоих случаях основными ферментами, которые участвуют в инициации апоптоза, а также отвечают за большинство морфологических признаков погибающих клеток, являются белки семейства цистеиновых аспартат-специфичных протеаз – каспазы (caspases, от англ. cysteinyl aspartate specific proteases) [4]. Каспазы активируются при поступлении сигналов инициации апоптоза, передаваемых как через внешний, так и через внутренний путь [4]. В свою очередь, поступление сигналов апоптоза ведет к образованию макромолекулярных комплексов, в которых происходит активация каспаз, что и служит сигналом к инициации программы клеточной гибели [2, 5]. Каспазы экспрессируются в клетке в виде неактивных предшественников, или прокаспаз, состоящих из трех основных участков: N-концевого (называемого продоменом) варьирующей длины, большого (р20) и малого (р10) каталитических доменов. Каталитические домены являются предшественниками субъединиц, образующих активную каспазу. Каспазы активируются в результате протеолитического расщепления пептидной связи после остатков аспартата (D), локализованных между продоменом, малым и большим каталитическими доменами [4]. Образовавшаяся таким образом активная каспаза представляет собой гетеротетрамер р102–р202, состоящий из двух больших (~20 кДa) и двух малых субъединиц (~10 кДa). Субстратами каспаз служат многие белки, вовлеченные в апоптоз и воспалительные процессы.
Прокаспазы, как упомянуто выше, обычно находятся в клетке в виде неактивных предшественников, однако при запуске апоптоза они подвергаются протеолизу, за которым следует их активация [6]. В частности, при поступлении сигнала запуска апоптоза образуется ряд макромолекулярных белковых комплексов, в которых происходит активация инициаторных, или апикальных прокаспаз (каспазы-2, -8, -9, -10). Инициаторные каспазы, в свою очередь, расщепляют и активируют эффекторные цистеиновые протеазы (каспазы-3, -6, -7), что и приводит к реализации программы гибели клетки.
Важное структурное отличие инициаторных каспаз от эффекторных состоит в наличии протяженного продомена, который, в свою очередь, включает такие белковые модули, как “эффекторный домен смерти” (DED, от англ. death effector domain) или “домен активации и рекрутирования каспазы” (CARD, от англ. caspase activation recruitment domain). Эти два структурных модуля вместе с “доменом смерти” (DD, от англ. death domain) по структурным характеристикам относятся к суперсемейству DD-доменов [3, 7]. Каждый из этих мотивов содержит шесть антипараллельных α-спиральных участков, которые образуют структуру так называемого греческого ключа. При этом α-спирали способны участвовать в гомотипических, или однотипных белок-белковых взаимодействиях [2]. При гомотипическом связывании DD взаимодействует с другим DD (соответственно, CARD c CARD; DЕD c DЕD) за счет α-спиральных участков, которые входят в состав этих структурных мотивов. Именно за счет гомотипических взаимодействий происходит образование апоптотических макромолекулярных комплексов, инициирующих апоптоз [2]. Кроме того, именно CARD- или DЕD-мотивы обеспечивают связывание инициаторных прокаспаз -2, -8, -9 и -10 в эти комплексы, их последующую активацию и автопротеолиз.
Следует отметить, что для каждой инициаторной каспазы существует свой специфический макромолекулярный комплекс, или макромолекулярная платформа, где происходит ее активация [4]. При этом внешний и внутренний пути индукции апоптоза контролируются образованием фундаментально отличающихся друг от друга инициаторных белковых комплексов, активирующих различные каспазы. Так, при индукции внешнего пути апоптоза наблюдается активация каспазы-8, при инициации внутреннего пути активируется каспаза-9, а в некоторых случаях каспаза-2 [8]. В представленном обзоре рассмотрена тонкая регуляция активации каспазы-8 в макромолекулярных комплексах, образующихся на рецепторах смерти (DR), как ключевое событие, определяющее судьбу клетки при индукции внешнего пути апоптоза.
ИНДУКЦИЯ ВНЕШНЕГО ПУТИ АПОПТОЗА ЧЕРЕЗ РЕЦЕПТОРЫ СМЕРТИ
Инициация внешнего пути апоптоза происходит через активацию семейства DR-рецепторов [1]. Семейство DR-рецепторов входит в состав суперсемейства рецепторов фактора некроза опухоли (TNF, от англ. tumor necrosis factor) [9]. Всего к настоящему моменту охарактеризовано восемь DR-рецепторов: TNF-R1/р55, CD95 (Fas/APO-1), TRAIL-R1, TRAIL-R2, DR3 и DR6, EDAR и NGFR/p75 [3]. Считается, что для передачи сигнала DR-рецепторы должны образовывать олигомерные структуры, предположительно тримеры. Каждый DR-рецептор (TNF-R1/p55, CD95 (Fas/APO-1), TRAIL-R1/DR4, и TRAIL-R2/DR5) связывает свой специфический лиганд смерти ‒ TNFα, CD95L (FasL/APO-1L) и TRAIL, которые, за исключением лигандов рецепторов DR6 и NGFR/p75, входят в семейство TNF.
Цитоплазматическая часть DR-рецепторов содержит такую характерную для всех членов семейства DR структурную особенность, как DD-домены. Как упомянуто выше, DD-домен – это структурный мотив (или модуль), длиной около 80‒100 аминокислотных остатков, включающий шесть антипараллельных α-спиральных участков [3]. DD-домен играет ключевую роль в передаче сигнала апоптоза, поскольку именно за счет гомотипических взаимодействий между DD-доменами рецепторов и соответствующими доменами так называемых белков-адаптеров происходит образование макромолекулярных комплексов, инициирующих апоптоз. Белки-адаптеры, такие как FADD, содержат, как правило не только DD-домен, но также DED-домен, который, в свою очередь, позволяет связать в инициаторный комплекс прокаспазу-8. Последующая активация прокаспазы-8 в комплексе, образованным соответствующим DR-рецептором, приводит к апоптотической гибели клетки.
Лиганды смерти могут специфически узнавать и связывать помимо DR-рецепторов так называемые псевдорецепторы (DcR, от англ. decoy receptor). У псевдорецепторов отсутствует DD-домен, поэтому они не могут образовывать апоптотические комплексы и, соответственно, участвовать в передаче сигнала гибели. Уровень экспрессии псевдорецепторов часто повышен в раковых клетках, что позволяет им защищать себя от индукции внешнего пути апоптоза.
CD95 (называемый также APO-1, Fas, Fas antigen, TNFRSF6 и APT1) ‒ один из наиболее изученных представителей семейства DR-рецепторов [7]. Первый этап инициации апоптоза через рецептор CD95 заключается в образовании комплекса DISC (от англ. Death-Inducing Signaling Complex, сигнальный комплекс, индуцирующий гибель) [7]. Cвязывание CD95L с внеклеточным доменом рецептора CD95 инициирует конформационный переход во внутриклеточном домене, что, в свою очередь, делает DD-домен доступным для связывания белков рецепторного комплекса DISC. CD95 DISC ‒ это сложный макромолекулярный комплекс, инициирующий апоптоз, который состоит из олигомеризованного рецептора CD95, белка-адаптера FADD (от англ. Fas-Associated Death Domain, Fas-ассоциированный домен смерти), прокаспазы-8/10 и белка c-FLIP (от англ. cellular FLICE inhibitory protein, клеточный белок, ингибирующий FLICE) [7]. Гомотипические взаимодействия играют центральную роль в формировании комплекса CD95 DISС. DD-домен рецептора CD95 взаимодействует с DD-доменами белка-адаптера FADD, а за счет взаимодействий с доменами DED происходит связывание в комплекс DISC прокаспазы-8, прокаспазы-10 и белка с-FLIP [10], что приводит к активации каспазы-8 и служит основным сигналом запуска внешнего пути апоптоза.
Следует отметить, что комплекс DISC также образуется при активации рецепторов TRAIL-R1/2 [11, 12]. При этом состав рецепторного комплекса TRAIL-R1/2 очень близок к составу комплекса DISC, образованному на рецепторе CD95, и включает олигомеризованный рецептор, белки FADD, прокаспазы-8/10 и c-FLIP [13]. Таким образом, комплекс DISC представляет собой сложнейшую молекулярную машину, или макромолекулярный комплекс, в состав которого входит целый ряд DD- и DED-содержащих белков, поэтому тонкая регуляция эффективности сборки данного комплекса играет важнейшую роль при запуске внешнего пути апоптоза.
МЕХАНИЗМЫ АКТИВАЦИИ ПРОКАСПАЗЫ-8 ВО ВНЕШНЕМ ПУТИ АПОПТОЗА
Структура и изоформы каспазы-8
Прокаспаза-8 (называемая также СAP4, FLICE, MACH, MCH5) ‒ один из двух представителей DED-содержащих каспаз [14]. Прокаспаза-8 состоит из следующих структурных элементов: N-концевого продомена, который включает DED1 (аминокислотные остатки 2‒80) и DED2 (аминокислотные остатки 100‒177), за которыми следуют большой и малый каталитические домены (рис. 1). Именно за счет гомотипических взаимодействий между DED прокаспаза-8 связывается с комплексом DISC [7].
Рис. 1.
Схема автокаталитического расщепления прокаспазы-8a/b. Показаны две изоформы прокаспазы-8: 8а (р55) и 8b (р53). Обозначены эффекторные домены смерти DЕD1 и DЕD2, большая и малая каталитические субъединицы р18 и р10, а также сайты автокаталитического расщепления ‒ D210, D216, D374, D384, и два основных остатка активного центра фермента ‒ гистидин 237 (Н237) и цистеин 287 (С287). Коричневым показан участок, который отличает прокаспазу-8а от прокаспазы-8b. Представлены два этапа расщепления и образование каталитического гетеротетрамера р102-р182, а также продукты автокаталитического расщепления прокаспазы-8a/b (p55/p53): p43/p41, p26/p24, р18 и p10.
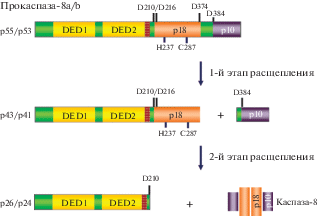
Прокаспаза-10 ‒ очень близкий структурный аналог прокаспазы-8, также связывается в комплекс DISC за счет взаимодействий между DED [11, 15]. Прокаспаза-10, как и прокаспаза-8, содержит два DED-мотива в N-концевом продомене, за которыми следуют большой и малый каталитические домены. Несмотря на такое структурное сходство, необходимо отметить, что согласно ряду исследований прокаспаза-10 не может инициировать апоптоз в отсутствие прокаспазы-8, по-видимому, из-за более низкого уровня ее экспрессии в большинстве тканей [11, 15]. Поэтому инициация внешнего пути апоптоза в существенной степени определяется активацией прокаспазы-8 в комплексе DISC, но не активацией прокаспазы-10. Всего описано девять изоформ прокаспазы-8, которые образуются в результате альтернативного сплайсинга [14]. Считается, что в состав комплекса DISC входят только две изоформы прокаспазы 8 ‒ 8а и 8b, имеющие молекулярную массу 55 кДа (р55) и 53 кДа (р53) соответственно [14, 16] (рис. 1). Прокаспаза-8а считается основной изоформой, ее аминокислотная последовательность положена в основу нумерации первичной структуры всех изоформ прокаспазы-8. Структурные различия между изоформами 8а и 8b очень незначительны ‒ прокаспаза-8а содержит небольшой участок (аминокислотные остатки 184‒198), следующий за DED2, которого нет у прокаспазы-8b (рис. 1). Поэтому прокаспаза-8b, состоящая из 464 аминокислотных остатков, короче прокаспазы-8а (479 остатков) [14, 16]. Участок 184‒198 находится перед сайтом расщепления между продоменом и большим каталитическим доменом, поэтому большая (р18) и малая (р10) каталитические субъединицы, образующиеся в результате расщепления прокаспаз-8а и 8b, имеют идентичную структуру. Интересно, что выявить функциональные различия в индукции апоптоза этими двумя белками к настоящему моменту не удалось, что можно объяснить их очень близкими структурными характеристиками.
Автокаталитическое расщепление прокаспазы-8
Изучение автокаталитической активации и протеолитического расщепления прокаспазы-8a/b показало, что этот процесс протекает в два этапа [17]. На первом этапе происходит расщепление между большим и малым каталитическим доменами по остаткам аспартата 374 и 384 (D374 и D384) с образованием фрагментов р43/р41 и р10, за которым следует расщепление по остаткам аспартата между продоменом р26/р24 и большим каталитическим доменом с образованием активного гетеротетрамера р102-р182 (рис. 1) [16, 17]. Как отмечено выше, структуры большой (р18) и малой (р10) каталитических субъединиц, образующихся в результате расщепления прокаспаз-8а и -8b, идентичны. Единственное различие между ними состоит в том, что молекулярная масса продомена р26 прокаспазы-8а, как и р43, продукта первого шага расщепления, на 2 кДа больше, чем у соответствующих фрагментов прокаспазы-8b ‒ р24 и р41 соответственно [17].
Важно отметить, что два ключевых остатка активного центра фермента, а именно C287 и H237, необходимые для катализа, располагаются на большой каталитической субъединице р18 (рис. 1). При этом димер, образованный двумя молекулами прокаспазы-8, уже обладает ферментативной активностью, а последующее расщепление прокаспазы-8 с образованием гетеротетрамера р102-р182 необходимо только для стабилизации фермента [18]. По-видимому, это происходит за счет пространственной сближенности субъединиц р18 и р10 в составе гомодимера из двух молекул прокаспазы-8 (р55/p55) и возможности образования активного центра еще до расщепления каспазы-8. Другая интересная особенность гомодимера, образованного двумя молекулами прокаспазы-8 (р55/p55), состоит в том, что субстратная специфичность такого гомодимера отличается от субстратной специфичности гетеротетрамера р102-р182 каспазы-8. Эти важные наблюдения сделаны в лаборатории профессора M. MacFarlane, известной циклом работ, посвященных сборке комплекса DISC in vitro из его компонентов, что позволило сделать важные выводы о механизмах активации каспазы-8 [18, 19]. В частности о том, что субстратами прокаспазы-8 (гомодимера р55/р55) являются белки с-FLIP и RIP1, в то время как у активной каспазы-8 (гетеротетрамера р102-р182) это прокаспаза-3 и Bid [20]. Также в лаборатории M. MacFarlane показано, что субстратная специфичность прокаспазы-8 изменяется уже при расщеплении до фрагмента р43/р41. Таким образом, установлено, что оба гетеротетрамера ‒ р102-р182 и р102-432 ‒ обладают такой же субстратной специфичностью, как и активная каспаза-8 [20]. Каким образом один и тот же белок может иметь разную субстратную специфичность остается вопросом будущих исследований.
К настоящему моменту времени известен целый ряд посттрансляционных модификаций прокаспазы-8, включая фосфорилирование и убиквитинирование, которые могут как ингибировать, так и усиливать активацию каспазы-8 [5, 19]. Важнейшим примером ингибирования активации прокаспазы-8 за счет посттрансляционной модификации и последующего изменения конформации участка ее расщепления может быть фосфорилирование прокаспазы-8 по остатку Y380 [19]. Остаток Y380 располагается в непосредственной близости от D384, расщепление по которому приводит к образованию малой каталитической субъединицы р10 [14, 16]. Оказалось, что фосфорилирование Y380 блокирует расщепление по D384, что приводит к ингибированию апоптоза.
Структурная организация DED-филаментов
Как показано недавно, взаимодействие между DED-доменами прокаспазы-8 в комплексе DISC приводит к сборке так называемых DED-филаментов. Подобные олигомерные структуры служат платформой для димеризации и последующей активации прокаспазы-8. Эти открытия, сделанные с использованием методов количественной масс-спектрометрии в 2012 году, позволили предположить, что прокаспаза-8 образует так называемые “DED-цепи” в комплексе DISC [21‒23]. После введения концепции DED-цепей последовала расшифровка их структуры методом криоэлектронной микроскопии [24]. При этом выяснилось, что линейные DED-цепи представляют собой только часть структур, образуемых прокаспазой-8 в комплексе DISC, а общая структура, которую можно охарактеризовать как олигомеры прокаспазы-8, получила название DED-филаменты.
Оказалось, что организацию DED-доменов каспазы-8 в составе филамента можно описать тремя типами взаимодействий, которые приводят к образованию структуры со спиральной симметрией. Такой тип сборки является общим для других членов суперсемейства DD-доменов [25]. В структуре DED-филамента каждый DED-домен может быть окружен шестью соседними доменами за счет несимметричных взаимодействий интерфейсов типов I, II и III. В результате DED-домены, образующие три спиральные цепи за счет взаимодействий интерфейсов типа I, связаны друг с другом в структуру единого филамента посредством взаимодействий интерфейсов типа II и III (рис. 2).
Рис. 2.
Структура DED-филамента каспазы-8. a ‒ Структура DED-доменов каспазы в ленточном представлении, DED1-домен выделен оранжевым цветом, DED2 – синим. б ‒ Интерфейсы взаимодействия DED-доменов каспазы-8 в составе филамента. Указаны типы интерфейсов и аминокислотные остатки, образующие их. в ‒ Структура DED-филамента каспазы-8 в ленточном представлении. г ‒ Трехмерная диаграмма DED-филамента. Сферами показаны N‑концевые участки DED1 (оранжевый) и DED2 (синий) доменов каспазы-8. Черной пунктирной линией показаны направления взаимодействий типа I, II и III в одной из субъединиц филамента. Три цепи, a, b и c, образованные взаимодействием типа I, показаны пунктирной линией красного, зеленого и синего цвета соответственно. д ‒ Двухмерная диаграмма структуры DED-филамента. Сверху показана схема DED1- и DED2-доменов каспазы-8, указаны интерфейсы взаимодействия. Снизу приведена схема взаимодействия DED-доменов каспазы-8. Цветные пунктирные линии показывают DED-цепи, образованные взаимодействием типа I. Черными пунктирными линиями указаны направления взаимодействия типа II и III.
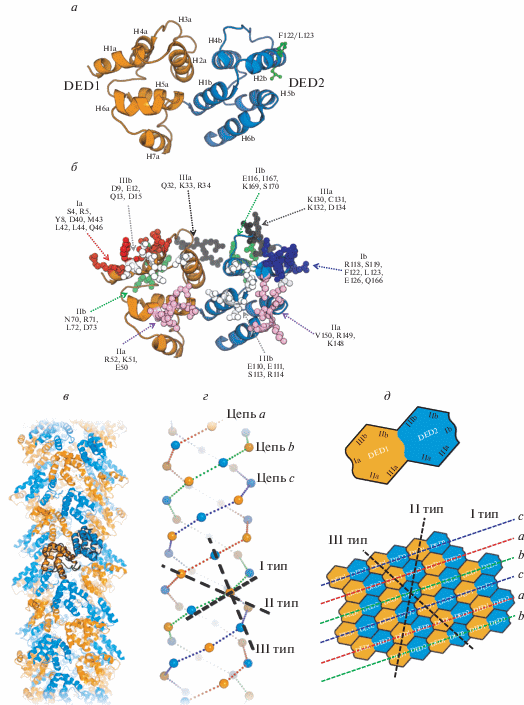
Взаимодействие типа I происходит за счет связывания DED2-домена одной из молекул каспазы-8 (интерфейс Ib, рис. 2) с DED1-доменом соседней молекулы каспазы-8 (интерфейс Ia, рис. 2). Это взаимодействие осуществляется преимущественно путем связывания α-спиральных участков DED2- и DED1-доменов, а именно, Helix 2b (H2b) и H5b (DED2) взаимодействуют с H1a и H4a (DED1). В частности, во взаимодействия интерфейсов типа I вовлечены высококонсервативные остатки FL-мотива (F122, L123), принадлежащие участку H2b DED2-домена каспазы-8 и вступающие в гидрофобные взаимодействия с Y8, L42 и L44 DED1-домена каспазы-8 (рис. 2). Во взаимодействие типа I также вовлечены полярные остатки, такие как S4, R5, D40, Q46, в составе интерфейса Ia и R118, S119, E126 и Q166 в составе интерфейса Ib. Однако cогласно данным сайт-специфического мутагенеза, двойные замены гидрофобных остатков, включая F122A/L123A, приводят к наибольшим эффектам подавления сборки DED-филаментов, в то время как замены полярных остатков вызывают значительно меньший эффект [22, 26].
В образовании взаимодействий типа II принимает участие интерфейс IIa, образуемый α-спиральными участками H4a и H4b DED1- и DED2-доменов каспазы-8, соответственно, и интерфейс IIb, который формируется H5a, H6a и петлей между H5a и H6a в составе DED1-домена каспазы-8, а также H5b, H6b и петлей между H5b и H6b в составе DED2-домена. Во взаимодействия этого типа вовлечены остатки, образующие консервативный элемент в семействе DED-доменов, так называемую заряженную триаду (“charge triad”) [15, 27]. Заряженная триада, известная также, как RxDL-мотив, включает в остатки R71, D73 и L74 DED1-домена каспазы-8. В случае взаимодействий типа III поверхность IIIa образуется за счет остатков H3a DED1-домена и петли между H2b и H4b DED2-домена, в то время как поверхность IIIb образуется остатками H1a и петлей между H1a и H2a в составе DED1-домена, а также участком H1b и петлей между H1b и H2b в составе DED2-домена. Большое число полярных остатков на интерфейсах взаимодействий типа II и III позволяет предположить, что комплементарность электростатических взаимодействий может определять селективность связывания с различными DED-доменами и служит важным фактором регуляции сборки DED-филаментов и комплекса DISC.
Интересно, что в образовании структуры DED-филамента каспазы-8 участвуют все комбинации взаимодействий типа II и III, включая как гомотипичные (DED1:DED1, DED2:DED2), так и гетеротипичные (DED1:DED2, DED2:DED1). Так, в трех DED-цепях (a, b и с), образующих структуру филамента (рис. 2), цепи a и b, а также b и c связаны между собой гомотипичными взаимодействиями интерфейсов типа II и гетеротипичными взаимодействиями типа III (рис. 2). При этом между соседними цепями a и c (рис. 2) образуются гетеротипичные взаимодействия типа II и гомотипичные взаимодействия типа III. Можно ожидать, что наличие всех комбинаций интерфейсов взаимодействий между DED-доменами критически важно для корректной сборки комплекса DISC.
Структура комплекса DISC, включающая взаимодействия DED-доменов, остается на сегодняшний день нерасшифрованной. Однако комплекс, образованный CD95/FADD, вызывает увеличение эффективности роста DED-филаментов каспазы-8 in vitro. При этом рост DED-филамента каспазы-8 возможен только в одном направлении относительно положения CD95/FADD.
Согласно данным количественной масс-спектрометрии, соотношение между прокаспазой-8 и белком FADD в составе DED-филамента равно 10 : 1 [21–23]. Важно отметить, что размер филамента, по-видимому, определяется целым рядом факторов. В частности, высказано предположение, что длинные филаменты не обладают высокой стабильностью по аналогии с актиновыми филаментами, и, по всей видимости, длинные филаменты каспазы-8 в клетке не образуются [15]. Подобный механизм должен позволить предотвратить инициацию спонтанного апоптоза в клетке. Действительно, если предположить возможность образования длинных филаментов, то спонтанная активация даже одного DR-рецептора может привести к активации большого количества каспазы-8 в клетке и к превышению пороговой концентрации каспазной активности, необходимой для индукции и запуска апоптоза [28]. Безусловно, расшифровка структуры комплекса DISC позволит решить данную задачу и понять механизмы ограничения длины филамента. При этом структура комплекса DISC, включая взаимодействия DED-доменов, остается нерасшифрованной. Однако комплекс, образованный CD95/FADD, приводит к увеличению эффективности роста DED-филаментов каспазы-8 in vitro. При этом рост DED-филамента каспазы-8 возможен только в одном направлении относительно положения CD95/FADD [24].
В последнее время появился целый ряд работ о том, что каспаза-8 способна активироваться не только в комплексе DISC, образованном на DR-рецепторе, но и в других комплексах, которые образуются при участии белков RIPK1, RIPK3 и FADD. Интересно, что эти комплексы в зависимости от их стехиометрии и посттрансляционных модификаций способны индуцировать различные сигналы. В частности, каспаза-8 в составе данных комплексов может индуцировать апоптоз, репарацию ДНК, а также пироптоз [29‒31]. В дальнейшем будет установлено, является ли образование DED-филаментов в макромолекулярных комплексах ключевым этапом активации каспазы-8 и каким образом происходит сборка комплексов в отсутствие DR-рецепторов.
Таким образом, прокаспаза-8 ‒ это ключевое звено индукции внешнего пути апоптоза. В то же время, необычайно сложный процесс активации прокаспазы-8 включает связывание в комплекс DISC, димеризацию и олигомеризацию в этом комплексе, активацию и дальнейшее протеолитическое расщепление с образованием активного гетеротетрамера р102-р182. Все это указывает на необходимость и важность тонкой регуляции активации данного белка. Не случайно, что мутации и полиморфизмы в гене каспазы-8 находят при онкологических и аутоиммунных заболеваниях, в частности при раке прямой кишки, печени, молочной железы, аденокарциноме легкого и поджелудочной железы, что еще раз показывает важнейшую роль точного контроля активации прокаспазы-8 при индукции апоптоза [7].
Список литературы
Krammer P.H., Arnold R., Lavrik I.N. (2007) Life and death in peripheral T cells. Nat. Rev. Immunol. 7, 532‒542.
Zamaraev A.V., Kopeina G.S., Zhivotovsky B., Lav-rik I.N. (2015) Cell death controlling complexes and their potential therapeutic role. Cell Mol. Life Sci. 72, 505‒517.
Lavrik I., Golks A., Krammer P.H. (2005) Death receptor signaling. J. Cell Sci. 118, 265‒267.
Lavrik I.N., Golks A., Krammer P.H. (2005) Caspases: pharmacological manipulation of cell death. J. Clin. Invest. 115, 2665‒2672.
Zamaraev A.V., Kopeina G.S., Prokhorova E.A., Zhivotovsky B., Lavrik I.N. (2017) Post-translational modification of caspases: the other side of apoptosis regulation. Trends Cell Biol. 27, 322‒339.
Golks A., Brenner D., Fritsch C., Krammer P.H., Lavrik I.N. (2005) c-FLIPR, a new regulator of death receptor-induced apoptosis. J. Biol. Chem. 280, 14507‒14513.
Lavrik I.N., Krammer P.H. (2012) Regulation of CD95/Fas signaling at the DISC. Cell Death Differ. 19, 36‒41.
Аксенова В.И., Былино О.В., Животовский Б.Д., Лаврик И.Н. (2013) Каспаза-2: что мы о ней знаем сегодня? Молекуляр. биология. 47, 187–204.
Lavrik I.N. (2014) Systems biology of death receptor networks: live and let die. Cell Death Dis. 5, e1259.
Риесс Д., Лаврик И.Н. (2010 Применение метода двумерного электрофореза для изучения состава рецепторного комплекса, образуемого на рецепторе CD45/Fas. Acta Naturae. 2(5), 102‒107.
Horn S., Hughes M.A., Schilling R., Sticht C., Tenev T., Ploesser M., Meier P., Sprick M.R., MacFarlane M., Leverkus M. (2017) Caspase-10 negatively regulates caspase-8-mediated cell death, switching the response to CD95L in favor of NF-kappaB activation and cell survival. Cell Rep. 19, 785‒797.
Lafont E., Kantari-Mimoun C., Draber P., De Miguel D., Hartwig T., Reichert M., Kupka S., Shimizu Y., Taraborrelli L., Spit M., Sprick M.R., Walczak H. (2017) The linear ubiquitin chain assembly complex regulates TRAIL-induced gene activation and cell death. EMBO J. 36, 1147‒1166.
Cullen S.P., Martin S.J. (2015) Fas and TRAIL 'death receptors’ as initiators of inflammation: Implications for cancer. Semin. Cell. Dev. Biol. 39, 26‒34.
Hoffmann J.C., Pappa A., Krammer P.H., Lavrik I.N. (2009) A new C-terminal cleavage product of procaspase-8, p30, defines an alternative pathway of procaspase-8 activation. Mol. Cell. Biol. 29, 4431‒4440.
Schleich K., Buchbinder J.H., Pietkiewicz S., Kahne T., Warnken U., Ozturk S., Schnolzer M., Naumann M., Krammer P.H., Lavrik I.N. (2016) Molecular architecture of the DED chains at the DISC: regulation of procaspase-8 activation by short DED proteins c-FLIP and procaspase-8 prodomain. Cell Death Differ. 23, 681‒694.
Golks A., Brenner D., Schmitz I., Watzl C., Krueger A., Krammer P.H., Lavrik I.N. (2006) The role of CAP3 in CD95 signaling: new insights into the mechanism of procaspase-8 activation. Cell Death Differ. 13, 489‒498.
Lavrik I., Krueger A., Schmitz I., Baumann S., Weyd H., Krammer P.H., Kirchhoff S. (2003) The active caspase-8 heterotetramer is formed at the CD95 DISC. Cell Death Differ. 10, 144‒145.
Hughes M.A., Powley I.R., Jukes-Jones R., Horn S., Feoktistova M., Fairall L., Schwabe J.W., Leverkus M., Cain K., MacFarlane M. (2016) Co-operative and hierarchical binding of c-FLIP and caspase-8: a unified model defines how c-FLIP isoforms differentially control cell fate. Mol. Cell. 61, 834‒849.
Powley I.R., Hughes M.A., Cain K., MacFarlane M. (2016) Caspase-8 tyrosine-380 phosphorylation inhibits CD95 DISC function by preventing procaspase-8 maturation and cycling within the complex. Oncogene. 35, 5629‒5640.
Hughes M.A., Harper N., Butterworth M., Cain K., Cohen G.M., MacFarlane M. (2009) Reconstitution of the death-inducing signaling complex reveals a substrate switch that determines CD95-mediated death or survival. Mol. Cell. 35, 265‒279.
Schleich K., Warnken U., Fricker N., Ozturk S., Richter P., Kammerer K., Schnolzer M., Krammer P.H., Lavrik I.N. (2012) Stoichiometry of the CD95 death-inducing signaling complex: experimental and modeling evidence for a death effector domain chain model. Mol. Cell. 47, 306‒319.
Dickens L.S., Boyd R.S., Jukes-Jones R., Hughes M.A., Robinson G.L., Fairall L., Schwabe J.W., Cain K., Macfarlane M. (2012) A death effector domain chain DISC model reveals a crucial role for caspase-8 chain assembly in mediating apoptotic cell death. Mol. Cell. 47, 291‒305.
Schleich K., Krammer P.H., Lavrik I.N. (2013) The chains of death: a new view on caspase-8 activation at the DISC. Cell Cycle. 12, 193‒194.
Fu T.M., Li Y., Lu A., Li Z., Vajjhala P.R., Cruz A.C., Srivastava D.B., DiMaio F., Penczek P.A., Siegel R.M., Stacey K.J., Egelman E.H., Wu H. (2016) Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Mol. Cell. 64, 236‒250.
Ferrao R., Li J., Bergamin E., Wu H. (2012) Structural insights into the assembly of large oligomeric signalosomes in the Toll-like receptor-interleukin-1 receptor superfamily. Sci. Signal. 5, re3.
Singh N., Hassan A., Bose K. (2016). Molecular basis of death effector domain chain assembly and its role in caspase-8 activation. FASEB J.: official publ. Fed. Am. Soc. Exp. Biol. 30, 186‒200.
Wang L., Yang J.K., Kabaleeswaran V., Rice A.J., Cruz A.C., Park A.Y., Yin Q., Damko E., Jang S.B., Raunser S., Robinson C.V., Siegel R.M., Walz T., Wu H. (2010) The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations. Nat. Struct. Mol. Biol. 17, 1324‒1329.
Bentele M., Lavrik I., Ulrich M., Stosser S., Heermann D.W., Kalthoff H., Krammer P.H., Eils R. (2004). Mathematical modeling reveals threshold mechanism in CD95-induced apoptosis. J. Cell. Biol. 166, 839‒851.
Boege Y., Malehmir M., Healy M.E., Bettermann K., Lorentzen A., Vucur M., Ahuja A.K., Bohm F., Mertens J.C., Shimizu Y., Frick L., Remouchamps C., Mutreja K., Kähne T., Sundaravinayagam D., Wolf M.J., Rehrauer H., Koppe C., Speicher T., Padrissa-Altés S., Maire R., Schattenberg J.M., Jeong J.S., Liu L., Zwirner S., Boger R., Hüser N., Davis R.J., Müllhaupt B., Moch H., Schulze-Bergkamen H., Cla-vien P.A., Werner S., Borsig L., Luther S.A., Jost P.J., Weinlich R,. Unger K., Behrens A., Hillert L., Dillon C., Di Virgilio M., Wallach D., Dejardin E., Zender L., Naumann M., Walczak H., Green D.R., Lopes M., Lavrik I., Luedde T., Heikenwalder M., Weber A. (2017). A dual role of caspase-8 in triggering and sensing proliferation-associated DNA damage, a key determinant of liver cancer development. Cancer Cell. 32, 342‒359 e310.
Sarhan J., Liu B.C., Muendlein H.I., Li P., Nilson R., Tang A.Y., Rongvaux A., Bunnell S.C., Shao F., Green D.R., Poltorak A. (2018). Caspase-8 induces cleavage of gasdermin D to elicit pyroptosis during Yersinia infection. Proc. Natl. Acad. Sci. USA. 115, E10888‒E10897.
Tenev T., Bianchi K., Darding M., Broemer M., Langlais C., Wallberg F., Zachariou A., Lopez J., MacFarlane M., Cain K., Meier P. (2011). The ripoptosome, a signaling platform that assembles in response to genotoxic stress and loss of IAPs. Mol. Cell. 43, 432‒448.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


