Молекулярная биология, 2019, T. 53, № 5, стр. 838-848
Поиск молекулярных партнеров ассоциированного с фосфатазой фосфопротеина (LPAP), участвующих в активации лимфоцитов человека
Н. А. Круглова a, b, *, А. Т. Копылов c, А. В. Филатов a, b
a Государственный научный центр Институт иммунологии Федерального медико-биологического агентства
115522 Москва, Россия
b Кафедра иммунологии биологического факультета Московского государственного университета
им. М.В. Ломоносова
119234 Москва, Россия
c Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Россия
* E-mail: natalya.a.kruglova@yandex.ru
Поступила в редакцию 26.03.2019
После доработки 04.04.2019
Принята к публикации 12.04.2019
Аннотация
LPAP ‒ небольшой связанный с фосфатазой CD45 трансмембранный белок лимфоцитов, функция которого неизвестна. Изучение интерактома LPAP позволит выявить новые детали регуляции CD45 и активации лимфоцитов в целом. С помощью коиммунопреципитации с последующим масс-спектрометрическим анализом, стабилизации комплексов с помощью поперечных сшивок, а также голубого нативного электрофореза нами проведен поиск белков-партнеров LPAP. В дополнение к фосфатазе CD45, среди партнеров LPAP идентифицированы CD71, CD98, некоторые компоненты цитоскелета, мембранный транспортер аминокислот SLC1A4 и белок HS1, участвующий в передаче внутриклеточного сигнала. Подтверждено, что более 70% молекул LPAP ассоциированы с фосфатазой CD45, с которой LPAP образует комплекс в соотношении 1 : 1. Влияние фосфатазы CD45 на белок LPAP изучено на клетках CEM и Jurkat с нокаутом CD45. Уровень LPAP в этих клетках составлял 10% от уровня в клетках дикого типа. Обнаружено, что фосфорилирование белка LPAP по Ser153 и Ser163 не зависит от наличия CD45, тогда как фосфорилирование Ser99 и Ser172 значительно снижается в отсутствие CD45. Таким образом, белок CD45 способен регулировать экспрессию и статус фосфорилирования LPAP.
ВВЕДЕНИЕ
LPAP (Lymphocyte Phosphatase-Associated Phosphoprotein) ‒ небольшой трансмембранный белок лимфоцитов, впервые описанный как партнер фосфатазы CD45 [1]. Гомологи LPAP в протеоме человека не найдены, а его функции неизвестны. Опубликованы лишь косвенные данные о роли LPAP в активации Т-клеток [2] и развитии В-клеток [3]. Однако ряд наблюдений свидетельствует в пользу того, что LPAP может участвовать в процессе антигенспецифичной активации лимфоцитов. Во-первых, LPAP образует прочный комплекс с фосфатазой CD45, необходимой для Т-клеточной сигнализации. Каким образом происходит регуляция самой CD45, не установлено [4], и LPAP рассматривается в качестве возможного регулятора. Во-вторых, экспрессия LPAP и CD45 взаимосвязана [5]. Наконец, LPAP имеет несколько сайтов фосфорилирования, один из которых фосфорилируется только при активации клеток [6]. Модификация белков с помощью фосфорилирования ‒ распространенный способ регуляции клеточных процессов, включая антигенспецифичную активацию лимфоцитов
Участие белка в том или ином процессе можно предсказать, зная молекулярные партнеры, с которыми он взаимодействует. В основе большинства внутриклеточных процессов лежат межмолекулярные взаимодействия, которые могут быть как прочными, так и слабыми, достаточно длительными или кратковременными. В большинстве случаев белки связываются друг с другом в области доменов или мотивов, представленных определенным образом структурированными аминокислотными последовательностями. В белке LPAP отсутствуют выраженные домены и мотивы, поэтому анализ аминокислотной последовательности не дает информации о том, с какими белками LPAP способен взаимодействовать.
Надежно подтвержденным партнером LPAP является фосфатаза CD45. Имеются также единичные сообщения о взаимодействии LPAP с киназами Lck и Zap70 [7, 8], однако функциональная роль этих взаимодействий не выяснена. Ранее мы обнаружили, что протеинкиназа CK2 фосфорилирует LPAP [9], т.е. CK2 можно рассматривать как возможный партнер LPAP. Другие данные о белковых взаимодействиях LPAP отсутствуют, а они могли бы оказаться очень полезными для понимания функции этого белка. Кроме того, LPAP может связывать CD45 с еще не описанными партнерами, изучение которых откроет новые детали регуляции CD45. Наиболее информативными методами определения молекулярных партнеров считаются аффинное выделение с пептидной меткой, двугибридная система, а также коиммунопреципитация [10].
В представленной работе с помощью различных протеомных методов проведен поиск и идентификация белков, взаимодействующих с LPAP, а также изучена функциональная значимость обнаруженных взаимодействий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клетки и антитела. Клетки линий CEM, Jurkat и Raji культивировали в среде DMEM/F12 с добавлением 10% фетальной сыворотки крупного рогатого скота, L-глутамина (4 мМ) и гентамицина (80 мг/л) (все реагенты “ПанЭко”, Россия) в увлажненной атмосфере с 5%-ным СО2 при 37°С. Клетки Jurkat LPAP-FLAG получали с помощью лентивирусной трансдукции линии Jurkat с дефицитом LPAP.
Антитела CL3, CL7 и LT45 против белков LPAP и CD45, а также фосфоспецифические антитела против LPAP получены нами ранее [6].
Создание клеточных линий CEM и Jurkat с нокаутом CD45. Нокаут проводили по технологии двойного одноцепочечного разрыва (double nicking) [11]. Две таргетные последовательности для гена PTPRC выбирали с помощью онлайн ресурса www.genome-engineering.org [12].
Последовательности гидовых РНК (gRNA), синтезированных в компании “Евроген”:
5'-gRNA-CD45-1: CACCGAAATGACAGCGCTTCCAGAA,
3'-gRNA-CD45-1: AAACTTCTGGAAGCGCTGTCATTTC,
5'-gRNA-CD45-2: CACCGAGGTGATATTACCCTCAGTC,
3'-gRNA-CD45-2: AAACGACTGAGGGTAATATCACCTC.
Олигонуклеотиды отжигали и клонировали в вектор pKS-gRNA-BB по рестрикционному сайту BbsI [11, 13]. Клетки CEM и Jurkat (106) трансфицировали с помощью системы для электропорации Neon (“Invitrogen”, США). Для этого клетки 1 раз отмывали в фосфатно-солевом буфере (PBS) и ресуспендировали в 115 мкл буфера R, содержащего 3 мкг плазмиды pcDNA3.3-Cas9 D10A (“Addgene” [13]) и по 3 мкг плазмид pKS-gRNA-BB с gRNA для гена LPAP. Режим электропорации клеток CEM включал один импульс 1230 В длительностью 40 мс; клеток Jurkat ‒ три импульса 1350 В длительностью 10 мс. Через 5 сут после трансфекции оценивали экспрессию CD45 в клетках, наращивали и сортировали популяцию, негативную по CD45.
Активация клеток. Клетки CEM или Jurakat (10 млн) суспендировали в свежей среде, добавляли форбол-12-миристат-13-ацетат (PMA) до конечной концентрации 10 нг/мл или антитела OKT3 (1 мкг/мл). Активацию проводили в течение 30 мин в CO2-инкубаторе.
Иммунопреципитационный анализ с флуоресцентной меткой (FIPA). Белки метили с использованием активированных красителей – родамина 6G (“Синтол”, Россия), реагирующего с NH2-группой лизина, и Dy547 (“Dyomics”, ФРГ), реагирующего с SH-группой цистеина. При поверхностном мечении к 20 млн клеток в 1 мл PBS добавляли краситель до конечной концентрации 0.3 мг/мл. Клетки инкубировали в течение 20 мин, отмывали 2 раза в PBS и лизировали на холоду в 500 мкл 1%-ного Тритона Х-100, содержавшего 20 мM Трис-HCl (pH 8.0), 150 мM NaCl, 5 мМ EDТА, 1 мМ фенилметилсульфонилфторида, 10 мМ NaF и 1 мМ ортованадата натрия (все реагенты “Merck”, США). При проведении коиммунопреципитации вместо Тритона X-100 использовали детергент Brij58. При внутриклеточном мечении к лизату клеток добавляли краситель в конечной концентрации 0.3 мг/мл и инкубировали в течение 30 мин в темноте при 4°С. Непрореагировавший краситель гасили с помощью 0.3 мМ L-лизина (в случае R6G) или 0.3 мМ L-цистеина (в случае Dy547).
Иммунопреципитацию проводили с помощью антител CL7, CL3 или LT45, ковалентно иммобилизованных на носителе AffiGel-Hz (“Bio-Rad”, США). Иммунопреципитаты трижды отмывали в лизирующем буфере, белок элюировали в буфере образца для SDS-PAGE (62.5 мМ Трис-HCl, pH 6.8, 10% глицерина, 2% SDS, 0.05% бромфенолового синего) прогреванием в течение 5 мин при 80°С. В некоторых случаях буфер содержал 1%-ный 2-меркаптоэтанол (восстанавливающие условия).
Сшивка белков in situ. К 20 млн клеток в 1 мл PBS добавляли 40 мкл дитиобис(сукцинимидпропионата) (DSP) до конечной концентрации 1.0 мМ. В контрольный образец добавляли 40 мкл DMSO. Клетки инкубировали при комнатной температуре в течение 30 мин, периодически перемешивая суспензию на вортексе. Затем к клеткам добавляли 50-кратный стоп-раствор, содержавший 1 M Трис-HCl (pH 7.5), инкубировали в течение 10 мин и отмывали в PBS. Клетки лизировали в буфере RIPA, который помимо 1% ТХ-100 содержал также 0.5% дезоксихолата и 0.1% SDS, в течение 30 мин. Лизаты пропускали через иглу 23-го калибра и центрифугировали в течение 25 мин при 4°С (20 000 g). Белки в лизате метили красителем Dy547, как описано выше, и проводили иммунопреципитацию.
Дефосфорилирование белков in vitro. Сорбент с иммунопреципитированным белком LPAP переводили в 50 мкл буфера для фосфатазы (50 мМ Tрис-HCl (pH 7.6), 10 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT), добавляли 10 единиц фосфатазы CIP (“Сибэнзим”) и инкубировали при 37°C в течение 1 ч на шейкере. Контрольные образцы не содержали CIP.
Электрофорез. Белки разделяли с помощью SDS-PAGE в буферной системе Лэммли. В качестве маркеров молекулярной массы использовали предокрашенные белки (“Thermo Fisher Scientific”, США). При проведении FIPA для регистрации флуоресцентного сигнала гели сканировали на приборе Amersham Imager 600 (“GE HealthCare”, США).
Голубой нативный электрофорез (Blue-Native PAGE). Blue-Native PAGE проводили по методике Swamy и соавт. [14]. Клетки Jurkat (2 млн) отмывали 2 раза в холодном PBS, лизировали в 100 мкл буфера для Blue-Native PAGE (20 мМ бис-Трис, (pH 7.0), 500 мМ ε-аминокапроновая кислота, 20 мМ NaCl, 2 мМ EDТА, 10% глицерина). Перед лизисом в буфер добавляли детергент (0.1% Тритона X-100 или 0.1% Brij97) и ингибиторы (1 мМ фенилметилсульфонилфторид, 10 мМ NaF и 1 мМ ортованадат натрия). Клетки лизировали на льду в течение 15 мин, после чего центрифугировали при 13 000 g в течение 15 мин. Супернатант вносили в лунки 3.2%-ного (32 : 1) концентрирующего геля, содержавшего 50 мМ бис-Трис и 66.6 мМ ε‑аминокапроновой кислоты. Разделение проводили в градиентном разделяющем PAGE (4–15%), содержавшем 50 мМ бис-Трис и 66.6 мМ ε-аминокапроновой кислоты. После нанесения образцов верхнюю камеру заполняли катодным буфером (15 мМ бис-Трис (pH 7.0), 50 мМ трицин, 0.02% Coomassie blue G250). Нижнюю камеру заполняли анодным буфером (50 мМ бис-Трис pH 7.0). Электрофорез проводили при 75 В (15 мин) и 200 В (1 ч). Перед Вестерн-блотингом гели выдерживали в 10%-ном SDS в течение 5 мин.
Фосфо-аффинный электрофорез с реагентом Phos-tag. Phos-tag SDS-PAGE проводили согласно [15]. Белки концентрировали в 5%-ном PAGE (С=3.33), содержащем 0.35 мМ бис-Трис (pH 6.8), затем разделяли в 10%-ном PAGE (С=3.33), содержавшем 0.35 мМ бис-Трис (pH 6.8), 50 мкМ Phos-tag acrylamide (“Wako”, Япония) и 100 мкМ ZnCl2. Электродный буфер содержал 0.1 М Трис, 0.1 М MOPS, 0.1% SDS, 5 мМ NaHSO3. Перед Вестерн-блотингом гель выдерживали в буфере для переноса с 1 мМ EDТА (2 раза по 10 мин), а затем еще 20 мин в стандартном буфере для переноса.
Вестерн-блотинг. После SDS-PAGE гели выдерживали в течение 20 мин в буфере для переноса (0.025 М Трис, 0.192 М глицин, 20%-ный этанол). Белки переносили на PVDF-мембрану полусухим методом по протоколу Bio-Rad Catalog Number 170-3940. Мембрану блокировали 5%-ным сухим обезжиренным молоком в PBS с 0.1%-ным Tween 20. При непрямом проявлении (образцы лизатов) мембрану инкубировали с первичным антителом в течение 1 ч на качалке. Для выявления общего LPAP использовали антитело CL7. Фосфорилированный LPAP определяли с помощью поликлональных фосфоспецифических антител против LPAP pSer153. Мембраны отмывали PBS-Tween (3 раза по 10 мин) и инкубировали со вторичными антителами против иммуноглобулина мыши, конъюгированными с пероксидазой хрена (#NA931 “GE Healthcare”). При прямом проявлении (образцы после иммунопреципитации) мембрану окрашивали антителом CL7-HRP (1 : 1000) или CL3-HRP (1 : 2000) в течение 1 ч. Сигнал детектировали на приборе ChemiDoc XRS (“Bio-Rad”) с использованием реагентов для хемилюминесценции фирмы “Millipore” (США).
Масс-спектрометрический анализ. Для идентификации белковых полос, обнаруженных методом FIPA, полосы вырезали, фиксировали в 1%-ной уксусной кислоте и отмывали дважды в 40%-ном метаноле с 10% уксусной кислоты и трижды в деионизированной воде. Перед трипсинолизом кусочки геля уравновешивали в буфере с 50 мМ бикарбоната триэтиламмония (pH 8.0) с 5 мМ ТСЕР (“Pierce”, США). Модифицированный трипсин (“Promega”, США) добавляли из расчета 1/50 (w/w) и инкубировали при 42°C в течение 5 ч. Экстракцию проводили 3 раза 100 мкл раствора 1%-ной трифторуксусной кислоты. Объединенные пептидные экстракты высушивали под вакуумом и восстанавливали в объеме 15 мкл раствора 0.5%-ной муравьиной кислоты. Полученный раствор использовали в LC-MS-анализе.
Хроматографическое разделение проводили на системе Ultimate 3000 RSLC Nano (“Thermo Scientific”). Пептиды разделяли в градиенте подвижной фазы “А” (водный раствор 0.01% муравьиной кислоты, 0.03% уксусной кислоты, рН 2.63 при T = 21.4°C) и подвижной фазы “В” (90% ацетонитрила, 10% метанола, 0.01% муравьиной кислоты, 0.03% уксусной кислоты) на стационарной фазе Acclaim Pepmap® С18 (геометрия 75 мкм × 150 мм, 1.8 мкм, 60 Å). Начальные условия градиента элюции 98% “А”, 2% “В”.
Масс-спектрометрический анализ проводили на гибридном масс-спектрометре высокого разрешения Orbitrap Fusion (“Thermo Scientific”) с источником ионизации NSI в режиме положительной электростатической ионизации и динамическим потенциалом на входной S-линзе. Ионы-предшественники изолировали через квадруполь в диапазоне ±0.75 Th с асимметричным сдвигом +0.25 Th и номинальным разрешением R = 60 К в диапазоне m/z 425–1250 с максимальной скоростью накопления ионов 15 мс и минимальным числом интеграции 4е5 ионов. Селекцию по зарядному состоянию проводили для ионов с z = 2+…6+ с активным динамическим исключением после n = 6 рекуррентных сканирований с асимметричной изоляцией +10/–25 ppm. Тандемное сканирование проводили в режиме HCD-фрагментации с относительной энергией активации 27% с переменным смещением ±20%. Тип детектора фрагментных ионов – орбитальный, разрешение 15 К с максимальным временем накопления 47 мс и числом интеграции ионов – 5е4. Время одного полного цикла сканирования – 4 с.
Обработка данных. Исходные данные прибора конвертировали в формат mgf для дальнейшего поиска сигнала пептидов против таксон-специфичной базы данных аминокислотных последовательностей белков версии Uniprot 2018.03 с использованием поискового алгоритма X1Tandem. Ложные положительные совпадения исчисляли против обращенной базы аминокислотных последовательностей, равной по размеру канонической базе. Для проведения поиска устанавливали следующие параметры: протеаза – трипсин; число внутренних пропущенных участков – не более двух; заряд ионов – от 2+ до 6+; точность измерения прекурсорных ионов ±5 ppm; точность измерения фрагментных ионов ± 0.005 Да; вариабельные модификации – окислительное дезаминирование Q/E, окисление метионина; мономеры DSP по первичным аминам. Уровень ложного сигнала по PSM/пептидам/белкам – не более 1%; динамическая корреляция измеренных пептидов с теоретической суммой масс канонических пептидов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Поиск белков-партнеров LPAP с помощью метода FIPA
Для обнаружения белков, образующих прочные комплексы с LPAP, в первую очередь использовали метод FIPA [16]. Клеточные белки метили флуоресцентным красителем и иммунопреципитировали на сорбенте с антителами против LPAP, далее проводили электрофорез, регистрировали флуоресцентный сигнал и сравнивали полосы копреципитации в опытном и контрольном образцах. Опытный образец лизировали в мягком буфере, содержащем 1% Brij58, в котором сохраняются многие межбелковые взаимодействия. Контрольный образец готовили в более жестком буфере с 1% TX-100, в котором комплексы, как правило, разрушаются. Опытные образцы из Т-клеточной линии CEM в дополнение к полосе белка LPAP содержали полосы копреципитации, отсутствующие в контрольном образце (рис. 1а, 1 и 2). Наиболее выраженная полоса коиммунопреципитации, локализованная в районе молекул размером около 200 кДа, соответствовала белку CD45, что подтверждено Вестерн-блотингом и обратной иммунопреципитацией (рис. 1а, 3 и 4). Более слабые полосы вырезали и анализировали методом масс-спектрометрии (рис. 1б). Для сравнения использовали также образцы из В-клеточной линии Raji (рис. 1б). Среди идентифицированных белков большую часть составляли белки цитоскелета. В обоих случаях удалось идентифицировать белок CD71, а в случае клеток Raij ‒ молекулу HLA II (рис. 1б), представленную на клетках Raji, но не CEM.
Рис. 1.
Анализ белков, копреципитированных антителами против LPAP и CD45, с помощью флуоресцентной иммунопреципитации. а – Kлетки CEM метили родамином 6G, лизировали в 1%-ном ТХ-100 или Brij58. Иммунопреципитацию проводили на антителах против LPAP или CD45. Выделенные белки разделяли в 12%-ном SDS-PAGE в невосстанавливающих условиях. После регистрации флуоресценции (верхняя панель) белки переносили на PVDF-мембрану и проявляли c помощью Вестерн-блотинга с антителами против CD45 или LPAP (средняя и нижняя панели). б – Белки из клеток CEM и Raji копреципитировали на антителе против LPAP и разделяли в 10%-ном SDS-PAGE в восстанавливающих условиях. Полосы 1–5 вырезали для дальнейшего анализа, справа указаны белки, идентифицированные методом масс-спектрометрии в соответствующих полосах.
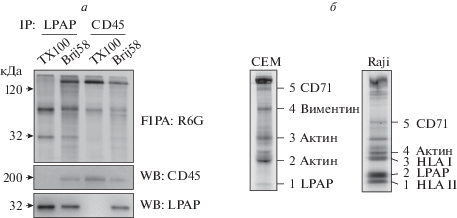
Коиммунопреципитация/масс-спектрометрия без поперечного сшивания
Метод FIPA позволяет определять белки, присутствующие в молекулярных комплексах в достаточно больших количествах. Белки, которые образуют комплекс лишь с небольшой долей молекул партнера, не будут давать явно выраженную полосу копреципитации. Кроме того, некоторые белки плохо взаимодействуют с красителем и также не дают сигнала в FIPA. Взаимодействия с такими белками можно выявлять с помощью другого подхода – коиммунопреципитации, совмещенной с последующим масс-спектрометрическим анализом (co-IP/MS). В этом случае проводят очень короткий электрофорез белков, полученных после иммунопреципитации комплексов, при котором белки входят в гель, но заметного их разделения еще не происходит. Затем участок геля, который содержит полный набор белков из элюата, обрабатывают трипсином, полученные пептиды анализируют с помощью масс-спектрометрии. Таким способом можно найти дополнительные белки, которые невозможно выявить методом FIPA.
Поиск белков-партнеров проводили в клеточной линии CEM, контрольный иммунопреципитат готовили из клеток CEM с нокаутом LPAP. Чтобы выявить специфически преципитированные белки, из списка молекул, идентифицированных в опытном образце, исключали белки, определенные в контрольном образце. Проведены три эксперимента, в трех повторностях, в каждой из которых кроме CD45 обнаружены еще три белка (табл. 1).
Таблица 1.
Белки, копреципитируемые с LPAP
| Белок | Ген | Номер в базе данных Swiss-Prot |
|---|---|---|
| Рецептор трансферрина CD71 | TFRC | P02786 |
| Тяжелая цепь поверхностного белка CD98 | SLC3A2 (MDU1) | P08195 |
| Моэзин | MSN | P26038 |
В двух повторностях детектированы 23 белка, в том числе белки клеточного метаболизма (транскетолаза, фосфоглицераткиназа, альдолаза), белки с ядерной локализацией (импортин, HNRNPA2B1, FLII, SIPA1), компоненты и регуляторы цитоскелета (тропомодулин, плектин, α-актинин), мембранный белок SLC1A4, который, как и CD98, участвует в транспорте аминокислот. Наконец, обнаружен белок HS1, участвующий в передаче внутриклеточного сигнала.
Коиммунопреципитация/масс-спектрометрия с предварительной поперечной сшивкой взаимодействующих белков
Многие белковые взаимодействия носят временный характер или являются очень слабыми, поэтому традиционные методы копреципитации не подходят для их обнаружения. Фиксировать такие взаимодействия можно с использованием сшивающих реагентов, способных стабилизировать комплексы.
Для поперечного сшивания LPAP с потенциальными партнерами подходит сульфгидрильная группировка Cys134, расположенного в средней части молекулы LPAP. Однако обработка клеток гомобифункциональным агентом DTME не приводила к заметному сшиванию LPAP. Это может свидетельствовать об отсутствии пространственно сближенных с Cys134 (длина DTME составляет около 13 Å) белков со стерически доступными свободными сульфгидрильными группами.
Другой популярный агент – DSP, сшивает белки по аминогруппам лизина. LPAP не содержит остатков этой аминокислоты, поэтому DSP способен сшивать белок LPAP только через аминогруппу, расположенную на его свободном N-конце. Чтобы повысить эффективность сшивания с помощью DSP, мы использовали клеточную линию Jurkat LPAP-FLAG, в которой LPAP на С-конце дополнительно несет FLAG-последовательность (DYKDDDDK), включающую два остатка лизина.
Реагент DSP успешно сшивал LPAP с другими белками с образованием высокомолекулярных комплексов. Это проявлялось в том, что при электрофорезе в невосстанавливающих условиях снижалась интенсивность полосы LPAP, определенная как по флуоресценции, так и с помощью Вестерн-блот-анализа (рис. 2а, дорожки 2 и 4). Эффект сшивки белка CD45 был еще более выражен (рис. 2а, 6). Это легко объяснить большим количеством остатков лизина в молекуле CD45. Сшивки могут нарушать распознаваемый антителом эпитоп белка и препятствовать коиммунопреципитации. Мы сравнили эффективность выделения белка LPAP с использованием двух антител, CL7 и CL3, которые реагировали с разными эпитопами LPAP (рис. 2, 1–4). Картины, полученные с помощью обоих антител, были сходными, при этом антитело CL7 обеспечивало, как правило, более высокий уровень иммунопреципитации. DSP содержит S-S-связь, которая легко разрывается в восстанавливающих условиях при добавлении 2-меркаптоэтанола, и компоненты комплекса высвобождаются в виде отдельных молекул. В соответствии с этим при электрофорезе в восстанавливающих условиях наблюдали повышение интенсивности полосы LPAP после обработки DSP (рис. 2б, 2 и 4).
Рис. 2.
Влияние сшивания с помощью DSP на образование комплексов белков LPAP и CD45. Белки клеток Jurkat LPAP-FLAG сшивали с помощью 1 мМ DSP, клетки лизировали в буфере RIPA, белки метили по SH-группам с помощью красителя Dy547, иммунопреципитировали на антителах против LPAP (CL7 или CL3) или против CD45. Выделенные белки разделяли в 12%-ном SDS-PAGE в невосстанавливающих (а) или восстанавливающих (б) условиях. После регистрации флуоресценции (верхние панели) белки переносили на PVDF-мембрану и проявляли методом Вестерн-блотинга с антителом против LPAP (нижние панели).
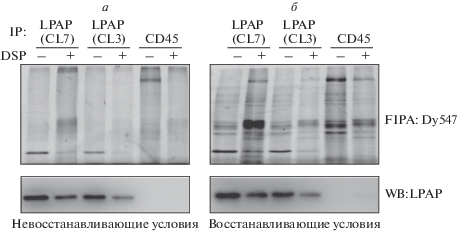
Дальнейшие эксперименты по co-IP/MS проведены с использованием DSP. Образцы для масс-спектрометрического анализа готовили следующим образом. Клетки Jurkat LPAP-FLAG инкубировали с 1 мM DSP, лизировали в жестком буфере RIPA и иммунопреципитировали комплексы на сорбенте с антителом CL7. В буфере RIPA белковые взаимодействия нарушаются, поэтому при лизисе клеток в таких условиях образец без поперечных сшивок мог служить отрицательным контролем для образца со сшивками. Элюаты после иммунопреципитации подвергали краткому электрофорезу, кусочек геля с полным элюатом трипсинизировали и проводили масс-спектрометрический анализ. По результатам трех экспериментов проводили поиск белков, идентифицированных в опытных образцах (со сшиванием), которые отсутствовали в контрольных образцах (без сшивок). Во всех трех экспериментах был идентифицирован лишь один такой белок ‒ CD45.
Комплексы LPAP, проявляемые с помощью голубого нативного электрофореза
Антитела против LPAP, использованные в экспериментах по иммунопреципитации, распознают внутриклеточные эпитопы, расположенные в центральной части белка. Взаимодействие антитела с белком может нарушать ассоциацию LPAP с белками-партнерами и преципитировать только свободный LPAP. Чтобы преодолеть это затруднение, мы использовали Blue-Native PAGE. В этом случае белковые комплексы выделяют в мягких условиях без стадии иммунопреципитации и разделяют с помощью нативного электрофореза. Этот метод позволяет не только определить белки-партнеры, но и сделать выводы о составе комплексов и стехиометрии входящих в них компонентов [14].
Клетки Jurkat лизировали в мягких условиях в присутствии 0.1% ТХ-100 или 0.1% Brij97. В низкомолекулярной части геля обнаруживалась полоса, которая окрашивалась антителом против LPAP, но не против CD45. Подвижность этой полосы была несколько выше в образцах, лизированных в детергенте TX-100, чем в Brij97. Очевидно, эта полоса связана с мономерным LPAP. В высокомолекулярной части геля находилась полоса, которая окрашивалась антителом против CD45, но не против LPAP. Эта полоса отнесена нами к мономерному CD45.
Наряду с полосами мономерного LPAP и CD45 на электрофореграммах обнаружена более высокомолекулярная полоса, которая при проведении Вестерн-блотинга окрашивалась антителами как против LPAP, так и против CD45 (рис. 3). Очевидно, эта полоса связана с комплексом LPAP-CD45. Соотношение [комплекс : свободные мономеры] определяли путем денситометрии соответствующих полос. Долю свободного LPAP можно оценить в пределах 1% в растворе 0.1%-ного ТХ-100 и около 23% в растворе 0.1%-ного Brij97. В случае мономерного CD45 соответствующие показатели составили 74 и 14%. При активации клеток с помощью антител против CD3 доли молекул LPAP и CD45, образовавших комплекс, увеличивались.
Рис. 3.
Определение комплексов белков LPAP и CD45 с помощью Blue-Native PAGE. Клетки Jurkat активировали в течение 15 мин с помощью 1 мкг/мл антитела против CD3 (OKT3), затем лизировали в 0.1%-ном ТХ-100 или 0.1%-ном Brij97. Белки разделяли с помощью Blue-Native PAGE и проявляли методом Вестерн-блотинга с антителами против LPAP (левая панель) или CD45 (правая панель). В контроле клетки не подвергали активации.

Фосфорилирование LPAP в клетках с нокаутом CD45
Ранее мы показали, что в нестимулированных клетках белок LPAP фосфорилирован по трем сайтам, Ser99, Ser153 и Ser172, а при активации клеток фосфорилированию подвергается дополнительный сайт – Ser163 [6]. Полосы, появляющиеся при проведении 18% SDS-PAGE и фосфо-аффинного электрофореза, соотнесли с конкретными фосфоформами LPAP. Эта интерпретация полос воспроизведена на рис. 4. Например, в 18% SDS-PAGE полоса с повышенной электрофоретической подвижностью соответствует фосфоформе LPAP pSer172 [6].
Рис. 4.
Фосфорилирование LPAP в клетках CEM и Jurkat с дефицитом CD45. а ‒ LPAP иммунопреципитировали из клеток CEM и Jurkat wt или их вариантов с нокаутом по CD45 (CD45 KO), проводили SDS-PAGE (18%-ный гель), проявляли методом Вестерн-блотинга с помощью антител против общего LPAP (верхняя панель), против фосфоформы pSer153 (средняя панель) или против тубулина (нижняя панель). б – LPAP получали из клеток CEM и Jurkat wt или CD45 KO, активированных с помощью PMA (дорожки PMA+), или неактивированных клеток (PMA-), дефосфорилировали с помощью фосфатазы CIP (дорожки CIP+). Фосфоформы разделяли методом фосфо-аффиннного электрофореза (PhosTag-PAGE) и проявляли методом Вестерн-блотинга с использованием антитела CL7 против общего LPAP. Отнесение полос к определенным фосфоформам LPAP сделано в соответствии с ранее опубликованными данными [6].
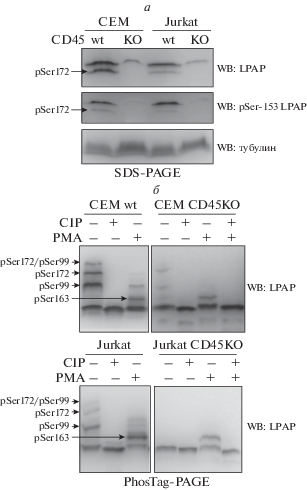
Учитывая прочную связь LPAP с молекулой CD45, мы оценили изменение статуса фосфорилирования LPAP в отсутствие CD45. С этой целью проведен нокаут гена PTPRC, кодирующего фосфатазу CD45 в двух клеточных линиях ‒ CEM и Jurkat. Это привело к падению уровня LPAP в обеих линиях до 10% от уровня в родительских клетках (рис. 4), что значительно затрудняло анализ фосфорилирования LPAP. Низкий уровень экспрессии LPAP в клетках с дефицитом CD45 не позволил сделать однозначный вывод о фосфорилировании Ser172 в отсутствие CD45 (рис. 4а, верхняя панель). Тем не менее, можно утверждать, что LPAP из клеток с дефицитом CD45 окрашивался фосфоспецифическим антителом pSer153 (рис. 4а, средняя панель). Для выявления фосфоформы pSer163 мы использовали фосфо-аффинный электрофорез, в котором эта фосфоформа представлена отдельной полосой (рис. 4б, дорожки 3 и 6). Хорошо видно, что эта полоса сохраняется в клетках CEM и Jurkat с нокаутом CD45. Наиболее выраженные изменения обнаружены при сравнении данных фосфо-аффинного электрофореза нестимулированных клеток дикого типа и CD45KO (рис. 4б, 1). Как показано нами ранее, фосфорилирование Ser99 и Ser172, а также их комбинация приводят к появлению трех полос со сниженной электрофоретической подвижностью [6]. При нокауте CD45 эти полосы или полностью исчезали (клетки Jurkat), или вместо них обнаруживались полосы низкой интенсивности с иным расположением (клетки CEM). Это можно рассматривать как свидетельство того, что белок LPAP не подвергается фосфорилированию по Ser99 и Ser172 в отсутствие CD45.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для идентификации белков-партнеров LPAP мы использовали ряд протеомных методов, позволяющих детектировать как прочные, так и слабые и/или временные взаимодействия. Группа методов включала стадию иммунопреципитации. Эффективность этих методов зависит от способности антител распознавать белок и при этом не нарушать его взаимодействие с белками-партнерами. Альтернативный подход с использованием Blue-Native PAGE позволяет наблюдать комплексы без их предварительного выделения. Совокупность полученных данных позволяет утверждать, что основным партнером LPAP является фосфатаза CD45. Это хорошо соответствует опубликованным данным. Новизна нашего исследования состоит в том, что мы смогли оценить соотношение свободных и ассоциированных молекул. Стехиометрическое соотношение молекул LPAP и CD45 в комплексе до сих пор не установлено. К сожалению, методом нативного электрофореза трудно точно определить молекулярные массы разделяемых белков, однако можно оценить, что разница в электрофоретической подвижности комплекса CD45-LPAP и мономерного CD45 соответствует массе одного мономерного LPAP. Это позволяет предположить, что в составе комплекса LPAP и CD45 существуют в стехиометрическом соотношении 1 : 1.
В качестве дополнительных партнеров нами обнаружены такие белки, как CD71, CD98, моэзин и некоторые другие компоненты цитоскелета. Эти белки частично соответствовали определенным ранее в комплексе, образованном молекулой CD4. В этом комплексе CD71 напрямую взаимодействует с CD45 [17], поэтому весьма вероятно, что этот белок образует комплекс с LPAP не напрямую, а через молекулу CD45. Наконец, среди белков-партнеров LPAP нами обнаружены переносчик аминокислот SLC1A4 и белок HS1 (Hematopoietic lineage cell-specific protein), который регулирует полимеризацию актина при активации лимфоцитов [18].
При сравнении результатов, полученных с помощью различных методов, стоит отметить, что во всех случаях обнаружено взаимодействие LPAP с фосфатазой CD45. Фосфатаза CD45 выявлена в качестве партнера LPAP с помощью методов с использованием коиммунопреципитации, а также независимого подхода – Blue-Native PAGE. Другой партнер, взаимодействие которого с белком LPAP подтверждено более чем одним методом, ‒ CD71. Этот белок обнаружен как методом FIPA, так и с помощью co-IP/MS. Остальные потенциальные партнеры удалось идентифицировать только при масс-спектрометрическом анализе преципитатов LPAP. Можно заключить, что лишь небольшая доля молекул LPAP вступает во взаимодействие c этими белками, в то время как с фосфатазой CD45 связано более половины мономеров LPAP.
Ранее с использованием двугибридной системы в качестве партнера LPAP был идентифицирован фактор транскрипции EEF1A1 [10], который регулирует продукцию цитокинов в клетках Th1 [19], а также белок DCDC2, вовлеченный в сигнальный путь Wnt [20]. Однако эти взаимодействия не подтверждены независимыми методами аффинного выделения с пептидной меткой или иммунопреципитации нативного белка. Описанное взаимодействие LPAP с киназами Lck и Zap-70 [8, 21] в наших экспериментах не зафиксировано.
Анализ аминокислотной последовательности LPAP показывает, что C-концевой домен этого белка (остатки 98‒173) является внутренне неупорядоченным (Intrinsically Disordered Region). Такие домены, как правило, позволяют реагировать с большим количеством белков [22]. Тем не менее, основным и, пожалуй, единственным партнером белка LPAP является фосфатаза CD45. Образование прочного комплекса между LPAP и CD45 позволяет предположить, что эти белки связаны функционально. В серии наблюдений показано, что молекула CD45 важна для поддержания стабильности LPAP и его мышиного гомолога CD45-AP. Во-первых, в лимфоцитарных клеточных линиях с нокдауном CD45 LPAP синтезируется, но быстро деградирует [5]. Во-вторых, в опытах на линии T-клеток с индуцируемой экспрессией CD45 установлено, что экспрессия LPAP начинается только после активации синтеза CD45 [1]. В-третьих, обнаружено, что стабильность мРНК и белка по-разному регулируются в CD45+/+ и CD45–/– линиях клеток и в разных популяциях лимфоцитов [23]. Кроме того, в лимфоцитах мышей с нокаутом LPAP снижен уровень CD45 [24, 25]. В наших экспериментах стабильность LPAP оказалась сниженной в клетках Jurkat CD45KO, что согласуется с опубликованными данными.
Необходимо отметить, что зависимость экспрессии LPAP от CD45 может быть верна только для лимфоидных клеток, в которых ген экспрессируется под контролем эндогенного промотора. Если же для экспрессии гена белка LPAP в клетках HeLa использовали Т7-промотор, то белок синтезировался и в отсутствие CD45 [21]. Ранее мы успешно экспрессировали LPAP в клетках НЕК293Т, которые не содержат CD45. Экспрессию наблюдали как при временной, так и при стабильной трансфекции с использованием цитомегаловирусного промотора. Предположительно, в таких искусственных условиях при использовании сильного промотора скорость синтеза белка значительно превышает время его деградации (полужизни). С другой стороны, в нелимфоидных клетках могут отсутствовать механизмы деградации LPAP.
Поскольку CD45 и LPAP являются основными партнерами, то интересно выяснить, каким образом каждый из них влияет на функционирование своего партнера. Фосфатазная активность CD45, как показано ранее, повышается в присутствии мышиного гомолога LPAP [26]. Функция LPAP до сих пор не определена, поэтому для выяснения того, как CD45 влияет на LPAP, нами выбран такой параметр, как фосфорилирование. Показано, что фосфорилирование по Ser153 и Ser163 не зависит от CD45. В то же время фосфорилирование по Ser99 и Ser172 значительно снижается в отсутствие CD45. Это хорошо согласуется с нашими более ранними данными о том, что в негемопоэтических клетках HEK293, которые не экспрессируют CD45, сохраняется фосфорилирование Ser153 и Ser163, но Ser99 и Ser172 не подвергаются фосфорилированию [9].
Таким образом, полученные нами данные свидетельствуют о том, что фосфатаза CD45 и молекула LPAP являются молекулярными партнерами, при этом белок CD45 способен регулировать экспрессию и статус фосфорилирования LPAP.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-34-00705 – протеомные эксперименты; грант № 17-04-00526 – эксперименты по получению клеток с нокаутом и стабильно трансфицированных клеток).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениями или сопоставимым нормам этики.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Schraven B., Kirchgessner H., Gaber B., Samstag Y., Meuer S. (1991) A functional complex is formed in human T lymphocytes between the protein tyrosine phosphatase CD45, the protein tyrosine kinase p56lck and pp32, a possible common substrate. Eur. J. Immunol. 21(10), 2469–2477.
Leitenberg D., Falahati R., Lu D.D., Takeda A. (2007) CD45-associated protein promotes the response of primary CD4 T cells to low-potency T-cell receptor (TCR) stimulation and facilitates CD45 association with CD3/TCR and lck. Immunology. 121(4), 545–554.
Kleiman E., Salyakina D., De Heusch M., Hoek K.L., Llanes J.M., Castro I., Wright J.A., Clark E.S., Dykxhoorn D.M., Capobianco E., Takeda A., Renauld J.C., Khan W.N. (2015) Distinct transcriptomic features are associated with transitional and mature B-cell populations in the mouse spleen. Front. Immunol. 6, 30.
Rheinländer A., Schraven B., Bommhardt U. (2018) CD45 in human physiology and clinical medicine. Immunol. Lett. 196, 22–32.
Schraven B., Schoenhaut D., Bruyns E., Koretzky G., Eckerskorn C., Wallich R., Kirchgessner H., Sakorafas P., Labkovsky B., Ratnofsky S. (1994) LPAP, a novel 32-kDa phosphoprotein that interacts with CD45 in human lymphocytes. J. Biol. Chem. 269(46), 29102–29111.
Kruglova N.A., Meshkova T.D., Kopylov A.T., Mazurov D.V., Filatov A.V. (2017) Constitutive and activation-dependent phosphorylation of lymphocyte phosphatase-associated phosphoprotein (LPAP). PLoS One. 12(8), e0182468.
Motoya S., Kitamura K., Matsuda A., Maizel A.L., Yamamoto H., Takeda A. (1999) Interaction between CD45-AP and protein-tyrosine kinases involved in T cell receptor signaling. J. Biol. Chem. 274(3), 1407–1414.
Veillette A., Soussou D., Latour S., Davidson D., Gervais F.G. (1999) Interactions of CD45-associated protein with the antigen receptor signaling machinery in T-lymphocytes. J. Biol. Chem. 274(20), 14392–14399.
Цой Т.В., Круглова Н.А., Филатов А.В. (2018) Фосфатазо-ассоциированный фосфопротеин является субстратом протеинкиназы CK2. Биохимия. 83(11), 1698–1707.
Stelzl U., Worm U., Lalowski M., Haenig C., Brembeck F.H., Goehler H., Stroedicke M., Zenkner M., Schoenherr A., Koeppen S., Timm J., Mintzlaff S., Abraham C., Bock N., Kietzmann S., Goedde A., Toksöz E., Droege A., Krobitsch S., Korn B., Birchmeier W., Lehrach H., Wanker E.E. (2005) A human protein-protein interaction network: A resource for annotating the proteome. Cell. 122(6), 957–968.
Ran F.A., Hsu P.D., Lin C.-Y., Gootenberg J.S., Konermann S., Trevino A.E., Scott D.A., Inoue A., Matoba S., Zhang Y., Zhang F. (2013) Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 154(6), 1380–1389.
Hsu P.D., Scott D.A., Weinstein J.A., Ran F.A., Konermann S., Agarwala V., Li Y., Fine E.J., Wu X., Shalem O., Cradick T.J., Marraffini L.A., Bao G., Zhang F. (2013) DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31(9), 827–832.
Mali P., Yang L., Esvelt K.M., Aach J., Guell M., DiCarlo J.E., Norville J.E., Church G.M. (2013) RNA-guided human genome engineering via Cas9. Science. 339(6121), 823–826.
Swamy M., Siegers G.M., Minguet S., Wollscheid B., Schamel W.W.A. (2006) Blue native polyacrylamide gel electrophoresis (BN-PAGE) for the identification and analysis of multiprotein complexes. Sci. Signal. 2006(345), pl4-pl4.
Kinoshita E., Kinoshita-Kikuta E. (2011) Improved Phos-tag SDS-PAGE under neutral pH conditions for advanced protein phosphorylation profiling. Proteomics. 11(2), 319–323.
Filatov A.V., Krotov G.I., Zgoda V.G., Volkov Y. (2007) Fluorescent immunoprecipitation analysis of cell surface proteins: A methodology compatible with mass-spectrometry. J. Immunol. Methods. 319(1–2), 21–33.
Кротов Г.И., Крутикова М.П., Згода В.Г. Филатов А.В. (2007) Профилирование белков рецепторного комплекса молекулы CD4. Биохимия. 72(11), 1495–1505
Hao J.-J., Zhu J., Zhou K., Smith N., Zhan X. (2005) The coiled-coil domain is required for HS1 to bind to F-actin and activate Arp2/3 complex. J. Biol. Chem. 280(45), 37988–37994.
Maruyama T., Nara K., Yoshikawa H., Suzuki N. (2006) Txk, a member of the non-receptor tyrosine kinase of the Tec family, forms a complex with poly(ADP-ribose) polymerase 1 and elongation factor 1α and regulates interferon-γ gene transcription in Th1 cells. Clin. Exp. Immunol. 147(1), 164–175.
Schueler M., Braun D.A., Chandrasekar G., Gee H.Y., Klasson T.D., Halbritter J., Bieder A., Porath J.D., Airik R., Zhou W., LoTurco J.J., Che A., Otto E.A., Böckenhauer D., Sebire N.J., Honzik T., Harris P.C., Koon S.J., Gunay-Aygun M., Saunier S., Zerres K., Bruechle N.O., Drenth J.P., Pelletier L., Tapia-Páez I., Lifton R.P., Giles R.H., Kere J., Hildebrandt F. (2015) DCDC2 mutations cause a renal-hepatic ciliopathy by disrupting Wnt signaling. Am. J. Hum. Genet. 96(1), 81–92.
Cahir McFarland E.D., Thomas M.L. (1995) CD45 protein-tyrosine phosphatase associates with the WW domain-containing protein, CD45AP, through the transmembrane region. J. Biol. Chem. 270(47), 28103–28107.
Snead D., Eliezer D. (2019) Intrinsically disordered proteins in synaptic vesicle trafficking and release. J. Biol. Chem. 294(10), 3325–3342.
Kitamura K., Matsuda A., Motoya S., Takeda A. (1997) CD45-associated protein is a lymphocyte-specific membrane protein expressed in two distinct forms. Eur. J. Immunol. 27(2), 383–388.
Ding I., Bruyns E., Li P., Magada D., Paskind M., Rodman L., Seshadri T., Alexander D., Giese T., Schraven B. (1999) Biochemical and functional analysis of mice deficient in expression of the CD45-associated phosphoprotein LPAP. Eur. J. Immunol. 29(12), 3956–3961.
Matsuda A., Motoya S., Kimura S., McInnis R., Maizel A.L., Takeda A. (1998) Disruption of lymphocyte function and signaling in CD45-associated protein-null mice. J. Exp. Med. 187(11), 1863–1870.
Takeda A., Matsuda A., Paul R.M.J., Yaseen N.R. (2004) CD45-associated protein inhibits CD45 dimerization and up-regulates its protein tyrosine phosphatase activity. Blood. 103(9), 3440–3447.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


