Молекулярная биология, 2019, T. 53, № 6, стр. 998-1011
Водорастворимые хлорофиллсвязывающие белки растений: структура, свойства и функции
Ю. В. Малеева a, *, К. В. Неверов a, b, Ю. Н. Обухов b, М. С. Крицкий b
a Биологический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
b Институт биохимии им. А.Н. Баха Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
117071 Москва, Россия
* E-mail: yulya_maleeva@mail.ru
Поступила в редакцию 14.06.2019
После доработки 09.07.2019
Принята к публикации 09.07.2019
Аннотация
Водорастворимые хлорофиллсвязывающие белки (WSCP) высших растений отличаются от большинства хлорофилл(бактериохлорофилл)содержащих белков тем, что они растворимы в воде, а не встроены в липидную мембрану и непосредственно не участвуют в процессе фотосинтеза. Молекулы хлорофилла в ансамблях WSCP организованы в виде димеров внутри гидрофобной зоны белкового матрикса, что сходно с упаковкой “специальной пары” пигмента в реакционных центрах фототрофов. Принимая во внимание этот факт в сочетании с обнаруженной фотосенсибилизирующей активностью белков WSCP, можно рассчитывать на их возможное использование для моделирования прототипов фотосинтетического аппарата и искусственных конверторов солнечной энергии. В семействе белков WSCP выделяют два класса, I и II, представители которых проявляют слабую степень гомологии первичной структуры, но высокое сходство третичной и четвертичной структуры. Одна из особенностей белков WSCP класса I состоит в их способности к фотоконверсии, то есть изменению структуры и спектральных свойств хромофора под действием света. Функции белков WSCP в растении, как предполагают, связаны с защитой от стресса.
ВВЕДЕНИЕ
Фотосинтезирующие организмы – уникальные формы жизни, способные использовать солнечную энергию для синтеза органических молекул, необходимых для жизни как самих фотоавтотрофов, так и гетеротрофов. Ключевым участником фотосинтеза служит хлорофилл – магнийсодержащее производное порфирина. Основу фотосинтетического процесса преобразования энергии составляет возбуждение молекулы хлорофилла “специальной пары” (т.е. димера молекул хлорофилла) в составе реакционного центра фотосистемы. Возбуждение молекул хлорофилла реакционного центра может быть следствием непосредственного поглощения фотонов светового потока, а также передачи энергии от пигмент-белковых комплексов светособирающей антенны, в состав которых также входит хлорофилл. Хлорофилл-белковые комплексы реакционных центров и светособирающих антенн фотосинтеза связаны с липидным бислоем мембран тилакоидов или мембранных структур аноксигенных фототрофных бактерий. Мембранная локализация не только определяет структурно-функциональную организацию фотосинтетического преобразователя энергии, но и принципиально важна для функционирования электронтранспортной цепи фотосинтеза и формирования трансмембранного электрохимического протонного градиента, обеспечивающего функционирование ATP-синтазы и образование ATP.
Из этого правила есть, однако, исключения. У некоторых фотосинтезирующих организмов обнаружены хлорофилл-белковые комплексы, локализованные не в липидном окружении, а в водной фазе. Известные к настоящему времени водорастворимые хлорофиллсвязывающие белки составляют небольшую и гетерогенную в филогенетическом и структурном плане группу. Начало исследованию положило открытие в 1962 году у фотосинтетических зеленых серных и ацидобактерий белка Fenna–Mathews–Olson (FMO) [1, 2]. В 1976 году в клетках динофлагеллят был открыт белок PCP (Peridinin-Chlorophyll Protein) [3, 4]. У FMO и PCP не обнаружено гомологии по первичной структуре и они далеки друг от друга в плане пространственной организации как пептидных мономеров, так и полноценного хлорофилл-белкового комплекса. Белки FMO (см. [5–8]) и PCP (см. [9–12]) активно используют в качестве модельных объектов для анализа пигмент‒пигментных и пигмент-белковых взаимодействий. Эти белки традиционно находятся в фокусе при изучении молекулярных механизмов поглощения света, трансформации и переноса энергии возбуждения при фотосинтезе. Молекулярная организация и свойства каждого из них уникальны. Считается, что эти водорастворимые белки играют роль мобильных промежуточных фотосинтетических антенн. Однако обсуждение этих белков не входит в нашу задачу.
В представленном обзоре рассмотрены свойства представителей другой группы ‒ семейства водорастворимых хлорофиллсвязывающих белков (Water-Soluble Chlorophyll Proteins; WSCP) высших растений. Белки этого семейства открыты в 1963 году [13], но в структурно-функциональном плане изучены хуже, чем белки FMO или PCP. WSCP тоже не относятся к мембрансвязанным и, кроме того, не имеют прямого отношения к функционированию фотосинтетического аппарата. Полагают, что WSCP связаны с формированием ответа растительного организма на действие стрессовых факторов.
Однако не только участие в антистрессовом ответе определяет интерес к исследованию белков семейства WSCP. Привлекает внимание, прежде всего, сам принцип их молекулярной организации. Относительно простая (по сравнению с белковыми ансамблями фотосистем) структура апобелкового матрикса сочетается с димерной организацией встроенных в него молекул хлорофилла, которая аналогична “специальной паре” хлорофилла в составе реакционных центров фотосинтеза. Благодаря этим особенностям, белки семейства WSCP представляют интерес для моделирования аналогов и эволюционных прототипов фотосинтетических структур, а также для конструирования искусственных преобразователей энергии и информации.
БЕЛКИ WSCP И ИХ КЛАССИФИКАЦИЯ
WSCP высших растений составляют уникальную по своим свойствам группу. Они не участвуют в фотосинтезе, их мономеры отличаются небольшой молекулярной массой и могут собираться in vitro в термостабильные гомотетрамерные комплексы, извлекая при этом хлорофилл как из раствора, так и из изолированных пигмент-белковых комплексов тилакоидов. При самосборке WSCP могут связывать до четырех молекул хлорофилла на тетрамер, но не способны связывать каротиноиды [14–18]. Экспрессия генов этих белков усиливается в условиях стресса [19, 20].
На основе способности к фотоконверсии белки WSCP разделили на два класса: белки класса I могут изменять спектр поглощения хромофоров под действием света, а белки класса II таким свойством не обладают [11]. Белки класса I встречаются в семействах Amaranthaceae, Chenopodiaceae и Polygonaceae, относящихся к порядку Caryophyllales (Гвоздичные). Белки класса II обнаружены только в семействе Brassicaceae, порядок Brassicales (Крестоцветные). При отсутствии работ по планомерному поиску и анализу встречаемости этих белков у цветковых растений нельзя исключать того, что список таксонов, у представителей которых присутствуют белки WSCP, будет расширяться.
Белки WSCP класса II включают в себя два подкласса. WSCP подкласса IIА связывают преимущественно хлорофилл a, а подкласса IIВ – хлорофиллы a и b с близкой эффективностью [11].
ОСОБЕННОСТИ СТРУКТУРЫ И СВОЙСТВА БЕЛКОВ WSCP
Белки WSCP классов I и II в структурном плане представляют собой разнородную группу. Между классами практически отсутствует гомология по аминокислотной последовательности [21]. Единственной общей особенностью вторичной структуры этих белков служит преобладание β-листов [20]. Учитывая встречаемость белков этих двух классов у Гвоздичных и Крестоцветных, можно сделать предположение о конвергентном характере появления этого признака в эволюционно неродственных таксонах цветковых растений. Что касается третичной структуры, то для белков WSCP класса II она была установлена методом рентгеноструктурного анализа [22], в то время как для белков WSCP класса I опубликованы лишь результаты ее молекулярного моделирования на основании данных о первичной структуре [19, 20, 23].
Белки WSCP класса I
Объектом практически всех экспериментальных работ по исследованию белков этого класса служил выделенный из мари белой (Chenopodium album) белок СaWSCP [13]. (В настоящее время белки семейства WSCP обозначают начальными буквами латинских названий растений, из которых они выделены.) Известно, что белок СaWSCP локализован в зеленых частях молодых растений.
Молекулярная масса тетрамера СaWSCP составляет 69‒78 кДа, а мономера – 16 кДа. Его апобелок имеет более высокое сродство к хлофиллу a [14, 16]. Предполагают, что мономер СaWSCP связывает не более одной молекулы хлофилла [15, 16].
Последовательность гена белка CaWSCP не содержит интронов и состоит из 585 п.н., кодирующих 195 аминокислотных остатков, что соответствует расчетной массе белка 18.39 кДа. Молекулярная масса зрелого белка, равная 15.86 кДа, соответствует созревшей молекуле, образующейся после удаления 23 аминокислотных остатков с С‑конца. На основании поиска гомологов по нуклеотидной последовательности CaWSCP отнесен к белкам семейства DUF538 (DUF – “domain with unknown function”), обнаруженным у 39 видов высших растений [17]. Среди белков этого семейства первичная структура CaWSCP имеет наибольше сходство с белком At5g01610, выделенным из резуховидки Таля (Arabidopsis thaliana). Следует заметить, что белок At5g01610 не связывает хлорофилл; причем в его последовательности отсутствуют важные для этой функции остатки Cys2 и Cys30 [15].
CaWSCP устойчив к 7 М мочевине, 5%-ному Triton-X100 и 10 мМ EDTA, а также к кислотности среды в широком диапазоне pH. Добавление β-меркаптоэтанола или дитиотреитола лишают белок возможности связывать хлорофилл, из чего сделан вывод о важности дисульфидных связей в формировании третичной структуры CaWSCP [15].
Белки WSCP класса II
Белки WSCP класса II сходны между собой по структуре и обладают мотивом, характерным для белков-ингибиторов протеаз типа Кунитца [21]. В полипептидных продуктах трансляции белков этого класса также присутствует удаляемая в ходе процессинга С-концевая последовательность, содержащая высоко консервативный участок из 7 аминокислотных остатков ‒ L[K/R]MFPFY [14]. Еще одной особенностью созревания белков WSCP класса II служит наличие удаляемой N-концевой сигнальной последовательности, необходимой для транспорта полипептида в эндоплазматический ретикулум [14, 17, 18, 24]. Кроме того, в белках этой группы присутствует консервативный участок (39-PFCPLGI-45), гомологичный мотиву [F/Y]DPLGL из фотосинтетического антенного комплекса (Light Harvesting Complex; LHC) [14].
Апобелки WSCP класса II имеют молекулярную массу около 20 кДа, образуют тетрамерные комплексы, связывающие хлорофилл и обладающие высокой фото- и термостабильностью [21]. Тетрамер может связывать до четырех молекул хлорофилла, причем сродство апобелка к хлорофиллу настолько сильное, что позволяет ему извлекать этот пигмент из пигмент‒белковых комплексов тилакоидов в экспериментах in vitro [14, 21].
Белки WSCP подкласса IIА. Белки WSCP подкласса IIA обнаружены у растений родов Brassica, Raphanus и Arabidopsis [25]. Впервые белок WSCP этого подкласса выделен из цветной капусты (Brassica oleracea var. botrys). Комплекс WSCP из B. oleracea (ВоWSCP) имеет молекулярную массу 78 кДа и изоэлектрическую точку (pI) в диапазоне 4.6–4.7 [14]. Участок ДНК, содержащий ген белка ВоWSCP, кодирует полипептид, состоящий из 218 аминокислотных остатков [26]. После процессинга с удалением консервативных C- и N-концов зрелый мономер BoWSCP имеет молекулярную массу 19.0 кДа и состоит из 178 аминокислотных остатков. Функция C-концевого фрагмента остается неизвестной, а N-концевой фрагмент играет роль сигнального пептида, выполняющего, как предполагают, транспортную функцию [25].
Белок BoWSCP оказался на 94% гомологичным белку BnD22 с молекулярной массой 22 кДа, выделенному из рапса (Brassica napus L.) и индуцируемому при недостатке влаги, и на 51% белку P22 из редиса (Raphanus sativas L.), индуцируемому при солевом стрессе [26].
Белки WSCP подкласса IIВ. Первый и пока единственный представитель WSCP белков подкласса IIB выделен из представителя семейства крестоцветных ‒ клоповника виргинского (Lepi-dium virginicum). Соотношение связываемых белком LvWSCP хлофилла a и хлофилла b ниже, чем для белков WSCP класса IIA, и зависит от места произрастания и части растения [14].
Молекулярная масса тетрамера LvWSCP составляет 78‒80 кДа, мономера ‒ 19.6 кДа, а pI находится в диапазоне 4.2–4.5 [14, 21, 27]. Как и белок подкласса IIA BoWSCP, тетрамер LvWSCP связывает четыре молекулы хлорофилла и самостоятельно собирается в пигмент-белковый комплекс [14].
Ген LvWSCP содержит безынтронную рамку считывания из 669 п.н. и кодирует 223 аминокислотных остатка. Зрелый белок содержит последовательность аминокислотных остатков 27‒206 транслируемого полипептида, то есть при процессинге утрачивается N-концевой 26-членный сигнальный пептид, а также C-концевой фрагмент из 17 аминокислотных остатков [27].
Пространственная структура хлорофилл-белковых комплексов WCSP класса II. Среди белков WSCP класса II третичная структура первоначально была расшифрована для белка из L. virginicum, относящегося к подклассу IIB. Строение мономеров LvWSCP очень похоже на укладку цепей в ингибиторах протеаз типа Кунитца: основу составляет β-трилистник из 12 β-цепей. В этой структуре цепи 1, 4, 5, 8, 9 и 12 формируют β-бочонок, а остальные 6 цепей ‒ три двухцепочечных антипараллельных β-листа, накрывающих бочонок сверху [21].
Тетрамер LvWSCP сложен из двух гомодимерных субъединиц, повернутых относительно друг друга на определенный угол. В центре тетрамера локализованы молекулы хлорофилла, плотно заключенные в гидрофобную полость, сформированную аминокислотными остатками 31‒61, 86‒96 и 152‒156 каждой из субъединиц. Связывание хлорофилла с белком происходит через находящийся в порфириновом кольце хлорофилла ион Mg2+ и кислород пептидной связи между Pro36 и Ala37 молекулы белка [21]. Доступ молекул воды к молекулам хлорофилла в гидрофобном кластере возможен лишь через 4 поры в гидрофобной полости тетрамера, которые блокированы плотно упакованными молекулами хлорофилла [21]. Подобная упаковка предотвращает также контакт хлорофилла с O2, что может объяснить его устойчивость к окислению активными формами кислорода (АФК) [28].
В гидрофобной полости комплекса пигменты упакованы в виде димеров по типу “открытого сэндвича”, в котором молекулы расположены под углом около 27° относительно друг друга (см. рис. 1а). Расстояние между участками молекул варьирует от 10.7 Å до 3.6 Å, что допускает делокализацию энергии возбуждения. Это свойство структуры LvWSCP позволяет рассматривать димеры хлорофилла как единые ансамбли [21]; при этом расстояние между двумя димерами составляет 20 Å, то есть связь между димерами слабая [28].
Рис. 1.
Димерная организация хлорофилла в составе белков семейства WSCP и реакционных центров фотоснтеза. а ‒ Четвертичная структура пигмент-белковых комплексов семейства WSCP класса II на примере WSCP из Lepidium virginicum (ID 2DRE по PDB). б ‒ Димерная структура ансамблей хлорофилла, входящих в состав тетрамера WSCP из L. virginicum (ID 2DRE по PDB). Фрагменты структуры пигмент-белковых комплексов реакционных центров с димерами хлорофилла Р700 в фотосистеме 1 (ID 4Y28 по PDB) (в) и хлорофилла Р680 в фотосистеме 2 (ID 5XNL по PDB) (г). RCSB PDB database website. [Electronic resource]/URL: http://www.rcsb.org/(дата обращения 17.05.2019).
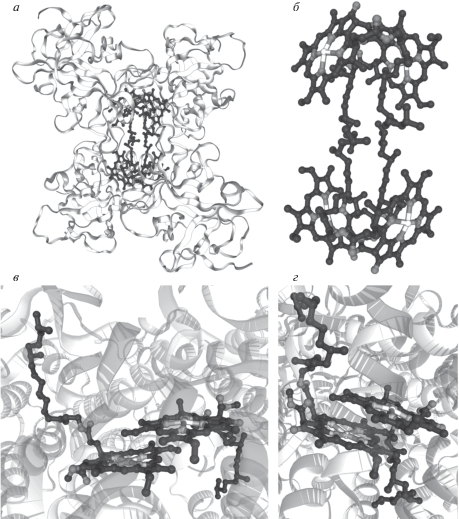
Фитольные хвосты молекул хлорофилла в составе двух димеров направлены друг к другу и создают в центре кластера тесные гидрофобные контакты, важные для тетрамеризации комплекса (рис. 1б) [21]. Для полной стабилизации комплекса из четырех субъединиц достаточно фитольных хвостов одного димера молекул хлорофилла. Экспериментально это показано на белке ВоWSCP, который при низких концентрациях хлорофилла может включать в себя только один его димер вместо двух, сохраняя устойчивость к термическому воздействию, денатурации, экстремальным значениям pH и интенсивному видимому свету. Механизм, по которому комплекс WSCP с одним димером хлорофилла может связывать еще две молекулы пигмента, остается неизвестным [29].
Трехмерная структура белка WSCP подкласса IIA из B. oleracea, рассчитанная на основании рентгеноструктурного анализа, сходна со структурой WSCP подкласса IIB из L. virginicum. Отличие состоит в измененном на 60° угле поворота димеров относительно друг друга. Еще одно отличие ‒ наличие специфических аминокислотных остатков в гидрофобной полости, вызывающих деформацию плоскости кольца макроцикла хлорофилла, что приводит к батохромному сдвигу на 10 нм длинноволнового пика поглощения хлорофилла у белков подкласса IIA по сравнению с подклассом IIВ [30].
СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ БЕЛКОВ WSCP
Спектры поглощения нативных тетрамерных комплексов WSCP всех классов складываются из полос поглощения аминокислотных остатков белков в УФ-области (280 нм и более короткий диапазон) и пиков локализованных в белковом матриксе молекул хлорофилла a и b в ближней УФ-области (350‒400 нм) и в видимой части спектра: наиболее интенсивная полоса Соре (430‒470 нм) и полоса (660‒680 нм), соответствующая самому длинноволновому So‒S1-переходу молекулы, или Qy-переходу.
Спектральные свойства белков WSCP класса I
Белки WSCP класса I из C. album (CaWSCP) в природных условиях связывают только хлорофилл a. Спектр поглощения CaWSCP, кроме полос в УФ-спектре, содержит характерные для хлорофилла a максимумы при 429 нм (полоса Соре) и 668 нм (полоса, соответствующая Qy-переходу). Полоса Qy-перехода для хлорофилла в CaWSCP сдвинута в длинноволновую область по сравнению с органическими растворителями (например, для хлорофилла a в ацетоне это 663 нм). Такой батохромный сдвиг характерен для всех хлорофиллсодержащих белков [31].
Спектральные свойства белков WSCP класса II
Абсорбционная спектроскопия. В спектре поглощения тетрамера BoWSCP (рис. 2а) в красной области присутствует основной пик при 673‒674 нм (соответствующий Qy-переходу в молекуле хлорофилла) вместе с минорным пиком при 628 нм, пики полосы Соре при 421 и 436 нм, а также дополнительные максимумы при 341 и 383 нм. Аналогично в спектре поглощения тетрамера LvWSCP (рис. 2б) присутствуют пики поглощения при 661‒663 и 619 нм (Qy-переход), пики полосы Соре при 421, 436 и 468 нм и дополнительные пики при 335 и 381 нм. Эти спектры поглощения для BoWSCP и LvWSCP получены нами на препаратах белков после самосборки in vitro. Белки собирались из мономеров и хлорофилла из пигмент-белковых комплексов тилакоидных мембран шпината, и их спектры поглощения полностью совпадали с таковыми для нативных BoWSCP и LvWSCP [25, 27].
Рис. 2.
Спектры поглощения тетрамерных комплексов BoWSCP (а) и LvWSCP (б). Здесь и на других рисунках комплексы WSCP с хлорофиллом получены путем самосборки in vitro с использованием пигмент-белковых комплексов тилакоидных мембран шпината. Прибор ‒ спектрофотометр Varian Cary® 50 UV-Vis (“Agilent Technologies”, США). (Рис. 2–5 взяты из Выпускной квалификационной работы магистра Обухова Ю.Н.)
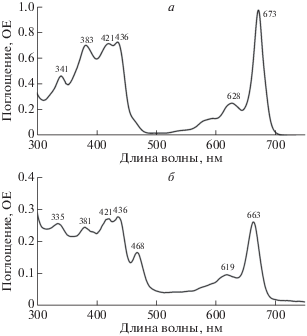
В представленных спектрах поглощения в длинноволновой области у обоих белков положения максимумов различаются примерно на 10 нм (628 и 673 нм для BoWSCP, 619 и 663 нм для LvWSCP). Данный факт объясняется, очевидно, вкладом поглощения хлорофилла b, который находится в составе LvWSCP: максимум поглощения хлорофилла b смещен в короткую область спектра по сравнению с хлорофиллом a [31]. Кроме того, различия в положении максимума в красной области спектра могут быть связаны с различиями аминокислотного окружения в сайте связывания пигмента [30]. Также в спектре поглощения LvWSCP есть дополнительный пик при 468 нм ‒ его нет у BoWSCP. Максимум при 468 нм принадлежит полосе Соре хлорофилла b в составе LvWSCP; известно, что пик поглощения хлорофилла b в свободном состоянии находится около 455 нм [31]. Связывание хлорофилла b вместе с хлорофиллом a при взаимодействии мономера с пигмент-белковыми комплексами тилакоидов ‒ характерная особенность белков WSCP класса IIВ (хлорофилл a/b = 1.5‒3.5) [27]. Известно, что в этих условиях мономер BoWSCP практически не связывает хлорофилл b (хлорофилл a/b = 6‒10) [14].
Пигментный состав WSCP класса II в природе не ограничивается молекулами хлорофилла. Белок WSCP, выделенный из соцветий B. oleracea, а также из сосудистых пучков японского редиса Raphanus sativus (CP674), кроме хлорофилла a содержит пигмент с пиком поглощения при 700 нм, который, по-видимому, образуется при разрушении хлорофилла; этот хромофор отсутствует у WSCP, полученного из листьев [14].
Интересно, что из постэтиолированных проростков ячменя удалось изолировать белок, гомологичный WSCP, но связывающий не хлорофилл, а хлорофиллид a и названный FCBP (free chlorophyllide-binding protein). Молекулярная масса его предшественника составляет 27 кДa, после процессинга и транспорта в хлоропласт она уменьшается до 22 кДа. Как считается, FCBP выполняет в постэтиолированных растениях функцию переносчика хлорофиллида a [32].
Флуоресцентная спектроскопия. Хлорофилл в составе WSCP разных классов обладает собственной флуоресценцией, квантовый выход которой сравним с наблюдаемым в фотосинтетических хлорофилл-белковых комплексах [33]. Анализ спектров испускания и возбуждения флуоресценции хлорофилла при комнатной и низкой температурах позволяет получать информацию о характере пигмент-белковых и пигмент-пигментных взаимодействий в тетрамерах WSCP.
В спектре флуоресценции комплексов BoWSCP (подкласс IIА) при комнатной температуре главный максимум находится при 684 нм (рис. 3). Этот спектр можно разложить на 3 главные гауссовы полосы: 677, 684, и 693 нм для белка, содержащего только хлорофилл a, и 665, 675 и 689 нм для белка, содержащего только хлолрофилл b [34].
Рис. 3.
Спектр флуоресценции BoWSCP при температуре 20°С. Длина волны возбуждении ‒ 435 нм. Стрелка – длина волны регистрации флуоресценции (760 нм) при измерении спектра возбуждения флуоресценции BoWSCP (на врезке). Прибор – спектрофлуориметр Cary Eclipse (“Agilent Technologies”, США). На врезке: спектр возбуждения флуоресценции BoWSCP при температуре 20°С (сплошная линия). Регистрация при 760 нм. Спектральную коррекцию не проводили. Пунктирная линия – спектр поглощения BoWSCP. Спектры нормированы в максимуме 673 нм. Стрелка – длина волны возбуждения (435 нм) при измерении спектра флуоресценции.
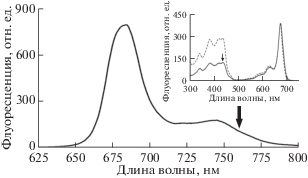
Спектр возбуждения флуоресценции BoWSCP (рис. 4, врезка) по положению и составу пиков совпадает со спектром поглощения этого комплекса. Некоторое расхождение в соотношении амплитуд пиков спектра поглощения и спектра возбуждения флуоресценции вызвано тем, что на спектрофлуориметре не предусмотрена коррекция спектра на спектральное распределение источника света.
Рис. 4.
Спектры флуоресценции LvWSCP при температуре 20°С. Длины волн возбуждения ‒ 430 нм (сплошная линия) и 470 нм (пунктирно-точечная линия). Стрелка – длина волны регистрации флуоресценции (740 нм) при измерении спектра возбуждения флуоресценции LvWSCP (на врезке). Прибор ‒ спектрофлуориметр Cary Eclipse (“Agilent Technologies”, США). На врезке: спектр возбуждения флуоресценции LvWSCP при температуре 20°С (сплошная линия), регистрация при 740 нм. Спектральную коррекцию не проводили. Пунктирная линия – спектр поглощения LvWSCP. Спектры нормированы в максимуме 663 нм. Стрелки – длины волн возбуждения (430, 470 нм) при измерении спектров флуоресценции LvWSCP.
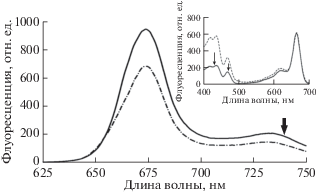
Отсутствие смещения основных пиков в спектре возбуждения флуоресценции BoWSCP относительно пиков поглощения свидетельствует о том, что флуоресценция излучается нативной формой хлорофилла a в тетрамерном комплексе BoWSCP [33, 34].
В спектре флуоресценции тетрамерных комплексов LvWSCP при комнатной температуре главный максимум приходится на 675 нм (рис. 4), причем максимум спектра флуоресценции этого комплекса при возбуждении светом, как длиной волны 430 нм (полоса Соре хлорофилла a), так и 470 нм (полоса Соре хлорофилла b), не меняется и соответствует свечению хлорофилла a [18].
Cпектр возбуждения флуоресценции LvWSCP (рис. 4, врезка) по положению и составу пиков совпадает со спектром поглощения. Аналогично BoWSCP, отсутствие смещения основных пиков в спектре возбуждения флуоресценции LvWSCP относительно основных пиков поглощения свидетельствует о том, что флуоресценция в исследуемом препарате LvWSCP излучается нативной формой хлорофилла a.
Совпадение спектров флуоресценции LvWSCP при возбуждении длинами волн 430 и 470 нм позволяет считать хлорофилл a в составе этого белка единственным флуорофором. В спектре возбуждения флуоресценции LvWSCP есть все полосы, имеющиеся в его спектре поглощения. Это значит, что хлорофилл b в LvWSCP передает свою энергию возбуждения хлорофиллу a, вызывая его флуоресценцию; при этом эффективность миграции энергии возбуждения от молекулы хлорофилла b на хлорофилл a близка 100% [33, 35].
Белки подкласса IIB, способные связывать in vitro хлорофилл a и b в разных соотношениях, уже используют в качестве модели для изучения пигмент‒пигментных и пигмент‒белковых взаимодействий [33].
КД-спектроскопия. К эффективным методам изучения белок‒белковых и белок‒пигментных взаимодействий в биополимерах и сложных надмолекулярных комплексах относится спектроскопия кругового дихроизма, или КД-спектроскопия [36, 37].
Во всех белках семейства WSCP молекулы хлорофилла упакованы в виде димеров, которые обладают высокой амплитудой КД-сигнала в видимой области. Особенно характерен спектр КД в Q-области, где находятся длинноволновые пики поглощения хлорофилла. В спектре КД таких структур в области Qy-перехода есть два симметричных, но разнонаправленных пика [36].
Присутствие симметричных разнонаправленных пиков на КД-спектрах BoWSCP и LvWSCP ‒ свидетельство наличия в их составе димеров хлорофилла и нативности их структуры (рис. 5) [29, 38]. Любое нарушение конформации белковых субъединиц, не разрушающее молекулу хлорофилла, но приводящее к диссоциации его димеров, неизменно вызывает падение амплитуды КД-сигнала в красной области спектра. Это обусловлено тем, что коэффициент экстинкции КД мономерных молекул хлорофилла очень низкий [36, 37].
Рис. 5.
Спектр кругового дихроизма тетрамеров BoWSCP (а) и LvWSCP (б), снятый на КД-спектрометре Hirascan (“Applied Photophysics”, Великобритания). На обоих рисунках оптическая плотность хлорофилла в максимуме красной области спектра, Dred, равна 0.2; постоянная времени, τ, равна 0.5 с. Такой спектр в длинноволновой области характерен для димерной организации молекул хлорофилла a и хлорофилла b в белке.
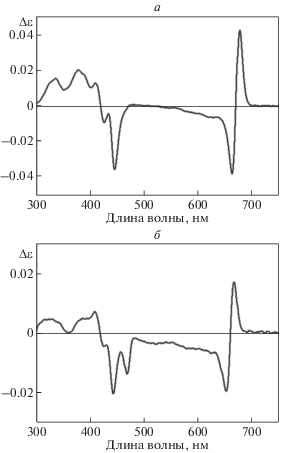
Методом КД-спектроскопии показано, что нативные комплексы WSCP классов IIA и IIB устойчивы к высоким температурам. Белки выдерживают нагревание при 80°С в течение 20 мин без деградации. Только добавление к белкам 1%-ного SDS и кипячение при 100°С в течение 5 мин вызывают полную диссоциацию комплексов [40]. Заметим, что комплексы, полученные при самосборке белка с хлорофиллидом (бесфитольным производным хлорофилла), быстро разрушаются при кипячении, что сопровождается полным исчезновением КД-сигнала в красной области спектра. Это значит, что фитольная цепь хлорофилла играет важную роль в обеспечении прочности тетрамерной структуры WSCP, по-видимому, за счет гидрофобных взаимодействий [39].
ОСОБЕННОСТИ СВЯЗЫВАНИЯ ХЛОРОФИЛЛА И ДРУГИХ ХРОМОФОРОВ WSCP КЛАССА II
В белках семейства WSCP разных классов выявлено различное содержание хлорофилла (до четырех молекул на тетрамер), что можно объяснить как свойствами самих белков, так и условиями самосборки комплексов [14]. Например, для ВоWSCP показана возможность связывания 2 молекул хлорофилла на тетрамер [25, 40]. Это может быть связано с высокой кооперативностью процесса, обусловленной, как полагают, кинетикой ассоциации белковых субъединиц: они быстро образуют тетрамер с закрытием двух свободных сайтов связывания [35].
При самосборке комплексов WSCP в смеси мономеров с раствором хлорофилла в 40%-ном метаноле соотношение связанных молекул хлорофилла а и b отличается от того, которое получается при сборке с тилакоидами. Следовательно, это соотношение зависит от условий (сольватации, микроокружения), в которых происходит взаимодействие белковых субъединиц и молекул пигмента [25].
Для самосборки белков BoWSCP, LvWSCP и RsWSCP (белок из редиса японского Raphanus sativus) предложен альтернативный метод ‒ с использованием водно-масляной эмульсии, ‒ где мономеры белка находятся в водной фазе, а молекулы хлорофилла в гидрофобных мицеллах. Этот метод обеспечивает большую площадь поверхности контакта гидрофобной и водной фаз, а также позволяет создать условия, предотвращающие агрегацию белка или неспецифическое связывание его с хлорофиллом, как это может происходить в 40%-ном метаноле [18]. Этот метод успешно использован и для кристаллизации белка ВоWSCP с целью изучения его трехмерной структуры [30].
Самосборка BoWSCP при низких концентрациях хлорофилла приводит к образованию тетрамера, содержащего две, а не четыре молекулы хлорофилла a в димерном состоянии. Этот комплекс может связать еще две молекулы хлорофилла a при его добавлении в среду и образовать нативный тетрамер BoWSCP с четырьмя молекулами хлорофилла a, уложенными в два димера. Тетрамер WSCP с двумя молекулами хлорофилла a так же, как и с четырьмя, устойчив к термическому воздействию, денатурации, экстремальным значениям pH и фотоокислению пигмента. Это значит, что одной пары молекул хлорофилла достаточно для образования стабильных тетрамерных комплексов WSCP. Однако механизм транспортировки второй пары молекул хлорофилла в гидрофобный карман тетрамера пока не выяснен [29].
ФОТОСЕНСИБИЛИЗИРОВАННЫЕ РЕАКЦИИ С УЧАСТИЕМ ХЛОРОФИЛЛА В СОСТАВЕ WSCP
Фотоконверсия хлорофилла в белках WSCP класса I
Уникальная особенность СаWSCP заключается в способности к фотоконверсии ‒ фотоиндуцированному превращению в другую форму белка с изменением спектра поглощения. Первичная форма белка, до фотоконверсии, названа CP668 (по значению максимума поглощения в Q-области), а фотоконвертированная форма соответственно CP743 [41]. Фотоконверсия происходит в водном растворе в аэробных условиях и в широком диапазоне значений рН (от 0.2 до 11.8), но наиболее эффективна при значении pH 5.0 [15, 42]. Спектр поглощения фотоконвертированной формы белка, CP743, имеет кроме главного максимума (по разным данным составляющего от 740 до 743 нм) пик поглощения при 668 нм (неконвертированная форма хлорофилла а) и минорные полосы при 363, 399 и 564 нм [41].
Реакция фотоконверсии происходит исключительно в CaWSCP, содержащем хлорофилл a, а белок, связавший хлорофилл b, не подвержен фотоконверсии. [41]. Существует гипотеза, что в ходе фотоконверсии хлорофилл a переходит в триплетное состояние и реагирует с молекулярным кислородом с образованием активного синглетного кислорода; последний немедленно вступает в реакцию с хлорофиллом a (форма CP668), превращая его в новый пигмент (форма CP743) [14]. При попытке выделения из белка CP743 образовавшегося пигмента P743 происходит его превращение в другие моноокисленные формы хлорофилла a, получившие названия P726 и P700 [41]. Расположение С=С связей в P743 похоже на строение бактериохлорофилла a, а спектр поглощения пигмента в CP743 схож со спектром поглощения бактериохлорофилла g. Предполагают, что в результате фотоконверсии CaWSCP катализирует окисление хлорофилла a с превращением последнего в пигмент бактериохлоринового типа, структура которого на данный момент точно не известна [14].
Предположение об окислении хлорофилла подтверждает тот факт, что фотоконверсия CP668 в CP743 обратима при облучении светом с длиной волны 735 нм в присутствии 10 мМ гидросульфита натрия. Попытки провести эту реакцию в темноте не принесли результатов [43]. Важно заметить, что после обратного превращения первичная форма белка СР668 утрачивает способность к фотоконверсии. Так, после облучения CP743 светом с длиной волны 735 нм в восстановительных условиях, кроме регенерации в спектре поглощения полосы при 668 нм, появляется дополнительный пик при 763 нм. На основании этого было сделано заключение, что при обратной фотоконверсии происходит не регенерация первичной формы СР668, а образуется комплекс белка CaWSCP с совершенно новым пигментом (эта форма комплекса названа CP763).
Установлено, что фотоконверсия происходит в три этапа, в ходе каждого из которых фотоконвертируется по одной молекуле хлорофилла a. В конце последнего этапа из 4 молекул хлорофилла a в составе тетрамера CaWSCP только 3 претерпевают фотоконверсию, а одна остается в виде CP743 [16].
Таким образом, фотоконверсия белков WSCP класса I представляет собой крайне интересное явление фотоиндуцированных окислительно-восстановительных превращений хлорофилла a внутри белкового матрикса без участия экзогенных редокс-агентов. Такие фотопревращения хлорофилла в CaWSCP могут быть тесно связаны с его функцией в биологических системах, а также служить удобной модельной системой для изучения эволюции путей биосинтеза хлорофилла и бактериохлорофилла.
Фотосенсибилизированные хлорофиллом реакции в белках WSCP класса II
В отличие от WSCP класса I, в белках класса II фотоконверсии хромофоров не наблюдают. Логично предположить, что, так как в процессе фотоконверсии CaWSCP происходят окислительные реакции, димеры хлорофилла в других белках WSCP способны к фотоактивации молекул кислорода, диффундирующих в гидрофобную зону белка из водной среды.
Известно, что в присутствии кислорода на свету хлорофилл a, b и большинство порфиринов в растворах или поврежденных пигмент–белковых комплексах начинают быстро деградировать из-за генерации ими АФК (прежде всего, синглетного кислорода). В нативных пигмент–белковых комплексах тилакоидов такой процесс предотвращается тушением триплетно возбужденного состояния хлорофилла каротиноидами, которые с ним контактируют [21, 44‒46].
Экспериментально показано, что устойчивость хлорофилла в белках WSCP к интенсивному облучению видимым светом примерно в 4 раза выше, чем для хлорофилла в водно-детергентных эмульсиях, хотя каротиноидов в составе WSCP, как уже говорилось, нет. Этот результат объясняют защитными свойствами фитольных хвостов хлорофилла в WSCP, которые, как считается, препятствуют прямому контакту молекулярного кислорода с порфириновым ядром и снижают эффективность генерации синглетного кислорода [28, 38].
На основании трехмерной структуры белка WSCP класса IIB из L. virginicum предположили, что защита хлорофилла от фотодеградации обусловлена изоляцией молекулы пигмента от находящегося в среде молекулярного кислорода внутри образуемой белком гидрофобной полости [21]. Эта интересная особенность белков WSCP класса II легла в основу их использования в качестве модели для изучения тонких барьеров диффузии кислорода [33]. В то же время, недавно для WSCP, связанного только с двумя молекулами хлорофилла, обнаружена такая же фотоустойчивость, как и у комплекса с четырьмя молекулами пигмента [29]. Упомянутая выше способность фитольных хвостов хлорофилла защищать молекулу от фотоокисления подтверждена в экспериментах по самосборке тетрамеров WSCP в присутствии хлорофиллидов (у них нет фитольного хвоста). В таких “химерных” комплексах пигмент быстро разрушается под действием света [28]. Таким образом, несмотря на множество данных по высокой фотостабильности хлорофилла в тетрамерах WSCP, молекулярные механизмы этого феномена до конца не выяснены.
Хлорофилл в нативных комплексах WSCP может реагировать с молекулярным кислородом, способным проникать внутрь гидрофобного кармана белка. В связи с этим интересно выяснить, может ли хлорофилл в составе WSCP фотокатализировать окислительно-восстановительные реакции с участием экзогенных водорастворимых доноров и акцепторов электрона. Нами получены предварительные данные о возможном участии тетрамеров BoWSCP и LvWSCP в фотохимических реакциях, но, чтобы это подтвердить или опровергнуть, необходимы серьезные исследования.
ВОЗМОЖНЫЕ ФУНКЦИИ БЕЛКОВ WSCP В РАСТЕНИЯХ
Превалирует мнение, что белки семейства WSCP связаны с системами ответа растительного организма на различные виды стресса. Однако экспериментальные свидетельства этого часто носят косвенный характер.
Известно, что многие представители суперсемейства DUF538, в которое входят WSCP класса I, относятся к белкам, индуцируемым стрессом [19]. По результатам компьютерного моделирования выявлено некоторое сходство строения CaWSCP и других белков DUF538 c хлорофиллазами и эстеразами жиров [19]. В дальнейшем получены и экспериментальные подтверждения наличия у CaWSCP и белков DUF538 из Celosia cristata хлорофиллазной активности, приводящей к образованию антиоксидантов [20, 23]. Предполагается, что суперсемейство DUF538 представляет собой новую группу хлорофиллаз, которые в стрессовых условиях реагируют с хлорофиллом с образованием соединений, обладающих антиоксидантными свойствами [19, 20, 23].
Существенно больше известно о белках WSCP класса II. Показана индукция синтеза этих белков такими стрессовыми воздействиями, как недостаток влаги, засоленность, повышение температуры, недостаток питательных веществ, обработка метилжасмонатом и механическое повреждение листьев [14, 27, 33, 34, 39]. Предложена гипотеза, согласно которой белки WSCP классов I и II могут функционировать в качестве пары хлорофиллаза‒ингибитор протеазы. В стрессовых условиях хлорофиллаза утилизирует хлорофилл из поврежденных фотосинтетических комплексов, снижая риск фотогенерации АФК, а ингибитор блокирует работу протеаз, защищая хлорофилл‒белковые комплексы от дальнейшего разрушения. Однако в настоящее время нет данных, подтверждающих совместную локализацию пар таких белков в растении [20].
Сведения об участии белков WSCP класса II в утилизации хлорофилла вне хлоропластов противоречивы. Предшественник BoWSCP содержит 19 остатков на N-конце белка, которые имеют признаки сигнального пептида секреторного пути. Возможно, пре-BoWSCP поступает в эндоплазматический ретикулум, куда может транспортироваться и хлорофиллаза [14]. В трансгенном растении табака сверхэкспрессия BoWSCP не приводила к ускорению изменения содержания хлорофилла, что не согласуется с предположением об участии этого белка в катаболизме хлорофилла [40]. Таким образом, при нормальных условиях белки WSCP класса II, скорее всего, никакой роли в утилизации хлорофилла не играют. В то же время замечено увеличение содержания протохлорофиллидов в этиолированных листьях трансгенных растений табака, что может быть обусловлено ролью этого белка как хранилища биосинтетических предшественников хлорофилла [40]. Аналогичные результаты получены в экспериментах с белком FCBP массой 22 кДа, который гомологичен по последовательности белкам WSCP класса II и выделен из ячменя (Hordeum vulgare). Он накапливается в этиолированных хлоропластах, процессируется там в зрелую форму и может выполнять в них функцию транспортера хлорофиллидов, участвуя таким образом в челночном переносе метаболитов пути биосинтеза хлорофилла [32].
В опытах с трансгенными растениями табака, в которых собственный белок WSCP обнаружен не был, показано отсутствие изменения фенотипа при гиперэкспрессии WSCP класса IIA из B. ole-racea по сравнению с диким типом [40]. Однако, как и в B. oleracea, в стрессовых условиях в трансгенных растениях табака содержание этого белка увеличивалось, но далее, в процессе старения листьев, снижалось. При сверхэкспрессии WSCP в трансгенных растениях снижалась генерация АФК, что позволило предположить участие WSCP подкласса IIA в защитном ответе на стресс [40].
Гипотеза о защитной функции белков WSCP подкласса II подтверждена экспериментальными данными по внутриклеточной локализации белков. С помощью меченного флуоресцентным белком N-концевого транспортного пептида из WSCP подкласса IIA, а также из белка BnD22 показано, что WSCP может транспортироваться в тельца эндоплазматического ретикулума (ER-тельца) ‒ особые компартменты, связанные с эндоплазматической сетью, обнаруженные у растений семейства Brassicaceae [25]. Обнаружено, что в ER-тельцах накапливаются и другие белки: AtWSCP (из Arabidopsis thaliana), RsWSCP [24] и LvWSCP [27]. С этим компартментом связывают различные защитные реакции растения. Например, они активно формируются при ранениях и обработке метилжасмонатом [25]. Также в ER-тельцах обнаружены белки PYK10, которые, как достоверно показано, участвуют в защите растения от патогенов [25, 27].
Высказано предположение, что при повреждениях клетки белки семейства WSCP выполняют роль контейнеров-сборщиков свободного хлорофилла, внося тем самым вклад в защиту клетки от образования АФК. Повреждение органелл в растительной клетке вследствие стресса (действия патогенов и других воздействий) служит сигналом для выхода апобелков WSCP из эндоплазматического ретикулума. Далее они попадают в хлоропласты через поврежденные мембраны и экстрагируют хлорофилл из пигмент–белковых комплексов тилакоидов, иммобилизуя его в прочных тетрамерных комплексах [25, 27].
Возможно, апобелки WSCP эффективно извлекают хлорофилл в первую очередь из поврежденных хлорофилл–белковых комплексов, где он связан слабее и разобщен с каротиноидами. Нарушение связи молекул хлорофилла с каротиноидами приводит к тому, что он переходит в долгоживущее триплетное состояние и генерирует цитотоксичный синглетный кислород [47]. В комплексе с WSCP эффективность генерации хлорофиллом АФК значительно понижается [28]. Таким образом, механизм защитного действия WSCP заключается в специфической экстракции фотохимически активного хлорофилла из поврежденных пигмент–белковых комплексов и изоляции его от клеточных органелл.
При оценке физиологической роли семейства WSCP нельзя не упомянуть о сходстве белков WSCP класса II с семейством белковых ингибиторов протеаз типа Кунитца [14]. Характерный для этих ингибиторов структурный мотив относится к эволюционно консервативным (возраст более 500 млн лет) [48].
Для отдельных представителей семейства WSCP класса II выявлена способность ингибировать трипсин и только для белка BnD22 ‒ химотрипсин, но не субтилизин и протеазу K [49‒51].
Доказано, что белок AtWSCP ингибирует папаинподобную цистеиновую протеиназу RD21 арабидопсиса; при этом он присутствует только в молодых стручках и исчезает с развитием растения [39]. Наиболее активно AtWSCP синтезируется в районе апекса в темноте и пропадает при росте на свету [52]. Показано, что в клетках апекса этот белок локализуется в зоне клеточных стенок, в апопластах и ER-тельцах, где и взаимодействует с RD21.
Известно, что протеолитический фермент RD21 в норме регулирует процессы программируемой клеточной смерти, играющие большую роль в дифференцировке тканей и развитии растения, а также участвует в ответе на стресс. Существенно, что RD21 дополнительно содержит продомен, который во время развития семян регулирует активность фермента путем аутоингибирования. При прорастании, когда значение внутриклеточного рН падает ниже 5, происходят внутримолекулярные конформационные изменения, приводящие к дестабилизации и расщеплению пропептида. Для того, чтобы избежать неконтролируемой активности RD21, клетка использует еще один уровень регуляции ‒ ингибиторы протеазы. Предполагают, что AtWSCP один из таких ингибиторов, который экспрессируется в клетках проростков и контролирует активность RD21 на протяжении фазы роста [52‒54].
Белок RD21, как и AtWSCP, синтезируется в виде предшественника, с N-концевым сигнальным пептидом, направляющим белок в эндоплазматический ретикулум. Предполагают, что AtWSCP обратимо ингибирует RD21 при прорастании в темноте и далее на свету, связываясь с хлорофиллидами, высвобождает протеазу в проростках. К последующей регуляции подключается белок из группы ингибиторов сериновых протеаз Serpin, который уже необратимо ингибирует активность протеазы RD21 [52, 54].
ЗАКЛЮЧЕНИЕ
Перспективы исследования пигмент–белковых ансамблей WSCP включают не только углубленное изучение их молекулярного и надмолекулярного устройства, но и поиск областей возможного практического применения.
Несмотря на то, что каждая из групп белков семейства WSCP имеет свои особенности в структурном, филогенетическом и функциональном плане, всех их объединяют два общих свойства: высокое сродство к хлорофиллу и растворимость в воде, а не в липофильной среде, что характерно для хлорофилл–белковых комплексов фотосинтетического аппарата.
Функции белков WSCP в растительном организме остаются малоизученными, хотя, скорее всего, они связаны с обеспечением защиты организма растения от стрессовых воздействий. Сегодня сформировалось несколько направлений, ориентированных на исследование роли белков WSCP в антистрессовой и адаптационной системах растений, в частности, в качестве ингибиторов протеаз. Анализируют и взаимодействие белков WSCP с хлорофиллом. Особое внимание привлекает высокое сродство белков к этому пигменту. Как сказано ранее, мономеры WSCP даже могут извлекать молекулы хлорофилла из антенных комплексов тилакоидов. В связи с этим интересно изучить кинетику и оценить константы связывания белками WSCP молекул хлорофилла из частично разрушенных фотосинтетических структур. Удаление “свободного”, разобщенного с каротиноидами (и потому фотохимически активного), хлорофилла, по-видимому, препятствует развитию фотодинамического повреждения клетки и тем самым вносит вклад в защиту растения от окислительного стресса.
Особенности структуры пигмент–белковых комплексов WSCP растений, а именно укладка в гидрофобном внутреннем пространстве белка молекул хлорофилла в виде двойного димера, открывает еще одно направление экспериментальных исследований. Благодаря такой уникальной упаковке хромофоров тетрамеры WSCP можно рассматривать в качестве своеобразного структурного аналога фотосинтетических реакционных центров, так как именно димеры хлорофилла или бактериохлорофилла выполняют ключевую роль первичного донора электронов при фотохимическом разделении зарядов в реакционных центрах фотосистем.
Исследование фотохимических свойств WSCP разных классов расширит представления об участии димеров хлорофилла в фотосенсибилизации окислительно-восстановительных реакций с участием экзогенных доноров и акцепторов электрона. Относительная простота организации апобелков WSCP и их растворимость в водной фазе, а не в липидном окружении открывает возможность использования WSCP для моделирования эволюционных предшественников фотосинтетического конвертора энергии. Разумеется, при моделировании эволюционных прототипов безмембранного фотосинтеза необходимо учитывать такие ограничения, как структурные различия WSCP и реакционных центров фотосистем. Это касается прежде всего различия набора аминокислотных остатков, связывающих Mg2+ в порфириновом ядре хлорофилла, а также разного взаиморасположения фитольных хвостов хлорофилла в димерах.
Участие белков семейства WSCP в процессах переноса энергии и фотокатализируемых димерами хлорофилла окислительно-восстановительных реакциях позволяет рассматривать их как материал для создания фотобиотехнологических систем и ориентироваться на них при конструировании наноразмерных преобразователей световой энергии в химическую и/или в информационный сигнал.
Авторы благодарят доцента кафедры молекулярной биологии биологического факультета МГУ им. М.В. Ломоносова В.В. Асеева за ценные советы при подготовке рукописи.
Статья подготовлена при частичной поддержке Программы фундаментальных исследований РАН № 16 (подпрограмма 1, координатор – академик Э.М. Галимов).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Olson J.M., Romano C.A. (1962) A new chlorophyll from green bacteria. Biochim. Biophys. Acta. 59, 726‒728.
Fenna R.E., Matthews B.W. (1975) Chlorophyll arrangement in a bacteriochlorophyll protein from Chlorobium limicola. Nature. 258, 573–577.
Prezelin B.B., Haxo F.T. (1976) Purification and characterization of peridinin‒chlorophyll a-proteins from the marine dinoflagellates Glenodinium sp. and Gonyaulax polyedra. Planta. 128, 133–141.
Song P.S., Koka P., Prezelin B.B., Haxo F.T. (1976) Molecular topology of the photosynthetic light-harvesting pigment complex, peridinin‒chlorophyll a–protein, from marine dinoflagellates. Biochemistry. 15, 4422‒4427.
Стадничук И.Н., Литвин Ф.Ф. (1977) Производные спектры поглощения и флуоресценции зеленых бактерий. Биофизика. 22, 170‒174.
Tronrud D.E., Wen J., Gay L., Blankenship R.E. (2009) The structural basis for the difference in absorbance spectra for the FMO antenna protein from various green sulfur bacteria. Photosynth. Res. 100, 79‒87.
Wen J., Zhang H., Gross M.L., Blankenship R.E. (2011) Native electrospray mass spectrometry reveals the nature and stoichiometry of pigments in the FMO photosynthetic antenna protein. Biochemistry. 50, 3502‒3511.
Saer R.G., Blankenship R.E. (2017) Light harvesting in phototrophic bacteria: structure and function. Biochem. J. 474, 2107‒2131.
Hofmann E., Wrench P.M., Sharples F.P., Hiller R.G., Welte W., Diederichs K. (1996) Structural basis of light harvesting by carotenoids: peridinin‒chlorophyll‒protein from Amphidinium carterae. Science. 272, 1788‒1791.
Schulte T., Johanning S., Hofmann E. (2010) Structure and function of native and refolded peridinin‒chlorophyll‒proteins from dinoflagellates. Eur. J. Cell Biol. 89, 990‒997.
Jiang J., Zhang H., Kang Y., Bina D., Lo C.S., Blankenship R.E. (2012) Characterization of the peridinin–chlorophyll a-protein complex in the dinoflagellate Symbiodinium. Biochim. Biophys. Acta. 1817, 983‒989.
Carbonera D., Di Valentin M., Spezia R., Mezzetti A. (2014) The unique photophysical properties of the peridinin–chlorophyll a-protein. Curr. Protein Pept. Sci. 15(4), 332‒350.
Yakushiji E., Uchino K., Sugimura Y., Shiratori I., Takamiya F. (1963) Isolation of water-soluble chlorophyll protein from the leaves of Chenopodium album. Biochim. Biophys. Acta. 75, 293‒298.
Satoh H., Uchida A., Nakayama K., Okada M. (2001) Water-soluble chlorophyll protein in Brassicaceae plants is a stress-induced chlorophyll-binding protein. Plant Cell Physiol. 42, 906‒911.
Takahashi S., Seki Y., Uchida A., Nakayama K., Satoh H. (2014) Cysteine-2 and cys30 are essential for chlorophyll-binding activity of the water-soluble chlorophyll-binding protein (WSCP) of Chenopodium album. Biosci., Biotechnol., Biochem. 78, 1825‒1832.
Takahashi S., Uchida A., Nakayama K., Satoh H. (2014) Three-step photoconversion of only three subunits of the water-soluble chlorophyll-binding protein tetramer from Chenopodium album. Protein J. 33(4), 337–343.
Takahashi S., Yoshikawa M., Kamada A., Ohtsuki T., Uchida A., Nakayama K., Satoh H. (2013) The photoconvertible water-soluble chlorophyll-binding protein of Chenopodium album is a member of DUF538, a superfamily that distributes in Embryophyta. J. Plant Physiol. 170, 1549‒1552.
Bednarczyk D., Takahashi S., Satoh H., Noy D. (2015) Assembly of water-soluble chlorophyll-binding proteins with native hydrophobic chlorophylls in water-in-oil emulsions. Biochim. Biophys. Acta. 1847, 307‒313
Gholizadeh A. (2016) DUF538 protein superfamily is predicted to be chlorophyll hydrolyzing enzymes in plants. Physiol. Mol. Biol. Plants. 22, 77‒85.
Gholizadeh A. (2017) Plants water soluble chlorophyll binding proteins act as enzyme-inhibitor pair. Russ. J. Plant Physiol. 64, 91‒99.
Horigome D., Satoh H., Itoh N., Mitsunaga K., Oonishi I., Nakagawa A., Uchida A. (2007) Structural mechanism and photoprotective function of water-soluble chlorophyll-binding protein. J. Biol. Chem. 282, 6525‒6531.
Ohtsuki T., Ohshima S., Uchida A. (2007) Purification, crystallization and preliminary X-ray diffraction analysis of water-soluble chlorophyll-binding protein from Chenopodium album. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 63, 740‒741.
Gholizadeh A. (2018) Chlorophyll binding ability of non-chloroplastic DUF538 protein superfamily in plants. Proc. Natl. Acad. Sci. India, Sect. B. 88(3), 967‒976.
Takahashi S., Aizawa K., Nakayama K., Satoh H. (2015) Water-soluble chlorophyll-binding proteins from Arabidopsis thaliana and Raphanus sativus target the endoplasmic reticulum body. BMC Res. Notes. 8, 365.
Takahashi S., Yanai H., Nakamaru Y., Uchida A., Nakayama K., Satoh H. (2012) Molecular cloning, characterization and analysis of the intracellular localization of a water-soluble chl-binding protein from brussels sprouts (Brassica oleracea var. Gemmifera). Plant Cell Physiol. 53, 879–891.
Satoh H., Nakayama K., Okada M. (1998) Molecular cloning and functional expression of a water-soluble chlorophyll protein, a putative carrier of chlorophyll molecules in cauliflower. J. Biol. Chem. 273, 30568‒30575.
Takahashi S., Yanai H., Oka-Takayama Y., Zanma-Sohtome A., Fujiyama K., Uchida A., Nakayama K., Satoh H. (2013) Molecular cloning, characterization and analysis of the intracellular localization of a water-soluble chlorophyll-binding protein (WSCP) from virginia pepperweed (Lepidium virginicum), a unique WSCP that preferentially binds chlorophyll b in vitro. Planta. 238, 1065‒1080.
Agostini A., Palm D.M., Schmitt F.-J., Albertini M., Valentin M.D., Paulsen H., Carbonera D. (2017) An unusual role for the phytyl chains in the photoprotection of the chlorophylls bound to water-soluble chlorophyll-binding proteins. Sci. Rep. 7, 7504.
Palm D.M., Agostini A., Tenzer S., Gloeckle B.M., Werwie M., Carbonera D., Paulsen H. (2017) Water-soluble chlorophyll protein (WSCP) stably binds two or four chlorophylls. Biochemistry. 56, 1726‒1736.
Bednarczyk D., Dym O., Prabahar V., Peleg Y., Pike D.H., Noy D. (2016) Fine tuning of chlorophyll spectra by protein-induced ring deformation. Angew. Chem., Int. Ed. Engl. 55, 6901‒6905.
Lichtenthaler H.K. (1987) Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Methods Enzymol. 148, 350‒382.
Reinbothe C., Satoh H., Alcaraz J.-P., Reinbothe S. (2004) A novel role of water-soluble chlorophyll proteins in the transitory storage of chorophyllide. Plant Physiol. 134, 1355‒1365.
Renger G., Pieper J., Theiss C., Trostmann I., Paulsen H., Renger T., Eichler H.J., Schmitt F.-J. (2011) Water soluble chlorophyll binding protein of higher plants: a most suitable model system for basic analyses of pigment–pigment and pigment–protein interactions in chlorophyll protein complexes. J. Plant Physiol. 168, 1462‒1472.
Schmitt F.-J., Trostmann I., Theiss C., Pieper J., Renger T., Fuesers J., Hubrich E.H., Paulsen H., Eichler H.J., Renger G. (2008) Excited state dynamics in recombinant water-soluble chlorophyll proteins (WSCP) from cauliflower investigated by transient fluorescence spectroscopy. J. Phys. Chem. B. 112, 13951‒13961.
Theiss C., Trostmann I., Andree S., Schmitt F.J., Renger T., Eichler H.J., Paulsen H., Renger G. (2007) Pigment–pigment and pigment–protein interactions in recombinant water-soluble chlorophyll proteins (WSCP) from cauliflower. J. Phys. Chem. B. 111, 13325‒13335.
Фрайфелдер Д. (1980) Физическая биохимия. Применение физико-химических методов в биохимии и молекулярной биологии. Москва, Мир.
Клейтон Р. (1984) Фотосинтез. Физические механизмы и химические модели. Москва, Мир.
Schmidt K., Fufezan C., Krieger-Liszkay A., Satoh H., Paulsen H. (2003) Recombinant water-soluble chlorophyll protein from Brassica oleracea var. Botrys binds various chlorophyll derivatives. Biochemistry. 42, 7427‒7433.
Bektas I., Fellenberg C., Paulsen H. (2012) Water-soluble chlorophyll protein (WSCP) of Arabidopsis is expressed in the gynoecium and developing silique. Planta. 236, 251‒259.
Damaraju S., Schlede S., Eckhardt U., Lokstein H., Grimm B. (2011) Functions of the water soluble chlorophyll-binding protein in plants. J. Plant Physiol. 168, 1444‒1451.
Hirabayashi H., Amakawa M., Kamimura Y., Shino Y., Satoh H., Itoh S., Tamiaki H. (2006) Analysis of photooxidized pigments in water-soluble chlorophyll protein complex isolated from Chenopodium album. J. Photochem. Photobiol., A. 183, 121‒125.
Oku T., Yoshida M., Tomita G. (1972) The photoconversion of heat-treated Chenopodium chlorophyll protein and its pH dependence. Plant Cell Physiol. 13, 773‒782.
Takahashi S., Uchida A., Nakayama K., Satoh H. (2015) Effect of near-infrared irradiation on photoconversion of the water-soluble chlorophyll-binding protein of Chenopodium album. Biosci., Biotechnol., Biochem. 79, 439‒442.
Foote C.S. (1976) Photosensitized oxidation and singlet oxygen: consequences in biological systems. In: Free Radicals in Biology, vol. 2. Ed. Pryor W.A. Academic Press, NY, pp. 85–133.
Неверов К.В. Шалыго Н.В. Аверина Н.Г., Красновский А.А. мл. (1996) Образование триплетного состояния пигментов в зеленых листьях растений, обработанных хелаторами металлов. Физиология растений. 43, 89‒99.
Стриж И.Г., Неверов К.В. (2007) Фотоингибирование фотосистемы II in vitro. Спектральный кинетический анализ. Физиология растений. 54, 499‒510.
Neverov K.V., Krasnovsky A.A., Jr., Zabelin A.A., Shuvalov V.A., Shkuropatov A.Ya. (2015) Low-temperature (77 K) phosphorescence of triplet chlorophyll in isolated reaction centers of photosystem II. Photosynth. Res. 125, 43–49.
Ikeo K., Takahashi K., Gojobori T. (1992) Evolutionary origin of a Kunitz-type trypsin inhibitor domain inserted in the amyloid β precursor protein of Alzheimer’s disease. J. Mol. Evol. 34, 536‒543.
Ilami G., Nespoulous C., Huet J.C., Vartanian N., Pernollet J.C. (1997) Characterization of BnD22, a drought-induced protein expressed in Brassica napus leaves. Phytochemistry. 45, 1‒8.
Etienne P., Desclos M., Le Gou L., Gombert J., Bonnefoy J., Maurel K., Le Dily F., Ourry A., Avice J.C. (2007) N-protein mobilization associated with the leaf senescence process in oilseed rape is concomitant with the disappearance of trypsin inhibitor activity. Funct. Plant Biol. 34, 895‒906.
Desclos M., Dubousset L., Etienne P., Le Caherec F., Satoh H., Bonnefoy J., Ourry A., Avice J.C. (2008) A proteomic profiling approach to reveal a novel role of Brassica napus drought 22 kD/water-soluble chlorophyll-binding protein in young leaves during nitrogen remobilization induced by stressful conditions. Plant Physiol. 147, 1830‒1844.
Boex-Fontvieille E., Rustgi S., Von Wettstein D., Reinbothe S., Reinbothe C. (2015) Water-soluble chlorophyll protein is involved in herbivore resistance activation during greening of Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA. 112, 7303‒7308.
Boex-Fontvieille E., Rustgi S., Reinbothe S., Reinbothe C. (2015) A Kunitz-type protease inhibitor regulates programmed cell death during flower development in Arabidopsis thaliana. J. Exp. Bot. 66, 6119‒6135.
Rustgi S., Boex-Fontvieille E., Reinbothe C., Wettstein D.V., Reinbothe S. (2017) Serpin1 and WSCP differentially regulate the activity of the cysteine protease RD21 during plant development in Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA. 114, 2212‒2217.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


