Молекулярная биология, 2020, T. 54, № 1, стр. 87-94
Клетки гепатоклеточной карциномы с негативно регулируемым ZEB2 становятся устойчивыми к ресвератролу в результате одновременной индукции экспрессии ABCG2
P. Balcik-Ercin a, M. Cetin a, I. Yalim-Camci a, T. Uygur a, T. Yagci a, *
a Department of Molecular Biology and Genetics, Laboratory of Molecular Oncology, Gebze Technical University
41400 Gebze, Kocaeli, Turkey
* E-mail: tyagci@gtu.edu.tr
Поступила в редакцию 14.12.2018
После доработки 06.03.2019
Принята к публикации 11.03.2019
Аннотация
Присутствие опухолевых стволовых клеток (CSC) связано с лекарственной устойчивостью, эпителиально-мезенхимальным переходом и рецидивами гепатоцеллюлярной карциномы (HCC). Изучен профиль экспрессии генов ZEB1, ZEB2, ABCG2 в HCC-CSC и роль фактора эпителиально-мезенхимального перехода ZEB2 в клетках, обработанных ресвератролом. Экспрессию генов ZEB1, ZEB2 и ABCG2 анализировали в CD133+/CD44+ клетках, выделенных из линии клеток PLC/PRF/5. Изучена ZEB2-зависимая экспрессия гена ABCG2 и влияние ресвератрола на пролиферацию, клеточный цикл и апоптоз клонов клеток SNU398. Выявлена обратная корреляция между уровнями ZEB1/ZEB2 и ABCG2 в CSC и клетках с нокдауном ZEB2. Обработка ресвератролом приводит к значительному снижению жизнеспособности клеток, при этом увеличивается ZEB2-независимая остановка клеточного цикла. ZEB2 придает клеткам, обработанным ресвератролом, устойчивость к апоптозу. Проанализирована экспрессия факторов транскрипции ABCG2 и ZEB, входящих в семейство факторов EMT, в клетках HCC с CSC-подобным фенотипом, а также влияние ZEB2 на ответ клеток HCC на ресвератрол. Интересно, что обработанные ресвератролом клетки с низким уровнем ZEB2 были устойчивы к апоптозу. Взаимодействие экспрессии факторов ABCG2 и ZEB может играть роль в установлении CSC-подобного фенотипа в клетках HCC, устойчивых к ресвератролу.
Гепатоцеллюлярная карцинома (HCC) ‒ наиболее распространенный вид рака печени и четвертая по частоте причина смерти от онкологических заболеваний [1]. Терапию НСС существенно затрудняет резистентность опухолевых клеток к химиотерапевтическим средствам и высокая частота рецидивов. Наилучшие результаты дает трансплантация печени, однако из-за высокой стоимости этого метода в качестве последней линии лечения часто используют радиочастотную абляцию (РЧА) и мультикиназные ингибиторы [2]. Выявление молекулярных механизмов патогенеза HCC может способствовать разработке новых лекарственных средств, таких как природный полифенольный фитоалексин ресвератрол (транс-3,4,5-тригидроксистильбен) [3]. Недавно показали, что ресвератрол оказывает противоопухолевое действие при различных онкологических заболеваниях, в том числе при колоректальном раке, раке молочной и поджелудочной железы, легкого и HCC in vitro и in vivo [3, 4].
Традиционная химиотерапия, используемая в настоящее время, направлена на устранение дифференцированных или дифференцирующихся клеток, которые составляют большинство клеток опухоли. Обычные методы химиотерапии предотвращают размножение новых клеток; однако клетки, входящие в подмножество так называемых опухолевых стволовых клеток (CSC), способны выживать и вызывать появление метастазов [4, 5]. CSC, известные также как клетки, инициирующие опухоль, составляют небольшую часть клеток в опухоли. Инъекция таких клеток модельным животным может вызывать образование новых опухолей – способность, которой не обладают миллионы других нестволовых раковых клеток [6]. CSC обладают многими уникальными свойствами, в частности, высокими показателями самообновления, способностью к дифференцировке и повышенной устойчивостью к обычным химиотерапевтическим средствам [7, 8]. Устойчивость CSC обусловлена, в основном, активностью АТР/ABC-зависимых эффлюксных насосов с ATP-связывающими кассетами (ABC), которые защищают клетки от апоптоза, индуцированного химиотерапевтическими средствами [8, 9]. Более внимательный взгляд на эту систему показал, что белок 2, принадлежащий к подсемейству ABC-G (ABCG2), на высоком уровне экспрессируется в клетках CSC и придает им устойчивость к химиотерапии [10].
Эпителиально-мезенхимальный переход (EMT) – это процесс, посредством которого клетки совершают переход между эпителиальным и мезенхимальным состояниями, играющими важную роль в формировании устойчивости опухолевых клеток к химиотерапии и метастазировании [11]. Экзогенная экспрессия EMT-транскрипционного фактора TWIST в клетках эпителия молочной железы приводит к генерации клеток, обладающих признаками стволовых [12]. Индукция EMT ведет не только к появлению CSC, но также к развитию лекарственной устойчивости при инвазивном и метастатическом раке [13]. В ходе EMT экспрессируются члены семейств факторов транскрипции SNAI, TWIST и ZEB. Семейство ZEB включает два члена ‒ ZEB1 и ZEB2, которые вовлечены в прогрессию опухоли [14]. Недавно были получены дополнительные доказательства, подтверждающие связь ZEB2 с лекарственной устойчивостью опухолевых клеток. Изучение ZEB2-зависимой лекарственной устойчивости показало, что сайленсинг ZEB2 приводит к повышению чувствительности клеток рака желудка к цисплатину [15]. Поэтому мы определили профиль экспрессии факторов транскрипции семейства ZEB и гена устойчивости к лекарственным средствам ABCG2 в HCC-CSC. Кроме того, мы проанализировали влияние обработки ресвератролом на клетки с нокдауном ZEB2 и на ZEB2-экспрессирующие клоны клеточной линии SNU398, полученной из HCC.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные культуры. Линию клеток SNU398, происходящую из HCC, культивировали в среде RPMI1640, а линию клеток PLC/PRF/5 – в среде DMEM, содержащей 10% плодной сыворотки крупного рогатого скота (FBS), 1% пенициллина-стрептомицина с добавлением 1% заменимых аминокислот.
Выделение опухолевых стволовых клеток (CSC). Клетки CD133+/CD44+ выделяли из культивируемых клеток PLC/PRF/5 методом сортировки с активированной флуоресценцией (FACSJazz, “BD Biosciences”, США). Мертвые клетки удаляли с использованием красителя 7-аминоактиномицина D (7-AAD; “BD Biosciences”). Проводили двойное окрашивание антителами CD44-APC (“BD Biosciences”) и CD133-PE (“Miltenyi Biotec”, США). Для выделения РНК клетки CD133+/CD44+ собирали в 500 мкл FBS, центрифугировали и промывали в холодном фосфатно-солевом буфере (PBS).
Получение клонов ZEB2-shРНК. Ранее мы описали получение клонов ZEB2-shРНК и последующую валидацию экспрессии генов и белков [16]. Клетки SNU398 трансдуцировали лентивирусными частицами, несущими ZEB2-shРНК, и контрольными shРНК (NSC-shZEB2), не способными к подавлению экспрессии, в присутствии полибрена (8 мкг/мл). Через 24 ч клетки обрабатывали пуромицином (5 мкг/мл) с целью отбора стабильных клонов shZEB2-SNU398 (shZEB2) и контрольных клонов (NSC- SNU398).
Количественная ПЦР в реальном времени (ОT-кПЦР). Суммарную РНК выделяли с использованием набора NucleoSpin RNA II (“Macherey-Nagel”, Германия). РНК выделяли из CD133+/CD44+ клеток PLC/PRF/5, родительских клеток PLC/PRF/5, клеток shZEB2-SNU398 и контрольных клонов NSC-SNU398. кДНК синтезировали с использованием набора для ОТ-ПЦР Pro-Script M-MuLV-Taq (“New England Biolabs”, США) в соответствии с инструкциями производителя. ОТ‑кПЦР проводили с использованием мастер-микса Maxima SYBR Green qPCR (“Thermo Scientific”, США). кДНК гена ZEB2 амплифицировали с использованием следующих праймеров: 5'-CAAGGAGCAGGTAATCGCAAGT-3' и 5'-GG-AACCAGAATGGGAGAAACG-3'; ZEB1: 5'-GATCAAAGACATGTGACGCAG-3' и 5'-TGTGTGAGCTATAGGAGCCAG-3'; ABCG2: 5'-ATGGATTTACGGCTTTGCAG-3' и 5'-GAGATCGATGCCCTGCTTTA-3'. Для амплификации кДНК гена домашнего хозяйства GAPDH использовали праймеры: 5'-GGCTGAGAACGGGAAGCTTGTCAT-3' и 5'-CAGCCTTCTCCATGGTGGTGAAGA-3'. Относительную экспрессию гена рассчитывали с использованием метода ΔΔCt, результаты представляли как значения log2-кратного изменения. Значения Ct нормировали по GAPDH и калибровали по значению Ct в контроле [17].
Анализ жизнеспособности клеток и определение концентрации ресвератрола. Клетки shZEB2-SNU398 и NSC-SNU398 помещали в 96-луночные планшеты по 5 × 103 клеток в 100 мкл среды в каждую лунку. После инкубации в течение 24 ч в присутствии ресвератрола в пяти различных концентрациях (0, 50, 100, 150, 200 мкМ) клетки растили в течение еще 24 или 48 ч. Рост и жизнеспособность клеток определяли с помощью соли тетразолия WST-1 (“Roche Applied Science”, Германия). Все эксперименты проводили не менее 3 раз в трех сериях.
Анализ клеточного цикла и апоптоза. Клетки shZEB2 и NSC высевали в матрасы размером 25 см2 при плотности 5 × 105 клеток/мл и инкубировали в течение 24 ч при 37°C. Клетки обрабатывали ресвератролом в концентрации 150 мкМ. После обработки клетки инкубировали в течение 24 и 48 ч при 37°C. Затем клетки трипсинизировали и промывали в холодном PBS. Для анализа клеточного цикла клетки фиксировали 70%-ным этанолом и обрабатывали раствором иодида пропидия (PI) в течение 1 ч при 37°C. Затем краситель отмывали и удаляли центрифугированием, а клетки повторно суспендировали в холодном PBS. Для количественной оценки апоптоза клетки повторно суспендировали при плотности 1 × 106 клеток/мл в 1× связывающем буфере (10 мМ HEPES/NaOH, рН 7.4; 140 мМ NaCl; 2.5 мМ CaCl2). Затем 100 мкл клеточного раствора окрашивали 5 мкл аннексина (Annexin V-APC) и 5 мкл PI (BD 550475, BD 51-66211E) в течение 15 мин при комнатной температуре. После окрашивания к клеткам добавляли 400 мкл 1× связывающего буфера. Фазы клеточного цикла и апоптоз анализировали с использованием проточного цитометра Accuri C6 (“Becton Dickinson”, США). Проводили по три независимых эксперимента.
Статистический анализ. Статистическую значимость оценивали с помощью t-критерия Стьюдента и двухфакторного теста ANOVA. Статистически значимыми считали р < 0.05. Все опыты проводили в трех повторностях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
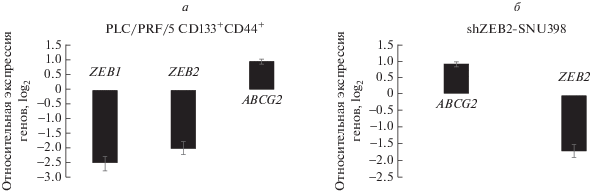
Как показано ранее, антигены CD133 и CD44 можно рассматривать в качестве маркеров HCC-CSC [18, 19]. Методом проточной цитометрии из культуры клеток PLC/PRF/5 мы выделили популяцию клеток, дважды положительных по CD133/CD44. В этих клетках с помощью ОТ-кПЦР определили экспрессию гена множественной лекарственной устойчивости ABCG2 и EMT-генов ZEB1 и ZEB2. В популяции клеток, положительных по двум антигенам – CD133 и CD44, выявлено снижение экспрессии ZEB1 и ZEB2 и увеличение экспрессии ABCG2, связанного с лекарственной устойчивостью (рис. 1а). Однако опубликованы данные, согласно которым экспрессия ZEB1 эпигенетически ингибируется в клетках рака ротовой полости, обработанных ресвератролом, и повышается в клетках рака яичников [20, 21]. Показано также, что ресвератрол подавляет экспрессию ZEB1 в CSC рака носоглотки [22]. Поэтому отсутствие информации о поведении раковых клеток на фоне терапии ресвератролом побудило нас изучить влияние ресвератрола на экспрессию ABCG2 в клетках, экспрессирующих или неэкспрессирующих ZEB2. С этой целью мы трансдуцировали клеточную линию SNU398 с высоким уровнем эндогенного ZEB2, лентивирусной конструкцией ZEB2-shРНК и контрольным лентивирусным вектором, который не способен вызывать сайленсинг. Резкое снижение уровня мРНК ZEB2 сопровождалось почти двукратным увеличением экспрессии ABCG2 в клетках, трансдуцированных ZEB2-shРНК (рис. 1б).
Рис. 1.
Профиль экспрессии генов ABCG2, ZEB1 и ZEB2 в популяциях клеток PLC/PRF/5 и SNU398 HCC. а ‒ Сравнение профилей экспрессии генов ZEB1, ZEB2 и ABCG2 в клетках CD133+/CD44+ PLC/PRF/5 и родительскими клетками PLC/PRF/5. Показана экспрессия генов ABCG2, ZEB1 и ZEB2 в клетках PLC/PRF/5, положительных по CD133/CD44. Значения Ct калибровали по родительским клеткам PLC/PRF/5 и нормировали по GAPDH. б ‒ Профиль экспрессии генов ZEB2 и ABCG2 в клетках shZEB2-SNU398. Значения относительной экспрессии генов ZEB2 и ABCG2 рассчитаны с использованием метода ΔΔCt и представлены в виде кратного изменения (log2). Данные ОT-кПЦР откалиброваны для контрольного клона NSC-SNU398 (контроль, не вызывающий сайленсинг) и нормированы по GAPDH. Эксперименты повторяли трижды, перпендикулярные отрезки показывают стандартные отклонения (SD).
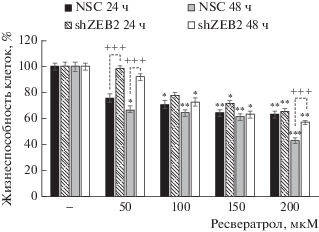
Затем, чтобы оценить реакцию на ресвератрол клеток с различным функциональным статусом ZEB2, мы обрабатывали клетки с нокдауном ZEB2 и контрольные клоны повышающимися концентрациями ресвератрола (50, 100, 150 или 200 мкМ) в течение 24 и 48 ч. Обнаружено значительное цитотоксическое действие ресвератрола как в клетках shZEB2, так и в контрольных клонах (150 и 200 мкМ как через 24 ч, так и через 48 ч). Кроме того, обработка контрольного клона NSC ресвератролом (50 мкМ, 48 ч) и всех клеточных клонов (100 мкМ, 24 и 48 ч), за исключением клеток shZEB2, обработанных в течение 24 ч, выявила значительную цитотоксичность ресвератрола. Однако воздействие 50 мкМ ресвератрола не привело к существенным различиям в индукции цитотоксичности в обработанных и необработанных клонах shZEB2. Cледует отметить, что жизнеспособность клонов клеток shZEB2 возросла после их обработки 50 мкМ ресвератролом в течение 24 и 48 ч и 200 мкМ – в течение 48 ч (рис. 2). Таким образом, первичная оценка воздействия ресвератрола на клетки HCC, экспрессирующие или неэкспрессирующие ZEB2, дает представление о защите клеток с ZEB2-нокдауном от токсичности ресвератрола.
Рис. 2.
Влияние ресвератрола на пролиферацию клеток shZEB2-SNU398 и NSC-SNU398. Клетки shZEB2 и NSC обрабатывали ресвератролом в концентрации 50, 100, 150 или 200 мкМ в течение 48 ч. Жизнеспособность клеток определяли с помощью WST-1, представлены результаты для временных точек 24 и 48 ч. Эксперименты повторяли 3 раза, стандартные отклонения (SD) показаны в виде перпендикулярных отрезков. ***р < 0.001, **р < 0.01, *р < 0.05 ‒ значительные изменения жизнеспособности обработанных клеток по сравнению с необработанными. ###p < 0.001 ‒ значительные различия между клонами клеток NSC и shZEB2.
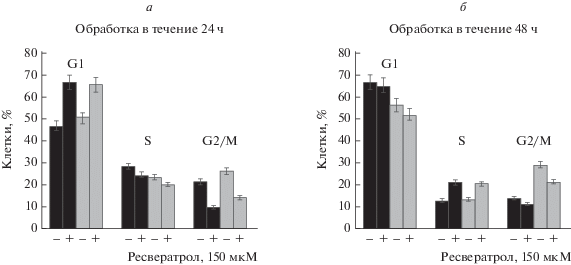
Согласно полученным нами результатам, ресвератрол в концентрации 150 мкМ значительно подавлял клеточный рост как shZEB2, так и контрольных клеток, поэтому именно эту концентрацию использовали для проверки влияния ресвератрола на прохождение клетками shZEB2 и контрольными клонами клеточного цикла через 24 и 48 ч. Как показано на рис. 3а, 24-часовая обработка ресвератролом приводит к остановке клеточного цикла в фазе G1 как в shZEB2 (66.8 против 47% в контроле), так и в контрольных клонах (65.5 против 50.4% в контроле). Интересно, что через 48 ч увеличилась задержка клеток shZEB2 в S-фазе клеточного цикла (21.6 против 13.3% в контроле) и в клонах клеток NSC (20.9 против 13.7% в контроле), но исчез эффект задержки в фазе G1, наблюдаемый через 24 ч (рис. 3б).
Рис. 3.
Влияние ресвератрола на прохождение клеточного цикла клетками с нокдауном ZEB2 и контрольными клонами HCC. а ‒ Клетки shZEB2 и NSC, обработанные 150 мкМ ресвератролом в течение 24 ч. б ‒ Клетки shZEB2 и NSC, обработанные 150 мкМ ресвератролом в течение 48 ч. Клеточный цикл и влияние ресвератрола на прохождение клеточного цикла анализировали с помощью проточной цитометрии. Столбцы ‒ процент клеток в фазах G1, S и G2/M. Эксперименты повторяли 3 раза, перпендикулярные отрезки показывают стандартные отклонения (SD). ◼ – shZEB2; ◻ – NSC.
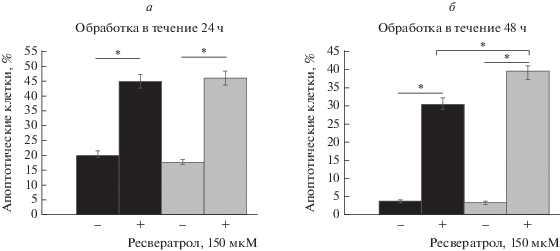
Затем мы оценили, приводило ли индуцированное ресвератролом подавление роста клеток переходом к апоптозу. Количество апоптотических клеток увеличилось более чем в 2 раза как среди клеток shZEB2 (44.9 против 20.4%), так и в контрольных клетках NSC (45.8 против 7.8%), получавших ресвератрол в течение 24 ч (р < 0.05) (рис. 4а). После 48 ч обработки ресвератролом обнаружено 7.5- и 11-кратное увеличение доли апоптотических клеток shZEB2 (30.6 против 4%) и NSC (39.3 против 3.5%) соответственно (р < 0.05). Поразительно, что после обработки ресвератролом в течение 48 ч уровень апоптоза в клонах с ZEB2-нокдауном был значительно ниже, чем в клетках NSC (30.6 против 39.3%; p < 0.05; рис. 4б). Наши результаты дают основания предполагать, с одной стороны, обратную корреляцию между экспрессией ZEB2 и ABCG2 в клетках, происходящих из HCC. С другой стороны, подавление активности ZEB2 повышает устойчивость клеток HCC к апоптозу, опосредованному ресвератролом.
Рис. 4.
Влияние подавления экспрессии ZEB2 на апоптотический ответ клеток HCC, обработанных ресвератролом. Клетки shZEB2 и NSC
обрабатывали 150 мкМ ресвератролом в течение 24 ч (a) и 48 ч (б). Столбцы ‒ процент апоптотических клеток, определенный методом проточной цитометрии
после 24 и 48 ч культивирования. Эксперименты повторяли 3 раза, стандартные отклонения
(SD) (*p < 0.05) представлены в виде перпендикулярных отрезков верхней части столбцов. ◼ –
shZEB2;  – NSC.
– NSC.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рак входит в число самых распространенных заболеваний, а HCC является второй по значимости причиной онкологической смертности. CSC, присутствующие в HCC, устойчивы к облучению и химиотерапии, что приводит к рецидивированию опухоли [6]. Нами изучены профили экспрессии генов ZEB2 и ABCG2 в CD133+/CD44+ CSC-подобной популяции клеточной линии HCC. Проанализировано также ZEB2-зависимое влияние ресвератрола на рост и апоптоз клеток HCC. CSC составляют сравнительно небольшую популяцию клеток в опухоли, они похожи на стволовые клетки по таким свойствам, как самообновление, плюрипотентность, способность к инициации опухоли и лекарственная устойчивость [23]. В настоящее время еще не установлено окончательно, какие именно маркеры клеточной поверхности следует использовать при выделении CSC, однако отмечено, что представленная в HCC субпопуляция клеток, положительных одновременно по двум антигенам – CD133 и CD44, обладает характеристиками CSC [19]. Фенотип CSC также связан с EMT и лекарственной устойчивостью, так как активация программы EMT вызывает устойчивость к химиотерапевтическим средствам и появление свойств CSC в опухолевых клетках [24]. В процессе EMT участвуют три основных семейства факторов транскрипции ‒ TWIST, SNAI и ZEB. У позвоночных семейство ZEB представлено всего двумя гомологами ‒ ZEB1 и ZEB2, которые имеют ДНК-связывающие домены типа цинкового пальца [25, 26]. Предыдущие исследования показали, что ингибирование экспрессии ZEB1/ZEB2 подавляет CSC-подобные свойства, включая способность к самообновлению, экспрессию маркеров “стволовости” и лекарственную устойчивость клеток рака головы и шеи [27]. В этом исследовании из клеточной линии PLC/PRF/5, происходящей из НСС, нами выделена популяция CD133+/CD44+ CSC-подобных клеток. Обнаружено, что в этих клетках снижена экспрессия ZEB1 и ZEB2, но повышена экспрессия гена устойчивости к лекарственным средствам ABCG2. ABC-транспортирующий белок ABCG2, который считается одним из маркеров CSC, играет критическую роль в выведении лекарственных средств из клетки [28]. Чтобы изучить влияние ZEB2 на лекарственную устойчивость нами получены клоны shZEB2-SNU398 клеточной линии HCC и контрольные клоны SNU398 с высокой эндогенной экспрессией ZEB2. Анализ экспрессии гена ABCG2 выявил повышение уровня транскрипта ABCG2 в клетках с нокдауном ZEB2, что подтверждает правильность наблюдения, сделанного нами ранее на HCC-субпопуляции клеток CD133+/CD44+, согласно которому ZEB2 и ABCG2 связаны по типу обратной корреляции.
Противоопухолевая активность ресвератрола протестирована на различных видах рака, включая HCC. Показано, что ресвератрол подавляет пролиферацию и жизнеспособность раковых клеток [3, 8, 29, 30]. В одном из немногих исследований, описывающих специфический механизм действия ресвератрола при HCC, показано, что этот препарат вызывает снижение уровней VEGF и HIF1α и уменьшает ангиогенез в процессе гепатоканцерогенеза [31]. Кроме того, недавно установлено, что ресвератрол ингибирует c-Met при HCC [3]. Чтобы изучить влияние ZEB2 на ответ клеток HCC на ресвератрол, мы подвергали клетки с ZEB2-нокдауном и контрольные клетки HCC воздействию различных концентраций ресвератрола. Полученные нами результаты оценки цитотоксичности согласуются с данными ранее проведенных исследований и показывают значительное подавление пролиферации клеток ресвератролом в концентрации 150 и 200 мкМ. Далее мы оценили влияние ресвератрола на прохождение клеточного цикла клетками SNU398 с экспрессией ZEB2 и без нее. Как показано ранее, в клетках нейробластомы ресвератрол вызывает задержку клеточного цикла в S-фазе в результате подавления p21 и повышения уровня циклина E [32]. Кроме того, инкубация клеток рака легкого с ресвератролом в течение 48 ч приводила к накоплению клеток в фазе G1 в результате снижения уровней циклина D1, CDK4 и CDK6 [33]. Проведенный нами анализ прохождения клеточного цикла в shZEB2 и в контрольных клетках, обработанных ресвератролом, выявил задержку в фазах G1 и S в зависимости от продолжительности воздействия. Через 24 ч после обработки мы обнаружили накопление клеток в G1-фазе; однако через 48 ч оба клона – shZEB2 и NSC – содержали больше клеток в S-фазе. Ранее показали, что ресвератрол может индуцировать апоптоз в большинстве типов опухолевых клеток [29, 34, 35]. С другой стороны, роль ZEB2 в реакции опухолевых клеток на лекарственные средства рассматривали на примере разных тканей. Так, в клеточных линиях рака желудка подавление ZEB2 приводило к повышенной чувствительности клеток к цисплатину [15]. Аналогичные результаты получены на устойчивой к лекарственным средствам популяции клеток рака предстательной железы ‒ обнаружены высокие уровни экспрессии ZEB1 и ZEB2 [36]. В связи с этим может возникнуть вопрос о влиянии химиотерапии на экспрессию белков ZEB. Фактически, в раковых клетках, обработанных ресвератролом, наблюдали и подавление, и активацию ZEB1 [20‒22]. Однако мы обнаружили, что обработка ресвератролом клеток NSC, экспрессирующих ZEB2, индуцировала существенно более высокий уровень апоптоза, чем в клетках с нокдауном ZEB2. Эти результаты дают основание полагать, что в клетках NSC экспрессия ZEB2 не модулируется ресвератролом, поскольку в противном случае ответ должен быть таким же, как в клетках shZEB2. Следовательно, в отличие от упомянутых исследований, в которых экспрессия ZEB2 положительно коррелировала с лекарственной устойчивостью, наши результаты показывают, что ингибирование ZEB2 делает клетки HCC более устойчивыми к ресвератролу. Это может быть связано с обратной корреляцией между ZEB2 и ABCG2 в CSC-подобных субпопуляциях и клеточных линиях, полученных из HCC.
Эффлюксные ABC-насосы, в частности ABCG2, играют жизненно важную роль в CSC. Показано, что ABCG2 является маркером CSC, вовлеченным в формирование множественной лекарственной устойчивости [10, 37‒39]. Интересно, что ингибирование ZEB2 приводит к повышению активности ABCG2 в клетках HCC. Поэтому можно предположить, что низкий апоптотический ответ на ресвератрол клеток, в которых подавлена активность ZEB2, зависит от увеличения экспрессии ABCG2.
В целом, нами показано, что в CSC-подобной популяции, выделенной из клеточных линий HCC, снижена экспрессия ZEB1 и ZEB2 и повышена экспрессия ABCG2. Кроме того, обнаружено повышение экспрессии ABCG2 в клетках с нокдауном ZEB2. Обработка ресвератролом клеточных клонов, полученных из HCC, ингибирует их пролиферацию независимо от экспрессии ZEB2. Однако клетки с ZEB2-нокдауном были более устойчивы к индукции апоптоза в ответ на обработку ресвератролом, чем клетки, экспрессирующие ZEB2. Эта лекарственная устойчивость может зависеть от повышенной экспрессии гена ABCG2, отвечающего за выведение лекарственных средств, на фоне подавления ZEB2.
Таким образом, нами получены данные, которые могут использоваться для изучения экспрессии ZEB2 при терапии HCC ресвератролом.
Работа поддержана грантом Совета по научно-техническим исследованиям Турции (111S484 to TY).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. (2018) Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 68(6), 394‒424. https://doi.org/10.3322/caac.21492
Bruix J., Sherman M. (2011) Management of hepatocellular carcinoma: an update. Hepatology. 53, 1020‒1022.
Gao F., Deng G., Liu W., Zhou K., Li M. (2017) Resveratrol suppresses human hepatocellular carcinoma via targeting HGF-c-Met signaling pathway. Oncol. Rep. 37, 1203‒1211.
Jiang Z., Chen K., Cheng L., Yan B., Qian W., Cao J., Li J., Wu E., Ma Q., Yang W. (2017) Resveratrol and cancer treatment: updates. Ann. N.Y. Acad. Sci. 1403, 59‒69.
Chikina A., Alexandrova A.Y. (2014) The cellular mechanisms and regulation of metastasis formation. Mol. Biol. 48, 165‒180.
Vinogradov S., Wei X. (2012) Cancer stem cells and drug resistance: the potential of nanomedicine. Nanomedicine. 7, 597‒615.
Yang M., Liu P., Huang P. (2016) Cancer stem cells, metabolism, and therapeutic significance. Tumour Biol. 37, 5735‒5742.
Seino M., Okada M., Shibuya K., Seino S., Suzuki S., Takeda H., Ohta T., Kurachi H., Kitanaka C. (2015) Differential contribution of ROS to resveratrol-induced cell death and loss of self-renewal capacity of ovarian cancer stem cells. Anticancer Res. 35, 85‒96.
Moitra K. (2015) Overcoming multidrug resistance in cancer stem cells. Biomed. Res. Int. 3, 1‒8.
Zhang G., Wang Z., Luo W., Jiao H., Wu J., Jiang C. (2013) Expression of potential cancer stem cell marker ABCG2 is associated with malignant behaviors of hepatocellular carcinoma. Gastroenterol. Res. Pract. 2013, 782581. https://doi.org/10.1155/2013/782581
Heerboth S., Housman G., Leary M., Longacre M., Byler S., Lapinska K., Willbanks A., Sarkar S. (2015) EMT and tumor metastasis. Clin. Transl. Med. 4, 6. https://doi.org/10.1186/s40169-015-0048-3
Mani S.A., Guo W., Liao M.-J., Eaton E.N., Ayyanan A., Zhou A.Y., Brooks M., Reinhard F., Zhang C.C., Shipitsin M., Campbell L.L., Polyak K., Brisken C., Yang J., Weinberg R.A. (2008) The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 133, 704‒715.
Singh A., Settleman J. (2010) EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer. Oncogene. 29(34), 4741‒4751.
Sánchez-Tilló E., Siles L., De Barrios O., Cuatrecasas M., Vaquero E.C., Castells A., Postigo A. (2011) Expanding roles of ZEB factors in tumorigenesis and tumor progression. Am. J. Cancer Res. 1, 897‒912.
Geng D., Kan X., Zhang W. (2017) Effect of ZEB2 silencing on cisplatin resistance in gastric cancer. Eur. Rev. Med. Pharmacol. Sci. 21, 1746‒1752.
Balcik-Ercin P., Cetin M., Yalim-Camci I., Odabas G., Tokay N., Sayan A.E., Yagci T. (2018) Genome-wide analysis of endogenously expressed ZEB2 binding sites reveals inverse correlations between ZEB2 and GalNAc-transferase GALNT3 in human tumors. Cell. Oncol. 1‒15.
Avci M.E., Konu O., Yagci T. (2008) Quantification of SLIT-ROBO transcripts in hepatocellular carcinoma reveals two groups of genes with coordinate expression. BMC Cancer. 8, 392.
Yagci T., Cetin M., Ercin P.B. (2017) Cancer stem cells in hepatocellular carcinoma. J. Gastrointest. Cancer. 48, 241‒245.
Zhu Z., Hao X., Yan M., Yao M., Ge C., Gu J., Li J. (2010) Cancer stem/progenitor cells are highly enriched in CD133+ CD44+ population in hepatocellular carcinoma. Int. J. Cancer. 126, 2067‒2078.
Chang Y.-C., Lin C.-W., Yu C.-C., Wang B.-Y., Huang Y.-H., Hsieh Y.-C., Kuo Y.-L., Chang W.-W. (2016) Resveratrol suppresses myofibroblast activity of human buccal mucosal fibroblasts through the epigenetic inhibition of ZEB1 expression. Oncotarget. 7, 12137‒12149.
Baribeau S., Chaudhry P., Parent S., Asselin É. (2014) Resveratrol inhibits cisplatin-induced epithelial-to-mesenchymal transition in ovarian cancer cell lines. PLoS One. 9, e86987.
Shen Y.-A., Lin C.-H., Chi W.-H., Wang C.-Y., Hsieh Y.-T., Wei Y.-H., Chen Y.-J. (2013) Resveratrol impedes the stemness, epithelial-mesenchymal transition, and metabolic reprogramming of cancer stem cells in nasopharyngeal carcinoma through p53 activation. Evid Based Complement Alternat. Med. 2013. 590393. https://doi.org/10.1155/2013/590393
Yamashita T., Wang X.W. (2013) Cancer stem cells in the development of liver cancer. J. Clin. Invest. 123, 1911‒1918.
Shibue T., Weinberg R.A. (2017) EMT, CSCs, and drug resistance: the mechanistic link and clinical implications. Nat. Rev. Clin. Oncol. 14, 611‒629.
Ansieau S., Collin G., Hill L. (2014) EMT or EMT-promoting transcription factors, where to focus the light? Front. Oncol. 4, 353. https://doi.org/10.3389/fonc.2014.00353
Vandewalle C., Van Roy F., Berx G. (2009) The role of the ZEB family of transcription factors in development and disease. Cell. Mol. Life Sci. 66, 773‒787.
Chu P.-Y., Hu F.-W., Yu C.-C., Tsai L.-L., Yu C.-H., Wu B.-C., Chen Y.-W., Huang P.-I., Lo W.-L. (2013) Epithelial–mesenchymal transition transcription factor ZEB1/ZEB2 co-expression predicts poor prognosis and maintains tumor-initiating properties in head and neck cancer. Oral Oncol. 49, 34‒41.
Hu J., Li J., Yue X., Wang J., Liu J., Sun L., Kong D. (2017) Expression of the cancer stem cell markers ABCG2 and OCT-4 in right-sided colon cancer predicts recurrence and poor outcomes. Oncotarget. 8, 28463‒28470.
Joe A.K., Liu H., Suzui M., Vural M.E., Xiao D., Weinstein I. B. (2002) Resveratrol induces growth inhibition, S-phase arrest, apoptosis, and changes in biomarker expression in several human cancer cell lines. Clin. Cancer Res. 8, 893‒903.
Harati K., Slodnik P., Chromik A.M., Goertz O., Hirsch T., Kapalschinski N., Klein-Hitpass L., Kolbenschlag J., Uhl W., Lehnhardt M., Daigeler A. (2015) Resveratrol induces apoptosis and alters gene expression in human fibrosarcoma cells. Anticancer Res. 35, 767‒774.
Yu H.-B., Zhang H.-F., Zhang X., Li D.-Y., Xue H.-Z., Pan C.-E., Zhao S.-H. (2010) Resveratrol inhibits VEGF expression of human hepatocellular carcinoma cells through a NF-kappa B-mediated mechanism. Hepatogastroenterology. 57, 1241‒1246.
Chen Y., Tseng S.-H., Lai H.-S., Chen W.-J. (2004) Resveratrol-induced cellular apoptosis and cell cycle arrest in neuroblastoma cells and antitumor effects on neuroblastoma in mice. Surgery. 136, 57‒66.
Yuan L., Zhang Y., Xia J., Liu B., Zhang Q., Liu J., Luo L., Peng Z., Song Z., Zhu R. (2015) Resveratrol induces cell cycle arrest via a p53-independent pathway in A549 cells. Mol. Med. Rep. 11, 2459‒2464.
Clément M.-V., Hirpara J.L., Chawdhury S.-H., Pervaiz S. (1998) Chemopreventive agent resveratrol, a natural product derived from grapes, triggers CD95 signaling-dependent apoptosis in human tumor cells. Blood. 92, 996‒1002.
Kuo P.-L., Chiang L.-C., Lin C.-C. (2002) Resveratrol-induced apoptosis is mediated by p53-dependent pathway in Hep G2 cells. Life Sci. 72, 23‒34.
Hanrahan K., O’neill A., Prencipe M., Bugler J., Murphy L., Fabre A., Puhr M., Culig Z., Murphy K., Watson R.W. (2017) The role of epithelial–mesenchymal transition drivers ZEB1 and ZEB2 in mediating docetaxel‒resistant prostate cancer. Mol. Oncol. 11, 251‒265.
Ding X.-W., Wu J.-H., Jiang C.-P. (2010) ABCG2: a potential marker of stem cells and novel target in stem cell and cancer therapy. Life Sci. 86, 631‒637.
Zhou S., Schuetz J.D., Bunting K.D., Colapietro A.-M., Sampath J., Morris J.J., Lagutina I., Grosveld G.C., Osawa M., Nakauchi H., Sorrentino B.P. (2001) The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat. Med. 7, 1028‒1034.
Mo W., Zhang J.-T. (2012) Human ABCG2: structure, function, and its role in multidrug resistance. Int. J. Biochem. Mol. Biol. 3, 1‒27.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


