Молекулярная биология, 2020, T. 54, № 1, стр. 103-113
Механизмы участия рецептора урокиназы в направленном росте аксонов
П. С. Климович a, b, Е. В. Семина a, b, *
a Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии Министерства здравоохранения Российской Федерации
121552 Москва, Россия
b Факультет фундаментальной медицины Московского государственного университета им. М.В. Ломоносова
119192 Москва, Россия
* E-mail: e-semina@yandex.ru
Поступила в редакцию 14.12.2018
После доработки 12.03.2019
Принята к публикации 20.03.2019
Аннотация
Деградация внеклеточного матрикса играет важную роль в морфогенезе, ангио- и нейрогенезе, заживлении ран, воспалении, канцерогенезе и других процессах. Рецептор урокиназы (uPAR) является важным участником процессов, регулирующих внеклеточный протеолиз, адгезию клеток к внеклеточному матриксу, их миграцию по градиенту хемокинов, пролиферацию и выживаемость с участием рецепторов факторов роста. Отсутствие трансмембранного и цитоплазматического доменов делает uPAR высокоподвижным на мембране клеток и способствует привлечению латеральных партнеров для реализации его сигнальных эффектов. Показано участие рецептора fMLP-хемокина FPRL в регуляции uPAR-зависимого хемотаксиса. Более того, миграция нейральных предшественников и их созревание в нейроны при формировании структур головного мозга в эмбриогенезе также регулируется рецепторами хемокинов. Известно, что uPAR участвует в процессах морфогенеза, однако роль взаимодействия uPAR с рецепторами хемокинов в навигационных процессах, опосредующих рост и регенерацию нервов, изучена недостаточно. В настоящей работе впервые показано, что uPAR регулирует траекторию роста аксонов, и этот эффект не зависит от урокиназы. Установлено также, что в основе регуляции направленного роста аксонов при их регенерации лежит взаимодействие uPAR с рецептором хемокинов FPRL1. Эти данные выявляют новые механизмы участия урокиназной системы в регуляции направленного роста аксонов.
ВВЕДЕНИЕ
Урокиназная система ‒ ключевое звено процессов морфогенеза, ангио- и нейрогенеза, заживления ран, а также воспаления и канцерогенеза. Эта система регулирует не только внеклеточный протеолиз, но и адгезию клеток к внеклеточному матриксу (ВКМ), миграцию по градиенту урокиназы (uPA) и хемокинов, а также пролиферацию и выживаемость клеток с участием рецепторов факторов роста [1]. Рецептор uPA (uPAR) участвует во всех этих процессах, которые могут осуществляться также в отсутствие протеолитически активной uPA [2]. Помимо варианта uPAR, заякоренного в мембране через гликозилфосфатидилинозит (ГФИ), существует, как минимум, еще одна “активная” форма uPAR – растворимая форма, suPAR, обнаруженная во многих биологических жидкостях организма. Обе формы ‒ и ГФИ-заякоренная, и suPAR, могут подвергаться ограниченному протеолизу с образованием растворимых N-концевых фрагментов [3]. Наличие такого якоря объясняет многие уникальные функции uPAR. Во-первых, ГФИ делает мембранную форму uPAR высокоподвижной в липидных рафтах, где осуществляются многие его сигнальные функции. Во-вторых, отсутствие трансмембранного и цитоплазматического доменов предполагает участие мембранных партнеров в реализации сигнальных эффектов uPAR [4]. И, наконец, уровень экспрессии мембранного uPAR и его растворимых форм может регулироваться не только протеазами, но и специфичными фосфолипазами (C и D) [3].
С тех пор, как в 1995 году uPAR впервые был обнаружен как одноцепочечный трехдоменный пептид, взаимодействующий с интегринами и Src-киназами в липидных рафтах, дальнейшее изучение функций uPAR выявило спектр процессов, в которых uPAR играет важную, если не главную, роль [5, 6]. При изучении мембранных партнеров, вовлеченных в uPAR-зависимые процессы в клетках, особое внимание привлекают интегрины, рецептор fMLP-хемокина FPRL и рецептор эпидермального фактора роста EGFR [4, 7]. Однако мало известно о роли взаимодействия uPAR с другими лигандами в процессах, связанных с аксональным наведением, дифференцировкой и выживаемостью нейронов. С одной стороны, uPAR взаимодействует с интегринами, рецептором FPRL и тирозинкиназой EGFR в различных типах клеток (не в нервной ткани), где такое взаимодействие регулирует направленную миграцию (хемотаксис), пролиферацию и выживаемость/апоптоз [8‒11]. С другой стороны, опубликованы данные о том, что совместное действие uPAR, интегринов, FPRL или EGFR может регулировать как рост и регенерацию, так и дифференцировку и выживаемость нейронов [12‒15]. Однако механизмы реализации uPAR-зависимых эффектов в нейронах с участием этих рецепторов не установлены. Таким образом, в нашей работе изучена навигационная роль урокиназной системы при росте аксонов, а также возможное взаимодействие uPAR c рецептором FPRL1 на мембране конуса растущего аксона при его регенерации. Изучение участия урокиназной системы в этих процессах позволит глубже понять ее роль в морфогенезе нервной ткани, регенерации нервов, а также при развитии патологических состояний.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторные животные. Мышей содержали в сертифицированном SPF виварии на территории МГУ. Манипуляции с животными проводили в соответствии с требованиями приказа № 267 МЗ РФ “Об утверждении Правил лабораторной практики” (19.06.2003 г. № 4809). Дизайн исследования одобрен местным этическим комитетом в соответствии с внутренними требованиями, утвержденными Комиссией по биоэтике факультета фундаментальной медицины МГУ им. М.В. Ломоносова. Использовали мышей-самцов линии C57/Bl6 в возрасте 4‒5 недель, у которых отсутствовали гены uPA (uPA–/–) и uPAR (uPAR–/–). Контролем служили мыши дикого типа (WT). Перед выделением спинальных ганглиев (СГ) животных летально анестезировали изофлурановым наркозом IsoFlo® (USP) в газовой камере.
Модель трехмерной эксплантной культуры спинального ганглия мыши в Матригеле. Методика трехмерной эксплантной культуры СГ мыши в Матригеле описана нами ранее [16]. Для выделения СГ мышей летально анестезировали и декапитировали, фиксировали на операционном столике, операционное поле дезинфицировали 70%-ным раствором этанола, вскрывали кожу и удаляли мышцы. СГ извлекали в асептических условиях под стереомикроскопом Olympus SZ Stereo, используя хирургические инструменты для мелких лабораторных животных. Выделенные СГ сразу помещали в чашку Петри, содержащую стерильный буфер Хенкса, и в условиях культурального ламинара переносили в 8-луночные планшеты (Lab-Tek®, cat#155411), покрывали каплей (100 мкл) Матригеля (MatrigelTM “BD Biosciences”, США). После полимеризации Матригеля образцы покрывали культуральной средой RPMI и культивировали в клеточном инкубаторе при 37°С и 5% СО2.
В зависимости от условий эксперимента для стимуляции роста нейритов клетки НЕК293, трансфицированные плазмидами, содержащими кДНК uPA или uPAR мыши, или нетрансфицированные HEK293 в качестве контроля, смешивали со 100 мкл Матригеля и помещали в противоположную сторону от СГ для создания градиента концентрации исследуемых белков (рис. 1). Результаты документировали с использованием стереомикроскопа Olympus SZX16 на 7-е сутки после высадки эксплантов. Изображения обрабатывали (определяли площади СГ и площади отрастания нейритов из СГ) с использованием программы автоматического анализа изображений (ImageJ, Research Services Branch). Для подсчета площадь Матригеля с ганглием и нейритами делили на две части так, чтобы в одной части был Матригель с клетками, в другой – контрольная сторона Матригеля без клеток (рис. 2). Для обсчета результатов площадь СГ с регенерирующими от него нейритами нормировали на площадь CГ. Анализировали результаты, полученные на СГ трех мышей каждой группы (uPA–/– и WT). Представлены результаты трех независимых экспериментов.
Рис. 1.
Трехмерная модель эксплантов спинальных ганглиев мыши в Матригеле для изучения навигационных свойств урокиназной системы ex vivo.
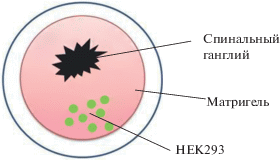
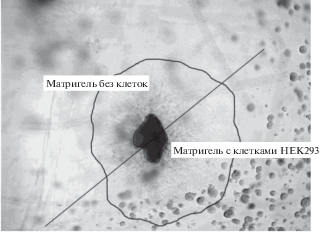
Рис. 2.
Схема определения площади роста нейритов. Площадь Матригеля с ганглием и нейритами условно делили на две части так, чтобы в одной части был Матригель с клетками HEK293, в другой – контрольная сторона Матригеля без клеток.
Хемотактические свойства uPAR и его взаимодействия с FPRL1 при регенерации нейритов изучали с использованием СГ мышей uPAR–/–, чтобы исключить влияние эндогенного uPAR. СГ культивировали в условиях, описанных выше. В зависимости от условий эксперимента вносили растворимую форму uPAR (suPAR, Кат. № MBS135764) в концентрации 1 нМ, коклюшный токсин (Pertussis toxin, PT, “Sigma Aldrich” США, Кат. № P7208), блокирующий Gαi-субъединицу G-белка, ассоциированного с FPRL1 [31], в концентрации 100 мкМ или смесь suPAR с PT. Вещества растворяли в дополнительной капле Матригеля и наносили по разные стороны от СГ после его полимеризации в основном Матригеле. Динамику и направление роста нейритов из СГ документировали на 4-е сутки с использованием фазово-контрастного микроскопа Leica AF6000. Среднюю длину нейрита определяли с использованием программы автоматического анализа изображений (ImageJ, Research Services Branch). Для подсчета изображения СГ условно делили на две части в зависимости от внесенных в Матригель добавок; на каждой половине анализировали среднюю длину нейрита (выраженную в условных единицах), растущего в сторону добавок. Измеряли длину не менее 20 нейритов с каждой стороны СГ. Представлены результаты четырех независимых экспериментов.
Трансфекция клеток HEK293 (ATCC®CRL-1573TM). кДНК uPA трансфицировали c использованием вектора pcDNA3.1 (“Life Technologies”, США), кДНК uPAR ‒ вектора pN1. Получение кДНК и дизайн векторов описаны нами ранее [17]. Клетки культивировали в стандартной среде DMEM с высокой концентрацией глюкозы (“Hyclone”, США) с 10%-ной фетальной бычьей сывороткой FBS (“Hyclone”) и раствором антибиотика-антимикотика (“Gibco”, США). Tрансфекцию проводили с помощью Lipofectamine 2000 (“Life Technologies”) в соответствии с протоколом производителя. Клетки культивировали в селективной среде с антибиотиком G418 не менее 4 недель. Известно, что клетки HEK293 не экспрессируют uPA и uPAR. Более того, uPA мыши не взаимодействует с uPAR человека [18], поэтому можно предполагать, что наблюдаемые в экспериментах эффекты опосредованы именно uPA и uPAR мыши, которые экспрессируются клетками HEK293 и взаимодействуют с нейритами нейронов мыши.
Анализ секреции uPA и uPAR клетками НЕК293 после трансфекции. Мы предполагаем, что uPA и uPAR действуют на нейриты в виде растворимых форм, поэтому содержание uPA и uPAR мыши в среде культивирования НЕК293 до и после трансфекции было проанализировано методом ELISA с использованием коммерческих наборов фирм “Cell Sciences” (Mouse uPA Antigen ELISA Кат. № CS380A) и “R&D Systems” (Mouse uPAR DuoSet ELISA Кат. № DY531) в соответствии с протоколом производителя. Конечная концентрация uPA и uPAR в кондиционированных средах составляла 20 и 80 нг/мл соответственно.
Получение первичной культуры нейронов спинальных ганглиев. Для получения первичной культуры нейронов СГ мыши, выделенные в стерильных условиях, как описано выше, помещали в раствор коллагеназы (1 мг/мл, Collagenase type I, 285 U/mg, 17100-017, “Gibco”, США), приготовленный на буфере Хенкса, и инкубировали в течение 90 мин при 37°С. Образцы гомогенизировали инсулиновым шприцем, центрифугировали, удаляли раствор коллагеназы и добавляли 1 мл укомплектованной среды DMEM. Образцы пипетировали для дезагрегации клеток в суспензии и наносили на стекла, предварительно покрытые раствором L-полилизина в концентрации 10 мкг/мл (Ф069, “Панэко”, Россия). Клетки оставляли на ночь в инкубаторе до полной адгезии и культивировали далее в среде для роста нейронов Neuro Basal Media с добавками B27 (“Gibco”) в течение 7 дней для полноценной адгезии нейронов и роста нейритов.
Иммунофлуоресцентное окрашивание нейронов и конфокальная микроскопия. Образцы первичной культуры нейронов промывали раствором фосфатно-солевого буфера (PBS). Далее клетки фиксировали 4%-ным раствором параформальдегида в течение 10 мин, после фиксации клетки отмывали в PBS. Чтобы блокировать неспецифическое связывание, клетки обрабатывали 10%-ным раствором сыворотки донора вторых антител, приготовленном на 5%-ном бычьем сывороточном альбумине (БСА) (“Sigma Аldrich”, США) в PBS в течение 1 ч. После отмывки образцы инкубировали с первичными антителами кролика против uPAR мыши (“Abcam”, Великобритания) и рецептора хемокинов FPRL1 (“Abcam”) в течение ночи. После трех отмывок в PBS образцы инкубировали со вторыми антителами, конъюгированными с флуорохромами AlexaFluor®594 или AlexaFluor®488 (разведение 1 : 500, “Molecular Probes”, США) в течение 1 ч. Для визуализации ядер образцы докрашивали DAPI (“Sigma Аldrich”, 1 : 10 000). После отмывки в PBS образцы заключали в нефлуоресцирующую водную среду Aqua Poly Mount (“Polysciences”, США).
Препараты фотографировали с помощью конфокального микроскопа Leica (TCS SP5, Leica “LeicaMicrosystems”, Германия). DAPI, AlexaFluor®488 и AlexaFluor®594 последовательно возбуждали лазерами с длиной волны 405 и 488, 594 нм соответственно. Все изображения получали при одинаковых настройках микроскопа и хранили в виде файлов TIFF в программном обеспечении Leica LAS, а затем обрабатывали в Photoshop (версия CS5, Adobe).
Статистический анализ. Статистический анализ проводили с использованием программного обеспечения SigmaPlot 11.0. Нормальность данных анализировали с помощью теста Шапиро‒Вилка. Данные, полученные в каждой экспериментальной группе, сравнивали попарно, используя тест ANOVA и Holm‒Sidak. При сравнении двух групп использовали t-тест Стьюдента. Данные представлены как среднее ± стандартное отклонение. Статистически значимым различие считали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Сверхэкспресcия uPAR приводит к увеличению площади роста нейритов
В экспериментах использовали описанную нами ранее трехмерную эксплантную модель СГ мыши в Матригеле ex vivo [16]. СГ мышей uPA–/– и WT высаживали в каплю Матригеля. Перед полимеризацией Матригеля в противоположную сторону от СГ вносили нетрансфицированные клетки НЕК293 (рис. 2). В качестве контроля использовали Матригель без добавок. Общую площадь ганглия с отросшими из него нейритами нормировали на площадь СГ (относительная площадь).
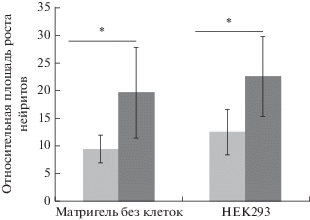
Площадь нейритов, отрастающих из СГ в Матригель, у мышей uPA–/– была статистически значимо больше, чем у мышей WT (uPA–/– 19.5 ± 8.2 отн. ед.; WT 9.32 ± 2.6 отн. ед., р = 0.01). Также обнаружено, что у мышей uPA–/– при введении в Матригель нетрансфицированных клеток НЕК293 нейриты отрастают лучше, чем у мышей WT: площадь нейритов, отрастающих от СГ uPA–/– мышей значимо больше площади нейритов, отрастающих от СГ мышей WT (uPA–/– 22.45 ± 7.2 отн. ед.; WT 12.45 ± 4.1 отн. ед., р < 0.001) (рис. 3, 4).
Рис. 3.
Спинальные ганглии мышей WT и uPA–/–, помещенные в каплю Матригеля. Белыми стрелками показаны клетки HEK293, предварительно помещенные в Матригель.
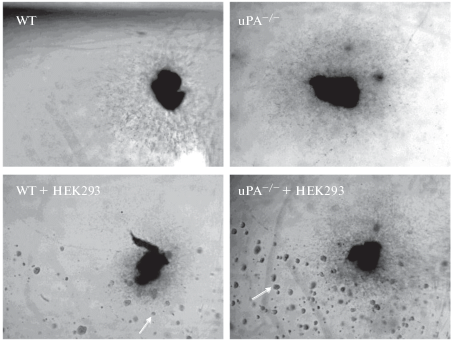
Рис. 4.
Относительная площадь роста нейритов из спинальных ганглиев (СГ) мышей WT и uPA–/–. В отсутствие добавок (Матригель без клеток) площадь роста нейритов из СГ в Матригель у мышей uPA–/– значимо больше, чем у мышей WT (р = 0.01). При введении нетрансфицированных клеток НЕК293 в Матригель (HEK293) площадь нейритов, отрастающих от СГ мышей uPA–/–, больше площади нейритов, отрастающих от WT СГ. Данные представлены как среднее ± стандартное отклонение, р <0.05. Светло серые столбики – WT, темно-серые – uPA–/–.
uPAR регулирует траекторию роста нейритов в отсутствие uPA
Далее мы оценили направление роста нейритов СГ мышей WT и uPA–/– в Матригеле, в который дополнительно вводили клетки НЕК293, стабильно экспрессирующие растворимые формы uPA и uPAR. Оказалось, что uPAR проявляет навигационные свойства даже в отсутствие своего лиганда ‒ uPA (рис. 5). Введение клеток HEK293, трансфицированных uPA (НЕК293-uPA), в группы WT и uPA–/– стимулировало рост нейритов именно в область локализации uPA по градиенту концентрации: площадь роста нейритов в направлении клеток НЕК293-uPA, экспрессирующих uPA, у мышей WT составила 17.5 ± 0.9 отн. ед., а площадь роста нейритов в противоположную сторону ‒ 9.4 ± ± 0.55 отн. ед., р < 0.001. У мышей uPA–/– площадь роста нейритов в сторону клеток НЕК293-uPA, экспрессирующих uPA, составила 17.7 ± 0.08 отн. ед., в противоположную ‒ 14.2 ± 0.68 отн. ед., р < < 0.05 (рис. 6).
Рис. 5.
Спинальные ганглии мышей WT и uPA–/–, помещенные в каплю Матригеля. Справа от спинальных ганглиев находятся клетки HEK293, секретирующие uPAR (HEK293-uPAR, верхняя панель) и uPA (HEK293-uPA, нижняя панель).
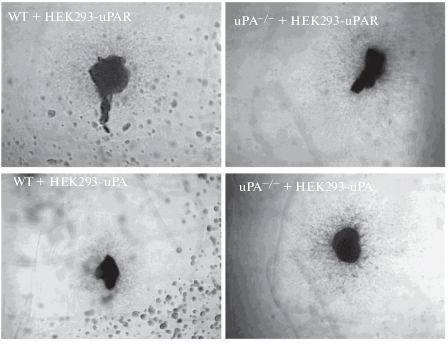
Рис. 6.
Относительная площадь роста нейритов из спинальных ганглиев мышей WT и uPA–/– по градиенту концентрации uPA и uPAR. Клетки HEK293, трансфицированные uPA и uPAR, стимулируют рост нейритов в область их локализации по градиенту концентрации. Данные представлены как среднее ± стандартное отклонение, р < 0.05.
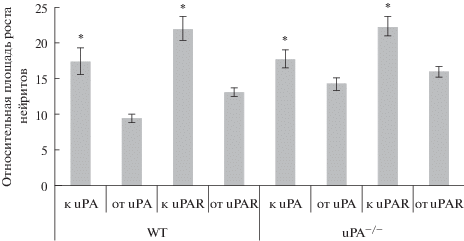
Введение в Матригель клеток HEK293, трансфицированных uPAR (НЕК293-uPAR), приводило к увеличению площади нейритов, растущих в сторону этих клеток, у мышей WT и uPA–/– (у WT ‒ 21.9 ± 1.8 отн. ед. к uPAR и 15.8 ± 2.9 отн. ед. от uPAR, р < 0.001; у мышей uPA–/– ‒ 22.3 ± 0.89 отн. ед. к uPAR и 13 ± 1.1 отн. ед. от uPAR, р < 0.001) (рис. 6).
uPAR солокализуется с хемокиновым рецептором FPRL1 в нейронах
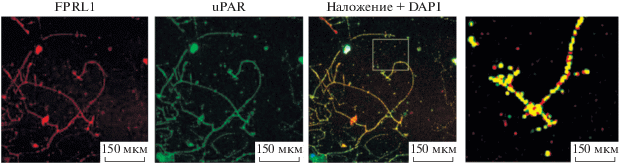
Чтобы выяснить возможный механизм участия uPAR в регуляции направленного роста аксонов, мы выделили первичную культуру нейронов из СГ мышей WT и c помощью иммунофлуоресцентного окрашивания оценили экспрессию uPAR и рецептора хемокинов FPRL1. Методом конфокальной микроскопии обнаружено, что uPAR и FPRL1 экспрессируются на конусе роста аксонов и в телах нейронов, выделенных из СГ. Более того, выявлена солокализация uPAR и рецептора FPRL1 как в конусах роста, так и в телах нейронов (рис. 7).
Рис. 7.
Двойное иммунофлуоресцентное окрашивание первичной культуры нейронов мыши антителами к uPAR (зеленая флуоресценция) и FPRL1 (красная флуоресценция). uPAR и рецептор хемокина FPRL1 экспрессируются в нейронах спинального ганглия, включая конус роста аксонов. Обнаружена значительная солокализация uPAR и FPRL1 (желтая флуоресценция). На врезке справа увеличенное изображение конуса роста аксона.
suPAR обладает хемотактическими свойствами
Способность suPAR стимулировать рост нейритов изучали с использованием рецептора хемокинов FPRL1 и СГ мышей uPAR–/–, чтобы исключить эффекты эндогенного uPAR. СГ высаживали в Матригель, после полимеризации слева и справа от СГ добавляли капли Матригеля, в который дополнительно вносили suPAR (1 нМ), PT (100 мкМ), сигналинг от FPRL1, смесь PT и suPAR. Опыт проводили в четырех вариантах: группа 1 ‒ Матригель с добавлением suPAR; группа 2 – Матригель с PT; группа 3 – Матригель с PT с одной стороны и suPAR с другой; группа 4 – смесь PT c suPAR с одной стороны и suPAR с другой. Далее сравнивали между собой среднюю длину нейритов, растущих из каждой стороны СГ, в зависимости от вносимой добавки.
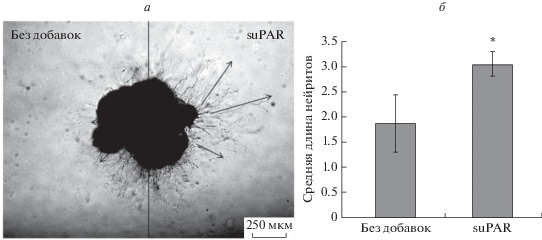
Оказалось, что средняя длина нейритов, растущих в сторону suPAR, в группе 1 значимо превышала среднюю длину нейритов, растущих без вносимых добавок: 3.05 ± 0.25 против 1.87 ± 0.57 усл. ед., р < 0.05 (рис. 8).
Рис. 8.
Микрофотография спинального ганглия uPAR–/–, помещенного в каплю Матригеля (а), и средняя длина нейритов, растущих из спинального ганглия по градиенту концентрации suPAR (б). а ‒ Справа нанесена капля Матригеля с suPAR; слева ‒ контрольная сторона без добавок. Стрелками обозначено направление роста нейритов. Данные представлены как среднее ± стандартное отклонение, *р < 0.05.
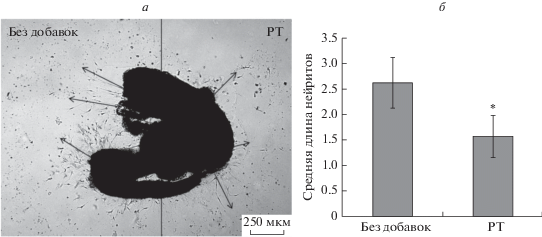
Средняя длина нейритов, растущих в сторону PT (группа 2), была значительно меньше, чем у нейритов, растущих в сторону Матригеля без добавок: 1.57 ± 0.42 против 2.63 ± 0.49 усл. ед., р < < 0.05 (рис. 9). Эти данные подтверждают ранее высказанное нами предположение об участии рецептора хемокинов FPRL1 в регуляции направленного роста аксонов.
Рис. 9.
Микрофотография спинального ганглия uPAR–/–, помещенного в каплю Матригеля (а), и средняя длина нейритов, растущих из спинального ганглия по градиенту концентрации коклюшного токсина (PT), по сравнению с контрольной стороной (б). а ‒ Справа от спинального ганглия нанесена капля Матригеля с коклюшным токсином; слева ‒ контрольная сторона без добавок. Стрелками обозначено направление роста нейритов. Данные представлены как среднее ± стандартное отклонение, * р < 0.05.
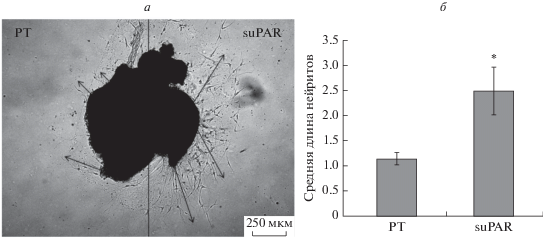
Оказалось, что в группе 3 средняя длина нейритов, растущих в сторону suPAR, была значимо больше, чем нейритов, растущих в сторону PT: 2.5 ± 0.47 против 1.14 ± 0.12 усл. ед., р < 0.05 (рис. 10).
Рис. 10.
Микрофотография спинального ганглия uPAR–/–, помещенного в каплю Матригеля (а), и средняя длина нейритов, растущих из спинального ганглия по градиенту концентрации suPAR и коклюшного токсина (PT) (б). а ‒ Справа от спинального ганглия нанесена капля Матригеля с suPAR, слева ‒ PT. Стрелками обозначено направление роста нейритов. Данные представлены как среднее ± стандартное отклонение, *р < 0.05.
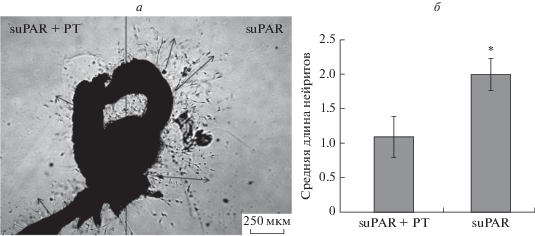
В группе 4 совместное введение suPAR и PT приводит к значимому уменьшению длины нейритов по сравнению с добавлением только suPAR (1.1 ± 0.3 против 2.0 ± 0.22 усл. ед., p < 0.05) (рис. 11). Эти данные свидетельствуют о том, что блокирование рецептора FPRL1 снижает стимулирующее воздействие suPAR на рост нейритов. Так как мы показали совместную локализацию uPAR и FPRL1 на конусе растущего аксона, то в сумме эти данные говорят о том, что хемотактические эффекты suPAR реализуются через рецептор FPRL1.
Рис. 11.
Микрофотография спинального ганглия uPAR–/–, помещенного в каплю Матригеля (а), и средняя длина нейритов, растущих из спинального ганглия по градиенту концентрации suPAR, по сравнению со смесью коклюшного токсина (PT) и suPAR (б). а ‒ Справа нанесена капля Матригеля с suPAR, слева – смесь PT и suPAR. Стрелками обозначено направление роста нейритов. Данные представлены как среднее ± стандартное отклонение, *р < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Появившиеся за последние несколько лет данные о роли урокиназной системы в процессах морфогенеза и регенерации тканей и органов предполагают ее участие не только в регуляции протеолиза и деградации ВКМ в направлении роста сосудов и нервов, но и в навигационных процессах, регулирующих траекторию роста аксонов и нервов [12‒14, 17, 24]. Известно, что в развивающейся нервной системе uPA и uPAR экспрессируются в эмбриогенезе в мигрирующих клетках нервного гребня, гранулярных клетках мозжечка, астроцитах, симпатических и сенсорных нейронах и регулируют миграцию, пролиферацию, выживаемость нервных клеток [25‒27]. Полученные нами ранее на эксплантной модели CГ данные свидетельствуют о том, что uPAR, не только стимулирует рост аксонов и миграцию нейральных клеток, но также регулирует траекторию роста аксонов и их ветвление. При этом блокирование uPAR специфичными антителами нарушает траекторию роста аксонов и приводит к появлению аберрантных структур [17].
Мы более детально изучили влияние урокиназной системы на направление роста нейритов. Используя эксплантную модель, мы показали, что площадь роста нейритов у мышей uPA–/– больше, чем у мышей WT. По-видимому, этот эффект объясняется более высоким уровнем экспрессии uPAR в СГ мышей uPA–/–, который существенно стимулирует рост нейритов даже в отсутствие uPA [17]. Возможно также, что отсутствие uPA в ганглиях мышей uPA–/– стабилизирует uPAR на мембранах клеток, так как известно, что комплекс uPA/uPAR быстро удаляется с поверхности клеток путем эндоцитоза [19, 20]. В данном исследовании введение в Матригель нетрансфицированных клеток HEK293 стимулирует прорастание аксонов из СГ в Матригель, и этот эффект у мышей uPA–/– выражен в большей степени, чем у мышей WT. Известно, что клетки HEK293 секретируют факторы роста и цитокины, стимулирующие рост аксонов, пролиферацию и миграцию нейронов. В число этих факторов входят инсулиноподобный фактор роста 1 (ИФР-1), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), фактор роста гепатоцитов, тромбоцитарный фактор роста. Клетки HEK293 обладают также нейропротекторными свойствами, которые реализуются с участием PI3K-сигнального пути, связывания свободных радикалов, а также путем модуляции экспрессии субъединиц рецепторов каиновой кислоты (каинатный рецептор KAR) в нейронах [28]. Таким образом, для исключения собственных нейропротекторных и стимулирующих нейритогенез свойств клеток HEK293 в качестве контроля мы использовали нетрансфицированные клетки. Данные о способности uPAR стимулировать рост нейритов и о том, что uPAR выполняет некоторые функции без участия uPA, согласуются с результатами, полученными нами ранее на клеточной модели in vitro, согласно которым сверхэкспрессия uPAR в клетках Neuro2a стимулирует рост нейритов даже в отсутствие uPA в среде культивирования [17].
Нами показано, что рекомбинантные uPA и uPAR стимулируют рост нейритов из эксплантов СГ в Матригель по градиенту концентрации. Такой градиент мы создали, вводя в Матригель клетки HEK293, которые стабильно экспрессируют плазмиды, содержащие кДНК uPA и uPAR мыши. Известно, что uPA стимулирует хемотаксис гладкомышечных клеток за счет связывания с uPAR на мембране [29]. Более того, uPA способна стимулировать нейритогенез и миграцию постмитотических нейронов в развивающейся ЦНС куриного эмбриона, причем скорость роста нейритов пропорциональна концентрации uPA в среде. Основным медиатором этого эффекта также было связывание uPA с uPAR. Экспрессия uPAR обнаружена на поверхности нейронов, особенно на конусах роста нейритов. При этом в развивающейся ЦНС максимальная экспрессия uPAR выявлена в мигрирующих постмитотических нейронах, а также в клетках, в которых протекал нейритогенез [14]. Показано, что растворимая форма suPAR стимулирует хемотаксис клеток в отсутствие uPA [19]. Подобный эффект мы наблюдали у мышей uPA–/– ‒ uPAR стимулировал рост нейритов из СГ в отсутствие uPA. Площадь роста нейритов в обеих группах животных была статистически значимо больше при стимуляции uPAR, нежели uPA.
Известно, что uPAR не имеет трансмембранного и внутриклеточного доменов ‒ его C-конец ковалентно связан с плазматической мембраной за счет ГФИ-якоря. Это делает возможным взаимодействие uPAR с различными трансмембранными рецепторами и передачу сигнала внутриклеточно, а также для потенцирования сигнальных эффектов мембранных партнеров [4]. К наиболее изученным латеральным лигандам, которые могут опосредовать uPAR-зависимый хемотаксис, относятся рецепторы хемокинов – трансмембранные семидоменные рецепторы, ассоциированные с G-белками [9]. К этому семейству рецепторов принадлежит FPRL1, который связывается с N-формилированными пептидными лигандами, например с fMLP [30]. uPAR состоит из трех LU-доменов (DI, DII, DIII), которые соединяются двумя короткими линкерными последовательностями [4]. Эти три внеклеточных домена uPAR образуют глобулярную структуру, формирующую доступные сайты для латеральных взаимодействий. За связывание с FPRL1 в молекуле uPAR отвечает участок линкерной области между доменами D2‒D3 [31]. На клетках моноцитарной линии THP-1 человека показано, что связывание uPAR с FPRL1 активирует этот семидоменный рецептор и стимулирует хемотаксис по градиенту suPAR [30]. Экспрессия этого рецептора хемокинов на нейронах была показана ранее [21]. При латеральном взаимодействии uPAR с FPRL1 запускается мобилизация Ca2+ из депо и активация Erk-киназ [31]. Методом иммунофлуоресцентного окрашивания первичной культуры нейронов с последующей конфокальной микроскопией нами показано, что uPAR экспрессируется и колокализуется с рецептором хемокинов FPRL1 как в теле нейронов, так и на конусе роста. Нами впервые показано, что suPAR обладает хемотактическим эффектом при регенерации нейритов. Этот эффект может быть обусловлен взаимодействием suPAR с FPRL1, так как добавление РТ, блокирующего Gαi-субъединицу G-белка, ассоциированного c FPRL1, снижает стимуляцию роста нейритов.
Таким образом, нами показана навигационная роль урокиназной системы: отрастающие от ганглиев нейриты растут преимущественно в область высокой экспрессии растворимых форм uPA и uPAR. Более того, uPAR обладает собственными навигационными свойствами, которые проявляются в отсутствие в системе протеолитически активной uPA. Мы предполагаем, что навигационный механизм участия uPAR в определении направления роста аксонов обусловлен его взаимодействием с рецептором FPRL1, который экспрессируется на конусах растущих аксонов и колокализуется при этом с uPAR. Эти данные раскрывают новые механизмы участия урокиназной системы в регуляции направленного роста нервов.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект номер 17-04-00386).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lu P., Takai K., Weaver V.M., Werb Z. (2011) Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harb. Perspect. Biol. 3, 12
Smith H.W., Marshall C.J. (2010) Regulation of cell signalling by uPAR. Nat. Rev. Mol. Cell. Biol. 11, 23‒36.
Mahmood N., Mihalcioiu C., Rabbani S.A. (2018) Multifaceted role of the urokinase-type plasminogen activator (upa) and its receptor (upar): diagnostic, prognostic, and therapeutic applications. Front. Oncol. 8, 24.
Eden G., Archinti M., Furlan F., Murphy R., Degryse B. (2011) The urokinase receptor interactome. Curr. Pharm. Des. 17, 1874‒1889.
Cunningham O., Andolfo A., Santovito M.L., Iuzzolino L., Blasi F., Sidenius N. (2003) Dimerization controls the lipid raft partitioning of uPAR/CD87 and regulates its biological functions. EMBO J. 22, 5994‒6003.
Rubina K.A., Semina E.V., Balatskaya M.N., Plekhanova O.S., Tkachuk V.A. (2018) Mechanisms of regulation of the directed growth of vessels and nerves by the fibrinolytic system components and GPI-anchored navigation receptors. Neurosci. Behav. Physiol. 104, 1001–1026.
Ferraris G.M., Sidenius N. (2013) Urokinase plasminogen activator receptor: a functional integrator of extracellular proteolysis, cell adhesion, and signal transduction. Semin. Thromb. Hemost. 39, 347‒355.
Gorrasi A., Li Santi A., Amodio G., Alfano D., Remondelli P., Montuori N., Ragno P. (2014) The urokinase receptor takes control of cell migration by recruiting integrins and FPR1 on the cell surface. PLoS One. 9, e86352.
Resnati M., Pallavicini I., Wang J.M., Oppenheim J., Serhan C.N., Romano M., Blasi F. (2002) The fibrinolytic receptor for urokinase activates the G protein-coupled chemotactic receptor FPRL1/LXA4R. Proc. Natl. Acad. Sci. USA. 99, 1359‒1364.
Wei Y., Lukashev M., Simon D.I., Bodary S.C., Rosenberg S., Doyle M.V., Chapman H.A. (1996) Regulation of integrin function by the urokinase receptor. Science. 273, 1551‒1555.
Eden G., Archinti M., Arnaudova R., Andreotti G., Motta A., Furlan F., Citro V., Cubellis M.V., Degryse B. (2018) D2A sequence of the urokinase receptor induces cell growth through alphavbeta3 integrin and EGFR. Cell. Mol. Life Sci. 75, 1889‒1907.
Merino P., Diaz A., Jeanneret V., Wu F., Torre E., Cheng L., Yepes M. (2017) Urokinase-type plasminogen activator (uPA) binding to the uPA receptor (uPAR) promotes axonal regeneration in the central nervous system. J. Biol. Chem. 292, 2741‒2753.
Wu F., Catano M., Echeverry R., Torre E., Haile W. B., An J., Chen C., Cheng L., Nicholson A., Tong F.C., Park J., Yepes M. (2014) Urokinase-type plasminogen activator promotes dendritic spine recovery and improves neurological outcome following ischemic stroke. J. Neurosci. 34, 14219‒14232.
Lino N., Fiore L., Rapacioli M., Teruel L., Flores V., Scicolone G., Sanchez V. (2014) uPA-uPAR molecular complex is involved in cell signaling during neuronal migration and neuritogenesis. Dev. Dyn. 243, 676‒689.
Семина Е.В., Рубина К.А., Степанова В.В., Ткачук В.А. (2016) Участие рецептора урокиназы и его эндогенных лигандов в развитии головного мозга и формировании когнитивных функций. Росс. физиол. журн. им. И.М. Сеченова. 102, 881–903.
Семина Е.В., Рубина К.А., Сысоева В.Ю., Степанова В.В., Ткачук В.А. (2016) Трехмерная модель биоматрикса как способ изучения роста кровеносных сосудов и нервов в тканеинженерных конструкциях. Вест. Мос. ун-та. Сер. 2: Химия. 71, 172‒177.
Semina E., Rubina K., Sysoeva V., Rysenkova K., Klimovich P., Plekhanova O., Tkachuk V. (2016) Urokinase and urokinase receptor participate in regulation of neuronal migration, axon growth and branching. Eur. J. Cell. Biol. 95, 295‒310.
Jo M., Takimoto S., Montel V., Gonias S.L. (2009) The urokinase receptor promotes cancer metastasis independently of urokinase-type plasminogen activator in mice. Am. J. Pathol. 175, 190‒200.
Blasi F., Carmeliet P. (2002) uPAR: a versatile signalling orchestrator. Nat. Rev. Mol. Cell. Biol. 3, 932‒943.
Jaiswal R.K., Varshney A.K., Yadava P.K. (2018) Diversity and functional evolution of the plasminogen activator system. Biomed. Pharmacother. 98, 886‒898.
Ho C.F., Ismail N.B., Koh J.K., Gunaseelan S., Low Y.H., Ng Y.K., Chua J.J., Ong W.Y. (2018) Localization of formyl-peptide receptor 2 in the rat central nervous system and its role in axonal and dendritic outgrowth. Neurochem. Res. 43, 1587‒1598.
Resnati M., Guttinger M., Valcamonica S., Sidenius N., Blasi F., Fazioli F. (1996) Proteolytic cleavage of the urokinase receptor substitutes for the agonist-induced chemotactic effect. EMBO J. 15, 1572‒1582.
Montuori N., Bifulco K., Carriero M.V., La Penna C., Visconte V., Alfano D., Pesapane A., Rossi F.W., Salzano S., Rossi G., Ragno P. (2011) The cross-talk between the urokinase receptor and fMLP receptors regulates the activity of the CXCR4 chemokine receptor. Cell. Mol. Life Sci. 68, 2453‒2467.
Rivellini C., Dina G., Porrello E., Cerri F., Scarlato M., Domi T., Ungaro D., Del Carro U., Bolino A., Quattrini A., Comi G., Previtali S.C. (2012) Urokinase plasminogen receptor and the fibrinolytic complex play a role in nerve repair after nerve crush in mice, and in human neuropathies. PLoS One. 7, e32059.
Archinti M., Britto M., Eden G., Furlan F., Murphy R., Degryse B. (2011) The urokinase receptor in the central nervous system. CNS Neurol. Disord. Drug Targets. 10, 271‒294.
Bruneau N., Szepetowski P. (2011) The role of the urokinase receptor in epilepsy, in disorders of language, cognition, communication and behavior, and in the central nervous system. Curr. Pharm. Des. 17, 1914‒1923.
Sumi Y., Dent M.A., Owen D.E., Seeley P.J., Morris R.J. (1992) The expression of tissue and urokinase-type plasminogen activators in neural development suggests different modes of proteolytic involvement in neuronal growth. Development. 116, 625‒637.
Venugopal C., Prasad Y., Shobha K., Pinnelli V.B., Dhanushkodi A. (2018) HEK-293 secretome attenuates kainic acid neurotoxicity through insulin like growth factor-phosphatidylinositol-3-kinases pathway and by temporal regulation of antioxidant defense machineries. Neurotoxicology. 69, 189‒200.
Mukhina S., Stepanova V., Traktouev D., Poliakov A., Beabealashvilly R., Gursky Y., Minashkin M., She-velev A., Tkachuk V. (2000) The chemotactic action of urokinase on smooth muscle cells is dependent on its kringle domain. Characterization of interactions and contribution to chemotaxis. J. Biol. Chem. 275, 16450‒16458.
de Paulis A., Montuori N., Prevete N., Fiorentino I., Rossi F.W., Visconte V., Rossi G., Marone G., Ragno P. (2004) Urokinase induces basophil chemotaxis through a urokinase receptor epitope that is an endogenous ligand for formyl peptide receptor-like 1 and -like 2. J. Immunol. 173, 5739‒5748.
Fazioli F., Resnati M., Sidenius N., Higashimoto Y., Appella E., Blasi F. (1997) A urokinase-sensitive region of the human urokinase receptor is responsible for its chemotactic activity. EMBO J. 16, 7279‒7286.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


