Молекулярная биология, 2020, T. 54, № 2, стр. 244-251
На эффективность иммунопреципитации комплексов микроРНК и белка AGO2 из плазмы крови человека влияет последовательность процедур
Д. Д. Паншин a, К. А. Кондратов a, *
a Институт молекулярной биологии и генетики Национального медицинского исследовательского центра
им. В.А. Алмазова
197341 Санкт-Петербург, Россия
* E-mail: kondratovk.kirill@yandex.ru
Поступила в редакцию 07.04.2019
После доработки 27.05.2019
Принята к публикации 30.05.2019
Аннотация
Изучение внеклеточных микроРНК – одна из наиболее динамичных областей современных биомедицинских исследований. Часто при исследовании этих молекул требуется изолированно изучить пул микроРНК, связанных с определенным носителем. Такими носителями могут быть сложные комплексы этих молекул с белками. К одним из наиболее хорошо изученных белковых компонентов этих рибонуклеопротеинов относится белок Аргонавт-2 (Ago2). Часто для выделения этих комплексов применяют метод иммунопреципитации – осаждение специфическими антителами. Мы сравнили эффективность трех вариантов коиммунопреципитации из плазмы крови микроРНК с белком Ago2. В первом варианте анти-Ago2-антитела вносили в плазму, а затем добавляли белок А-сефарозу (БА-сефарозу) – для связывания комплексов микроРНК/Ago2/антитело. Во втором варианте антитела сначала инкубировали с БА-сефарозой, которую затем вносили в плазму крови. В третьем варианте, в отличие от второго, после сорбции Ago2-специфических антител на БА-сефарозе проводили дополнительную операцию – блокировку неспецифическими антителами. Эффективность коиммунопреципитации оценивали по соотношению уровней следующих микроРНК: miR-16-5p, miR-21-5p и miR-144-3p – в преципитатах с антителами против Ago2 и с контрольными кроличьими антителами. Для miR-16-5p эффективными оказались все три варианта коиммунопреципитации, для miR-21-5p – только вариант 2, а для miR-144-3p – ни один из протоколов. Таким образом, при коиммунопреципитации микроРНК и белка Ago2 из плазмы следует учитывать, что для каждой конкретной микроРНК эффективность процесса может зависеть от последовательности добавления реагентов.
ВВЕДЕНИЕ
МикроРНК – малая регуляторная молекула, участвующая в сайленсинге генов. В последние годы большое внимание уделяется тем микроРНК, которые существуют вне клеток во внеклеточных жидкостях организма (слюне, плазме крови, ликворе) [1]. Известно, что уровень этих молекул меняется при различных заболеваниях: диабете [2], раке [3], ишемии [4]. Также показано, что микроРНК из внеклеточной среды может поглощаться клетками и регулировать в них экспрессию генов [5]; при этом специфичность регулируемых генов в клетке-реципиенте определяется последовательностью микроРНК. Показано, что эта молекула выделяется в физиологические жидкости как в составе сложных мембранных структур (внеклеточных везикул, экзосом, апоптотических телец) [6], так и в свободной от мембран форме в комплексе с белками [7]. Известно, что даже не окруженная мембраной микроРНК находится в этих жидкостях в особой, защищенной форме в комплексах с белками [8]. Следует отметить, что с разными белками связывается различный набор микроРНК [9]. По этой причине набор генов, экспрессия которых в клетке-реципиенте изменяется под воздействием внеклеточных микроРНК, различен для разных белков-носителей этих микроРНК. Таким образом, для выяснения влияния той или иной микроРНК на клетки-мишени важно знать, с какими белками эта микроРНК связана вне клетки. Известен широкий набор внутриклеточных белков, с которыми может быть ассоциирована микроРНК [10]. К наиболее изученным белкам, в комплексе с которыми микроРНК выходит во внеклеточное пространство, относится белок Аргонавт-2 (Ago2). В клетке этот белок – основной компонент RISC-комплекса, осуществляющего регуляцию сайленсинга генов [11]. Показано, что с Ago2 микроРНК ассоциирована в таких физиологических жидкостях, как моча [12], перикардиальная жидкость [13] и плазма крови [9]. Наиболее простые и удобные способы изучения взаимодействия белка Ago2 и микроРНК основаны на использовании антител, специфически связывающих этот белок. В одной из работ для получения и изучения комплексов Ago2/микроРНК использовали нерастворимые подложки, на которых сорбированы антитела против Ago2 [14]. Однако для изучения комплексов белок/РНК чаще всего применяют метод коиммунопреципитация РНК антителами против белка, взаимодействующего с ней [15, 16]. Существует несколько способов иммунопреципитации, основанных на двух основных подходах [17]. В первом случае антитела против преципитируемого белка добавляются в жидкость, содержащую этот белок, а затем в полученную смесь смешивают с сорбентом, связывающим антитела [9, 18]. Во втором случае сначала получают комплекс антител с сорбентом, который затем добавляют к раствору исследуемого белка [19, 20]. При выделении рибонуклеопротеиновых комплексов, содержащих микроРНК и белок Ago2, используют как первую [9, 18], так или вторую методику [21]. Следует отметить, что авторы этих работ не сравнивали эффективность разных способов иммунопреципитации и не оценивали, какой вариант подходит для той или иной микроРНК.
Следует упомянуть, что одна из важнейших жидкостей, в которой необходимо оценивать уровни микроРНК, – это плазма крови (ПК). Важная особенность ПК заключается в том, что в этой жидкости присутствуют антитела, которые могут сорбироваться на аффинный сорбент и конкурировать с рабочими антителами. Ситуация с преципитацией из ПК микроРНК осложняется тем, что против белков, связывающих микроРНК, могут существовать аутоантитела [22–24]. Важно знать, что даже незначительное количество аутоантител может сильно искажать результаты иммунопреципитации, что не позволяет регистрировать различия в уровнях микроРНК при преципитации антителами против Ago2 и контрольными изотипическими. Также следует учитывать, что влияние аутоантител может быть различным при разных способах иммунопреципитации.
Таким образом, назрела необходимость сравнить разные варианты иммунопреципитации рибонуклеопротеиновых комплексов, содержащих белок Ago2 и микроРНК. Это позволит оптимизировать стратегию проведения преципитации микроРНК антителами против белка Ago2 из ПК. Возможно, полученные результаты будут использованы и для других микроРНК-связывающих белков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток HEK-293. Клетки HEK-293 культивировали до состояния монослоя в чашке Петри диаметром 9 см на среде Игла, модифицированной Дульбекко, содержащей 10% сыворотки. Клетки промывали трижды фосфатно-солевым буфером (PBS) и лизировали в 250 мкл буфера: PBS с 1% Triton X-100, 0.5% NP-40, коктейлем ингибиторов протеаз (P8340; “Sigma”, США). Затем пробу разводили в 4 раза лизисным буфером, замораживали и хранили при –70°С. Перед использованием лизат размораживали и центрифугировали 10 мин при 16 000 × g.
Иммунопреципитация из лизата клеток. Супернатант после центрифугирования использовали для проведения иммунопреципитации. Иммунопреципитацию проводили тремя способами, схематически показанными на рис. 1. Все процедуры проводили при 4°С с использованием 2 видов кроличьих антител: контрольных (I5006; “Sigma”) и поликлональных против белка Ago2 (sc-32877; “Santa Cruz”, США) – в концентрации 200 мкг/мл.
Рис. 1.
Общая схема способов иммунопреципитации комплекса микроРНК/Ago2 антителами против белка Ago2. Связывание с БА-сефарозой – гранулы БА-сефарозы добавляли в ПК. Способ 1 – контрольные антитела или антитела против Ago2 добавляли в плазму, а затем смешивали с БА-сефарозой. Способ 2 – контрольные антитела или антитела против Ago2 смешивали с БА-сефарозой, а затем добавляли ПК. Способ 3 – контрольные антитела или антитела против Ago2 смешивали с БА-сефарозой и добавляли избыточное количество блокирующих антител, после чего смешивали с ПК.
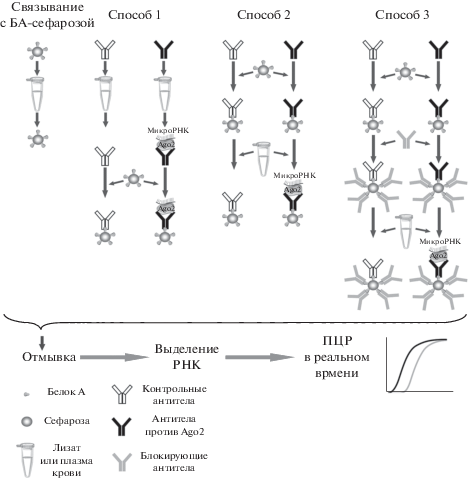
При проведении преципитации первым способом к 250 мкл лизата добавляли 5 мкл антител (контрольных или анти-Ago2) и инкубировали при перемешивании в течение 3 ч. Через 3 ч к пробе добавляли 24 мкл PBS, инкубировали в тех же условиях еще 3 ч, вносили 5 мкл белок А-сефарозы (БА-сефарозы) (P3391; “Sigma”), ресуспендированной в 45 мкл лизисного буфера, и инкубировали при перемешивании в течение ночи.
При преципитации вторым способом 5 мкл БА-сефарозы, ресуспендированной в 45 мкл лизисного буфера, смешивали с 5 мкл антител (контрольные или анти-Ago2). Смесь инкубировали при перемешивании в течение 3 ч, добавляли 24 мкл PBS и инкубировали еще 3 ч. В пробу вносили 250 мкл клеточного лизата и инкубировали при перемешивании в течение ночи.
При преципитации третьим способом 5 мкл БА-сефарозы, ресуспендированной в 45 мкл лизисного буфера, смешивали с 5 мкл антител (контрольные или анти-Ago2), инкубировали при перемешивании в течение 3 ч, добавляли 24 мкл блокирующих кроличьих антител (I5006; “Sigma”) в концентрации 5 мг/мл и инкубировали 3 ч. После внесения 250 мкл лизата пробу инкубировали при перемешивании в течение ночи.
В последнем случае к 5 мкл БА-сефарозы, ресуспендированной в 45 мкл лизисного буфера, добавляли 29 мкл PBS и 250 мкл лизата клеток и инкубировали в течение ночи. Затем БА-сефарозу, полученную после каждой преципитации, промывали 5 раз 1 мл лизисного буфера. Полученные преципитаты в дальнейшем использовали для электрофореза в полиакриламидном геле.
Электрофорез и иммуноблотинг. В полученный преципитат БА-сефарозы добавляли 50 мкл буфера Лэммли и инкубировали 10 мин при 100°С, после чего наносили на градиентный полиакриламидный гель (4–12%) и проводили электрофорез. После электропереноса разделенных белков на нитроцеллюлозную мембрану ее окрашивали мышиными моноклональными антителами против Ago2 (ab57113; “Abcam”, Великобритания) и вторичными конъюгированными с пероксидазой хрена козьими антителами против антител мыши (170-5047; “Bio-Rad Laboratories”, США). Белок детектировали с помощью набора Super Signal Substrate (“Thermo Scientific”, США) на приборе Fusion FX (“Vilber”, Франция).
Иммунопреципитация из плазмы крови человека. Кровь забирали у 23 здоровых доноров (13 мужчин и 10 женщин) в пробирки с EDTA. Каждый донор подписывал информированное согласие на участие в исследовании. Пробы центрифугировали 10 мин при 3000 × g. Супернатант переносили в новую пробирку и центрифугировали еще раз в тех же условиях. Полученный супернатант, т.е. ПК, замораживали и хранили при температуре –70°С. Перед использованием образец размораживали и центрифугировали 10 мин при 3000 × g. Из 100 мкл ПК выделяли суммарную РНК, а 50 мкл использовали для иммунопреципитации.
Перед иммунопреципитацией образец смешивали с равным объемом буфера (PBS, 2% Triton Х-100, 1% NP-40). Иммунопреципитацию проводили тремя способами, описанными выше для лизата клеток. При всех действиях по иммунопреципитации из ПК использовали буфер, не содержащий коктейля ингибиторов протеаз (PBS, 1% Triton Х-100, 0.5% NP-40). После преципитации БА-сефарозу отмывали 7 раз этим же буфером и ресуспендировали в 100 мкл. Из полученных образцов выделяли РНК.
Выделение РНК. РНК выделяли из двух типов препаратов: цельной ПК и иммунопреципитата из этой плазмы. К 100 мкл образца добавляли 300 мкл Trizol LS (“Ambion”, США), содержащего 3 мкг/мл тРНК Escherichia coli (R1753; “Sigma”) и 5 фмоль/мл miR-39 (“Синтол”, Россия). РНК выделяли по методике, рекомендованной производителем реагента Trizol LS с ранее описанными модификациями [25]. Полученную РНК растворяли в 20 мкл воды, обработанной диэтилпирокарбонатом.
Синтез кДНК и количественная ПЦР. Для оценки количества miR-16-5p, miR-21-5p и miR-144-3p использовали стандартные растворы (1010, 108, 106, 104, 102 молекул в мкл) их синтетических аналогов производства “Синтол”. Стандартные растворы и пробы выделенной РНК использовали для синтеза кДНК и количественной ПЦР в реальном времени. Синтез кДНК и ПЦР в реальном времени проводили с использованием набора “Applied Biosystems” (США) и зондов к конкретной микроРНК также производства “Applied Biosystems” (Cat. N. 4427975; Assay ID 000391, 000397, 002676). Для каждой реакции синтеза кДНК брали по 1.66 мкл раствора РНК. Синтез кДНК проводили в 5 мкл. Количественную ПЦР проводилась в объеме 20 мкл; на одну реакцию брали по 2.4 мкл раствора кДНК. На основе полученных значений Ct строили калибровочные кривые, по которым рассчитывали количество miR-16-5p, miR-21-5p и miR-144-3p в образцах. Для оценки эффективности выделения и степени деградации РНК использовали внутренний контроль – miR-39. Значения Ct для miR-16-5p, miR-21-5p и miR-144-3p нормировали по уровню этой микроРНК.
Математическая обработка результата. Полученные данные обрабатывали в программе R-studio, версия 3.3.3. Для определения достоверности различий использовали W-критерий Уилкоксона. Достоверными считали различия при p-value < 0.05. Для сравнения средних значений в выборке использовали среднее геометрическое.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Специфичность иммунопреципитации белка Ago2 из лизата клеток HEK-293
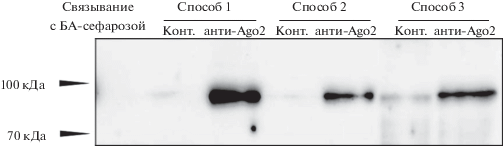
Прежде всего мы проверили специфичность анти-Ago2-антител и возможность их использования для преципитации белка Ago2 из лизата клеток HEK-293. Как видно из рис. 2, полоса белка с молекулярной массой 92–98 кДа, соответствующей рассчитанной для Ago2, появляется во всех трех вариантах иммунопреципитации, но практически отсутствует при использовании контрольных антител и в негативном контроле (связывание с БА-сефарозой в отсутствие антител).
Рис. 2.
Иммуноблотинг с антителами против белка Ago2. Проанализированы преципитаты, полученные из лизата клеток HEK-293, по трем вышеописанным способам (см. рис. 1). Здесь и далее на рисунках: Конт. –иммунопреципитация, проведенная с использованием контрольных антител кролика; анти-Ago2 – иммунопреципитация, проведенная с использованием антител против Ago2.
Определение количества трех микроРНК в плазме крови и в пробах, полученных после иммунопреципитации антителами против Ago2
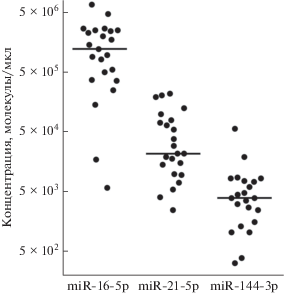
На следующем этапе мы определили количество miR-16-5p, miR-21-5p и miR-144-3p в цельной ПК. Показано (рис. 3), что в среднем концентрация miR-16-5p составляет 7.73 × 105, miR-21-5p – 2.7 × 104, а miR-144-3p – 3.5 × 103 молекул/мкл ПК.
Рис. 3.
Количественное определение miR-16-5p, miR-21-5p и miR-144-3p в плазме крови человека. Анализ проведен методом ПЦР в реальном времени с предварительной обратной транскрипцией. Горизонтальной чертой указана медиана выборки (N = 23).
В дальнейшем сравнили эффективность трех способов коиммунопреципитации исследуемых микроРНК с белком Ago2. Как видно из рис. 4, для разных микроРНК они дали разные результаты. Так, уровень miR-16-5p (рис. 4а) в преципитате, полученном с антителами против белка Ago2, в первом случае в 2.8 раза (p = 0.003) превосходил таковой в контроле (преципитат с контрольными антителами), в 3.3 раза при иммунопреципитации вторым способом (p = 0.001) и в 2.3 раза в третьем варианте (p = 0.042). Уровень miR-21-5p в 5.6 раз (p = 0.042) был выше контрольного при иммунопреципитации вторым способом (рис. 4б); при этом не получено достоверных различий в содержании этой микроРНК ни в первом, ни в третьем варианте.
Рис. 4.
Сравнение уровней miR-16-5p (а), miR-21-5p (б) и miR-144-3p (в) в трех вышеописанных способах коиммунопреципитации с Ago2 из плазмы крови человека (N = 10).
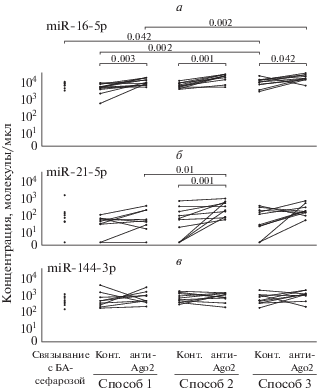
При сравнении количества микроРНК, связавшейся с БА-сефарозой в отсутствие антител (отрицательный контроль) и в присутствии контрольных антител, показано (рис. 4а), что при использовании контрольных антител в способе 3 уровень miR-16-5p в 1.5 раза выше (p = 0.042), чем при связывании с БА-сефарозой, и в 2.4 раза выше (p = 0.002) по сравнению с иммунопреципитацией контрольными антителами способом 1. Для miR-21-5p и miR-144-3p при сравнении количества микроРНК, связавшейся с БА-сефарозой в отсутствие антител и в присутствии контрольных антител, не выявлено достоверных отличий (рис. 4б, в).
При сравнении содержания трех микроРНК в преципитатах, полученных с использованием антител против Ago2 тремя способами, обнаружено, что уровень miR-16-5p (рис. 4а) в способе 3 был в 1.9 раз выше, чем при иммунопреципитации способом 1 (p = 0.002), а уровень miR-21-5p (рис. 4б) при использовании способа 2 в 4 раза превышал таковой в способе 1 (p = 0.01).
В случае miR-144-3p (рис. 4в) ни в одном из способов иммунопреципитации не выявлено ни одного достоверного отличия в уровнях этой микроРНК в преципитатах, полученных с антителами к Ago2 и с контрольными антителами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для сравнения вариантов коиммунопреципитации микроРНК с белком Ago2 из ПК мы, прежде всего, выбрали возможные микроРНК-мишени этого белка и проверили специфичность и работоспособность анти-Ago2-антител. Наш выбор остановился на трех микроРНК: miR-16-5p, miR-21-5p и miR-144-3p, – которые, согласно данным литературы, ассоциированы с белком Ago2 в крови [18, 21, 26]. Используя количественную ПЦР с предварительной обратной транскрипцией, мы выяснили, что они экспрессируются в ПК доноров на уровнях, отличающихся приблизительно на порядок (рис. 3). Для анти-Ago2-антител показано (рис. 2), что они специфически осаждают белок Ago2 из сложной белковой смеси (лизат клеток человека, линия HEK-293) в любом из трех используемых способов иммунопреципитации.
Известно, что в ПК комплексы микроРНК с белком Ago2 могут находиться как в свободной форме [21], так и в составе внеклеточных везикул [8]. Наличие внеклеточных везикул может искажать результаты иммунопреципитации, так как с антителами взаимодействует и находящийся на поверхности везикулы белок Ago2, который не связывается с исследуемой микроРНК. С целью предотвратить это нежелательное явление в ПК перед иммунопреципитацией добавляли неионные детергенты (Triton Х-100, NP-40), которые разрушают везикулы, но при этом мало влияют на взаимодействие между белками и нуклеиновыми кислотами.
Сравниваемые варианты иммунопреципитации отличаются порядком взаимодействия компонентов комплекса: антигена (Ago2), антитела и БА-сефарозы (способы 1 и 2, рис. 1) и наличием блокирующих антител (способ 3, рис. 1). В случае способа 2, когда в ПК вносят рабочие антитела, уже связанные с БА-сефарозой, собственные антитела донора, находящиеся в ПК, взаимодействуют с оставшимися свободными сайтами связывания на БА-сефарозе, не конкурируя с рабочими. Действительно, уровень одной из исследуемых микроРНК, miR-21-5p, достоверно превышал контрольный в 5.5 раз (p = 0.001) только при использовании способа 2 (рис. 4б), в то время как в вариантах 1 и 3 значимых отличий от контроля для этой микроРНК не выявлено. Возможно, анти-Ago2-антитела связываются с БА-сефарозой более эффективно при предварительной сорбции (способ 2), чем в виде комплексов с антигеном (способ 1). Но тогда не совсем понятно, по какой причине для miR-21-5p оказался неэффективным способ 3 иммунопреципитации, так как в нем рабочие антитела, как и в варианте 1, предварительно инкубируют с БА-сефарозой. Видимо, блокирующие антитела повлияли на эффективность иммунопреципитации. Следует отметить, что в способах 2 и 3 уровни miR-21-5p значимо не отличались при преципитации антителами против Ago2 и контрольными антителами, кроме того, они были сходными для этих двух вариантов.
Причин, по которым для трех микроРНК различные способы иммунопреципитации обладают неодинаковой эффективностью, может быть несколько. Возможно, эти различия связаны с тем, что в случае микроРНК, экспрессирующихся на низком уровне (рис. 3) в ПК (например, miR-144-3p), нельзя достоверно измерить разницу между их содержанием в преципитатах антител против Ago2 и контрольных антител. Однако количество miR-144-3p в преципитатах, полученных с контрольными антителами всеми тремя методами (рис. 4в), было существенно выше количества miR-21-5p в аналогичных пробах (рис. 4б). Общий уровень в плазме miR-21-5p, наоборот, был в 10 раз выше, чем miR-144-3p (рис. 3). В связи с этим возможно и другое объяснение отсутствия специфической преципитации miR-144-3p. Например, эти две микроРНК находятся в комплексах с разными белками и те, в которых содержится miR-144-3p, сильнее неспецифически связываются с БА-сефарозой. Не выяснена и роль аутоантител, присутствующих в ПК, в этом процессе, хотя известно, что такие антитела могут вырабатываться как на сам белок Ago2 [22], так и на белки, взаимодействующие с ним [27–29], а также на микроРНК-связывающие белки [30, 31]. Это может усложнять процессы, проходящие при иммунопреципитации исследуемых комплексов. Следует заметить, что использование методики, которая не дает достоверной разницы между преципитацией контрольными и рабочими антителами, может привести к неверным выводам об отсутствии взаимодействия конкретной микроРНК с белком (в данном случае, с Ago2), хотя его можно зарегистрировать, применив другой вариант метода. Таким образом, при иммунопреципитации комплексов микроРНК с белками необходимо предварительно выбрать оптимальный вариант методики.
Выражаем благодарность заведующему лабораторией молекулярных механизмов атеросклероза Института молекулярной биологии и генетики Национального медицинского исследовательского центра имени В.А. Алмазова Антону Владимировичу Федорову за ценные советы при подготовке экспериментов и написании статьи.
Работа выполнена при финансовой поддержке Российского Научного Фонда (грант 19-75-20076).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Бавыкин А.С. (2017) Циркулирующие микроРНК для идентификации биологических жидкостей: новый подход к стандартизации методов экспрессионной диагностики. Молекуляр. биология. 51, 573–581.
Sebastiani G., Nigi L., Grieco G.E., Mancarella F., Ventriglia G., Dotta F. (2017) Circulating microRNAs and diabetes mellitus: a novel tool for disease prediction, diagnosis, and staging? J. Endocrinol. Invest. 40, 591–610.
Armand-Labit V., Pradines A. (2017) Circulating cell-free microRNAs as clinical cancer biomarkers. Biomol. Concepts. 8, 61–81.
Lorenzen J.M. (2015) Vascular and circulating microRNAs in renal ischaemia-reperfusion injury. J. Physiol. 593, 1777–1784.
Lv Z., Wei Y., Wang D., Zhang C.Y., Zen K., Li L. (2014) Argonaute 2 in cell-secreted microvesicles guides the function of secreted miRNAs in recipient cells. PLoS One. 9, e103599.
Hoy A.M., Buck A.H. (2012) Extracellular small RNAs: what, where, why? Biochem. Soc. Trans. 40, 886–890.
Turchinovich A, Weiz L, Langheinz A, Burwinkel B. (2011) Characterization of extracellular circulating microRNA. Nucleic Acids Res. 39, 7223–7233.
Li L., Zhu D., Huang L., Zhang J., Bian Z., Chen X., Liu Y., Zhang C.Y., Zen K. (2012) Argonaute 2 complexes selectively protect the circulating microRNAs in cell-secreted microvesicles. PLoS One. 7, e46957.
Turchinovich A., Burwinkel B. (2012) Distinct AGO1 and AGO2 associated miRNA profiles in human cells and blood plasma. RNA Biol. 9, 1066–1075.
Zealy R.W., Wrenn S.P., Davila S., Min K.W., Yoon J.H. (2017) MicroRNA-binding proteins: specificity and function. Wiley Interdiscip. Rev. RNA. 8, 1–8.
Filipowicz W. (2005) RNAi: the nuts and bolts of the RISC machine. Cell. 122, 17‒20.
Beltrami C., Clayton A., Newbury L.J., Corish P., Jenkins R.H., Phillips A.O., Fraser D.J., Bowen T. (2015) Stabilization of urinary microRNAs by association with exosomes and Argonaute 2 protein. Noncoding RNA. 1, 151–166.
Beltrami C., Besnier M., Shantikumar S., Shearn A.I., Rajakaruna C., Laftah A., Sessa F., Spinetti G., Petretto E., Angelini G.D., Emanueli C. (2017) Human pericardial fluid contains exosomes enriched with cardiovascular-expressed microRNAs and promotes therapeutic angiogenesis. Mol. Ther. 25, 679–693.
Vaghi V., Potrich C., Lunelli L., Facci P., Pasquardini L., Vanzetti L., Pederzolli C. (2016) Bio-functional surfaces for the immunocapture of AGO2-bound microRNAs. Colloids Surf. B Biointerfaces. 146, 746–753.
Hassan M.Q., Gordon J.A., Lian J.B., van Wijnen A.J., Stein J.L., Stein G.S. (2010) Ribonucleoprotein immunoprecipitation (RNP-IP): a direct in vivo analysis of microRNA-targets. J. Cell. Biochem. 110, 817–822.
Качаев З.М., Гильмутдинов Р.А., Копытова Д.В., Желудкевич А.А., Шидловский Ю.В., Курбидаева А.С. (2017) Метод иммунопреципитации РНК из лизатов культуры клеток S2 Drosophila melanogaster. Молекуляр. биология. 51, 85‒93.
Bonifacino J.S., Dell’Angelica E.C., Springer T.A. (2001) Immunoprecipitation. Curr. Protoc. Mol. Biol. 10, 16.1–16.29.
Turchinovich A., Weiz L., Burwinkel B. (2013) Isolation of circulating microRNA associated with RNA-binding protein. Methods Mol. Biol. 1024, 97–107.
Noetel A., Elfimova N., Altmüller J., Becker C., Becker D., Lahr W., Nürnberg P., Wasmuth H., Teufel A., Büttner R., Dienes H.P., Odenthal M. (2013) Next generation sequencing of the Ago2 interacting transcriptome identified chemokine family members as novel targets of neuronal microRNAs in hepatic stellate cells. J. Hepatol. 58, 335–341.
Wang W.X., Wilfred B.R., Hu Y., Stromberg A.J., Nelson P.T. (2010) Anti-Argonaute RIP-Chip shows that miRNA transfections alter global patterns of mRNA recruitment to microribonucleoprotein complexes. RNA. 16, 394–404.
Arroyo J.D., Chevillet J.R., Kroh E.M., Ruf I.K., Pritchard C.C., Gibson D.F., Mitchell P.S., Bennett C.F., Pogosova-Agadjanyan E.L., Stirewalt D.L., Tait J.F., Tewari M. (2011) Argonaute 2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma. Proc. Natl. Acad. Sci. USA. 108, 5003–5008.
Satoh M., Chan J.Y., Ceribelli A., (2013) Vazquez del-Mercado M., Chan E.K. Autoantibodies to Argonaute 2 (Su antigen). Adv. Exp. Med. Biol. 768, 45–59.
Ceribelli A., Tincani A., Cavazzana I., Franceschini F., Cattaneo R., Pauley B.A., Chan J.Y., Chan E.K., Satoh M. (2011) Anti-argonaute2 (Ago2/Su) and -Ro antibodies identified by immunoprecipitation in primary anti-phospholipid syndrome (PAPS). Autoimmunity. 44, 90–97.
Fredenburg K.M., Chan E.K. (2015) Our journey from the study of human autoantibodies to the microRNA world. Front. Immunol. 6, 110.
Kondratov K., Kurapeev D., Popov M., Sidorova M., Minasian S., Galagudza M., Kostareva A., Fedorov A. (2016) Heparinase treatment of heparin-contaminated plasma from coronary artery bypass grafting patients enables reliable quantification of microRNAs. Biomol. Detect. Quantif. 8, 9–14.
Vu L., Ragupathy V., Kulkarni S., Atreya C. (2017) Analysis of Argonaute 2-microRNA complexes in ex vivo stored red blood cells. Transfusion. 57, 2995–3000.
Takimoto K., Wakiyama M., Yokoyama S. (2009) Mammalian GW182 contains multiple Argonaute-binding sites and functions in microRNA-mediated translational repression. RNA. 15, 1078–1089.
Bloch D.B., Nobre R.A., Yang W.H. (2013) GW/P-bodies and autoimmune disease. Adv. Exp. Med. Biol. 768, 61–70.
Jakymiw A., Ikeda K., Fritzler M.J., Reeves W.H., Satoh M., Chan E.K. (2006) Autoimmune targeting of key components of RNA interference. Arthritis Res. Ther. 8, R87.
Nabors L.B., Furneaux H.M., King P.H. (1998) HuR, a novel target of anti-Hu antibodies, is expressed in non-neural tissues. J. Neuroimmunol. 92, 152–159.
Mukherjee K., Ghoshal B., Ghosh S., Chakrabarty Y., Shwetha S., Das S., Bhattacharyya S.N. (2016) Rever-sible HuR-microRNA binding controls extracellular export of miR-122 and augments stress response. EMBO Rep. 17, 1184–1203
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


