Молекулярная биология, 2020, T. 54, № 2, стр. 308-312
Регулируемый доксициклином двухпропромоторный интегратор на основе трансактиватора системы TET-ON 3G
Ю. М. Ходарович a, *, Д. Д. Рахманинова a, А. М. Барышникова a, С. М. Деев a
a Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
117997 Москва, Россия
* E-mail: khodarovich@mail.ru
Поступила в редакцию 10.10.2019
После доработки 10.10.2019
Принята к публикации 05.11.2019
Аннотация
Создана искусственная генетическая цепь ‒ двухпромоторный интегратор, активность выходного сигнала которого высока только при высокой активности двух промоторов на входе цепи. Работа такого интегратора показана на примере онкоспецифических промоторов генов сурвивина и теломеразы человека, которые могут использоваться для специфической транскрипции целевых генов в опухолевых клетках. Для создания интегратора мы использовали хорошо известную систему TET-ON 3G, регулируемую доксициклином.
ВВЕДЕНИЕ
Повышение тканевой или клеточной специфичности экспрессии генетических конструкций представляет важную задачу, решение которой позволит усилить избирательность экспрессии целевых генов в выбранных клетках-мишенях. Одним из подходов к решению этой задачи может быть использование двух промоторов c перекрывающейся специфичностью, которые обеспечивают синтез двухкомпонентных регуляторов экспрессии целевого гена [1‒7]. Наиболее универсальный подход основан на том, что каждый промотор регулирует синтез одного из компонентов бинарного трансактиватора, в результате сборки которого активируется экспрессия целевого гена. В известных нам работах [4‒7] используется трансактиватор с ДНК-связывающим доменом на основе белка GAL4, который, как известно, в больших количествах может быть токсичным для клеток [8].
Мы решили создать подобную генетическую схему на основе хорошо известной системы TET-ON 3G. Этот трансактиватор имеет ряд преимуществ: он не токсичен, использует другие участки связывания в промоторах, что позволяет применять его совместно с регуляторными цепями на основе белка GAL4. Кроме того, активность трансактиватора можно дополнительно регулировать с помощью доксициклина. На входе разработанной нами генетической цепи мы использовали промоторы генов сурвивина и теломеразы человека. Это хорошо известные онкоспецифичные промоторы, которые ранее по отдельности использовали для специфической транскрипции целевых генов в опухолевых клетках. Теломераза предотвращает укорачивание теломер при делении клеток, что необходимо для неограниченной пролиферации раковых клеток. Повышенный уровень теломеразы, наблюдаемый более чем в 90% опухолей человека, обусловлен активацией транскрипции ее гена [9]. Белок сурвивин относится к семейству белков-ингибиторов апоптоза. Промотор гена сурвивина также активен во многих типах раковых клеток и малоактивен в нормальной дифференцированной ткани [10]. Таким образом, генетическая схема, позволяющая повысить специфичность экспрессии целевых генов в клетках, где активны промоторы генов как сурвивина, так и теломеразы человека, может найти применение в таргетной генотерапии опухолей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Создание плазмид. Плазмида pTERT-luc, любезно предоставленная И. Черновым (ИБХ РАН), представляет собой плазмиду pGL3-Basic (“Promega”, США), в которую перед геном люциферазы светлячка вставлен промотор (240 п.н.) гена теломеразы человека.
Плазмида pSurv-Luc получена из плазмиды pRL-Surv4-SV40, предоставленной И. Черновым (ИБХ РАН), содержащей ген люциферазы Renilla под контролем промотора гена сурвивина длиной 1500 п.н. Для этого фрагмент XbaI‒HindIII плазмиды pRL-Surv4-SV40, содержащий векторную часть и промотор гена сурвивина, лигировали с фрагментом XbaI‒HindIII плазмиды pTERT-luc, содержащим последовательность, кодирующую люциферазу светлячка.
Плазмиды pTERT-Tr1 и pSurv-Tr2 созданы на основе pBSK(+)Simple-Amp-Trans1-2, полученной методом синтеза генов (фирма “BIOMATIC”, Россия). Она содержат фрагменты трансактиватора, соединенные с соответствующими фрагментами разделенного интеина Npu DnaE. Все синтезированные в плазмиде pBSK(+)Simple-Amp-Trans1-2 последовательности были оптимизированы для высокой экспрессии в клетках млекопитающих. Для создания плазмид pTERT-Tr1 и pSurv-Tr2 фрагменты плазмиды pBSK(+)Simple-Amp-Trans1-2, вырезанные с помощью рестриктаз XbaI‒HindIII, перенесли в плазмиды pTERT-luc и pSurv-Luc соответственно.
Плазмида pPTRE-Tight-Luc получена путем вставки последовательности гена люциферазы светлячка из плазмиды pRL-Surv4-SV40 (фрагмент XbaI‒HindIII) в полилинкер плазмиды pTRE-Tight (“Clontech”, США).
Правильность сборки всех плазмид проверяли с помощью частичного секвенирования.
Линии клеток. Все клеточные линии культивировали в среде DMEM с высоким содержанием глюкозы, 10% фетальной сыворотки крупного рогатого скота (“HyClone”, США) и 2 мМ L-глутамина в атмосфере 5% CO2 при 37°C.
Трансфекция клеточных линий. Трансфекцию клеток проводили с использованием линейного полиэтиленимина (PEI, 25 кДа, “Polysciences”, ФРГ, кат. № 23966). Плазмидную ДНК выделяли из бактериальных клеток с использованием набора GeneJET Plasmid Maxiprep (“Fermentas”, США, кат. № K0492). Комплексы ДНК с PEI готовили следующим образом: 10 мкг плазмидной ДНК (не более 50 мкл) разбавляли средой DMEM до конечного объема 500 мкл; 5 мкл исходного раствора PEI (5 мг/мл) смешивали с 495 мкл среды DMEM. Разбавленные растворы ДНК и PEI инкубировали при комнатной температуре в течение 5 мин, затем раствор PEI добавляли к раствору ДНК и тщательно перемешивали пипетированием (не менее 15 раз). Смесь выдерживали в течение 15‒20 мин при комнатной температуре. В лунки 96-луночных планшетов добавляли 10 мкл комплексов плазмида–PEI. Для уменьшения возможного цитотоксичнеского действия PEI время инкубации было ограничено 4 ч, после чего культуральную среду в лунках заменяли свежей.
Измерение активности промоторов. Клетки высевали в 96-луночные планшеты с плотностью 20‒50 × 103 на лунку в зависимости от скорости пролиферации и размера клеток. На следующий день, когда клетки достигали визуальной плотности 70‒80%, их трансфицировали эквимолярной смесью плазмид pRL-TK (“Promega”)/ pGL3-hTERT для измерения активности промотора гена теломеразы человека или эквимолярной смесью плазмид pRL-TK (“Promega”)/pSurv-Luc для измерения активности промотора гена сурвивина. Плазмида pRL-TK, которая кодирует люциферазу Renilla reniformis под контролем конститутивного промотора гена тимидинкиназы, включена в смесь для трансфекции в качестве внутреннего контроля для нормирования транскрипционной активности промоторов. Через 24 ч после трансфекции клетки промывали буфером PBS, после чего лизировали, добавляя в каждую лунку 50 мкл 1 × лизирующего буфера (NEB, # B3321S). Две аликвоты клеточного лизата из каждой лунки переносили в лунки 96-луночного черного планшета: одну использовали для измерения активности люциферазы Renilla, другую ‒ для измерения активности люциферазы светлячка. Активность люциферазы измеряли с использованием устройства для считывания микропланшетов Infinite M1000 Pro (“Tecan”, Швейцария) в режиме инъекции. Растворы для инъекций: 100 мМ Трис-HCl (рН 8.0), 15 мМ MgSO4, 5 мМ EDТА, 150 мкМ АТP, 5 мМ DTT, 250 мкг/мл D-люциферина (“Biotium”, США, # 10101-1) для измерения активности люциферазы светлячка; 15 мМ EDТА, 500 мМ NaCl, 10 мМ DTT, 1.6 мкг/мл Coelenterazine h (“Biotium”, # 10111-1) ‒ для измерения активности люциферазы Renilla. Активность промотора гена TERT выражали в относительных единицах. Все данные (среднее значение ± стандартное отклонение) получены по результатам не менее трех независимых экспериментов.
Измерение активности интегратора. Активность интегратора определяли, как и активность промоторов. Единственное отличие заключалось в котрансфекции смесью из четырех плазмид: pTERT-Tr1; pSurv-Tr2; pPTRE-Tight-Luc; и pRL-TK. Плазмиды смешивали в молярном соотношении 1 : 1 : 1 : 1, активности интегратора определяли, как при измерении активности промоторов. Фоновый сигнал определяли с использованием котрансфекции смесью плазмид pEGFPN1, pPTRE-Tight-Luc и pRL-TK, взятых в соотношении 2 : 1 : 1. Таким образом, количество репортерной плазмиды pPTRE-Tight-Luc было одинаковым в опытах и в контрольных измерениях фона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
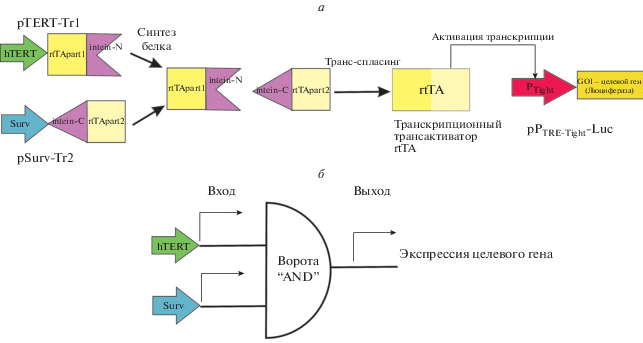
В нашей работе проверена возможность создания двухпромоторного интегратора на основе трансактиватора rtTA с дополнительной регуляцией доксициклином. С этой целью получены генетические конструкции, схематически изображенные на рис. 1. Видно, что для активации экспрессии целевого гена, в нашем случае это ген люциферазы светлячка, кодируемый плазмидой pРTRE-Tight-Luc, требуется связывание трансактиватора rtTA с промотором РTight. Трансактиватор синтезируется из двух неактивных по отдельности фрагментов с помощью интеина Npu DnaE, который отличается высокой эффективностью реакции транс-сплайсинга [11]. Первый фрагмент трансактиватора (кодируемый плазмидой pTERT-Tr1) содержит ДНК-связывающий и димеризационный домены; второй фрагмент (кодируется плазмидой pSurv-Tr2) содержит домен, активирующий транскрипцию. Экспрессия каждого фрагмента трансактиватора контролируется отдельным промотором. С этой целью мы использовали промоторы генов теломеразы человека (в плазмиде pTERT-Tr1) и сурвивина (плазмида pSurv-Tr2) человека, которые могут быть использованы для опухолеспецифичной экспрессии целевого гена. Таким образом, наивысшая активность люциферазы в нашей схеме должна наблюдаться только в клетках с высоким уровнем активности промоторов как гена сурвивина, так и гена теломеразы человека.
Рис. 1.
Схема работы двухпромоторного интегратора (а) и логической схемы, лежащей в ее основе (б). hTERT ‒ промотор гена теломеразы человека, Surv ‒ промотор гена сурвивина человека; rtTApart1 ‒ фрагмент трансактиватора rtTA, содержащий ДНК-связывающий и димеризационный домены; rtTApart2 ‒ фрагмент трансактиватора rtTA, содержащий активирующий транскрипцию домен; intein-N и intein-C ‒ N и C фрагменты разделенного интеина Npu DnaE соответственно; PTight ‒ тетрациклин-чувствительный промотор системы TET-ON 3G.
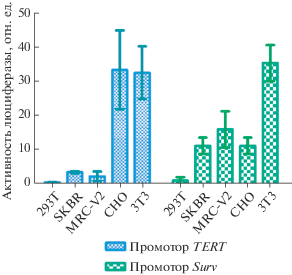
Для тестирования работы интегратора мы измерили активности промоторов генов сурвивина и теломеразы человека на панели клеток млекопитающих. Результаты измерения активности промоторов в выбранных линиях клеток представлены на рис. 2. Среди этих линий клеток есть линии с очень низким уровнем активности обоих промоторов (HEK293T), с низкой активностью одного промотора и высокой другого (линии SKBR3 и MRCV2), а также линии с высокой активностью обоих промоторов (CHO и 3T3). Стоит отметить довольно большое стандартное отклонение при измерении активности промоторов, что, по-видимому, отражает зависимость активности промоторов от незначительных изменений в условиях культивирования клеток. Так, например, недавно показано, что активность промотора гена теломеразы человека зависит от фазы клеточного цикла [12].
Рис. 2.
Активность промоторов генов сурвивина и теломеразы человека в ряде линий клеток млекопитающих.
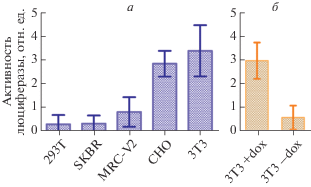
Работу интегратора тестировали путем котрансфекции в выбранные линии клеток смеси плазмид pTERT-Tr1, pSurvTr2 (плазмиды, кодирующие фрагменты трансактиватора), pPTRE-Tight-Luc (репортерная плазмида, выходной элемент цепи) и pRL-TK, которая кодирует люциферазу Renilla под контролем промотора гена тимидинкиназы и используется для нормирования результатов эксперимента. Результаты тестирования представлены на рис. 3а. Видно, что в линиях клеток с низкой активностью обоих промоторов (линия 293Т) или одного из промоторов (SKBR3, MRC-V2), выходной сигнал интегратора существенно меньше, чем в линиях с высокой активностью обоих промоторов (CHO, 3T3). Кроме того, активность интегратора зависит от присутствия в культуральной среде доксициклина (рис. 3б).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время опубликовано несколько работ, в которых с использованием нескольких схем сконструированы двухпромоторные интеграторы [3‒7]. Так, в работе [3] использовали плазмиды, кодирующие белок CRISPR и РНК cas9 под контролем промоторов генов теломеразы и уроплакина II человека. Если в клетке активны оба промотора, то образуется комплекс CRISPR/Cas9, который направлен на разрушение РНК репрессора LacI, что, в свою очередь, активирует синтез целевого гена. К недостаткам этого подхода относится необходимость в синтезе репрессора для подавления активности целевого гена. Таким образом, в первое время после трансфекции, пока не синтезировалось достаточное количество репрессора, промотор целевого гена активен, что может приводить к синтезу во всех трансфицированных клетках небольшого количества целевого белка, токсичного для клетки при суицидной генной терапии. В других работах под контролем двух разных промоторов находятся фрагменты трансактиватора, необходимого для активации промотора, регулирующего синтез целевого белка. Первый фрагмент трансактиватора представляет собой ДНК-связывающий домен GAL4, второй ‒ домен VP16 [4‒6] или VP64 [7], активирующий транскрипцию. Узнавание ДНК-связывающего и активирующего транскрипцию доменов достигается за счет добавления к ним адаптерных доменов [4‒6] или разделенного интеина [7].
В нашей работе создан двухпромоторный интегратор на основе системы TET-ON 3G. Трансактиватор из системы TET-ON 3G имеет ряд преимуществ: он не токсичен для клеток, связывается с другми участками в промоторах, что позволяет использовать его вместе с цепями на основе белка GAL4. Кроме того, активность трансактиватора можно дополнительно регулировать с помощью доксициклина. Наш интегратор оказался функционально активным: экспрессия целевого гена зависела от присутствия в составе трансфекционной смеси плазмид, кодирующих фрагменты трансактиватора. Наивысший уровень активности интегратора наблюдали только в клетках с наибольшими уровнями активности промоторов как сурвивина, так и теломеразы человека. Более того, полученный в результате реакции транс-сплайсинга трансактиватор сохранил способность изменять активность в зависимости от присутствия в культуральной среде доксициклина. В ходе работы выявлен и недостаток существующего дизайна интегратора ‒ низкий уровень экспрессии целевого гена. Именно низкий уровень выходного сигнала препятствует более детальному изучению свойств интегратора. И хотя в ряде задач (например, при направленной экспрессии высокотоксичных генов) низкий уровень выходного сигнала может быть желательным, в большинстве случаев такой слабый выходной сигнал может препятствовать использованию данного интегратора. Низкий выходной сигнал обусловлен, очевидно, малым количеством синтезированного трансактиватора. Если при трансфекции вместо плазмид pTERT-Tr1 и pSurv-Tr2 использовать плазмиду, кодирующую полный трансактиватор под контролем сильного цитомегаловирусного промотора (CMV), то выходной сигнал увеличивается более чем в 100 раз. Мы видим два подхода к решению этой проблемы. Первый ‒ использование на входе разработанного нами интегратора очень сильных промоторов. Однако большинство ткане- и онкоспецифичных промоторов довольно слабые, поэтому такой подход сильно ограничивает спектр решаемых задач. Второй подход, который в настоящее время разрабатывается нами, ‒ включение в состав фрагментов трансактиватора сигналов ядерного импорта. Добавление сигналов ядерного импорта может повысить концентрацию трансактиватора в ядре клетки, что должно намного увеличить уровень выходного сигнала интегратора.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта (№ 18-04-00212 А). Работы по созданию генно-инженерных конструкций выполнены при поддержке Российского научного фонда, проект № 19-14-00112.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Li Y., Idamakanti N., Arroyo T., Thorne S., Reid T., Nichols S., VanRoey M., Colbern G., Nguyen N., Tam O., Working P., Yu D.C. (2005) Dual promoter-controlled oncolytic adenovirus CG5757 has strong tumor selectivity and significant antitumor efficacy in preclinical models. Clin. Cancer Res. 11(24 Pt 1), 8845‒8855.
Ryan P.C., Jakubczak J.L., Stewart D.A., Hawkins L.K., Cheng C., Clarke L.M., Ganesh S., Hay C., Huang Y., Kaloss M., Marinov A., Phipps S.S., Reddy P.S., Shirley P.S., Skripchenko Y., Xu L., Yang J., Forry-Schaudies S., Hallenbeck P.L. (2004) Antitumor efficacy and tumor-selective replication with a single intravenous injection of OAS403, an oncolytic adenovirus dependent on two prevalent alterations in human cancer. Cancer Gene Ther. 11(8), 555‒569.
Liu Y., Zeng Y., Liu L., Zhuang C., Fu X., Huang W., Cai Z. (2014) Synthesizing AND gate genetic circuits based on CRISPR-Cas9 for identification of bladder cancer cells. Nat. Commun. 5, 5393.
Jerome V., Muller R. (1998) Tissue-specific, cell cycle-regulated chimeric transcription factors for the targeting of gene expression to tumor cells. Hum. Gene Ther. 9(18), 2653–2659.
Jérôme V., Müller R. (2001) A synthetic leucine zipper-based dimerization system for combining multiple promoter specificities. Gene Ther. 8(9), 725‒729.
Nissim L., Bar-Ziv R.H. (2010) A tunable dual-promoter integrator for targeting of cancer cells. Mol. Syst. Biol. 6, 444.
Wang H., Liu J., Yuet K.P., Hill A.J., Sternberg P.W. (2018) Split cGAL, an intersectional strategy using a split intein for refined spatiotemporal transgene control in Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA. 115(15), 3900‒3905.
Scott E.K., Mason L., Arrenberg A.B., Ziv L., Gosse N.J., Xiao T., Chi N.C., Asakawa K., Kawakami K., Baier H. (2007) Targeting neural circuitry in zebrafish using GAL4 enhancer trapping. Nat. Methods. 4(4), 323–326.
Shay J.W., Bacchetti S. (1997) A survey of telomerase activity in human cancer. Eur. J. Cancer. 33(5), 787‒791.
Altieri D.C. (2008) Survivin, cancer networks and pathway-directed drug discovery. Nat. Rev. Cancer. 8(1), 61‒70.
Zettler J., Schütz V., Mootz H.D. (2009) The naturally split Npu DnaE intein exhibits an extraordinarily high rate in the protein trans-splicing reaction. FEBS Lett. 583(5), 909‒914.
Murofushi Y., Nagano S., Kamizono J., Takahashi T., Fujiwara H., Komiya S., Matsuishi T., Kosai K. (2006) Cell cycle-specific changes in hTERT promoter activity in normal and cancerous cells in adenoviral gene therapy: a promising implication of telomerase-dependent targeted cancer gene therapy. Int. J. Oncol. 29(3), 681‒688.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология