Молекулярная биология, 2020, T. 54, № 2, стр. 262-266
Область контактов кластеров генов рРНК с геном FANK1 соответствует неактивному хроматину
О. В. Кретова a, Д. М. Федосеева a, Ю. В. Кравацкий a, Е. С. Клушевская a, И. Р. Алембеков a, И. Ю. Словохотов a, Н. А. Чуриков a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: tchurikov@eimb.ru
Поступила в редакцию 04.07.2019
После доработки 22.08.2019
Принята к публикации 24.08.2019
Аннотация
Гены рРНК играют важную роль в дифференцировке клеток и эпигенетической регуляции экспрессии многих генов. Нами проведен анализ мест контактов кластеров генов рРНК человека с помощью метода 4С (circular chromosome conformation capture). В области хромосомы 10 обнаружены частые контакты кластеров генов рРНК в 5'-концевой области гена FANK1. Места контактов совпадают с границей изменения состояний хроматина и фазирования нуклеосом. Соседние гены DHX32, BCCIP и UROS не имеют контактов с генами рРНК, расположены в активном хроматине и по данным РНК-секвенирования активно транскрибируются, тогда как ген FANK1 практически не транскрибируется и находится в неактивном хроматине. Тепловой шок приводит к нарушению большей части контактов с генами рРНК и активации транскрипции гена FANK1 почти в 4 раза. Предполагается, что контакты генов рРНК могут вызывать сайленсинг гена FANK1 в клетках HEK293T.
Пространственные структуры хромосом важны для эпигенетической регуляции экспрессии генов [1‒4]. Известно, что кластеры генов рРНК (рДНК), расположенные в пяти акроцентрических хромосомах человека, образуют многочисленные контакты с разными районами хромосом [5]. На эмбриональных стволовых клетках мыши показано, что гетерохроматиновые области кластеров рДНК инициируют гетерохроматинизацию в разных районах хромосом, а ингибирование такой репрессии рДНК останавливает дифференцировку этих клеток [6]. Механизмы подобного влияния рДНК не установлены. Не известны и гены, активность которых сопряжена с работой генов рРНК. Для выявления генов, которые эпигенетически регулируются с помощью контактов с кластерами генов рРНК, мы использовали метод 4С, предназначенный для обнаружения и количественной оценки межхромосомных и внутрихромосомных контактов выбранной области генома (якорь). В настоящей работе представлены данные анализа области 260 т.п.н. хромосомы 10 человека, в которой нами обнаружены частые контакты генов рРНК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты 4С (circular chromosome conformation capture). Препараты ДНК выделяли из клеток линии HEK293T, происходящей из почки эмбриона человека [7]. Исходные чтения глубокого секвенирования двух реплик депонированы в базу данных NCBI (accession number GSE49193). Картирование чтений 4C на геном человека версии hg19 проводили согласно [7].
Эксперименты РНК-сек. Препараты РНК получали после лизирования клеток смесью Trisol (“Invitrogen”, США). Качество РНК тестировали с помощью биоанализатора Agilent, затем проводили очистку поли(А)-содержащей РНК. Библиотеки готовили с помощью наборов реактивов TruSeq Stranded RNA (“Illumina”, США). Данные глубокого секвенирования, проведенного с использованием прибора HiSeq1500 (“Illumina”, США), поместили в базу данных NCBI (accession number GSM2587583).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Контакты генов рРНК в области, содержащей ген FANK1 в хромосоме 10
На рис. 1 представлена область длиной 260 т.п.н. хромосомы 10. Она содержит несколько генов, расположенных на плюс- и минус-цепях. Видно, что в области первого интрона гена FANK1 и перед ним расположены сайты контактов кластеров генов рРНК. Эта группа контактов большей частью находится в районе длиной около 40 т.п.н. (показана красной рамкой на рис. 1).
Рис. 1.
Физическая карта района 260 т.п.н. субтеломерной области хромосомы 10 человека в браузере IGB (координаты по версии hg19). Вверху указаны места контактов данной области с генами рРНК. По оси Y приведены значения lg числа картированных чтений глубокого секвенирования – 4C-рДНК, полученные для исходных клеток HEK293T (HS-), и клеток, подвергнутых тепловому шоку (HS+). Пики контактов рДНК показаны синим или красным соответственно. Ниже указаны гены, расположенные в этом сегменте хромосомы 10 (на плюс- и минус-цепях), а также приведены эпигенетические метки (браузер UCSC), включающие метку активного хроматина H3K27ac, гиперчувствительные к ДНКазе I сайты, сайты связывания факторов транскрипции, данные ChIA-PET для CTCF и РНК-полимеразы II. Кроме того, указаны сайты картированных малых некодирующих РНК и позиции нуклеосом в этом районе. На треках ChromHMM зеленым показаны области транскрипции; красным – промоторы; серым и белым – репрессированный хроматин.
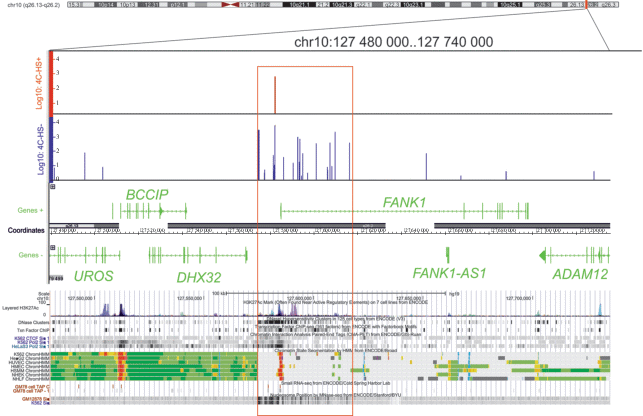
Небольшие пики меток активного хроматина H3K27ac видны в нескольких районах указанного фрагмента хромосомы 10. Эти отчасти перекрывающиеся между собой пики ацетилированного гистона H3 выявлены в семи линиях клеток человека разного происхождения, отобранных для такого анализа в проекте ENCODE. В 5'-концевой области гена FANK1 имеются узкие пики H3K27ac синего и фиолетового цвета, что соответствует линиям K562 и NHEK. В остальных пяти линиях клеток (GM12872, H1-hESC, HSMM, HUVEC, NHLF) данная гистоновая метка в гене FANK1 отсутствует. Эти данные свидетельствуют о том, что в перечисленных пяти клеточных линиях ген FANK1 либо не активен, либо слабо активен.
Интересно, что область контактов генов рРНК точно совпадает с границей изменения состояний хроматина (дорожки ChromHMM, рис. 1). Белый цвет на этих дорожках указывает на репрессированный хроматин, а зеленый – на области транскрипции. Кроме того, здесь же расположены и границы как фазирования нуклеосом, так и паттерна распределения сайтов, гиперчувствительных к ДНКазе I. На вовлечение этой области гена FANK1 в межхромосомные взаимодействия независимо указывают данные ChIA-PET для CTCF и РНК-полимеразы II (рис. 1). Метод ChIA-PET (Chromatin Interaction Analysis by Paired-End Tag Sequencing) включает иммунопреципитацию препаратов хроматина после лигирования контактирующих областей хроматина [8]. Эти сигналы намного сильнее выражены в клетках HeLa.
Красные сигналы на дорожках ChromHMM указывают на промоторные области. Согласно ChromHMM (рис. 1), промотор в гене FANK1 не активен, поскольку в семи использованных линиях клеток не обнаружена его активная транскрипция (на дорожках ChromHMM показано зеленым цветом). Напротив, промотор гена DHX32, который транскрибируется с другой цепи ДНК, в этих клетках активен. Можно предположить, что ген FANK1 активно транскрибируется и в клетках HeLa, поскольку имеется сильный сигнал ChIA-PET для РНК-полимеразы II, соответствующий данному промотору. Интересно, что в области контактов картированы малые некодирующие РНК. Они соответствуют области репрессированного промотора гена FANK1.
Эти данные позволяют предположить, что контакты генов рРНК в области гена FANK1 могут приводить к эпигенетическому сайленсингу, имеющему четкую границу распространения у 5'‑концевой части гена. Для проверки этого предположения необходимо выяснить, активен ли ген FANK1 в клетках HEK293T, в которых мы обнаружили контакты генов рРНК.
Ген FANK1 не активен в клетках HEK293T
Для изучения активности транскрипции гена FANK1 и трех генов, расположенных перед ним – DHX32, BCCIP и UROS, использовали данные РНК-сек, полученные нами как для исходных клеток HEK293T, так и для клеток, подвергнутых тепловому шоку. Результаты 4С-рДНК, приведенные на рис. 1, указывают на то, что после теплового шока пропадает большая часть контактов генов рРНК в области гена FANK1. Остается лишь один пик в области 127582 т.п.н. Известно, что тепловой шок приводит к репрессии генов рРНК [9]. Поэтому было интересно выяснить, как репрессия генов рРНК и резкое уменьшение их контактов в области гена FANK1 скажется на его транскрипции. Оказалось, что исходные клетки содержат лишь единичные транскрипты гена (рис. 2). После теплового шока, который приводит к утрате большей части контактов генов рРНК, транскрипция существенно возрастает (почти в 4 раза). Транскрипты гена FANK1-AS1 в этих экспериментах не обнаружены. Ген DHX32, расположенный на расстоянии 5 т.п.н. от ближайшего к нему контакта генов рРНК, в исходных клетках транскрибируется значительно активнее (примерно в 140 раз), а более удаленный от района контактов ген BCCIP – более чем в 500 раз активнее гена FANK1. Эти данные позволяют сделать вывод о том, что контакты генов рРНК в исходных клетках могут вызывать сайленсиг гена FANK1. Контакты кластеров генов рРНК приводят к изменению состояния хроматина, которое имеет четкую границу у 5'-конца гена. Репрессирующее влияние этих контактов в указанной области хромосомы 10 не распространяется выше (upstream).
Рис. 2.
Транскрипция четырех генов в изучаемой области хромосомы 10 человека в клетках HEK293T. Представлена активность гена FANK1 и генов, расположенных перед ним – DHX32, BCCIP и UROS. Приведены результаты РНК-сек (по две биологических реплики для исходных клеток и клеток, подвергнутых тепловому шоку (HS+)). В каждом случае указано число чтений, соответствующих данному гену, на 10 млн чтений РНК-сек. Масштабы по оси Y существенно отличаются. * – p < 0.05.
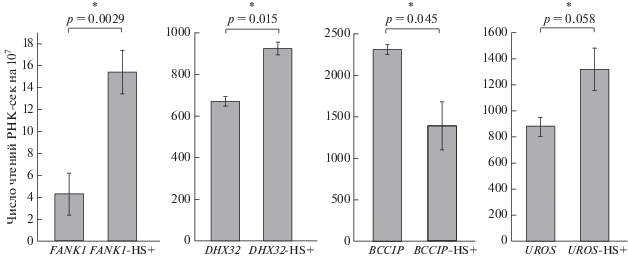
Гены BCCIP и UROS, указанные на рис. 1 и рис. 2, расположены на разных цепях в данной области хромосомы 10. Они имеют сближенные старты транскрипции (transcription start sites, TSS) и расположены в области активного хроматина. TSS этих генов отстоят только на 290 п.н., т.е. имеют небольшую область общего промотора. Однако в исходных клетках линии HEK293T они обнаруживают разную активность. Ген BCCIP транскрибируется примерно в 2.8 раза активнее, чем ген UROS. После теплового шока эти гены также ведут себя по-разному: BCCIP транскрибируется слабее (примерно в 1.6 раза), а ген UROS сильнее (примерно в 1.56 раза). Эти данные указывают на важную роль не только общей промоторной области в регуляции этих генов, но и каких-то других факторов. Кластеры генов рРНК являются только одним из эпигенетических регуляторов, которые могут избирательно вызывать репрессию в области гена FANK1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ген FANK1 экспрессируется в основном в яичках и фаллопиевых трубах (https://www.genecards.org/ cgi-bin/carddisp.pl?gene=FANK1). Клетки HEK293T происходят из нейронов эмбриональной почки человека [10, 11]. Наши данные о сайленсинге гена FANK1 соответствуют результатам, согласно которым экспрессия данного гена минимальна в почках. По данным Gene Onthology FANK1 кодирует фактор транскрипции и регулятор апоптоза (https://www.uniprot.org/uniprot/Q8TC84). Белок FANK1 содержит анкириновые повторы (ankyrin repeats), которые участвуют в белок-белковых взаимодействиях [12].
Механизмы, обеспечивающие сайленсинг гена FANK1, не описаны. Наши данные свидетельствуют о том, что репрессия гена FANK1 может быть связана с контактами генов рРНК. Можно предположить, что репрессированные или активные кластеры генов рРНК могут образовывать в ядре специфические компартменты, способные репрессировать или активировать хромосомные гены в их составе. Ранее обнаружили, что места контактов генов рРНК часто приходятся на самые мощные пики гистоновой метки H3K27ac, протяженностью до 50 т.п.н. [5]. Такие области могут соответствовать суперэнхансерам [13]. Мы полагаем, что с такими сайтами хромосом контактируют работающие кластеры генов рРНК, которые и активируют эти суперэнхансеры, а также прилежащие к ним гены. С областью гена FANK1 могут контактировать молчащие кластеры генов рРНК, распространяя таким образом сайленсинг на другие гены.
Гены FANK1, BCCIP, UROS и DHX32 не связаны друг с другом функционально. Наши данные свидетельствуют о том, что эти гены регулируются с помощью разных механизмов, несмотря на локализацию в составе относительно небольшого сегмента ДНК, размер которого меньше, чем у типичного топологического домена. Даже гены BCCIP и UROS, имеющие общий двунаправленный промотор, экспрессируются независимо и с разной интенсивностью. Очевидно, что точные механизмы эпигенетической регуляции весьма разнообразны. Недавно было обнаружено, что ген Tlk дрозофилы имеет множественные контакты с генами рРНК, которые участвуют в его активации путем образования петель хроматина вокруг мест контактов [14]. Предполагается, что такие петли обеспечивают локальную регуляцию гена.
Механизмы эпигенетической регуляции экспрессии генов с помощью контактов с генами рРНК должны быть детально исследованы. В частности, необходимо выяснить, способны ли эти контакты изменять гистоновые метки, а также понять роль некодирующих РНК, обнаруживаемых в местах контактов. Как именно скажется удаление областей наиболее частых контактов генов рРНК в некодирующих областях генома на экспрессии близко расположенных генов мы планируем выяснить с использованием геномного редактирования.
Исследование выполнено при поддержке Российского научного фонда (грант №18-14-00122). Картирование истинных ДНКаза-I-гиперчувствительных сайтов поддержано грантом Российского фонда фундаментальных исследований (№17-04-02152).
Настоящая работа не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dekker J., Rippe K., Dekker M. (2002) Capturing chromosome conformation. Science. 95, 1306–1311. https://doi.org/10.1126/science.1067799
Ulianov S.V., Khrameeva E.E., Gavrilov A.A., Flyamer I.M., Kos P., Mikhaleva E.A., Penin A.A., Logacheva M.D., Imakaev M.V., Chertovich A., Gelfand M.S., Shevelyov Y.Y., Razin S.V. (2016) Active chromatin and transcription play a key role in chromosome partitioning into topologically associating domains. Genome Res. 26, 70‒84. https://doi.org/10.1101/gr.196006.115
Sidorenko D.S., Sidorenko I.A., Zykova T.Y., Goncharov F.P., Larsson J., Zhimulev I.F. (2019) Molecular and genetic organization of bands and interbands in the dot chromosome of Drosophila melanogaster. Chromosoma. 128, 97‒117. https://doi.org/10.1007/s00412-019-00703-x
Sarnataro S., Chiariello A.M., Esposito A., Prisco A., Nicodemi M. (2017) Structure of the human chromosome interaction network. PLoS One. 12(11), e0188201. eCollection 2017.https://doi.org/10.1371/journal.pone.0188201
Tchurikov N.A., Fedoseeva D.M., Sosin D.V., Snezhkina A.V., Melnikova N.V., Kudryavtseva A.V., Kravatsky Y.V., Kretova O.V. (2015) Hot spots of DNA double-strand breaks and genomic contacts of human rDNA units are involved in epigenetic regulation. J. Mol. Cell. Biol. 7, 366‒382. https://doi.org/10.1093/jmcb/mju038
Savić N., Bär D., Leone S., Frommel S.C., Weber F.A., Vollenweider E., Ferrari E., Ziegler U., Kaech A., Shakhova O., Cinelli P., Santoro R. (2014) lncRNA maturation to initiate heterochromatin formation in the nucleolus is required for exit from pluripotency in ESCs. Cell Stem Cell. 15, 720‒734. https://doi.org/10.1016/j.stem.2014.10.005
Кретова О.В., Федосеева Д.М., Кравацкий Ю.В., Алембеков И.Р., Словохотов И.Ю., Чуриков Н.А. (2019) Гомеотические гены DUX4, контролирующие развитие эмбриона человека на стадии двух бластомеров, окружены областями, которые образуют контакты с кластерами генов рРНК. Молекуляр. биология. 53(2), 268‒273. https://doi.org/10.1134/S0026898419020083
Fullwood M.J., Ruan Y. (2009) ChIP-based methods for the identification of long-range chromatin interactions. J. Cell. Biochem. 107, 30–39. ISSN 1097-4644.https://doi.org/10.1002/jcb.22116
Zhao Z., Sentürk N., Song C., Grummt I. (2018) lncRNA PAPAS tethered to the rDNA enhancer recruits hypophosphorylated CHD4/NuRD to repress rRNA synthesis at elevated temperatures. Genes Dev. 32, 836‒848. https://doi.org/10.1101/gad.311688.118
Shaw G., Morse S., Ararat M., Graham F.L. (2002) Preferential transformation of human neuronal cells by human adenoviruses and the origin of HEK 293 cells. FASEB J. 16, 869‒971. https://doi.org/10.1096/fj.01-0995fje
Graham F.L., Smiley J., Russell W.C., Nairn R. (1977) Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J. Gen. Virol. 36, 59‒74. https://doi.org/10.1099/0022-1317-36-1-59
Wang H., Song W., Hu T., Zhang N., Miao S., Zong S., Wang L. (2011) Fank1 interacts with Jab1 and regulates cell apoptosis via the AP-1 pathway. Cell. Mol. Life Sci. 68, 2129–2139. https://doi.org/10.1007/s00018-010-0559-4
Hnisz D., Abraham B.J., Lee T.I., Lau A., Saint-André V., Sigova A.A., Hoke H.A., Young R.A. (2013) Super-enhancers in the control of cell identity and disease. Cell. 155, 934–947.
Кретова О.В., Федосеева Д.М., Словохотов И.Ю., Клушевская Е.С., Кравацкий Ю.В., Чуриков Н.А. (2019) Гены рРНК дрозофилы образуют устойчивые контакты с геном Tlk в области экспрессии малых РНК и влияют на организацию петлевых доменов. Молекуляр. биология. 54, в печати.https://doi.org/10.31857/S0026898420020081
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


