Молекулярная биология, 2020, T. 54, № 2, стр. 313-320
Паргилин и n-хлорфенилаланин снижают экспрессию гена Ptpn5, кодирующего стриатумспецифичную протеинтирозинфосфатазу (STEP), в стриатуме мышей
Е. А. Куликова a, *, **, Д. В. Фурсенко a, Е. Ю. Баженова a, А. В. Куликов a
a Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: kulikova@bionet.nsc.ru
** E-mail: lisa_kulikova@ngs.ru
Поступила в редакцию 27.08.2019
После доработки 05.11.2019
Принята к публикации 06.11.2019
Аннотация
Стриатумспецифичная протеинтирозинфосфатаза (STEP), кодируемая геном Ptpn5 и впервые обнаруженная в стриатуме, экспрессируется в нейронах в различных структурах мозга. Белок STEP участвует в регуляции пластичности нервной системы и изменения его активности ассоциированы у человека с нейродегенеративными заболеваниями. Показано, что ингибитор белка STEP, гидрохлорид 8-трифторметил-1,2,3,4,5-бензопентатиепин-6-амина (ТС-2153), оказывает влияние на серотониновую систему головного мозга. В то же время непосредственное участие серотониновой системы мозга в регуляции фермента STEP ранее не изучали. Нами проанализировано влияние фармакологического изменения уровня серотонина в мозге на экспрессию гена Ptpn5 и активность белка STEP у половозрелых самцов мышей линии C57BL/6J. Уровень серотонина в головном мозге понижали или повышали с помощью трехкратного внутрибрюшинного введения ингибиторов его синтеза (n-хлорфенилаланина) или разрушения (паргилина). Изменение концентрации серотонина оценивали с помощью высокоэффективной жидкостной хроматографии. Активность STEP определяли спектрофотометрически в супернатанте по изменению скоростей дефосфорилирования п-нитрофенилфосфата в отсутствие и присутствии селективного ингибитора STEP – TC-2153. Уровень мРНК Ptpn5 определяли с помощью количественной ОТ-ПЦР в реальном времени. Экспрессия гена Ptpn5 в стриатуме была в 3 раза выше, чем в коре или гиппокампе. В данной работе впервые показано, что как повышение, так и понижение концентрации серотонина в мозге сопряжено со снижением уровня мРНК Ptpn5 в стриатуме. Активность STEP в стриатуме и коре была достоверно выше по сравнению с гиппокампом. Однако ни паргилин, ни n-хлорфенилаланин не влияли на активность STEP в исследованных структурах мозга. Таким образом, нами разработан метод определения активности STEP в мозге в присутствии других фосфатаз и впервые показано, что n-хлорфенилаланин и паргилин снижают экспрессию гена Ptpn5 в стриатуме мышей.
ВВЕДЕНИЕ
Стриатумспецифичная протеинтирозинфосфатаза (striatal-enriched protein tyrosine phosphatase ‒ STEP) принадлежит к большому семейству тирозиновых фосфатаз, отщепляющих фосфатные группы от остатков тирозина в молекулах белков. Этот белок экспрессируется преимущественно в нейронах в различных структурах мозга [1]. Белок STEP кодируется геном PTPN5, расположенном на хромосоме 11 у человека [2], и геном Ptpn5 на хромосоме 7 у мышей [1]. В настоящее время известно 4 различные изоформы этого белка: STEP46, STEP61, STEP20 и STEP38, ‒ из которых только STEP46 и STEP61 имеют каталитический центр и способны регулировать активность других белков [3].
STEP дефосфорилирует и тем самым дезактивирует киназы ERK1/2, p38 [4, 5], Fyn [6], Pyk2 [7], а также субъединицы NMDA и AMPA рецепторов [8], которые участвуют в регуляции передачи сигнала в нейроне. Показана ассоциация как увеличения, так и снижения уровня экспрессии STEP с тяжелыми нейродегенеративными заболеваниями [3].
Cеротонин (5-HT) ‒ один из ключевых нейромедиаторов головного мозга, участвующий в развитии различных психопатологий [9, 10]. Серотониновая система направляет аксоны из ядер шва во все отделы головного мозга, за счет чего участвует в регуляции множества физиологических функций и форм поведения [11]. Триптофангидроксилаза 2 (ТПГ2) ‒ ключевой фермент синтеза 5-HT, который гидроксилирует L-триптофан до L-5-гидрокситриптофана [12‒14]. Известно, что введение ингибитора ТПГ2, n-хлорфенилаланина, приводит к значительному снижению уровня 5-HT в мозге [15]. Ключевой фермент разрушения 5-HT ‒ моноаминоксидаза А (МАОА), локализующаяся на внешней мембране митохондрий [16]. Блокада МАОА с помощью паргилина приводит к повышению уровня 5-HT в мозге [17, 18].
Ранее показано, что селективный ингибитор белка STEP, гидрохлорид 8-трифторметил-1,2,3,4,5-бензопентатиепин-6-амина (TC-2153), оказывает влияние на 5-HT-систему мозга: увеличивает уровень 5-HT в гипоталамусе [19], снижает уровень мРНК генов, кодирующих серотониновый 5-HT1A рецептор и МАОА, в среднем мозге [20], а также подавляет функциональную активность и понижает уровень рецептора 5-HT2A в мозге мышей [21]. В то же время влияние изменений в 5-HT-системе на активность или экспрессию STEP ранее не изучали.
Целью работы было исследование влияния фармакологического снижения и повышения уровня 5‑HT на уровень мРНК Ptpn5 и активность белка STEP в головном мозге мышей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные и воздействия. Эксперименты проводили на 24 половозрелых самцах мышей линии C57BL/6J (возраст 11 недель, вес 26 ± 1 г) со статусом SPF (specific pathogen free) на протяжении всего эксперимента. В возрасте трех недель животных отсаживали от матерей и содержали по 4 особи в индивидуально вентилируемых клетках Optimice (“Animal Care Systems, Inc.”) при температуре 24°С, влажности 45‒50% и в стандартном для вивария фотопериоде (14 ч свет, 10 ч темнота). Стерильный корм и воду животные получали без ограничения. За 2 суток до начала экспериментальных процедур животных рассаживали по одиночке в клетки Optimice для снятия группового эффекта. Животных разделяли на 3 экспериментальные группы ‒ по 8 животных в каждой, ‒ которым ежедневно в течение 3 суток внутрибрюшинно вводили физиологический раствор (физраствор), ингибитор ТПГ2 n-хлорфенилаланин в дозе 300 мг/кг или ингибитор МАОА паргилин в дозе 20 мг/кг. Препараты вводили в объеме 100 мкл на 10 г массы. На третьи сутки, через 2 ч после инъекции, животных усыпляли CO2 (1‒2 мин), декапитировали, извлекали головной мозг, выделяли кору, гиппокамп и стриатум.
Условия содержания животных и экспериментальные процедуры проводили в соответствии с правилами Совета Европейского Парламента (Директива 2010/63/EU от 22 сентября 2010 года) и были одобрены Комиссией по биоэтике ИЦиГ СО РАН. Разведение и содержание животных поддержано проектами № 0259-2019-0002 и RFMEFI62119X0023.
Выделение РНК и ПЦР с обратной транскрипцией (ОТ-ПЦР). Выделение РНК проводили из половинок коры, гиппокампа и стриатума в 500 мкл Trizol Reagent (“Ambion”, “Life Technologies”, США) согласно протоколу производителя. Следы геномной ДНК удаляли с помощью ДНКазы, свободной от РНКаз (“Promega”, США). Синтез кДНК проводили с помощью набора R01-250 (“Биолабмикс”, Россия), согласно протоколу производителя. Концентрацию мРНК искомых генов определяли методом количественной ОТ-ПЦР с помощью наборов R-402 (“Синтол”, Россия) и специфически подобранных праймеров (табл. 1). Праймеры для гена Ptpn5 были подобраны на последний экзон, который кодирует транскрипты двух активных изоформ белка: STEP61 и STEP46. Полученные данные нормировали и нормировали на 100 копий гена домашнего хозяйства Polr2a, кодирующего ДНК-зависимую РНК-полимеразу. Уровень экспрессии оценивали по калибровочной кривой, построенной по известным концентрациям геномной ДНК мыши [22, 23].
Таблица 1.
Праймеры, использованные при проведении количественной ОТ-ПЦР
| Ген | Праймерa | Тпл | Длина ампликона | Эффективность |
|---|---|---|---|---|
| Ptpn5b | F 5′-ACCTGTGAGACATCTTTCTGTG-3′ | 61 | 196 | 1.897 ± 0.042 |
| R 5′-TCCGTTTGCCGTGGAATAA-3′ | ||||
| Polr2a | F 5′-GTTGTCGGGCAGCAGAATGTAG-3′ | 63 | 188 | 1.905 ± 0.024 |
| R 5′-TCAATGAGACCTTCTCGTCCTCC-3′ |
Определение уровня 5-HT. Половинки коры, гиппокампа и стриатума гомогенизировали в 200 мкл буфера 50 мМ Трис-HCl (pH 7.6). Из полученного гомогената отбирали 50-мкл аликвоту и смешивали с 150 мкл 0.6 М HClO4, центрифугировали 20 мин при 12 700 об/мин (4°С). Полученный супернатант использовали для определения уровня 5-HT с помощью жидкостного хроматографа (“Shimadzu Corporation”, США) с электрохимическим детектором DECADE II™ (“Antec”, Нидерланды), согласно раннее описанной методике [24]. Осадок использовали для определения концентрации общего белка в пробе по Брэдфорду (“BioRad”, США), согласно протоколу производителя. Концентрацию 5-НТ в пробе определяли по площади пика с помощью программы LabSolution LG/GC (“Shimadzu Corporation”) и нормировали по калибровочной кривой, полученной с использованием стандартов: 1, 2 и 3 нг 5-HT [24]. Содержание 5-HT выражали в нг/мг общего белка.
Определение активности STEP. Из гомогената, полученного на стадии гомогенизации проб для определения количества 5-HT, отбирали 150-мкл аликвоту и центрифугировали 20 мин при 12 700 об/мин (4°С). Супернатант использовали для определения активности STEP с помощью оригинальной, разработанной нами методики, основанной на ферментативной реакции отщепления фосфата от п-нитрофенилфосфата [25] с образованием окрашенного продукта ‒ n-нитрофенола.
Для начала в получившемся супернатанте определяли концентрацию белка по Брэдфорду (“BioRad”) и разводили его до концентрации 0.5‒1.5 мкг/мкл, так как в предварительных исследованиях нами показано, что скорость образования продукта реакции, п-нитрофенола, линейно зависит от концентрации белка в диапазоне от 0.2 до 1.5 мкг/мкл.
Определение ферментативной активности STEP проводили в буфере 50 мМ MES (2-(N-морфолино)этансульфоновая кислота), pH 7.0, при температуре 35°С на спектрофотометре Multiscan GO (“Thermo Fisher Scientific”, США). Объем реакционной смеси составлял 150 мкл. В планшет Costar Assay Plate (“Corning”, США) добавляли 100 мкл буфера, 20 мкл полученного супернатанта и 30 мкл субстрата ‒ n-нитрофенилфосфата (“Acros organics”, Китай) ‒ в конечной концентрации 0.8 мM. Оптическую плотность реакционной смеси измеряли при длине волны 405 нм каждые 5 мин в течение 40 мин, после чего добавляли 5 мкл специфического ингибитора STEP, TC-2153 (синтезирован в НИОХ СО РАН, Россия), до конечной концентрации 10 мкМ и измеряли оптическую плотность каждые 5 мин на протяжении еще 40 мин в тех же условиях. Скорость реакции представляли в виде графика временной зависимости накопления п-нитрофенола, которая сохраняла линейность в течение всего эксперимента (рис. 1).
Рис. 1.
Кинетика накопления n-нитрофенола ‒ продукта дефосфорилирования п-нитрофенилфосфата ‒ в ткани стриатума мышей (C57BL/6J) в отсутствие или в присутствии 10 мкМ TC-2153 ‒ ингибитора белка STEP. Реакцию проводили в 150 мкл реакционной смеси, содержащей буфер MES (pH 7.0), 0.8 мM п-нитрофенилфосфат и 0.03 мг выделенного из стриатума белка, при температуре 35°С.
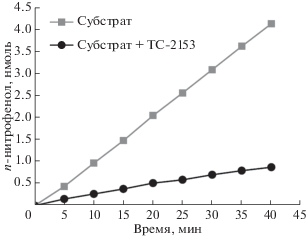
В качестве стандартов для построения калибровочной кривой и вычисления коэффициента регрессии (Scal) использовали растворы n-нитрофенола (продукта реакции) с концентрациями 0.2, 0.1, 0.05 и 0.025 мM.
Общую и STEP-специфичную фосфатазную активность (соответственно Vtotal и Vstep) рассчитывали по формулам (1) и (2) и выражали в наномолях п-нитрофенола, образовавшегося за 1 мин, на 1 мг белка (нмоль · мин–1 · мг–1):
(1)
${{V}_{{{\text{total}}}}} = {{{{O}_{0}}} \mathord{\left/ {\vphantom {{{{O}_{0}}} {({{S}_{{{\text{cal}}}}} \cdot P)}}} \right. \kern-0em} {({{S}_{{{\text{cal}}}}} \cdot P)}},$(2)
${{V}_{{{\text{step}}}}} = {{({{O}_{0}} - {{O}_{i}})} \mathord{\left/ {\vphantom {{({{O}_{0}} - {{O}_{i}})} {({{S}_{{{\text{cal}}}}} \cdot P)}}} \right. \kern-0em} {({{S}_{{{\text{cal}}}}} \cdot P)}},$Статистика. Результаты представляли как среднее ± ошибка среднего и анализировали с помощью двухфакторного ANOVA для зависимых наблюдений с межгрупповым фактором “воздействие” и внутригрупповым фактором “структура”. Сравнение post hoc проводили по Фишеру. Результаты считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние п-хлорфенилаланина и паргилина на уровень 5-HT в мозге
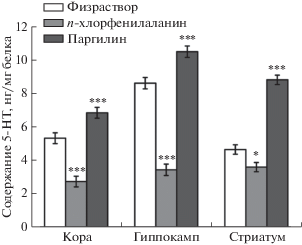
Выявлены значимые эффекты факторов “воздействие” (F2,21 = 243.1, p < 0.001), “структура” (F2,42 = 51.3, p < 0.001) и взаимодействия “воздействие” × “структура” (F4,42 = 14.2, p < 0.001) на уровень 5-HT. Трехкратное введение ингибитора ТПГ2, п-хлорфенилаланина, снизило уровень 5-HT в коре до 51%, в гиппокампе на 40% и в стриатуме на 77%, тогда как введение ингибитора МАОА, паргилина, повысило этот показатель до 128% в коре, 122% в гиппокампе и 190% в стриатуме (рис. 2). Таким образом, мы убедились, что выбранные дозы ингибиторов и способ их введения (трехкратная в/б инъекция), действительно, существенно изменяют уровень 5-HT и наблюдаемые эффекты ассоциированы с изменениями в 5-HT-системе мозга.
Влияние п-хлорфенилаланина и паргилина на уровень мРНК Ptpn5 в мозге
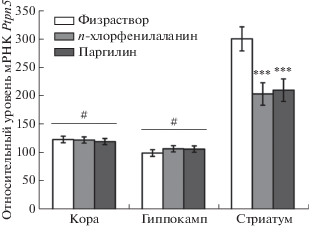
Выявлены значимые эффекты факторов “воздействие” (F2,20 = 4.58, p < 0.05), “структура” (F2,40 = 107.5, p < 0.001) и взаимодействия “воздействие” × “структура” (F4,40 = 6.79, p < 0.001) на уровень мРНК Ptpn5. Этот показатель в стриатуме был примерно в 3 раза выше, чем в коре и гиппокампе (рис. 3). Трехкратное введение п-хлорфенилаланина и паргилина значительно снижало уровень мРНК Ptpn5 в стриатуме, но не влияло на экспрессию Ptpn5 в коре и гиппокампе (рис. 3).
Рис. 3.
Относительный уровень мРНК гена Ptpn5 (на 100 копий мРНК Polr2a) в коре, гиппокампе и стриатуме мышей линии C57BL/6J после трехкратного в/б введения физиологического раствора (физраствор), 300 мг/кг n-хлорфенилаланина или 20 мг/кг паргилина. ***p < 0.001 vs физиологического раствора в стриатуме, #p < 0.001 vs стриатум.
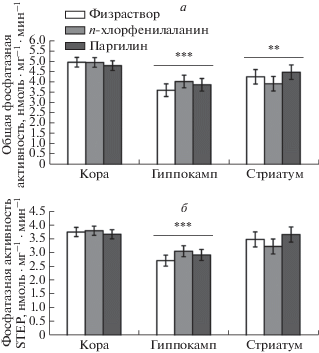
Влияние п-хлорфенилаланина и паргилина на общую фосфатазную активность и отдельно на активность STEP в мозге
Выявлен значимый эффект фактора “структура” (STEP: F2,21 = 12.41, p < 0.001; общая фосфатазная активность: F2,21 = 10.55, p < 0.001), но не факторов “воздействие” (F2,42 < 1) и взаимодействия “воздействие” × “структура” (F2,42 < 1) на активность STEP и общую активность всех фосфатаз. Наибольшие значения общей фосфатазной активности и STEP обнаружены в коре и стриатуме (рис. 4). Ни n-хлорфенилаланин, ни паргилин не влияли на эти показатели ни в одной из исследуемых структур мозга (рис. 4). Выявлены высокие коэффициенты корреляции между активностью STEP и общей фосфатазной активностью в коре (r = 0.96, n = 24, p < 0.01), гиппокампе (r = 0.99, n = 24, p < 0.001) и стриатуме (r = 1.0, n = 24, p < < 0.01). В то же время активность STEP не коррелировала с уровнем мРНК Ptpn5 ни в одной из исследованных структур мозга: коре (r = 0.41, n = 24, p > 0.05), гиппокампе (r = 0.26, n = 24, p > 0.05) и стриатуме (r = –0.06, n = 23, p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее установлено, что однократное введение селективного ингибитора STEP ‒ TC-2153 ‒ приводило к повышению уровня 5-HT в гипоталамусе [19], тогда как его многократное введение снижало уровень экспрессии генов, кодирующих МАОА и рецептор 5-НТ1А в среднем мозге [20], а также функциональную активность и уровень рецептора 5-HT2A в мозге мышей [21]. На основании этих результатов нами было сделано предположение о связи между STEP и 5-HT-системой мозга [26], хотя непосредственное участие 5-HT в регуляции экспрессии и/или активности STEP ранее никто не изучал.
В представленной работе мы использовали стандартные и общепризнанные модели фармакологического снижения и повышения уровней 5-HT в мозге, а именно введение соответственно ингибитора триптофангидроксилазы, n-хлорфенилаланина, или моноаминоксидазы, паргилина, которые широко используются для исследования роли 5-HT в регуляции поведения и физиологических функций [27‒33]. С помощью этих фармакологических моделей исследована ассоциация избытка и недостатка 5-HT с уровнем мРНК Ptpn5 и ферментативной активностью STEP в коре, гиппокампе и стриатуме. Выбор этих структур мозга обусловлен тем, что в них экспрессируется STEP, а нарушение их работы приводит к развитию целого ряда нейропатологий. Согласно полученным в данной работе результатам ВЭЖХ, введение ингибитора ТПГ2 сопровождалось снижением уровня 5-НТ приблизительно в 2 раза по сравнению с контролем, а ингибитора МАОА ‒ повышением почти в 1.5 раза в зависимости от структуры мозга.
В работе впервые описана разработанная нами методика измерения активности белка STEP в гомогенате мозга в присутствии других фосфатаз. Используя ее, мы показали, что паргилин и n‑хлорфенилаланин не влияют на активность STEP в коре, гиппокампе и стриатуме мышей. В тоже время обнаружено значительное влияние этих препаратов на экспрессию гена Ptpn5, кодирующего белок STEP.
Для определения уровня мРНК Ptpn5 использованы праймеры, подобранные на последний экзон этого гена, который кодирует транскрипты двух активных изоформ белка STEP: STEP46 и STEP61. Таким образом, уровень мРНК Ptpn5, измеренный в данном исследовании, представляет собой сумму этих двух транскриптов. Самый высокий уровень экспрессии гена Ptpn5 выявлен в стриатуме ‒ он в 3 раза выше, чем в коре и гиппокампе. Такая высокая экспрессия гена Ptpn5 в этой структуре мозга неслучайна и только подтверждает название кодируемого им белка STEP (striatal-enriched protein tyrosine phosphatase).
В представленной работе впервые показано, что в стриатуме, где присутствуют изоформы STEP46 и STEP61 [3], экспрессия гена Ptpn5 снижается примерно до 70% от нормы, как после введения паргилина, так и n-хлорфенилаланина. В то же время эти препараты не влияли на экспрессию гена Ptpn5 в коре и гиппокампе, где у мышей присутствует только изоформа STEP61 [3]. Таким образом, стриатумспецифичные изменения в экспрессии этого гена могут быть обусловлены присутствием изоформы STEP46 в этой структуре мозга и ее отсутствием в коре и гиппокампе.
Более того, можно предположить, что 5-НТ оказывает влияние на экспрессию STEP не напрямую, а опосредованно ‒ через свои рецепторы. Известно, что на поверхности стриатума присутствуют как стимулирующие [34], так и подавляющие [35] активность клетки рецепторы 5-HT, а длительное изменение концентрации 5-НТ в мозге может приводить к дисбалансу этих рецепторов. По-видимому, именно поэтому два противоположных воздействия: снижение и повышение уровня 5-HT ‒ дают один и тот же эффект – подавление экспрессии гена Ptpn5 в стриатуме.
Интересно обсудить и действие ингибитора МАОА, паргилина, который относится к клинически эффективным антидепрессантам и оказывает антидепрессивное действие в моделях депрессии на лабораторных грызунах [36]. В результате проведенного нами исследования впервые показано, что паргилин снижает экспрессию Ptpn5 в стриатуме. Кроме того, по имеющимся в литературе клиническим наблюдениям и экспериментальным данным, депрессивноподобные состояния могут быть связаны как со снижением, так и с увеличением уровня 5-HT в мозге [15, 37‒39]. Так, ранее показано, что ингибитор синтеза 5‑HT, n-хлорфенилаланин, также оказывает антидепрессивное действие в моделях депрессии на лабораторных животных [36]. В данной работе впервые показано, что его введение снижает экспрессию гена Ptpn5 в стриатуме. Эти результаты подтверждают гипотезу о позитивной связи между STEP и депрессивными психозами [26, 40], основанную на антидепрессивном действии селективного ингибитора STEP – TC-2153 [21, 41, 42]. Таким образом, полученный результат имеет важное медицинское и практическое значение и служит еще одним доказательством связи между STEP, депрессией и действием антидепрессантов.
ЗАКЛЮЧЕНИЕ
Разработанная нами методика спектрофотометрического определения активности STEP в головном мозге проста в исполнении, не требует дорогостоящего оборудования и может быть использована при изучении роли этого фермента в регуляции работы головного мозга в норме и при патологиях.
• Впервые установлено, что паргилин и п‑хлорфенилаланин снижают уровень мРНК Ptpn5 в стриатуме, но не в коре или гиппокампе мышей.
• Не выявлено связи ферментативной активности STEP с изменением (снижением или повышением) уровня 5-HT в коре, гиппокампе и стриатуме мышей.
• Снижение экспрессии Ptpn5 под действием паргилина и п-хлорфенилаланина можно рассматривать как подтверждение гипотезы о вовлечении STEP в механизмы депрессии и действия некоторых антидепрессантов, так как паргилин относится к уже зарегистрированным и применяемым в клинике антидепрессантам, а п-хлорфенилаланин проявляет антидепрессивный эффект в моделях депрессии на лабораторных животных.
Авторы благодарны сотрудникам лаборатории физиологически активных веществ (заведующий: д.х.н., проф. Н.Ф. Салахутдинов) Новосибирского института органической химии им. Н.Н. Ворожцова СО РАН за любезно предоставленный препарат TC-2153.
Работа поддержана грантом РНФ 17-15-01032. Разведение и содержание животных поддержано бюджетным молодежным проектом № 0259-2019-0002 с использованием оборудования ЦКП “Центр генетических ресурсов лабораторных животных” ФИЦ ИЦиГ СО РАН, поддержанного Минобрнауки России (уникальный идентификатор проекта RFMEFI62119X0023).
Условия содержания животных и экспериментальные процедуры проводили в соответствии с правилами Совета Европейского Парламента (Директива 2010/63/EU от 22 сентября 2010 года. The Directive 2010/63/EU of the European Parliament and the Council of 22 September 2010).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Venkitaramani D.V., Paul S., Zhang Y., Kurup P., Ding L., Tressler L., Allen M., Sacca R., Picciotto M.R., Lombroso P.J. (2009) Knockout of striatal enriched protein tyrosine phosphatase in mice results in increased ERK1/2 phosphorylation. Synapse. 63, 69‒81.
Pelov I., Teltsh O., Greenbaum L., Rigbi A., Kanyas-Sarner K., Lerer B., Lombroso P., Kohn Y. (2012) Involvement of PTPN5, the gene encoding the striatal-enriched protein tyrosine phosphatase, in schizophrenia and cognition. Psychiatr. Genet. 22, 168‒176.
Goebel-Goody S.M., Baum M., Paspalas C.D., Fernandez S.M., Carty N.C., Kurup P., Lombroso P.J. (2012) Therapeutic implications for striatal-enriched protein tyrosine phosphatase (STEP) in neuropsychiatric disorders. Pharmacol. Rev. 64, 65‒87.
Olausson P., Venkitaramani D.V., Morand T.D., Salterd M.W., Taylora J.R., Lombroso P.J. (2012) The tyrosine phosphatase STEP constrains amygdala-dependent memory formation and neuroplasticity. J. Neuro-sci. 225, 1‒8.
Gladding C.M., Fan J., Zhang L.Y., Wang L., Xu J., Li E.H., Lombroso P.J., Raymond L.A. (2014) Alte-rations in striatal-enriched protein tyrosine phosphatase (STEP) expression, activation, and downstream signaling in early and late stages of the YAC128 Huntington’s disease mouse model. J. Neurochem. 130, 145‒159.
Nguyen T.H., Liu J., Lombroso P.J. (2002) Striatal enriched phosphatase 61 dephosphorylates Fyn at phosphotyrosine 420. J. Biol. Chem. 277, 24274‒24279.
Xu J., Kurup P., Bartos J.A., Patriarchi T., Hell J.W., Lombroso P.J. (2012) Striatal-enriched protein-tyrosine phosphatase (STEP) regulates Pyk2 kinase activity. J. Biol. Chem. 287, 20942–20956.
Kurup P., Zhang Y., Xu J., Venkitaramani D.V., Haroutunian V., Greengard P., Nairn A.C., Lombroso P.J. (2010) A beta-mediated NMDA receptor endocytosis in Alzheimer’s disease involves ubiquitination of the tyrosine phosphatase STEP61. J. Neurosci. 30, 5948‒5957.
Kulikov A.V., Gainetdinov R.R., Ponimaskin E., Kalueff A.V., Naumenko V.S., Popova N.K. (2018) Interplay between the key proteins of serotonin system in SSRI antidepressants efficacy. Expert Opin. Ther. Targets. 22, 319‒330.
Popova N.K., Naumenko V.S. (2019) Neuronal and behavioral plasticity: the role of serotonin and BDNF systems tandem. Expert Opin. Ther. Targets. 23, 227‒239.
Lucki I. (1998) The spectrum of behavior influenced by serotonin. Biol. Psychiatry. 44, 151‒162.
Walther D.J., Peter J.U., Bashammakh S., Hörtnagl H., Voits M., Fink H., Bader M. (2003) Synthesis of serotonin by a second tryptophan hydroxylase isoform. Science. 299, 76.
Popova N.K., Kulikov A.V. (2010) Targeting tryptophan hydroxylase 2 in affective disorder. Expert Opin. Ther. Targets. 14, 1259‒1271.
Kulikov A.V., Popova N.K. (2015) Tryptophan hydroxylase 2 in seasonal affective disorder: underestimated perspectives? Rev. Neurosci. 26, 679‒690.
Kulikova E.A., Kulikov A.V. (2019) Tryptophan hydroxylase 2 as a therapeutic target for psychiatric disorders: focus on animal models. Expert Opin. Ther. Targets. 23, 655‒667.
Shih J.C., Thompson R.F. (1999) Monoamine oxidase in neuropsychiatry and behavior. Am. J. Hum. Genet. 65, 593‒598.
Allen D.L., Renner K.J., Luine V.N. (1993) Pargyline-induced increase in serotonin levels: correlation with inhibition of lordosis in rats. Pharmacol. Biochem. Behav. 45, 837‒841.
Edmondson D.E., Mattevi A., Binda C., Li M., Hubálek F. (2004) Structure and mechanism of monoamine oxidase. Curr. Med. Chem. 11, 1983‒1993.
Kulikova E.A., Bazhenova E.Y., Popova N.K., Khomenko T.M., Volcho K.P., Salakhutdinov N.F., Kulikov A.V. (2015) Effect of acute administration of 8‑(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153) on biogenic amines metabolism in mouse brain. Lett. Drug Design Discov. 12, 833‒836.
Куликов А.В., Тихонова М.А., Куликова Е.А., Хоменко Т.М., Корчагина Д.В., Волчо К.П., Салахутдинов Н.Ф., Попова Н.К. (2011) Влияние нового потенциального психотропного препарата гидрохлорида 8-(трифторметил)-1,2,3,4,5-бензопентариепин-6-амина на экспрессию генов, вовлеченных в метаболизм и рецепцию медиатора серотонина, в головном мозге мышей. Молекуляр. биология. 45, 282‒288.
Kulikova E.A., Khotskin N.V., Illarionova N.B., Sorokin I.E., Bazhenova E.Y., Kondaurova E.M., Volcho K.P., Khomenko T.M., Salakhutdinov N.F., Ponimaskin E., Naumenko V.S., Kulikov A.V. (2018) Inhibitor of striatal-enriched protein tyrosine phosphatase, 8-(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153), produces antidepressant-like effect and decreases functional activity and protein level of 5-HT(2A) receptor in the brain. Neuroscience. 394, 220‒231.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikho-nova M.A., Popova N.K. (2005) Quantitative RT-PCR assay of 5-HT1A and 5-HT2A serotonin receptor mRNAs using genomic DNA as an external standard. J. Neurosci. Methods. 141, 97‒101.
Naumenko V.S., Osipova D.V., Kostina E.V., Kulikov A.V. (2008) Utilization of a two-standard system in real-time PCR for quantification of gene expression in the brain. J Neurosci. Methods. 170, 197‒203.
Khotskin N.V., Plyusnina A.V., Kulikova E.A., Bazhenova E.Y., Fursenko D.V., Sorokin I.E., Kolotygin I., Mormede P., Terenina E.E., Shevelev O.B., Kulikov A.V. (2019) On association of the lethal yellow (AY) mutation in the agouti gene with the alterations in mouse brain and behavior. Behav. Brain Res. 359, 446‒456.
MacKintosh C., Moorhead G. (1993) Assay and purification of protein (serine/threonine) phosphatases. In: Protein Phosphorylation: A Practical Approach. Ed. D.G. Hardie. New York: IRL Press, pp. 153‒182.
Kulikova E., Kulikov A. (2017) Striatal-enriched tyrosine protein phosphatase (STEP) in the mechanisms of depressive disorders. Curr. Protein Pept. Sci. 18, 1152‒1162.
Mehta H., Saravanan K.S., Mohanakumar K.P. (2003) Serotonin synthesis inhibition in olivo-cerebellar system attenuates harmaline-induced tremor in Swiss albino mice. Behav. Brain Res. 145, 31‒36.
Dailly E., Chenu F., Petit-Demoulière B., Bourin M. (2006) Specificity and efficacy of noradrenaline, serotonin depletion in discrete brain areas of Swiss mice by neurotoxins. J. Neurosci. Methods. 150, 111‒115.
Kornum B.R., Licht C.L., Weikop P., Knudsen G.M., Aznar S. (2006) Central serotonin depletion affects rat brain areas differently: a qualitative and quantitative comparison between different treatment schemes. Neurosci. Lett. 392, 129‒134.
Izumi T., Iwamoto N., Kitaichi Y., Kato A., Inoue T., Koyama T. (2006) Effects of co-administration of a selective serotonin reuptake inhibitor and monoamine oxidase inhibitors on 5-HT-related behavior in rats. Eur. J. Pharmacol. 532, 258‒264.
Lima F.B., Szawka R.E., Anselmo-Franci J.A., Franci C.R. (2007) Pargyline effect on luteinizing hormone secretion throughout the rat estrous cycle: correlation with serotonin, catecholamines and nitric oxide in the medial preoptic area. Brain Res. 1142, 37‒45.
Fisar Z., Hroudová J., Raboch J. (2010) Inhibition of monoamine oxidase activity by antidepressants and mood stabilizers. Neuro Endocrinol. Lett. 31, 645‒656.
Kulikov A.V., Osipova D.V., Naumenko V.S., Terenina E., Mormède P., Popova N.K. (2012) A pharmacological evidence of positive association between mouse intermale aggression and brain serotonin metabolism. Behav. Brain Res. 233, 113‒119.
Roth B.L. (2011) 5-HT(2A) serotonin receptor biology: interacting proteins, kinases and paradoxical regulation. Neuropharmacology. 61, 348‒354.
Shimizu S., Tatara A., Imaki J., Ohno Y. (2010) Role of cortical and striatal 5-HT1A receptors in alleviating antipsychotic-induced extrapyramidal disorders. Prog. Neuropsychopharmacol. Biol. Psychiatry. 34, 877‒881.
Borsini F. (1995) Role of the serotonergic system in the forced swimming test. Neurosci. Biobehav. Rev. 19, 377‒395.
Nagayama H., Tsuchiyama K., Yamada K., Akiyoshi J. (1991) Animal study on the role of serotonin in depression. Prog. Neuropsychopharmacol. Biol. Psychiatry. 15, 735‒744.
Jacobsen J.P., Medvedev I.O., Caron M.G. (2012) The 5-HT deficiency theory of depression: perspectives from a naturalistic 5-HT deficiency model, the tryptophan hydroxylase 2Arg439His knockin mouse. Philos. Trans. R. Soc., B. 367, 2444‒2459.
Shah R., Courtiol E., Castellanos F.X., Teixeira C.M. (2018) Abnormal serotonin levels during perinatal development lead to behavioral deficits in adulthood. Front. Behav. Neurosci. 12, 114.
Kulikova E.A., Volcho K.P., Salakhutdinov N.F. and Kulikov A.V. (2017) Benzopentathiepine derivative, 8-(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153), as a promising antidepressant of new generation. Lett. Drug Des. Discov. 14, 974‒984.
Kulikov A.V., Tikhonova M.A., Kulikova E.A., Volcho K.P., Khomenko T.M., Salakhutdinov N.F., Popova N.K. (2014) Antidepressant activity of 8-(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153): comparison with classical antidepressants. Lett. Drug Des. Discov. 11, 169‒173.
Куликова Е.А., Тихонова М.А., Волчо К.П., Хоменко Т.М., Салахутдинов Н.Ф., Куликов А.В., Попова Н.К. (2015) Сравнение психотропного эффекта флуоксетина, имипрамина и нового психотропного препарата TC-2153 у мышей, различающихся по наследственной предрасположенности к каталепсии. Журн. высш. нервн. деят. им. И.П. Павлова. 65, 105‒112.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология