Молекулярная биология, 2020, T. 54, № 2, стр. 187-203
Стволовые клетки растений
А. С. Воронина a, Е. С. Пшенникова a, *
a Институт биохимии им. А.Н. Баха Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: pshennikova57@mail.ru
Поступила в редакцию 03.06.2019
После доработки 22.10.2019
Принята к публикации 24.10.2019
Аннотация
Представлен краткий обзор данных по молекулярной биологии стволовых клеток, образующих меристемы и дифференцирующихся в различные органы покрытосеменных растений. Сравниваются первичные и вторичные меристемы. Описано взаимодействие гормонов, регуляторных генных сетей и сигнальных путей в разных типах меристем.
Эволюция многоклеточных растений и животных происходила независимо, и, как следствие, стадии развития и определяющие их молекулярные механизмы стали существенно различаться со времени последнего общего предка. На фоне огромной эволюционной дистанции кажется удивительным, что концепция стволовых клеток и даже дизайн систем стволовых клеток имеют определенное сходство в этих царствах [1–4]. Тем не менее, различия в образе жизни растений и животных привели к появлению характерных особенностей регуляции функционирования стволовых клеток, что стало причиной проведения множества сравнительных исследований. Растениям, использующим для жизни солнечную энергию, не нужно охотиться, как животным, но необходимо максимально увеличить площадь поверхности. Они, как и животные, сталкиваются с условиями, резко меняющимися в течение года, с конкуренцией, атаками травоядных и болезнями, и все это при отсутствии возможности передвижения для выбора лучших условий жизни. В процессе эволюции эти проблемы были решены в результате появления у растений способности к формированию органов и их регенерации на протяжении всего жизненного цикла, непревзойденной пластичности в росте и форме. В основе этой стратегии развития лежат постоянно активные группы плюрипотентных стволовых клеток, расположенных в особых нишах, находящихся в специальных тканях, названных меристемами. Расположенные в точках роста растения меристемы продуцируют клетки, чья судьба определяется положением и может “на лету” измениться в соответствии с требованиями, диктуемыми окружающей средой или стадией развития [5]. Другая важная фундаментальная особенность растений ‒ отсутствие централизованной системы механической поддержки организма. В отличие от большинства животных, чье тело поддерживается экзо- или эндоскелетом, форма и структурная целостность растений обусловлены ригидными клеточными оболочками (стенками), в которые упакованы все клетки по отдельности. Локальная регуляция жесткости клеточной стенки, плоскости деления клеток, а, в конечном счете, размера и формы клеток являются критичными параметрами в морфологии растений. При этом физические ограничения, обусловленные наличием клеточной стенки, исключают миграцию клеток. Судьба клетки диктуется ее тесным окружением, улавливающим сигналы как изнутри, так и извне растения, тогда как в развитии животных организмов именно миграция клеток считается одним из важнейших факторов.
ПРОИСХОЖДЕНИЕ И ФУНКЦИИ СИСТЕМ СТВОЛОВЫХ КЛЕТОК РАСТЕНИЙ
Термин “стволовая клетка” впервые был использован выдающимся русским гистологом профессором Александром Александровичем Максимовым в докладе на чрезвычайном заседании Берлинского гематологического общества 1 июня 1909 года [6]. Ученый выдвинул и развил идею о существовании клетки-предшественницы форменных элементов крови у взрослых птиц и млекопитающих.
Сравнению стволовых клеток животных и растений посвящены многие экспериментальные и обзорные работы [1–4, 7]. Стволовые клетки растений, как и животных, характеризуются способностью к самовозобновлению и обладают свойством потентности, т.е. способностью давать потомство в виде определенного количества типов специализированных клеток. В соответствии с этим, стволовые клетки животных делятся на тотипотентные (омнипотентные), способные дифференцироваться в клетки эмбриональных тканей; плюрипотентные – потомки тотипотентных, которые могут давать начало практически всем тканям, за исключением эмбриональных; лигопотентные, которые могут дифференцироваться лишь в некоторые близкие по свойствам типы клеток; и унипотентные, или клетки-предшественницы, дающие начало одному определенному типу клеток. У животных тотипотентны клетки, возникающие после первых делений дробления, т.е. клетки бластоцисты уже не равноценны и плюрипотентны. Ключевое отличие стволовых клеток растений от стволовых клеток животных в том, что все без исключения стволовые клетки растений тотипотентны. Более того, тотипотентны у растений практически все живые дифференцированные клетки, которые могут обретать свойства стволовых в процессе дедифференцировки – это свойство лежит в основе высокой способности растений к регенерации, соматическому эмбриогенезу и вегетативному размножению [7]. В этом же обзоре [7] приведены общие принципы существования стволовых клеток у всех многоклеточных организмов, несмотря на различия их свойств, такие как: 1) высокая потентность и отсутствие маркеров дифференцировки; 2) большая продолжительность клеточного цикла, длительность клеточного цикла стволовых клеток порой в десятки раз выше, чем в окружающих клетках; 3) способность к самоподдержанию и асимметричным делениям, при которых продуцируется одна стволовая клетка и одна клетка, вступающая на путь активного деления и затем приступающая к дифференцировке; 4) существование в специальных компартментах, поставляющих сигналы для поддержания состояния стволовых клеток, – нишах стволовых клеток. Термин “ниша стволовых клеток” был предложен Raymond Schоfield [8] в 1978 г для гемопоэтических стволовых клеток, и определен им как “ограниченное специализированное микроокружение, которое интегрирует и осуществляет межклеточные сигналы для регуляции и поддержания гомеостаза принадлежащих ей стволовых клеток”. Здесь же перечислены основные функции ниш стволовых клеток: 1) предотвращение дифференцировки стволовых клеток путем экранирования сигналов дифференцировки, поступающих из соседних тканей; 2) обеспечение самоподдержания и длительного пребывания стволовых клеток в состоянии покоя; 3) создание условий для максимальной защищенности стволовых клеток от неблагоприятных воздействий [7, 8].
Ниши стволовых клеток растений формируются в процессе эмбриогенеза и постэмбрионально поддерживаются внутри популяции делящихся клеток, известных как меристемы. Меристемы состоят из нескольких доменов ‒ собственно стволовых клеток, ниш и клеток на разных стадиях дифференцировки. Делящиеся потомки стволовых клеток в меристемах эквивалентны транзиторным амплифицирующимся клеткам животных. Наличие меристем позволяет растениям постоянно образовывать новые органы и структуры на протяжении всей жизни, формируя таким образом архитектуру растений. Однако у животных, план строения тела которых в основном формируется в эмбриогенезе, почти нет плюрипотентных стволовых клеток, а существующие мультипотентные стволовые клетки осуществляют поддержание гомеостаза и регенерацию тканей.
Во время эмбриогенеза растений закладываются так называемые первичные меристемы ‒ апикальные меристемы побега и корня (АМП и АМК), обеспечивающие продольный рост, а также прокамбий. АМП и АМК не активны до прорастания [9], и только когда росток окажется в благоприятных условиях, стволовые клетки активируются, и происходит рост органов [10]. Из клеток АМК и АМП образуются все типы клеток подземных и надземных органов соответственно. Закладка сосудистых тканей начинается в эмбриогенезе с формирования вдоль оси корень–подсемядольное колено филаментов из клеток меристемы, предшественников сосудов, названных клетками прокамбия, относящегося к первичным меристемам. Сосудистая система растений эволюционирует уже более 450 млн лет. Именно ее появление позволило растениям выйти на сушу, обеспечив транспорт воды и питательных веществ из почвы на большие расстояния. В результате растения стали независимыми от окружающей воды и смогли вытянуться в высоту в конкурентной борьбе за свет [11].
Помимо продольного роста, у органов растений наблюдается и радиальный рост (в толщину) с помощью группы цилиндрических и концентрических меристем, расположенных под поверхностью органа. Эти вторичные меристемы, из которых наиболее известен камбий [12], анатомически высокоорганизованы, и образование ткани происходит строго радиально. В процессе развития камбий образуется из клеток прокамбия – первичной сосудистой меристемы, находящихся в центре первичных сосудистых пучков, и спектр образующихся из камбия типов клеток ограничен в основном клетками сосудов [12]. Генетические эксперименты позволили выявить ключевые регуляторы развития сосудистой системы растений – гормоны, пептиды, рецепторы, киназы и факторы транскрипции (см. обзор [13]). Вторичные меристемы появляются и в дополнительных точках роста в корнях и побегах, обеспечивая развитие латеральных корневых меристем и пазушных меристем [14, 15], и ветвление. Хотя начальные этапы формирования вторичных меристем и их эмбриональных “коллег” различаются, полностью развитые вторичные меристемы неотличимы от первичных. Это делает их удобными моделями для изучения образования новых стволовых клеток и их дифференцировки при различных условиях.
АПИКАЛЬНАЯ МЕРИСТЕМА ПОБЕГА (АМП)
Клеточное строение апикальной меристемы побега
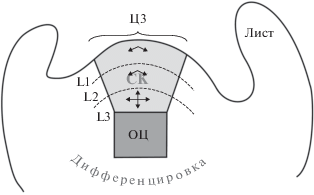
АМП располагается на конце побега и состоит из куполообразной популяции мелких пролиферирующих клеток. АМП представлена тремя клонально различными слоями – клетки L1 и L2 образуют два внешних слоя и делятся строго антиклинально, т.е. в боковом направлении, при этом слой L1 обращен к поверхности, а L2 расположен строго под ним (рис. 1). Клетки слоя L3, расположенного под L2, напротив, делятся во всех направлениях, и их потомки обеспечивают также и рост стебля. Эпидермальный (L1) и субэпидермальный (L2) слои формируют наружный слой, называемый туникой. Внутренний слой (L3) называется корпусом. Отдельные слои клеток порождают независимые клеточные линии и вносят свой индивидуальный вклад в развивающиеся органы. В центре меристемы стволовые клетки делятся лишь иногда, и часть их потомства отодвигается в сторону периферии, где клетки делятся гораздо чаще, и в конечном итоге вовлекаются в формирование латеральных органов или сосудистых тканей стебля [1, 16]. Как и у многих животных, стволовым клеткам растений необходимы индуктивные ниши. Роль их регулятора в АМП играют клетки организующего центра (ОЦ), или меристемы ожидания, расположенные под стволовыми клетками. Клетки во всех доменах АМП постоянно делятся с разными скоростями, следовательно, основная система структурирования должна быть достаточно динамичной. Действительно, домены АМП не привязаны к конкретным клеткам, а определяются относительным положением в ткани. Таким образом, клетки, рожденные в домене стволовых клеток, в конце концов будут вытеснены их делящимися потомками. В результате эти клетки перестанут синтезировать маркеры стволовых клеток и либо обретут идентичность периферической зоны, если очутятся в стороне от стволовых клеток, либо, если окажутся под ОЦ, образуют внутренние ткани стебля, включая сосудистые. В периферическом слое перед тем, как стать тканями развивающихся органов – листьев или цветков ‒ клетки быстро делятся. В изящных хирургических экспериментах доказана главенствующая роль относительного расположения клеток в обретении ими идентичности и невероятной пластичности АМП. Удаление центральной зоны приводило к формированию нескольких кластеров стволовых клеток вокруг места ампутации с одним превалирующим центром. Даже если удалить одновременно и стволовые клетки, и ОЦ, то полностью функциональная и пространственно организованная система стволовых клеток будет воссоздана за несколько дней. Сигналы, запускающие такое феноменальное репрограммирование, пока не известны. Однако, по-видимому, эпидермальный слой ответственен за направление роста, структурирование и проведение внеклеточных сигналов, включая растительные гормоны и микроРНК [17, 18].
Рис. 1.
Схема продольного среза апикальной меритемы побега (АМП) у арабидопсиса. АМП состоит из центральной зоны (ЦЗ), включающей организующий центр (ОЦ) и располагающиеся выше стволовые клетки (СК), дающие дочерние клетки, которые делятся и образуют слои L1, L2, L3 периферической зоны. Стрелками указаны направления деления клеток в слоях.
Генные регуляторные системы апикальной меристемы побега
Важную роль играет связь между развивающимися органами на периферии и стволовыми клетками в центре АМП. Из-за пространственного разобщения пролиферации и дифференцировки локальные регуляторные системы, по-видимому, не участвуют в синхронизации поведения стволовых клеток с развитием или факторами окружающей среды. Эту роль выполняют гормоны, в том числе ауксин и цитокинин. В АМП цитокинин служит индуктором клеточного цикла, необходимым для активации гомеобоксного фактора транскрипции WUSCHEL (WUS) [19, 20], тогда как основная роль ауксина ‒ запуск дифференцировки на периферии [21]. В АМК, напротив, репрессия сигналов цитокинина необходима для спецификации стволовых клеток [22]. Обнаружено, что у Arabidopsis thaliana активность обоих гормонов сходится на промоторах двух генов, кодирующих негативные регуляторы ARABIDOPSIS RESPONSE REGULATOR (ARR) ‒ ARR7 и ARR15, сигнального пути цитокининов. В результате их совместных усилий происходит регуляция функций меристем. Ингибирование накопления ауксина в АМП приводило к снижению экспрессии WUS. Кроме того, ауксиновый сигнал передается стволовым клеткам, по крайней мере частично, с участием цитикининового сигнального пути [19].
STM
В АМП A. thaliana экспрессируется ген гомеобоксного фактора транскрипции SHOOTMERISTEM-LESS (STM), относящегося к классу 1 семейства KNOX (KNOTTED1-LIRE HOMEOBOX) [23]. Кодируемый геном STM фактор транскрипции стимулирует экспрессию гена IPT7, продукт которого, фермент ATР/АDP-изопентенилтрансфераза 7 запускает биосинтез цитокининов — гормонов, стимулирующих деление клеток. Соотношение между цитокининами и ауксинами определяет процесс деления клеток и их дифференцировку. STM подавляет дифференцировку и поддерживает пролиферативную способность клеток меристемы [24, 25], а также может координировать механические сигналы при формировании латеральных органов [26]. STM часто экспрессируется вместе с геном KNOX1, а также с BREVIPEDICELLUS (BP). Активность этих белков модулируется белками другого гомеобоксного семейства, BEL-like proteins [23]. Экспрессия STM обнаруживается во всей АМП, но каким-то образом ингибируется в областях наибольшей концентрации ауксина ‒ в популяциях быстро делящихся клеток, потомков стволовых клеток, теряющих свойства плюрипотентности и готовых к дифференцировке [27, 28]. До сих пор окончательно не выяснены ни функциональная значимость, ни механизм такого ингибирования STM в примордиях ‒ областях зачатков будущих органов растения [29].
WUS, CLV3 и ER
ОЦ характеризуется точечной экспрессией гомеобоксного фактора транскрипции WUSCHEL (WUS), который обеспечивает поддержание клетками стволового состояния [30, 31]. Однако в нишах стволовых клеток растений, в отличие от ниш животных клеток, белок WUS не запускает слаженные генные каскады, а, вероятно, двигается к стволовым клеткам по межклеточным контактам, плазмодесмам, чтобы непосредственно регулировать экспрессию генов-мишеней в клетках ниши и стволовых клетках [32, 33]. Судьба стволовых клеток у арабидопсиса контролируется сложной регуляторной сетью сигнальных молекул и факторов транскрипции [34]. В петле отрицательной обратной связи идентифицирован основной участник, названный CLAVATA3 (CLV3), ‒ короткий секретируемый пептид, активирующийся в результате процессинга и посттрансляционной модификации [35, 36]. Обнаружено, что для выполнения своей роли в регуляции размера меристемы белок CLV3 должен быть полностью гликозилирован L-арабинозой. Мутации в гене арабинозилтрансферазы приводили к увеличению размера плода в процессе доместикации растений томата [37]. Белок CLV3 диффундирует в интерстициальное пространство и действует при связывании с комплексами рецепторов с обогащенными лейцином повторами (LRR), которые расположены на плазматической мембране [38, 39]. Общее у этих рецепторов в том, что в результате связывания CLV3 запускается внутриклеточный сигнальный каскад, молекулярный механизм которого начинает проясняться. Оказалось, что некоторые рецепторные комплексы представляют собой гомомеры LRR-RLK (LRR-receptor-like kinases), как CLAVATA1 (CLV1), а некоторые являются комплексами LRR с мембраносвязанными киназами или псевдокиназами, как в случае CLAVATA2 (CLV2) и CORYNE (CRN) [40‒42]. Снижение экспрессии WUS, обусловленное CLV-сигналами [43], замыкает локальную петлю отрицательной обратной связи: WUS распространяется от ОЦ к стволовым клеткам для поддержания их состояния, а стволовые клетки секретируют CLV3. В ОЦ запускается CLV-зависимый каскад, что приводит к уменьшению активности WUS. Этот каскад впервые обнаружили у арабидопсиса, однако он характерен и для кукурузы, риса и растений томата. Мутации, затрагивающие синтез или рецепцию CLV3, приводят к росту образования стволовых клеток в АМП [37, 44].
Параллельно с каскадом CLV экспрессия WUS регулируется каскадом ERECTA (ER)‒LRR-RK [45]. Участники этого каскада, вероятнее всего, входят в семейство EPIDERMAL PATTERNING FACTOR (EPF), вовлеченное в процессы роста и развития устьиц [46, 47]. В развитие меристемы в качестве сигнальных молекул вовлечены G-белки. Предполагается, что рецепторы ER и CLV могут функционировать совместно в общем сигнальном каскаде. Известно также, что сигнальный путь CLV негативно регулируется некоторыми протеинкиназами, включая POLTERGIEST, POL-LIKE1 и KINASE ASSOCIATED PROTEIN PHOSPHATASE (KAPP), однако прямой связи с функцией рецепторов не обнаружено. Показано также, что в работе CLV3 может участвовать убиквитинлигаза Е3 [48‒51]. Позже обнаружили, что функционирование рецепторов ER вместе с рецепторами гистидинкиназ арабидопсиса ARABIDOPSIS HISTIDINE KINASE (AHK) необходимо для точной регуляции чувствительности клеток к цитокинину и, следовательно, обеспечения правильной морфологии АМП. В то время как AHK повышают чувствительность к цитокинину, рецепторы ER ограничивают поступление сигнала к более глубоким слоям АМП, тем самым определяя спецификацию ОЦ [18, 52, 53].
ARF
При исследовании формирования репродуктивных примордиев арабидопсиса было изучено функционирование белков группы ARF (auxin response factor). Именно они в ответ на воздействие ауксина регулируют в клетках меристем экспрессию генов, отвечающих за дифференцировку клеток и развитие новых тканей и органов. ARF делятся на три класса: A, B и C [54]. ARF класса А активируют транскрипцию, тогда как ARF классов B и C отнесены к репрессорам транскрипции [55, 56]. К классу A относится фактор транскрипции MONOPTEROS (MP, или ARF5) регулирующий формирование цветка. Известно, что своим глутамин-богатым неструктурированным центральным доменом этот фактор может связываться с ремодуляторами хроматина [57]. Кроме MP, в клетках будущих примордиев обнаружена значительная экспрессия только двух других ARF: ETTIN (ETT, или ARF3) и ARF4. Оба они относятся к “репрессорному” классу B. И оба, ETT и ARF4, участвуют во многих процессах развития арабидопсиса, включая инициацию ветвления корней и направление роста листа. Известно, что при низкой концентрации ауксина небольшие ядерные белки Aux/IAA связываются с МР, образуют комплекс с корепрессором TOPLESS (TPL) и препятствуют активации генов ARF [57‒59]. Увеличение концентрации ауксина приводит к убиквитинированию и последующей деградации белков Aux/IAA, высвобождению корепрессоров и разрешению MP связаться с ремодуляторами хроматина. Таким образом, MP непосредственно активирует гены, необходимые для развития цветка, например гены факторов транскрипции FILAMENTOUS FLOWER (FIL) и LEAFY (LFY). MP также модулирует экспрессию генов, контролирующих ответ на действие ауксина и его накопление. Показано, что репрессия STM приводит к инициации репродуктивного примордия [29]. При этом ETT и ARF4, экспрессирующиеся в зарождающемся примордии, ингибируют STM, действуя параллельно с MP. Кроме того, выключение гена плюрипотентности STM и гена BP факторами FIL и ETT/ARF4 осуществляется в результате деацетилирования гистонов [29].
Роль клеточной стенки
Клеточная стенка растений представлена сетью целлюлозных микрофибрилл, соединенных между собой молекулами гемицеллюлозы, погруженными в пектиновый матрикс [60]. Для взаимодействия рецептор‒лиганд существенно состояние апопластического пространства, или межклеточного матрикса. Клеточная стенка ‒ самая наружная контактная поверхность для восприятия сигналов и взаимодействий всех клеток растений. Она служит избирательным барьером для многих биомолекул, обеспечивает механическую прочность и препятствует движениям клеток внутри и между тканями. Топологическая гомогенность клеток АМП обеспечивает прочность межклеточных взаимодействий, она обусловлена работой гена KATANIN1. Показано, что ген KATANIN1, названный по аналогии с японским мечом катана, кодирует белок, расщепляющий микротрубочки [61] и участвующий в межклеточных механических взаимодействиях в АМП арабидопсиса [62]. Анализ вклада механических взаимодействий в определение формы клеток и клеточную организацию в целом показал [63], что в отсутствие катанина реориентация кортикальных микротрубочек происходит медленнее, целлюлоза не накапливается в местах максимальной нагрузки, и в результате клеточная стенка недостаточно укрепляется. Клетки растений, несущих мутации в этом гене, не могут механически противостоять давлению их соседей. Реорганизация микротрубочек играет ключевую роль в контроле геометрии клеток и свойств меристемы в целом. В таких развивающихся тканях, как меристемы, должны существовать механизмы, обеспечивающие скоординированное ремоделирование клеточной стенки при выборе клеткой своей судьбы [64]. Это подтверждается способностью ферментов, ремоделирующих клеточную стенку, индуцировать появление органа на периферии АМП [65].
Сигнализация с участием клеточной стенки и степень напряжения в мембране [66] играют важную роль в поддержании функционального состояния меристемы. Интересно, что даже экспрессия маркера стволовых клеток STM контролируется механическими силами, действующими на границе купола АМП [26, 67, 68]. В свою очередь, синтез клеточной стенки регулируется АМП [69], в результате возникают различия в ригидности клеток даже в пределах меристемы [70]. Связь дифференцировки клетки с ремоделированием ее клеточной стенки обеспечивается механизмами обратной связи между каскадами, отвечающими за судьбу стволовых клеток, и сигнальными молекулами, контролирующими целостность клеточной стенки. По-видимому, степень метилирования пектина, главного компонента клеточной стенки, в значительной степени определяется несколькими рецепторными комплексами, расположенными в цитоплазматической мембране [71‒73].
Находясь еще под поверхностью почвы, в темноте, сеянцы растений развиваются особым способом, который ускоряет процесс проталкивания почки на воздух, одновременно защищая ее от повреждений. Этот тип роста назван скотоморфогенезом. При попадании на свет происходит переключение растений на другой, более регулярный тип роста, названный фотоморфогенезом, при котором ствол перестает расти, а листья становятся широкими и зелеными. Показано, что олигомеры галактуроновой кислоты, продуцируемые клеточной стенкой, и основной ее компонент пектин ингибируют переход от скотоморфогенеза к фотоморфогенезу [74], что сопровождается активацией АМП [75].
АПИКАЛЬНАЯ МЕРИСТЕМА КОРНЯ (АМК)
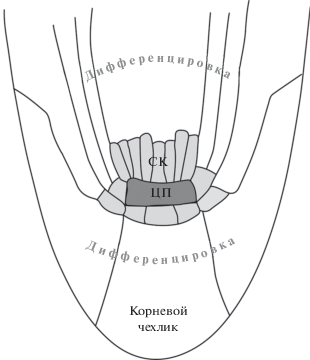
В АМК обнаружены те же регуляторные элементы, что и в АМП, несмотря на более упорядоченную организацию клеток меристемы корня, например у A. thaliana, по сравнению с побегом. В АМК, как и в АМП, существует группа клеток, которые служат нишей, они называются центром покоя (ЦП) и находятся в самом центре кончика корня (рис. 2). Стволовые, или инициальные, клетки окружают ЦП и поддерживают контакт с ЦП, дают начало тканям корня и корневого чехлика. Такое расположение существенно для идентичности стволовых клеток. Показано, что клетки могут повторно обрести свойства стволовых, как только они попадут в данное окружение [76]. В отличие от АМП, где ауксин запускает дифференцировку, в АМК этот гормон необходим для спецификации ниши стволовых клеток и поддерживает их пролиферацию [22, 77]. Цитокинин, напротив, вызывает дифференцировку и действует преимущественно на некотором расстоянии от кончика корня [78]. Однако обнаружено также, что цитокинин действует на клетки ЦП, уменьшая импорт ауксина из их окружения и индуцируя в этом случае деление клеток [79].
Рис. 2.
Схема продольного среза АМК арабидопсиса. АМК образована концентрически расположенными клеточными слоями. Центр покоя (ЦП) окружен стволовыми клетками (СК), обеспечивающими рост корня.
Несмотря на противоположное действие гормонов в корне и стебле, на транскрипционном уровне поддержание стволовых клеток корня происходит по общей схеме. Как и в побеге, в корне спецификация клеток обусловлена действием гомеобоксного фактора транскрипции, названного WUSCHEL-RELATED HOMEOBOX 5 (WOX5) [80]. WOX5 не только близок WUS, но и действует посредством того же механизма. Белок WOX5 движется из ЦП к центральным стволовым клеткам, чтобы определить их судьбу [81]. Более того, экспрессия как WUS, так и WOX5, находится под контролем системы пептид‒рецептор. Чтобы ограничить экспрессию WOX5, в АМК сигнальный пептид CLAVATA3-ESR related 40 (CLE40) действует через систему киназ CLV1, ARABIDOPSIS CRINKLY4 (ACR4), LEUCINE-RICH REPEAT RECEPTOR-LIKE KINASES (RLK) [82, 83]. Однако топология этого сигнального модуля существенно отличается от его топологии в АМП. В отличие от CLV3 в побеге, CLE40 экспрессируется не в стволовых клетках, а в дифференцированных клетках корневого чехлика, тогда как рецепторы CLV1 и ACR4 находятся в обеих популяциях клеток. Интересно, что эти рецепторы не экспрессируются в ЦП, но неким образом осуществляют CLE40-зависимую регуляцию WOX5, возможно, блокируя его экспрессию в стволовых клетках [84]. Сходство апикальных меристем на этом не заканчивается ‒ WOX5, как и WUS, действует как репрессор транскрипции, и эта его активность обеспечивается физическим связыванием с белками, кодируемыми семейством генов TOPLESS (TPL) [81, 85]. Они относятся к группе корепрессоров типа GROUCHO, которые вызывают деацетилирование гистонов, влияя на соответствующие деацетилазы (HDAC) [86].
Еще один важный, но не обязательный компонент модуля, регулирующего работу WOX, ‒ факторы транскрипции с GRAS-доменом ‒ HAIRY MERISTEM (HAM), непосредственно взаимодействующие с белками WOX. Известно также, что белки HAM связываются не только с WUS и WOX5, но и с WOX4, маркером ниш стволовых клеток сосудов [87].
ПРОКАМБИЙ
Первичные сосудистые пучки растений образуются из клеток прокамбия еще в эмбриогенезе [88, 89]. Клетки сосудов корня происходят из четырех инициальных клеток, которые появляются на глобулярной стадии развития. Эти инициальные сосудистые клетки, которые считаются предшественниками прокамбия, проходят несколько циклов деления для получения значительной популяции сосудистых клеток. Клеточные деления находятся под контролем фактора транскрипции TARGET OF MONOPTEROS 5 (TMO5) и ауксина. Как только популяция клеток станет достаточно большой, в центре начинают постепенно формироваться сосуды ксилемы, а с двух сторон сосуды флоэмы. Такое расположение сосудистых пучков и его поддержание обуславливается совместным влиянием ауксина и цитокинина. Решающим в процессе формирования прокамбия является направленный транспорт ауксина. Классическая гипотеза проведения ауксинового сигнала предполагает, что распределение ауксина сужается с широкого поля клеток до небольшой популяции клеток с интенсивным транспортом ауксина. Эти клетки и станут сайтами формирования прокамбия [90, 91]. Когда расстановка сосудистых клеток завершена, клетки прокамбия обретают высокую пролиферативную активность, необходимую для обеспечения вторичного радиального роста растения. В частности, быстро делящиеся клетки прокамбия, располагающиеся в виде кольца вокруг центральной ксилемы и окруженные пучками флоэмы, на этой стадии уже называются клетками камбия. Этот переход обычно происходит в верхних “старых” частях корней. На этой стадии вторичного роста сосудистая меристема, состоящая из клеток камбия, дает начало клеткам вторичной ксилемы и вторичной флоэмы. Эти мультипотентные клетки камбия считаются стволовыми клетками сосудов, поскольку они обладают способностью к самообновлению. Показано, что пептидный гормон TDIF (TRACHEARY DIFFERENTIATION INHIBITORY FACTOR) и его рецептор TDR (или PSY) играют ключевую роль в формировании сосудистой меристемы [92, 93]. Генетические исследования позволили обнаружить, что сигнальный путь TDIF распадается на два отдельных каскада: путь WOX4 и путь GLYCOGEN SYNTHASE KINASE 3 (GSK3)‒BRI1‒EMS-SUPPRESSOR1 (BES1). Эти каскады регулируют баланс между клеточной пролиферацией и дифференцировкой [94, 95]. Кроме того, пептидные гормоны (EPIDERMAL PATTERNING FACTOR, EPF) и каскады, запускаемые гормоном этиленом, также способствуют поддержанию сосудистых меристем вместе с каскадами TDIF [89]. Другой регулятор пролиферации клеток камбия ‒ цитокинин [96, 97]. В результате область ксилемы существенно разрастается, что сопровождается дифференцировкой волокон ксилемы. Проведены эксперименты, в которых дифференцировку ксилемы в подсемядольном колене арабидопсиса при переходе к цветению можно вызывать гиббереллином, а сигнальный путь с участием рецепторов ERECTA (ER) и ER-LIKE 1 (ERL1), напротив, препятствует формированию волокон на ранних стадиях [89].
На стадиях после прорастания большинство эмбриональных прокамбиальных клеток дифференцируются в ксилему или флоэму. В семядолях эти проводящие пучки объединяются в простую сеть. При росте корня образование сосудистых тканей продолжается по такой же схеме, как и в подсемядольном колене. Однако при росте побега процесс формирования сосудистых пучков идет по иной схеме. Из сосудистых пучков формируются кольца, которые располагаются внутри ствола по кругу. Во время дифференцировки прокамбия в сосудистые пучки небольшая популяция его клеток, расположенная между ксилемой и флоэмой, сохраняет свойства меристем, даже если они находятся за пределами АМП. Эти клетки дадут начало васкулярной меристеме – камбию. Эти промежуточные прокамбиальные/камбиальные клетки продолжают делиться периклинально, увеличивая свое потомство и продуцируя клетки ксилемы с одной стороны и клетки флоэмы с другой, обеспечивая таким образом неограниченную способность растения к вторичному росту [91, 98].
ВТОРИЧНЫЕ МЕРИСТЕМЫ
Камбий
Известно, что эволюционно и функционально консервативные белки семейства WUS и WOX5 являются ключевыми факторами спецификации и поддержания популяции стволовых клеток во всех меристемах сосудистых растений [99]. В клетках прокамбия/камбия экспрессируется ген фактора WOX4, определяющего ниши стволовых клеток сосудов, и его транскрипция находится под контролем сигнального каскада LRR–CLE. Показано, что экспрессия WOX4 необходима для пролиферации стволовых клеток камбия, а не для запрета их дифференцировки в ксилему [92]. Однако из-за сложного анализа скоростей деления клеток и взаимоотношения клонов до сих пор не ясно, как термины “стволовая клетка”, “ниша” и “состояние покоя” можно применить к камбию. Так или иначе, пептиды CLE41/42/44 (гомологи TDIF арабидопсиса) продуцируются в дистальной зоне камбия, включая дифференцированную флоэму – ткань, производную камбия, транспортирующую ассимиляты и сигнальные молекулы на большие расстояния [93, 100]. Далее эти пептиды перемещаются к недифференцированным клеткам камбия и связываются с LRR-RLK PHLOEM INTERCALATED WITH XYLEM (PXY, он же TDR), вызывая индукцию экспрессии WOX4 [92, 93, 95, 100]. Одновременно комплекс PXY–CLE41/42/44 ингибирует дифференцировку ксилемы, которая образуется проксимально от камбия и специализируется на переносе воды на большие расстояния. Ингибирование дифференцировки ксилемы, происходящее независимо от WOX4, нуждается в компонентах сигнального каскада брассиностероидов (BR) [94]. Интересно, что в АМК для поддержания свойств ЦП каскад BR должен быть прерван фактором транскрипции BRAVO [101]. Предполагается, что ослабление влияния BR – общая черта ниш стволовых клеток растений. Таким образом, судьба стволовых клеток меристемы камбия, в отличие от подобных каскадов в АМП и АМК, обусловлена действием регуляторного каскада PXY–CLE41/42/44. Вместе с модулем PXY–CLE41/42/44 в дистальной зоне камбия действует модуль LRR-RLK MORE LATERAL GROWTH1 (MOL1), который подавляет активность стволовых клеток, как CLV1 в АМП. В принципе, MOL1 и CLV1 взаимозаменяемы, т.е. обладают одинаковым механизмом действия. Пространственные различия в активности рецепторов LRR‒RLK в камбии можно объяснить двойственностью происхождения этой ткани [102]. По зависимости от ауксина камбий напоминает АМП – ауксин необходим для пролиферации клеток камбия. Высокий уровень сигналов ауксина выявлен в стволовых клетках камбия или рядом с ними [103, 104]. WOX4 является интегратором действия ауксина, роль которого не зависит от стимуляции модулем PXY–CLE41/42/44 и кажется аналогичной ауксинзависимой активности WOX5 [90, 103, 105].
Латеральные меристемы
Растения отличаются от большинства животных способностью начинать новые циклы роста и развития, основанной на возникновении и работе меристем ветвления. У семенных растений ветвление обеспечивается пазушными, или латеральными, меристемами (ЛМ), которые располагаются в пазухе каждого листа и развиваются в боковые побеги [106, 107].
Активность стволовых клеток при инициации латеральных меристем
ЛМ обладают тем же потенциалом развития, что и АМП. Исследования на растениях арабидопсиса и томата, выполненные с использованием метода прижизненного имиджинга клеток пазухи листа, показали, что ЛМ происходят от популяции стволовых клеток [108, 109]. В независимых исследованиях обнаружено, что предшественники клеток ЛМ откладываются в АМП лишь за 7‒9 клеточных делений до инициации ЛМ [109]. Скорость деления клеток-предшественников ЛМ оказалась намного ниже, чем у клеток, окружающих будущую почку, однако непосредственно перед формированием ЛМ скорость деления увеличивается. В пазухе листа поддерживается популяция клеток, в которых постоянно экспрессируется маркер меристем STM, а потомки этих клеток образуют пазушные почки [108]. Удаление лазером STM-экспрессирующих клеток, но не соседних с ними, не позволяло формироваться почке. Таким образом, STM-экспрессирующие клетки ЛМ удовлетворяют критериям стволовых клеток, поскольку находятся в недифференцированном состоянии, могут дифференцироваться в специализированные клетки и могут делиться с образованием новых стволовых клеток. Обнаружено, что в популяции стволовых клеток клеточные деления происходят в две фазы, которые различаются уровнями экспрессии STM. Переход между этими фазами происходит по так называемой “пороговой модели”, согласно которой поддержание экспрессии STM на низком уровне при низком уровне ауксина необходимо, но не достаточно для инициации ЛМ, и лишь увеличение экспрессии STM приведет к индукции инициации ЛМ [108]. По-видимому, низкий уровень экспрессии STM и ауксина необходим для поддержания состояния компетентности стволовых клеток. Клетки, переставшие экспрессировать STM, утрачивают компетентность в отношении формирования меристемы, поскольку они не чувствительны к локальному повышению активности STM на более поздних стадиях. В этой же работе показано, что в отличие от АМП и АМК, удаление стволовых STM-продуцирующих клеток в ЛМ полностью препятствовало формированию почки [108].
Повышенная экспрессия STM приводит к активации делений компетентных клеток и формированию морфологически заметного бугорка. Далее для образования нового ОЦ апикальной меристемы бокового побега активируется de novo экспрессия WUSCHEL (WUS) [110, 111]. Экспрессия CLAVATA3 (CLV3), маркера стволовых клеток, становится заметной через один пластохрон (отрезок времени между образованием апексом побега двух последовательных примордиев) после экспрессии WUS, а WUS непосредственно активирует CLV3 [112]. Таким образом, появление модуля WUS‒CLV3 доказывает, что для ЛМ характерны те же структура и потенциал развития, что и у АМП.
Регуляция инициации латеральных меристем ауксином
Известно, что ауксин играет ключевую роль в развитии растений, и инициация ЛМ в процессе вегетативного роста происходит при минимальной концентрации ауксина [55, 113‒115]. И, соответственно, эктопическая гиперпродукция ауксина в пазухе листа ингибирует инициацию ЛМ, тогда как эктопическое ингибироваие ауксинового сигнала приводит к образованию дополнительных боковых почек. Низкий уровень ауксина вызывает формирование ЛМ в результате регуляции экспрессии STM [108]. Повышение же синтеза ауксина останавливает дифференцировку стволовых клеток.
Генные регуляторные сети, ответственные за инициацию латеральных меристем
Формирование ЛМ у A. thaliana регулируется несколькими генами, кодирующими такие факторы транскрипции, как CUP-SHAPED COTYLEDON (CUC), LATERAL SUPPRESSOR (LAS), REGULATOR OF AXILLARY MERISTEMS (RAX) и REVOLUTA (REV) [106, 107, 116]. Показано, что фактор транскрипции REV регулирует экспрессию маркера меристем STM [117]. Непосредственно перед началом формирования ЛМ локально продуцируемый REV активирует экспрессию STM в центре пазухи листа [108], при этом для поддержания повышенного уровня REV требуется фактор LAS [118]. Активация экспрессии STM зависит от уже существующего его уровня и также нуждается в подходящем эпигенетическом статусе. На границах примордиев в локусе STM наблюдаются модификации хроматина, приводящие к активации его транскрипции, тогда как во взрослых листьях хроматин в этом локусе модифицирован таким образом, что транскрипция затруднена [108]. Длительная эктопическая экспрессия REV поддерживает, а в дальнейшем активирует эктопическую экспрессию STM на верхней стороне взрослого листа, что приводит к формированию там эктопической ЛМ.
Другой ключевой регулятор, ответственный за формирование ЛМ ‒ RAX1 [119, 120]. Фактор транскрипции EXCESSIVE BRANCHES1 (EXB1) экспрессируется в пазухе листа и напрямую активирует экспрессию RAX1, при этом сверхэкспрессия EXB1 приводит к появлению “кустистого” фенотипа [121]. Известно также, что при переходе к цветению регулятор идентичности флоральной меристемы LEAFY (LFY) непосредственно активирует экспрессию RAX1 [122]. Однако мишени RAX1 не установлены, по-видимому, одна из них ‒ ген REGULATOR OF AXILLARY MERISTEM FORMATION (ROX) арабидопсиса, ортолог гена LAX PANICLE1 риса и гена STALK1 кукурузы, поскольку у растений, мутантных по гену RAX, экспрессия ROX не обнаружена [123].
Регуляция формирования латеральных меристем цитокинином
Помимо низкого содержания ауксина в окружении будущей ЛМ, перед ее формированием наблюдается повышение уровня цитокинина [114]. Показано даже, что гиперпродукция цитокинина в пазухе листа частично компенсировала дефекты инициации ЛМ в rax-мутантах. Экспрессирующийся в ОЦ фактор транскрипции WUS участвует не только в формировании АМП в эмбриогенезе, но он, как и его ортолог у риса, необходим для формирования ЛМ [110, 111, 124, 125]. Во время инициации ЛМ цитокинин в пазухе листа активирует экспрессию WUS de novo [110]. При этом с промотором гена WUS непосредственно связываются активаторы транскрипции цитокининового пути ARABIDOPSIS RESPONSE REGULATOR (ARR) типа В [126]. Как и в случае STM, для ограничения экспрессии WUS областью меристем с уже установленным определенным уровнем экспрессии STM необходимо соответствующее эпигенетическое окружение.
Следует отметить, что те же регуляторные цепи ответственны и за “внеурочное” формирование меристем, например, после повреждений [127, 128]. Остается открытым вопрос о природе сигналов положения, которые обуславливают различия между клетками пазухи листа и соседними дифференцированными клетками, а также поддерживают состояние компетентности стволовых клеток. Другой важный вопрос заключается в том, как меняется регуляция инициации ЛМ после перехода к цветению, особенно в пазухах стеблевых листьев. Существенно, что после перехода к цветению действует другой механизм регуляции влияния ауксина. Например, известно, что максимальный уровень ауксина необходим для ветвления соцветий у кукурузы [129, 130] и арабидопсиса [131]. Также известно, что для инициации ЛМ на вегетативных и репродуктивных стадиях необходима экспрессия разных наборов генов [106, 132].
Аналогия с регуляторными каскадами у животных
Для поддержания состояния плюрипотентности стволовым клеткам животных требуются условия гипоксии, тогда как повышение парциального давления кислорода приводит к их дифференцировке [133]. Недавно с помощью генетических методов и сверхчувствительных измерений концентрации кислорода было показано, что в АМП стволовые клетки растений также находятся в зоне гипоксии [134], и содержание кислорода играет существенную роль в регуляции формирования листьев. Обнаружено, что в условиях гипоксии, в которых находятся АМП, ингибируется путь протеолиза белка ZPR2, контролирующего активность фактора транскрипции HD-ZIP III, таким образом регулируется активность побеговых меристем [53]. Так показано, что кислород, как диффузный фактор, вовлечен в контроль активности стволовых клеток растений, живущих в аэробных условиях, и локальное содержание кислорода в тканях влияет на развитие растений. На молекулярном уровне роль кислорода объединяет состояние метаболической активности и регуляцию развития растений.
Оказалось, что помимо гормонов, в судьбе стволовых клеток растений принимает участие древний консервативный киназный комплекс TARGET OF RAPAMYCIN (TOR), известный как основной регулятор белкового синтеза и клеточной пролиферации всего живого. Многочисленные исследования доказывают, что TOR вовлечен в регуляцию транскрипции WUS, и его активность необходима для поддержания популяции стволовых клеток в АМП [75, 135‒138]. При прорастании экспрессия WUS дополнительно индуцируется энергией света, и для этого необходима активность TOR. Можно представить, что, вероятно, свет индуцирует синтез ауксина, ингибируя Е3-лигазу CONSTITUVE PHOTOMORPHOGENIC 1. Ауксин активирует малую Rho-подобную GTPазу ROP2, которая, в свою очередь, активирует TOR [139, 140]. Предполагается, что на следующих стадиях сигналом к развитию растения является трегалоза-6-фосфат, ингибирующий киназу SnRK1 ‒ антагониста TOR SUCROSENON-FERMENTING-1 (SNF1). Таким образом разрешается переход к цветению [141].
Предполагается также, что TOR играет роль интегратора гормонального статуса растений. Во время стресса, например при голодании, индуцированные рецепторы абсцизовой кислоты и фосфатаза PP2C активируют киназу SnRK2, которая фосфорилирует RAPTOR, регуляторную субъединицу TOR-комплекса, необходимую для выполнения им киназной функции. Такое фосфорилирование приводит к диссоциации RAPTOR от TOR, что ингибирует его киназную активность. При благоприятных условиях, напротив, TOR фосфорилирует рецепторы абсцизовой кислоты и ингибирует активность SnRK2 [142]. Индукция диссоциации комплекса TOR абсцизовой кислотой служит моделью количественного равновесия между различными сигналами. Помимо негативной регуляции транскрипционных сетей с участием абсцизовой кислоты, комплекс TOR ингибирует и каскады с участием жасмоновой и салициловой кислот [143‒145].
Известно, что фитогормоны оказывают влияние и на животные клетки, причем реакция на них со стороны животного организма может быть как благоприятной, так и негативной, выражающейся в туморогенном действии, индукции окислительного стресса, воспалительных и аллергических реакций [146]. В частности, экзогенная абсцизовая кислота стимулирует пролиферацию и подвижность мезенхимных стволовых клеток человека, культивируемых in vitro. Кроме того, этот гормон подавляет пролиферацию клеток лейкоза мышей, снижает жизнеспособность и вызывает дифференцировку линии клеток гепатоцеллюлярной карциномы человека, ингибируя экспрессию генов-маркеров стволовых клеток, усиливая экспрессию каспазы-3 и индуцируя апоптоз. Обнаружено, что часть сигнальных путей абсцизовая кислота делит с производными ретиноевой кислоты. Структура абсцизовой кислоты сходна с укороченной структурой ретиноевой кислоты, и у растений она синтезируется по пути, похожему на путь синтеза ретиноевой кислоты [147]. Интересно, что жасмонаты также оказались способны убивать и подавлять раковые клетки, но “не трогать” нормальные [146, 148]. Как это происходит —пока не до конца понятно. Предложено несколько механизмов, например, действие на митохондрии, запуск внутри клетки реакций, приводящих к генерации активных форм кислорода (прежде всего, пероксида водорода), в результате чего клетка буквально сгорает в окислительном пожаре. Другой возможный механизм, как и в случае с ретиноевой и абсцизовой кислотами, заключается в том, что процесс злокачественного перерождения обращается вспять ‒ недифференцированная клетка снова встает на путь специализации. Показано, что жасмонаты, способствуя усилению вторичного роста ствола, участвуют в сигнальном каскаде, определяющем баланс между пролиферацией и дифференцировкой клеток сосудов у арабидопсиса [95].
И у растений, и у животных гормоны контролируют каждую стадию развития стволовых клеток, включая спецификацию, поддержание и дифференцировку, причем их действие может быть различным. Например, растительные гормоны цитокинин и ауксин осуществляют руководство функционированием стволовых клеток в АМП и АМК, их спецификацией, а также могут контролировать их дифференцировку. Таким же образом тиреоидные гормоны контролируют морфогенез кишечника у мышей, влияя на поддержание стволовых клеток крипт и пролиферацию стволовых клеток эпителия [1].
Важнейшее различие между растениями и животными кроется в сфере плюрипотентности – даже вне ниш стволовых клеток многие растительные клетки способны к дедифференцировке, возврату к пролиферации и в состояние плюрипотентности, что наблюдается после обширной травмы или в культуре тканей. Именно поэтому считается, что концепция стволовых клеток растений должна быть существенно пересмотрена, и стволовыми должны считаться все клетки, способные формировать зародыши in vivo или in vitro (включая зиготу), вне зависимости от их расположения [149]. Согласно этому мнению, зигота должна считаться стволовой клеткой первого порядка, или прогениторной стволовый клеткой. При этом зигота находится в особом микроокружении, она может делиться и формировать несколько эмбрионов, однако она не обладает способностью к самоподдержанию (то же свойственно и эмбриональным стволовым клеткам животных). При этом, главным доводом считать эмбриональные стволовые клетки животных стволовыми клетками является их способность к самоподдержанию в определенных условиях in vitro.
Эксперименты по in vitro репрограммированию дифференцированных клеток животных предоставили возможность не только для потенциальной терапии, но и для исследования молекулярных механизмов плюрипотентности на основе сравнительного анализа. Обнаружение определенных модификаций гистонов в недифференцированных клетках, значительные эпигенетические модификации в процессе репрограммирования, активация деацетилаз гистонов при индукции стволовых клеток специфичным для растений фактором транскрипции WOX, позволили понять, на что нужно обратить особое внимание [81, 150, 151]. В конечном итоге эта информация позволит выявить механизмы естественного отбора, действовавшие в процессе эволюции на основные клеточные системы всех высших организмов, включая человека.
Написание настоящего обзора не потребовало специального финансирования.
Работа не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Heidstra R., Sabatini S. (2014) Plant and animal stem cells: similar yet different. Nat. Rev. Mol. Cell Biol. 15, 301–312.
Greb T., Lohmann J.U. (2016) Plant stem cells. Curr. Biol. 26, R816–R821.
Зубов Д.А. (2016) Стволовые клетки растений и животных: две стороны одной медали. Часть 1. Гены и клетки. 11(3), 14‒22.
Зубов Д.А. (2016) Стволовые клетки растений и животных: две стороны одной медали. Часть 2. Гены и клетки. 11(4), 6‒17.
Gaillochet C., Lohmann J.U. (2015) The never-ending story: from pluripotency to plant developmental plasticity. Development. 142, 2237–2249.
Maximow A. (1909) Der Lymphozyt als gemeinsame Stammzelle der verschiedenen Blutelemente in der embryonalen Entwicklung und im postfetalen Leben der Säugetiere. (Demonstrationsvortrag, gehalten in der ausserordentlichen Sitzung der Berliner Hämatologischen Gesellschaft am 1. Juni 1909). Folia Haematologica. 8, 125‒134.
Додуева И.Е., Творогова В.Е., Азарахш М., Лебедева М.А., Лутова Л.А. (2016) Стволовые клетки растений: единство и многообразие. Вавиловский журнал генетики и селекции. 20, 441‒458.
Schofield R. (1978) The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells. 4, 7–25.
ten Hove C.A., Lu K.J., Weijers D. (2015) Building a plant: cell fate specification in the early Arabidopsis embryo. Development. 142, 420–430.
Pfeiffer A., Janocha D., Dong Y., Medzihradszky A., Schone S., Daum G., Suzaki T., Forner J., Langenecker T., Rempel E., Schmid M., Wirtz M., Hell R., Lohmann J.U. (2016) Integration of light and metabolic signals for stem cell activation at the shoot apical meristem. Elife. 5, e17023.
Furuta K.M., Hellmann E., Helariutta Y. (2014) Molecular control of cell specification and cell differentiation during procambial development. Annu. Rev. Plant Biol. 65, 607– 638.
Zhang J., Nieminen K., Serra J.A., Helariutta Y. (2014) The formation of wood and its control. Curr. Opin. Plant Biol. 17, 56–63.
De Rybel B., Mahonen A.P., Helariutta Y., Weijers D. (2016) Plant vascular development: from early specification to differentiation. Nat. Rev. Mol. Cell Biol. 17, 30–40.
Wang Q., Hasson A., Rossmann S., Theres K. (2016) Divide et impera: boundaries shape the plant body and initiate new meristems. New Phytol. 209, 485–498.
Vilches-Barro A., Maizel A. (2015) Talking through walls: mechanisms of lateral root emergence in Arabidopsis thaliana. Curr. Opin. Plant Biol. 23, 31–38.
Reddy G.V., Heisler M.G., Ehrhardt D.W., Meyero-witz E.M. (2004) Real-time lineage analysis reveals oriented cell divisions associated with morphogenesis at the shoot apex of Arabidopsis thaliana. Development. 131, 4225‒4237.
Reinhardt D., Frenz M., Mandel T., Kuhlemeier C. (2003) Microsurgical and laser ablation analysis of interactions between the zones and layers of the tomato shoot apical meristem. Development. 130, 4073–4083.
Gruel J., Landrein B., Tarr P., Schuster C., Refahi Y., Sampathkumar A., Hamant O., Meyerowitz E.M., Jonsson H. (2016) An epidermis-driven mechanism positions and scales stem cell niches in plants. Sci. Adv. 2, 22‒24.
Zhao Z., Andersen S.U., Ljung K., Dolezal K., Miotk A., Schultheiss S.J., Lohmann J.U. (2010) Hormonal control of the shoot stem-cell niche. Nature. 465, 1089–1092.
Kurakawa T., Ueda N., Maekawa M., Kobayashi K., Kojima M., Nagato Y., Sakakibara H., Kyozuka J. (2007) Direct control of shoot meristem activity by a cytokinin-activating enzyme. Nature. 445, 652–655.
Besnard F., Refahi Y., Morin V., Marteaux B., Brunoud G., Chambrier P., Rozier F., Mirabet V., Legrand J., Laine S., Thévenon E., Farcot E., Cellier C., Das P., Bishopp A., Dumas R., Parcy F., Helariutta Y., Boudaoud A., Godin C., Traas J., Guédon Y., Vernoux T. (2014) Cytokinin signalling inhibitory fields provide robustness to phyllotaxis. Nature. 505, 417‒421.
Muller B., Sheen J. (2008) Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis. Nature. 453, 1094–1097.
Hay A., Tsiantis M. (2010) KNOX genes: versatile regulators of plant development and diversity. Development. 137, 3153–3165.
Long J.A., Moan E.I., Medford J.I., Barton M.K. (1996) A member of the KNOTTED class of homeodomain proteins encoded by the STM gene of Arabidopsis. Nature. 379, 66–69.
Hake S., Smith H.M. S., Holtan H., Magnani E., Mele G., Ramirez J. (2004) The role of knox genes in plant development. Annu. Rev. Cell Dev. Biol. 20, 125–151.
Landrein B., Kiss A., Sassi M., Chauvet A., Das P., Cortizo M., Laufs P., Takeda S., Aida M., Traas J., Vernoux T., Boudaoud A., Hamant O. (2015) Mechanical stress contributes to the expression of the STM homeobox gene in Arabidopsis shoot meristems. eLife. 4, 1‒27.
Heisler M.G., Ohno C., Das P., Sieber P., Reddy G.V., Long J.A., Meyerowitz E.M. (2005) Patterns of auxin transport and gene expression during primordium development revealed by live imaging of the Arabidopsis inflorescence meristem. Curr. Biol. 15, 1899–1911.
Long J., Barton M.K. (2000) Initiation of axillary and floral meristems in Arabidopsis. Dev. Biol. 218, 341–353.
Chung Y., Zhu Y., Wu M-F., Simonini S., Kuhn A., Armenta-Medina A., Jin R., Østergaard L., Stewart Gillmor C., Wagner D. (2019) Auxin response factors promote organogenesis by chromatin-mediated repression of the pluripotency gene SHOOTMERISTEMLESS. Nat. Comm. 10, 886.
Mayer K.F., Schoof H., Haecker A., Lenhard M., Jürgens G., Laux T. (1998) Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem. Cell. 95, 805–815.
Schuster C., Gaillochet C., Medzihradszky A., Busch W., Daum G., Krebs M., Kehle A., Lohmann J.U. (2014) A regulatory framework for shoot stem cell control integrating metabolic, transcriptional, and phytohormone signals. Dev. Cell. 28, 438–449.
Daum G., Medzihradszky A., Suzaki T., Lohmann J.U. (2014) A mechanistic framework for noncell autonomous stem cell induction in Arabidopsis. Proc. Natl. Acad. Sci. USA. 111, 14619–14624.
Yadav R.K., Perales M., Gruel J., Girke T., Jonsson H., Reddy G.V. (2011) WUSCHEL protein movement mediates stem cell homeostasis in the Arabidopsis shoot apex. Genes Dev. 25, 2025–2030.
Gordon S.P., Chickarmane V.S., Ohno C., Meyero-witz E.M. (2009) Multiple feedback loops through cytokinin signaling control stem cell number within the Arabidopsis shoot meristem. Proc. Natl. Acad. Sci. USA. 106, 16529–16534.
Ohyama K., Shinohara H., Ogawa-Ohnishi M., Matsubayashi Y. (2009) A glycopeptide regulating stem cell fate in Arabidopsis thaliana. Nat. Chem. Biol. 5, 578–580.
Fletcher J.C., Brand U., Running M.P., Simon R., Meyerowitz E.M. (1999) Signaling of cell fate decisions by CLAVATA3 in Arabidopsis shoot meristems. Science. 283, 1911–1914.
Xu C., Liberatore K.L., MacAlister C.A., Huang Z., Chu Y.-H., Jiang K., Brooks C., Ogawa-Ohnishi M., Xiong G., Pauly M. (2015) A cascade of arabinosyltransferases controls shoot meristem size in tomato. Nat. Genet. 47, 784‒792.
Ogawa M., Shinohara H., Sakagami Y., Matsubayashi Y. (2008) Arabidopsis CLV3 peptide directly binds CLV1 ectodomain. Science. 319, 294‒294.
Shinohara H., Matsubayashi Y. (2015) Reevaluation of the CLV3-receptor interaction in the shoot apical meristem: dissection of the CLV3 signaling pathway from a direct ligand-binding point of view. Plant J. 82, 328–336.
Bleckmann A., Weidtkamp-Peters S., Seidel C.A., Simon R. (2010) Stem cell signaling in Arabidopsis requires CRN to localize CLV2 to the plasma membrane. Plant Physiol. 152, 166–176.
Guo Y., Han L., Hymes M., Denver R., Clark S.E. (2010) CLAVATA2 forms a distinct CLE-binding receptor complex regulating Arabidopsis stem cell specification. Plant J. 63, 889–900.
Gish L.A., Clark S.E. (2011) The RLK/Pelle family of kinases. Plant J. 66, 117–127.
Schoof H., Lenhard M., Haecker A., Mayer K.F., Jurgens G., Laux T. (2000) The stem cell population of Arabidopsis shoot meristems in maintained by a regulatory loop between the CLAVATA and WUSCHEL genes. Cell. 100, 635–644.
Soyars C.L., James S.R., Nimchuk Z.L. (2016) Ready, aim, shoot: stem cell regulation of the shoot apical meristem. Curr. Opin. Plant Biol. 29, 163–168.
Shpak E.D. (2013) Diverse roles of ERECTA family genes in plant development. J. Integr. Plant Biol. 55, 1238‒1250.
Torii K.U. (2012) Mix-and-match: ligand–receptor pairs in stomatal development and beyond. Trends Plant Sci. 17, 711‒719.
Bergmann D.C., Lukowitz W., Somerville C.R. (2004) Stomatal development and pattern controlled by a MAPKK kinase. Science. 304, 1494‒1497.
Williams R.W., Wilson J.M., Meyerowitz E.M. (1997) A possible role for kinase-associated protein phosphatase in the Arabidopsis CLAVATA1 signaling pathway. Proc. Natl. Acad. Sci. USA. 94, 10467‒10472.
Song S-K., Lee M.M., Clark S.E. (2006) POL and PLL1 phosphatases are CLAVATA1 signaling intermediates required for Arabidopsis shoot and floral stem cells. Development. 133, 4691‒4698.
Yu L.P., Simon E.J., Trotochaud A.E., Clark S.E. (2000) POLTERGEIST functions to regulate meristem development downstream of the CLAVATA loci. Dev. Camb. Engl. 127, 1661–1670.
Kinoshita A., Seo M., Kamiya Y., Sawa S. (2015) Mystery in genetics: PUB4 gives a clue to the complex mechanism of CLV signaling pathway in the shoot apical meristem. Plant Signal Behav. 10, e1028707.
Kimura Y., Tasaka M., Torii K.U., Uchida N. (2018) ERECTA-family genes coordinate stem cell functions between the epidermal and internal layers of the shoot apical meristem. Development. 145, pii: dev156380.
Mandel T., Candela H., Landau U., Asis L., Zelinger E., Carles C.C., Williams L.E. (2016) Differential regulation of meristem size, morphology and organization by the ERECTA, CLAVATA and class III HD-ZIP pathways. Development. 143, 1612‒1622.
Kato H., Ishizaki K., Kouno M., Shirakawa M., Bowman J.L., Nishihama R., Kohchi T. (2015) Auxin-mediated transcriptional system with a minimal set of components is critical for morphogenesis through the life cycle in Marchantia polymorpha. PLoS Genet. 11, e1005084.
Ulmasov T., Hagen G., Guilfoyle T.J. (1999) Activation and repression of transcription by auxin-response factors. Proc. Natl Acad. Sci. USA. 96, 5844–5849.
Weijers D., Wagner D. (2016) Transcriptional responses to the auxin hormone. Annu. Rev. Plant. Biol. 67, 539–574.
Wu M.F., Yamaguchi N., Xiao J., Bargmann B., Estelle M., Sang Y., Wagner D. (2015) Auxin-regulated chromatin switch directs acquisition of flower primordium founder fate. eLife. 4, e09269.
Tiwari S.B., Hagen G., Guilfoyle T.J. (2004) Aux/IAA proteins contain a potent transcriptional repression domain. Plant Cell. 16, 533–543.
Szemenyei H., Hannon M., Long J.A. (2008) TOPLESS mediates auxindependent transcriptional repression during Arabidopsis embryogenesis. Science. 319, 1384–1386.
Cosgrove D.J. (2017) Diffuse growth of plant cell walls. Plant Physiol. 176, 16‒27.
Bichet A., Desnos T., Turner S., Grandjean O., Höfte H (2001) BOTERO1 is required for normal orientation of cortical microtubules and anisotropic cell expansion in Arabidopsis. Plant J. 25, 137–148.
Uyttewaal M., Burian A., Alim K., Landrein B.T., Borowska-Wykret D., Dedieu A., Peaucelle A., Ludynia M., Traas J., Boudaoud A., Kwiatkowska D., Hamant O. (2012) Mechanical stress acts via katanin to amplify differences in growth rate between adjacent cells in Arabidopsis. Cell. 149, 439–451.
Jackson M.D.B., Duran-Nebreda S., Kierzkowski D., Strauss S., Xu H., Landrein B., Hamant O., Smith R.S., Johnston I.G., Bassel G.W. (2019) Global topological order emerges through local mechanical control of cell divisions in the Arabidopsis shoot apical meristem. Cell Syst. 8, 53‒65.e3.
Milani P., Gholamirad M., Traas J., Arneodo A., Boudaoud A., Argoul F., Hamant O. (2011) In vivo analysis of local wall stiffness at the shoot apical meristem in Arabidopsis using atomic force microscopy. Plant J. 67, 1116‒1123.
Peaucelle A., Louvet R., Johansen J.N., Hofte H., Laufs P., Pelloux J., Mouille G. (2008) Arabidopsis phyllotaxis is controlled by the methylesterification status of cell-wall pectins. Curr. Biol. 18, 1943‒1948.
Tran D., Galletti R., Neumann E.D., Dubois A., Sharif-Naeini R., Geitmann A., Frachisse J.M., Hamant O., Ingram G.C. (2017) A mechanosensitive Ca2+ channel activity is dependent on the developmental regulator DEK1. Nat. Commun. 8, 1‒7.
Hamant O., Heisler M.G., Jonsson H., Krupinski P., Uyttewaal M., Bokov P., Corson F., Sahlin P., Boudaoud A., Meyerowitz E.M., Couder Y., Traas J. (2008) Developmental patterning by mechanical signals in Arabidopsis. Science. 322, 1650–1655.
Endrizzi K., Moussian B., Haecker A., Levin J.Z., Laux T. (1996) The SHOOT MERISTEMLESS gene is required for maintenance of undifferentiated cells in Arabidopsis shoot and floral meristems and acts at a different regulatory level than the meristem genes WUSCHEL and ZWILLE. Plant J. 10, 967‒979.
Yang W., Schuster C., Beahan C.T., Charoensawan V., Peaucelle A., Bacic A., Doblin M.S., Wightman R., Meyerowitz E.M. (2016) Regulation of meristem morphogenesis by cell wall synthases in Arabidopsis. Curr. Biol. 26, 1404‒1415.
Milani P., Mirabet V., Cellier C., Rozier F., Hamant O., Das P., Boudaoud A. (2014) Matching patterns of gene expression to mechanical stiffness at cell resolution through quantitative tandem epifluorescence and nanoindentation. Plant Physiol. 165, 1399‒1408.
Wolf S., Mravec J., Greiner S., Mouille G., Hofte H. (2012) Plant cell wall homeostasis is mediated by brassinosteroid feedback signaling. Curr. Biol. 22, 1732‒1737.
Wolf S., van der Does D., Ladwig F., Sticht C., Kolbeck A., Schurholz A-K., Augustin S., Keinath N., Rausch T., Greiner S., Schumacher K., Harter K., Zipfel C., Höfte H. (2014) A receptor-like protein mediates the response to pectin modification by activating brassinosteroid signaling. Proc. Natl. Acad. Sci. USA. 111, 15261‒15266.
Wolf S. (2017) Plant cell wall signalling and receptor-like kinases. Biochem. J. 474, 471‒492.
Sinclair S.A., Larue C., Bonk L., Khan A., Castillo-Michel H., Stein R.J., Grolimund D., Begerow D., Neumann U., Haydon M.J., Krämer U. (2017) Etiolated seedling development requires repression of photomorphogenesis by a small cell-wall-derived dark signal. Curr. Biol. 27, 3403–3418.e7.
Pfeiffer A., Janocha D., Dong Y., Medzihradszky A., Schone S., Daum G., Suzaki T., Forner J., Langenecker T., Rempel E., Schmid M., Wirtz M., Hell R., Lohmann J.U. (2016) Integration of light and metabolic signals for stem cell activation at the shoot apical meristem. eLife. 5, e17023.
van den Berg C., Willemsen V., Hendriks G., Weisbeek P., Scheres B. (1997) Short-range control of cell differentiation in the Arabidopsis root meristem. Nature. 390, 287–289.
Mähönen A.P., ten Tusscher K., Siligato R., Sme-tana O., Diaz-Trivino S., Salojarvi J., Wachsman G., Prasad K., Heidstra R., Scheres B. (2014) PLETHORA gradient formation mechanism separates auxin responses. Nature. 515, 125–129.
Dello I.R., Nakamura K., Moubayidin L., Perilli S., Taniguchi M., Morita M.T., Aoyama T., Costantino P., Sabatini S. (2008) A genetic framework for the control of cell division and differentiation in the root meristem. Science. 322, 1380–1384.
Zhang W., Swarup R., Bennett M., Schaller G.E., Kieber J.J. (2013) Cytokinin induces cell division in the quiescent center of the Arabidopsis root apical meristem. Curr. Biol. 23, 1979–1989.
Sarkar A.K., Luijten M., Miyashima S., Lenhard M., Hashimoto T., Nakajima K., Scheres B., Heidstra R., Laux T. (2007) Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers. Nature. 446, 811–814.
Pi L., Aichinger E., van der Graaff E., Llavata-Peris C.I., Weijers D., Hennig L., Groot E., Laux T. (2015) Organizer-derived WOX5 signal maintains root columella stem cells through chromatin-mediated repression of CDF4 expression. Dev. Cell. 33, 576–588.
Czyzewicz N., Nikonorova N., Meyer M. R., Sandal P., Shah S., Vu L.D., Gevaert K., Rao A.G., De Smet I. (2016) The growing story of (ARABIDOPSIS) CRINKLY 4. J. Exp. Bot. 67, 4835–4847.
Stahl Y., Grabowski S., Bleckmann A., Kuhnemuth R., Weidtkamp-Peters S., Pinto K.G., Kirschner G.K., Schmid J.B., Wink R.H., Hulsewede A., Felekyan S., Seidel C.A., Simon R. (2013) Moderation of Arabidopsis root stemness by CLAVATA1 and ARABIDOPSIS CRINKLY4 receptor kinase complexes. Curr. Biol. 23, 362–371.
Stahl Y., Wink R.H., Ingram G.C., Simon R. (2009) A signaling module controlling the stem cell niche in Arabidopsis root meristems. Curr. Biol. 19, 909–914.
Dolzblasz A., Nardmann J., Clerici E., Causier B., van der Graaff E., Chen J., Davies B., Werr W., Laux T. (2016) Stem cell regulation by Arabidopsis WOX genes. Mol. Plant. 9, 1028–1039.
Liu Z., Karmarkar V. (2008) Groucho/Tup1 family co-repressors in plant development. Trends Plant Sci. 13, 137–144.
Zhou Y., Liu X., Engstrom E.M., Nimchuk Z.L., Pruneda-Paz J.L., Tarr P.T., Yan A., Kay S.A., Meyero-witz E.M. (2014) Control of plant stem cell function by conserved interacting transcriptional regulators. Nature. 517, 377–380.
Miyashima S., Sebastian J., Lee J.Y., Helariutta Y. (2013) Stem cell function during plant vascular development. EMBO J. 32, 178–193.
Kondo Y. (2018) Reconstitutive approach for investigating plant vascular development. J. Plant Res. 13, 23–29.
Scarpella E., Marcos D., Friml J., Berleth T. (2006) Control of leaf vascular patterning by polar auxin transport. Gen. Dev. 20, 1015–1027.
Ma L., Sang X., Zhang T., Yu Z., Li Y., Zhao F., Wang Z., Wang Y., Yu P., Wang N., Zhang C., Ling Y., Yang Z., He G. (2017) Abnormal vascular bundles regulates cell proliferation and procambium cell establishment during aerial organ development in rice. New Phytol. 213, 275‒286.
Hirakawa Y., Kondo Y., Fukuda H. (2010) TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis. Plant Cell. 22, 2618–2629.
Hirakawa Y., Shinohara H., Kondo Y., Inoue A., Nakanomyo I., Ogawa M., Sawa S., Ohashi-Ito K., Matsubayashi Y., Fukuda H. (2008) Non-cell-autonomous control of vascular stem cell fate by a CLE peptide receptor system. Proc. Natl. Acad. Sci. USA. 105, 15208–15213.
Kondo Y., Ito T., Nakagami H., Hirakawa Y., Saito M., Tamaki T., Shirasu K., Fukuda H. (2014). Plant GSK3 proteins regulate xylem cell differentiation downstream of TDIF-TDR signalling. Nat. Commun. 5, 3504.
Etchells J.P., Smit M.E., Gaudinier A., Williams C.J., Brady S.M. (2016) A brief history of the TDIF-PXY signalling module: Balancing meristem identity and differentiation during vascular development. New Phytol. 209, 474–484.
Matsumoto-Kitano M., Kusumoto T., Tarkowski P., Kinoshita-Tsujimura K., Vaclavikova K., Miyawaki K., Kakimoto T. (2008) Cytokinins are central regulators of cambial activity. Proc. Natl. Acad. Sci. USA. 105, 20027–20031.
Nieminen K., Immanen J., Laxell M., Kauppinen L., Tarkowski P., Dolezal K., Tahtiharju S., Elo A., Decourteix M., Ljung K., Bhalerao R., Keinonen K., Albert V.A., Helariutta Y. (2008) Cytokinin signaling regulates cambial development in poplar. Proc. Natl. Acad. Sci. USA. 105, 20032–20037.
Sieburth L.E., Deyholos M.K. (2006) Vascular development: the long and winding road. Curr. Opin. Plant Biol. 9, 48‒54.
van der Graaff E., Laux T., Rensing S. A. (2009) The WUS homeobox-containing (WOX) protein family. Genome Biol. 10, 248.
Etchells J.P., Turner S.R. (2010) The PXY-CLE41 receptor ligand pair defines a multifunctional pathway that controls the rate and orientation of vascular cell division. Development. 137, 767–774.
Vilarrasa-Blasi J., Gonzalez-Garcia M.P., Frigola D., Fabregas N., Alexiou K.G., Lopez-Bigas N., Rivas S., Jauneau A., Lohmann J.U., Benfey P.N., Ibañes M., Caño-Delgado A.I. (2014) Regulation of plant stem cell quiescence by a brassinosteroid signaling module. Dev. Cell. 30, 36–47.
Gursanscky N., Jouannet V., Grünwald K., Sanchez P., Laaber-Schwarz M., Greb T. (2016) MOL1 is required for cambium homeostasis in Arabidopsis. Plant J. 86, 210–220.
Suer S., Agustı J., Sanchez P., Schwarz M., Greb T. (2011) WOX4 imparts auxin responsiveness to cambium cells in Arabidopsis. Plant Cell. 23, 3247–3259.
Nilsson J., Karlberg A., Antti H., Lopez-Vernaza M., Mellerowicz E., Perrot-Rechenmann C., Sandberg G., Bhalerao R.P. (2008) Dissecting the molecular basis of the regulation of wood formation by auxin in hybrid aspen. Plant Cell. 20, 843–855.
Ding Z., Friml J. (2010) Auxin regulates distal stem cell differentiation in Arabidopsis roots. Proc. Natl. Acad. Sci. USA. 107, 12046–12051.
Wang Q., Hasson A., Rossmann S., Theres K. (2016) Divide et impera: boundaries shape the plant body and initiate new meristems. New Phytol. 209, 485‒498.
Wang Y., Jiao Y. (2018) Axillary meristem initiation – a way to branch out. Curr. Opin. Plant Biol. 41, 61–66.
Shi B., Zhang C., Tian C., Wang J., Wang Q., Xu T., Xu Y., Ohno C., Sablowski R., Heisler M.G., Theres K., Wang Y., Jiao Y. (2016) Two-step regulation of a meristematic cell population acting in shoot branching in Arabidopsis. PLoS Genet. 12, e1006168.
Burian A., Barbier de Reuille P., Kuhlemeier C. (2016) Patterns of stem cell divisions contribute to plant longevity. Curr. Biol. 26, 1385‒1394.
Wang J., Tian C., Zhang C., Shi B., Cao X., Zhang T.Q., Zhao Z., Wang J.W., Jiao Y. (2017) Cytokinin signaling activates WUSCHEL expression during axillary meristem initiation. Plant Cell. 29, 1373‒1387.
Xin W., Wang Z., Liang Y., Wang Y., Hu Y. (2017) Dynamic expression reveals a two-step patterning of WUS and CLV3 during axillary shoot meristem formation in Arabidopsis. J. Plant Physiol. 214, 1‒6.
Yadav R.K., Perales M., Gruel J., Girke T., Jonsson H., Reddy G.V. (2011) WUSCHEL protein movement mediates stem cell homeostasis in the Arabidopsis shoot apex. Genes Dev. 25, 2025‒2030.
Vernoux T., Brunoud G., Farcot E., Morin V., Van den Daele H., Legrand J., Oliva M., Das P., Larrieu A., Wells D., Guédon Y., Armitage L., Picard F., Guyomarc’h S., Cellier C., Parry G., Koumproglou R., Doonan J.H., Estelle M., Godin C., Kepinski S., Bennett M., De Veylder L., Traas J. (2011) The auxin signalling network translates dynamic input into robust patterning at the shoot apex. Mol. Syst. Biol. 7, 508.
Wang Y., Wang J., Shi B., Yu T., Qi J., Meyerowitz E.M., Jiao Y. (2014) The stem cell niche in leaf axils is established by auxin and cytokinin in Arabidopsis. Plant Cell. 26, 2055‒2067.
Wang Q., Kohlen W., Rossmann S., Vernoux T., Theres K. (2014) Auxin depletion from the leaf axil conditions competence for axillary meristem formation in Arabidopsis and tomato. Plant Cell. 26, 2068‒2079.
Yang M., Jiao Y. (2016) Regulation of axillary meristem initiation by transcription factors and plant hormones. Front Plant Sci. 7, 183.
Tian C., Zhang X., He J., Yu H., Wang Y., Shi B., Han Y., Wang G., Feng X., Zhang C., Wang J., Qi J., Yu R., Jiao Y. (2014) An organ boundary-enriched gene regulatory network uncovers regulatory hierarchies underlying axillary meristem initiation. Mol. Syst. Biol. 10, 755.
Greb T., Clarenz O., Schafer E., Muller D., Herrero R., Schmitz G., Theres K. (2003) Molecular analysis of the LATERAL SUPPRESSOR gene in Arabidopsis reveals a conserved control mechanism for axillary meristem formation. Genes Dev. 17, 1175‒1187
Muller D., Schmitz G., Theres K. (2006) Blind homologous R2R3 Myb genes control the pattern of lateral meristem initiation in Arabidopsis. Plant Cell. 18, 586‒597.
Keller T., Abbott J., Moritz T., Doerner P. (2006) Arabidopsis REGULATOR OF AXILLARY MERISTEMS1 controls a leaf axil stem cell niche and modulates vegetative development. Plant Cell. 18, 598‒611.
Guo D.S., Zhang J.Z., Wang X.L., Han X., Wei B.Y., Wang J.Q., Li B.X., Yu H., Huang Q.P., Gu H.Y., Qu L.J., Qin G. (2015) The WRKY transcription factor WRKY71/EXB1 controls shoot branching by transcriptionally regulating RAX genes in Arabidopsis. Plant Cell. 27, 3112‒3127.
Chahtane H., Vachon G., Le Masson M., Thevenon E., Perigon S., Mihajlovic N., Kalinina A., Michard R., Moyroud E., Monniaux M., Sayou C., Grbic V., Parcy F., Tichtinsky G. (2013) A variant of LEAFY reveals its capacity to stimulate meristem development by inducing RAX1. Plant J. 74, 678‒689.
Yang F., Wang Q., Schmitz G., Muller D., Theres K. (2012) The bHLH protein ROX acts in concert with RAX1 and LAS to modulate axillary meristem formation in Arabidopsis. Plant J. 71, 61‒70.
Lu Z., Shao G., Xiong J., Jiao Y., Wang J., Liu G., Meng X., Liang Y., Xiong G., Wang Y., Li J. (2015) MONOCULM 3, an ortholog of WUSCHEL in rice, is required for tiller bud formation. J. Genet. Genomics. 42, 71‒78.
Tanaka W., Ohmori Y., Ushijima T., Matsusaka H., Matsushita T., Kumamaru T., Kawano S., Hirano H.Y. (2015) Axillary meristem formation in rice requires the WUSCHEL ortholog TILLERS ABSENT1. Plant Cell. 27, 1173‒1184
Argueso C.T., Raines T., Kieber J.J. (2010) Cytokinin signaling and transcriptional networks. Curr. Opin. Plant Biol. 13, 533‒539.
Meng W.J., Cheng Z.J., Sang Y.L., Zhang M.M., Rong X.F., Wang Z.W., Tang Y.Y., Zhang X.S. (2017) Type-B ARABIDOPSIS RESPONSE REGULATORs specify the shoot stem cell niche by dual regulation of WUSCHEL. Plant Cell. 29, 1357‒1372.
Zhang T.Q., Lian H., Zhou C.M., Xu L., Jiao Y., Wang J.W. (2017) A two-step model for de novo activation of WUSCHEL during plant shoot regeneration. Plant Cell. 29, 1073‒1087.
Gallavotti A., Yang Y., Schmidt R.J., Jackson D. (2008) The relationship between auxin transport and maize branching. Plant Physiol. 147, 1913‒1923.
Galli M., Liu Q.J., Moss B.L., Malcomber S., Li W., Gaines C., Federici S., Roshkovan J., Meeley R., Nemhauser J.L., Gallavotti A. (2015) Auxin signaling modules regulate maize inflorescence architecture. Proc. Natl. Acad. Sci. USA. 112, 13372‒13377.
Reinhardt D., Mandel T., Kuhlemeier C. (2000) Auxin regulates the initiation and radial position of plant lateral organs. Plant Cell. 12, 507‒518.
Huang X., Effgen S., Meyer R.C., Theres K., Koornneef M. (2012) Epistatic natural allelic variation reveals a function of AGAMOUS-LIKE6 in axillary bud formation in Arabidopsis. Plant Cell. 24, 2364‒2379.
Mohyeldin A., Garzón-Muvdi T., Quiñones-Hinojosa A. (2010) Oxygen in stem cell biology: a critical component of the stem cell niche. Cell Stem Cell. 7, 150–161.
Weits D.A., Kunkowska A.B., Kamps N.C.W., Portz K.M.S., Packbier N.K., Nemec Venza Z., Gaillochet C., Lohmann J.U., Pedersen O., van Dongen J.T., Licausi F. (2019) An apical hypoxic niche sets the pace of shoot meristem activity. Nature. 569, 714‒717.
Xiong Y., McCormack M., Li L., Hall Q., Xiang C., Sheen J. (2013) Glucose-TOR signalling reprograms the transcriptome and activates meristems. Nature. 496, 181‒186.
Li X., Cai W., Liu Y., Li H., Fu L., Liu Z., Xu L., Liu H., Xu T., Xiong Y. (2017) Differential TOR activation and cell proliferation in Arabidopsis root and shoot apexes. Proc. Natl. Acad. Sci. USA. 114, 2765‒2770.
Mohammed B., Farahi Bilooei S., Doczi R., Grove E., Railo S., Palme K., Ditengou F.A., Bogre L., Lopez-Juez E. (2017) Converging energy and hormonal signalling control meristem activity, leaf initiation and growth. Plant Physiol. 176, 1365–1381.
Janocha D., Lohmann J.U. (2018) From signals to stem cells and back again. Curr. Opin. Plant Biol. 45, 136‒142.
Cai W., Li X., Liu Y., Wang Y., Zhou Y., Xu T., Xiong Y. (2017) COP1 integrates light signals to ROP2 for cell cycle activation. Plant Signal Behav. 12, e1363946.
Schepetilnikov M., Makarian J., Srour O., Geldreich A., Yang Z., Chicher J., Hammann P., Ryabova L.A. (2017) GTPase ROP2 binds and promotes activation of target of rapamycin, TOR, in response to auxin. EMBO J. 36, 886‒903.
Nukarinen E., Nagele T., Pedrotti L., Wurzinger B., Mair A., Landgraf R., Bornke F., Hanson J., Teige M., Baena-Gonzalez E., Dröge-Laser W., Weckwerth W. (2016) Quantitative phosphoproteomics reveals the role of the AMPK plant ortholog SnRK1 as a metabolic master regulator under energy deprivation. Sci. Rep. 6, 31697.
Wang P., Zhao Y., Li Z., Hsu C-C., Liu X., Fu L., Hou Y-J., Du Y., Xie S., Zhang C. Gao J., Cao M., Huang X., Zhu Y., Tang K., Wang X., Tao W.A., Xiong Y., Zhu J.K. (2018) Reciprocal regulation of the TOR kinase and ABA receptor balances plant growth and stress response. Mol. Cell. 69, 100‒112.e6.
De Vleesschauwer D., Filipe O., Hoffman G., Seifi H.S., Haeck A., Canlas P., Van Bockhaven J., De Waele E., Demeestere K., Ronald P., Hofte M. (2018) Target of rapamycin signaling orchestrates growth-defense trade-offs in plants. New Phytol. 217, 305‒319.
Salem M.A., Li Y., Wiszniewski A., Giavalisco P. (2017) Regulatory associated protein of TOR (RAPTOR) alters the hormonal and metabolic composition of Arabidopsis seeds, controlling seed morphology, viability and germination potential. Plant J. 92, 525‒545.
Song Y., Zhao G., Zhang X., Li L., Xiong F., Zhuo F., Zhang C., Yang Z., Datla R., Ren M., Li F. (2017) The crosstalk between target of rapamycin (TOR) and jasmonic acid (JA) signaling existing in Arabidopsis and cotton. Sci. Rep. 7, 1‒15.
Вильданова М.С., Смирнова Е.А. (2016) Характер влияния и специфичность действия растительных гормонов на клетки животных. Цитология. 58(1), 5‒15.
Zhou N., Yao Y., Ye H., Zhu W., Chen L., Mao Y. (2016) Abscisic-acid-induced cellular apoptosis and differentiation in glioma via the retinoid acid signaling pathway. Int. J. Cancer. 138, 1947‒1958
Zhang M., Zhang M.W., Zhang L., Zhang L. (2015) Methyl jasmonate and its potential in cancer therapy. Plant Signal. Behavior. 10, e1062199.
Альберт Е.А., Ежова Т.А. (2013) Стволовые клетки побега растений ‒ генетическая регуляция. Генетика. 49, 127‒141.
Murakami K., Gunesdogan U., Zylicz J.J., Tang W.W., Sengupta R., Kobayashi T., Kim S., Butler R., Dietmann S., Surani M.A. (2016) NANOG alone induces germ cells in primed epiblast in vitro by activation of enhancers. Nature. 529, 403–407.
Lafos M., Kroll P., Hohenstatt M.L., Thorpe F.L., Clarenz O., Schubert D. (2011) Dynamic regulation of H3K27 trimethylation during Arabidopsis differentiation. PLoS Genet. 7, 1002040.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


