Молекулярная биология, 2020, T. 54, № 2, стр. 300-307
Термостабильность и рефолдинг белков в бактериях определяются активностью двух различных групп АТP-зависимых шаперонов
Г. Б. Завильгельский a, *, Е. Ю. Гнучих a, О. Е. Мелькина a
a Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра “Курчатовский институт”
117545 Москва, Россия
* E-mail: zavilgel@genetika.ru
Поступила в редакцию 07.10.2019
После доработки 07.10.2019
Принята к публикации 23.10.2019
Аннотация
Термостабильность белков-ферментов определяют, измеряя их активность при инкубировании при постоянной сравнительно высокой температуре. Рефолдинг термоинактивированных ферментов проводят в присутствии шаперонов, как правило, при пониженной температуре, оптимальной для проявления ферментативной активности. Нами проведен сравнительный анализ термостабильности бактериальных люцифераз, измеряемой in vitro (бесклеточные экстракты) и in vivo (непосредственно в бактериальной клетке). В качестве модели использованы термочувствительные люциферазы Aliivibrio fischeri, Photorhabdus luminescens и Photobacterium leiognathi. Показано, что термостабильнось этих люцифераз в бактериях Escherichia coli MG1655 dnaK+ и PK202 ΔdnaKJ14 значительно выше, чем в бесклеточных экстрактах. Однако, если кинетику термоинактивации люцифераз in vivo измерять в присутствии в среде разобщителя окислительного фосфорилирования протонофора карбонилцианид-3-хлорфенилгидразона (СССР) или летучего гидрофобного вещества (–)-лимонена (С10H16), то термостабильность ферментов резко снижается вплоть до уровня, характерного для бесклеточных препаратов. Показано также, что CCCP и (–)-лимонен практически полностью ингибируют DnaKJE-зависимый рефолдинг термоинактивированных люцифераз. В процессе повышения термостабильности люцифераз в E. coli помимо DnaKJE-шаперона участвуют ATP-зависимые шапероны ClpA и ClpB, активность которых также ингибируется в присутствии СССР и (–)-лимонена. Предполагается, что ATP-зависимые шапероны DnaKJE и GroEL/ES (группа 1) способны, затрачивая энергию гидролиза ATP → AMP, проводить рефолдинг белков как после снижения температуры (стандартные условия рефолдинга), так и при высокой температуре, при которой происходит термоинактивация белков (условие термодинамического неравновесия). ATP-зависимые шапероны ClpA, ClpB (группа 2) не способны самостоятельно осуществлять рефолдинг в стандартных условиях, т.е. при снижении температуры, но способны за счет гидролиза ATP поддерживать неравновесную стабилизацию белков в нативной форме при высокой температуре.
Термостабильность белков-ферментов определяют in vitro, измеряя их активность при инкубировании при постоянной температуре [1‒6]. Рефолдинг термоинактивированных белков проводят как in vitro, так и in vivo в присутствии шаперонов, как правило, при температуре, оптимальной для проявления ферментативной активности [7‒11]. Для получения неактивного препарата фермента, используемого для последующего рефолдинга, применяют предварительную термообработку при повышенной температуре в течение определенного интервала времени. Так рефолдинг малатдегидрогеназы (MDH), осуществляемый ATP-зависимым шаперонином GroEL/ES, проводили in vitro при повышенной температуре (37°С) [12]. При этом термоинактивация и рефолдинг фермента происходят одновременно, что характерно для термодинамически неравновесных систем. В связи с присутствием в клетке большого количества высоколабильных макромолекул (РНК, ферменты), для поддержания нативных структур которых in vivo при стрессовых условиях термодинамического неравновесия (повышенная температура, осмотический шок и др.) затрачивается значительное количество энергии (ATP → AMP), клетке необходимы различные группы ATP-зависимых шаперонов. Представляет интерес специфичность данных групп шаперонов, например, их способность поддерживать термостабильность белков при высокой температуре, т.е. в условиях термодинамического неравновесия, или проводить рефолдинг белков при понижении температуры среды, т.е. в оптимальных условиях. Термостабильность ферментов можно определять не только in vitro с использованием очищенных препаратов, но и in vivo, непосредственно в бактериальной клетке. Однако в этом случае необходимо использовать метод, с помощью которого можно разделить процессы истинной термоинактивации фермента и осуществляемого одновременно рефолдинга клеточными ATP-зависимыми шаперонами. С этой целью использовали: 1) разобщитель окислительного фосфорилирования ‒ протонофор карбонилцианид-3-хлорфенилгидразон (СССР), позволяющий снижать внутриклеточную концентрацию ATP до минимального уровня; и 2) низкомолекулярное гидрофобное вещество (–)-лимонен (C10H16). Так как для процесса рефолдинга белкам-шаперонам требуется гидролиз значительного количества ATP, то можно ожидать, что при добавлении СССР к суспензии бактерий будет происходить снижение ATP-зависимого рефолдинга. Использование гидрофобного (–)-лимонена в качестве ингибитора шаперонзависимого рефолдинга основано на ранее опубликованных нами данных об эффективном ингибировании DnaKJE-зависимого рефолдинга in vivo при добавлении к суспензии бактерий гидрофобных низкомолекулярных кетонов (2-гептанона и др.) [13]. В качестве белков-субстратов использовали бактериальные люциферазы Aliivibrio fischeri, Photobacteriuum leiognathi и Photorhabdus luminescens, которые характеризуются пониженной термостабильностью, что позволяет измерять термоинактивацию и шаперонзависимый рефолдинг ферментов непосредственно в бактериальной клетке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бактериальные штаммы и плазмиды. Escherichia coli K12 MG1655 и мутант PK202 ∆dnaK14 ∆dnaJ14 dksA::kan получены от E. Craig (США) [14]. E. coli K12 SG20250 ∆lacU169 araD flbB relA clpA+ clpB+ и его инсерционные мутанты SG22099 clpA::kan сlpB+ и SG22100 clpA+ clpB::kan получены от S. Gottesman (США) [15]. Гибридная плазмида pF2 с генами luxAB A. fischeri, расположенными под lac-промотором в векторе pUC18, сконструирована реклонированием фрагмента XhoI/SalI из плазмиды pF1, содержащей полный lux-оперон A. fischeri [16]. Гибридная плазмида pXen4 с генами luxAB P. luminescens Zm1, расположенными под lac-промотором в векторе pUC18, сконструирована реклонированием фрагмента XhoI/PstI из плазмиды pXen7, содержащей полный lux-оперон (luxCDABEG) P. luminescens Zm1 [17]. Гибридная плазмида pLeo1 содержит в векторе pUC18 гены luxCDABE Ph. leiognathi под lac-промотором [18].
Среды, реактивы. Клетки растили в бульоне Луриа–Бертани (LB) и на агаризованной среде LB, содержащей ампициллин (100 мкг/мл), при 30°C. FMN и н-деканаль и протонофор CCCP получены от “Sigma-Aldrich” США. (–)-Лимонен (C10H16) (>96%) и дитионит натрия получены от “Fisher Scientific”, Германия.
Выделение и очистка бактериальных люцифераз. Бактериальные клетки, содержащие гибридные плазмиды с генами luxAB, растили в L-бульоне с ампициллином (100 мкг/мл) при 28°C на качалке до OD = 2.5–3.0. После центрифугирования клетки ресуспендировали в 1/10 объема раствора, содержащего 50 мМ фосфатный буфер pH 7.0 и 20 мМ β-меркаптоэтанол. Белковый экстракт получали путем обработки суспензии ультразвуком (44 кГц) при охлаждении во льду порциями по 30 мл (6 раз по 20 с). Для удаления фрагментов клеток озвученную суспензию центрифугировали в течение 30 мин при 30 000 g. Последующую очистку белка проводили на колонке с сефадексом G-25, элюируя 0.1 M калий-фосфатным буфером, pH 7.0. Фракции, содержащие люциферазу, определяли по биолюминесценции. Содержание белка в пробе после очистки на колонке с сефадексом-G-25 составляло 100 мкг/мл.
Для измерения активности люциферазы Ph. leiognathi in vitro использовали двухкомпонентную ферментную систему (R + L): NADH:FMN-оксидоредуктаза + люцифераза [19]. Эта система включает две реакции:
(1)
${\text{FMN}} + {\text{NADH}} \to {\text{FMN}}{{{\text{H}}}_{2}} + {\text{NA}}{{{\text{D}}}^{ + }},$(2)
$\begin{gathered} {\text{FMN}}{{{\text{H}}}_{2}} + {\text{RCHO}} + {{{\text{O}}}_{2}} \to {\text{FMN}} + {\text{RCOOH}}\,\,{\text{ + }} \\ + \,\,{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{ квант света }}({{\lambda }_{{{\text{max}}}}} = 490{\text{ нм}}). \\ \end{gathered} $В первой реакции образуется восстановленный FMN (FMNH2), который, в свою очередь, обеспечивает постоянный уровень биолюминесценции. Лиофилизированные высокоочищенные ферменты двухкомпонентной системы (R + L) получены из лаборатории бактериальной биолюминесценции (Институт биофизики СО РАН, Красноярск). Каждая проба содержит 0.5 мг/мл люциферазы и 0.15 ед. NADH:FMN-оксидоредуктазы из Ph. leiognathi.
Измерение интенсивности биолюминесценции. Бактериальная люцифераза катализирует окисление длинноцепочечного альдегида (RCHO) атмосферным кислородом (O2) в присутствии FMNH2 (см. уравнение 2).
In vivo активность люциферазы измеряли с использованием люминометра LMAO1 (“Beckman”, США) при 20°C. Суспензию синтезирующей люциферазу бактериальной культуры (200 мкл) E. coli (pF2) или E. coli (pXen4) смешивали с 0.001% н-деканаля (3 мкл) в этаноле и через 30 с–1 мин измеряли интенсивность биолюминесценции. Для бактерий E. coli (pLeo1) н-деканаль не требуется, так как гены luxCDE обеспечивают клетки тетрадеканалем ‒ субстратом люциферазы.
In vitro активность люцифераз A. fischeri и P. luminescens (бесклеточные экстракты) определяли на люминометре модели 1251 (Финляндия) при 20°C. Реакционная среда содержала 0.1 M калий-фосфатный буфер, pH 7.0, 20 мМ β-меркаптоэтанол, 20 мкМ FMN и 6.8 мкМ н-деканаль. Реакцию запускали добавлением 20 мкл 0.1%-ного раствора дитионита натрия, восстанавливающего FMN до FMNH2, в кювету с реакционной смесью, расположенную непосредственно перед фотоумножителем люминометра [20]. Конечный объем реакционной смеси составлял 1 мл. Поскольку FMNH2 окисляется быстро по сравнению со временем жизни промежуточных интермедиатов люминесцентной реакции, фермент осуществляет лишь один оборот, причем интенсивность свечения достигает максимума в течение первых нескольких секунд.
In vitro активность люциферазы Ph. leiognathi, содержащейся в двухкомпонентной системе (R + L), определяли на люминометре LMAO1 (“Beckman”) при 20°C. Реакционная смесь содержала 5 мкл раствора двухкомпонентной ферментной системы, 200 мкл 0.05 М калий-фосфатного буфера (pH 6.8), 200 мкл 0.4 мМ NADH, 50 мкл 0.5 мМ FMN и 5 мкл 0.001%-ного н-деканаля. Все компоненты последовательно вносили в кювету и быстро перемешивали. Кювету ставили в люминометр перед фотоумножителем и измеряли максимальную интенсивность биолюминесценции (в относительных единицах, ОЕ).
Термоинактивация и рефолдинг люцифераз. Термоинактивацию люцифераз in vivo и in vitro проводили в водяной бане при фиксированной температуре. В опытах in vivo к суспензии клеток добавляли хлорамфеникол (167 мкг/мл) для ингибирования синтеза белка. Для снижения концентрации ATP в бактериях использовали разобщитель окислительного фосфорилирования CCCP. Концентрацию ATP в бактериальных клетках определяли с использованием люциферазы светлячка [21].
Рефолдинг люцифераз проводили in vivo (бактерии E. coli) или при комнатной температуре, или при температуре, оптимальной для данной люциферазы: 22°C для люцифераз A. fischeri и Ph. leiognathi и 35°C ‒ для люциферазы P. luminescens [1, 9]. Через определенные интервалы времени отбирали аликвоты (200 мкл) и измеряли интенсивность люминесценции.
При определении активности (–)-лимонена в качестве ингибитора рефолдинга эту субстанцию вносили в пластмассовые пробирки объемом 1 мл, содержащие бактериальные клетки (титр 2‒3 × 108/мл) в среде LB. Пробирки заклеивали парафильмом (“ParafilmM” США).
Предварительный “тепловой шок” проводили, выдерживая клетки E. coli при 42°C в течение 30 мин без добавления хлорамфеникола.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Рефолдинг термоинактивированных люцифераз
Измерение кинетики и уровня рефолдинга термоинактивированных люцифераз проводили in vivo в клетках E. coli K12 MG1655 и его делеционного мутанта PK202 ΔdnaKJ14, содержащих плазмиду с генами luxAB A. fischeri или P. luminescens (плазмиды pF2 или pXen4), а также плазмиду pLeo1 с генами luxCDABE Ph. leiognathi. Бактерии росли при 28°С до середины экспоненциальной фазы. После проведения “теплового шока” (30 мин при 42°С) к суспензии клеток для ингибирования последующего синтеза белка добавляли хлорамфеникол (167 мкг/мл), культуру переносили в водяную баню для инактивации люциферазы. Температуру и время инкубации для каждой люциферазы выбирали таким образом, чтобы окончательный уровень ферментативной активности составлял 10–3–10–4 от исходного. Рефолдинг инактивированных люцифераз проводили при 22°С (люциферазы A. fischeri и Ph. leiognathi) или при 35°С (люцифераза P. luminescens), оптимальных для этих ферментов. На рис. 1а‒в приведены зависимости уровня ренатурации люцифераз (в процентах от исходного уровня) от времени инкубации. Как видим, рефолдинг белков полностью отсутствует в клетках штамма PK202 ΔdnaKJ14 (кривые 2). В клетках MG1655 dnaK+ происходит рефолдинг всех люцифераз, однако термолабильные люциферазы A. fischeri и Ph. leiognathi ренатурируют значительно полнее (до 80% от исходного уровня у A. fischeri и до 40% ‒ у Ph. leiognathi) по сравнению с термостабильной люциферазой P. luminescens (около 10% от исходного уровня). Отметим, что несколько сниженный уровень рефолдинга (40%) люциферазы Ph. leiognathi вызван присутствием в среде синтезируемого одновременно с люциферазой субстрата реакции – длинноцепочечного альдегида тетрадеканаля, ингибирующего активность шаперона DnaKJE.
Рис. 1.
DnaKJE-зависимый рефолдинг бактериальных люцифераз A. fischeri (а), Ph. leiognathi (б) и P, luminescens (в). Влияние СССР и (–)-лимонена. 1 – E. coli MG1655 dnaK+, 2 – E. coli PK202 ΔdnaKJ14, 3 – E. coli MG1655 + + СССР (50 мкМ), 4 – E. coli MG1655 + (–)-лимонен (7 мкМ). По оси ординат указана активность люциферазы (в процентах от исходного уровня); по оси абсцисс – время (мин) выдерживания образца при температуре, оптимальной для данной люциферазы (22°C ‒ A. fischeri и Ph. leiognathi, 35°C ‒ P. luminescens). Здесь и на рис. 2‒4 представлены средние данные, полученные не менее чем из трех повторов.
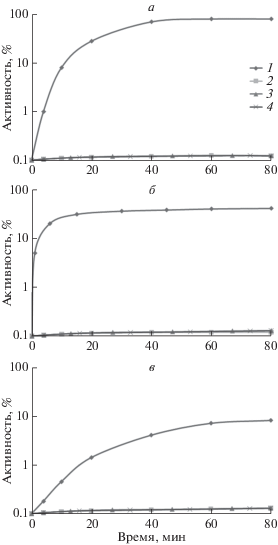
Если в клеточную суспензию за несколько минут до начала измерения уровня рефолдинга термоинактивированных люцифераз добавить СССР (50 мкM), то рефолдинг практически полностью отсутствует (кривые 3). Отметим, что уже через несколько минут после добавления СССР концентрация ATP в клетках снижается практически до фонового уровня как при комнатной, так и при повышенной температуре, причем при комнатной температуре исходная интенсивность биолюминесценции не снижается на протяжении всего опыта (данные не приведены). Следовательно, низкий уровень ATP в клетке критичен для рефолдинга белка, проводимого DnaKJE-шапероном, но не для самой биолюминесцентной реакции.
DnaKJE-зависимый рефолдинг практически полностью отсутствует, если к суспензии бактерий E. coli MG1655 добавлен (–)-лимонен (7 мкМ) (рис. 1, кривые 4).
Определение термостабильности люцифераз
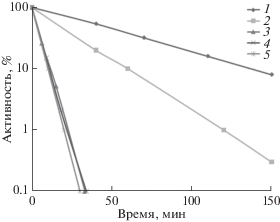
На рис. 2 приведены кинетические кривые термоинактивации люциферазы P. luminescens при 44°С: in vivo (в штаммах MG1655 dnaK+ и PK202 ΔdnaKJ14) и in vitro (бесклеточный экстракт) в стандартных условиях и при добавлении СССР или (–)-лимонена в среду c бактериальными клетками на ранней стадии термоинактивации. Как видим, скорость термоинактивации люциферазы в мутантном штамме PK202 ΔdnaKJ14 примерно в 2 раза выше, чем в штамме MG1655 dnaK+. Следовательно, шаперон DnaK, ответственный за рефолдинг белков при низкой температуре, принимает непосредственное участие также в процессе стабилизации структуры фермента при высокой температуре. В свою очередь, термостабильность люциферазы in vivo в штамме PK202, согласно кинетике кривых термоинактивации, примерно в 5‒6 раз выше термостабильности в “бесклеточном экстракте” in vitro. Если же CCCP или (–)-лимонен добавляли к суспензии клеток на ранней стадии термоинактивации, то скорости термоинактивации люциферазы, измеряемые in vivo, практически совпадали со скоростью термоинактивации, измеряемой in vitro. Следовательно, клетки мутантного штамма PK202 содержат ATP-зависимый шаперон (или несколько подобных шаперонов), который в отличие от DnaKJE не способен проводить стандартный, т.е. при пониженной температуре, рефолдинг термоинактивированных белков, но способен, затрачивая энергию гидролиза ATP, поддерживать нативную структуру белка при высокой температуре, т.е. в условиях термодинамического неравновесия.
Рис. 2.
Кинетика термоинактивации люциферазы P. luminescens in vitro и in vivo в E. coli MG1655 dnaK+ и PK202 ∆dnaKJ14 при 44°C. Влияние СССР и (–)-лимонена. По оси ординат указана активность люциферазы (в процентах от исходного уровня), по оси абсцисс – время термоинактивации, мин. 1 – E. coli MG1655 dnaK+; 2 – E. coli PK202 ∆dnaKJ14; 3 ‒ E. coli PK202 + CCCP (50 мкМ); 4 ‒ E. coli PK202 + (–)-лимонен (7 мкМ); 5 – “бесклеточный экстракт” (in vitro).
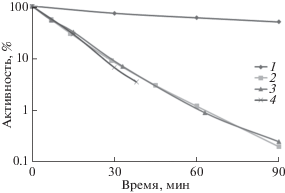
На рис. 3 приведены кинетические кривые термоинактивации термочувствительной люциферазы Ph. leiognathi при 35°С: in vivo (в штамме PK202 ΔdnaKJ14) и in vitro (двухкомпонентная система, R + L) в стандартных условиях и при добавлении СССР или (–)-лимонена в среду c бактериальными клетками на ранней стадии термоинактивации. Как и в варианте с термостабильной люциферазой P. luminescens, наблюдается повышенная термостабильность фермента in vivo. При добавлении в среду СССР (50 мкМ) или (–)-лимонена (7 мкМ) термостабильность снижается практически до уровня, характерного для очищенного препарата белка.
Рис. 3.
Кинетика термоинактивации люциферазы P. leiognathi in vitro и in vivo в E. coli PK202 ΔdnaKJ14 при 35°C. Влияние CCCP и (–)-лимонена. По оси ординат указана активность люциферазы (в процентах от исходного уровня), по оси абсцисс – время термоинактивации, мин. 1 – E. coli PK202 ΔdnaKJ14; 2 – E. coli PK202 + CCCP (50 мкМ); 3 – E. coli PK202 + (–)-лимонен (7 мкМ); 4 – “двухкомпонентная система”, R + L (in vitro).
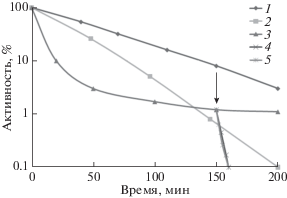
На рис. 4 представлены кривые термоинактивации люциферазы P. luminescens при 44°С in vivo в штаммах E. coli 20250 clpA+clpB+, 22100 clpA+clpB–, 22099 clpA–clpB+ (бактерии содержат плазмиду pXen4). В клетках штамма 22099 clpA-clpB+ наблюдается значительное снижение термостабильности люциферазы, что фиксируется как увеличение наклона на начальной стадии кинетической кривой. Если бактерии содержат шаперон ClpB (штаммы 20250 clpA+clpB+, 2099 clpA–clpB+), то в кинетических кривых термоинактивации люциферазы наблюдается “терморезистентная фракция”, которой нет в мутантном штамме 22100 clpA+clpB–. Для проверки участия шаперона ClpB в поддержании высокой термостабильности люциферазы в суспензию клеток штамма 22099 clpA–clpB+ (pXen4) в начальной стадии формирования “терморезистентной фракции” кинетической кривой термоинактивации вносили СССР (50 мкМ) или (–)-лимонен (7 мкМ). В результате происходило быстрое снижение уровня термостабильности люциферазы – активность фермента уменьшилась на несколько порядков за 7‒8 мин (момент добавления в суспензию клеток CCCP и (–)-лимонена указан стрелкой).
Рис. 4.
Кинетика термоинактивации люциферазы P. luminescens in vivo в E. coli K12 SG20250 clpA+ clpB+ и мутантных штаммах SG22099 clpA::kan сlpB+ и SG22100 clpA+ clpB::kan при 44°C. Влияние СССР и (–)-лимонена на ClpB-зависимую “терморезистентную фракцию”. По оси ординат указана активность люциферазы (в процентах от исходного уровня), по оси абсцисс – время термоинактивации, мин. 1 – E. coli SG20250 clpA+ clpB+; 2 – E. coli SG22100 clpA+ clpB::kan; 3 – E. coli SG22099 clpA::kan сlpB+. Стрелкой указан момент добавления препарата: 4 – (–)-лимонен; 5 – CCCP.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Установлено, что при повышенной температуре ATP-зависимые шапероны GroEL/ES и DnaKJE за счет энергии гидролиза ATP → AMP участвуют в процеcсе неравновесной стабилизации нативной структуры белков [12]. Как показано ранее, эти шапероны с высокой эффективностью проводят также рефолдинг термоинактивированных белков в стандартных условиях, т.е. при пониженных температурах. Согласно предложенной модели [12], при высокой температуре, инактивирующей ферменты, процесс поддержания нативной формы белка с участием шаперонов за счет энергии гидролиза ATP подчиняется законам неравновесной термодинамики. В этом случае формированию за счет тепловой энергии локально денатурированного участка в полипептидной цепи практически одновременно противостоит (ATP + шаперон)-зависимый процесс реверсии денатурированного участка в нативное состояние. При отсутствии ATP или шаперона при высокой температуре белок продолжает терять активность, а при понижении температуры переходит спонтанно в энергетически (свободная энергия) более низкую равновесную форму неактивного белка. Можно предположить, что более высокая термостабильность белков в бактериях по сравнению с бесклеточными препаратами не связана с активностью шаперонов, а определяется сугубо механическими условиями, например, адсорбцией на подложках типа мембран, так как закрепление фермента на носителе препятствует его разворачиванию и тем самым снижает уровень термоденатурации. Подобный способ повышения термостабильности используется в опытах in vitro при адсорбции ферментов на подложках специального состава (крахмальный и желатиновый гели, активированная агароза и др.) [19, 22]. Однако в этом случае повышенная термостабильность белков есть результат, определяемый согласно законам равновесной термодинамики, и не связана с необходимостью гидролиза ATP в качестве источника энергии для поддержания метастабильного нативного состояния.
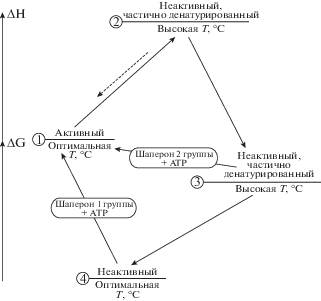
В свете данных, представленных в настоящей работе, необходимо рассматривать наличие в бактериальных клетках двух групп ATP-зависимых шаперонов: 1) способных проводить рефолдинг как при понижении температуры после термоинактивации белка, так и при высокой температуре, при которой происходит инактивация белка; 2) не способных проводить стандартный рефолдинг (т.е. при пониженной температуре), но способных поддерживать неравновесную стабилизацию нативных форм белка при высокой температуре. К первой группе шаперонов относятся DnaKJE и GroEL/ES, ко второй группе, по-видимому, относятся ClpB и, возможно, ClpA, а также пока неизвестные шапероны, проявляющие активность в мутантном штамме PK202 ΔdnaKJ14. Согласно “transient model” [5] термоинактивация фермента (1 – активная форма) при повышении температуры проходит через две промежуточные обратимые стадии 2 и 3 (неактивные формы), причем на энергетической шкале неактивная форма 3 располагается ниже формы 2, и переход из активной формы 1 в неактивную форму 3 происходит через промежуточную форму 2. При понижении температуры среды фермент переходит в неактивную форму 4, которая на энергетической шкале располагается ниже как формы 3, так и активной формы 1 (рис. 5). Можно предположить, что если ATP-зависимые шапероны группы 1 с высокой эффективностью осуществляют рефолдинг неактивного белка в форме 4 (переход 4 → 1, условие термодинамического равновесия), то ATP-зависимые шапероны группы 2 способны ренатурировать лишь неактивный белок в энергетически более высокой форме 3 (переход 3 → 1, условие термодинамического неравновесия). Согласно нашим предварительным данным, в грамположительных бактериях Bacillus subtilis шапероны группы 2 обладают повышенной способностью поддерживать белки в активном состоянии при условии термодинамического неравновесия, что проявляется в значительном повышении термостабильности (примерно на 4‒5°С) люцифераз по сравнению с их термостабильностью в грамотрицательных бактериях E. coli.
Рис. 5.
Переходы между различными формами фермента. 1 – фермент в активной форме при 20‒25°C, 2 и 3 – частично денатурированные неактивные формы фермента при высокой температуре, 4 – частично денатурированная неактивная форма фермента при 20‒25°C. При комплексировании с ATP-зависимым шапероном фермент из неактивных частично денатурированных конформаций 3 (+ шапероны группы 2) и 4 (+ шапероны группы 1) может в результате гидролиза ATP → AMP переходить в активную форму 1. Реакции, осуществляемые шаперонами, изображены стрелками.
Авторы выражают благодарность S. Gottesman (США) за предоставленные штаммы-мутанты clpAB, и E. Craig (США) за штамм PK202, а также А.В. Богачеву (МГУ им. М.В. Ломоносова) за помощь в измерении содержания ATP в бактериях и Р.С. Шакулову (ГосНИИгенетика, Москва) за обсуждение результатов.
Работа поддержана Государственным заданием № 595-00003-19ПР.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Тюлькова Н.А., Сандалова Т.П. (1996) Сравнительное исследование влияния температуры на бактериальные люциферазы. Биохимия. 61, 275‒287.
Valkova N., Szittner R., Meighen E. (1999) Control of luminescence decay and flavin binding by the LuxA carboxyl-terminal regions in chimeric bacterial luciferases. Biochemistry. 38. 13820‒13829.
Завильгельский Г.Б., Котова В.Ю., Мажуль М.М., Манухов И.В. (2004) Влияние белков семейства Clp на DnaK-зависимый рефолдинг бактериальных люцифераз. Mолекуляр. биология. 38, 507‒514.
Daniel R.M., Peterson M.E., Danson M.J., Price N.C., Kelly S.M., Monk C.R., Weinberg C.S., Oudshoorn M.L., Lee C.K. (2010) The molecular basis of the effect of temperature on enzyme activity. Biochem. J. 425, 353‒360.
Chen N.G., Gregory K., Sun Y., Golovlev V. (2011) Transient model of thermal deactivation of enzymes. Biochim. Biophys. Acta. 1814, 1318‒1324.
Koksharov M.N., Ugarova N.N. (2011) Thermostabilization of firefly luciferase by in vivo directed evolution. Protein Engin. Design Selection. 24, 835‒844.
Tomoyasu T., Ogura T., Tatsuta T., Bukau B. (1998) Levels of DnaK and DnaJ provide tight control of heat shock gene expression and protein repair in Escherichia coli. Mol. Microbiol. 30, 567‒581.
Goloubinoff P., Mogk A., Ben-Zvi A.P., Tomoyasu T., Bukau B. (1999) Sequential mechanism of solubilization and refolding of stable protein aggregates by a bichaperone network. Proc. Natl. Acad. Sci. USA. 96, 13732‒13737.
Manukhov I.V., Eroshnikov G.E., Vyssokikh M.Yu., Zavilgelsky G.B. (1999) Folding and refolding of thermolabile and thermostable luciferases: the role of DnaKJ heat-shock proteins. FEBS Lett. 448, 265‒268.
Zolkiewski M. (1999) ClpB cooperates with DnaK, DnaJ and GrpE in suppressing protein aggregation. A novel multi-chaperone system from Escherichia coli. J. Biol. Chem. 274, 28083‒28086.
Mogk A., Tomoyasu T., Goloubinoff P., Rudiger S., Roder D., Langen H., Bukau B. (1999) Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO J. 18, 38017‒38026.
Goloubinoff P., Sassi A.S., Fauvet B., Barducci A., De Los Rios P. (2018) Chaperones convert the energy from ATP into the nonequilibrium stabilization of native proteins. Nat. Chem. Biol. 14, 388‒395.
Melkina O.E., Khmel I.A., Plyuta V.A., Koksharova O.A., Zavilgelsky G.B. (2017) Ketones 2-heptanone, 2-nonanone, and 2-undecanone inhibit DnaK-dependent refolding of heat-inactivated bacterial luciferases in Escherichia coli cells lacking small chaperon IbpB. Appl. Microbiol. Biotechnol. 101, 5765‒5771.
Kang P.-J., Craig E.A. (1990) Identification and characterization of a new Escherichia coli gene that is a dosage-dependent suppressor of a dnaK deletion mutation. J. Bacteriol. 172, 2055‒2064.
Gottesman S., Roche E., Zhou Y., Sauer R.T. (1998) The ClpXP and ClpAP proteases degrade proteins with carboxy-terminal peptide tails added by the SsrA-tagging system. Genes Dev. 12, 1338‒1347.
Чернова Т.А., Завильгельский Г.Б. (1991) Клонирование lux-регулона Vibrio fischeri в клетках Escherichia coli. Биотехнология. 3, 37‒40.
Завильгельский Г.Б., Зарубина А.П., Манухов И.В. (2002) Определение и сравнительный анализ нуклеотидной последовательности lux оперона Photorhabdus luminescens, штамм Zm1. ERIC элементы как предполагаемые “горячие” точки рекомбинации. Молекуляр. биология. 36, 786‒795.
Завильгельский Г.Б., Котова В.Ю., Манухов И.В. (2003) Влияние белков – регуляторов RcsA и RcsB, на экспрессию lux-оперона Vibrio fischeri в клетках Escherichia coli. Молекуляр. биология. 37, 704–711.
Есимбекова Е.Н., Торгашина И.Г., Кратасюк В.А. (2009) Сравнение иммобилизованной и растворимой биферментных систем НАДН:ФМН-оксидоредуктаза-люцифераза. Биохимия. 74, 853–859.
Meighen E.A., Hastings J.W. (1971) Binding site determination from kinetic data. J. Biol. Chem. 246, 7666‒7674.
Lundin A., Thore A. (1975) Comparison of methods for extraction of bacterial adenine nucleotides determined by firefly assay. Appl. Microbiol. 30, 713‒721.
Лундовских И.А., Дементьева Е.И., Угарова Н.Н. (1998) Иммобилизованная рекомбинантная люцифераза светляков. Физико-химические свойства и применение. Биохимия. 63, 820‒826
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


