Молекулярная биология, 2020, T. 54, № 3, стр. 445-449
Гены рРНК дрозофилы образуют устойчивые контакты с геном Tlk в области экспрессии малых РНК и влияют на организацию петлевых доменов
О. В. Кретова a, Д. М. Федосеева a, И. Ю. Словохотов a, Е. С. Клушевская a, Ю. В. Кравацкий a, Н. А. Чуриков a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: tchurikov@eimb.ru
Поступила в редакцию 31.05.2019
После доработки 03.07.2019
Принята к публикации 04.07.2019
Аннотация
В экспериментах на клетках мыши и человека обнаружено, что гены рРНК играют важную роль в дифференцировке и эпигенетической регуляции многих других генов. Конкретные места контактов генов рРНК и их роль в геноме дрозофилы мы изучали с использованием метода 4С (circular chromosome conformation capture). Обнаружено, что ген Tlk, расположенный в Х-хромосоме, образует частые контакты с генами рРНК. Область контактов длиной 5 т.п.н. соответствует району экспрессии малых РНК в разных линиях клеток дрозофилы. После теплового шока число этих контактов увеличивается, а экспрессия гена возрастает. Гены Tlk и Rala, имеющие общую промоторную область, заметно отличаются активностью экспрессии. Показано, что петлевые домены хромосом образуются вокруг мест контактов генов рРНК в гене Tlk. Сделан вывод, что эпигенетическая регуляция с участием генов рРНК может адресно направляться малыми РНК, а контакты генов рРНК вовлечены в изменения трехмерных структур хроматина.
Пространственная организация хромосом важна для эпигенетической регуляции экспрессии генов. Ранее было обнаружено, что в клетках дрозофилы ядрышки, содержащие активные гены рРНК, образуют контакты с определенными местами хромосом [1]. Недавно установили, что кластеры генов рРНК участвуют в эпигенетической регуляции многих генов мыши и человека [2, 3]. Поэтому было интересно выяснить, с какими генами дрозофилы могут контактировать гены рРНК. С этой целью мы использовали метод 4С, который позволяет выявить контакты выбранной области генома с любыми участками хромосом. В настоящем исследовании представлены данные анализа области 85 т.п.н. X‑хромосомы дрозофилы, в которой нами обнаружены устойчивые контакты генов рРНК в гене Tlk.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты 4С. Препараты ДНК из клеток S2 выделяли, как описано ранее [3]. Области генома, контактирующие с генами рРНК, амплифицировали с использованием праймеров 5'‑ACTGTTCACGATGAACTTGGAATT-3' и 5'-TTCA-GTTCACAATCCCAAGACTG-3'. Чтения глубокого секвенирования двух биологических реплик 4C-рРНК, полученные на приборе HiSeq1500 (“Illumina”, США), картировали на геном дрозофилы версии dm6 с помощью пакета BWA. Пакет Samtools 1.6 (http://www.htslib.org) использовали для удаления некартированных чтений и конвертирования SAM-файла в формат BAM. Формат bedGraph использовали для анализа профилей контактов в браузерах. Отбирали гены, контактирующие с генами рРНК, т.е. те, которые находятся в районах наиболее частых контактов генов рРНК в геноме. Частоты контактов оценивали по числу чтений глубокого секвенирования 4C-рРНК (более 100 чтений), совпадающие в обеих репликах. Данные анализировали с использованием браузеров IGB (Integrated Genome Browser, Affymetrix), FlyBase и WASHU EPIGENOME BROWSER [4].
Эксперименты РНК-сек. Проводили два независимых эксперимента. Препараты РНК получали из лизированных клеток S2 с помощью реагента Trizol (“Invitrogen”, США). Качество препаратов контролировали с помощью биоанализатора Agilent. Библиотеки кДНК готовили с помощью наборов реактивов TruSeq Stranded RNA. Глубокое секвенирование двух биологических реплик проводили на приборе HiSeq1500 (“Illumina”). Экспрессию генов анализировали с помощью пакета Deseq2 R.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Обнаружение контактов генов рРНК в области Х-хромосомы, содержащей ген Tlk
На рис. 1 представлена область длиной 85 т.п.н. X-хромосомы. Места контактов генов рРНК обнаружены в области протяженного интрона гена Tlk. Число чтений глубокого секвенирования данных 4C достигает нескольких тысяч. Мы анализировали контакты, используя исходные клетки S2 и клетки после теплового шока (37°С, 1 ч с последующей инкубацией при 27°С в течение 1 ч). Видно, что контакты генов рРНК приходятся на область длиной около 5 т.п.н. Приведены данные двух реплик, которые хорошо согласуются между собой. Места контактов генов рРНК в исходных клетках и в клетках, подвергнутых тепловому шоку, довольно похожи, хотя имеются и небольшие отличия. Общее число контактов генов рРНК после теплового шока заметно возрастает. Кроме того, появляются дополнительные контакты в области седьмого интрона и последнего экзона гена Tlk.
Рис. 1.
Физическая карта района длиной 85 т.п.н. Х-хромосомы Drosophila. melanogaster в браузере IGB (координаты по версии dm6). Вверху указаны места контактов этой области хромосомы с генами рРНК (браузер IGB). По оси Y указаны lg10 чисел картированных чтений глубокого секвенирования – 4C-рДНК, полученные как для исходных клеток S2, так и клеток, подвергнутых тепловому шоку (пики контактов генов рРНК выделены синим или красным соответственно). В каждом случае приведены данные по двум биологическим репликам. Ниже указаны гены, расположенные в этом сегменте хромосомы на обеих цепях ДНК (варианты генов не показаны). В нижней части рисунка представлены данные из браузера FlyBase. Указаны сайты экспрессии малых РНК, характеристики хроматиновых доменов (модель девяти состояний в клетках S2: красным показаны активные промоторы, зеленым – активно транскрибируемые экзоны, коричневым – активно транскрибируемые интроны), а также распределение гистоновых меток.
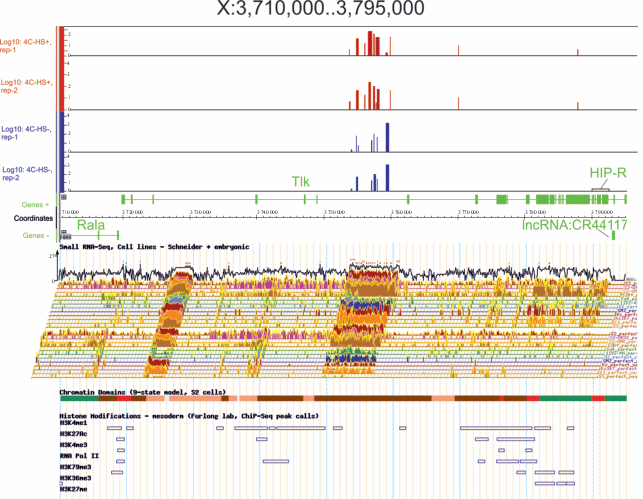
Область контактов генов рРНК приходится на активно транскрибируемый интрон (выделен коричневым на треке Chromatin Domains, модель девяти состояний) клеток S2. Модель создана на основании изучения профилей 18 модификаций гистонов. Внутри этого протяженного интрона контакты совпадают с областью, в которой картированы малые РНК длиной менее 30 н. (трек Small RNA-Seq). Большую часть этого района хромосомы (около 70 т.п.н.) занимает ген Tlk. Влияя на компоненты хроматина, этот ген участвует в морфогенезе, миграции клеток и апоптозе [5]. Рядом с геном Tlk, но на другой цепи ДНК, расположен ген Rala (Ras-like protein A). Расстояние между TSS этих генов составляет всего 372 н. На треке состояний хроматина красным показан общий активный промотор генов Tlk и Rala. За геном Tlk находится небольшой ген HIP-R (Hsp70-interacting protein related), который кодирует кошаперон, стабилизирующий конформацию белка Hsp70. Метки гистонов, обнаруженные в этом районе, свидетельствуют о том, что ген HIP-R транскрипционно активен.
Экспрессия гена Tlk усиливается после теплового шока
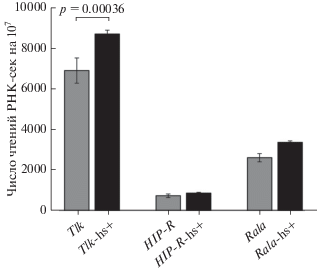
Поскольку контакты генов рРНК могут быть вовлечены в эпигенетическую регуляцию экспрессии генов в этом районе Х-хромосомы, мы оценили транскрипционную активность указанных генов. На рис. 2 показаны данные РНК-сек, полученные на исходных клетках S2, а также на клетках, подвергнутых тепловому шоку. Видно, что ген Tlk транскрибируется активнее, чем его соседи по этому отрезку хромосомы. Расстояния между генами небольшие, однако они экспрессируются по-разному. Ген Tlk более чем в 2 раза активнее гена Rala, хотя они имеют общий промотор. Расстояние между генами Tlk и HIP-R, расположенными на одной цепи ДНК, также не превышает 1 т.п.н., но уровень их транскрипция отличается на порядок. После теплового шока статистически значимо изменилась транскрипция только гена Tlk. Он экспрессируется немного активнее. Транскрипты гена некодирующей РНК CR44117 а наших экспериментах не обнаружены.
Рис. 2.
Уровни транскрипции трех генов в изучаемой области Х-хромосомы клеток S2 дрозофилы. Приведены результаты РНК-сек – по две биологических реплики для исходных клеток и клеток, подвергнутых тепловому шоку (hs+). В каждом случае указано число чтений, соответствующих данному гену, на 10 млн чтений РНК-сек.
Область контактов генов рРНК в гене Tlk и петлевые домены
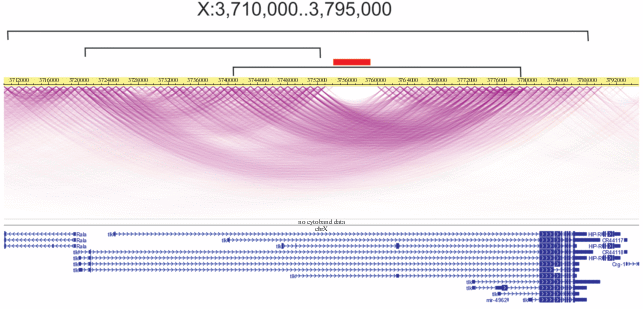
На рис. 3 показаны топологические петли внутри анализируемого района Х-хромосомы (браузер WashU Epigenome [4]). Видно, что ближайшие цис-взаимодействия в этом отрезке хромосомы в основном ограничены самим геном Tlk. При этом область контактов генов рРНК находится в центре, вокруг которого образуются основные петли хроматина. Такая пространственная организация этого района хромосомы подтверждает наш вывод об автономной регуляции гена Tlk. Она свидетельствует и о роли мест контактов генов рРНК в формировании петель хроматина. Интересно, что подобное расположение мест контактов генов рРНК относительно петель хроматина, а также связь таких мест с малыми РНК характерны и для многих других районов в хромосомах дрозофилы (данные будут опубликованы отдельно).
Рис. 3.
Цис-контакты внутри области Х-хромосомы дрозофилы, содержащей ген Tlk. Представлены данные Hi-C с разрешением в 1 т.п.н. (1 kb Hi-C) согласно браузеру WASHU EPIGENOME BROWSER для клеток Kc167 (http://epigenomegateway.wustl.edu) в геноме dm6. Квадратными скобками отмечены области наиболее частых контактов. Внизу показаны гены этой области, включая варианты гена Tlk разной длины. Область контактов генов рРНК (3.754‒3.759 т.п.н.) показана красным прямоугольником.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные убедительно свидетельствуют о существовании механизмов, которые строго избирательно, возможно индивидуально, регулируют близко расположенные гены, в результате чего активность соседствующих генов может отличаться в больших пределах. Эти данные позволяют считать, что наряду с механизмами, координирующими экспрессию генов в больших хромосомных доменах размером 50‒150 т.п.н. [6‒9], существуют пока непонятные механизмы локальной регуляции. Известно, что ген Tlk координирует клеточный цикл с помощью изменений хроматина, и активность гена изменяется в ходе каждого цикла [10]. Возможно, именно поэтому он и имеет собственную, отличную от окружающих его генов, локальную регуляцию.
Области контактов генов рРНК в гене Tlk соответствуют местам экспрессии малых РНК. Кроме того, эта область является центром, вокруг которого формируются самые частые внутрихромосомные контакты и образуются петлевые домены. По-видимому, образование этих петель хроматина и обусловливает независимую регуляцию гена Tlk. Поэтому мы предполагаем, что контакты генов рРНК играют важную роль в эпигенетической регуляции данного гена. Ранее обнаружили, что в хромосомах человека гены DUX4 и FANK1 образуют контакты с кластерами генов 45S рРНК и вызывают их сайленсинг [11, 12]. Ген Tlk активно транскрибируется, о чем свидетельствуют как данные об эпигенетических метках, так и результаты РНК-сек (рис. 1, рис. 2). После теплового шока число контактов генов рРНК в этом районе увеличивается, что коррелирует с усилением экспрессии гена Tlk в клетках S2. Это свидетельствует в пользу того, что контакты генов рРНК эпигенетически активируют ген Tlk. Механизм подобной активации не известен, однако есть основания считать, что малые РНК играют важную роль в направлении генов рРНК на соответствующие мишени в хромосомах. Кроме того, этот механизм связан с влиянием контактов генов рРНК на пространственные структуры хроматина.
Довольно давно Ананьев Е.В. и соавт. обнаружили, что ядрышки, в которых находятся активные гены рРНК, образуют многочисленные контакты с разными районами хромосом дрозофилы [1]. Чаще всего эти контакты приходятся на районы интеркалярного гетерохроматина. Ген Tlk расположен в районе 3F интеркалярного гетерохроматина политенных хромосомах дрозофилы. Одно из самых частых мест физических контактов ядрышек в Х-хромосоме находится в секции 3 [1]. Эти данные согласуются с нашими результатами.
Исследование выполнено при поддержке Российского фонда фундаментальных исследований (№18-04-00198). Статистический анализ выполнен при поддержке Российского научного фонда (№18-14-00122).
В работе не использованы биологические материалы, полученные от животных и человека.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Ananiev E.V., Barsky V.E., Ilyin Y.V., Churikov N.A. (1981) Localization of nucleoli in Drosophila melanogaster polytene chromosomes. Chromosoma. 81, 619–628.
Savić N., Bär D., Leone S., Frommel S.C., Weber F.A., Vollenweider E., Ferrari E., Ziegler U., Kaech A., Shakhova O., Cinelli P., Santoro R. (2014) lncRNA maturation to initiate heterochromatin formation in the nucleolus is required for exit from pluripotency in ESCs. Cell Stem Cell. 15, 720‒734. https://doi.org/10.1016/j.stem.2014.10.005
Tchurikov N.A., Fedoseeva D.M., Sosin D.V., Snezhkina A.V., Melnikova N.V., Kudryavtseva A.V., Kravatsky Y.V., Kretova O.V. (2015) Hot spots of DNA double-strand breaks and genomic contacts of human rDNA units are involved in epigenetic regulation. J. Mol. Cell. Biol. 7, 366‒382. https://doi.org/10.1093/jmcb/mju038
Zhou X., Maricque B., Xie M., Li D., Sundaram V., Martin E.A., Koebbe B.C., Nielsen C., Hirst M., Farnham P., Kuhn R.M., Zhu J., Smirnov I., Kent W.J., Haussler D., Madden P.A., Costello J.F., Wang T. (2011) The human epigenome browser at Washington University. Nat. Methods. 8, 989‒990. https://doi.org/10.1038/nmeth.1772
Swenson J.M., Colmenares S.U., Strom A.R., Cos-tes S.V., Karpen G.H. (2016). The composition and organization of Drosophila heterochromatin are heterogeneous and dynamic. eLife. 5, e16096.
Tchurikov N.A., Kretova O.V., Sosin D.V., Zykov I.A., Zhimulev I.F., Kravatsky Y.V. (2011) Genome-wide profiling of forum domains in Drosophila melanogaster. Nucl. Acids Res. 39, 3667‒3685. https://doi.org/10.1093/nar/gkq1353
Tchurikov N.A., Kretova O.V., Fedoseeva D.M., Sosin D.V., Grachev S.A., Serebraykova M.V., Romanenko S.A., Vorobieva N.V., Kravatsky Y.V. (2013) DNA double-strand breaks coupled with PARP1 and HNRNPA2B1 binding sites flank coordinately expressed domains in human chromosomes. PLoS Genet. 9(4), e1003429.
Tchurikov N.A., Krasnov A.N., Ponomarenko N.A., Golova Y.B., Chernov B.K. (1998) Forum domain in Drosophila melanogaster cut locus possesses looped domains inside. Nucl. Acids Res. 26, 3221‒3227.
Tolhuis B., de Wit E., Muijrers I., Teunissen H., Talhout W., van Steensel B., van Lohuizen M. (2006) Genome-wide profiling of PRC1 and PRC2 Polycomb chromatin binding in Drosophila melanogaster. Nat. Genet. 38, 694‒699.
Carrera P., Moshkin Y.M., Gronke S., Sillje H.H., Nigg E.A., Jackle H., Karch F. (2003) Tousled-like kinase functions with the chromatin assembly pathway regulating nuclear divisions. Genes Dev. 17(20), 2578‒2590.
Кретова О.В., Федосеева Д.М., Кравацкий Ю.В., Алембеков И.Р., Словохотов И.Ю., Чуриков Н.А. (2019) Гомеотические гены DUX4, контролирующие развитие эмбриона человека на стадии двух бластомеров, окружены областями, которые образуют контакты с кластерами генов pРНК. Молекуляр. биология. 53(2), 268‒273. https://doi.org/10.1134/S0026898419020083
Кретова О.В., Федосеева Д.М., Кравацкий Ю.В., Клушевская Е.С., Алембеков И.Р., Словохотов И.Ю., Чуриков Н.А. (2020) Область контактов кластеров генов рРНК с геном FANK1 соответствует неактивному хроматину. Молекуляр. биология. 54(2), 262–266.https://doi.org/10.31857/S002689842002007x
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


