Молекулярная биология, 2020, T. 54, № 3, стр. 450-456
Модификации неоднозначных оснований антикодона тРНК и устойчивость дрожжей к борной кислоте: в резистентных к бору делеционных мутантах активирован механизм общего контроля аминокислот и эффлюкс бора
İ. Uluisik a, b, H. Caglar Karakaya a, A. Koc a, c, *
a Department of Molecular Biology and Genetics, Izmir Institute of Technology
35430 İzmir, Turkey
b Department of Biomedical Engineering, Iskenderun Technical University
31200 Hatay, Turkey
c Department of Genetics, Inonu University School of Medicine
44280 Malatya, Turkey
* E-mail: ahmet.koc@inonu.edu.tr
Поступила в редакцию 19.09.2019
После доработки 19.10.2019
Принята к публикации 21.10.2019
Аннотация
Борная кислота необходима растениям и играет важную роль в жизни животных и микроорганизмов. Однако в высоких концентрациях она токсична для всех организмов. Ранее в коллекции делеционных мутантов дрожжей нами проведен поиск устойчивых и чувствительных к борной кислоте штаммов, чтобы идентифицировать гены, которые обеспечивают толерантность к бору. Теперь проанализирована способность устойчивых к бору мутантов: elp1∆, elp3∆, elp6∆, ncs2∆, ncs6∆ и kti12∆ ‒ модулировать систему общего аминокислотного контроля (GAAC) и индуцировать экспрессию гена ATR1, кодирующего эффлюксный насос бора. Проанализированные в работе мутанты не имеют генов, которые участвуют в синтезе неоднозначных оснований в антикодоне тРНК. Во всех устойчивых к бору мутантах повышена активность Gcn4-зависимого репортера и уровень транскрипта гена ATR1. Кроме того, при обработке борной кислотой устойчивые к бору клетки накапливали меньше борной кислоты в цитоплазме по сравнению с клетками дикого типа. Таким образом, полученные результаты указывают на то, что отсутствие модификаций неоднозначных оснований в тРНК приводит к активации системы GAAC и индукции экспрессии ATR1, что, в свою очередь, снижает внутриклеточное содержание бора и вызывает устойчивость к нему.
ВВЕДЕНИЕ
Уже около века бор (B) известен как необходимый металлоид для роста и развития растений [1]. Показано, что он играет важную роль в метаболизме и формировании структур клеток. Например, бор выполняет функцию сшивающего агента между волокнами пектинового рамногалактуронана II в клеточных стенках растений [2–4]. Однако молекулярные механизмы, лежащие в основе многих функций, выполняемых бором, неизвестны.
Недавно показано, что бор относится к важнейшим микроэлементам у широкого спектра организмов ‒ от бактерий до животных, ‒ хотя его необходимые уровни различаются у этих организмов [5–10]. Бор может быть токсичным, если присутствует в высоких концентрациях. Однако физиологическая основа этой токсичности до сих пор неясна. В этом отношении заслуживает внимания транспорт бора; и на сегодняшний день у растений и дрожжей выявлено много генов, участвующих в транспорте и устойчивости к бору. Ген BOR1 Arabidopsis thaliana был впервые идентифицирован как ген транспортера бора, а его гомологи обнаружены во многих организмах [11–14].
Дрожжи Saccharomyces cerevisiae широко используются в экспериментах по исследованию механизмов, которые вовлечены в ответ клеток на различные абиотические стрессы, включая металлы, такие как медь, железо и цинк. В ходе характеристики генов, обеспечивающих толерантность к бору у растений, исследователи использовали дрожжи в качестве модельной системы [15–19]. Дрожжевой белок Atr1 функционирует как канал, выкачивающий бор (эффлюксный насос бора), тем самым обеспечивая устойчивость клеток к нему [15]. При ответе на обработку борной кислотой экспрессию ATR1 и генов, связанных с биосинтезом аминокислот, регулирует фактор транскрипции Gcn4. Показано также, что бор активирует киназу Gcn2, что приводит к фосфорилированию eIF2α и затем к ингибированию синтеза белка [20]. Полногеномные скрининговые исследования на дрожжах позволили выявить новые гены, связанные с метаболизмом бора. В ходе скрининга библиотеки делеционных мутантов гаплоидных дрожжей идентифицировано 6 мутантов, устойчивых к бору [21]. Все обнаруженные мутанты: elp1∆, elp3∆, elp6∆, ncs2∆, ncs6∆ и kti12∆ ‒ были дефектны по модификации неоднозначных оснований в антикодоне тРНК.
В представленной работе охарактеризованы гены, делеция которых обеспечивает устойчивость дрожжей к бору, и проанализированы механизмы, лежащие в основе этой устойчивости. Обнаружено, что во всех устойчивых к бору мутантах конститутивно активирован путь общего аминокислотного контроля (GAAC) и экспрессия гена ATR1, вследствие чего в них снижена внутриклеточная концентрация бора и повышена устойчивость к его токсичным уровням.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рост дрожжей, питательные среды и трансформация. Saccharomyces cerevisiae дикого типа BY4741 (MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0; EUROSCARF) и его изогенные делеционные мутанты получены из библиотеки делеционных мутантов дрожжей. Клетки выращивали либо в YPD (2% глюкозы, 1% дрожжевого экстракта, 2% пептона и 2% агара для твердых сред), либо в YNB (азотистая основа дрожжевой питательной среды: 2% глюкозы, 0.67% дрожжевой азотистой основы без аминокислот и 2% агара) с добавками необходимых аминокислот и оснований. Дрожжи трансформировали, используя стандартный литий-ацетатный метод [22].
Анализ устойчивости к бору. В экспериментах использовали борную кислоту в качестве источника бора. Готовили чашки Петри с агаризованной средой YPD или YNB, содержащей различные концентрации борной кислоты. Ночные культуры разводили до оптической плотности 0.2 при 600 нм (OD600), а затем готовили серию разведений c OD600 0.02, 0.002 и 0.0002. Аликвоты по 5 мкл каждого разведения наносили на чашки Петри, инкубировали в течение 3 суток при 30°C и фотографировали.
Выделение РНК и ПЦР-анализ в реальном времени. Тотальную РНК выделяли из обработанных бором и необработанных образцов с использованием набора для выделения РНК (“Invitrogen”, США). Примесь геномной ДНК удаляли обработкой ДНКазой (“Fermentas”, Литва). Комплементарную ДНК (кДНК) синтезировали на матрице суммарной мРНК с использованием набора First Strand cDNA Synthesis Kit (“Fermentas”). кДНК использовали в качестве матрицы для амплификации фрагментов гена ATR1 длиной 186 п.н. и референсного гена размером 103 п.н. ПЦР в реальном времени проводили в трех параллелях в системе IQ5 Real-Time PCR System (“Bio-Rad”, США) с использованием смеси Fermentas MaximaTM SYBR Green qPCR Master (2×). ATR1 амплифицировали со следующими праймерами:
ATR1F (5'-ACGCGTATAGCATAGCCGCTT-TCA-3') и
ATR1B (5'-TGTAAGCCTGGTTCCAACCCGATA-3').
ACT1 амплифицировали с праймерами:
ACT1F (5'-ACGTTCCAGCCTTCTACGTTTCCA-3') и
ACT1B (5'-ACGTGAGTAACACCATCACCGGAA-3').
Условия ПЦР-амплификации были следующими: 40 циклов при 94°С в течение 30 с, 58°С в течение 30 с и 72°С в течение 30 с.
Молекулярное клонирование. В экспериментах по клонированию использовали систему клонирования Gateway (“Invitrogen”). Аллели дикого типа исследуемых генов амплифицировали с геномной ДНК дрожжей с использованием высокоточной ДНК-полимеразы (“Fermentas”). Амплифицированные фрагменты клонировали в вектор pDONR с использованием фермента BP ClonaseTM II (“Invitrogen”), полученные плазмиды использовали в реакции с клоназой LR. Реакция содержала очищенные входные плазмиды, экспрессионный вектор pAG426GPD и смесь ферментов LR ClonaseTM II (“Invitrogen”). Корректность полученных плазмид проверяли секвенированием, затем дрожжевые клетки трансформировали пустым вектором или плазмидой, экспрессирующей целевой ген, и отбирали колонии, прототрофные по урацилу.
Анализ активности β-галактозидазы. Клетки дикого типа и изогенные дрожжевые мутанты трансформировали плазмидой p180, несущей ген GCN4-lacZ [23]. Ночные культуры клеток дикого типа, выращенные в жидкой среде YNB без добавления урацила, разбавляли и после 2 ч инкубации культуры разделяли на две части: одну переносили в колбу с 20 мМ борной кислотой, а другую – в колбу без борной кислоты. Культуры растили до оптической плотности (OD600) от 0.2 до 0.6 в течение 3 ч в присутствии бора, отбирали 500 мкл и лизировали в 400 мкл Z-буфера (60 мМ Na2HPO4, 40 мМ NaH2PO4, 10 мМ KCl, 1 мМ MgSO4, 50 мМ β-меркаптоэтанол и 0.2% N-лаурилсаркозин). После 30 мин предварительной инкубации при 30°C в лизаты добавляли 150 мкл Z-буфера с 4 мг/мл о-нитрофенил-β-D-галактопиранозида (ONPG; “Sigma-Aldrich”, США) и инкубировали при 30°C в течение 30 мин. Реакцию останавливали добавлением 400 мкл 1.5 М Na2CO3 и полученную смесь центрифугировали в течение 1 мин. Супернатанты отбирали, измеряли их оптическую плотность при 420 нм (OD420) и нормировали на значения OD600 клеток.
Определение внутриклеточной концентрации бора. Мутантные клетки, устойчивые к бору, в экспоненциальной фазе роста обрабатывали 50 мМ борной кислотой в течение 1 ч и собирали центрифугированием, в контроле клетки ничем не обрабатывали. Клетки промывали дистиллированной водой и лизировали путем встряхивания со стеклянными шариками в буфере для лизиса: 2% Triton X-100, 1% SDS, 100 мМ NaCl, 10 мМ Tris-HCl (pH 7.6), 1 мМ EDTA. Лизаты осветляли центрифугированием и полученные супернатанты использовали для дальнейших исследований. Концентрацию бора в разбавленных клеточных экстрактах определяли с использованием Boron Cell Test Kit (“Merck”, Германия). Метод основан на изменении окраски реакционной смеси, что детектируют спектрофотометрически, и обладает высокой чувствительностью (0.05 мг бора/л). Полученные значения оптической плотности нормализовали по оптической плотности соответствующих культур клеток. Эксперимент повторяли три раза.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия генов, участвующих в образовании неоднозначных оснований, и толерантность к бору
Дрожжи дикого типа могут расти в присутствии 75 мМ борной кислоты [15, 16]. Мутанты с нарушенным образованием неоднозначных оснований в антикодоне тРНК: elp1∆, elp3∆, elp6∆, ncs2∆, ncs6∆ и kti12∆ ‒ способны выдерживать концентрации борной кислоты вплоть до 125 мМ (рис. 1а). С целью узнать, изменяется ли ответ клеток на бор при активации экспрессии этих генов, мы их клонировали в клетках дикого типа и создали условия для их избыточной экспрессии. Согласно полученным результатам (рис. 1б), сверхэкспрессия этих генов не изменяла ответ клеток на стресс, вызванный бором. Таким образом, делеция, а не активация этих генов необходима для толерантности дрожжей к бору.
Активность Gcn4 и экспрессия ATR1 в мутантных клетках
С целью понять механизмы, обеспечивающие устойчивость к бору в мутантных штаммах, мы оценили активность системы GAAC и экспрессию гена ATR1. Предполагается, что всего несколько генов обеспечивает толерантность дрожжей к бору, но их роль, за исключением ATR1, пока не выяснена. Экспрессию ATR1 регулирует транскрипционный фактор Gcn4 ‒ главный регулятор генов биосинтеза аминокислот [15, 20]. Известно, что нарушение образования неоднозначных оснований в антикодонах тРНК индуцирует трансляцию Gcn4 [24]. Учитывая эти данные, мы сосредоточились на определении статуса мутантов по экспрессии генов GCN4 и ATR1.
Сначала, используя кодируемый плазмидой репортерный белок Gcn4-LacZ [23], мы определили относительную активность Gcn4 в мутантных клетках в сравнение с клетками дикого типа (см. рис. 2а). Обнаружено, что по сравнению с клетками дикого типа активность Gcn4 во всех мутантах выше в 1.4‒3.6 раза. После обработки клеток мутантов борной кислотой активность Gcn4 еще больше повышалась. Таким образом, в мутантных штаммах с нарушением процесса образования неоднозначных оснований в тРНК повышена активность системы GAAC. Индукция экспрессии гена-экспортера бора ATR1 – это одно из проявлений активации системы GAAC. Фактически, транскрипционный фактор Gcn4 одновременно индуцирует экспрессию генов биосинтеза аминокислот и гена ATR1 [15].
Рис. 2.
Определение активности Gcn4, уровня мРНК ATR1 и внутриклеточной концентрации бора в дрожжевых штаммах. а – Штаммы дикого типа (WT) и устойчивые к бору мутанты трансформировали плазмидой, содержащий репортерный ген GCN4-lacZ. Культуры в логарифмической фазе роста обрабатывали 20 мМ борной кислоты (20 мМ) в течение 3 ч. В контроле обработку борной кислотой не проводили. Активность β-галактозидазы определяли, как описано в “Экспериментальной части”. б – Экспрессию гена ATR1 в штамме дикого типа и устойчивых к бору мутантах определяли с помощью ПЦР в реальном времени. Ген β-актина использовали в качестве референсного гена. в – Относительное внутриклеточное содержание бора в штаммах дикого типа и мутантах, обработанных 50 мМ борной кислоты в течение 1 ч. Данные представлены как средние значения ± SD, рассчитанные по результатам трех независимых экспериментов.
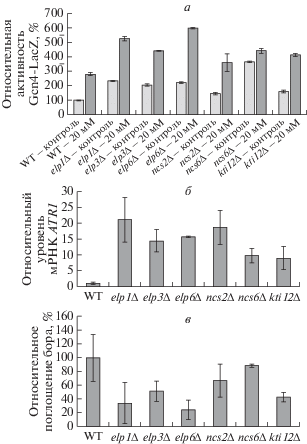
Далее определяли уровень экспрессии ATR1 в мутантах. Судя по полученным результатам, представленным на рис. 2б, в мутантных клетках уровень экспрессии ATR1 от 5 до 20 раз выше, чем в клетках дикого типа. Очевидно, что устойчивые к бору мутанты имели конститутивно высокую активность Gcn4 и экспрессию ATR1. Это может быть причиной толерантности мутантов к борной кислоте. Высокие уровни экспрессии ATR1 приводят к выбросу большего количества борной кислоты из клеток мутантов, что снижает внутриклеточное содержание бора в них. Действительно, внутриклеточные уровни бора в мутантах ниже, чем в клетках дикого типа (см. рис. 2в).
Сверхэкспрессия ATR1 с плазмиды приводит к дополнительному повышению резистентности мутантов к бору
С целью выяснить, можно ли еще больше повысить устойчивость к бору за счет дополнительной экспрессии гена ATR1 в резистентных к бору мутантах, клетки трансформировали высококопийной по гену ATR1 плазмидой. Согласно полученным результатам (рис. 3), мутанты elp3Δ и ncs6Δ, сверхэкспрессирующие ATR1, были толерантны к борной кислоте в концентрации 350 мМ, в то время как чувствительность к борной кислоте у других трансформантов была сходна со штаммом дикого типа.
Мутанты с нарушенным биогенезом неоднозначных оснований тРНК не проявляют осмотолерантности
Предполагается, что ответ клеток на высокое осмотическое давление путем синтеза глицерина (HOG pathway) вовлечен в реакцию дрожжей на борную кислоту [25]. С целью выяснить, проявляют ли мутанты повышенную устойчивость к соли и сорбитолу, штаммы растили на чашках Петри с агаром, содержащим различные концентрации соли (NaCl) или сорбитола. В результате между мутантами и клетками дикого типа не обнаружено никаких различий в отношении толерантности к соли и сорбитолу (рис. 4). На основании полученных данных можно предполагать, что боррезистентный фенотип мутантов обусловлен не общей реакцией клеток на стресс, а скорее специфичным ответом на бор.
Рис. 4.
Анализ ответа на осмотический стресс резистентных к бору мутантов дрожжей. Штаммы дикого типа (WT) и мутанты растили до логарифмической фазы роста, делали серию разведений до оптической плотности 0.2, 0.02, 0.002 и 0.0002 при длине волны 600 нм. По 5 мкл каждого разведения наслаивали на твердую питательную среду YPD, содержащую указанное количество хлорида натрия (а) или сорбитола (б). Чашки Петри инкубировали при 30°C в течение 3 суток и затем фотографировали.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами показано, что фактор транскрипции Gcn4 и эффлюксный насос бора Atr1 активированы в дрожжевых мутантах с делецией генов, участвующих в синтезе неоднозначных оснований тРНК. Транспортные РНК относятся к ключевым компонентам системы биосинтеза белка и претерпевают множество посттранскрипционных модификаций. Гипомодификация неоднозначных оснований, по-видимому, очень важна в регуляции трансляции. В частности U34, считывающий третью позицию в кодонах, часто подвергается модификациям, которые модулируют спаривание неоднозначных оснований и способствуют эффективному распознаванию кодонов. Многие тРНК дрожжей модифицированы по U34, и в этот процесс вовлечено более двух десятков генов, включая комплекс элонгаторов (Elp1–Elp6), гены устойчивости к киллер-токсину (Kti11–Kti14) и уридинтиолирующие лигазы (Ncs2 и Ncs4) [26, 27]. Все мутанты, охарактеризованные нами в этой работе, связаны с модификациями U34, а, по литературным данным, их отсутствие приводит к формированию различных фенотипов ответа на различные виды стресса [28, 29]. При некоторых обстоятельствах отсутствие модификаций тРНК может быть полезным для клеток: например, недостаточное тиолирование неоднозначных оснований придает клеткам устойчивость к стрессу эндоплазматического ретикулума [30]. Теперь нами показано, что отсутствие модификаций U34 обеспечивает устойчивость к бору.
На основании полученных нами результатов и данных литературы можно сделать вывод, что изменения в паттерне модификаций тРНК по U34 опосредуют клеточный ответ на различные виды стресса. Достаточно хорошо известно, что происходит с машинерией синтеза белка в отсутствие модификаций тРНК: замедление трансляции, перекодирование и синтез неправильных белков [27]. Однако в большинстве случаев неясно, как модификации тРНК регулируют реакцию на стресс.
Механизм толерантности к бору у мутантов elp1∆, elp3∆, elp6∆, ncs2∆, ncs6∆ и kti12∆ можно объяснить индукцией биосинтеза эффлюксного насоса бора Atr1 через фактор транскрипции Gcn4. Возможно участие и других механизмов. Например, тРНК в этих мутантах может ускользать от расщепления. Как часть ответа на стресс, тРНК подвергается гидролизу специфичными нуклеазами. Так, при аминокислотном голодании в Tetrahymena thermophila и Aspergillus fumigatus происходит расщепление тРНК [31, 32]. Окислительный стресс в Saccharomyces cerevisiae также приводит к расщеплению тРНК в антикодоновой петле [33, 34]. Механизмы и функциональная значимость расщепления тРНК в различных стрессовых условиях пока не ясны, но не исключено, что этот процесс играет регуляторную роль при ответе клеток на стресс.
Работа выполнена при финансовой поддержке Turkish Scientific and Research Council (TÜBİTAK; грант 110T917 для Ahmet Koc).
Статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Warington K. (1923) The effect of boric acid and borax on the broad bean and certain other plants. Ann. Bot. 37, 629–672.
Goldbach H.E., Wimmer M.A. (2007) Boron in plants and animals: ıs there a role beyond cell-wall structure? J. Plant Nutr. Soil Sci.‒Z. Pflanzenernaehr. Bodenkd. 170, 39–48. https://doi.org/10.1002/jpln.200625161
Kobayashi M., Matoh T., Azuma J. (1996) Two chains of rhamnogalacturonan II are cross-linked by borate-diol ester bonds in higher plant cell walls. Plant Physiol. 110, 1017–1020.
O’Neill M.A., Ishii T., Albersheim P., Darvill A.G. (2004) Rhamnogalacturonan II: structure and function of a borate cross-linked cell wall pectic polysaccharide. Annu. Rev. Plant Biol. 55, 109–139.
Ahmed I., Yokota A., Fujiwara T. (2007) A novel highly boron tolerant bacterium, Bacillus boroniphilus sp. nov., isolated from soil, that requires boron for its growth. Extremophiles. 11(2), 217–224.
Anderson G.R., Jordan J.V. (1961) Boron: a non-essential growth factor for Azotobacter chroococcum. Soil Sci. 92, 113–116.
Bolanos L., Lukaszewski K., Bonilla I., Blevins D. (2004) Why boron? Plant Physiol. Biochem. 42, 907–912.
Cui Y., Winton M.I., Zhang Z.F., Rainey C., Marshall J., De Kernion J.B., Eckhert C.D. (2004) Dietary boron intake and prostate cancer risk. Oncol. Rep. 11, 887–892.
Mahabir S., Spitz M.R., Barrera S.L., Dong Y.Q., Eastham C., Forman M.R. (2008) Dietary boron and hormone replacement therapy as risk factors for lung cancer in women. Am. J. Epidemiol. 167, 1070–1080.
Rowe R.I., Eckhert C.D. (1999) Boron is required for zebrafish embryogenesis. J. Exp. Biol. 202, 1649–1654.
Miwa K., Takano J., Omori H., Seki M., Shinozaki K., Fujiwara T. (2007) Plants tolerant of high boron levels. Science. 318, 1417–1417.
Nakagawa Y., Hanaoka H., Kobayashi M., Miyoshi K., Miwa K., Fujiwara T. (2007) Cell-type specificity of the expression of os BOR1, a rice efflux boron transporter gene, is regulated in response to boron availability for efficient boron uptake and xylem loading. Plant Cell. 19, 2624–2635.
Park M., Li Q., Shcheynikov N., Zeng W.Z., Muallem S. (2004) NaBC1 is a ubiquitous electrogenic Na+-coupled borate transporter essential for cellular boron homeostasis and cell growth and proliferation. Mol. Cell. 16, 331–341.
Takano J., Noguchi K., Yasumori M., Kobayashi M., Gajdos Z., Miwa K., Hayashi H., Yoneyama T., Fujiwara T. (2002) Arabidopsis boron transporter for xylem loading. Nature. 420, 337–340.
Kaya A., Karakaya H.C., Fomenko D.E., Gladyshev V.N., Koc A. (2009) Identification of a novel system for boron transport: Atr1 is a main boron exporter in yeast. Mol. Cell. Biol. 29, 3665–3674.
Nozawa A., Takano J., Kobayashi M., von Wiren N., Fujiwara T. (2006) Roles of BOR1, DUR3, and FPS1 in boron transport and tolerance in Saccharomyces cerevisiae. FEMS Microbiol. Lett. 262, 216–222.
Sutton T., Baumann U., Hayes J., Collins N.C., Shi B.J., Schnurbusch T., Hay A., Mayo G., Pallotta M., Tester M., Langridge P. (2007) Boron-toxicity tolerance in barley arising from efflux transporter amplification. Science. 318, 1446–1449.
Takano J., Kobayashi M., Noda Y., Fujiwara T. (2007) Saccharomyces cerevisiae Bor1p is a boron exporter and a key determinant of boron tolerance. FEMS Microbiol. Lett. 267, 230–235.
Takano J., Wada M., Ludewig U., Schaaf G., von Wiren N., Fujiwara T. (2006) The Arabidopsis major intrinsic protein NIP5;1 is essential for efficient boron uptake and plant development under boron limitation. Plant Cell. 18, 1498–1509.
Uluisik I., Kaya A., Fomenko D.E., Karakaya H.C., Carlson B.A., Gladyshev V.N., Koc A. (2011) Boron stress activates the general amino acid control mechanism and ınhibits protein synthesis. PLoS One. 6(11), e27772. https://doi.org/10.1371/journal.pone.0027772
Uluisik I., Kaya A., Unlu E.S., Avsar K., Karakaya H.C., Yalcin T., Koc A. (2011) Genome-wide identification of genes that play a role in boron stress response in yeast. Genomics. 97, 106–111.
Gietz R.D., Schiestl R.H. (1995) Transforming yeast with DNA. Methods Mol. Cell. Biol. 5, 255–269.
Hinnebusch A.G. (1985) A hierarchy of trans-acting factors modulates translation of an activator of amino acid biosynthetic genes in Saccharomyces cerevisiae. Mol. Cell. Biol. 5, 2349–2360.
Qiu H., Hu C., Anderson J., Bjök G.R., Sarkar S., Hopper A.K., Hinnebusch A.G. (2000) Defects in tRNA processing and nuclear export ınduce GCN4 translation ındependently of phosphorylation of the alpha subunit of eukaryotic translation ınitiation factor 2. Mol. Cell. Biol. 20, 2505–2516.
Schmidt M., Akasaka K., Messerly J.T., Boyer M.P. (2012) Role of Hog1, Tps1 and Sod1 in boric acid tole-rance of Saccharomyces cerevisiae. Microbiology. 158, 2667–2678.
Huang B., Johansson M.J.O., Bystrom A.S. (2005) An early step in wobble uridine tRNA modification requires the elongator complex. RNA. 11, 424–436.
Ranjan N., Rodnina M.V. (2016) tRNA wobble modifications and protein homeostasis. Translation. 4, e1143076.
Chan C.T., Pang Y.L., Deng W., Babu I.R., Dyavaiah M., Begley T.J., Dedon P.C. (2012) Reprogramming of tRNA modifications controls the oxidative stress response by codon-biased translation of proteins. Nat. Commun. 3, 937.
Chan C.T., Dyavaiah M., DeMott M.S., Taghizadeh K., Dedon P.C., Begley T.J. (2010) A quantitative systems approach reveals dynamic control of tRNA modifications during cellular stress. PLoS Genet. 6, e1001247.
Damon J.R., Pincus D., Ploegh H.L. (2014) tRNA thiolation links translation to stress responses in Saccharomyces cerevisiae. Mol. Biol. Cell. 26, 270–282.
Jöchl C., Rederstorff M., Hertel J., Stadler P.F., Hofacker I.L., Schrettl M., Haas H., Hüttenhofer A. (2008) Small ncRNA transcriptome analysis from Aspergillus fumigatus suggests a novel mechanism for regulation of protein synthesis. Nucleic Acids Res. 36, 2677–2689.
Lee S.R., Collins K. (2005) Starvation-induced clea-vage of the tRNA anticodon loop in Tetrahymena thermophila. J. Biol. Chem. 280, 42744–42749.
Thompson D.M., Lu C., Green P.J., Parker R. (2008) tRNA cleavage is a conserved response to oxidative stress in eukaryotes. RNA. 14, 2095–2103.
Thompson D.M., Parker R. (2009) The RNase Rny1p cleaves tRNAs and promotes cell death during oxidative stress in Saccharomyces cerevisiae. J. Cell Biol. 185, 43–50.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология




