Молекулярная биология, 2020, T. 54, № 4, стр. 680-687
Клонирование, экспрессия и характеристика новой лакказы из природного штамма Bacillus subtilis OH67
O. Hajipour a, *, N. Mercan Dogan a, S. Dincer b, M. Norizadehazehkand c
a Department of Biology, Faculty of Science and Arts, Pamukkale University
20160 Denizli, Turkey
b Department of Biology, Faculty of Science, Çukurova University
01330 Adana, Turkey
c Department of Pharmaceutical Biotechnology, ZBEU University
67600 Zonguldak, Turkey
* E-mail: orkideh.hajipoor88@yahoo.com
Поступила в редакцию 09.12.2019
После доработки 12.02.2020
Принята к публикации 12.02.2020
Аннотация
Бактериальные лакказы сохраняют стабильность при высокой температуре и высоких значениях pH и имеют множество приложений в биотехнологии и промышленности. В этой статье описано клонирование, гетерологичная экспрессия и очистка лакказы из Bacillus subtilis АА. Молекулярная масса фермента, определенная при помощи электрофореза в SDS-ПАГ, составила 34 кДа. Активность рекомбинантного фермента подтверждена по способности окислять гваякол. Значения KM и Vmax фермента составили, соответственно, 1.1077 мМ и 19.3 мкмоль/мин/мг. Рекомбинантная лакказа эффективно обесцвечивала красители Turquoise blue HF6, Remazol red 106, Remazol brilliant orange 3R и Brilliant blue, то есть обладает свойствами, необходимыми для возможного применения в текстильной и природоохранной отраслях.
ВВЕДЕНИЕ
Лакказа ‒ фермент, который содержит несколько атомов меди и катализирует окисление широкого спектра фенольных и нефенольных ароматических соединений, а также восстанавливает молекулярный кислород [1, 2]. Обычно число атомов меди в активном центре фермента равно четырем, они образуют по одному центру типа I (“голубая” медь) и типа II и два центра типа III [3]. Благодаря широкому спектру молекул, служащих субстратами лакказы, этот фермент уже широко применяется в промышленности и биотехнологии, например, при отбеливании бумаги и целлюлозы, в процессах биодеградации (биоремедиации), для обесцвечивания текстильных красителей и в качестве биосенсоров [4–7]. Кроме того, показано, что лакказа ингибирует пролиферацию клеточной линии гепатокарциномы HuH7 [8–11].
Лакказы широко распространены у грибов, растений и бактерий, включая Anoxybacillus sp., Stenotrophomonas maltophilia, Pantoea ananatis и B. subtilis [12–14]. Грибные лакказы, которые чаще всего используют в промышленных процессах, нестабильны при высоких температурах и в щелочных условиях, что ограничивает их практическое применение для очистки сточных вод [15]. Напротив, большинство бактериальных лакказ термически стабильны, в меньшей степени зависимы от ионов металлов, менее восприимчивы к ингибирующим агентам и активны в нейтральных или щелочных условиях [16].
Термостабильные бактериальные лакказы CotA в изобилии представлены во внешнем слое клеточной стенки B. subtilis, их присутствие необходимо для устойчивости спор к перекиси водорода и ультрафиолетовому излучению [17]. Кроме того, CotA участвует в метаболизме коричневого пигмента спор меланина [18]. Ранее показано, что бактериальные и грибные лакказы могут приводить к обесцвечиванию и деградации синтетических красителей [19, 20]. Так, бактериальная лакказа из морского микробного метагенома обесцвечивает два вида антрахинонов и четыре вида азокрасителей [21]. Похожим образом лакказы из Collybia dryophila и Stropharia rugosoannulata, как и почвенные изоляты, оказались способны обесцвечивать различные красители [22]. Споровая лакказа, которая эффективно обесцвечивает различные синтетические красители в нейтральных или щелочных условиях, может быть применена в ряде промышленных отраслей.
В статье приведены методики клонирования гена лакказы B. subtilis в клетках Escherichia coli BL21DE3, экспрессии и очистки фермента для дальнейшей характеристики. Показано, что рекомбинантная лакказа обесцвечивает красители Turquoise blue HF6, Remazol red 106, Remazol brilliant orange 3R и Brilliant blue.
ЭКПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использованы гваякол, сирингальдазин (SGZ) и катехол производства “Sigma Aldrich” (США); набор для выделения бактериальной ДНК, набор для выделения ДНК из геля, Taq ДНК-полимераза, вектор pETb22 и изопропил-β-D-тиогалактозид (IPTG) производства “Novagen” (США); ДНК-полимераза DreamTaq™ Hot Start производства “Thermo Fisher Scientific” (США). Красители Turquoise blue HF6, Remazol red 106, Remazol brilliant orange 3R и Brilliant blue были получены от компании “Dystar Textile Co.” (Турция).
Выделение и идентификация штамма-продуцента лакказы. Бактериальный штамм-продуцент лакказы был выделен из образцов почвы, взятых в Стамбуле (Турция). Для этой цели, природные бактериальные штаммы культивировали на LB-агаре, содержащем сирингальдазин или катехол. Развитие черного, коричневого или розового цвета считалось признаком положительной колонии [23, 24]. После биохимического и морфологического анализа штамм, который продуцировал высокие уровни лакказы, был идентифицирован секвенированием 16S рДНК в компании “Iontek” (Турция). Последовательность 16S рДНК анализировали в программах NCBI-Blast и clustal W, после чего строили филогенетическое дерево в программе Mega7. Кроме того, бактерии идентифицировали при помощи биохимических и морфологических тестов. В результате исследования выявлено, что бактериальные клетки имеют палочковидную форму, формируют споры, грамположительные, несут жгутик, положительные по каталазной реакции, оксидазной реакции, нитратредуктазной реакции, цитрату, инозитолу, крахмалу и негативные по индолу, метиловому красному и уреазе.
Клонирование, экспрессия и очистка лакказы. Последовательности прямого праймера 5'-ATACAT CCATGGATACATATCACCCATTCA GTCTTACCA-3', содержащего последовательность сайта NcoI, и обратного праймера 5'-ATTTTTAAGCTTTCAGTGGTGGTGGTGGTGGTGTGCCTCCTCATTCCGATAAAGGAC-3', содержащего последовательности сайта рестрикции HindIII, His6-tag и стоп-кодон, были подобраны с использованием программы Oligo 7. Фрагмент, кодирующий лакказу, амплифицировали с геномной ДНК с использованием ПЦР. Реакционная смесь объемом 25 мкл содержала 0.125 мкл ДНК-полимеразы DreamTaq Hot Start, 2.5 мкл 10× ПЦР-буфера, 2 мкл смеси dNTPs (10 мМ), 5 мкл ДНК-матрицы (50 мкг/мл), 2 мкл прямого праймера (10 мкМ), 2 мкл обратного праймера (10 мкМ) и 11.375 мкл деионизованной воды. Условия реакции были следующими: начальная денатурация при 94°C в течение 5 мин, денатурация при 94°C 50 с, отжиг праймеров при 54°C 50 с, элонгация при 72°C 55 с и финальная достройка 72°C 5 мин. Продукты ПЦР и вектор pET22b обрабатывали ферментами рестрикции NcoI и HindIII и лигировали с использованием T4 ДНК-лигазы. Полученным рекомбинантным вектором pET-lac трансформировали компетентные клетки штамма Escherichia coli BL21DE3 при помощи теплового шока. Клоны, содержащие вектор pET-lac, отбирали на LB-агаре с ампициллином и методом ПЦР с колоний. Выбранные колонии переносили в жидкую среду LB с ампициллином и инкубировали при 37°C с покачиванием при 200 об./мин. Фазу роста культуры определяли путем измерения оптической плотности при 600 нм (OD600). Когда значение OD600 культуры достигало 2, в ростовую среду добавляли IPTG (0.1 мМ), чтобы индуцировать экспрессию лакказы. Бактериальную культуру инкубировали при 30°C с непрерывным покачиванием при 150 об./мин в течение 4 ч и затем при 25°C без покачивания в течение 16 ч. Клетки осаждали на 4000 об./мин в течение 15 мин, супернатант удаляли. Осадок клеток ресуспендировали в растворе, содержащем 50 мМ фосфата натрия (pH 8.0) и 0.3 M хлорида натрия. Клетки озвучивали при 10 кГц по 20 с с 30-секундными интервалами, центрифугировали при 15 000 × g в течение 15 мин и отбирали супернатант для последующей очистки фермента. Очистку проводили с использованием HIS-Select® HF Nickel Affinity Gel [25]. Уровни экспрессии рекомбинантной лакказы оценивали электрофорезом в денатурирующем полиакриламидном геле (SDS-PAGE) [26]. Молекулярную массу полученного белка определяли по стандартным маркерам молекулярных масс.
Исследование ферментативной активности. Активность выделенной лакказы определяли с использованием гваякола (2 мМ) в качестве субстрата в присутствии 0.5 мМ CuSO4 в 0.1 М буфере Tris-HCl (pH 7.50) при 37°C. Окисление гваякола детектировали спектрофотометрически по поглощению при 465 нм (ε = 21.600 M/см). Единицу активности (U) определяли как количество фермента, окисляющего 1 мкмоль гваякола в 1 мл реакционной смеси за 1 мин, и рассчитывали по уравнению:
Кроме того, мы исследовали зависимость ферментативной активности лакказы от концентрации субстрата (13.75, 27.5, 55, 110, 220, 440 и 880 мкМ). Константу Михаэлиса‒Ментен (KM) и максимальную скорость реакции (Vmax) рассчитывали по графику в координатах Лайнуивера‒Берка [27, 28].
Электрофорез в полиакриламидном геле и зимография рекомбинантной лакказы. Молекулярную массу выделенных белков определяли методом SDS-PAGE с 5%-ным концентрирующим гелем и 10%-ным разделяющим. После электрофореза гель окрашивали в Coomasie Brillant Blue R-250 и отмывали смесью метанола, уксусной кислоты и воды. Зимографию проводили методом нативного электрофореза в полиакриламидном геле с окрашиванием в растворе 5 мМ гваякола в 10 мМ ацетате натрия (pH 5.6) при комнатной температуре [29].
Влияние pH на активность и стабильность рекомбинантной лакказы. Ферментативную активность лакказы определяли при различных значениях pH: в 0.1 M цитратном буфере (pH 3.4–5.4), 0.1 M фосфатном буфере (pH 5.8–8.0) и 0.1 M бикарбонат-карбонатном буфере (pH 8.4–10.7).
Влияние pH на стабильность рекомбинантной лакказы исследовали, инкубируя фермент в различных буферных растворах (pH 3.4–10.7) при комнатной температуре в течение 3 ч. Остаточную ферментативную активность измеряли при оптимальном значении pH при 37°C в течение 1 ч [30].
Влияние температуры на активность и стабильность рекомбинантной лакказы. Влияние температуры на активность рекомбинантной лакказы исследовали, измеряя активность фермента в диапазоне температур от 4 до 100°C. Для исследования термостабильности фермент инкубировали при различных температурах (4–100°C) в течение 1 ч. Остаточную ферментативную активность измеряли при оптимальной температуре в течение 1 ч.
Окисление текстильных красителей под действием рекомбинантной лакказы. Способность очищенной лакказы обесцвечивать красители оценивали с использованием четырех промышленных текстильных красителей, включая Turquoise blue HF6 (λmax = = 613 нм), Remazol red 106 (λmax = 590 нм), Remazol brilliant orange 3R (λmax = 629 нм) и Brilliant blue (λmax = 629 нм). Активность лакказы по отношению к красителям определяли в 0.1 M цитрат-фосфатном буфере (pH 6.0) с добавлением красителя (25 м.д.) и CuSO4 (0.1 мМ) и очищенной лакказы (100 ЕА). Смесь инкубировали в течение 6 ч при 50°C при перемешивании со скоростью 40 об./мин. Контролем служила смесь без лакказы. Степень обесцвечивания для каждого красителя определяли спектрофотометрически при соответствующей оптической плотности.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Выделение и идентификация штамма-продуцента лакказы
В результате микроскопического и биохимического анализов показано, что природный штамм, продуцирующий лакказу на высоком уровне, относится к виду Bacillus subtilis. Биоинформатический анализ выявил сходство последовательности гена 16S рРНК изолированного штамма с геном B. subtilis на 98.88%. Как можно видеть на рис. 1, филогенетическое дерево, построенное в программе MEGA7, подтверждает результаты анализа. Последовательность гена 16S рРНК выделенного штамма, Bacillus subtilis OH67, зарегистрирована в базе данных NCBI под идентификационным номером MK659939.1.
Клонирование рекомбинантной лакказы из штамма B. subtilis OH67
Ген лакказы был амплифицирован с ДНК выделенного штамма с использованием подобранных генспецифичных праймеров. Размер ПЦР-продукта составил около 850 п.н. Ген лакказы клонировали в экспрессионный вектор pET22b в компетентных клетках E. coli штамма BL21(DE3). Клетки, содержащие вектор со вставкой гена лакказы, отбирали на среде с ампициллином при помощи ПЦР с колоний. После секвенирования новая последовательность гена, кодирующего лакказу, была загружена в базу данных NCBI под идентификационным номером MK685357 и проанализирована при помощи биоинформатических инструментов. Анализ показал сходство гена лакказы на 99% с аналогичными последовательностями других штаммов B. subtilis, представленными в базах данных NCBI. Последовательность клонированного гена лакказы была зарегистрирована в GenBank под номером MK685357.1.
Электрофоретический анализ и зимография фермента
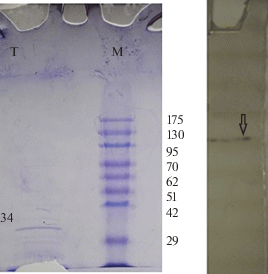
На основании электрофоретической подвижности в денатурирующем полиакриламидном геле молекулярная масса фермента составляет 34 кДа. Кроме того, по результатам зимографии выявлено наличие ферментативной активности в отношении гваякола в области нативного геля, соответствующей белку этой молекулярной массы (рис. 2).
Рис. 2.
Электрофоретический и зимографический анализ лакказы. На левом геле (SDS-PAGE) на дорожку М нанесен маркер молекулярных масс, на дорожку Т ‒ препарат очищенного фермента; на фрагменте геля справа (нативный PAGE) отображен результат зимографии очищенного фермента (стрелкой указана полоса, соответствующая Mr лакказы, с ферментативной активностью в отношении гваякола).
Оценка ферментативной активности лакказы
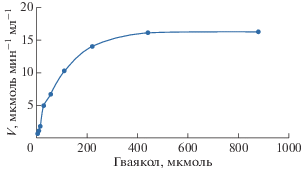
Окислительную активность ферментов из семейства лакказ можно детектировать по развитию оранжевой окраски в реакционной смеси, содержащей субстрат фермента гваякол. Как видно из рис. 3, рекомбинантная лакказа подчиняется кинетике Михаэлиса‒Ментен. Значения KМ и Vmax, вычисленные при помощи графика Лайнуивера‒Берка, составили соответственно 1.1077 мМ и 19.30 мкмоль/мин/мг (рис. 3).
Влияние температуры и pH на активность и стабильность рекомбинантной лакказы
В процессе исследования выявлено, что рекомбинантная лакказа из B. subtilis окисляет гваякол как в кислых, так и в щелочных условиях, то есть активна в широком диапазоне значений pH. Оптимальное значение pH, при котором лакказная активность максимальна, соответствовало 6.6 (рис. 4а). После предварительной инкубации лакказы в течение 3 ч при pH 3.0, 3.8, 4.6, 5.4, 6.0, 6.6, 7.0, 7.6, 8.0, 8.8, 9.4, 10.0 и 10.4 лакказная активность (при рН 6.6) составляла 21, 53, 77, 83, 99, 100, 98, 90, 52, 21, 14, 12 и 9% от начальной (рис. 4б).
Рис. 4.
Влияние различных факторов на ферментативную активность лакказы: рН-зависимость (а), рН-стабильность (б), температурная зависимость (в), термостабильность (г).
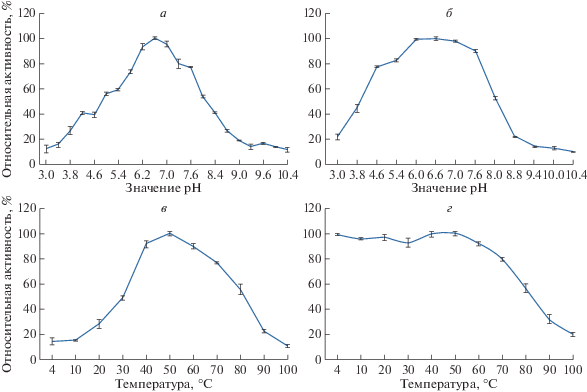
Обнаружено, что рекомбинантная лакказа окисляет гваякол в температурном диапазоне от 20 до 100°C. Температурный оптимум ферментативной активности зарегистрирован при 50°C (рис. 4в). После предварительной инкубации лакказы в течение 1 ч в температурном диапазоне от 10°C до 100°C (с интервалами в 10°C) остаточная активность (при 50°C) составляла: 95, 96, 92, 99, 100, 91, 79, 56, 32 и 20% соответственно (рис. 4г).
Максимум лакказной активности регистрировали при pH 6.6, при повышении pH активность снижалась и при pH 10 составляла только 13% от максимальной. При исследовании рН-стабильности выявлено, что при инкубации лакказы в течение 3 ч в диапазоне pH 6‒7 ее активность полностью сохраняется, а при pH > 7.6 ферментативная активность снижалась. Температурный оптимум для лакказной активности зарегистрирован при 50°C, при 80°C активность снижалась вдвое, а при 4°C составляла только 13.95% от максимальной. Фермент сохранял активность после предварительной инкубации в диапазоне температур от 4 до 50°C.
Обесцвечивании текстильных красителей под действием лакказы
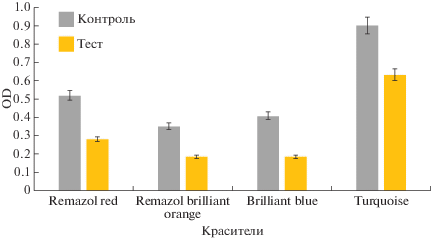
Нами проанализирована способность рекомбинантной лакказы обесцвечивать красители, ориентированные на текстильную промышленность: Turquoise blue HF6, Remazol red 106, Remazol brilliant orange 3R и Brilliant blue. Эффективность обесцвечивания различных материалов составила соответственно 30.00, 46.16, 47.15, 54.9% (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Лакказы имеют широкий спектр применения в различных биотехнологических и промышленных приложениях. Лакказы можно обнаружить в растениях, насекомых, грибах и бактериях. В противоположность грибам и растениям, бактерии имеют такие преимущества как быстрое время удвоения, постоянные условия продукции фермента, легкость экстракции и очистки ферментов, а также стабильность ферментов в жестких условиях. Бактериальные лакказы очень активны и гораздо более стабильны при высоких температурах и высоких значениях pH. В настоящее время больше внимания уделяется бактериальным лакказам с целью получения новых биокатализаторов с потенциалом применения в промышленности.
Вектор pET22b содержит N-концевую лидерную последовательность пектатлиазы B (PelB), состоящую из 22 а.о., массой почти 2.2 кДа, которая направляет белки в периплазматическое пространство клетки-хозяина по Sec-пути. N-концевая аминокислотная последовательность PelB следующая: MKYLLPTAEAGLLLLLAAPQIA. Кроме того, вектор содержит ген устойчивости к ампициллину, который индуцирует устойчивость к ампициллину клетки-хозяина.
Штамм B. subtilis выделен нами из загрязненной нефтью почвы, взятой в районе Стамбула (Турция). Для отбора бактериальных штаммов с лакказной активностью был использован метод, ранее описанный Xiao и др. [31].
Сирингальдазин, гваякол и катехол исследованы нами в качестве субстратов лакказ. Выделение штамма B. subtilis и клонирование гена cotA, кодирующего целевой фермент, повышает доступность рекомбинантной лакказы с биотехнологическим потенциалом [25]. Мы проанализировали последовательность гена клонированной лакказы и сравнили ее с другими аналогичными последовательностями из базы NCBI GenBank. Степень идентичности последовательности клонированной лакказы по отношению к другим лакказам, присутствующим в этой базе данных, составила 99%. Молекулярная масса фермента, определенная по электрофоретической подвижности в SDS-PAG, составила 34 кДа. Фермент состоит из 306 а.о., куда входит последовательность PelB (22 а.о.) с N-конца и 6 остатков His (His6-tag) с С-конца. Ранее Nguyen с соавт. [32] сообщали, что масса лакказы составляет 27.7 кДа.
По результатам сравнения значений Vmax и KМ для лакказ из разных организмов можно говорить о том, что их субстратная специфичность сильно разнится [33]. Мы можем сравнить результаты проведенного нами исследования с другими работами, в которых использовали гваякол в качестве субстрата. По графику Лайнуивера‒Берка рассчитанные значения KМ и Vmax для рекомбинантной лакказы составили 1.1077 мМ и 19.30 мкмоль/мин/мг соответственно. Опубликованные Ademakinwa и др. [34] значения KМ и Vmax для очищенной лакказы из Aureobasidium pullulans на этом же субстрате составили 1.05 мМ и 12.67 мкмоль/мл/мин соответственно. Таким образом, для полученного нами фермента значение Vmax выше, чем для лакказы из Aureobasidium pullulans, хотя значения KМ практически одинаковы. По данным Chaudhary и др. [35], величины KМ и Vmax для очищенной лакказы из Ganoderma lucidum соответствуют 3.83 мМ и 0.617 мкмоль/мл/мин. Для выделенного нами фермента значение KМ ниже, а Vmax выше, чем для лакказы Ganoderma lucidum. Valeriano и др. [36] рассчитали KМ (13.25 мМ) для очищенной лакказы из Stereum ostrea. В исследовании Xiao и др. [31] для лакказы из базидиомицета Trametes sp. AH28-2 значение KМ составило 1.249 мМ. Zahidi и соавт. [37] нашли, что для лакказы из Brassica oleraceae значение KМ равно 6.43 мM. По результатам проведенного нами исследования очищенная лакказа из штамма B. subtilis OH67 обладает высоким сродством к гваяколу, судя по низкому значению KМ и высокому Vmax.
Нами определены оптимальные значения pH (6.6) и температуры (50°C) для активности рекомбинантной лакказы из B. subtilis, что неплохо согласуется с данными Nguyen с соавт. [32], которые рассчитали оптимальные pH и температуру для лакказ из разных организмов как 7.0 и 67°C соответственно. Однако Dalfard и др. [24] сообщали о температурном оптимуме 37°C для лакказы, что совсем не согласуется с таковым для полученного нами фермента из B. subtilis OH67, который проявляет высокую активность при высокой температуре. Niladevi & Prema [38] сообщали о значениях рН 7.5 и температуре 32°C как оптимальных для лакказы, продуцируемой Streptomyces psammoticus. Охарактеризованная нами лакказа наиболее активна при 50°C, что согласуется с данными, опубликованными для фермента из B. subtilis wD23 [39]. Для лакказы из Halobasillus halophilus выявлена высокая термостабильность и активность при 77°C [32]. Лакказа из B. subtilis X1 оказалась близка исследованной нами, будучи стабильной при 50 и 60°C [18], в то время как лакказа из B. subtilis VTCC-DVN-12-01 стабильно работала только при 50°C [32].
ЗАКЛЮЧЕНИЕ
Лакказа из штамма B. subtilis ОН67 была успешно клонирована, экспрессирована в E. coli и очищена. Обнаружено, что этот бактериальный фермент активен при высокой температуре и в широком диапазоне pH, что открывает перспективы для его наработки и использования в промышленном масштабе. Очищенная лакказа эффективно обесцвечивает ряд химических красителей и, таким образом, может найти применение в текстильной и природоохранной отраслях.
Авторы благодарят за финансовую поддержку Университет Памуккале, Фонд финансирования научно-исследовательских проектов (Pamukkale University, Scientific Research Project Funding (PAUBAP), Project number 2016FEBE043).
Статья не содержит экспериментов, включающих людей или животных в качестве объектов исследования.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Giardina P., Faraco V., Pezzella C., Piscitelli A., Vanhulle S., Sannia G. (2010) Laccases: a never-ending story. Cell. Mol. Life Sci. 67, 369–385.
Singh G., Bhalla A., Kaur P., Capalash N., Sharma P. (2011) Laccase from prokaryotes: a new source for an old enzyme. Rev. Environ. Sci. Biotechnol. 10, 309–326.
Solomon E.I., Sundaram U.M., Machonkin T.E. (1996) Multicopper oxidases and oxygenases. Chem. Rev. 96, 2563–2606.
Abari A.H., Emtiazi G., Ghasemi S.M. (2012) The role of exopolysaccharide, biosurfactant and peroxidase enzymes on toluene degradation by bacteria isolated from marine and wastewater environments. Jundishapur J. Microbiol. 5, 479–485.
Baldrian P. (2006) Fungal laccases–occurrence and properties. FEMS Microbiol. Rev. 30, 215–242.
Mayer A.M., Staples R.C. (2002) Laccase: new functions for an old enzyme. Phytochemistry. 60, 551–565.
Vianello F., Ragusa S., Cambria M.T., Rigo A. (2006) A high sensitivity amperometric biosensor using laccase as biorecognition element. Biosens. Bioelectron. 21, 2155–2160.
Bolli A., Galluzzo P., Ascenzi P., Del Pozzo G., Manco I., Vietri M.T. Mita L., Altucci L., Mita D.G., Marino M. (2008) Laccase treatment impairs bisphenol A-induced cancer cell proliferation affecting estrogen receptor α‑dependent rapid signals. IUBMB Life. 60, 843–852.
Aswini L., Mukherjee S., Arunagirinathan N. (2016) Molecular characterization and anticancer activity of laccase from fusant strain of Pleurotus ostreatus against HuH7 hepatocarcinoma cell line. Int. J. Innovative Res. Develop. 5, 79–84.
Matuszewska A., Karp M., Jaszek M., Janusz G., Osińska-Jaroszuk M., Sulej J., Stefaniuk D., Tomczak W., Giannopoulos K. (2016) Laccase purified from Cerrena unicolor exerts antitumor activity against leukemic cells. Oncol. Lett. 11, 2009–(2018)
Lakshmi R.J, siva Mallika Donepudi, Jeevan Amos Seelam, Kasturi Kondapalli (2015) Novel approach for treating cancer by using laccases from marine fungi. Int. J. Pharm. Sci. Rev. Res. 34,124–129.
Al-Kahem Al-Balawi T.H., Wood A.L., Solis A., Cooper T., Barabote R.D. (2017) Anoxybacillus sp. strain UARK-01, a new thermophilic soil bacterium with hyperthermostable alkaline laccase activity. Curr. Microbiol. 74, 762–771.
Galai S., Limam F., Marzouki M.N. (2009) A new Stenotrophomonas maltophilia strain producing laccase. Use in decolorization of synthetics dyes. Appl. Biochem. Biotechnol. 158, 416–431.
Muthukumarasamy N.P., Jackson B., Raj A.J., Sevanan M. (2015) Production of extracellular laccase from Bacillus subtilis MTCC 2414 using agroresidues as a potential substrate. Biochem. Res. Int. 2015, 765190.
Sondhi S., Sharma P., George N., Chauhan P.S., Puri N., Gupta N. (2015) An extracellular thermo-alkali-stable laccase from Bacillus tequilensis SN4, with a potential to biobleach softwood pulp. 3 Biotech. 5, 175–185.
Sharma P., Goel R., Capalash N. (2007) Bacterial laccases. World J. Microbiol. Biotechnol. 23, 823–832.
Enguita F.J., Marçal D., Martins L.O., Grenha R., Henriques A.O., Lindley P.F. (2004) Substrate and dioxygen binding to the endospore coat laccase from Bacillus subtilis. J. Biol. Chem. 279, 23472–23476.
Guan Z.B., Zhang N., Song Ch.M., Zhou W., Zhou L.X., Zhao H. (2014) Molecular cloning, characterization, and dye-decolorizing ability of a temperature-and pH-stable laccase from Bacillus subtilis X1. Appl. Biochem. Biotechnol. 172, 1147–1157.
Kaushik G., Thakur I. (2013) Purification, characterization and usage of thermotolerant laccase from Bacillus sp. for biodegradation of synthetic dyes. Appl. Biochem. Microbiol. 49, 352–359.
Yan J., Chen D., Yang E., Niu J., Chen Y., Chagan I. (2014) Purification and characterization of a thermotolerant laccase isoform in Trametes trogii strain and its potential in dye decolorization. Int. Biodeter. Biodegr. 93, 186–194.
Fang Z., Li T., Wang Q., Zhang X., Peng H., Fang W. (2011) A bacterial laccase from marine microbial metagenome exhibiting chloride tolerance and dye decolorization ability. Appl. Microbiol. Biotechnol. 89, 1103–1110.
Baldrian P., Šnajdr J. (2006) Production of ligninolytic enzymes by litter-decomposing fungi and their ability to decolorize synthetic dyes. Enzyme Microb. Technol. 39, 1023–1029.
Dalfard A.B., Khajeh K., Soudi M.R., Naderi-Ma-nesh H., Ranjbar B., Sajedi R.H., (2006) Isolation and biochemical characterization of laccase and tyrosinase activities in a novel melanogenic soil bacterium. Enzyme Microb. Technol. 39, 1409–1416.
Sambasiva Rao K.R., Tripathy N.K., Mahalaxmi Y., Prakasham R.S. (2012) Laccase-and peroxidase-free tyrosinase production by isolated microbial strain. J. Microbiol. Biotechnol. 22, 207–214.
Barkhordari F., Sohrabi N., Davami F., Mahboudi F., Talebkhan Garoosi Y. (2019) Cloning, expression and characterization of a HER2-alpha luffin fusion protein in Escherichia coli. Prep. Biochem. Biotech. 49, 759–766.
Sen S.K., Raut S., Satpathy S., Rout P.R., Bandyopadhyay B., Das Mohapatra P.K. (2014) Characterizing novel thermophilic amylase producing bacteria from Taptapani hot spring, Odisha, India. Jundishapur J. Microbiol. 7, 12.
Rathinasamy P., Palvannan Thayumanavan (2018) Identification of efficient dye decolorizing laccase producing fungi from Kolli Hills. Indian J. Biotechnol. 17, 33–43.
Valipour E., Arikan B. (2016) Increased production of tyrosinase from Bacillus megaterium strain m36 by the response surface method. Arch. Biol. Sci. 68, 659–668.
Tavakoli M., Bouzari S., Siadat S.D., Najar Peerayeh S., Jafari A. (2015) Prokaryotic high-level expression system in producing adhesin recombinant protein E of nontypeable Haemophilus influenzae. Jundishapur J. Microbiol. 8(4), e16377.
Coelho G.D., Ballaminut N., Thomaz D.V., Gomes Machado K.M. (2019) Characterization of a thermostable Deconica castanella laccase and application toward pentachlorophenol degradation. Prep. Biochem. Biotech. 49, 908–915.
Xiao Y.Z., Chen Q., Hang J., Shi Y.Y., Xiao Y.Z., Wu J., Hong Y.Z., Wang Y.P. (2004) Selective induction, purification and characterization of a laccase isozyme from the basidiomycete Trametes sp. AH28-2. Mycologia. 96, 26–35.
Nguyen T.T., Quyen T.D., Le H.T. (2013) Cloning and enhancing production of a detergent-and organic-solvent-resistant nattokinase from Bacillus subtilis VTCC-DVN-12-01 by using an eight-protease-gene-deficient Bacillus subtilis WB800. Microb. Cell Fact. 12, 79.
Kiiskinen L.L. (2004) Characterization and heterologous production of a novel laccase from Melanocarpus albomyces. Dissertation for the degree of Doctor of Science in Technology, Espoo 2004, Vtt Publication 556, 94p. https://www.vtt.fi/inf/pdf/publications/2004/P556.pdf
Ademakinwa A.N., Agboola F.K. (2016) Biochemical characterization and kinetic studies on a purified yellow laccase from newly isolated Aureobasidium pullulans NAC8 obtained from soil containing decayed plant matter. J. Genet. Eng. Biotechnol. 14, 143–151.
Chaudhary R., Hooda S., Beniwal S., Sindha A. (2016) Partial purification and immobilization of laccase isolated from medicinal mushroom (Ganoderma lucidum). Indian J. Chem. Technol. 23, 313–317.
Valeriano V.S., Silva A.M., Santiago M.F., Bara M.T., Garcia T.A. (2009) Production of laccase by Pynocorpus sanguineus using 2,5-xylidine and ethanol. Braz. J. Microbiol. 40, 790–794.
Zahidi T., Lekchiri A., Zahidi T., Lekchiri W., Berrichi A., Mimouni M., Halouani H. (2018) Extraction and comparison of two new peroxidases from leaves and roots of Brassica oleracea var. ramose. J. Mater. Environ. Sci. 9(5), 1398–1404.
Niladevi K., Prema P. (2008) Effect of inducers and process parameters on laccase production by Streptomyces psammoticus and its application in dye decolourization. Bioresour. Technol. 99, 4583–4589.
Wang Ch.L., Zhao M., Lu L., Wei X.D., Li T. (2011) Characterization of spore laccase from Bacillus subtilis WD23 and its use in dye decolorization. African J. Biotechnol. 10, 2186–2192.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология