Молекулярная биология, 2020, T. 54, № 4, стр. 699-704
Возрастзависимый подход к поиску генетических вариантов, связанных с риском инфаркта миокарда
Г. Ж. Осьмак a, b, *, А. Р. Сидько a, И. С. Киселев a, b, О. О. Фаворова a, b
a Национальный медицинский исследовательский центр кардиологии Министерства здравоохранения
Российской Федерации
121552 Москва, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Министерства здравоохранения Российской Федерации
117997 Москва, Россия
* E-mail: german.osmak@gmail.com
Поступила в редакцию 12.03.2020
После доработки 12.03.2020
Принята к публикации 20.03.2020
Аннотация
Инфаркт миокарда (ИМ) ‒ одно из наиболее распространенных проявлений старения сердечно-сосудистой системы, нередко оканчивающееся летальным исходом. Подавляющее число исследований генетической предрасположенности к возрастзависимым заболеваниям проводится с использованием дизайна “случай–контроль”. Однако его применение связано с рядом сложностей, большинство из которых возникает на этапе формирования контрольной группы из условно здоровых индивидов. В работе проведен анализ функций дожития у носителей альтернативных полиморфных вариантов 18 генов, ассоциация которых с ИМ исследована нами ранее методом “случай‒контроль”, и дана оценка величины смещения возраста дебюта заболевания в зависимости от индивидуальных вариаций генома. Выявлены ассоциированные с возрастом дебюта ИМ варианты риска rs2430561*A гена IFNG (HR = 1.3, p = 0.043), rs1799889*5 гена PAI-1 (HR = 1.3, p = 0.039), rs1800896*GG гена IL10 (HR = 1.5, p = 0.0048), rs1800471*C гена TGFB1 (HR = 1.5, p = 0.043) и rs11614913*ТТ гена MIR196A2 (HR = 1.5, p = 0.035), носительство которых способствует развитию заболевания на 3‒6 лет раньше в сравнении с носителями альтернативных вариантов. Результаты исследования сопоставлены с ранее полученными на той же выборке оценками ассоциаций методом “случай‒контроль”. Оказалось, что по большей части оценки, получаемые двумя методами, не совпадают, однако возрастзависимый подход опирается на меньшее число допущений, которые могут быть проверены, что, на наш взгляд, делает этот подход более перспективным по сравнению с подходом “случай‒контроль”.
ВВЕДЕНИЕ
Инфаркт миокарда (ИМ) – одна из наиболее тяжелых форм ишемической болезни сердца (ИБС) и главная причина смертности от неинфекционных заболеваний в миpе [1]. ИМ в большинстве случаев возникает как осложнение прогрессирующего атеросклероза, который по своей этиологии принадлежит к многофакторным полигенным заболеваниям [2]. Риск как атеросклероза, так и ИМ повышается с возрастом, вследствие чего их относят к возрастзависимым заболеваниям [3]. Анализ генетической архитектуры атеросклероза и его частых осложнений показал, что от 40 до 60% предрасположенности к развитию этих состояний определяется отягощенной наследственностью [4], однако полногеномные ассоциативные исследования полиморфных вариантов объясняют менее 20% наследуемости [5, 6].
Подавляющее число исследований генетической предрасположенности к ИМ проводится с использованием дизайна “случай‒контроль”. Однако его применение связано с рядом сложностей, большинство из которых возникает на этапе формирования контрольной группы из условно здоровых индивидов [7].
В то же время исследование предрасположенности к возрастзависимым заболеваниям можно проводить путем оценки времени до наступления события (time-to-event (survival) data analysis) [8]. Применительно к генетическим исследованиям исходят из допущения, что индивидуальные генетические вариации задают начальный уровень риска возрастзависимых заболеваний (в частности ИМ), определяющий их последующую динамику. В таком случае не требуется сравнения с контрольной группой, а в качестве зависимой (целевой) переменной принимается время от рождения индивида до дебюта заболевания. Очевидно, что при рассмотрении таких заболеваний возрастание числа факторов риска будет смещать возраст их дебюта в сторону уменьшения, что активно используется при генетических исследованиях старения и долгожительства [9], а также при оценках риска сердечно-сосудистых событий с помощью прогностических шкал.
Ранее методом “случай‒контроль” мы изучали связь с риском развития ИМ полиморфных вариантов 18 генов и выявили значимую ассоциацию с ИМ для шести из них: TGFB1, FGB, CRP, IFNG, PTGS1 и MIR196A2 [10, 11]. В представленной работе мы оценили смещение возраста дебюта ИМ в зависимости от носительства вариантов исследуемых генов в выборке больных ИМ, сформированной в цитированных исследованиях. Полученные результаты сопоставлены с предшествующими данными [10, 11], оценена их согласованность, проанализированы достоинства и недостатки двух подходов при использовании в качестве инструментов оценки риска развития возрастзависимых заболеваний.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В pаботе иcпользовали экcпеpиментальные данные по геномному типиpованию полимоpфныx учаcтков генов CRP (rs1130864), IL10 (rs1800896), CTLA4 (rs231775), CCR5 (rs333), FGA (rs6050), FGB (rs1800788, rs1800790), PDE4D (rs152312), IL4 (rs2243250), TNF (rs1800629), LTA (rs909253), IL6 (rs1800795), PAI-1 (rs1799889), PTGS1 (rs3842787), IFNG (rs2430561), TGFB1 (rs1800469, rs1982073, rs1800471), MIR146A (rs2910164), MIR196A2 (rs11614913) и MIR499A (rs3746444), полученные нами ранее на выборке из 289 пациентов (193 мужчин и 96 женщин) с диагностированным первым “острым инфарктом миокарда” [10, 11].
Поиск генетических вариантов, от которых может зависеть возраст дебюта ИМ, осуществляли посредством сравнения функций выживаемости Каплана–Майера, рассчитывая отношение рисков (hazard ratio, HR) дебюта ИМ и его 95%-ный доверительный интервал (confidence interval, 95% СI) у групп носителей альтернативных аллелей или генотипов в модели пропорциональных рисков Кокса. Для целей настоящего исследования отсчет времени при построении кривых выживаемости вели со дня рождения пациента, а в качестве конечной точки принимали первый случай ИМ.
Статистическую обработку данных проводили при помощи средств языка программирования R. Исследование функций выживаемости, включая проверку пропорциональности рисков при помощи теста остатков Шенфильда, проводили с использованием пакета “survival” в соответствии с документаций (https://www.rdocumentation.org/ packages/survival/versions/3.1-11). Построение регрессионной модели для предсказания возраста ИМ осуществляли при помощи библиотеки scikit-learn для языка Python 3. Для отбора наиболее важных признаков использовали Lasso-регрессию с регуляризацией по L1-норме [12]. Подбор величины штрафа осуществляли прямым перебором, реализованным в классе sklearn.linear_model.LassoCV по сетке параметров с 10-кратной кросс-валидацией для повышения устойчивости модели и снижения вероятности переобучения. Разбиение выборки на обучающую и тестовую проводили в пропорции 4 : 1 соответственно, используя функцию train_test_split той же библиотеки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализируя кривые выживаемости для больных ИМ, носителей альтернативных вариантов 18 исследуемых генов, наблюдали значимую ассоциацию с возрастом дебюта ИМ носительства вариантов генов IFNG, PAI-1, IL10, FGB, TGFB1 и MIR196A (p-value < 0.05, 95% CI не пересекает единицу). На рис. 1 представлено смещение кривых выживаемости у носителей различных вариантов этих генов. Проверка условия пропорциональности рисков при помощи теста остатков Шенфельда показала, что оценки HR для вариантов этих генов постоянны и значимо не зависят от возраста индивидов (p < 0.05). Обращает на себя внимание резкое смещение функции выживаемости в случае носителей генотипа АА rs1800790 гена FGB, у всех из них первый ИМ произошел в возрасте до 40 лет.
Рис. 1.
Кривые Каплана–Майера возраста дебюта ИМ для носителей альтернативных полиморфных вариантов указанных генов (представлены данные только для значимых ассоциаций). В гене PAI-1 исследован инсерционно-делеционный полиморфизм 4G/5G; остальные полиморфизмы ‒ однонуклеотидные замены. Кривые для аллелей/генотипов, повышающих риск раннего ИМ, выделены красным цветом, а для протективных вариантов ‒ зеленым.
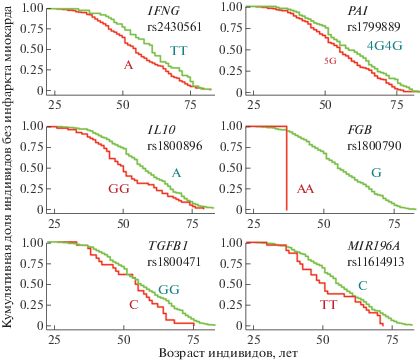
В табл. 1 приведены значения p-value и HR (95% CI) для тех аллелей или генотипов приведенных на рис. 1 генов, носительство которых значимо снижает возраст дебюта ИМ (т.е. вариантов риска ИМ). Значения HR для всех из них, за исключением генотипа АА гена FGB, лежат в довольно узком диапазоне: от 1.3 до 1.5. Для FGB*АА значение HR составляет 11, при том, что лежит в достаточно узком диапазоне 95% CI: 9.15–13.3.
Таблица 1.
Полиморфные варианты генов, значимо ассоциированные с более ранним возрастом дебюта ИМ
| Ген, идентификационный номер полиморфизма |
Аллель/генотип риска | p-Value | HR (95% CI) | Величина смещения возраста ИМ (лет) |
|---|---|---|---|---|
| IFNG, rs2430561 | A | 0.043 | 1.3 (1.06–1.66) | 3.08 |
| PAI-1, rs1799889 | 5G* | 0.039 | 1.3 (1.05–1.56) | 3.02 |
| IL10, rs1800896 | GG | 0.0048 | 1.5 (1.23–1.81) | 5.77 |
| TGFB1, rs1800471 | C | 0.043 | 1.5 (1.11–1.93) | 3.42 |
| MIR196A, rs11614913 | TT | 0.035 | 1.5 (1.12–1.88) | 3.34 |
| FGB, rs1800790 | AA | 0.022 | 11.0 (9.15–13.3) | 0 |
Для оценки числа лет, на которые смещается возраст дебюта ИМ в зависимости от генотипа, мы сформулировали задачу предсказания возраста дебюта ИМ при носительстве тех или иных полиморфных вариантов. Такая постановка вопроса позволяет перейти к моделям на основе линейной регрессии. В этом случае коэффициенты уравнения регрессии при полиморфных вариантах будут соответствовать величине смещения возраста дебюта ИМ у носителей аллелей или генотипов риска относительно среднего возраста дебюта в исследуемой выборке.
Модель обучали, минимизируя квадратичную функцию потерь с введением штрафа по L1-норме для прореживания признакового пространства полиморфных вариантов. В результате получены оценки смещения возраста дебюта ИМ в сторону более раннего его развития в диапазоне от 3.08 лет для носителей rs2430561*A гена IFNG до 5.77 лет для носителей rs1800896*GG гена IL10 (табл. 1). Исключение составляет ген FGB, для которого оценка смещения возраста составила 0 лет.
Совокупность представленных результатов свидетельствует об ассоциации вариантов генов IFNG, PAI-1, IL10, TGFB1 и MIR196A с риском ИМ. Использование регуляризации по L1-норме позволило исключить из числа значимых для оценки возраста дебюта ИМ ген FGB, что согласуется с отмеченными выше отклонениями кривых выживаемости и значениями HR для этого гена относительно других генов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами исследована ассоциация полимоpфныx вариантов генов CRP (rs1130864), IL10 (rs1800896), CTLA4 (rs231775), CCR5 (rs333), FGA (rs6050), FGB (rs1800788, rs1800790), PDE4D (rs152312), IL4 (rs2243250), TNF (rs1800629), LTA (rs909253), IL6 (rs1800795), PAI-1 (rs1799889), PTGS1 (rs3842787), IFNG (rs2430561), TGFB1 (rs1800469, rs1982073, rs1800471), MIR146A (rs2910164), MIR196A2 (rs11614913) и MIR499A (rs3746444) с возрастом дебюта ИМ. Выявлены ассоциированные с возрастом дебюта ИМ рисковые варианты генов IFNG, PAI-1, IL10, TGFB1 и MIR196A, носительство которых способствует его развитию на 3‒6 лет раньше в сравнении с носителями альтернативных вариантов.
Неоднозначные результаты, полученные нами для носителей генотипа rs1800790*АА гена FGB, привели к исключению этого гена из рассмотрения. Скорее всего, эти результаты связаны с малым числом (n = 3) таких носителей и плохо отражают свойства генеральной совокупности больных ИМ.
Сравнивая результаты настоящего исследования с ранее полученными для той же выборки больных ИМ методом “случай‒контроль” [10, 11] (табл. 2), можно видеть, что качественно совпадают результаты только для варианта гена IFNG. В то же время при анализе методом “случай‒контроль” [10] наблюдали ассоциацию с ИМ других полиморфных участков генов TGFB1 (rs1982073) и FGB (rs1800788), а также варианта гена CRP rs1130864.
Таблица 2.
Сравнение результатов представленного исследования с полученными ранее методом “случай–контроль” для той же выборки больных ИМ
| Носительство аллеля или генотипа | Отношение рисков (HR) по результатам проведенного исследовании | Отношение шансов (OR) по результатам исследования методом “случай‒контроль” [10, 11] |
|---|---|---|
| IFNG rs2430561*Aa | 1.3 | 2.9 |
| MIR196A2 rs11614913*ТТ | 1.5 | 0.5 |
| IL10 rs1800896*GG | 1.5 | Н.З.b |
| PAI-1 rs1799889*5G | 1.3 | Н.З. |
| TGFB1 rs1800471*C | 1.5 | Н.З. |
Таким образом, результаты, полученные при исследовании ассоциации генетических вариантов с возрастом дебюта ИМ, отличаются от результатов, полученных методом “случай‒контроль”. В рамках проведенного исследования мы не можем проанализировать все возможные причины наблюдаемых расхождений, но некоторые из них следует отметить.
При дизайне “случай‒контроль” для исследования многофакторных возрастзависимых заболеваний невозможно гарантировать, что они не разовьются у индивидов контрольной группы спустя некоторое время после ее формирования. Искажение результатов может происходить вследствие вмешательства негенетических (посторонних) факторов, которые не были учтены при формировании групп сравнения, ‒ так называемых конфаунд-эффектов [13]. Смещение оценок может происходить также из-за несоответствия между поставленными задачами, способом формирования контрольной группы (эксклюзивный, конкурентный, инклюзивный), распространенностью заболевания и особенностями исследуемых факторов риска. Все это неизбежно приводит к невыполнению статистических условий и некорректной трактовке получаемых результатов [14]. Выше перечисленные факторы могут приводить к получению результатов, не в полной мере отражающих реальное положение вещей, и при их интерпретации следует соблюдать осторожность.
В свою очередь, возрастзависимый подход к исследованию генетической предрасположенности к ИМ основан на оценке возраста дожития до первого ИМ и предполагает, что эффекты тех или иных генетических вариантов на риск возникновения ИМ постоянны в разных возрастах и накапливаются кумулятивно по мере старения, что и определяет возрастзависимый характер заболевания. В случае же нелинейных эффектов будет нарушаться пропорциональность рисков ‒ важное условие для применения регрессионной модели Кокса, что приведет к ложноположительному или ложноотрицательному результату анализа. В проведенном исследовании с помощью теста остатков Шенфельда проверена пропорциональность рисков и показано, что это условие соблюдалось, о чем свидетельствует также отсутствие пересечения кривых дожития, построенных для носителей альтернативных генотипов (см. рис. 1).
Таким образом, при исследовании генетической архитектуры ИМ с использованием возрастзависимого подхода вводится меньше допущений, чем при подходе “случай‒контроль”, причем все они могут быть проверены. Это и определяет преимущество возрастзависимого подхода перед дизайном типа “случай‒контроль”. Неслучайно методы диагностики, основанные именно на возрастзависимых оценках, получили широкое распространение в практической медицине в составе шкал оценок риска неблагоприятных сердечно-сосудистых событий (шкала SCORE [15], Фрамингемская шкала [16], шкала ASCVD [17] и др.).
Исследование поддержано грантом РФФИ № 19-315-80019.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Roberts R. (2014) Genetics of coronary artery disease. Circ. Res. 114(12), 1890–1903.
Wu M.-Y., Li C.-J., Hou M.-F., Chu P.-Y. (2017) New insights into the role of inflammation in the pathogenesis of atherosclerosis. Int. J. Mol. Sci. 18(10), pii: E2034.
Head T., Daunert S., Goldschmidt-Clermont P.J. (2017) The aging risk and atherosclerosis: a fresh look at arterial homeostasis. Front. Genet. 8, 216.
(2002) The Genetic Basis of Common Diseases. Eds King R.A., Rotter J.I., Motulsky A.G. Oxford: Oxford University Press, vol. 44.
Hartiala J., Schwartzman W.S., Gabbay J., Ghazalpour A., Bennett B.J., Allayee H. (2017) The genetic architecture of coronary artery disease: current knowledge and future opportunities. Curr. Atheroscler. Rep. 19(2), 6.
Marian A.J. (2012) The enigma of genetics etiology of atherosclerosis in the post-GWAS era. Curr. Atheroscler. Rep. 14(4), 295–299.
Tenny S., Hoffman M.R. (2020) Case Control Studies. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing.
Kleinbaum D.G., Klein M. (2010) Survival Analysis, vol. 3. Springer.
Slagboom P.E., van den Berg N., Deelen J. (2018) Phenome and genome based studies into human ageing and longevity: an overview. Biochim. Biophys. Acta Mol. Basis Dis. 1864(9), 2742–2751.
Barsova R.M., Lvovs D., Titov B.V., Matveeva N.A., Shakhnovich R.M., Sukhinina T.S., Kukava N.G., Ruda M.Ya., Karamova I.M., Nasibullin T.R., Mustafina O.E., Osmak G.J., Tsareva E.Yu., Kulakova O.G., Favorov A.V., Favorova O.O. (2015) Variants of the coagulation and inflammation genes are replicably associated with myocardial infarction and epistatically interact in Russians. PLoS One. 10(12), e0144190. https://doi.org/10.1371/journal.pone.0144190
Осьмак Г.Ж., Матвеева Н.А., Титов Б.В., Фаворова О.О. (2018) Связь полиморфизма гена MIR196A2 с инфарктом миокарда и возможное вовлечение микроРНК miR-196a2 в сигнальные пути, участвующие в формировании патологического фенотипа. Молекуляр. биология. 52(6), 1006–1013.
Tibshirani R. (1996) Regression shrinkage and selection via the lasso. J. R. Stat. Soc. Ser. B Methodol. 58(1), 267–288.
Beaglehole R., Bonita R., Kjellström T. (1993) Basic Epidemiology. World Health Organization, Geneva.
Rodrigues L., Kirkwood B.R. (1990) Case-control designs in the study of common diseases: updates on the demise of the rare disease assumption and the choice of sampling scheme for controls. Int. J. Epidemiol. 19(1), 205–213.
Conroy R.M., Pyörälä K., Fitzgerald A.P., Sans S., Menotti A., Backer G.D., Bacquer D.D., Ducimetière P., Jousilahti P., Keil U., Njølstad I., Oganov R.G., Thomsen T., Tunstall-Pedoe H., Tverdal A., Wedel H., Whincup P., Wilhelmsen L., Graham I.M. (2003) Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur. Heart J. 24(11), 987–1003.
Wilson P.W., D’Agostino R.B., Levy D., Belanger A.M., Silbershatz H., Kannel W.B. (1998) Prediction of coronary heart disease using risk factor categories. Circulation. 97(18), 1837–1847.
Goff D.C., Lloyd-Jones D.M., Bennett G., Coady S., D’agostino R.B., Gibbons R., Greenland P., Lackland D.T., Levy D., O’donnell C.J. (2014) 2013 ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Part B. J. Am. Coll. Cardiol. 63(25), 2935–2959.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


