Молекулярная биология, 2020, T. 54, № 5, стр. 872-880
Эффективность гидролиза РНК биназой из Bacillus pumilus: влияние структуры субстрата, ионов металлов и низкомолекулярных соединений нуклеотидной природы
А. А. Кузнецова a, А. А. Ахметгалиева b, В. В. Ульянова b, О. Н. Ильинская b, О. С. Федорова a, *, Н. А. Кузнецов a, **
a Институт химической биологии и фундаментальной медицины Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
b Институт фундаментальной медицины и биологии Казанского (Приволжского) федерального университета
420008 Казань, Россия
* E-mail: fedorova@niboch.nsc.ru
** E-mail: nikita.kuznetsov@niboch.nsc.ru
Поступила в редакцию 13.04.2020
После доработки 28.04.2020
Принята к публикации 28.04.2020
Аннотация
Биназа – внеклеточная гуанилспецифичная рибонуклеаза из Bacillus pumilus, основной биологической функцией которой является деградация РНК с образованием 2',3'-гуанозинциклофосфата и его последующим гидролизом до 3'-фосфата. Внеклеточные РНКазы относятся к важным агентам, влияющим на функциональную активность организма, поскольку они взаимодействуют непосредственно с эпителиальными и иммунными клетками. При этом биологические эффекты фермента могут реализоваться как за счет прямой деградации РНК, так и вследствие накопления 2',3'-cGMP в организме человека. В настоящей работе проведен сравнительный анализ эффективности расщепления модельных РНК-субстратов, представляющих собой короткие шпилечные структуры, в которых варьировали положение гуанозина. Показано, что эффективность гидролиза модельных РНК-субстратов зависит от положения гуанозина. Кроме того, выявлено влияние ионов различных двухвалентных металлов и низкомолекулярных соединений нуклеотидной природы на протекание эндорибонуклеазной реакции, катализируемой биназой.
ВВЕДЕНИЕ
Биназа (Bi) – внеклеточная гуанилспецифичная рибонуклеаза из Bacillus pumilus [1], относится к семейству РНКаз N1/T1/U2 (IPR001887). Фермент катализирует гидролиз фосфодиэфирной связи между гуанозин-3'-фосфатом и 5'-ОН-группой соседнего нуклеотида с образованием 2',3'-гуанозинциклофосфата, после чего происходит гидролиз 2',3'-гуанозинциклофосфата до 3'-фосфата [2]. Несмотря на то, что основным сайтом расщепления РНК биназой является гуанозин, фермент способен также проводить гидролиз РНК по остаткам аденозина, но с меньшей эффективностью. Показано [3, 4], что стадия гидролиза 2',3'-циклофосфатного интермедиата происходит существенно медленнее, чем стадия его образования. В случае последовательно расположенных пуриннуклеотидов в РНК это будет приводить к накоплению 2',3'-cGMP и 2',3'-cAMP.
Биологические эффекты биназы, такие как противоопухолевая и противовирусная активности [5‒7], могут быть реализованы как за счет прямой деградации РНК, так и вследствие накопления 2',3'-cGMP в организме человека. Необходимо отметить, что биологическая роль 2',3'-циклических производных еще не изучена детально, но уже появляются данные об их участии в защите клеток при повреждениях и инфекциях [8‒10]. Можно предположить, что 2',3'-циклические производные также влияют на активность РНКазы и таким образом могут регулировать биологический эффект РНКаз. Кроме того, еще одним фактором, влияющим на активность РНКаз, могут быть ионы металлов. Несмотря на то что биназу рассматривают как фермент, которому не требуются ионы металлов для каталитического гидролиза РНК, ранее было установлено, что некоторые ионы металлов влияют на протекание эндорибонуклеазной реакции [11, 12]. Однако роль ионов металлов в ферментативном процессе может заключаться как в прямом участии в каталитической реакции, так и в стабилизации структуры РНК. Действительно, показано [12], что скорость образования 2',3'-cGMP возрастает в присутствии ионов Mg2+, Ca2+, Zn2+, которые, по-видимому, стабилизируют структуру РНК. В то же время в присутствии ионов Mn2+, Co2+, Fe2+ происходило значительное уменьшение количества 2',3'-cGMP за счет нарушения контактов с атомом N7 гуанина в активном центре биназы.
Нами проведен комплексный предстационарный кинетический анализ процесса взаимодействия биназы с модельными РНК-субстратами. В качестве модельных субстратов использовали короткие шпилечные структуры, в которых варьировалось местоположение гуанозина. Протекание ферментативного процесса регистрировали методом “остановленного потока” по изменению интенсивности флуоресценции остатка флуоресцеина, вводимого в состав субстратов. Образование продуктов реакции также регистрировали с помощью разделения реакционной смеси методом гель-электрофореза (PAGE). Сравнительный анализ эффективности расщепления модельных РНК-субстратов, представляющих собой короткие шпилечные структуры, показал, что эффективность гидролиза РНК зависит от местоположения гуанозина в молекуле субстрата. Установлено влияние различных ионов двухвалентных металлов и низкомолекулярных соединений нуклеотидной природы на протекание эндорибонуклеазной реакции, катализируемой биназой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали реактивы производства фирмы “Sigma-Aldrich” (США): акриламид, N,Nꞌ-метиленбисакриламид, дитиотреитол, мочевину, глицерин, HEPES, изопропил-β-D-тиогалактопиранозид, Tрис, NaCl, NaOH, EDТА, HCl, соли двухвалентных металлов (CaCl2, CoCl2, MgCl2, MnCl2, ZnCl2, NiSO4). Все растворы готовили на дважды дистиллированной воде.
Ферменты. Биназа (молекулярная масса 12.3 кДа, 109 аминокислотных остатков, pI = 9.5) очищена в виде гомогенного белка из культуральной жидкости B. pumilus 7P. Каталитическая активность биназы в отношении дрожжевой РНК равна 14 × 106 ед. акт./мг при рН 8.5. В качестве контрольного фермента использовали пиримидинспецифичную панкреатическую РНКазу А крупного рогатого скота (13.7 кДа, 124 аминокислотных остатка, pI = 9.63) (“Sigma-Aldrich”).
Олигорибонуклеотиды. Олигорибонуклеотиды получали твердофазным фосфитамидным методом на синтезаторе АСМ-800 (“Биоссет”, Россия) с использованием соответствующих фосфитамидов 2'-O-трет-бутилдиметилсилильных (2'-О-TBDMS) рибонуклеотидов (“ChemGenes”, США), как описано ранее [13]. Для введения флуоресцеина на 5'-конец использовали фосфитамид флуоресцеина (“Glen Research”, США). Олигонуклеотиды, содержащие на 3'-конце тушитель флуоресценции BHQ1, получали с использованием соответствующего модифицированного полимерного носителя 3'-BHQ-1 CPG (Black Hole Quencher) (“Glen Research”). Деблокирование олигорибонуклеотидов проводили в стандартных условиях. Деблокированные олигорибонуклеотиды выделяли с помощью препаративного PAGE. Оптическую плотность растворов олигонуклеотидов измеряли на спектрофотометре NanoDrop 1000 (“ThermoScientific”, США) относительно деионизованной воды. Концентрации олигонуклеотидов в исходном растворе рассчитывали с использованием коэффициента молярного поглощения олигорибонуклеотидов или их конъюгатов при 260 нм. Последовательности модельных олигорибонуклеотидов представлены в табл. 1.
Таблица 1.
Модельные РНК-субстраты, использованные в работе
| Название | Нуклеотидная последовательность | Структура |
|---|---|---|
| G-loop | FAM-r(AUAUAAGAUCAUUAUAU)-BHQ1 | 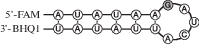 |
| ds-G | FAM-r(AUACAACAUAAUUGUAU)-BHQ1 | 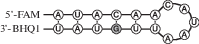 |
| no-G | FAM-r(AUAUAACAUCAUUAUAU)-BHQ1 | 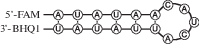 |
Кинетический анализ гидролиза РНК-субстратов методом “остановленного потока”. Кинетику протекания ферментативного процесса регистрировали по изменению интенсивности флуоресценции остатка флуоресцеина, входящего в состав модельных субстратов (табл. 1). Флуоресцентные кинетические кривые зарегистрированы на спектрометре “остановленного потока” SX.18MV (“Applied Photophysics”, Великобретания), как описано ранее [14]. Эффективность резонансного переноса энергии флуоресценции (FRET) в составе пары FAM/BHQ1 регистрировали при возбуждении флуоресценции красителя FAM на длине волны 494 нм. FRET-сигнал регистрировали на длинах волн более 530 нм при использовании светофильтра OG-515 (“Schott”, Германия). Мертвое время прибора составляло 1.38 мс. Каждую кинетическую кривую усредняли по результатам не менее четырех экспериментов. Эксперименты выполняли в буферном растворе 50 мM Tрис-HCl (pH 7.5, 6.5 и 8.5) с 50 мM KCl, 1 мM EDТА, 1 мM дитиотреитолом, 9% глицерина при 25°С. Влияние ионов металлов и низкомолекулярных соединений изучали в буферном растворе 50 мM Tрис-HCl (pH 7.5) с 1 мM дитиотреитолом, 9% глицерина при 25°С, дополнительно содержащим 0.1 мМ соль двухвалентного металла (CaCl2, CoCl2, MgCl2, MnCl2, ZnCl2, NiSO4) или соответствующее производное NADH, 3',5'-cycloA, ATP, pG, pppG, 3',5'-cycloG.
Для определения наблюдаемых констант скорости ферментативной реакции каждую кинетическую кривую аппроксимировали суммой экспонент по уравнению (1) в программном пакете OriginPro 8.0 (OriginLab Corp., США):
где F – интенсивность флуоресценции FAM в момент времени t, A – коэффициент, kobs – наблюдаемая константа скорости, C – интенсивность флуоресценции при t → ∞.Зависимость наблюдаемых констант скорости kobs от начальной концентрации биназы аппроксимировали линейным уравнением (2)
Кинетический анализ гидролиза РНК-субстратов методом PAGE. Кинетические зависимости степени расщепления субстрата получали по следующей методике. К 30 мкл буферного раствора, содержащего субстрат G-loop, ds-G или no-G (2.0 мкМ), добавляли 30 мкл (20 нМ или 2.0 мкМ) фермента в том же буферном растворе. После быстрого перемешивания реакционной смеси через определенные промежутки времени из нее отбирали аликвоты объемом 10 мкл, которые помещали в пробирки с 10 мкл раствора 9 М мочевины и 25 мМ EDТА и выдерживали в течение 2 мин при 96°С. PAGE в 20%-ном геле проводили в вертикальной термостатируемой камере Protean II xi (“Bio-Rad Lab. Inc”.) при напряжении 200–300 В и 50°С. Гель визуализировали с помощью гель-документирующей системы E-Box CX.5 TS (“Vilber Lourman”, Франция). Степень расщепления субстрата определяли в программном пакете Gel-Pro Analyzer 4.0 (“Media Cybernetics”, США). Степень расщепления расcчитывали как отношение площади пика продукта расщепления к сумме площадей пиков продукта и исходного олигорибонуклеотида. Ошибка определения степени модификации не превышала, как правило, 20%.
Частичный гидролиз субстрата РНКазы A проводили по следующей методике. Реакционную смесь (20 мкл), содержащую 3.0 мкМ субстрата и 3.0 нМ РНКазы A в буферном растворе (50 мM Tрис-HCl, pH 8.5, 50 мM NaCl, 1 мM EDТА, 1 мM дитиотреитол, 9%-ный глицерин), выдерживали в течение 5 мин при 25°С. После этого в реакционную смесь добавляли 20 мкл раствора, содержащего 9 М мочевины и 25 мМ EDТА, и выдерживали в течение 5 мин при 96°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ продуктов реакции методом гель-электрофореза
В настоящей работе нами использован ряд модельных РНК-субстратов длиной 17 н., представляющих собой короткие шпилечные структуры, в которых длина стебля равна 6 п.н., а размер петли составлял 5 н. Остаток гуанозина находился в петле (G-loop-субстрат), стебле (ds-G-субстрат) или отсутствовал (no-G-субстрат) (табл. 1).
Поскольку биназа может расщеплять РНК не только по остаткам гуанозина, но и по другим нуклеотидам, была изучена кинетика накопления продуктов, образующихся из разных субстратов. С этой целью проводили электрофоретическое разделение продуктов реакции, полученных при 100-кратном избытке субстрата над ферментом. На рис. 1 видно, что в присутствии субстратов G-loop (рис. 1а) и ds-G (рис. 1б) реакция протекает очень быстро, и спустя 30 с исходный олигорибонуклеотид полностью гидролизован. В первый момент времени накапливается продукт гидролиза по остатку гуанозина (G7 в G-loop и G14 в ds-G), который далее гидролизуется биназой по остаткам аденозина. При взаимодействии биназы с субстратом no-G наблюдается статистическое расщепление по остаткам аденина (рис. 1в). При эквимолярном соотношении фермента и субстратов процесс протекает очень быстро и уже через 30 с в смеси присутствует только конечный продукт (рис. 1г).
Рис. 1.
Электрофоретическое разделение продуктов реакции G-loop (а), ds-G (б) и no-G (в) при избыточной концентрации субстрата (1.0 мкМ) по отношению к ферменту (10 нM). г – Электрофоретическое разделение продуктов реакции гидролиза субстратов G-loop, ds-G и no-G при эквимолярных концентрациях субстрата и фермента, равных 1.0 мкМ.
Анализ взаимодействия биназы с субстратами G-loop, ds-G и no-G методом “остановленного потока”
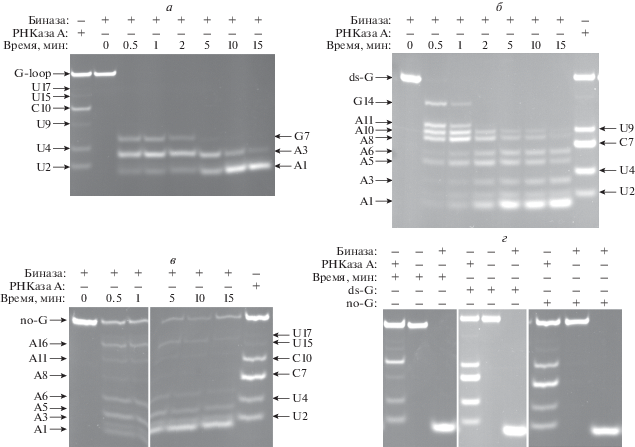
Нами проведен сравнительный анализ кинетики расщепления модельных РНК-субстратов, в которых варьировалось местоположение гуанозина (табл. 1). Олигорибонуклеотиды G-loop, no-G и ds-G содержат FRET-пару, состоящую из остатка флуоресцеина (FAM) и тушителя (BHQ1). При расщеплении субстрата происходит отдаление в пространстве остатков флуорофора и тушителя и, как следствие, рост интенсивности флуоресценции остатка FAM.
При взаимодействии биназы с субстратами G-loop, ds-G и no-G наблюдали рост интенсивности флуоресценции FAM (рис. 2). При этом скорость расщепления уменьшалась в ряду G-loop $ \gg $ ds-G $ \gg $ $ \gg $ no-G, что свидетельствует о более эффективном расщеплении гуанозина, находящегося в петле, по сравнению с остатком G в стебле. Более того, статистическое расщепление no-G-субстрата по остаткам аденозина, расположенным как в петле, так и в стебле, происходит значительно медленнее, чем обоих субстратов, содержащих гуанозин.
Рис. 2.
Изменение интенсивности флуоресценции FAM в процессе взаимодействия биназы с субстратами G-loop, ds-G и no-G. Концентрация фермента и субстратов – 0.1 мкM.
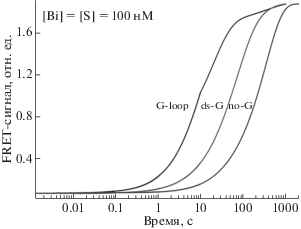
Для каждого субстрата получена серия кинетических кривых, в которой концентрация субстратов составляла 0.1 мкM, а концентрация фермента варьировала от 1.0 нM до 10 мкM. Как видно из рис. 3, при увеличении концентрации фермента скорость гидролиза субстрата возрастала. Поскольку каждый субстрат имеет несколько сайтов расщепления, то кинетические кривые должны отражать несколько независимых процессов, протекающих с разной скоростью, например, расщепление субстрата по остатку гуанозина и различным остаткам аденозина. Таким образом, можно предположить, что начальный участок кинетических кривых отражает расщепление по самому эффективному сайту (гуанозин в случае G-loop и ds-G), в то время как последующая часть кривой характеризует совокупный статистический гидролиз РНК-субстратов по остаткам аденозина вплоть до полной деградации РНК. Действительно, в случае G-loop-субстрата различие в константах скоростей этих параллельных процессов настолько велико, что на кинетических кривых видна дополнительная фаза роста интенсивности флуоресценции FAM (рис. 3а). Начальную фазу роста интенсивности флуоресценции FAM на кинетических кривых использовали для аппроксимации экспоненциальным уравнением (1), которое позволило рассчитать значение наблюдаемой константы скорости.
Рис. 3.
Изменение интенсивности флуоресценции FAM в процессе взаимодействия биназы с субстратами G-loop (а), ds-G (б) и no-G (в). Концентрация субстратов составляла 0.1 мкM, концентрация фермента варьировала от 1.0 нM до 10 мкM.
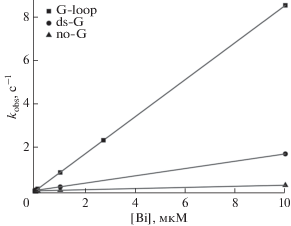
Зависимости наблюдаемых констант скорости kobs от начальной концентрации биназы имели линейный вид (рис. 4). Линейная зависимость свидетельствует о том, что наблюдаемая константа скорости характеризует бимолекулярный процесс и позволяет рассчитать кажущиеся константы скорости образования продукта по уравнению (2) (табл. 2). В этом случае кинетическая схема ферментативного процесса может быть представлена в виде Схемы 1 , причем величина константы скорости каталитической реакции должна соответствовать условию k2$ \gg $ k1 × S.
Таблица 2.
Значение констант скоростей, характеризующих процесс взаимодействия биназы с субстратами G-loop, ds-G и no-G
| Константа скорости | G-loop | ds-G | no-G |
|---|---|---|---|
| k1, (мкM × c)–1 | 0.930 ± 0.004 | 0.170 ± 0.002 | 0.026 ± 0.001 |
| k–1, c–1 | 0.002 ± 0.003 | 0.02 ± 0.01 | 0.003 ± 0.002 |
Схема 1 . E – биназа, S – субстрат, E•S – каталитический комплекс фермента с субстратом, P – продукт реакции.
Видно (табл. 2), что значение константы скорости k-1 является малой величиной по сравнению с произведением k1 × [Bi] для [Bi] > 1 мкМ. Это свидетельствует о том, что эффективность образования каталитического комплекса в большей степени зависит от величины константы скорости k1. При этом значение константы скорости k1 для образования каталитического комплекса с G-loop-субстратом, в котором остаток гуанозина расположен в петле шпильки, в 5.5 раз больше, чем при расположении гуанозина в двухцепочечном участке ds-G-субстрата. Необходимо отметить, что константа скорости образования каталитического комплекса с субстратами G-loop и ds-G, содержащими гуанозин, в 36 и 6.5 раз больше, чем с no-G-субстратом, включающим только остатки аденозина.
Влияние низкомолекулярных соединений на активность биназы
Нами проанализировано влияние низкомолекулярных соединений (NADH, 3',5'-cycloA, ATP, pG, pppG, 3',5'-cycloG) на процесс взаимодействия биназы с субстратами G-loop и ds-G. Из рис. 5а, б видно, что в присутствии низкомолекулярных соединений происходит незначительное замедление реакции. Полученные кинетические кривые удовлетворительно описывались уравнением (1). В табл. 3 приведены значения наблюдаемых констант. Анализ наблюдаемых констант скоростей, полученных для субстрата G-loop и ds-G, показывает, что природа добавляемого низкомолекулярного компонента влияет на kobs. Значение наблюдаемой константы скорости kobs для субстрата G-loop и ds-G уменьшается в ряду: No (без добавочного компонента) > 3',5'-cycloA ~ ~ NADH > ATP > pG > pppG > 3',5'-cycloG (табл. 3). При этом наибольшее влияние на скорость реакции оказывал 3',5'-cycloG. В целом, можно заключить, что производные гуанина приводили к уменьшению kobs в 1.5–2 раза, в то время как производные аденина лишь незначительно влияли на значения kobs.
Рис. 5.
Изменение интенсивности флуоресценции FAM при взаимодействии биназы с субстратами G-loop (а) и ds-G (б) в присутствии различных низкомолекулярных компонентов. Концентрация фермента и субстрата составляла 0.1 мкМ, концентрация низкомолекулярного компонента – 0.1 мM.
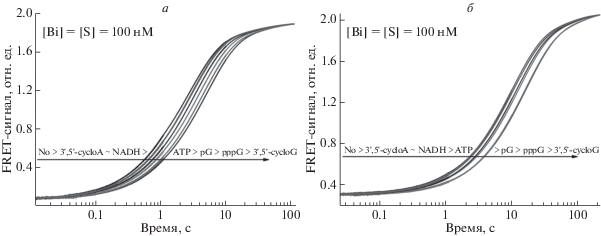
Таблица 3.
Значение наблюдаемых констант скорости kobs (с–1), характеризующих процесс взаимодействия биназы с субстратами G-loop и ds-G, в присутствии различных низкомолекулярных компонентов
| Низкомолекулярный компонент | G-loop | ds-G |
|---|---|---|
| – | 0.48 ± 0.0004 | 0.14 ± 0.0004 |
| 3',5'-cycloA | 0.39 ± 0.0004 | 0.13 ± 0.0003 |
| NADH | 0.39 ± 0.0004 | 0.12 ± 0.0004 |
| ATP | 0.35 ± 0.0003 | 0.11 ± 0.0002 |
| pG | 0.31 ± 0.0002 | 0.10 ± 0.0002 |
| pppG | 0.27 ± 0.0002 | 0.082 ± 0.0002 |
| 3',5'-cycloG | 0.24 ± 0.0002 | 0.082 ± 0.0003 |
Влияние ионов двухвалентных металлов
Изучено влияние ионов двухвалентных металлов Mg2+, Ca2+, Ni2+, Mn2+, Zn2+ и Co2+ на взаимодействие биназы с субстратом G-loop (рис. 6). Добавление в реакционную смесь солей различных двухвалентных металлов в концентрации 0.1 мM приводило к замедлению реакции. Полученные кинетические кривые удовлетворительно описывались уравнением (1). Полученные значения наблюдаемых констант скорости kobs приведены в табл. 4. Видно, что ионы Mg2+, Ca2+ и Zn2+ незначительно влияют на эффективность гидролиза РНК, в то время как ионы Co2+ уменьшают наблюдаемую константу гидролиза в 1.5 раза, а ионы Ni2+ и Mn2+ – в 2 раза.
Рис. 6.
Изменение интенсивности флуоресценции FAM при взаимодействии биназы с G-loop-субстратом в присутствии солей двухвалентных металлов. Концентрация фермента и субстрата – 0.1 мкM, концентрация соли двухвалентного металла – 0.1 мM.
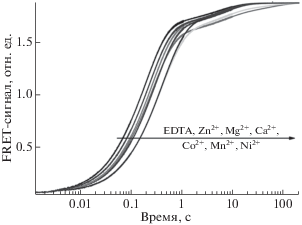
Таблица 4.
Значения наблюдаемых констант скорости, характеризующих процесс взаимодействия биназы с субстратом G-loop в присутствии солей различных двухвалентных металлов
| Соль | kobs, с–1 |
|---|---|
| EDТА | 5.4 ± 0.003 |
| ZnCl2 | 4.6 ± 0.002 |
| MgCl2 | 4.0 ± 0.002 |
| CaCl2 | 3.9 ± 0.003 |
| CoCl2 | 3.5 ± 0.002 |
| MnCl2 | 2.6 ± 0.002 |
| NiSO4 | 2.5 ± 0.002 |
Таким образом, анализ влияния ионов металлов на ферментативный процесс, катализируемый биназой, свидетельствует, что первая стадия гидролиза субстрата и образования 2',3'-гуанозинциклофосфата незначительно замедляется только в присутствии ионов Mn2+, Ni2+ и Co2+. Известно, что взаимодействие некоторых ионов переходных металлов с азотистыми основаниями нарушает образование водородных связей между парами оснований и тем самым дестабилизирует двойную спираль [15, 16]. В то же время катионы, более специфично связывающие фосфатные группы, стабилизируют двойную спираль за счет нейтрализации зарядов рибозофосфатного остова. Кроме того, еще одним фактором, который может влиять на эффективность гидролиза, может быть ионный радиус, вследствие чего ионы могут связываться с разными функциональными группами на поверхности фермента и субстрата. Как известно, эффективные радиусы ионов для координационного числа 6 уменьшаются в ряду: 1.0 Å у Ca2+, 0.74 Å у Zn2+, 0.72 Å у Mg2+, 0.69 Å у Ni2+, 0.67 Å у Mn2+ и 0.65 Å у Co2+ [17], что примерно коррелирует с уменьшением величины kobs (табл. 4). Таким образом, ионы с наименьшим радиусом наиболее существенно ингибируют фермент.
В работе проведен предстационарный кинетический анализ процесса взаимодействия биназы из B. pumilus с модельными РНК-субстратами – короткими шпилечными структурами, в которых варьировало местоположение гуанозина. Показано, что фермент наиболее эффективно гидролизует G-loop-субстрат, в котором остаток гуанозина расположен в петле шпильки. При расположении гуанозина в двухцепочечном участке (ds-G-субстрат) константа скорости, характеризующая образование каталитического комплекса, уменьшается в 5.5 раз. Биназа также способна гидролизовать РНК по остаткам аденозина, однако константа скорости образования каталитического комплекса с субстратами G-loop и ds-G, содержащими гуанозин, в 36 и 6.5 раз больше, чем с no-G-субстратом, включающим только остатки аденозина. В ходе работы выявлено влияние низкомолекулярных соединений нуклеотидной природы и ионов двухвалентных металлов на процесс взаимодействия биназы с субстратами. При этом эффективность гидролиза РНК уменьшается в ряду: No (без добавочного компонента) > 3',5'-cycloA ~ NADH > > ATP > pG > pppG > 3',5'-cycloG. Установлено, что гидролиз РНК также незначительно замедляется в присутствии ионов Mn2+, Ni2+ и Co2+. Однако максимальный ингибирующий эффект использованных низкомолекулярных соединений и ионов двухвалентных металлов, рассчитанный как отношение константы скорости без эффектора и константы скорости в присутствии соответствующего компонента, не превышал коэффициент 2. Таким образом, наибольшее влияние на эффективность гидролиза РНК оказывает расположение остатка гуанозина в структуре РНК-субстрата.
Работа выполнена при поддержке грантов Российского научного фонда (№ 19-74-10034, дизайн и синтез РНК-субстратов, анализ ферментативного процесса методами гель-электрофореза и остановленного потока) и Российского фонда фундаментальных исследований (№ 17-00-00060), при частичной поддержке бюджетного финансирования для обеспечения регламентных работ на использованном оборудовании (№ АААА-А17-117020210022-4), а также в рамках программы повышения конкурентоспособности ФГАОУ ВО “Казанский (Приволжский) федеральный университет”.
В работе не использованы люди и животные в качестве объектов исследования.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ulyanova V., Vershinina V., Ilinskaya O. (2011) Barnase and binase: twins with distinct fates. FEBS J. 278(19), 3633–3643.
Yoshida H. (2001) The ribonuclease T1 family. Methods Enzymol. 341, 28–41.
Okorokov A.L., Panov K.I., Offen W.A., Mukhortov V.G., Antson A.A., Karpeisky M.Ya., Wilkinson A.J., Dodson G.G. (1997) RNA cleavage without hydrolysis. Splitting the catalytic activities of binase with Asn101 and Thr101 mutations. Protein Eng. 10(3), 273–278.
Сокуренко Ю.В., Зеленихин П.В., Ульянова В.В., Колпаков А.И., Мюллер Д., Ильинская О.Н. (2015) Идентификация 2',3'-cGMP как интермедиата каталитического расщепления РНК биназой и оценка его биологического действия Биоорган. химия. 41(1), 37–43.
Зеленихин П.В., Мохамед И.С., Надырова А.И., Сироткина А.А., Ульянова В.В., Миронова Н.Л., Миткевич В.А., Макаров А.А., Зенкова М.А., Ильинская О.Н. (2020) Рибонуклеаза Bacillus pumilus ингибирует миграцию клеток аденокарциномы двенадцатиперстной кишки человека HuTu 80. Молекуляр. биология. 54(1), 146–152.
Shah Mahmud R., Mostafa A., Müller C., Kanrai P., Ulyanova V., Sokurenko Y., Dzieciolowski J., Kuznet-sova I., Ilinskaya O., Pleschka S. (2018) Bacterial ribonuclease binase exerts an intra-cellular anti-viral mode of action targeting viral RNAs in influenza a virus-infected MDCK-II cells. Virol. J. 15, 5.
Mitkevich V.A., Burnysheva K.M., Petrushanko I.Y., Adzhubei A.A., Schulga A.A., Chumakov P.M., Makarov A.A. (2017) Binase treatment increases interferon sensitivity and apoptosis in SiHa cervical carcinoma cells by downregulating E6 and E7 human papilloma virus oncoproteins. Oncotarget. 8(42), 72666–72675.
Zhang Z., Ohto U., Shibata T., Taoka M., Yamauchi Y., Sato R., Shukla N.M., David S.A., Isobe T., Miyake K., Shimizu T. (2018) Structural analyses of Toll-like receptor 7 reveal detailed RNA sequence specificity and recognition mechanism of agonistic ligands. Cell Rep. 25(12), 3371–3381. e5.
Jackson E.K., Mi Z., Janesko-Feldman K., Jackson T.C., Kochanek P.M. (2019) 2',3'-cGMP exists in vivo and comprises a 2',3'-cGMP-guanosine pathway. Am. J. Physiol. Regul. Integr. Comp. Physiol. 316(6), R783–R790.
Van Damme T., Blancquaert D., Couturon P., Van Der Straeten D., Sandra P., Lynen F. (2014) Wounding stress causes rapid increase in concentration of the naturally occurring 2',3'-isomers of cyclic guanosine- and cyclic adenosine monophosphate (cGMP and cAMP) in plant tissues. Phytochemistry. 103, 59–66.
Deswarte J., De Vos S., Langhorst U., Steyaert J., Loris R. (2001) The contribution of metal ions to the conformational stability of ribonuclease T1: crystal versus solution. Eur. J. Biochem. 268(14), 3993–4000.
Sokurenko Y., Ulyanova V., Zelenikhin P., Kolpakov A., Blokhin D., Müller D., Klochkov V., Ilinskaya O. (2016) The role of metals in the reaction catalyzed by metal-ion-independent bacillary RNase. Bioinorg. Chem. Appl. 2016, 4121960.
Кузнецова A.A., Новопашина Д.С., Федорова O.С., Кузнецов Н.A. (2020) Влияние структуры субстрата и ионов металлов на эффективность гидролиза неповрежденной РНК апуриновой/апиримидиновой эндонуклеазой человека APE1. Acta Naturae. 12(2), 4–15.
Miroshnikova A.D., Kuznetsova A.A., Vorobjev Y.N., Kuznetsov N.A., Fedorova O.S. (2016) Effects of mono- and divalent metal ions on DNA binding and catalysis of human apurinic/apyrimidinic endonuclease 1. Mol. BioSyst. 12(5), 1527–1539.
Duguid J., Bloomfield V.A., Benevides J., Thomas G.J. (1993) Raman spectral studies of nucleic-acids. Biophys. J. 65(5), 1916–1928.
Hackl E.V., Kornilova S.V., Blagoi Y.P. (2005) DNA structural transitions induced by divalent metal ions in aqueous solutions. Int. J. Biol. Macromol. 35(3–4), 175–191.
Shannon R.D. (1976) Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. Acta Cryst. 32, 751–767.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология