Молекулярная биология, 2020, T. 54, № 6, стр. 990-996
Новые микроРНК как потенциальные регуляторы контрольной точки иммунитета PD-1/PD-L1, и прогностический потенциал метилирования MIR9-1 и MIR124-2 при раке яичников
Н. Е. Кушлинский a, В. И. Логинов b, c, Д. О. Уткин a, Е. А. Филиппова b, А. М. Бурдённый b, Е. А. Короткова a, И. В. Пронина b, С. С. Лукина b, А. В. Смирнова d, Е. С. Герштейн a, Э. А. Брага b, c, *
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина Министерства здравоохранения Российской Федерации
115478 Москва, Россия
b Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, Россия
c Медико-генетический научный центр им. акад. Н.П. Бочкова
115478 Москва, Россия
d Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации
119435 Москва, Россия
* E-mail: eleonora10_45@mail.ru
Поступила в редакцию 22.06.2020
После доработки 03.07.2020
Принята к публикации 05.07.2020
Аннотация
Рак яичников (РЯ) чаще всего выявляют на поздних стадиях, осложненных метастазированием, и уровень пятилетней выживаемости пациенток составляет всего 30%, что диктует необходимость разработки более щадящих и избирательно направленных препаратов в сравнении с химиотерапевтическими средствами. Стал актуален поиск факторов, способных влиять на активность сигнального пути контрольной точки иммунитета PD-1/PD-L1 в опухолях, среди которых важную роль играют микроРНК (miРНК). За последние 5 лет открыто только несколько miРНК (miR-34a, miR-145 и miR-424), которые оказывают регулирующее воздействие на систему PD-1/PD-L1 у больных РЯ. В представленной работе определены уровни метилирования 13 генов miРНК в 26 первичных опухолях и 19 перитонеальных метастазах больных РЯ и сопоставлены с содержанием растворимой формы PD-L1 (sPD-L1) в плазме крови тех же пациенток. Показано, что уровни метилирования генов пяти miРНК: miR-124-2, miR-34b/c, miR-9-1, miR-9-3 и miR-339 ‒ в опухолях находятся в прямой корреляции с содержанием sPD-L1 в плазме крови. Кроме того, при анализе этих пяти генов, определена значимая ассоциация уровня метилирования гена miR-9-1 (MIR9-1) и, на уровне тенденции, miR-124-2 (MIR124-2) со снижением трехлетней безрецидивной выживаемости больных РЯ. Таким образом, получены первые данные, позволяющие предполагать роль ингибиторов контрольной точки иммунитета sPD-L1 для пяти miРНК (miR-124, miR-34b, miR-34c, miR-9, miR-339) и возможность использования гиперметилированных генов MIR9-1 и, предположительно, MIR124-2 в качестве самостоятельных прогностических маркеров плохой безрецидивной выживаемости больных РЯ.
Рак яичников (РЯ) развивается бессимптомно вплоть до запущенных стадий, которые отличаются обширным метастазированием и образованием асцита, что снижает до 30% уровень пятилетней выживаемости пациенток. Для повышения эффективности лечения РЯ необходима разработка более щадящих и избирательно направленных препаратов в сравнении с классическими химиотерапевтическими средствами. Взаимодействие между рецептором программируемой клеточной смерти PD-1 (programmed cell death protein 1) и его лигандом PD-L1 (programmed death ligand 1) ‒ ключевая контрольная точка иммунитета, которую используют опухолевые клетки для уклонения от иммунного ответа [1]. Блокада контрольной точки иммунитета PD-1/PD-L1 усиливает противоопухолевый иммунитет за счет подавления регуляторных (супрессорных) T-клеток и восстановления эффекторных T-клеток [2]. Препараты, подавляющие функции PD-1/PD-L1, уже находят широкое применение при лечении ряда онкологических заболеваний, например, рака почки и меланомы [2, 3].
В настоящее время актуален поиск новых механизмов и факторов, способных влиять на содержание PD-1/PD-L1 в опухолях, среди которых важную роль могут играть микроРНК (miРНК), ингибирующие экспрессию генов на посттранскрипционном уровне. Анализ опухолей разного происхождения позволил идентифицировать группы miРНК, непосредственно взаимодействующие с 3′-регионом мРНК PD-1 (miR-28, -138, -4717) или с мРНК PD-L1 (например, miR-15a/b, -138, -142, -424, -513) [4]. Интересно, что обнаружено также влияние некоторых miРНК на систему PD-1/PD-L1 при посредничестве таких сигнальных белков, как PTEN, IFR-1 [4] или c-Myc через ось miR-145/c-Myc/PD-L1 [5].
Ранее нами выявлена сильная положительная корреляция между метилированием и снижением уровня экспрессии генов 12 miРНК при РЯ [6] и высказано предположение, что метилирование служит критерием инактивации этих генов. Кроме того, на основе метилирования генов miРНК мы идентифицировали новые потенциальные маркеры для диагностики и прогноза метастазирования РЯ [7]. Важно отметить, что в этой работе 19 из 26 (73%) образцов РЯ было получено от пациенток с тяжелой III стадией с множественными метастазами по брюшине ‒ когда содержание циркулирующих в крови фрагментов ДНК и РНК может отражать их содержание в ткани опухоли.
Цель представленной работы – оценить связь уровня метилирования группы генов miРНК в опухолях и перитонеальных метастазах больных РЯ с содержанием растворимой формы PD-L1 (sPD-L1) в плазме крови, чтобы выявить новые miРНК, вовлеченные в регуляцию экспрессии PD-L1. Важно отметить, что на настоящий момент опубликовано только четыре работы по идентификации miРНК, регулирующих PD-L1 у больных РЯ [5, 8‒10].
Кроме того, в последнее время для более эффективного прогноза и лечения больных РЯ проводится широкий скрининг генов и некодирующих РНК для выявления потенциальных маркеров общей и безрецидивной выживаемости. Так, с привлечением мета-анализа установлено высокое прогностическое значение уровня экспрессии miR-200c [11]. В связи с важностью прогноза выживаемости для выбора тактики лечения больных РЯ в задачи представленной работы включена оценка прогностического потенциала гиперметилируемых генов miРНК в отношении безрецидивной выживаемости исследованных пациенток. В мировой литературе есть публикации как по гиперметилированным генам, кодирующим белки, так и по высокоэкспрессируемым miРНК со значимым прогностическим потенциалом в отношении общей и безрецидивной выживаемости больных РЯ [11, 12]. Однако работ, в которых проанализирована возможность применения уровня метилирования генов miРНК как маркера выживаемости больных РЯ, пока нет (PubMed, 20.06.2020).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материал исследования. Исследованы образцы первичных опухолей (26), гистологически неизмененных тканей яичников (15) и перитонеальных метастазов (19) больных РЯ, которым проводили обследование и лечение в ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России в период с 2017 по 2020 гг. У всех пациенток клинический диагноз подтвержден данными гистологического исследования первичных опухолей и метастазов РЯ в соответствии с TNM-классификацией Международного противоракового союза и морфологически верифицирован на основании критериев классификации ВОЗ [13]. При морфологическом исследовании удаленных опухолей и метастазов у всех больных выявлена серозная аденокарцинома яичников. У 19 пациенток установлена III, у трех – II и у четырех – I стадия РЯ. Все больные получали комбинированную нео- или адъювантную химиотерапию таксанами и препаратами платины по общепринятым стандартным схемам. Образцы тканей и крови пациенток были взяты до лечения. Для отбора образцов с высоким содержанием опухолевых клеток (не менее 70‒80%) проводили дополнительный гистологический анализ микросрезов (3‒5 мкм), окрашенных гематоксилином-эозином.
Выделение тотальной ДНК. ДНК выделяли из образцов ткани яичников по стандартной методике фенол-хлороформной очистки. ДНК хранили при ‒20°С. Качество и концентрацию ДНК определяли по оптической плотности при длине волны 260 нм на спектрофотометре NanoDrop ND-1000 (“Thermo Fisher Scientific”, США).
Анализ метилирования генов miРНК. Метилирование генов miРНК анализировали методом количественной метилспецифичной ПЦР (МС-ПЦР) с детекцией в реальном времени с применением бисульфитной конверсии ДНК (0.5‒2.0 мкг), как описано ранее [6]. Модифицированную бисульфитом ДНК хранили при ‒20°С и использовали в качестве матрицы в МС-ПЦР в реальном времени по методу, опубликованному в работах [14, 15]. Последовательности олигонуклеотидных праймеров и условия проведения ПЦР генов miРНК подобраны нами ранее [6, 7]. Набор реактивов qPCRmix-HS SYBR (“Евроген”, Россия) использовали в соответствии с рекомендациями производителя. Амплификацию проводили в системе Bio-Rad CFX96 Real-Time PCR Detection System (“Bio-Rad”, США) по протоколу производителя. Для каждой пары праймеров проверяли отсутствие продукта ПЦР на неконвертированной ДНК. В качестве контролей для неметилированных аллелей использовали коммерческий препарат ДНК #G1471 (“Promega”, США). В качестве позитивного контроля 100%-ого метилирования использовали коммерческий препарат ДНК #SD1131 (“Thermo Fisher Scientific”).
Определение концентрации sPD-L1. Концентрацию sPD-L1 в образцах плазмы крови, полученной до начала специфического лечения по стандартной методике в присутствии EDTA, определяли с использованием набора реактивов для прямого иммуноферментного анализа Human PD-L1 Platinum ELISA (“Affimetrix, eBioscience”, США) в соответствии с инструкциями производителя. Измерения проводили на автоматическом иммуноферментном анализаторе BEP 2000 Advance (“Siemens Healthcare Diagnostics”, Германия). Содержание маркеров выражали в пикограммах (пг) на 1 мл плазмы крови.
Статистический анализ. Полученные данные по метилированию генов miРНК обрабатывали, используя в качестве параметра уровня метилирования показатель индекса метилирования (ИМ), который рассчитывали по формуле ИМ = = 100 × М/(M + U), где М ‒ число метилированных копий гена, U ‒ число неметилированных копий гена [16]. Значение ИМ рассчитывали для каждого образца. Статистическую значимость различий уровней метилирования оценивали с применением непараметрического U-теста Манна–Уитни. Корреляционный анализ проводили посредством расчета коэффициента корреляции Спирмена и уровня его значимости.
Расчет выживаемости проведен для 26 пациенток, которые находились под наблюдением в течение 1‒3 лет. Их разделили на две подгруппы по уровню исследуемого маркера. При разбиении пациентов на группы по уровням метилирования генов miРНК использовали медиану и квартили суммарной группы. С учетом результатов по отдаленным наблюдениям были выбраны пороговые уровни, соответствующие нижнему квартилю метилирования исследуемых маркеров. Кривые выживаемости строили по методу Каплана–Мейера. При сравнении двух кривых выживаемости использовали логарифмический ранговый критерий (log-rank test), а также модель Кокса, в основе которой лежит метод множественной регрессии при предположении пропорциональных рисков (Cox’s test). Для всех расчетов значения р < 0.05 считали статистически значимыми. Применяли поправку на множественное сравнение Бенджамини-Хохберга и оценивали величину FDR (false discovery rate, частота ложного обнаружения). Расчеты проводили в системе для статистического анализа данных IBM SPSS Statistics 22.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ ассоциации степени метилирования генов miРНК в опухолях и метастазах больных РЯ с уровнем sPD-L1 в плазме крови
В табл. 1 представлены корреляционные зависимости между содержанием лиганда sPD-L1 в плазме крови и уровнями метилирования 13 генов miРНК в 26 образцах первичных опухолей, 15 образцах неизмененной ткани яичников и 19 перитонеальных метастазах больных РЯ.
Таблица 1.
Корреляционные связи между концентрациями sPD-L1 в плазме крови и уровнями метилирования генов miРНК в тканях больных РЯ
| Ген miРНК | Коэффициент корреляции Спирмена (rs)/p-value | ||
|---|---|---|---|
| Неизмененная ткань яичников (n = 15) | Опухоль яичников (n = 26) | Ткань метастазов (n = 19) |
|
| MIR124-2 | 0.33/0.20 | 0.59/0.002 | 0.10/>0.2 |
| MIR124-3 | 0.23/> 0.2 | 0.03/> 0.2 | 0.04/>0.2 |
| MIR125B1 | ‒0.46/0.06 | 0.13/> 0.2 | ‒0.28/0.20 |
| MIR127 | ‒0.03/> 0.2 | 0.33/0.05 | 0.16/>0.2 |
| MIR129-2 | ‒0.07/> 0.2 | 0.31/0.10 | ‒0.16/>0.2 |
| MIR132 | 0.25/> 0.2 | 0.13/> 0.2 | ‒0.09/>0.2 |
| MIR137 | ‒0.24/> 0.2 | 0.10/> 0.2 | 0.04/>0.2 |
| MIR203А | 0.30/0.20 | 0.03/> 0.2 | ‒0.47/0.04 |
| MIR34B/C | 0.36/ 0.20 | 0.49/0.01 | -0.09/>0.2 |
| MIR375 | 0.19/> 0.2 | ‒0.05/> 0.2 | ‒0.11/>0.2 |
| MIR9-1 | 0.19/> 0.2 | 0.43/0.03 | ‒0.05/>0.2 |
| MIR9-3 | 0.36/0.18 | 0.49/0.01 | ‒0.05/>0.2 |
| MIR339 | 0.42/0.12 | 0.43/0.03 | ‒0.32/0.18 |
Обнаружено, что в исследованных первичных опухолях уровни метилирования пяти генов: MIR124-2, MIR34B/C, MIR9-1, MIR9-3 и MIR339 ‒ статистически значимо ассоциированы с концентрациями sPD-L1 в плазме крови больных РЯ (табл. 1). Основываясь на данных о сильной отрицательной корреляции метилирования с экспрессией этих miРНК при РЯ [6], можно заключить, что уровни экспрессии кодируемых этими генами miРНК: miR-124, miR-34b, miR-34c, miR-9, miR-339 ‒ находятся в обратной зависимости с содержанием sPD-L1. Следовательно, эти miРНК могут играть роль ингибиторов контрольной точки иммунитета PD-L1 при РЯ.
Можно также отметить значимую отрицательную корреляцию между уровнем метилирования гена MIR203A в метастазах и концентрацией sPD-L1 в плазме крови больных РЯ (табл. 1). Эти данные соотносятся с характеристиками гена MIR203A, для которого ранее гиперметилирование выявлено преимущественно среди пациенток с метастазами [6].
Корреляция безрецидивной выживаемости больных РЯ с уровнем метилирования генов miРНК
Проанализирована возможная корреляция трехлетней безрецидивной выживаемости в группе 26 больных РЯ с уровнями метилирования пяти генов miРНК, ассоциированных с экспрессией sPD-L1: MIR124-2, MIR34B/C, MIR9-1, MIR9-3 и MIR339. С учетом результатов по отдаленным наблюдениям отобраны пороговые значения, основанные на нижних квартилях уровней метилирования MIR124-2 и MIR9-1: 30 и 9% соответственно. Зависимость безрецидивной выживаемости от пороговых уровней метилирования генов MIR124-2 и MIR9-1 представлена на рис. 1 и 2 в виде кривых Каплана–Мейера.
Рис. 1.
Кривые Каплана–Мейера безрецидивной выживаемости больных РЯ в зависимости от уровня метилирования гена MIR124-2: меньше 30% и не менее 30%. Пороговые уровни метилирования приведены относительно нижнего квартиля.
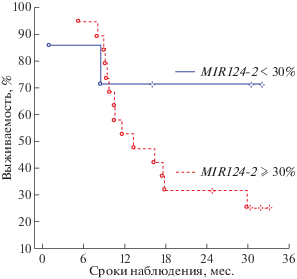
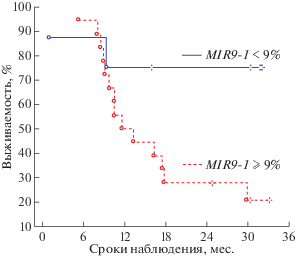
Рис. 2.
Кривые Каплана–Мейера безрецидивной выживаемости больных РЯ в зависимости от уровня метилирования гена MIR9-1: меньше 9% и не менее 9%. Пороговые уровни метилирования приведены относительно нижнего квартиля.
Обнаружено существенное снижение трехлетней безрецидивной выживаемости больных РЯ с повышением уровней метилирования генов MIR124-2 и MIR9-1. При низких (менее нижнего квартиля) уровнях метилирования этих двух генов показатели безрецидивной выживаемости больных РЯ были гораздо выше, чем у больных с высоким уровнем.
Так, в группе с уровнями метилирования MIR124-2 ниже 30% (семь больных) трехлетняя безрецидивная выживаемость была на уровне 70%, а в группе с уровнями метилирования MIR124-2 выше или равной 30% (19 больных) составляла всего 25% (log-rank test p = 0.11; Cox’s test p = 0.02, FDR = 0.02; рис. 1 ).
Более значимо отличалась по уровню трехлетней безрецидивной выживаемости группа с низким уровнем метилирования MIR9-1 (< 9%, 8 больных) от группы c уровнем метилирования выше обозначенного порога (≥ 9%, 18 больных): 75 и 20% соответственно (log-rank test p = 0.04; Cox’s test p = 0.008, FDR = 0.01; рис. 2 ).
Из полученных результатов следует, что высокие уровни метилирования гена MIR9-1 и, предположительно, MIR124-2 в опухолях могут служить самостоятельными прогностическими маркерами неблагоприятного исхода и низкой безрецидивной трехлетней выживаемости больных РЯ. Однако окончательно сформулировать этот вывод можно будет только после проверки на большой выборке образцов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему времени опубликованы только единичные работы по влиянию miРНК на функционирование контрольной точки иммунитета PD-1/PD-L1 в тканях и плазме крови больных РЯ [5, 8‒10]. Так, обнаружено снижение хеморезистентности РЯ в результате ингибирования PD-L1 через прямое связывание miR-424 с 3'-нетранслируемой областью мРНК PD-L1 [9]. В плазме больных РЯ повышенная экспрессия miR-34a была ассоциирована со снижением уровня sPD-L1 (p = = 0.02) [8]. На устойчивых к препарату цисплатину линиях клеток РЯ (SKOV3/DDP и A2780/DDP) подтверждено прямое связывание miR-34a с PD-L1, которое приводило к снижению устойчивости клеток к химиотерапии [10]. Кроме того, найдено, что miR-145 тоже снижает содержание PD-L1 при посредничестве c-Myc [5]. Таким образом, в исследованиях miРНК на клеточных линиях РЯ, а также в тканях и плазме больных РЯ, представленных в мировой литературе за последние 5 лет, идентифицированы miR-34a и miR-424, ингибирующие PD-L1 через прямое взаимодействие, и miR-145 – через ось miR-145/c-Myc/PD-L1 [5, 8‒10]. Недавно в клетках опухоли РЯ обнаружено влияние miR-654 на PD-L1 через цепь взаимодействий EMX2OS/miR-654/AKT3/PD-L1, в которых кроме miРНК участвует онкогенная длинная некодирующая РНК EMX2OS, что усиливает проопухолевую активность PD-L1 [17]. Ингибирующие эффекты cупрессорных miРНК на уровень мРНК PD-L1 способствуют повышению чувствительности больных РЯ к химиотерапии.
В проведенном нами исследовании впервые показано, что степень метилирования пяти генов miРНК: MIR124-2, MIR34B/C, MIR9-1, MIR9-3 и MIR339 ‒ в образцах опухолей больных РЯ находится в положительной корреляции с содержанием sPD-L1 в плазме крови этих пациенток. В соответствии с данными о сильной отрицательной корреляции метилирования с экспрессией генов этих miРНК при РЯ [6] логично предположить, что уровни этих miРНК, напротив, находятся в обратной зависимости с содержанием sPD-L1 в плазме крови этих больных. Таким образом, кодируемые этими генами miРНК: miR-124, miR-34b, miR-34c, miR-9, miR-339 ‒ могут быть ингибиторами лиганда контрольной точки иммунитета PD-L1.
Кроме того, в исследованных образцах опухолей РЯ нами выявлена значимая корреляция между высокими уровнями метилирования гена MIR9-1 и, на уровне тенденции, гена MIR124-2 и низкой безрецидивной выживаемостью больных. Таким образом, высокие уровни метилирование гена MIR9-1 и, предположительно, MIR124-2 в опухолях РЯ могут служить самостоятельными прогностическими маркерами неблагоприятного исхода и низкой безрецидивной выживаемости больных РЯ. Эти результаты, безусловно, требуют подтверждения на большой выборке больных, но следует учитывать, что это первые данные по выявлению роли метилирования генов miРНК как маркеров выживаемости при РЯ.
Интересно отметить, что новые маркеры общей и безрецидивной выживаемости больных РЯ обнаружены за последние 5 лет при анализе экспрессии некоторых длинных некодирующих РНК: HOXD-AS1 (HOXD cluster antisense RNA 1) через оси HOXD-AS1/miR-608/FZD4 и HOXD-AS1/miR-186-5p/PIK3R3 [18, 19] или PVT1 (plasmocytoma variant translocation 1) при посредничестве ряда miРНК (miR-133a, miR-214, miR-140 и miR-543), в частности через ось PVT1/miR-543/SERPINI1 [20‒23].
В целом, полученные нами данные ‒ свидетельство важной роли метилирования генов регуляторных онкосупрессорных miРНК в опухолях больных РЯ. Гиперметилирование подавляет их экспрессию, а значит и ингибирование их проопухолевых генов-мишеней. Так, нами показано, что повышенное метилирование пяти генов miРНК: MIR124-2, MIR34B/C, MIR9-1, MIR9-3 и MIR339 ‒ коррелирует с усилением экспрессии лиганда контрольной точки иммунитета ‒ PD-L1, что может быть связано со снижением экспрессии этих miРНК. Кроме того, нами обнаружено, что высокий уровень метилирования генов MIR124-2 и MIR9-1, кодирующих важные онкосупрессорные miРНК, ассоциирован с низкой безрецидивной выживаемостью больных РЯ.
Работа выполнена за счет средств Российского научного фонда (грант № 20-15-00368); часть исследований, а именно анализ уровня sPD-L1 в плазме крови больных, ‒ в рамках Государственного задания Минобрнауки РФ на 2020 год.
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. У всех пациентов получено письменное информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Omar H.A., El-Serafi A.T., Hersi F., Arafa E.A., Zaher D.M., Madkour M., Arab H.H., Tolba M.F. (2019) Immunomodulatory microRNAs in cancer: targeting immune checkpoints and the tumor microenvironment. FEBS J. 286(18), 3540–3557. https://doi.org/10.1111/febs.15000
Кушлинский Н.Е., Фридман М.В., Морозов А.А., Герштейн Е.С., Кадагидзе З.Г., Матвеев В.Б. (2018) Современные подходы к иммунотерапии рака почки. Онкоурология. 14(2), 54–67.
Коротаева А.А., Апанович Н.В., Брага Э.А., Матвеев В.Б., Карпухин А.В. (2019) Современные достижения в иммунотерапии рака почки. Онкоурология. 15(4), 30–38.
Wang Q., Lin W., Tang X., Li S., Guo L., Lin Y., Kwok H.F. (2017) The roles of microRNAs in regula-ting the expression of PD-1/PD-L1 immune checkpoint. Int. J. Mol. Sci. 18(12). pii: E2540. https://doi.org/10.3390/ijms18122540
Sheng Q., Zhang Y., Wang Z., Ding J., Song Y., Zhao W. (2020) Cisplatin-mediated down-regulation of miR-145 contributes to up-regulation of PD-L1 via the c-Myc transcription factor in cisplatin-resistant ovarian carcinoma cells. Clin. Exp. Immunol. 200(1), 45‒52. https://doi.org/10.1111/cei.13406
Loginov V.I., Pronina I.V., Burdennyi A.M., Filippova E.A., Kazubskaya T.P., Kushlinsky D.N., Utkin D.O., Khodyrev D.S., Kushlinskii N.E., Dmitriev A.A., Braga E.A. (2018) Novel miRNA genes deregulated by aberrant methylation in ovarian carcinoma are involved in metastasis. Gene. 662, 28‒36. https://doi.org/10.1016/j.gene.2018.04.005
Braga E.A., Loginov V.I., Burdennyi A.M., Filippova E.A., Pronina I.V., Kurevlev S.V., Kazubskaya T.P., Kushlinskii D.N., Utkin D.O., Ermilova V.D., Kushlinskii N.E. (2018) Five hypermethylated microRNA genes as potential markers of ovarian cancer. Bull. Exp. Biol. Med. 164(3), 351‒355. https://doi.org/10.1007/s10517-018-3988-y
Koukourakis M.I., Kontomanolis E., Sotiropoulou M., Mitrakas A., Dafa E., Pouliliou S., Sivridis E., Giatromanolaki A. (2018) Increased soluble PD-L1 levels in the plasma of patients with epithelial ovarian cancer correlate with plasma levels of miR34a and miR200. Anticancer Res. 38(10), 5739‒5745. https://doi.org/10.21873/anticanres.12912
Xu S., Tao Z., Hai B., Liang H., Shi Y., Wang T., Song W., Chen Y., OuYang J., Chen J., Kong F., Dong Y., Jiang S.W., Li W., Wang P., Yuan Z., Wan X., Wang C., Li W., Zhang X., Chen K. (2016) miR-424(322) rever-ses chemoresistance via T-cell immune response activation by blocking the PD-L1 immune checkpoint. Nat. Commun. 7, 11406. https://doi.org/10.1038/ncomms11406
Zuo Y., Zheng W., Liu J., Tang Q., Wang S.S., Yang X.S. (2020) MiR-34a-5p/PD-L1 axis regulates cisplatin chemoresistance of ovarian cancer cells. Neoplasma. 67(1), 93‒101. https://doi.org/10.4149/neo_2019_190202N106
Shi C., Zhang Z. (2016) The prognostic value of the miR-200 family in ovarian cancer: a meta-analysis. Acta Obstet. Gynecol. Scand. 95(5), 505‒512. https://doi.org/10.1111/aogs.12883
Xia L., Zhang W., Gao L. (2019) Clinical and prognostic effects of CDKN2A, CDKN2B and CDH13 promoter methylation in ovarian cancer: a study using meta-analysis and TCGA data. Biomarkers. 24(7), 700‒711. https://doi.org/10.1080/1354750X.2019.1652685
(2014) WHO Classification of Tumours of Female Reproductive Organs. Eds Kurman R.J., Carcangiu M.L., Herrington C.S., Young R.H., 4th edition. Lyon, IARC.
Hattermann K., Mehdorn H.M., Rolf Mentlein R., Schultka S., Held-Feindt J. (2008) A methylation-specific and SYBR-green-based quantitative polymerase chain reaction technique for O6-methylguanine DNA methyltransferase promoter methylation analysis. Anal. Biochem. 377(1), 62‒71. https://doi.org/10.1016/j.ab.2008.03.014
Panagopoulou M., Karaglani M., Balgkouranidou I., Biziota E., Koukaki T., Karamitrousis E., Nena E., Tsamardinos I., Kolios G., Lianidou E., Kakolyris S., Chatzaki E. (2019) Circulating cell-free DNA in breast cancer: size profiling, levels, and methylation patterns lead to prognostic and predictive classifiers. Oncogene. 38(18), 3387‒3401. https://doi.org/10.1038/s41388-018-0660-y
van Hoesel A.Q., Sato Y., Elashoff D.A., Turner R.R., Giuliano A.E., Shamonki J.M., Kuppen P.J., van de Velde C.J., Hoon D.S. (2013) Assessment of DNA methylation status in early stages of breast cancer development. Br. J. Cancer. 108(10), 2033‒2038.
Duan M., Fang M., Wang C., Wang H., Li M. (2020) LncRNA EMX2OS induces proliferation, invasion and sphere formation of ovarian cancer cells via regulating the miR-654-3p/AKT3/PD-L1 axis. Cancer Manag. Res. 12, 2141‒2154. https://doi.org/10.2147/CMAR.S229013
Wang Y., Zhang W., Wang Y., Wang S. (2018) HOXD-AS1 promotes cell proliferation, migration and invasion through miR-608/FZD4 axis in ovarian cancer. Am. J. Cancer Res. 8(1), 170‒182.
Dong S., Wang R., Wang H., Ding Q., Zhou X., Wang J., Zhang K., Long Y., Lu S., Hong T., Ren H., Wong K., Sheng X., Wang Y., Zeng Y. (2019) HOXD-AS1 promotes the epithelial to mesenchymal transition of ova-rian cancer cells by regulating miR-186-5p and PIK3R3. J. Exp. Clin. Cancer Res. 38(1), 110. https://doi.org/10.1186/s13046-019-1103-5
Yang Q., Yu Y., Sun Z., Pan Y. (2018) Long non-coding RNA PVT1 promotes cell proliferation and invasion through regulating miR-133a in ovarian cancer. Biomed. Pharmacother. 106, 61–67. https://doi.org/10.1016/j.biopha.2018.06.112
Chen Y., Du H., Bao L., Liu W. (2018) LncRNA PVT1 promotes ovarian cancer progression by silencing miR-214. Cancer Biol. Med. 15(3), 238‒250. https://doi.org/10.20892/j.issn.2095-3941.2017.0174
Ding Y., Fang Q., Li Y., Wang Y. (2019) Amplification of lncRNA PVT1 promotes ovarian cancer proliferation by binding to miR-140. Mamm. Genome. 30(7‒8), 217‒225. https://doi.org/10.1007/s00335-019-09808-1
Qu C., Dai C., Guo Y., Qin R., Liu J. (2020) Long non-coding RNA PVT1-mediated miR-543/SERPINI1 axis plays a key role in the regulatory mechanism of ovarian cancer. Biosci. Rep. 40(6), BSR20200800. https://doi.org/10.1042/BSR20200800
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


