Молекулярная биология, 2020, T. 54, № 6, стр. 1018-1028
Действие донора сероводорода GYY4137 и белка HSP70 на активацию клеток SH-SY5Y липополисахаридами
М. М. Юринская a, Д. Г. Гарбуз b, В. Н. Афанасьев a, М. Б. Евгеньев a, b, *, М. Г. Винокуров a
a Институт биофизики клетки Российской академии наук – обособленное подразделение исследовательского центра “Пущинский научный центр биологических исследований Российской академии наук”
142290 Московская обл., Пущино, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: misha672011@yahoo.com
Поступила в редакцию 06.05.2020
После доработки 20.05.2020
Принята к публикации 26.05.2020
Аннотация
Изучено влияние экзогенного рекомбинантного белка теплового шока человека Hsp70 и донора сероводорода GYY4137 на механизмы эндоцитоза липополисахарида (ЛПС) клетками нейробластомы человека SH-SY5Y. Показано, что Hsp70 и GYY4137 значительно снижают ЛПС-индуцированную продукцию медиаторов воспаления, включая активные формы кислорода, оксид азота, TNFα, IL-1β и IL-6, клетками SH-SY5Y. И рекомбинантный Hsp70, и донор сероводорода GYY4137 защищают клетки от воздействия ЛПС, однако совместное использование этих агентов не приводило к кумулятивному эффекту. Показано, что в защите клеток от ЛПС-индуцированной продукции активных форм кислорода и NO как донором сероводорода, так и Hsp70 участвуют пиноцитоз, а также клатрин-, кавеолин-, тубулин- и рецепторзависимый эндоцитоз.
ВВЕДЕНИЕ
Липополисахариды (ЛПС) – компоненты клеточной стенки грамотрицательных энтеробактерий, являющиеся мощным индуктором воспаления, играют важную роль в патогенезе различных заболеваний, таких как грамотрицательный сепсис [1], сахарный диабет [2], нейродегенеративные заболевания [3]. При этих заболеваниях наблюдается развитие эндотоксемии – увеличение концентрации ЛПС в крови больных [3]. Сепсис часто осложняется энцефалопатией, при которой нарушается проницаемость гематоэнцефалического барьера и наблюдается повреждение нейронов [4].
Известно, что за распознавание ЛПС отвечают такие клеточные рецепторы, как TLR4, экспрессирующиеся в нейтрофилах, макрофагах, клетках микроглии, астроцитах, нейронах, кардиомиоцитах [5]. Ключевую роль в реакции клеток-мишеней на ЛПС играет формирование мембранного гетеродимерного рецепторного комплекса (TLR4-MD-2-ЛПС)2 [6]. Затем к этому комплексу присоединяется группа цитоплазматических адаптерных белков, которые обеспечивают передачу сигнала активации от рецептора к нескольким внутриклеточным сигнальным путям, включая различные протеинкиназы. На следующем этапе эти сигналы достигают факторов транскрипции, таких как NF-κB и AP-1, что, в конечном итоге, проявляется в увеличении продукции активных форм кислорода (АФК), оксида азота (NO), секреции различных провоспалительных цитокинов и нарушении регуляции клеточной гибели нейронов [1, 4, 7]. При шоке, часто осложняющем грамотрицательный сепсис, увеличивается накопление Hsp70 в плазме крови больных [8].
Свойства белка Hsp70 в большинстве случаев изучают по действию эндогенного Hsp70, который проявляет шаперонные свойства, регулирует гомеостаз и участвует в сборке и переносе клеточных белков через мембраны в различные отделы клеток [9]. Определенные сведения получены и по действию внеклеточного Hsp70 (вHsp70), но они носят противоречивый характер. В одних статьях показано, что вHsp70 обладает противовоспалительными свойствами, тогда как в других утверждается, что вHsp70 может усиливать воспаление [9, 10].
Ранее мы установили, что рекомбинантный вHsp70 увеличивает выживаемость животных в модели грамотрицательного и грамположительного сепсиса [11, 12], а также защищает нейтрофилы от активации, вызванной ЛПС [13, 14]. Анализ опубликованных данных позволяет заключить, что воздействие вHsp70 на клетки может реализоваться с использованием нескольких механизмов. вHsp70 вызывает экспрессию цитокинов в различных клеточных культурах, причем обнаружен ряд рецепторов, участвующих в интернализации вHsp70 (в том числе, TLR2, TLR4, CD14, CD40 и CCR5) [15].
Как ЛПС, так и вHsp70 поступают в клетки с помощью эндоцитоза [16–18]. Для ЛПС это, в первую очередь, рецепторзависимый эндоцитоз. Помимо этого, ЛПС попадают в клетки путем клатринзависимого эндоцитоза и макропиноцитоза. Эти механизмы обеспечивают быстрое проникновение ЛПС в макрофаги [16, 17]. C клатрином может взаимодействовать и конститутивно экспрессируемый Hsc70, однако в опухолевых клетках уровень Hsp70 поддерживается клатриннезависимым эндоцитозом [18].
В настоящее время отсутствуют эффективные средства лечения эндотоксинового шока и других заболеваний, связанных с действием ЛПС. За последние годы показано, что одним из потенциальных средств защиты клеток и организма млекопитающих от действия ЛПС может быть сероводород (H2S), образующийся в клетках млекопитающих и участвующий в регуляции ряда физиологических и патофизиологических процессов [19]. Есть данные, что сероводород увеличивает выживаемость животных при сепсисе [20]. Среди различных доноров активной серы большой интерес представляет медленный донор сероводорода – GYY4137 [21]. В настоящее время известно, что GYY4137 уменьшает ЛПС-индуцированное увеличение уровня цитокинов TNFα, IL-1β, IL-6, образование NO, С-реактивного белка, синтез которых увеличивается при эндотоксиновом шоке [22].
Ранее на разных клеточных и животных моделях мы показали, что рекомбинантный Hsp70 обладает противовоспалительной активностью и защищает клетки от действия ЛПС [12, 13, 23].
Данные о комбинированном использовании вHsp70 и доноров активной серы для защиты клеток человека и животных от бактериальных эндотоксинов отсутствуют, хотя получены свидетельства того, что повышение уровня сероводорода в клетке может приводить к индукции Hsp70 [24].
В нашей работе охарактеризовано действие донора сероводорода GYY4137 на клетки нейробластомы человека SH-SY5Y, подвергнутые воздействию ЛПС и рекомбинантного белка Hsp70. Оценена роль путей эндоцитоза при реализации защитного действия как GYY4137, так и рекомбинантного Hsp70 на ЛПС-индуцированную продукцию АФК и оксида азота клетками SH-SY5Y.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. В работе использовали культуральную среду DMEM, флуоресцентный зонд SF7-AM, HEPES, L-глутамин, фосфатно-солевой буфер (PBS), краситель Crystal Violet, краситель нитросиний тетразолий (НСТ), краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (MTT), актиномицин D, додецилсульфат натрия, пенициллин, стрептомицин, диметилсульфоксид (ДМСО), раствор трипсина-Версена, реактив Грисса, L-NAME (гидрохлорид), ЛПС из Escherichia coli O55:B5, GYY4137 (морфолин-4-иум(4-метоксифенил)морфолин-4-илфосфинодитиоат)) (“Sigma-Aldrich”, США), эмбриональную сыворотку крупного рогатого скота (ЭТС), тестированную на присутствие эндотоксина 0.01 ед./мл (“HyClone”, США), динасор, амилорид, метил-β-циклодекстрин (MβCD), нокодазол, филипин (“Sigma-Aldrich”, США).
Получение Hsp70. Использовали рекомбинантный Hsp70 человека с пятью аминокислотными заменами, повышающими растворимость и стабильность белка [25]. Белок экспрессировали в бактериальной культуре с использованием конструкции на основе вектора pET-14b. Hsp70 очищали методом металл-аффинной хроматографии на Ni-NTA-сефарозе и аффинной хроматографии на АТР-агарозе. Дополнительную доочистку препаратов Hsp70 от остаточного ЛПС проводили на полимиксин- или полилизин-агарозе, степень очистки контролировали с помощью электрофореза в полиакриламидном геле (ПААГ) и LAL-теста согласно инструкции производителя. Концентрацию очищенного белка измеряли по методу Брэдфорда (Pierce Coomassie (Bradford) Protein Assay Kit).
Культуры клеток. Клетки нейробластомы человека SH-SY5Y получены из Европейской коллекции аутентичных клеточных культур (ECACC), фибробласты L-929 мыши – из коллекции клеточных культур Института цитологии РАН (Санкт-Петербург, Россия). Клетки выращивали в культуральной среде (КС) DMEM c добавлением 10% термоинактивированной ЭТС, 2 мМ L-глутамина, 1% стрептомицина, 100 ед. пенициллина при 37°C в атмосфере с 5% CO2. Hsp70 в диапазоне концентраций от 10 до 300 нМ не влиял на жизнеспособность клеток.
В экспериментах, в которых исследовали действие Hsp70, GYY4137 и ЛПС на клетки нейробластомы SН-SY5Y, клетки собирали с использованием раствора трипсина-Версена, отмывали в полной КС, разводили в КС с 10% ЭТС до требуемой концентрации, рассевали в 24-луночные планшеты (“Sarstedt”, Германия) с повышенной адгезией и инкубировали в течение 24 ч при 37°C с 5% CO2. После этого к клеткам добавляли Hsp70, GYY4137 или (Hsp70 + GYY4137) на 120 мин, а затем ЛПС и инкубировали в течение 24 ч.
Ингибиторный анализ. Ингибиторы эндоцитоза добавляли к клеткам за 30 мин до введения Hsp70 и GYY4137 [26]. Для определения оптимальных и нетоксичных концентраций ингибиторов предварительно получали их концентрационные зависимости (данные не представлены).
В табл. 1 приведены ингибиторы эндоцитоза [27], использованные в нашей работе.
Таблица 1.
Ингибиторы эндоцитоза
| Ингибитор | Клеточная мишень |
|---|---|
| Метил-β-циклодекстрин (MβCD) | Липидные микродомены (рафты), вызывает экстракцию мембранного холестерина и разрушение липидных микродоменов |
| Динасор | Клатринзависимый эндоцитоз, ингибитор разных видов динамина (динамин I и II), участвует в отщеплении эндоцитозной везикулы от цитоплазматической мембраны |
| Амилорид | Макропиноцитоз, фагоцитоз Ингибирует Na+/H+-антипортер |
| Нокодазол | Тубулинзависимый эндоцитоз связывается с тубулином, препятствуя полимеризации микротрубочек |
| Филипин | Кавеолин-опосредованный эндоцитоз, связывается с холестерином в мембране |
Жизнеспособность клеток контролировали с использованием MTT-теста [28]. Клетки SH-SY5Y (2 × 104 клеток/лунка 96-луночного планшета в 100 мкл 10% КС) культивировали в течение 24 ч при 37°С и 5% СО2. После этого КС заменяли свежей средой, добавляли GYY4137 в различной концентрации. Клетки культивировали в течение 24 ч, а затем с 1 мг/мл МТТ в течение 2 ч при комнатной температуре. Раствор красителя удаляли, образовавшиеся кристаллы формазана растворяли в 100 мкл ДМСО на лунку. Оптическую плотность полученного раствора измеряли при длине волны 530 нм на планшетном ридере “Униплан” (“Вектор-Бест”, Россия).
Жизнеспособность клеток в экспериментальных пробах была не менее 96–99%.
Образование сероводорода в клетках. Образование H2S под действием донора сероводорода GYY4137 определяли на проточном цитометре CytoFLEX (“Beckman Coulter”, США) с использованием флуоресцентного зонда SF7-AM [29]. Показано, что добавление GYY4137 приводило к высвобождению H2S в клетках SH-SY5Y, что полностью соответствует результатам, приведенным в [28].
Образование активных форм кислорода (АФК) в клетках SH-SY5Y определяли с помощью красителя НСТ [14]. Использованный метод отражает активность кислородзависимого клеточного метаболизма – источника АФК. По окончании культивирования из планшетов с клетками отбирали КС, промывали PBS и добавляли 0.1%-ный раствор НСТ (2 ч при 37°С и 5% СО2). Затем клетки 2 раза отмывали PBS, фиксировали этанолом и сушили. Образовавшийся внутриклеточный формазан растворяли в 300 мкл 2 М КОН и 400 мкл ДМСО на лунку. Оптическую плотность полученного раствора измеряли при длине волны 620 нм на планшетном ридере “Униплан” (“Вектор-Бест”).
Продукцию оксида азота клетками оценивали с использованием реактива Грисса [13]. После инкубации клеток с исследуемыми веществами аликвоты каждого супернатанта (100 мкл) переносили в 96-луночные планшеты с плоским дном. После добавления реагента Грисса (100 мкл) в каждую лунку планшеты инкубировали при комнатной температуре в течение 10 мин в темноте и измеряли оптическую плотность при 530 нм с использованием планшетного ридера “Униплан” (“Вектор-Бест”). Специфичность образования NO контролировали с использованием L-NAME (гидрохлорида).
Продукцию TNFα клетками определяли по цитотоксическому действию образцов на клетки-мишени – линию фибробластов L-929 мыши [28]. Клетки L-929 культивировали в 96-луночных планшетах по 2 × 104 в 100 мкл КС на лунку при 37°С и 5% СO2. Через 24 ч культивирования к образовавшемуся монослою клеток L-929 добавляли актиномицин D (1 мкг/мл), а затем по 100 мкл супернатанта исследуемых клеток. К контрольным лункам добавляли только культуральную среду. Планшеты инкубировали в течение 24 ч, затем клетки отмывали фосфатным буфером, окрашивали красителем Crystal Violet (“Sigma-Aldrich”, США) и определяли выживаемость клеток после растворения кристаллов в 1%-ном растворе додецилсульфата натрия. Оптическую плотность измеряли при 595 нм на планшетном ридере “Униплан” (“Вектор-Бест”). Продукцию TNFα определяли по индексу цитотоксичности [30]. Специфичность цитотоксического действия TNFα проверяли в реакции нейтрализации моноклональными антителами (“StressGen”, Канада).
Определение уровня интерлейкинов (IL). Уровни IL-1β и IL-6 в клетках SH-SY5Y, обработанных Hsp70, GYY4137 и ЛПС, определяли с использованием иммуноферментного анализа (ELISA). Клетки обрабатывали GYY4137, Hsp70 и ЛПС или их комбинациями в течение 24 ч. Бесклеточные супернатанты собирали для определения концентрации цитокинов с использованием набора для ELISA (наборы ELISA для IL-1β человека и IL-6 человека, “Sigma-Aldrich”) в соответствии с протоколами производителя.
По окончании культивирования определяли продукцию NO, АФК, TNFα и IL в одних и тех же экспериментальных пробах.
Статистика. Все эксперименты с клетками проводили в четырех повторностях. Данные представлены как среднее значение ± стандартное отклонение в четырех независимых экспериментах, выполненных в четырех повторностях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
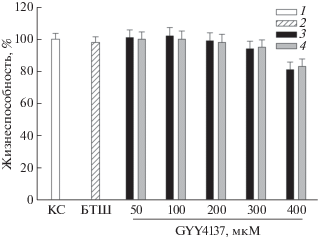
Влияние Hsp70 и GYY4137 на жизнеспособность клеток SH-SY5Y
Согласно полученным результатам, введение рекомбинантного Hsp70 (рис. 1, 2) не влияет на жизнеспособность клеток. Добавление GYY4137 как отдельно (рис. 1, 3), так и вместе с Hsp70 (рис. 1, 4) в концентрации от 50 до 200 мкМ не влияло на жизнеспособность клеток, хотя при более высоких концентрациях донора сероводорода жизнеспособность клеток снижалась (рис. 1).
Hsp70 и GYY4137 снижают ЛПС-индуцированное увеличение продукции АФК и NO клетками SH-SY5Y
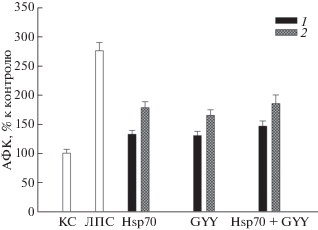
Инкубация клеток с Hsp70 (2 мкг/мл) и GYY4137 (100 мкМ) в течение 24 ч приводит к небольшому увеличению продукции АФК – на 26 и 22% соответственно (рис. 2, 1). При добавлении Hsp70 и GYY4137 к клеткам за 2 ч до ЛПС продукция АФК увеличивается на 55 и 45% соответственно. Характерно, что комбинация Hsp70 и GYY4137 (при последующем добавлении ЛПС) (рис. 2, Hsp70 + GYY4137) не приводит к увеличению продукции АФК клетками по сравнению с добавлением Hsp70 и GYY4137 по отдельности.
Рис. 2.
Продукция АФК клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), донора H2S GYY4137 (GYY, 100 мкМ) и их комбинации (Hsp70 + GYY) при действии ЛПС (1 мкг/мл). 1 – Добавление Hsp70 и GYY в отсутствие ЛПС; 2 – добавление Hsp70 и GYY за 2 ч до ЛПС. За 100% принята продукция АФК клетками SH-SY5Y в контроле, все остальные значения выражены в процентах от указанного значения. Общее время культивирования клеток – 24 ч.
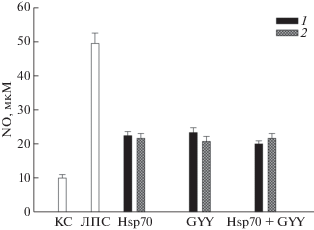
Инкубация клеток в присутствии Hsp70 и GYY4137 не вызывала значительного повышения продукции оксида азота как при раздельном (рис. 3, Hsp70, 1; GYY, 1), так и при совместном применении (рис. 3, Hsp70 + GYY, 1). В присутствии ЛПС при комбинированном действии Hsp70 и GYY4137 продукция NO клетками примерно соответствовала значениям, полученным в присутствии только Hsp70 или только GYY4137 (рис. 3, Hsp70 + GYY, 1, 2). Показано, что и GYY4137, и Hsp70 как вместе, так и по отдельности сильно снижают продукцию оксида азота и АФК, вызванную добавлением ЛПС.
Рис. 3.
Продукция NO клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), донора H2S GYY4137 (GYY, 100 мкМ) и их комбинации (Hsp70 + GYY) в присутствии ЛПС (1 мкг/мл). Обозначения, как на рис. 2. 1 – Добавление Hsp70 и GYY в отсутствие ЛПС; 2 – добавление Hsp70 и GYY за 2 ч до ЛПС.
Hsp70 и GYY4137 снижают ЛПС-индуцированное увеличение продукции TNFα, IL-1β и IL-6 клетками SH-SY5Y
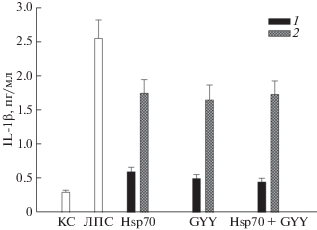
Инкубация клеток с Hsp70 и GYY4137 не приводила к повышению продукции TNFα и IL-6 по сравнению с контролем (рис. 4 и 5) (в отличие от продукции IL-1β (рис. 6)). Hsp70 и GYY4137 и при раздельном, и при одновременном действии значительно снижали индуцированную ЛПС продукцию трех цитокинов. Интересно, что комбинация Hsp70 и GYY4137 обеспечивала такой же уровень защиты клеток от активации ЛПС, как и каждый из них по отдельности, т.е. и в этом случае мы не наблюдали кумулятивного эффекта двух противовоспалительных агентов (рис. 4–6).
Рис. 4.
Продукция TNFα клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), донора H2S GYY4137 (GYY, 100 мкМ) и их комбинации (Hsp70 + GYY) при действии ЛПС (1 мкг/мл). Обозначения как на рис. 2.
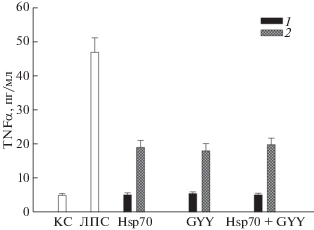
Рис. 5.
Продукция IL-6 клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), донора H2S GYY4137 (GYY, 100 мкМ) и их комбинации (Hsp70 + GYY) при действии ЛПС (1 мкг/мл). Обозначения, как на рис. 2.
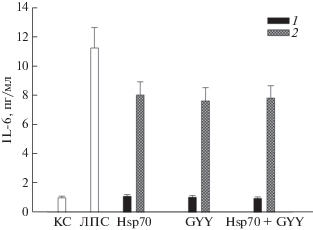
Рис. 6.
Продукция IL-1β клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), донора H2S GYY4137 (GYY) (100 мкМ) и их комбинации (Hsp70 + GYY) при действии ЛПС (1 мкг/мл). Обозначения, как на рис. 2.
Влияние Hsp70 и GYY4137 на реализацию механизмов эндоцитоза ЛПС в клетки SH-SY5Y
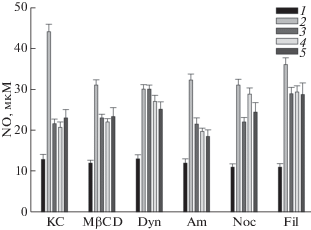
Изучение действия ингибиторов эндоцитоза показало, что все примененные ингибиторы уменьшали ЛПС-индуцированную продукцию АФК и оксида азота.
Так, ингибиторы MβCD, динасор, амилорид и нокодазол практически полностью отменяли вызванную добавлением Hsp70 защиту клеток от индуцированного ЛПС образования АФК (рис. 7, сравнение столбиков 2 и 3). Нокодазол также отменял защитное действие донора сероводорода GYY4137 от ЛПС-индуцированной продукции АФК (рис. 7, сравнение столбиков 2 и 4). Некоторое уменьшение защитного действия GYY4137 наблюдали также при действии MβCD, динасора и амилорида (рис. 7). Ингибитор филипин лишь незначительно снижал защитное действие как Hsp70, так и GYY4137 (рис. 7, Fil).
Рис. 7.
Влияние ингибиторов эндоцитоза на продукцию АФК клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), GYY4137 (100 мкМ) и ЛПС (1 мкг/мл). КC – культуральная среда; MβCD – 2 мМ, метил-β-циклодекстрин; Dyn – 40 мкМ, динасор; Am – 100 мкМ, амилорид; Noc – 1 мкМ, нокодазол; Fil – 1 мкМ, филипин. 1 – КС; 2 –добавление ЛПС; 3 – добавление Hsp70; 4 – добавление GYY4137. 5 – совместное добавление Hsp70 и GYY4137. Ингибиторы добавляли за 30 мин до Hsp70 и GYY4137, клетки инкубировали в течение 2 ч и добавляли ЛПС. За 100% принята продукция АФК клетками SH-SY5Y в контроле, все остальные значения выражены в процентах от указанного значения. Общее время культивирования клеток – 24 ч.

Действие ингибиторов эндоцитоза на ЛПС-индуцированную продукцию NO клетками SH-SY5Y было не столь однозначным, как в случае АФК. Максимальное снижение защитного действия Hsp70 и GYY4137 обеспечивал динасор (ингибитор динаминов I и II), минимальное – амилорид (рис. 8, сравнение столбиков 3 и 4 с 2). Интересно, что нокодазол отменял защитное действие только GYY4137, но не Hsp70 (рис. 8, Noc, 4). Защитное действие Hsp70 и GYY4137 достаточно эффективно снижал филипин (рис. 8, Fil).
Рис. 8.
Влияние ингибиторов эндоцитоза на продукцию оксида азота клетками SH-SY5Y в присутствии Hsp70 (2 мкг/мл), GYY4137 (100 мкМ) и ЛПС (1 мкг/мл). Обозначения, как на рис. 7.
Совместное добавление Hsp70 и GYY4137 на фоне ингибиторов эндоцитоза не усиливало защиту клеток от продукции и АФК, и NO.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Провоспалительное действие ЛПС на клетки реализуется на нескольких уровнях регуляции, таких как связывание с рецепторами, поступление внутрь клеток (путем эндоцитоза) и воздействие на внутриклеточные сигнальные пути и факторы транскрипции.
Образование рецепторного комплекса ЛПС включает активацию двух внутриклеточных сигнальных путей. Первый из них – MyD88-зависимый путь – обеспечивает раннюю активацию MAPK и NF-kB, что сопровождается экспрессией провоспалительных цитокинов, таких как TNFα и IL-6 [31]. В результате этого увеличивается продукция АФК. Второй путь, MyD88-независимый, характеризуется сравнительно более поздней индукцией экспрессии NF-kB. Воздействие ЛПС на различные клетки быстро индуцирует секрецию основного провоспалительного цитокина TNFα и соответствующей мРНК, уровень которой достигает максимума через 2 ч после добавления ЛПС [32]. Секретируемый TNFα способен реализовать свое действие, связываясь с рецепторами клеток (TNF-R1 и TNF-R2). Молекулярный механизм действия TNFα включает сборку NOX2 и резкое увеличение продукции АФК клетками [33, 34].
Проведенный нами транскриптомный анализ клеток THP-1 показал, что ЛПС усиливает экспрессию MyD88, что, видимо, вызывает повышение экспрессии факторов транскрипции NF-κB и AP-1 [28]. Предварительная обработка клеток GYY4137 приводила к значительному снижению экспрессии CD14 [28]. Поэтому даже повышенные уровни MD-2 не вызывают значительную активацию TLR4. Также обнаружено, что предварительная обработка GYY4137 существенно снижает экспрессию MyD88 и NF-κB, что должно привести к снижению продукции АФК, NO и других провоспалительных цитокинов, как и установлено в нашей работе [28]. Поскольку экспрессия АР-1 не ингибируется донором сероводорода GYY4137, мы показали, что GYY4137 не полностью защищает клетки THP-1 от активирующего действия ЛПС. При этом наши результаты выявили значительное ослабление действия ЛПС на иммуносвязанные и провоспалительные гены в клетках, предварительно обработанных GYY4137. Важно отметить, что предварительная обработка GYY4137 приводит к значительному ингибированию ЛПС-индуцированной экспрессии многих эффекторов TNF, включая хемокины Ccl2, Ccl5, Cxcl10, колониестимулирующий фактор 2, провоспалительные цитокины IL-1β, IL-6, фактор транскрипции JunB и другие эффекторные пути TNF [28]. Кроме того, проведенный нами транскриптомный анализ показал, что сам GYY4137 незначительно увеличивает уровень экспрессии некоторых воспалительных генов, экспрессию которых многократно увеличивает ЛПС. С этим, вероятно, связана некоторая активация продукции АФК, NO и IL-6 клетками, обработанными GYY4137 (рис. 2, 3, 5). Продукция АФК, NO и IL-6 также несколько увеличивается в присутствии Hsp70 (рис. 2, 3, 5). Т.е. Hsp70, наряду с противовоспалительным действием, обладает и слабой провоспалительной активностью, что связано, возможно, с увеличением уровня рецепторов TLR2 и TLR4 в мембране клеток при введении рекомбинантного Hsp70 [23].
Известно, что рекомбинантный Hsp70, поступивший в клетки, проявляет себя как негативный регулятор ферментов Nox (1, 2, 5), благодаря своей способности связывать эти белки и вызывать их убиквитинирование и деградацию и, следовательно, снижать продукцию АФК [35]. Снижение ЛПС-индуцированной продукции NO клетками при действии Hsp70 может быть обусловлено снижением экспрессии iNOS из-за ингибирования NADPH-оксидазы [40].
Транскриптомный анализ показал, что GYY4137 вызывает значительную индукцию нескольких генов белков теплового шока, которые принадлежат, в частности, к семействам Hsp40 и Hsp70. Индукция генов стресса при предварительной обработке GYY4137 может представлять ответ клеток на H2S, который может функционировать в данной ситуации как сигнал опасности [28].
Возможные механизмы, лежащие в основе защитного действия рекомбинантного экзогенного Hsp70 и GYY4137, могут действовать на нескольких уровнях клеточной регуляции. На первом уровне эти соединения влияют на клеточные рецепторы, участвующие в провоспалительном ответе клеток на ЛПС. На данном (первом) этапе Hsp70 взаимодействует с клеточными мембранными структурами, включая специфические рецепторы. После образования Hsp70-рецепторных комплексов они (комплексы) могут проникать в клетки посредством эндоцитоза и взаимодействовать с внутриклеточными сигнальными путями, участвующими в активации клеток после воздействия ЛПС [37]. Ранее мы показали, что белок начинает проникать в клетки различного типа в течение 5 мин после добавления 125I-меченного Hsp70 в среду, и эффективность проникновения коррелирует с уровнями TLR2 и TLR4 в клеточной мембране [23]. Согласно нашим данным GYY4137 также быстро проникает через клеточную мембрану и уже через 20 с в клетках SH-SY5Y начинается образование сероводорода [28]. На втором этапе Hsp70 и GYY4137, поступившие в клетки, взаимодействуют с внутриклеточными сигнальными путями, участвующими в активации клеток ЛПС.
Поскольку известно, что в процессе поступления ЛПС и Hsp70 в клетки важную роль играют механизмы эндоцитоза [16, 17, 37, 38], в своей работе мы использовали классические ингибиторы этого процесса (табл. 1).
Для оценки изменения эффективности защиты клеток белком Hsp70 и GYY4137 в присутствии ингибитора MβCD мы определили отношение продукции АФК и NO в пробах с ЛПС к продукции этих соединений в пробах с (Hsp70 + ЛПС) и (GYY4137+ЛПС) (рис. 7 и 8, КC2/КM3 и КM2/КM4). Эти величины равны 2 и 1.87 соответственно. В присутствии MβCD эти величины несколько уменьшаются (до 1.14 и 1.22 соответственно), что указывает на снижение защитного дейcтвия используемых соединений. Воздействие MβCD приводило к значительному снижению индуцированной ЛПС активации клеток (АФК и NO), по-видимому, вследствие разрушения липидных микродоменов, содержащих мембранные рецепторы TLR2 и TLR4 [39]. Липидные микродомены, как известно, играют важную роль в работе NADPH-оксидазы [40], поэтому их разрушение влияет на активность этого фермента. Отсутствие значительного снижения образования АФК (рис. 7, MβCD, 3 и 4 по сравнению с 2) связано, вероятно, с вкладом митохондрий, в которых нет липидных микродоменов [41]. Защитное действие GYY4137 также реализуется через различные внутриклеточные сигнальные пути, например, через снижение экспрессии TLR4, с чем связано некоторое увеличение продукции АФК (рис. 7, MβCD, 4) по сравнению с контрольной пробой (рис. 7, КС, 4), тогда как экзогенный Hsp70 несколько повышает экспрессию TLR2 и TLR4 в клетках [23].
Эндоцитоз, способствуя рециркуляции синаптических пузырьков и регулируя количество постсинаптических рецепторов нейротрансмиттеров, играет важную роль в функционировании мозга [42]. Основным механизмом поступления в клетки трансмембранных белков является клатринзависимый эндоцитоз [43]. Ингибитор этого типа эндоцитоза – динасор, в наших экспериментах значительно уменьшал индуцированную ЛПС продукцию АФК и NO в клетках SH-SY5Y (рис. 7 и 8). Наблюдаемое снижение продукции АФК и NO связано, вероятно, с уменьшением экспрессии мембранных рецепторов TLR4 и CD14 [17]. В частности, снижение продукции АФК в присутствии динасора (рис. 7) может быть связано с ингибированием NADPH-оксидазы [44].
Интересно, что динасор практически полностью отменял защитное действие Hsp70 и частично – GYY4137. При совместном применении Hsp70 и GYY4137 наблюдалась неполная отмена защиты, что, возможно, связано с разными механизмами действия Hsp70 и GYY437, влияющими на экспрессию мембранных рецепторов, участвующих в активации клеток ЛПС. Полученные результаты свидетельствуют об участии клатринзависимого пути в опосредованной Hsp70 защите клеток от действия ЛПС.
Известно, что амилорид эффективно блокирует индуцированную ЛПС продукцию провоспалительных цитокинов в клетках [45]. Как и ожидалось, в наших экспериментах этот ингибитор эффективно снижал ЛПС-индуцированную продукцию АФК и NO (рис. 7 и 8). При этом амилорид практически полностью подавлял способность Hsp70 и GYY4137 защищать клетки от образования АФК. Менее эффективно амилорид подавлял способность Hsp70 и GYY4137 защищать клетки от продукции NO. Амилорид ингибирует Na+/H+-антипортер, что приводит к подавлению ЛПС-индуцированной активации NADPH-оксидазы [46].
В функционировании нейронов важную роль играет тубулин микротрубочек, который участвует в морфологической поляризации нейронов [47]. Кроме того, микротрубочки важны для внутриклеточного транспорта различных веществ [48]. В наших экспериментах ингибитор нокодазол снижал образование АФК и NO, индуцированное ЛПС (рис. 7, 8). Блокирование полимеризации микротрубочек нокодазолом снижает ЛПС-индуцированную продукцию TNFα и АФК [49]. Кроме того, известно, что микротрубочки играют заметную роль в активации индуцибельного пути NO в ответ на медиаторы воспаления [50]. Нокодазол снижал образование NO клетками, однако большая продукция NO в присутствии GYY4137 (рис. 8, Noc, 4) по сравнению с Hsp70 (рис. 8, Noc, 3), по-видимому, связана со способностью самого H2S стимулировать образование NO в клетках [51].
Среди механизмов эндоцитоза важное место занимает кавеолинзависимый эндоцитоз. В кавеолах находятся различные факторы роста, рецепторы, киназы. В кавеолах локализованы eNOS, инсулин, EGF, TGF-b, P2X7, тирозинкиназа Src, Ras. Кавеолы также связаны сигнальными путями с MAP-киназами, Akt, малой GTPазой Rac и др. [52]. Все эти сигнальные пути в определенной степени связаны с активирующим действием ЛПС на клетки. В наших экспериментах филипин – ингибитор опосредованного кавеолином эндоцитоза – снижал защитное действие Hsp70 и GYY4137, нарушая структуру кавеол и воздействуя на многообразие внутриклеточных сигнальных путей, связанных с кавеолинзависимым эндоцитозом [53].
Под действием ЛПС в клетках увеличиваются фосфорилирование и экспрессия кавеолина-1 [54]. Известно, что H2S увеличивает миграцию макрофагов за счет активации сигнального пути с участием Src и ускорения интернализации интегрина β1 [55] (эндоцитоз интегрина β1, зависимый от кавеолина [56]). В активации окислительного стресса, вызванного ЛПС и приводящего к образованию разных медиаторов воспаления, участвуют различные пути внутриклеточной сигнализации. В активацию продукции АФК NADPH-оксидазой вовлечен Src (TLR4 → MyD88 → TRAF6 → c-Src → → NADPH-оксидаза → АФК) [57]. Ингибирование Src-тирозинкиназы рассматривается как эффективный подход к снижению нейровоспаления при нейродегенеративных заболеваниях [58]. Это хорошо коррелирует с полученными нами на клетках THP-1 данными [28], согласно которым ЛПС вызывает увеличение экспрессии кавеолина и Src, а воздействие GYY4137 снижает экспрессию последних. В механизме активации образования АФК, вызванном влиянием ЛПС на TLR4-зависимые сигнальные пути, важную роль играют не только Src, но и другие тирозинкиназы (в том числе, PI3K, JNK, p38MAPK). Ранее мы показали, что внеклеточный Hsp70 снижает продукцию АФК (при действии ЛПС и других соединений), влияя на эти сигнальные молекулы [28, 59].
Наши результаты позволяют заключить, что рекомбинантный Hsp70 человека и медленный донор сероводорода GYY4137, действуя раздельно и совместно, снижают ЛПС-индуцированную продукцию АФК, NO, TNFα, IL-1β и IL-6.
Отсутствие значимого аддитивного эффекта действия Hsp70 и GYY4137 на ЛПС-индуцируемую активацию клеток связано, по-видимому, с воздействием Hsp70 и GYY4137 на взаимосвязанные сигнальные пути активации клеток ЛПС. Различия в защите клеток от действия ЛПС обусловлены, по-видимому, различным влиянием Hsp70 и GYY4137 на экспрессию мембранных рецепторов, участвующих в активации клеток ЛПС.
С использованием ингибиторного анализа показано также, что в механизме защиты клеток от ЛПС-индуцированной продукции АФК и NO как донором сероводорода GYY4137, так и Hsp70 участвуют пиноцитоз, а также клатрин-, кавеолин-, тубулин- и рецепторзависимый эндоцитоз.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 19-04-00109), выделение и очистка рекомбинантного Hsp70 человека проведены при финансовой поддержке Российского научного фонда № 19-14-00167 (ДГ) и № 17-74-30030 (МЕ).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Rosadini C.V., Kagan J.C. (2017) Early innate immune responses to bacterial LPS. Curr. Opin. Immunol. 44, 14–19.
Gomes J.M.G., Costa J.A., Alfenas R.C.G. (2017) Metabolic endotoxemia and diabetes mellitus: a systematic review. Metabolism. 68, 133–144.
Brown G.C. (2019) The endotoxin hypothesis of neurodegeneration. J. Neuroinflammation. 16(1), 180.
Nwafor D.C., Brichacek A.L., Mohammad A.S., Griffith J., Lucke-Wold B.P., Benkovic S.A., Geldenhuys W.J., Lockman P.R., Brown C.M. (2019) Targeting the blood-brain barrier to prevent sepsis-associated cognitive impairment. J. Cent. Nerv. Syst. Dis. 11, 1179573519840652.
Hanke M.L., Kielian T. (2011) Toll-like receptors in health and disease in the brain: mechanisms and therapeutic potential. Clin. Sci. (Lond). 121(9), 367–387.
Kim S.J., Kim H.M. (2017) Dynamic lipopolysaccharide transfer cascade to TLR4/MD2 complex via LBP and CD14. BMB Rep. 50(2), 55–57.
Meneses G., Cárdenas G., Espinosa A., Rassy D., Pérez-Osorio I.N., Bárcena B., Fleury A., Besedovsky H., Fragoso G., Sciutto E. (2019) Sepsis: developing new alternatives to reduce neuroinflammation and attenuate brain injury. Ann. NY Acad. Sci. 1437(1), 43–56.
Qu B., Jia Y., Liu Y, Wang H., Ren G., Wang H. (2015) The detection and role of heat shock protein 70 in various nondisease conditions and disease conditions: a literature review. Cell Stress Chaperones. 20(6), 885–892.
Khandia R., Munjal A.K., Iqbal H.M.N., Dhama K. (2017) Heat shock proteins: therapeutic perspectives in inflammatory disorders. Recent Pat. Inflamm. Allergy Drug Discov. 10(2), 94–104.
Heck T.G., Scomazzon S.P., Nunes P.R., Schöler C.M., da Silva G.S., Bittencourt A., Faccioni-Heuser M.C., Krause M., Bazotte R.B., Curi R., Homem de Bittencourt P.I., Jr. (2017) Acute exercise boosts cell proliferation and the heat shock response in lymphocytes: correlation with cytokine production and extracellular-to-intracellular HSP70 ratio. Cell Stress Chaperones. 22(2), 271–291.
Kustanova G.A., Murashev A.N., Karpov V.L., Margulis B.A., Guzhova I.V., Prokhorenko I.R., Grachev S.V., Evgen’ev M.B. (2006) Exogenous heat shock protein 70 mediates sepsis manifestations and decreases the mortality rate in rats. Cell Stress Chaperones. 11(3), 276–286.
Vinokurov M., Ostrov V., Yurinskaya M., Garbuz D., Murashev A., Antonova O., Evgen’ev M. (2012) Recombinant human Hsp70 protects against lipoteichoic acid-induced inflammation manifestations at the cellular and organismal levels. Cell Stress Chaperones. 17(1), 89–101.
Rozhkova E., Yurinskaya M., Zatsepina O., Garbuz D., Surkov S., Murashev A., Ostrov V., Margulis B., Evgen’ev M., Vinokurov M. (2010) Exogenous mammalian extracellular HSP70 reduces endotoxin manifestations at the cellular and organism levels. Ann. NY Acad. Sci. 1197, 94–107.
Yurinskaya M., Kochetkova O., Shabarchina L., Antonova O., Suslikov A., Evgen’ev M., Vinokurov M. (2017) Encapsulated Hsp70 decreases endotoxin-induced production of ROS and TNFα in human phagocytes. Cell Stress Chaperones. 22(1), 163–171.
Calderwood S.K., Theriault J., Gray P.J., Gong J. (2007) Cell surface receptors for molecular chaperones. Methods. 43(3), 199–206.
Shim D.W., Heo K.H., Kim Y.K., Sim E.J., Kang T.B., Choi J.W., Sim D.W., Cheong S.H., Lee S.H., Bang J., Won H.S., Lee K.H. (2015) Anti-inflammatory action of an antimicrobial model peptide that suppresses the TRIF-dependent signaling pathway via inhibition of Toll-like receptor 4 endocytosis in lipopolysaccharide-stimulated macrophages. PLoS One. 10(5), e0126871.
Józefowski S., Śróttek M. (2017) Lipid raft-dependent endocytosis negatively regulates responsiveness of J774 macrophage-like cells to LPS by down regulating the cell surface expression of LPS receptors. Cell Immunol. 312, 42–50.
Nimmervoll B., Chtcheglova L.A., Juhasz K., Cremades N., Aprile F.A., Sonnleitner A., Hinterdorfer P., Vigh L., Preiner J., Balogi Z. (2015) Cell surface localised Hsp70 is a cancer specific regulator of clathrin-independent endocytosis. FEBS Lett. 589(19, Pt B), 2747–2753.
Szaby C. (2007) Hydrogen sulphide and its therapeutic potential. Nat. Rev. Drug Discov. 6, 917–935.
Zhang H.X., Du J.M., Ding Z.N., Zhu X.Y., Jiang L., Liu Y.J. (2017) Hydrogen sulfide prevents diaphragm weakness in cecal ligation puncture-induced sepsis by preservation of mitochondrial function. Am. J. Transl. Res. 9(7), 3270–3281.
Kimura H. (2015) Physiological roles of hydrogen sulfide and polysulfides. In: Chemistry, Biochemistry and Pharmacology of Hydrogen Sulfide. Handbook of Experimental Pharmacology. Eds Moore P., Whiteman M. Springer, 230, 61–81.
Li L., Fox B., Keeble J., Salto-Tellez M., Winyard P.G., Wood M.E., Moore P.K., Whiteman M. (2013) The complex effects of the slow-releasing hydrogen sulfide donor GYY4137 in a model of acute joint inflammation and in human cartilage cells. J. Cell. Mol. Med. 17(3), 365–376.
Yurinskaya M., Zatsepina O., Vinokurov M., Bobkova N., Garbuz D., Morozov A., Kulikova D., Mitkevich V., Makarov A., Funikov S., Evgen’ev M. (2015) The fate of exogenous human HSP70 introduced into animal cells by different means. Curr. Drug Deliv. 12(5), 524–532.
Du Y., Liu X.-H., Zhu H.-C., Wang L., Wang Z.-S., Ning J.-Z., Xiao C.-C. (2019) Hydrogen sulfide treatment protects against renal ischemia-reperfusion injury via induction of heat shock proteins in rats. Iran J. Basic Med. Sci. 22(1), 99–105.
Gurskiy Y.G., Garbuz D.G., Soshnikova N.V., Kras-nov A.N., Deikin A., Lazarev V.F., Sverchinskyi D., Margulis B.A., Zatsepina O.G., Karpov V.L., Belzhelarskaya S.N., Feoktistova E., Georgieva S.G., Evgen’ev M.B. (2016) The development of modified human Hsp70 (HSPA1A) and its production in the milk of transgenic mice. Cell Stress Chaperones. 21(6), 1055–1064.
Giraldo E., Martin-Cordero L., Garcia J., Gerhmann M., Multhoff G., Ortega E. (2010) Exercise-induced extracellular 72 kDa heat shock protein (Hsp72) stimulates neutrophil phagocytic and fungicidal capacities via TLR-2. Eur. J. Appl. Physiol. 108(2), 217–225.
Dutta D., Donaldson J.G. (2012) Search for inhibitors of endocytosis: Intended specificity and unintended consequences. Cell Logist. 2(4), 203–208.
Yurinskaya M.M., Krasnov G.S., Kulikova D.A., Zatsepina O.G., Vinokurov M.G., Chuvakova L.N., Rezvykh A.P., Funikov S.Y., Morozov A.V., Evgen’ev M.B. (2020) H2S counteracts proinflammatory effects of LPS through modulation of multiple pathways in human cells. Inflamm Res. 69(5), 481–495.
Lin V.S., Lippert A.R., Chang C.J. (2013) Cell-trappable fluorescent probes for endogenous hydrogen sulfide signaling and imaging H2O2-dependent H2S production. Proc. Natl. Acad. Sci. USA. 110(18), 7131–7135.
Pfister H., Hennet T., Jungi T. (1992) Lipopolysaccharide synergizes with tumour necrosis factor-alpha in cytotoxicity assays. Immunology. 77(3), 473–476.
Dauphinee S.M., Karsan A. (2006) Lipopolysaccharide signaling in endothelial cells. Lab. Investig. 86(1), 9–22.
Pfeiffer J.R., McAvoy B.L, Fecteau R.E., Deleault K.M., Brooks S.A. (2011) CARHSP1 is required for effective tumor necrosis factor alpha mRNA stabilization and localizes to processing bodies and exosomes. Mol. Cell. Biol. 31(2), 277–286.
Mouzaoui S., Rahim I., Djerdjouri B. (2012) Aminoguanidine and curcumin attenuated tumor necrosis factor (TNF)-alpha-induced oxidative stress, colitis and hepatotoxicity in mice. Int. Immunopharmacol. 12(1), 302–311.
Lee D., Ding Y., Jayaraman A., Kwon J.S. (2018) Mathematical modeling and parameter estimation of intracellular signaling pathway: application to LPS-induced NFκB activation and TNFα production in macrophages. Processes. 6(3), 21.
Chen F., Yu Y., Qian J., Wang Y., Cheng B., Dimitropoulou C., Patel V., Chadli A., Rudic R.D., Stepp D.W., Catravas J.D., Fulton D.J. (2012) Opposing actions of heat shock protein 90 and 70 regulate nicotinamide adenine dinucleotide phosphate oxidase stability and reactive oxygen species production. Arterioscler. Thromb. Vasc. Biol. 32(12), 2989–2999.
Sumi D., Ignarro L.J. (2004) Regulation of inducible nitric oxide synthase expression in advanced glycation end product-stimulated raw264.7 cells: the role of heme oxygenase-1 and endogenous nitric oxide. Diabetes. 53(7), 1841–1850.
Vega V.L., Charles W., De Maio A. (2010). A new feature of the stress response: increase in endocytosis mediated by Hsp70. Cell Stress Chaperones. 15(5), 517–527.
Kutuzova G.D., Albrecht R.M., Erickson C.M., Qureshi N. (2001) Diphosphoryl lipid A from Rhodobacter sphaeroides blocks the binding and internalization of lipopolysaccharide in RAW 264.7 cells. J. Immunol. 167(1), 482–489.
Islam A.S., Beidelschies M.A., Huml A., Greenfield E.M. (2011) Titanium particles activate Toll-like receptor 4 independently of lipid rafts in RAW264.7 murine macrophages. J. Orthop. Res. 29(2), 211–217.
Jin S., Zhou F., Katirai F., Li P.L. (2011) Lipid raft redox signaling: molecular mechanisms in health and disease. Antioxid. Redox Signal. 15(4), 1043–1083.
Zheng Y.Z., Berg K.B., Foster L.J. (2009) Mitochondria do not contain lipid rafts, and lipid rafts do not contain mitochondrial proteins. J. Lipid Res. 50(5), 988–998.
Azarnia Tehran D., Kuijpers M., Haucke V. (2018) Presynaptic endocytic factors in autophagy and neurodegeneration. Curr. Opin. Neurobiol. 48, 153–159.
Kaksonen M., Roux A. (2018) Mechanisms of clathrin-mediated endocytosis. Nat. Rev. Mol. Cell. Biol. 19(5), 313–326.
Lamb F.S., Hook J.S., Hilkin B.M., Huber J.N., Volk A.P., Moreland J.G. (2012) Endotoxin priming of neutrophils requires endocytosis and NADPH oxidase-dependent endosomal reactive oxygen species. J. Biol. Chem. 287(15), 12395–12404.
Haddad J.J., Land S.C. (2002) Amiloride blockades lipopolysaccharide-induced proinflammatory cytokine biosynthesis in an IkappaB-alpha/NF-kappaB-dependent mechanism. Evidence for the amplification of an antiinflammatory pathway in the alveolar epithelium. Am. J. Respir. Cell. Mol. Biol. 26(1), 114–126.
Liu Y., Kintner D.B., Chanana V., Algharabli J., Chen X., Gao Y., Chen J., Ferrazzano P., Olson J.K., Sun D. (2010) Activation of microglia depends on Na+/H+ exchange-mediated H+ homeostasis. J. Neurosci. 30(45), 15210–15220.
Witte H., Neukirchen D., Bradke F. (2008) Microtubule stabilization specifies initial neuronal polarization. J. Cell. Biol. 180(3), 619–632.
Baas P.W., Rao A.N., Matamoros A.J., Leo L. (2016) Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73(9), 442–460.
Li Z., Davis G.S., Mohr C., Nain M., Gemsa D. (1996) Inhibition of LPS-induced tumor necrosis factor-alpha production by colchicine and other microtubule disrupting drugs. Immunobiology. 195(4–5), 624–639.
Marczin N., Jilling T., Papapetropoulos A., Go C., Catravas J.D. (1996) Cytoskeleton-dependent activation of the inducible nitric oxide synthase in cultured aortic smooth muscle cells. Br. J. Pharmacol. 118(5), 1085–1094.
Pardue S., Kolluru G.K., Shen X., Lewis S.E., Saffle C.B., Kelley E.E., Kevil C.G. (2020) Hydrogen sulfide stimulates xanthine oxidoreductase conversion to nitrite reductase and formation of NO. Redox Biol. 30,101447.
Lamaze C., Tardif N., Dewulf M., Vassilopoulos S., Blouin C.M. (2017) The caveolae dress code: structure and signaling. Curr. Opin. Cell. Biol. 47, 117–125.
Muriel O., Sánchez-Álvarez M., Strippoli R., Del Pozo M.A. (2018) Role of the endocytosis of caveolae in intracellular signaling and metabolism. Prog. Mol. Subcell. Biol. 57, 203–234.
Wang N., Zhang D., Sun G., Zhang H., You Q., Shao M., Yue Y. (2015) Lipopolysaccharide-induced caveolin-1 phosphorylation-dependent increase in transcellular permeability precedes the increase in paracellular permeability. Drug Des. Devel. Ther. 9, 4965–4977.
Miao L., Xin X., Xin H., Shen X., Zhu Y.-Z. (2016) Hydrogen sulfide recruits macrophage migration by integrin β1-Src-FAK/Pyk2-Rac pathway in myocardial infarction. Sci. Rep. 6, 22363.
Shi F., Sottile J. (2008) Caveolin-1-dependent beta1 integrin endocytosis is a critical regulator of fibronectin turnover. J. Cell. Sci. 121(Pt 14), 2360–2371.
Cho R.L., Yang C.C., Lee I.T., Lin C.C., Chi P.L., Hsiao L.D., Yang C.M. (2016) Lipopolysaccharide induces ICAM-1 expression via a c-Src/NADPH oxidase/ROS-dependent NF-κB pathway in human pulmonary alveolar epithelial cells. Am. J. Physiol. Lung Cell. Mol. Physiol. 310(7), L639–L657.
Yang H., Wang L., Zang C., Wang Y., Shang J., Zhang Z., Liu H., Bao X., Wang X., Zhang D. (2020) Src inhibition attenuates neuroinflammation and protects dopaminergic neurons in Parkinson’s disease models. Front. Neurosci. 18, 14–45.
Юринская М.М., Гарбуз Д.Г., Евгеньев М.Б., Винокуров М.Г. (2020) Экзогенный БТШ70 и сигнальные пути, участвующие в ингибировании индуцированной липополисахаридом нейротоксичности клеток нейробластомы. Молекуляр. биология. 54(1), 128–136.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология