Молекулярная биология, 2021, T. 55, № 1, стр. 118-125
Рецептор фактора роста сосудистого эндотелия типа II (VEGFR2) вносит вклад в формирование резистентности эстрогенположительного рака молочной железы к тамоксифену
Т. А. Дронова a, b, *, Н. Н. Бабышкина a, b, c, М. В. Завьялова a, c, Е. М. Слонимская d, Н. В. Чердынцева a, b
a Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии наук
634009 Томск, Россия
b Национальный исследовательский Томский государственный университет
634050 Томск, Россия
c Сибирский государственный медицинский университет Министерства здравоохранения Российской Федерации
634050 Томск, Россия
d Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: tanyadronova@mail.ru
Поступила в редакцию 30.05.2020
После доработки 20.07.2020
Принята к публикации 27.07.2020
Аннотация
Регуляторные взаимодействия рецепторов эстрогенов и рецепторных тирозинкиназ, в том числе рецептора фактора роста сосудистого эндотелия типа II (VEGFR2), считаются ключевым механизмом развития устойчивости клеток рака молочной железы к антиэстрогенному препарату тамоксифену. Высокий уровень экспрессии VEGFR2 рассматривается в качестве маркера резистентности опухоли к тамоксифену. Однако не выявлено значимости функциональных полиморфизмов гена VEGFR2/KDR, ассоциированных с изменением экспрессии и/или продукции кодируемого им белка, в качестве прогностического маркера эффективности тамоксифена. В 122 образцах опухоли молочной железы, полученных от пациенток с прогрессией опухоли (отдаленные метастазы или рецидив) и больных без прогрессии на фоне терапии тамоксифеном, изучены полиморфные локусы гена KDR (rs2071559, rs2305948) и определен уровень его транскрипционной активности методом ПЦР в реальном времени; оценка экспрессии VEGFR2 проведена с помощью иммуногистохимического анализа. Частота встречаемости гетерозиготных и мутантных генотипов локуса rs2305948 гена KDR значимо выше у больных с отсутствием прогрессии. Полиморфизм rs2305948 ассоциирован с высокими показателями выживаемости у больных раком молочной железы. Выявлена корреляционная связь между уровнем мРНК генов ESR1 и KDR и отсутствием прогрессии рака молочной железы. Полученные результаты свидетельствуют о прогностическом значении rs2305948 и его потенциальном вкладе в формирование чувствительного к тамоксифену фенотипа опухоли.
ВВЕДЕНИЕ
Антиэстрогенные препараты являются одним из основных компонентов комплексной терапии эстрогенположительного рака молочной железы (РМЖ). Однако несмотря на широкий арсенал антиэстрогенов, стандартом эндокринотерапии как при распространенном РМЖ, так и на ранних стадиях заболевания остается тамоксифен – частичный антагонист рецепторов эстрогенов (ERα) [1]. Применение тамоксифена приводит к снижению риска рецидива и увеличению продолжительности жизни, однако у 20–30% больных РМЖ антиэстрогенный эффект тамоксифена не реализуется [2].
Механизмы формирования резистентности к тамоксифену связаны с нарушением функционирования интегральных сигнальных систем (PI3K/Akt, Ras/MAPK и др.), контролирующих процессы синтеза белка, метаболизма и клеточного роста [3, 4]. Одни из важнейших эффекторов этих внутриклеточных каскадов – белки семейства фактора роста сосудистого эндотелия (VEGF), биологическое действие которых определяется взаимодействием со специфическими тирозинкиназами – рецепторами VEGF типа I (VEGFR1/Flt-1) и типа II (VEGFR2/Flk-1, KDR), причем активация VEGFR2 наиболее важна для передачи внутриклеточного сигнала [5]. Показано, что рост эстрогензависимых клеточных линий РМЖ опосредуется аутокринным действием VEGF, вызывающим активацию VEGFR2 и последующую стимуляцию p38 [6, 7]. Результаты исследований in vitro свидетельствуют о том, что эстрадиол способен индуцировать секрецию VEGF, тогда как тамоксифен, напротив, ингибирует продукцию VEGF и VEGFR2 в культурах клеток MCF-7, отменяя ангиогенный эффект эстрадиола [8]. Получен ряд клинических доказательств прогностической роли VEGFR2 как маркера резистентности к эндокринной терапии. Так, установлено, что высокий уровень VEGFR2 в опухоли связан с низкими показателями безрецидивной выживаемости у больных РМЖ, получавших тамоксифен в адъювантном режиме [9, 10].
Вариабельность экспрессии VEGFR2 может модулироваться полиморфизмами в кодирующих и некодирующих областях гена KDR. Из многочисленных однонуклеотидных замен (SNP) на активность гена KDR или на экспрессию его белкового продукта влияют полиморфные локусы rs2071559 и rs2305948 [11]. Однако вклад этих генетических вариантов в развитие опухолевого фенотипа, резистентного к тамоксифену, определен в настоящее время недостаточно точно. Кроме того, несмотря на установленное участие VEGFR2 в прогрессии РМЖ, перспективным представляется изучение взаимосвязи генетических особенностей экспрессии данной тирозинкиназы с рецепторным статусом опухоли.
Цель нашей работы состояла в изучении влияния полиморфных локусов rs2071559 и rs2305948 гена KDR, его транскрипционной активности и экспрессии кодируемого им белка в опухоли на эффективность терапии тамоксифеном у больных эстрогенположительным РМЖ и оценке прогностического потенциала этих факторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пациенты. В работе использованы образцы опухолевой и прилежащей морфологически нормальной ткани, полученные от 122 женщин, проходивших лечение в НИИ онкологии Томского НИМЦ по поводу РМЖ в период с 2002 по 2014 гг. Клинический диагноз подтвержден данными гистологического исследования. Все больные перенесли радикальное хирургическое вмешательство и принимали тамоксифен в качестве адъювантной гормональной терапии (20 мг/1 раз в сутки). Общая группа больных была разделена на подгруппы в соответствии с прогрессией заболевания: 27 пациенток с отдаленными метастазами или рецидивами составили группу, резистентную к тамоксифену; 95 пациенток без прогрессии вошли в группу, чувствительную к тамоксифену. Среднее время до прогрессирования составило 28.5 ± 17.8 мес. Исследуемые группы были сопоставимыми по возрасту, стадии и объему проведенного лечения.
Выделение ДНК. ДНК из образцов РМЖ выделяли при помощи наборов QIAamp DNA mini Kit (“Qiagen”, Германия) в соответствии с инструкцией производителя. Концентрацию и чистоту выделенной ДНК определяли на спектрофотометре NanoDrop-1000 (“Thermo Scientific”, США) (25–400 нг/мкл, соотношение А260/А280 = 2.10–2.35). Целостность ДНК оценивали с помощью капиллярного электрофореза (TapeStation, “Agilent Technologies”, США).
Генотипирование. Генотипирование SNP rs2071559 и rs2305948 гена KDR проведено методом ПЦР в режиме реального времени с использованием гибридизационных TaqMan-зондов. Подбор праймеров и зондов осуществляли с помощью программы OligoAnalysisVector NTI www.ncbi.nlm.nih.gov (табл. 1). Условия реакции, а также последовательности олигонуклеотидных праймеров и TaqMan-зондов описаны ранее [12]. Кривые накопления флуоресценции проанализированы с помощью программного обеспечения Bio-Rad CFX96 Manager 3.1 (“Bio-Rad”, США). Качество генотипирования контролировали реамплификацией 5% случайно отобранных образцов со 100%-ной воспроизводимостью результатов.
Таблица 1.
Последовательности олигонуклеотидных праймеров и TaqMan-зондов для генотипирования и анализа экспрессии генов
| Локус/ген | Праймеры, нуклеотидные последовательности, 5′ → 3′ | Зонды, нуклеотидные последовательности, 5′ → 3′ |
Tотж, °С |
|---|---|---|---|
| KDR rs2071559 | AATCTGGTTGCTCTTAATCAGAAA CACTTCAAACTTGGAGCCG |
FAM-TGCCCAGTTCGCCAGCATT ROX-CTTGCCCAGTTCGCCAACATT |
60 |
| KDR rs2305948 |
CTGTTCTTCTTGGTCATCAGC TCTGGGAGTGAGATGAAGAAA |
FAM-TGAGCACCTTAACTATAGATGGTATAACC ROX-TGAGCACCTTAACTATAGATGGTGTAAC |
61 |
| KDR | ACTCTCTCTGCCTACCTCACCT TACTGACTGATTCCTGCTGTGTT |
FAM-TGTATGGAGGAGGAGGAAGTATGTG | 60 |
| ESR1 | CAGGGTGGCAGAGAAAGATT GTAGCGAGTCTCCTTGGCA |
FAM-TGACAAGGGAAGTATGGCTATGGA | 60 |
Выделение РНК. РНК из образцов опухолевой и прилежащей нормальной ткани выделяли с помощью набора RNeasy Plus mini Kit, содержащего ДНКазу I (“Qiagen”). Концентрацию и качество выделенной РНК оценивали спектрофотометрически на приборе NanoDrop-1000 (“Thermo Scientific”). Концентрация РНК колебалась от 40 до 200 нг/мкл, А260/А280 = 1.95–2.05.
Анализ экспрессии генов KDR и ESR1. кДНК для определения уровня экспрессии генов синтезировали на основе полученных образцов РНК с использованием набора RevertAid™ (“Fermentas”, США) согласно инструкции к набору. ПЦР в реальном времени проводили с использованием специфических праймеров и TaqMan-зондов (табл. 1) на CFX96 (“Bio-Rad”). Реакционная смесь содержала 250 мкM dNTP (“Sibenzyme”, Россия), 300 нM прямого и обратного праймеров, 200 нM зонда, 2.5 мM MgCl2, 1 × SE-буфер (67 мM Tрис-HCl, pH 8.8 при 25°C, 16.6 мM (NH4)2SO4, 0.01% Tween-20), 2.5 ед. акт. HotStart Taq-полимеразы (“Sibenzyme”) и 50 нг кДНК. Pеакцию проводили в следующем режиме: предварительная денатурация (94°С, 10 мин); затем 40 циклов – 94°С, 10 с и 60°С, 20 с. Относительную экспрессию генов KDR и ESR1 определяли с помощью метода 2–ΔΔCT [13], используя ген GAPDH в качестве референсного.
Иммуногистохимическое исследование. Экспрессию рецепторов стероидных гормонов, а также белковых продуктов гена KDR анализировали на парафиновых срезах ткани опухолей молочной железы с использованием стрептавидин-биотинового метода и системы визуализации фирмы “Dako” LSAB2 System-HRP. Применяли антитела мыши к ERα фирмы “Dako” (клон 1D5, RTU) и рецептору прогестерона (PR) (клон PgR 636, RTU), антитела к VEGFR2 фирмы “Novus Biologicals” (клон 1B6, 1 : 100). Результаты иммуногистохимического анализа оценивали полуколичественно с использованием светового микроскопа при увеличении ×400, учитывая процент положительно окрашенных клеток и интенсивность их окрашивания в 10 полях зрения каждого среза. Умеренное (2+) или сильное (3+) цитоплазматическое и/или мембранное окрашивание более чем в 10% опухолевых клеток расценивали как VEGFR2-положительное, отрицательное окрашивание (0); слабую (1+) экспрессию в <10% клеток – как VEGFR2-негативное.
Статистическая обработка. Статистический анализ проводили с использованием программного обеспечения SPSS 21.0 (IBM SPSS Statistics, Armonk, NY, США) и GraphPad Prism 8.0.1. Частоты аллелей и генотипов исследуемых SNP были рассчитаны и протестированы на отклонение от равновесия Харди–Вайнберга. Различия в экспрессии мРНК генов KDR и ESR1 между группами пациентов оценивали с помощью U-критерия Манна–Уитни. Значимость различий между долей VEGFR2-экспрессирующих клеток в изучаемых группах определяли с использованием критерия согласия χ2. Корреляционные взаимосвязи оценивали с помощью непараметрического критерия Спирмена. Показатели безметастатической выживаемости рассчитывали по методу Каплана–Мейера. Все тесты были двусторонними, различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Частоты встречаемости полиморфных вариантов гена KDR у больных эстрогенположительным раком молочной железы в зависимости от эффективности лечения тамоксифеном
Результаты анализа двух полиморфных локусов гена KDR у больных с прогрессией и без признаков прогрессии РМЖ на фоне приема тамоксифена представлены в табл. 2. Распределение частот генотипов по локусу rs2071559 в обеих группах соответствовало равновесию Харди–Вайнберга (p = = 0.531 и p = 0.629 соответственно). Распределение частот генотипов полиморфного локуса rs2305948, соответствующее закону Харди–Вайнберга, наблюдалось лишь в группе больных без прогрессии РМЖ (p = 0.902). Отсутствие гетерозигот и гомозигот по мутантному аллелю rs2305948 не позволило определить значимость отклонения от равновесия Харди–Вайнберга в группе с прогрессией опухолевого процесса. Сравнительный анализ частот генотипов и аллелей локуса rs2071559 гена KDR не выявил значимых различий между больными исследуемых групп. Однако у пациентов без признаков прогрессии мутантные аллели и генотипы локуса rs2305948 встречались чаще, чем у больных с прогрессированием РМЖ на фоне терапии тамоксифеном (p = 0.015 и p = 0.040; табл. 2).
Таблица 2.
Распределение генотипов и аллелей гена KDR в группах больных
| SNP_ID | Генотип | Частота генотипа | Аллель | Частота аллеля | ||||
|---|---|---|---|---|---|---|---|---|
| ТАМ-Чa, n (%) |
ТАМ-Рb, n (%) |
p | ТАМ-Чa, n (%) |
ТАМ-Рb, n (%) |
p | |||
| KDR rs2071559 | TT | 31(32.6) | 64(67.4) | T | 101(53.2) | 89(46.8) | ||
| TC + CC | 12(24.4) | 15(55.6) | 0.264 | C | 34(63.0) | 20(37.0) | 0.201 | |
| KDR rs2305948 |
GG | 77(83.7) | 15(16.3) | G | 166(90.2) | 18(9.8) | ||
| GA + AA | 26(100.0) | 0(0.0) | 0.040 | A | 52(100.0) | 0(0.0) | 0.015 | |
Анализ экспрессии мРНК генов KDR и ESR1 у больных исследуемых групп
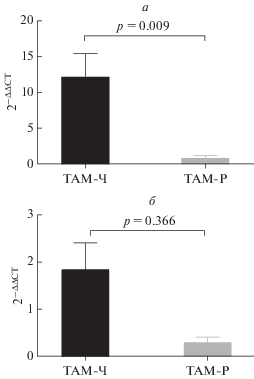
Изучение особенностей экспрессии исследуемых генов показало, что у пациенток с благоприятным ответом на тамоксифен уровень относительной экспрессии мРНК гена ESR1 выше, чем у пациенток c прогрессией РМЖ (12.21 ± 3.22, и 0.85 ± 0.32 соответственно, p = 0.009; рис. 1а). Отмечена сходная направленность изменений транскрипционной активности гена KDR (относительное количество мРНК – 1.85 ± 0.56 в группе без прогрессии РМЖ и 0.30 ± 0.11 в группе с прогрессией), но статистически значимые различия не обнаружены (рис. 1б).
Рис. 1.
Уровень экспрессии мРНК генов ESR1 (а) и KDR (б) в образцах рака молочной железы от больных группы ТАМ-Ч, чувствительной к тамоксифену, и ТАМ-Р, резистентной к тамоксифену. Результаты представлены как M ± SE, где M – среднее значение, SE –стандартная ошибка среднего.
Анализ связи между профилями экспрессии генов в группе больных, чувствительных к тамоксифену, показал значимую корреляционную зависимость (r = 0.458; p = 0.003) в отличие от группы пациенток, резистентных к терапии, в которой отсутствовала такая корреляция (r = = 0.657; p = 0.156).
Анализ экспрессии VEGFR2 у больных исследуемых групп
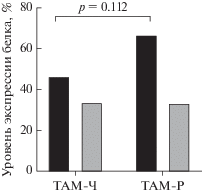
Иммуногистохимическая визуализация белкового продукта гена KDR показала, что VEGFR2 чаще экспрессируется в опухолях, резистентных к тамоксифену (68.8%), в то время как VEGFR2-негативная экспрессия чаще наблюдается в опухолях, чувствительных к такой терапии (53.8%). Однако найденные различия не достигали уровня статистической значимости (p = 0.112; рис. 2).
Рис. 2.
Уровень VEGFR2 у больных группы ТАМ-Ч, чувствительной к тамоксифену, и ТАМ-Р – резистентной к тамоксифену. ◼ – VEGFR2-позитивная; ◼ – VEGFR2-негативная.
Корреляционный анализ не выявил статистически значимой взаимосвязи между уровнем экспрессии мРНК и долей (%) VEGFR2-окрашенных клеток (r = 0.219; p = 0.262 в группе, чувствительной к тамоксифену; r = 0.500; p = 0.667 в группе, резистентной к тамоксифену).
Связь исследуемых маркеров с показателями безметастатической выживаемости у больных эстрогенположительным раком молочной железы
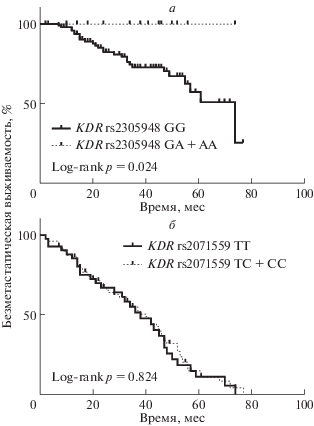
Согласно данным сравнительного анализа зависимости безметастатической выживаемости больных от носительства полиморфных локусов гена KDR, лучшие показатели отдаленных результатов лечения наблюдаются в группе носителей гетерозиготных и мутантных генотипов, чем у носителей дикого варианта rs2305948 (log-rank p = = 0.024; рис. 3а). Полиморфный локус rs2071559 гена KDR не был ассоциирован с показателями выживаемости (log-rank p = 0.824; рис. 3б).
Рис. 3.
Показатели безметастатической выживаемости больных РМЖ, носителей полиморфных локусов rs2305948 (а) и rs2071559 (б) гена KDR.
Относительный уровень мРНК генов ESR1 и KDR, а также экспрессия VEGFR2 в опухоли не оказали значимого влияния на показатели безметастатической выживаемости больных (данные не представлены).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Настоящее исследование позволило изучить роль тирозинкиназы VEGFR2 в развитии устойчивости к тамоксифену у больных эстрогенположительным РМЖ с учетом вклада ее генетических вариантов, транскрипционной активности и белкового профиля. Мы показали ассоциативную связь носительства гетерозиготных и мутантных вариантов локуса rs2305948 гена KDR у больных РМЖ с эффективным ответом на тамоксифен. Наличие этих генетических вариантов высоко коррелирует с лучшим прогнозом выживаемости. Кроме того, у пациентов с успешной гормональной терапией выявлена корреляционная связь между уровнями экспрессии генов ESR1 и KDR.
Следует отметить, что результаты изучения полиморфизма rs2305948 в аспекте эффективности лечения и прогноза клинического течения РМЖ весьма ограничены. Большинство проведенных исследований посвящено анализу рисковой значимости этого генетического варианта, однако полученные данные не подтверждают его роль в формировании РМЖ [14–16]. Försti и соавт. [14] выявили тенденцию к связи мутантного генотипа SNP rs2305948 с высокими показателями общей выживаемости больных РМЖ, другие авторы не нашли доказательств его прогностического значения [17]. Ранее мы обнаружили статистически значимое повышение общей выживаемости у носителей гетерозиготных и мутантных вариантов локуса rs2305948 в группе больных эстрогенположительным РМЖ, получавших тамоксифен [18]. В настоящем исследовании показана прогностическая значимость данных генотипов и в отношении безметастатической выживаемости.
Полиморфизм rs2305948 локализуется в экзоне 7 гена KDR, который кодирует внеклеточную часть рецептора, содержащую семь (D1–D7) Ig-подобных доменов. Структурно-функциональные исследования показали, что домены D2–D3 критичны для связывания лиганда с высокой аффинностью [19, 20]. Замена валина (V), Cβ-остатка, на более крупный Cγ-гидрофобный остаток, изолейцин (I) в положении 297 белка, приводит к изменению конформации соединительной петли β-листа в Ig-подобном домене D3, препятствуя процессу его димеризации [21, 22]. Таким образом, rs2305948 может влиять на активность процессов транс-аутофосфорилирования и внутриклеточной передачи сигнала [11, 23, 24]. Можно полагать, что, снижая эффективность связывания VEGFR2 с лигандом, данная мутация может определять низкую активность VEGFR2-опосредованных пролиферативных сигнальных путей в опухоли, способствующую более эффективному терапевтическому ответу и благоприятному прогнозу заболевания.
Изучаемые в настоящей работе функциональные варианты гена KDR были отобраны ранее с целью оценки их предиктивного потенциала у больных эстрогеннегативным РМЖ, получавших предоперационную химиотерапию. Интересно, что дикие генотипы локуса rs2071559 гена KDR представляют собой маркеры эффективности предоперационного лечения с включением капецитабина, тогда как у носителей диких генотипов полиморфного варианта rs2305948 выявлена лишь тенденция к повышению числа полных морфологических регрессий опухоли [12]. Вероятно, что вклад системы VEGF в механизмы прогрессии и развитие лекарственной резистентности эстрогенположительных и эстрогенотрицательных опухолей различен. Так, при эстрогеннегативном РМЖ VEGFR2-опосредованная стимуляция является одним из центральных регуляторных механизмов формирования устойчивости опухолевых клеток к действию цитостатических препаратов. Снижение активации пролиферативных VEGFR2-зависимых эффектов может быть обусловлено модулирующим влиянием других внутриклеточных путей, обладающих как про- так и противоопухолевой направленностью действия [25, 26]. Так, в экспериментах in vitro показана способность трансформирующего фактора-β непосредственно подавлять транскрипцию VEGFR2 в эндотелиальных клетках [27]. В случае эстрогенположительных опухолей ключевым сигнальным каскадом, контролирующим гормональную резистентность, является ERα, посредством которого осуществляется регуляция экспрессии VEGFR2 [28, 29]. Обнаруженная нами корреляция уровней экспрессии ESR1 и KDR у пациенток с успешной гормональной терапией может указывать на возможность корецепторных взаимодействий этих генов для обеспечения противоопухолевого действия тамоксифена [30]. Стоит отметить, что нами не выявлено прямой корреляционной зависимости между экспрессией гена KDR и его белкового продукта в опухолях таких больных. Вероятно, подобное несоответствие может быть связано с различными регуляторными механизмами, влияющими на уровень белка, а именно, с нарушением процессов трансляции, синтеза и деградации мРНК, посттрансляционной модификацией белковых продуктов.
Известно, что изменение уровня экспрессии гена ESR1 наряду со статусом ERα в опухоли может коррелировать с ответом на терапию тамоксифеном у больных эстрогенположительным РМЖ, причем высокий уровень транскрипционной активности ESR1 связан с чувствительностью к тамоксифену [31], а низкий уровень, напротив, с резистентностью к такой антиэстрогенной терапии [32]. В нашем исследовании высокий уровень мРНК гена ESR1 наблюдался в опухолях больных, которые не имели прогрессии заболевания после терапии тамоксифеном, что соотносится с результатами представленных выше работ.
Таким образом, полученные нами данные свидетельствуют о том, что эффект гормональной терапии тамоксифеном в определенной степени зависит от мутации в гене KDR rs2305948. Высокая частота встречаемости гетерозиготных и мутантных генотипов этого полиморфного локуса у пациенток с успешной гормональной терапией, а также их ассоциация с высокой продолжительностью жизни без прогрессии РМЖ позволяет рассматривать данные генетические маркеры в качестве факторов, определяющих благоприятный прогноз при этом заболевании. Координация экспрессии генов ESR1 и KDR может свидетельствовать о низком метастатическом потенциале опухоли и ее чувствительности к тамоксифену.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 17-29-06037 офи_м “Геномные механизмы регуляции опухолевой прогрессии рака молочной железы в условиях лекарственной терапии”).
Исследование проведено с соблюдением принципов добровольности и конфиденциальности в соответствии с “Основами законодательства РФ об охране здоровья граждан” (Указ Президента РФ от 24.12.93 № 2288) на основании разрешения комитета по биомедицинской этике НИИ онкологии Томского НИМЦ.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Burstein H.J., Curigliano G., Loibl S., Dubsky P., Gnant M., Poortmans P., Colleoni M., Denkert C., Piccart-Gebhart M., Regan M., Senn H.J., Winer E.P., Thurlimann B., Members of the St. Gallen International Consensus Panel on the Primary Therapy of Early Breast Cancer 2019. (2019) Estimating the benefits of therapy for early-stage breast cancer: the St. Gallen International Consensus Guidelines for the primary therapy of early breast cancer 2019. Ann. Oncol. 30(10), 1541‒1557.
Cardoso F., Costa A., Senkus E., Aapro M., Andre F., Barrios C.H., Bergh J., Bhattacharyya G., Biganzoli L., Cardoso M.J., Carey L., Corneliussen-James D., Curigliano G., Dieras V., El Saghir N., Eniu A., Fallowfield L., Fenech D., Francis P., Gelmon K., Gennari A., Harbeck N., Hudis C., Kaufman B., Krop I., Mayer M., Meijer H., Mertz S., Ohno S., Pagani O., Papadopoulos E., Peccatori F., Penault-Llorca F., Piccart M.J., Pierga J.Y., Rugo H., Shockney L., Sledge G., Swain S., Thomssen C., Tutt A., Vorobiof D., Xu B., Norton L., Winer E. (2017) 3rd ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 3). Ann. Oncol. 28(1), 16–33.
Clarke R., Tyson J.J., Dixon J.M. (2015) Endocrine resistance in breast cancer – An overview and update. Mol. Cell. Endocrinol. 418(3), 220–234.
Mills J.N., Rutkovsky A.C., Giordano A. (2018) Mechanisms of resistance in estrogen receptor positive breast cancer: overcoming resistance to tamoxifen/aromatase inhibitors. Curr. Opin. Pharmacol. 41, 59–65.
Shibuya M. (2011) Vascular endothelial growth factor (VEGF) and its receptor (VEGFR) signaling in angiogenesis: a crucial target for anti- and pro-angiogenic therapies. Genes Cancer. 2(12), 1097–1105.
Aesoy R., Sanchez B.C., Norum J.H., Lewensohn R., Viktorsson K., Linderholm B. (2008) An autocrine VEGF/VEGFR2 and p38 signaling loop confers resistance to 4-hydroxytamoxifen in MCF-7 breast cancer cells. Mol. Cancer Res. 6(10), 1630–1638.
Liang Y., Brekken R.A., Hyder S.M. (2006) Vascular endothelial growth factor induces proliferation of breast cancer cells and inhibits the anti-proliferative activity of anti-hormones. Endocr. Relat. Cancer. 13(3), 905–919.
Garvin S., Nilsson U.W., Dabrosin C. (2005) Effects of oestradiol and tamoxifen on VEGF, soluble VEGFR-1, and VEGFR-2 in breast cancer and endothelial cells. Brit. J. Cancer. 93(9), 1005–1010.
Linderholm B.K., Hellborg H., Johansson U., Skoog L., Lehtio J. (2011) Vascular endothelial growth factor receptor 2 and downstream p38 mitogen-activated protein kinase are possible candidate markers of intrinsic resistance to adjuvant endocrine treatment in steroid receptor positive breast cancer. Breast Cancer Res. Treat. 125(2), 457–465.
Ryden L., Jirstrom K., Bendahl P.O., Ferno M., Nordenskjöld B., Stal O., Thorstenson S., Jonsson P.E., Landberg G. (2005) Tumor-specific expression of vascular endothelial growth factor receptor 2 but not vascular endothelial growth factor or human epidermal growth factor receptor 2 is associated with impaired response to adjuvant tamoxifen in premenopausal breast cancer. J. Clin. Oncol. 23(21), 4695–4704.
Wang Y., Zheng Y., Zhang W., Yu H., Lou K., Zhang Y., Qin Q., Zhao B., Yang Y., Hui R (2007) Polymorphisms of KDR gene are associated with coronary heart disease. J. Am. Coll. Cardiol. 50(8), 760–767.
BabyshkinaN., Zavyalova M., Tarabanovskaya N., Dronova T., Krakhmal N., Slonimskaya E., Kzhyshkowska J., Choynzonov E., Cherdyntseva N. (2018). Predictive value of vascular endothelial growth factor receptor type 2 in triple-negative breast cancer patients treated with neoadjuvant chemotherapy. Mol. Cell. Biochem. 444(1–2), 197–206.
Livak K.J., Schmittgen T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2-Delta Delta C (T). Method. 24(4), 402–408.
Forsti A., Jin Q., Altieri A., Johansson R., Wagner K., Enquist K., Grzybowska E., Pamula J., Pekala W., Hallmans G., Lenner P., Hemminki K. (2007) Polymorphisms in the KDR and POSTN genes: association with breast cancer susceptibility and prognosis. Breast Cancer Res. Treat. 101(1), 83–93.
Schneider B.P., Radovich M., Sledge G.W., Robarge J.D., Li L., Storniolo A.M., Lemler S., Nguyen A.T., Hancock B.A., Stout M., Skaar T., Flockhart D.A. (2008) Association of polymorphisms of angiogenesis genes with breast cancer. Cancer. Res. Treat. 111(1), 157–163.
Beeghly-Fadiel A., Shu X.O., Lu W., Long J., Cai Q., Xiang Y.B., Zheng Y., Zhao Z., Gu K., Gao Y.T., Zheng W. (2011) Genetic variation in VEGF family genes and breast cancer risk: a report from the Shanghai breast cancer genetics study. Cancer Epidemiol. Biomarkers Prev. 20(1), 33–41.
Dorjgochoo T., Zheng Y., Gao Y.T., Ma X., Long J., Bao P., Zhang B., Wen W., Lu W., Zheng W., Shu X.O., Beeghly-Fadiel A. (2013) No association between genetic variants in angiogenesis and inflammation pathway genes and breast cancer survival among Chinese women. Cancer Epidemiol. 37(5), 619–624.
Косовец М.С., Дронова Т.А. (2019) Роль рецептора сосудисто-эндотелиального фактора роста II типа (VEGFR2) в прогрессировании эстрогензависимого рака молочной железы. Фундаментальная и клиническая онкология: достижения и перспективы развития. Российская научно-практическая конференция, посвященная 40-летию НИИ онкологии Томского НИМЦ. Под ред. Чойнзонова Е.Л., Чердынцевой Н.В., Чернова В.И. Томск: Изд-во Томского университета, С. 267.
Lu D., Kussie P., Pytowski B., Persaud K., Bohlen P., Witte L., Zhu Z. (2000) Identification of the residues in the extracellular region of KDR important for interaction with vascular endothelial growth factor and neutralizing anti-KDR antibodies. J. Biol. Chem. 275, 14321–14330.
Fuh G., Li B., Crowley C., Cunningham B., Wells J.A. (1998) Requirements for binding and signaling of the kinase domain receptor for vascular endothelial growth factor. J. Biol. Chem. 273, 11197–11204.
Stuttfeld E., Ballmer-Hofer K. (2009) Structure and function of VEGF receptors. IUBMB Life. 61, 915–922.
Yang Y., Xie P., Opatowsky Y., Schlessinger J. (2010) Direct contacts between extracellular membrane-proximal domains are required for VEGF receptor activation and cell signaling. Proc. Natl. Acad. Sci. USA. 107, 1906–1911.
Zhang W.L., Sun K., Wang Y., Hu F.B., Hui R.T. American Heart Association (AHA) 2007 Scientific Sessions. (2007) Orlando, Florida. Circulation. 116(Suppl), P. 521. Abstract 2377.
Matalliotaki C., Eliopoulos E., Matalliotakis M., Kalogiannidis I., Matalliotakis I., Spandidos D.A., Goulielmos G.N., Zervou M.I. (2019) Implication of VEGFR2 in endometriosis: A structural biological and genetic approach. World Acad. Sci. J. 1, 283–289.
Carmeliet P., Jain R.K. (2011) Molecular mechanisms and clinical applications of angiogenesis. Nature. 473(7347), 298–307.
Holderfield M.T., Hughes C.C. (2008) Crosstalk between vascular endothelial growth factor, notch, and transforming growth factor-beta in vascular morphogenesis. Circ. Res. 102(6), 637–652.
Minami T., Rosenberg R.D., Aird W.C. (2001) Transforming growth factor-beta 1-mediated inhibition of the Flk-1/KDR gene is mediated by a 5'-untranslated region palindromic GATA site. J. Biol. Chem. 276(7), 5395–5402.
Higgins K.J., Liu S., Abdelrahim M., Yoon K., Vanderlaag K., Porter W., Metz R.P., Safe S. (2006) Vascular endothelial growth factor receptor-2 expression is induced by 17beta-estradiol in ZR-75 breast cancer cells by estrogen receptor alpha/Sp proteins. Endocrinology. 147, 3285–3295.
Guo S., Colbert L.S., Fuller M., Zhang Y. (2010) Vascular endothelial growth factor receptor-2 in breast cancer. Biochim. Biophys. Acta. 1806(1), 108–121.
Bogin L., Degani H. (2002) Hormonal regulation of VEGF in orthotopic MCF7 human breast cancer. Cancer Res. 62(7), 1948–1951.
Bordeaux J.M., Cheng H., Welsh A.W., Haffty B.J., Lannin D.R., Wu X., Su N., Ma X-J., Luo Y., Rimm D.L. (2012) Quantitative in situ measurement of estrogen receptor mRNA predicts response to tamoxifen. PLoS One. 7(5), e36559.
Kim C., Tang G., Pogue-Geile K.L., Costantino J.P., Baehner F.L., Baker J., Cronin M.T., Watson D., Shak S., Bohn O.L., Fumagalli D., Taniyama Y., Lee A., Reilly M.L., Vogel V.G., McCaskill-Stevens W., Ford L.G., Geyer C.E., Wickerham D.L., Wolmark N., Paik S. (2011) Estrogen receptor (ESR1) mRNA expression and benefit from tamoxifen in the treatment and prevention of estrogen receptor-positive breast cancer. J. Clin. Oncol. 329(31), 4160–4167.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


