Молекулярная биология, 2021, T. 55, № 1, стр. 107-117
Роль транскрипционных факторов SP1 и FOXA1 в регуляции экспрессии гена IL33 в клетках рака молочной железы и рака легкого
А. М. Горбачева a, *, Д. В. Купраш a, b, Н. А. Митькин a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Биологический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: alisamur93@mail.ru
Поступила в редакцию 27.03.2020
После доработки 02.07.2020
Принята к публикации 02.07.2020
Аннотация
Интерлейкин-33 (IL-33) относится к семейству цитокинов IL-1 и известен, в первую очередь, как медиатор гуморального иммунного ответа. Он обеспечивает защиту барьерных тканей, а также принимает участие в развитии многих заболеваний. Результаты исследований свидетельствуют о негативной роли этого цитокина в канцерогенезе: он индуцирует деление и выживание раковых клеток, ремоделирование опухолевого микроокружения и создает условия для иммуносупрессии. Высокий уровень IL-33 наблюдается при многих типах злокачественных опухолей и коррелирует с неблагоприятным прогнозом для пациентов, что позволяет считать этот цитокин перспективной мишенью для иммунотерапии опухолей. Тем не менее механизмы регуляции экспрессии IL-33 в опухолевых клетках недостаточно исследованы. Нами показано, что экспрессия IL-33 в линиях клеток опухоли легкого и молочной железы зависит, по крайней мере частично, от активности транскрипционных факторов SP1 и FOXA1. Этот регуляторный механизм при определенных условиях приводит к повышению уровня IL-33, что ассоциируется с прогрессией опухоли и стимуляцией ее метастазирования.
ВВЕДЕНИЕ
Наряду с иммунными клетками важную роль в регуляции опухолевого роста играют компоненты матрикса, хемокины и цитокины, способствующие развитию воспаления в опухолевом очаге [1, 2]. Эффект, оказываемый воспалением, опосредован индукцией геномной нестабильности, возникновением эпигенетических модификаций, стимуляцией пролиферации и устойчивости раковых клеток к апоптозу, а также активацией метастазирования [3].
Цитокин интерлейкин-33 (IL-33), член суперсемейства цитокинов IL-1, ‒ важный участник опухолеассоциированного воспаления и ответной реакции на инвазию опухоли [4]. Многочисленные данные подтверждают проопухолевую роль IL-33, ассоциированную с иммуносупрессией опухолевого окружения и стимуляцией метастазирования, что позволяет считать этот цитокин потенциально важной мишенью для иммунотерапии рака [5, 6]. Известно, что IL-33 направленно взаимодействует с онкогенами, индуцируя пролиферацию, трансформацию и миграцию опухолевых клеток [6, 7]. На мышиной модели показано, что IL-33 стимулирует метастазирование раковых клеток, сопровождающееся накоплением в области опухоли клеток-супрессоров миелоидного происхождения (MDSCs) и Т-регуляторных клеток, а также подавлением цитотоксичности естественных киллеров [8]; при этом появление IL-33 в опухолевом микроокружении вызывает не только аккумуляцию MDSCs, но и увеличение иммуносупрессивной функции этих клеток [9].
Показано, что уровень экспрессии IL-33 повышен у пациентов с различными типами опухолей: раком легкого [10, 11] и молочной железы [6, 12], колоректальным раком [13], плоскоклеточным раком головы и шеи [7], а также раком желудка [14]. У пациентов с раком легкого и молочной железы высокий уровень IL-33 в сыворотке и строме опухоли положительно коррелирует с прогрессией заболевания, что предполагает возможное использование цитокина в качестве прогностического маркера [11, 12]. Повышенный уровень экспрессии IL33, наблюдаемый в клетках опухолевого окружения, приводит к стимуляции альтернативно активированных макрофагов и опухолеассоциированных фибробластов [7].
Несмотря на очевидную важность цитокина IL-33 в прогрессии рака, о механизмах контроля его экспрессии в нормальных тканях и опухоли сведений немного. Установлено, что промотор основной полноразмерной формы мРНК IL-33 человека включает чувствительную к стимуляции интерфероном последовательность ISRE и несколько сайтов GAS (от “gamma interferon activation sites”), чувствительных к интерферону гамма [15].
Ранее нами показано, что в клетках карциномы легких NCIH-196 транскрипционный фактор CREB1 повышает активность промотора гена IL33, содержащего рисковый аллель полиморфизма rs928413 [16]. Изучение детальных аспектов регуляции экспрессии IL33 и способов воздействия на нее позволит расширить имеющиеся знания о взаимодействии иммунной системы с раковыми клетками. В ходе данного исследования выявлены ключевые участки промотора IL33, важные для его активности в клетках опухоли легкого и молочной железы человека, а также идентифицированы транскрипционные факторы SP1 и FOXA1 как регуляторы экспрессии гена IL33.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии. Линия карциномы легких человека NCIH-196 получена из Американской коллекции типовых культур (АТСС, США). Клетки культивировали в ростовой среде RPMI-1640 (“Life Technologies”, США) с добавлением 10% эмбриональной телячьей сыворотки (FBS; “Thermo Fisher Scientific”, США). Клетки рака молочной железы человека MCF-7 любезно предоставлены E. Zabarovsky из Каролинского института (Стокгольм, Швеция), аутентичность локального стока клеток MCF-7 была подтверждена в 2016 году с использованием метода коротких тандемных повторов (STR-анализ), проведенного на коммерческой основе (“Гордиз”, Россия). Линию MCF-7 культивировали в ростовой среде DMEM (“Life Technologies”) с добавлением 10% FBS.
Создание люциферазных репортерных конструкций. Варианты промотора IL33 №2 (‒1398/+79) и №3 (‒786/+79) амплифицированы на основе имеющегося варианта №1 (‒2512/+79) [16] c использованием праймеров, содержащих сайты рестрикции HindIII и NcoI. Последовательности используемых праймеров приведены в табл. 1. Варианты промотора IL33 №1, содержащие делеции и мутации потенциальных сайтов связывания SP1 и FOXA1, амплифицировали методом двухэтапной ПЦР и проверяли последующим секвенированием. Для каждого варианта промотора с делециями 2, 3, 4, 5, 6, 7, 8 амплифицировали по 2 фрагмента (в табл. 1 обозначены как A и B, фрагмент A – находился с 5'-конца относительно делеции, фрагмент B – с 3'-конца), подвергали их рестрикции по внесенному сайту BamHI и лигировали. Для фрагментов 2A, 3A, 4A, 5A, 6A, 7A, 8А, 9 в качестве прямого праймера брали тот, с которым проводили амплификацию промотора IL33 №1. Для фрагментов 1, 2B, 3B, 4B, 5B, 6B, 7B, 8В в качестве обратного праймера использовали подобранный для амплификации промотора IL33. Для внесения точечных мутаций применяли перекрывающиеся праймеры, содержавшие в себе мутированные сайты связывания SP1 и FOXA1; при этом прямой праймер использовали в паре с обратным праймером для амплификации промотора IL33 №1, а обратный праймер ‒ в паре с прямым праймером для амплификации промотора IL33 №1. Затем амплифицировали перекрывающиеся фрагменты промотора, содержавшие мутированные сайты, и проводили overlap-ПЦР. Все исследуемые варианты промотора IL33 клонировали в вектор pGL3 basic (“Promega”, США), содержащий репортерный ген люциферазы Firefly, по сайтам рестрикции HindIII и NcoI.
Таблица 1.
Праймеры для амплификации вариантов промотора IL33, внесения делеций и точечного мутагенеза
| Праймерa | Последовательность 5' → 3' |
|---|---|
| IL33-1 fw | GCGAAGCTTACCATTGAGTACAACCAGAA |
| IL33-2 fw | TCTAAGCTTTAAGGCATGAAGCATAATTA |
| IL33-3 fw | GTCAAGCTTTGTAGATTGAATGGATGTAG |
| IL33 rev | AATCCATGGTATTCAGTCTTACCTTGTGA |
| 1 fw | GGTAAGCTTTTACGAGAGCATTGGCCAAG |
| 2A rev | GTTGGATCCCTATTAAAAAGTAGCTAACT |
| 2B fw | GGTGGATCCGGCCAGGCCCCCAGCAAGAA |
| 3A rev | ACGGGATCCCTTCCAATTTCCAATTTTGT |
| 3B fw | GGCGGATCCTCAGCCTCTTAAAAGCAGAG |
| 4A rev | AGGGGATCCTGCTTTTAAGAGGCTGATTT |
| 4B fw | TCCGGATCCGCCAGACACAGTGGCTCACG |
| 5A rev | GAGGGATCCCTGGATGAAACAATTTCTAA |
| 5B fw | GTTGGATCCCCGGGCATGGTGGCGGGCGC |
| 6A rev | ACGGGATCCCTAATTTTTTGTATTTTGTA |
| 6B fw | AATGGATCCGAGCGAGACTCCATCTCAAA |
| 7A rev | ACGGGATCCCGTCGCCCAGGCTGGAGTGC |
| 7B fw | GGCGGATCCATCAATAATTACAATAGATG |
| 8A rev | GTTGGATCCATATTTGAATTTGCTTCTAC |
| 8B fw | TCCGGATCCAAGTTTGAAAGAAAAAAGAT |
| 9 rev | TAACCATGGTCTGTGTCCTTACATTAAAG |
| SP1 site mutation fw | AACCTGGGATGCTTAGCTTGAAGTGAGCT |
| SP1 site mutation rev | CTTCAAGCTAAGCATCCCAGGTTCACACT |
| FOXA1 site mutation fw | CCATCTCAAAATAAATAAGTGTATAAATA |
| FOXA1 site mutation rev | ATTCACATATTTATTTATTTTGAGATGGA |
Трансфекция клеток NCIH-196 и MCF-7 и тест люциферазной активности. Клетки MCF-7 (по 1 млн на точку) трансфицировали 5 мкг плазмидной ДНК (оригинальный вектор pGL3 basic и его модификации, содержащие регуляторные элементы гена IL33) и 100 нг контрольного репортерного вектора pRL-CMV, содержащего ген люциферазы Renilla (“Promega”, США), с использованием капиллярного электропоратора Neon (“Thermo Fisher Scientific”). Электропорацию проводили при следующих условиях: напряжение импульса ‒ 1100 В, длительность импульса ‒ 30 мc, число импульсов ‒ 2. Клетки NCIH-196 (по 1 млн на точку) трансфицировали 1.8 мкг плазмидной ДНК и 0.2 мкг вектора pRL-CMV. Трансфекцию проводили с использованием мультикомпонентной смеси X-tremeGENE HP DNA Transfection Reagent (“Roche”, Швейцария), содержащей липиды, согласно протоколу производителя. Через 24 ч проводили измерение активности люцифераз Firefly и Renilla на люминометре 20/20n (“TurnerBioSystems”, США) с использованием набора Dual-Luciferase Reporter Assay System (“Promega”) согласно протоколу производителя. При обработке результатов значения активности люциферазы Firefly нормализовали на активность люциферазы Renilla.
Нокдаун факторов SP1 и FOXA1 с использованием коротких интерферирующих РНК (siРНК). Олигонуклеотидные последовательности специфичных siРНК и контрольной (scrambled) siРНК, подобранные с помощью базы данных NCBI Probe [17] и онлайн-ресурса siРНК Wizard (“InvivoGen”, США), синтезированы на коммерческой основе (“Синтол”, Россия). Для получения дуплекса siРНК смешивали равные количества смыслового (sense) и антисмыслового (antisense) олигонуклеотидов в буфере, содержащем 10 мM Tris-HCl (pH 8.0) и 20 мM NaCl, нагревали раствор до 95°C и медленно охлаждали до 25°C. Для определения эффективности работы подобранных вариантов siРНК ими трансфицировали клетки MCF-7 и NCIH-196, после чего оценивали уровень экспрессии мРНК SP1 и FOXA1 методом ПЦР в реальном времени. Для эффективного подавления экспрессии факторов в последующих экспериментах использовали siРНК2 для SP1 и siРНК1 для FOXA1.
Проводили трансфекцию клеток MCF-7 и NCIH-196 полученными siРНК (в количестве 500 пмоль на 5 млн клеток) и через 48 ч трансфицировали клетки люциферазными конструкциями совместно с 200 пмоль двухцепочечной siРНК для обеспечения продолжительного подавления экспрессии генов. Для проведения ПЦР с обратной транскрипцией (ОТ-ПЦР) через 24 ч после трансфекции siРНК из клеток выделяли РНК и анализировали, как описано ниже. Последовательности siРНК и scrambled-РНК представлены в табл. 2.
Таблица 2.
Последовательности siРНК для нокдауна SP1, FOXA1
| siРНК | Последовательность 5' → 3' |
|---|---|
| SP1-siРНК-1 sense | CCACAAGCCCAAACAAUCAtt |
| SP1-siРНК-1 antisense | UGAUUGUUUGGGCUUGUGGgt |
| SP1-siРНК-2 sense | GGCAGACCUUUACAACUCAtt |
| SP1-siРНК-2 antisense | UGAGUUGUAAAGGUCUGCCct |
| SP1-scrambled sense | GUUCCUCCGAAACUACGUAta |
| SP1-scrambled antisense | GCUUGGUAUGCGGUAAUCAct |
| FOXA1-siРНК-1 sense | GGACUUCAAGGCAUACGAAtt |
| FOXA1-siРНК-1 antisense | UUCGUAUGCCUUGAAGUCCag |
| FOXA1-siРНК-2 sense | ACAUGACCAUGAACACCAUtt |
| FOXA1-siРНК-2 antisense | AUGGUGUUCAUGGUCAUGUag |
| FOXA1-scrambled sense | GTGTACCTAGACGCAAATAgt |
| FOXA1-scrambled antisense | GGTGCTCCATCGTGTTCAAta |
Выделение РНК и ОТ-ПЦР в реальном времени. РНК выделяли методом гуанидин тиоцианат-фенол-хлороформной экстракции с помощью реагента TRIzol (“Invitrogen”, США) по протоколу производителя. Для синтеза первой цепи кДНК использовали набор реактивов MMLV RT kit (“Евроген”, Россия). Количественную ПЦР в реальном времени проводили в амплификаторе ABI 7500 Real-Time PCR System (“Applied Biosystems”, США) с использованием реактива qPCRmix-HS SYBR+LowROX (“Евроген”). Последовательности праймеров для амплификации кДНК SP1, FOXA1, IL33 и ACTB (ген β-актина) представлены в табл. 3.
Таблица 3.
Праймеры для ОТ-ПЦР
| Праймер | Последовательность 5' → 3' |
|---|---|
| IL33 fw | GACTCCTCCGAACACAGAGC |
| IL33 rev | GGCCTTCTGTTGGGATTTTCC |
| SP1 fw | TTGAAAAAGGAGTTGGTGGC |
| SP1 rev | TGCTGGTTCTGTAAGTTGGG |
| FOXA1 fw | CGCTTCGCACAGGGCTGGAT |
| FOXA1 rev | TGCTGACCGGGACGGAGGAG |
| ACTB fw | TGCGTGACATTAAGGAGAAG |
| ACTB rev | GTCAGGCAGCTCGTAGCTCT |
Анализ уровня белков методом иммуноблотинга. Для приготовления клеточных лизатов использовали 5× буфер Лэммли. Белки, содержащиеся в образцах (по 0.2 × 106 клеток на точку), разделяли электрофорезом в полиакриламидном геле в денатурирующих условиях (0.375 М Трис-HCl, pH 8.8, 12% акриламид, 0.1% SDS) и переносили на нитроцеллюлозную мембрану (4°С, 3 ч). Эффективность переноса белков оценивали по окрашиванию мембраны красителем Понсо. Блокировали незанятые участки мембраны 5%-ным раствором обезжиренного сухого молока в буфере TBST, содержащем 20 мМ Трис-HCl (pH 8.0), 150 мМ NaCl, 0.1% Tween-20, при 25°С в течение 30 мин и инкубировали с антителами к IL-33 (ab54385; “Abcam”, Великобритания) в разведении 1 : 1 000 и к β-актину (ab8229; “Abcam”) в разведении 1 : 3000. Визуализацию полос проводили с использованием субстрата Supersignal West Dura (“Thermo Fisher Scientific”) и ChemiDoc XRS+ (“BioRad”, США). Для обработки изображений использовали программу ImageJ.
Статистический анализ. Статистическую обработку результатов проводили с использованием программного обеспечения Microsoft Excel. Для определения статистической значимости различий между двумя независимыми выборками применяли двусторонний непарный t-критерий Стьюдента. Различия считали достоверными при значениях P < 0.01 и P < 0.005. Вне зависимости от типа эксперимента каждый образец был представлен как минимум в трех биологических повторах. Данные на графиках представлены в виде среднего и стандартных ошибок среднего (планки погрешностей).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Участок ‒2512/‒1399 промотора IL33 отвечает за повышение его базовой активности
Для определения возможных механизмов регуляции экспрессии гена IL33 необходимо было идентифицировать его цис-регуляторные элементы. Для достижения этой цели мы использовали UCSC Genome Browser (http://genome.ucsc.edu/, сборка Human Feb. 2009 GRCh37/hg19). В качестве маркеров регуляторных элементов использовали несколько характерных признаков: чувствительность регуляторных областей к ДНКазе I, их ассоциация с такими модификациями гистонов, как H3K4me1, H3K4me3, H3K27ac, а также скопление в зоне цис-регуляторных элементов потенциальных участков связывания ядерных транскрипционных факторов. Результаты поиска приведены на рис. 1а.
Рис. 1.
Участок ‒2512/‒1399 промотора IL33 отвечает за повышение его базовой активности. а ‒ Схематическое изображение 5'-области гена IL33 человека с выделенными участками модификаций гистонов, кластерами чувствительности к ДНКазе I и предсказанными сайтами транскрипционных факторов (UCSC Genome Browser, сборка GRCh37/hg19). H3K4me1 ‒ трек, иллюстрирующий зоны монометилирования гистона Н3 по Lys4; H3K4me3 ‒ трек, иллюстрирующий зоны триметилирования гистона Н3 по лизину 4; H3K27ac ‒ трек, иллюстрирующий зоны ацетилирования гистона Н3 по Lys27. б ‒ Вариант промотора IL33 №1 обеспечивает высокую экспрессию гена-репортера в клетках MCF-7 и NCIH-196. Цифрами на схеме обозначено положение нуклеотидов относительно старта транскрипции. Репортерные конструкции содержат ген люциферазы Firefly под контролем одного из вариантов промотора IL33. Уровень активности промотора соответствует уровню активности люциферазы Firefly в клеточных лизатах, нормализованному на активность люциферазы Renilla. Представлен результат пяти независимых экспериментов. *P < 0.01 по отношению к варианту промотора IL33 №3, #P < 0.005 по отношению к плазмиде pGL3 basic.
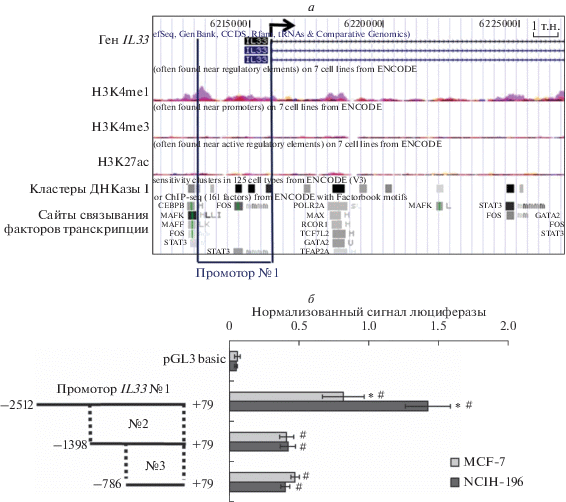
Ранее, с учетом описанных признаков, нами идентифицирован дистальный промотор IL33 (промотор № 1, 2512 п.о. от старта транскрипции) [16]. На основе вышеописанного биоинформатического анализа мы предположили, что ключевые участки, важные для активности промотора IL33, могут располагаться ближе к старту транскрипции. Для проверки гипотезы на основе промотора №1 были амплифицированы варианты №2 и №3 (рис. 1б). В качестве модельной системы для измерения уровня активности регуляторных элементов использовали линии опухоли молочной железы человека MCF-7 и карциномы легких NCIH-196, отличающиеся повышенной экспрессией гена IL33. Активность промотора в исследуемых линиях определяли по активности люциферазы Firefly, нормализованной на активность люциферазы Renilla. Представленные на рис. 1б результаты позволяют сделать вывод, что наибольшей активностью обладает первый вариант промотора, в то время как сокращение его длины в вариантах 2 и 3 приводит к падению интенсивности генной экспрессии. Данный эффект проявлялся в обеих линиях клеток и был статистически значимым. Подобный результат может быть обусловлен наличием в промоторе №1 участков, критически важных для модуляции его активности. В частности зоны, локализованные в области −2512/−1399 п.о. и отсутствующие в промоторах №2 и 3, содержат предсказанные сайты связывания ключевых транскрипционных факторов. Учитывая полученные результаты, в последующих экспериментах мы использовали вариант промотора IL33 №1.
Участки ‒1872/‒1745 и ‒1744/‒1618 играют ключевую роль в регуляции активности промотора IL33 №1
Для выявления зон, играющих ключевую роль в активности промотора IL33 №1, применили метод делеционного мутагенеза. На рис. 2 представлен нормализованный результат измерения сигнала биолюминесценции продукта люциферазной реакции Firefly (собраны данные, полученные в 5 независимых экспериментах).
Рис. 2.
Делеции участков ‒1872/‒1745 и ‒1744/‒1618 приводят к наибольшему падению активности промотора IL33 №1 в клетках MCF-7 и NCIH-196. Слева приведена схема расположения делеций на участке промотора IL33 №1 (‒2512/‒1399 п.о.). Справа показан результат измерения активности делеционных вариантов промотора IL33 №1 в люциферазной репортерной системе. Уровень активности промотора соответствует уровню активности люциферазы Firefly в клеточных лизатах, нормализованному на активность люциферазы Renilla. Представлен результат пяти независимых экспериментов. *P < 0.01, **P < 0.005 по отношению к варианту промотора IL33 № 1. Отличие всех вариантов промотора IL33 от плазмиды pGL3 basic статистически достоверно (P < 0.005).
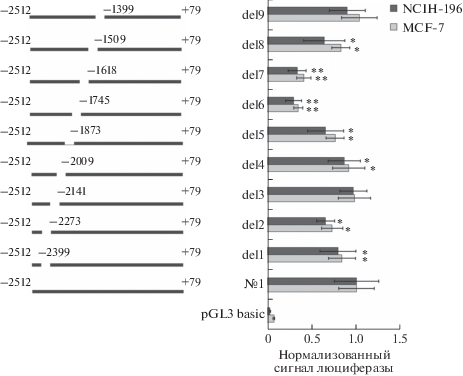
Согласно полученным результатам, в обеих линиях клеток все делеции, кроме 3 и 9, приводят к снижению базового уровня активности промотора IL33 №1. Наиболее сильное падение активности происходит при удалении участков 6 и 7, что говорит о критической роли этих зон в регуляции активности промотора IL33 №1.
Подавление экспрессии факторов SP1 и FOXA1 ассоциировано со снижением активности промотора и уровня экспрессии гена IL33
Для определения функциональной роли участков 6 и 7 промотора IL33 в этих зонах провели поиск потенциальных сайтов связывания транскрипционных факторов, используя базу данных JASPAR (www.jaspar.genereg.net). В результате при пороге значимости 90% были сформированы два списка сайтов для факторов с наиболее высоким рейтингом: ZNF460, SP1, SREBF1, TFAP2A, SREBF2 для участка 6 и ONECUT1, POU4F1, FOXD2, FOXD1, FOXA1 для участка 7. Мы исключили из рассмотрения ZNF460, ONECUT1, POU4F1, TFAP2A, FOXD2 и FOXD1, так как в обеих исследуемых линиях эти факторы экспрессируются на низком уровне (согласно данным базы CCLE: www.broadinstitute.org/ccle). Факторы SREBF1 и SREBF2 оказались нерелевантными для исследования в силу их биологической роли: они участвуют в регуляции липидного обмена [18], а также в развитии диабета 2 типа [19] и сердечно-сосудистых заболеваний [20].
Следует сказать, что факторы SP1 (5'-GCTCCGCCTCC-3' на минус-цепи; ‒1801/‒1791) и FOXA1 (5'-TATTTATTTATTTTG-3' на минус-цепи; ‒1728/‒1714), согласно литературным данным, принимают участие в канцерогенезе. Многие опухоли, включая рак легкого, отличаются повышенной экспрессией фактора SP1 [21, 22], а высокий уровень экспрессии FOXA1 наблюдается при опухолях легкого и молочной железы [23]. Известно, что SP1 принимает непосредственное участие в канцерогенезе, стимулируя пролиферацию, миграцию и инвазию клеток рака легкого [22], а также способствует прогрессии рака молочной железы [24]. Повышенная экспрессия FOXA1 коррелирует с низкой выживаемостью пациентов с раком легкого [23], а подавление его активности приводит к замедлению роста опухоли легкого [25, 26], а также опухоли молочной железы [27].
На основе вышесказанного мы предположили, что повышение уровня активности промотора гена IL33 в опухолевых клетках может быть обусловлено связыванием транскрипционных факторов SP1 и FOXA1 со своими сайтами. В свою очередь, повышенный уровень экспрессии IL33 может способствовать прогрессии опухоли легкого и молочной железы.
Оценку влияния статуса факторов SP1 и FOXA1 на активность промотора гена IL33 проводили методами точечного мутагенеза и РНК-интерференции (эффективность siРНК определяли, измеряя уровень экспрессии мРНК SP1 и FOXA1) (рис. 3а, 4а). Клетки MCF-7 и NCIH-196 трансфицировали репортерными конструкциями с вариантами промотора IL33 №1, содержащими оригинальные либо мутированные сайты связывания SP1 (рис. 3б) и FOXA1 (рис. 4б), а также специфичными к данным факторам siРНК.
Рис. 3.
Снижение экспрессии фактора SP1 ассоциировано с уменьшением активности промотора IL33 в клетках MCF-7 и NCIH-196. а ‒ РНК-интерференция приводит к подавлению экспрессии фактора SP1; “siРНК” и “scrambled РНК” означают добавление siРНК и контрольной РНК соответственно. Данные ОТ-ПЦР получены с использованием подсчета ΔΔCt, нормализованы на уровень ACTB и приведены к уровню экспрессии в контрольной пробе для линии NCIH-196. *P < 0.01 по отношению к контролю. б ‒ Позиционно-весовая матрица для сайта связывания фактора SP1 и схема его мутаганеза. в ‒ Подавление экспрессии фактора SP1 и наличие мутаций в сайте его связывания приводит к снижению активности промотора IL33. Прямоугольниками обозначены сайты связывания SP1 (оригинальный и мутированный). Представлен нормализованный результат измерения сигнала биолюминесценции продукта люциферазной реакции Firefly, полученный в 5 независимых экспериментах. * P < 0.01 по отношению к контролю; # P < 0.01 по отношению к оригинальному промотору IL33. Отличие всех вариантов промотора IL33 от плазмиды pGL3 basic статистически достоверно (P < 0.005).
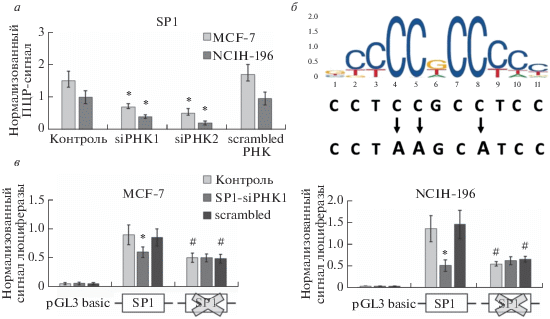
Рис. 4.
Снижение экспрессии фактора FOXA1 ассоциировано с уменьшением активности промотора IL33 в клетках MCF-7. а ‒ РНК-интерференция приводит к подавлению экспрессию фактора FOXA1; “siРНК” и “scrambled РНК” означают добавление siРНК к FOXA1 и контрольной РНК соответственно. Данные ОТ-ПЦР получены с использованием подсчета ΔΔCt, нормализованы на уровень ACTB и приведены к уровню экспрессии в контрольной пробе для линии NCIH-196. * P < 0.01 по отношению к контролю. б ‒ Позиционно-весовая матрица для сайта связывания фактора FOXA1 и схема его мутаганеза. в ‒ Подавление экспрессии фактора FOXA1 и наличие мутаций в сайте его связывания приводит к снижению активности промотора IL33 в клетках MCF-7. Прямоугольниками обозначены сайты связывания FOXA1 (оригинальный и мутированный). Представлен нормализованный результат измерения сигнала биолюминесценции продукта люциферазной реакции Firefly, полученный в пяти независимых экспериментах. * P < 0.01 по отношению к контролю; # P < 0.01 по отношению к оригинальному промотору IL33. Отличие всех вариантов промотора IL33 от плазмиды pGL3 basic статистически достоверно (P < 0.005).
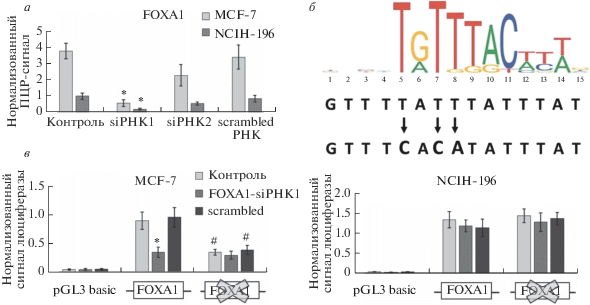
На основании полученных результатов можно сделать вывод, что нокдаун SP1, как и наличие в промоторе мутаций, инактивирующих сайт связывания SP1, приводят к снижению активности промотора IL33 в обеих линиях клеток (рис. 3в). В то же время мутагенез сайта связывания FOXA1 и подавление экспрессии этого фактора приводят к аналогичному эффекту только в клетках MCF-7, не вызывая изменения активности промотора IL33 в линии NCIH-196 (рис. 4в). Таким образом, связывание SP1 и FOXA1 на промоторе IL33 влияет на его активность, из чего можно предположить участие этих факторов в регуляции транскрипции гена IL33.
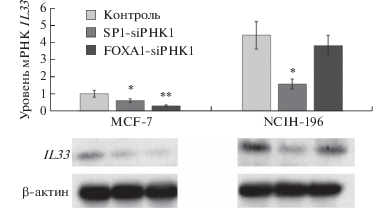
С целью исследовать влияние SP1 и FOXA1 на экспрессию гена IL33 мы провели оценку уровня мРНК и белка IL-33 в клетках MCF-7 и NCIH-196 в условиях подавления экспрессии этих факторов, опосредованного добавлением соответствующих siРНК. Анализ результатов ПЦР в реальном времени показал, что ингибирование фактора SP1 приводит к снижению экспрессии IL33 в клетках MCF-7 (~2 раза) и NCIH-196 (~3 раза), в то время как подавление FOXA1 ассоциировано с падением уровня экспрессии IL33 только в клетках MCF-7 (~3 раза) (рис. 5). Полученные данные согласуются с результатами теста люциферазной активности (рис. 3в и 4в) и подтверждают роль факторов SP1 и FOXA1 в регуляции экспрессии IL33.
Рис. 5.
Нокдаун факторов SP1 и FOXA1 вызывает снижение уровня экспрессии мРНК и белка IL-33. Данные ОТ-ПЦР получены с использованием подсчета ΔΔCt и нормализованы на уровень мРНК β-актина. Представлены данные пяти независимых экспериментов. * P < 0.01, ** P < 0.005 по отношению к контролю. Снизу представлен воспроизводимый результат оценки уровня белка методом иммуноблотинга, полученный в одном из трех независимых экспериментов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прогрессия опухоли часто сопровождается изменением уровня цитокинов, что вызывает снижение ее иммуногенности. Множество экспериментальных данных подтверждает, что повышенная экспрессия IL-33 характерна как для клеток микроокружения, так и для самой опухоли. Высокий уровень этого цитокина в строме и сыворотке опухоли способствует ее прогрессии и метастазированию путем мобилизации клеток-супрессоров миелоидного происхождения, регуляторных Т-клеток и гемопоэтических клеток-предшественников костного мозга [8, 28]. Однако механизмы, лежащие в основе прямой регуляции экспрессии IL-33, как в опухолевом, так и в стромальном компартментах, исследованы недостаточно.
Множество данных, свидетельствующих о проопухолевой роли IL-33, получено на различных моделях рака легкого и молочной железы. Известно, что стимуляция клеток рака легкого человека, А549, цитокином IL-33 способствует их метастазированию [29]. IL-33 также повышает пролиферацию и метастазирование клеток немелкоклеточного рака легкого (НМРЛ) [10], в то время как блокада этого цитокина значительно подавляет рост ксенотрансплантатов НМРЛ [30]. При раке молочной железы IL-33 способствует росту опухоли, стимулируя пролиферацию клеток эпителия посредством активации сигнальных путей JNK/cJun, MEK/ERK и STAT3 [6]. Также известно, что повышенная экспрессия IL-33 в клетках рака молочной железы коррелирует с их устойчивостью к воздействию тамоксифена, стимулируя возникновение у опухоли свойств, характерных для стволовых клеток [31].
В представленной работе проведен делеционный анализ промотора гена IL33 и выявлены ключевые участки, важные для его активности. Роль этих участков, по всей видимости, обусловлена наличием в них сайтов связывания транскрипционных факторов SP1 и FOXA1, влияющих на активность промотора и экспрессию гена IL33 в клетках рака легкого человека NCIH-196 и опухоли молочной железы человека MCF-7. Установлено, что фактор SP1 участвует в регуляции экспрессии IL33 в обеих линиях. Полученные результаты согласуются с хорошо известной ролью SP1 в прогрессии рака молочной железы [24] и канцерогенезе рака легкого, которая связана с индукцией пролиферации и метастазирования опухолевых клеток [22]. Необходимо отметить, что выраженность эффекта в обеих линиях, по всей видимости, также связана с высоким уровнем экспрессии SP1 в них. Нами показано, что фактор FOXA1, хорошо известный онкоген, важен для экспрессии гена IL33 в клетках MCF-7. Согласно литературным данным, FOXA1 стимулирует рост клеток MCF-7 и ответственен за развитие устойчивости к фулвестранту (препарату, используемому для лечения одного из видов метастатического рака молочной железы) [32], в то время как подавление его активности приводит к замедлению роста опухоли молочной железы [27]. Полученные нами результаты не позволяют говорить о значимом влиянии FOXA1 на активность промотора и экспрессию гена IL33 в клетках NCIH-196. Вероятно, это может быть связано с низким базальным уровнем экспрессии FOXA1 в этой линии опухолевых клеток.
Как следует из вышесказанного, нами выявлен возможный механизм регуляции экспрессии гена IL33 транскрипционными факторами SP1 и FOXA1. В связи с тем, что в задачи этого исследования не входил анализ прямого связывания SP1 и FOXA1 с промотором IL33, можно предполагать, что их влияние может быть опосредовано действием промежуточных факторов. Повышенный уровень IL-33, вырабатываемый клетками рака легкого и молочной железы, может способствовать развитию опухолеассоциированного воспаления и возникновению условий иммуносупрессии, что благоприятствует прогрессии опухоли. В ходе дальнейших исследований мы планируем детально проанализировать связывание транскрипционных факторов SP1 и FOXA1 с предсказанными сайтами в промоторе IL33.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (№ 18-34-01004).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
ggarwal B.B., Vijayalekshmi R. V, Sung B. (2009) Targeting inflammatory pathways for prevention and therapy of cancer : short-term friend, long-term foe. Clin. Cancer Res. 15(2), 425–430
Leibovici J., Itzhaki O., Huszar M., Sinai J. (2011) The tumor microenvironment: part 1. Immunotherapy. 3, 1367–1384.
Kumar J., Surh Y. (2008) Inflammation: gearing the journey to cancer. Mutat. Res. 659, 15–30.
Liew F.Y., Pitman N.I., McInnes I.B. (2010) Disease-associated functions of IL-33: the new kid in the IL-1 family. Nat. Rev. Immunol. 10, 103–110.
Gao X., Wang X., Yang Q., Zhao X., Wen, WenJiang J., Wu C., Zhang X. (2014) Tumoral expression of IL-33 inhibits tumor growth and modifies the tumor microenvironment through CD8 + T and NK cells. J. Immunol. 194(1), 438-445.
Kim J.Y., Lim S., Kim G., Yun H.J., Ahn S., Choi H.S. (2014) Interleukin-33/ST2 axis promotes epithelial cell transformation and breast tumorigenesis via upregulation of COT activity. Oncogene. 34(38), 4928‒4938.
Chen S.-F., Nieh S., Jao S.-W., Wu M.-Z., Liu C.-L., Chang Y.-C., Lin Y.-S. (2013) The paracrine effect of cancer-associated fibroblast-induced interleukin-33 regulates the invasiveness of head and neck squamous cell carcinoma. J. Pathol. 231, 180–189.
Jovanovic I.P., Pejnovic N.N., Radosavljevic G.D., Pantic J.M., Milovanovic M.Z., Arsenijevic N.N., Lukic M.L. (2014) Interleukin-33/ST2 axis promotes breast cancer growth and metastases by facilitating intratumoral accumulation of immunosuppressive and innate lymphoid cells. Int. J. Cancer. 134, 1669–1682.
Xiao P., Wan X., Cui B., Liu Y., Qiu C., Rong J., Zheng M., Song Y., Chen L., He J., Tan Q., Wang X., Shao X., Liu Y., Cao X., Wang Q. (2016) Interleukin 33 in tumor microenvironment is crucial for the accumulation and function of myeloid-derived suppressor cells. Oncoimmunology. 5, e1063772.
Wang C., Chen Z., Bu X., Han Y., Shan S., Ren T., Song W. (2016) IL-33 signaling fuels outgrowth and metastasis of human lung cancer. Biochem. Biophys. Res. Commun. 479, 461–468.
Hu L., Fu Y., Zhang D., Zhang J. (2013) Serum IL-33 as a diagnostic and prognostic marker in non- small cell lung cancer. Asian Pacific J. Cancer Prev. 14, 2563–2566.
Liu J., Shen J., Hu J., Huang W., Zhang G. (2014) Significance of interleukin-33 and its related cytokines in patients with breast cancers. Front. Immunol. 5, 141.
Liu X., Zhu L., Lu X., Bian H., Wu X., Yang W., Qin Q. (2014) IL-33/ST2 pathway contributes to metastasis of human colorectal cancer. Biochem. Biophys. Res. Commun. 453, 486–492.
Yu X.X., Hu Z., Shen X., Dong L.Y., Zhou W.Z., Hu W.H. (2015) IL-33 promotes gastric cancer cell invasion and migration via ST2–ERK1/2 pathway. Dig. Dis. Sci. 60, 1265–1272.
Tsuda H., Komine M., Tominaga S., Ohtsuki M. (2017) Identification of the promoter region of human IL-33 responsive to induction by IFNγ. J. Dermatol. Sci. 85, 137–140.
Gorbacheva A., Korneev K., Kuprash D., Mitkin N. (2018) The risk G allele of the single-nucleotide polymorphism rs928413 creates a CREB1-binding site that activates IL33 promoter in lung epithelial cells. Int. J. Mol. Sci. 19, 2911.
Hasson S.A., Kane L.A., Yamano K., Huang C.H., Sliter D.A., Buehler E., Wang C., Heman-Ackah S.M., Hessa T., Guha R., Martin S.E., Youle R.J. (2013) High-content genome-wide RNAi screens identify regulators of parkin upstream of mitophagy. Nature. 504, 291–295.
Bommer G.T., MacDougald O.A. (2011) Regulation of lipid homeostasis by the bifunctional SREBF2-miR33a locus. Cell Metab. 13, 241–247.
Moon Y.A., Liang G., Xie X., Frank-Kamenetsky M., Fitzgerald K., Koteliansky V., Brown M.S., Goldstein J.L., Horton J.D. (2012) The Scap/SREBP pathway is essential for developing diabetic fatty liver and carbohydrate-induced hypertriglyceridemia in animals. Cell Metab. 15, 240–246.
Park H.J., Georgescu S.P., Du C., Madias C., Aronovitz M.J., Welzig C.M., Wang B., Begley U., Zhang Y., Blaustein R.O., Patten R.D., Karas R.H., Van Tol H.H., Osborne T.F., Shimano H., Liao R., Link M.S., Gal-per J.B. (2008) Parasympathetic response in chick myocytes and mouse heart is controlled by SREBP. J. Clin. Invest. 118, 259–271.
Hsu T.I., Wang M.C., Chen S.Y., Yeh Y.M., Su W.C., Chang W.C., Hung J.J. (2012) Sp1 expression regulates lung tumor progression. Oncogene. 31, 3973–3988.
Wang R., Xu J., Xu J., Zhu W., Qiu T., Li J., Zhang M., Wang Q., Xu T., Guo R., Lu K., Yin Y., Gu Y., Zhu L., Huang P., Liu P., Liu L., De W., Shu Y. (2018) MiR-326/Sp1/KLF3: a novel regulatory axis in lung cancer progression. Cell Prolif. 52(2), e12551.
Huang C., Yonemura Y., Xiong B., Liu J., Yang X. (2018) Expression and prognosis analyses of forkhead box A (FOXA) family in human lung cancer. Gene. 685, 202–210.
Zhao Y., Ma J., Fan Y., Wang Z., Tian R., Ji W., Zhang F., Niu R. (2018) TGF-β transactivates EGFR and facilitates breast cancer migration and invasion through canonical Smad3 and ERK/Sp1 signaling pathways. Mol. Oncol. 12, 305–321.
Wang H., Liu X.S., Wang G., Zhang F., Meyer C.A., Fei T. (2013) A systematic approach identifies FOXA1 as a key factor in the loss of epithelial traits during the epithelial-to-mesenchymal transition in lung cancer. BMC Genomics. 14, 680.
Li J., Zhang S., Zhu L., Ma S. (2018) Role of transcription factor FOXA1 in non-small cell lung cancer. Mol. Med. Rep. 17, 509–521.
Schrijver W., Schuurman K., van Rossum A., Droog M., Jeronimo C., Salta S., Henrique R., Wesseling J., Moelans C., Linn S.C., van den Heuvel M., van Diest P., Zwart W. (2018) FOXA1 levels are decreased in pleural breast cancer metastases after adjuvant endocrine therapy, and this is associated with poor outcome. Mol. Oncol. 12, 1884–1894.
Kaplan R.N., Riba R.D., Zacharoulis S., Bramley A.H., Vincent L., Costa C., MacDonald D.D., Jin D.K., Shido K., Kerns S.A., Zhu Z., Hicklin D., Wu Y., Port J.L., Altorki N., Port E.R., Ruggero D., Shmelkov S. V., Jensen K.K., Rafii S., Lyden D. (2005) VEGFR1-po-sitive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature. 438, 820–827.
Yang Z., Gao X., Wang J., Xu L., Zheng Y., Xu Y. (2018) Interleukin-33 enhanced the migration and invasiveness of human lung cancer cells. OncoTargets Ther. 11, 843–849.
Wang K., Shan S., Yang Z., Gu X., Wang Y., Wang C., Ren T., Wang K., Shan S., Yang Z., Gu X., Wang Y., Wang C., Ren T. (2017) IL-33 blockade suppresses tumor growth of human lung cancer through direct and indirect pathways in a preclinical model. Oncotarget. 8, 68571–68582.
Hu H., Sun J., Wang C., Bu X., Liu X., Mao Y., Wang H. (2017) IL-33 facilitates endocrine resistance of breast cancer by inducing cancer stem cell properties. Biochem. Biophys. Res. Commun. 485, 643–650.
Rheinbay E., Parasuraman P., Grimsby J., Tiao G., Engreitz J.M., Kim J., Lawrence M.S., Taylor-Weiner A., Rodriguez-Cuevas S., Rosenberg M., Hess J., Stewart C., Maruvka Y.E., Stojanov P., Cortes M.L., Seepo S., Cibulskis C., Tracy A., Pugh T.J., Lee J., Zheng Z., Ellisen L.W., Iafrate A.J., Boehm J.S., Gabriel S.B., Meyerson M., Golub T.R., Baselga J., Hidalgo-Miranda A., Shioda T., Bernards A., Lander E.S., Getz G. (2017) Recurrent and functional regulatory mutations in breast cancer. Nature. 547, 55–60.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


