Молекулярная биология, 2021, T. 55, № 3, стр. 402-411
Пептидный препарат АКТГ(4-7)PGP (семакс) подавляет транскрипцию генов провоспалительных медиаторов, индуцированную обратимой ишемией мозга крыс
Л. В. Дергунова a, *, **, В. Г. Дмитриева a, И. Б. Филиппенков a, В. В. Ставчанский a, А. Е. Денисова b, В. В. Южаков c, Л. Е. Севанькаева c, Л. В. Валиева a, О. Ю. Сударкина a, Л. В. Губский b, Н. Ф. Мясоедов a, С. А. Лимборская a
a Научно-исследовательский центр “Курчатовский институт” – Институт молекулярной генетики
123182 Москва, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Министерства здравоохранения Российской Федерации
117997 Москва, Россия
c Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центра радиологии Министерства здравоохранения Российской Федерации
249036 Калужская область, Обнинск, Россия
* E-mail: lvd@img.ras.ru
** E-mail: lvdergunova@mail.ru
Поступила в редакцию 29.07.2020
После доработки 16.08.2020
Принята к публикации 23.08.2020
Аннотация
Пептидный препарат семакс успешно применяется при ишемическом инсульте. Семакс обладает ярко выраженным ноотропным, нейропротективным и иммуномодулирующим действием. Проведенный нами ранее RNA-Seq-анализ повреждающего действия ишемии на уровне транскриптома в условиях моделирования обратимой окклюзии средней мозговой артерии обнаружил увеличение содержания мРНК ряда генов, участвующих в воспалении, тогда как семакс снижал их экспрессию. Однако RNA-Seq не выявил значимых эффектов ишемии–реперфузии и семакса на экспрессию мРНК многих генов, кодирующих хорошо известные медиаторы воспаления, в том числе IL-1α, IL-1β, IL-6, TNF-α. По данным RNA-Seq значения FPKM, характеризующие число фрагментов на 1 т.п.н., отнесенное на миллион прочтений, свидетельствовали о низком содержании мРНК таких генов. В связи с этим нами проанализировано влияние пептида на экспрессию низко представленных мРНК нескольких генов провоспалительных медиаторов с помощью метода ОТ-ПЦР в реальном времени, который позволяет наиболее точно определить содержание транскриптов в исследуемых образцах. По данным ОТ-ПЦР в реальном времени в условиях эксперимента под воздействием семакса происходило статистически значимое снижение экспрессии мРНК генов интерлейкинов (Il1a, Il1b, Il6) и хемокинов (Ccl3 и Cxcl2), компенсировавшее активацию транскрипции этих генов, вызванную ишемией–реперфузией. Таким образом, протективный эффект семакса при инсульте может быть обусловлен выраженным противовоспалительным действием пептида. Обсуждаются ограничения метода RNA-Seq и значимость ОТ-ПЦР в реальном времени для количественной оценки содержания низко представленных транскриптов.
ВВЕДЕНИЕ
Ишемический инсульт – одно из тяжелейших заболеваний с высокой инвалидизацией и смертностью. Острое снижение мозгового кровотока до критического уровня приводит к гибели нейронов и клеток глии, сопровождающейся массированным воспалением. Накопившиеся экспериментальные данные убедительно свидетельствуют о ключевой роли медиаторов воспаления в патогенезе ишемического инсульта. С первых часов ишемии в мозге экспрессируются провоспалительные цитокины IL-1α, IL-1β, IL-6 и TNF-α, которые оказывают мощное инициирующее и усиливающее действие на воспалительный ответ [1–3]. Показано, что уровень провоспалительных цитокинов в крови может коррелировать с объемом и тяжестью инсульта [4]. Кроме того, имеются данные, что ингибирование экспрессии или нейтрализация с помощью антител к IL-1β эффективно снижает объем инфаркта на моделях инсульта у крыс [1], а одновременный нокаут генов IL-1α и IL-1β в модели обратимой окклюзии средней мозговой артерии (tMCAO) мыши снижает объем очага инсульта в 3 раза [5]. Многочисленные исследования свидетельствуют об увеличении экспрессии мРНК провоспалительных цитокинов в мозге животных, подвергнутых церебральной ишемии [6–8]. В число провоспалительных цитокинов входят многие хемокины. Индукция хемокинов Ccl3 и Cxcl2 при инсульте ассоциирована с инфильтрацией лейкоцитов в очаг ишемии и увеличением проницаемости гематоэнцефалического барьера [9–11], поэтому подавление синтеза провоспалительных цитокинов относится к числу терапевтических стратегий, направленных на лечение ишемической травмы головного мозга.
В терапии ишемического инсульта успешно используется пептидный препарат семакс (Met-Glu-His-Phe-Pro-Gly-Pro), на N-конце которого находится фрагмент АКТГ(4–7), а С-конец стабилизирован присоединением трипептида Pro-Gly-Pro (PGP). Семакс обладает ярко выраженным ноотропным, нейропротективным и иммуномодулирующим действием [12–14]. Транскриптомные исследования с использованием неполной глобальной ишемии мозга крыс и перманентной окклюзии СМА крыс (pMCAO) показали, что пептид активирует экспрессию мРНК генов нейротрофинов и их рецепторов [15, 16], существенно влияет на экспрессию генов, ассоциированных с процессами иммунного ответа [17, 18].
Ранее для изучения эффектов ишемии и защитных свойств семакса на уровне транскриптома с помощью высокопроизводительного секвенирования РНК (RNA-Seq) мы использовали модель tMCAO [19, 20]. С помощью метода RNA-Seq в подкорковых структурах мозга крыс спустя сутки после начала 90-минутной окклюзии СМА обнаружено, что под действием пептида изменяется экспрессия мРНК 394 генов, участвующих в различных клеточных процессах, включая воспаление [20]. Введение семакса преимущественно подавляло экспрессию мРНК генов, связанных с воспалением (Ccl6, Ccl9, Cxcl16, Icam1, Cd14 и других), активация которых наблюдалась при ишемии–реперфузии в отсутствие пептида. Функциональная аннотация семакс-индуцированных дифференциально экспрессирующихся генов (ДЭГ) в условиях tMCAO также показала, что пептид подавляет многие сигнальные пути, участвующие в воспалении [20]. Однако проведенный нами RNA-Seq-анализ не выявил статистически значимого влияния семакса на экспрессию мРНК многих генов, кодирующих хорошо известные медиаторы воспаления, в том числе генов IL-1α, IL-1β, IL-6, TNF-α. По данным RNA-Seq значения FPKM, характеризующие число фрагментов на 1 т.п.н., отнесенное на миллион прочтений, свидетельствовали о низком содержании мРНК таких генов. В связи с этим нам представлялось важным проанализировать влияние пептида на экспрессию низко представленных мРНК нескольких генов провоспалительных медиаторов. С этой целью мы использовали метод ОТ-ПЦР в реальном времени, который позволяет наиболее точно определить содержание транскриптов в образцах [21].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные. Исследование проводили на двухмесячных самцах крыс линии Wistar массой 200–250 г, содержавшихся в условиях 12-часового цикла день/ночь, при температуре 22–24°С и свободном доступе к пище и воде. Исследование проведено с соблюдением биоэтических норм обращения с экспериментальными животными в соответствии с “Правилами лабораторной практики в РФ” (Приказ МЗ РФ №267 от 19.06.2003).
Модель tMCAO. Обратимую фокальную церебральную ишемию вызывали эндоваскулярной окклюзией правой СМА с использованием филамента с силиконовым наконечником (“Doccol Corporation”, США) как описано ранее [19, 20]. Окклюзия проходила в течение 90 мин, после чего филамент вынимали, и кровоток восстанавливался. Перед оперативным вмешательством животное вводили в наркоз с помощью 3%-го изофлурана, затем использовали 1.5–2%-ный изофлуран с 78%-ной смесью воздуха для поддержания наркоза при помощи системы для анестезии животных EZ-7000 (E-Z Anesthesia systems, США). Животные, подвергнутые полуторачасовой окклюзии, получали семакс (группа “ишемия–реперфузия + семакс”) в дозе 10 мкг на 100 г массы животного или физиологический раствор (группа “ишемия–реперфузия”). Пептид или физиологический раствор вводили животным интраперитонеально через 90 мин, 2.5 и 6.5 ч от начала окклюзии. Группу крыс, обозначенную как “ложная операция”, также подвергали хирургическому вмешательству под наркозом (разрез на шее, выделение бифуркации), но не производили окклюзию СМА. Животные группы “ложная операция” получали физиологический раствор в те же временные точки. Каждая экспериментальная группа состояла не менее чем из 10 животных. Крыс выводили из эксперимента методом декапитации спустя 24 ч после операции. Из мозга крыс выделяли подкорковые структуры. Образцы мозга помещали в раствор RNAlater (“Sigma-Aldrich”, США) на 24 ч при 0°С, а затем хранили при –70°С.
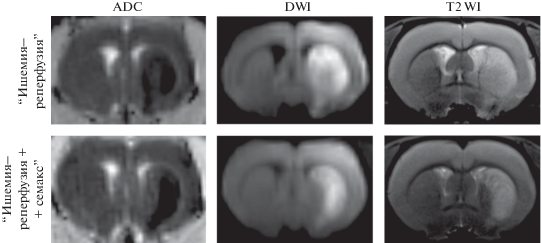
Магнитно-резонансная томография. Магнитно-резонансную томографию (МРТ) ишемического повреждения головного мозга крыс проводили с использованием системы ClinScan (“Bruker BioSpin”, США) для небольших животных с индукцией магнитного поля 7 Тл, как описано ранее [20]. Стандартный протокол включал следующие режимы: диффузионно-взвешенные изображения (DWI) с построением карт измеряемого коэффициента диффузии (ADC) и T2-взвешенные изображения (T2 WI) в поперечной плоскости. Трехмерную времяпролетную магнитно-резонансную ангиографию (3D-TOF MRA) использовали для визуализации основных артерий и контроля реканализации. Количественная оценка объема очага инфаркта выполнена с использованием программного пакета ImageJ (Wayne Rasband, National Institute of Mental Health, США). У крыс из групп “ишемия–реперфузия” и “ишемия–реперфузия + семакс” МРТ проводили непосредственно перед декапитацией.
Гистологическое исследование головного мозга крыс. Извлеченный из черепной коробки головной мозг крыс фиксировали в течение 48 ч в кислой жидкости Буэна, затем тщательно отмывали от пикриновой кислоты в четырех сменах 70%-ного этанола. Гистотопографическую вырезку мозга выполняли с фронтальной ориентацией двух тканевых блоков на уровнях –0.5…+5.0 мм и ‒4.0…–0.5 мм от брегмы для их последующего микротомирования в каудоростральном направлении. После стандартной гистологической проводки на гистопроцессоре Leica TP1020 (Германия) ориентированные фрагменты мозга заключали в Гистомикс (“БиоВитрум”, Россия) на станции заливки HistoStar (“ThermoFisher Scientific”, США). Для гистологических исследований серийные срезы толщиной 5–6 мкм, полученные с блоков через 0.5–1 мм на микротоме Leica RM2235 (Германия), после депарафинирования окрашивали гематоксилином и эозином (“БиоВитрум”). Патоморфологический анализ выполнен с учетом критериев вариантов нормы и патологии нервных клеток, а также артифициальных, суправитальных и реактивных изменений клеток нервной ткани, вызванных манипуляциями при выделении головного мозга и его погружением в фиксирующие смеси [22–24]. Гистотопографическое картирование зон повреждения и точное определение уровней коронарных срезов проводили по стереотаксическому атласу головного мозга крыс [25].
Выделение РНК и синтез кДНК. Суммарную РНК из образцов тканей выделяли с помощью реагента TRIzol (“Invitrogen”, США), обрабатывали ДНКазой I (“ThermoFisher Scientific”). Целостность препаратов РНК проверяли путем электрофореза в агарозном геле в денатурирующих условиях. кДНК синтезировали с использованием набора RevertAid First Strand cDNA Synthesis Kit (“ThermoFisher Scientific”) с праймером oligo(dT)18 согласно инструкции производителя.
Количественный анализ экспрессии генов с помощью ОТ-ПЦР в реальном времени. В качестве матрицы ПЦР использовали первую цепь кДНК. Cодержание транскриптов генов Il1a, Il1b, Il6, Cxcl2 анализировали с использованием праймеров фирмы “Qiagen” (США) (https://geneglobe. qiagen.com/product-groups/quantitect-primer-assays).
Праймеры, специфичные для генов Ccl3, Tnfa, Gapdh, Rpl3, подобранные с использованием программного обеспечения OligoAnalyzer Tool (https:// www.idtdna.com/pages/tools/oligoanalyzer), синтезированы акционерной компанией “Евроген” (Россия) и представлены в табл. 1. Реакционные смеси объемом 25 мкл содержали 1 мкл кДНК, прямой и обратный праймеры (5 пмоль каждого) и 5 мкл 5× реакционной смеси (“Евроген”), содержащей Taq ДНК-полимеразу, нуклеотиды и SYBR Green I. Реакции проводили с использованием прибора StepOnePlus (“Applied Biosystems”, США) в следующих условиях: (1) денатурация при 95°С – 10 мин; (2) амплификация с одним измерением флуоресценции при 95°С – 15 с, 65°С – 25 с, 72°С – 35 с (40 циклов); (3) анализ температуры плавления продуктов амплификации. Каждый образец кДНК анализировали трижды.
Таблица 1.
Характеристика ПЦР-праймеров
| Ген | Праймер, 5' → 3' | RefSeq | ПЦР-продукт, п.н. |
|---|---|---|---|
| Ccl3 | F: ACTGCCTGCTGCTTCTCCTA | NM_013025 | 206 |
| R: GTTCCTTGCTGCCTCTAATCTC | |||
| Tnfa | F: CAGACCCTCACACTCAGAT | NM_012675 | 213 |
| R: TTGTCCCTTGAAGAGAACCT | |||
| Gapdh | F: ACTCTACCCACGGCAAGTTCAACG | NM_017008.4 | 148 |
| R: GTAGACTCCACGACATACTCAGCAC | |||
| Rpl3 | F: ATGGGTCCTTGGGCTTCTTG | NM_198753.2 | 239 |
| R: CACAATACCCACAACCACCA |
В качестве внутреннего контроля для нормализации содержания мРНК использовали гены Gapdh и Rpl3. Расчеты проводили с использованием программы BestKeeper, version 1 и Relative Expression Software Tool (REST) 2005 software. Руководство доступно на сайте “REST.-gene-quantification.info” (http://www.genequantification.de/ rest-2009.html). Содержание исследуемых РНК относительно мРНК генов сравнения оценивали по-формуле 2Ct(ref) – Ct(tar), где Ct(tar) – средняя величина порогового цикла амплификации (Ct) исследуемых РНК, Ct(ref) – среднее значение Ct мРНК генов сравнения. В каждую группу сравнения включено не менее семи животных. При сравнении данных статистически значимыми считали различия с величиной вероятности р < 0.05. Дополнительную обработку данных осуществляли при помощи программы Microsoft Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Магнитно-резонансная томография
Ишемический очаг в мозге животных, подвергнутых tMCAO, детектировали с помощью МРТ непосредственно перед декапитацией. Данные о варьировании объема очага ишемии у животных групп “ишемия–реперфузия” и “ишемия–реперфузия + семакс” представлены в табл. 2. У всех животных очаг ишемического повреждения локализовался в подкорковых структурах мозга со стороны окклюзии, при этом у 40% крыс он распространялся на область коры. На рис. 1 представлены результаты МРТ исследования очага ишемии с подкорковой локализацией через 24 ч после tMCAO при введении крысам физиологического раствора или семакса. Воздействие семакса на содержание транскриптов генов цитокинов и хемокинов в условиях tMCAO изучали на области подкорки.
Таблица 2.
Объем очагов ишемического повреждения мозга через 24 ч после tMCAO
| Группа | Вид очага | DWI, мм3 | T2 WI, мм3 |
|---|---|---|---|
| Ишемия–реперфузия | Подкорковый | 19.10–72.40 | 20.15–81.31 |
| Полушарный | 85.30–332.57 | 59.39–332.70 | |
| Ишемия–реперфузия + семакс | Подкорковый | 31.03–59.26 | 23.66–53.64 |
| Полушарный | 42.26–436.25 | 51.83–384.46 |
Морфология тканей мозга у крыс экспериментальных групп
У крыс группы “ишемия–реперфузия” через 24 ч после обратимой окклюзии правой СМА ишемические повреждения ткани мозга в виде отека и очагов “просветления” определяли в латеральных участках базальных ядер подкорковой области правого полушария в диапазоне от +1.7 до –3.3 мм от брегмы. Одно из составляющих базальных ядер полушарий головного мозга – полосатое тело (corpus striatum), образованное комплексом хвостатое тело–скорлупа (nucleus caudatus–putaimen) и бледным шаром (globus pallidus). У грызунов стриатум не дифференцирован на хвостатое ядро и скорлупу и представлен единым образованием, которое называют каудопутамен.
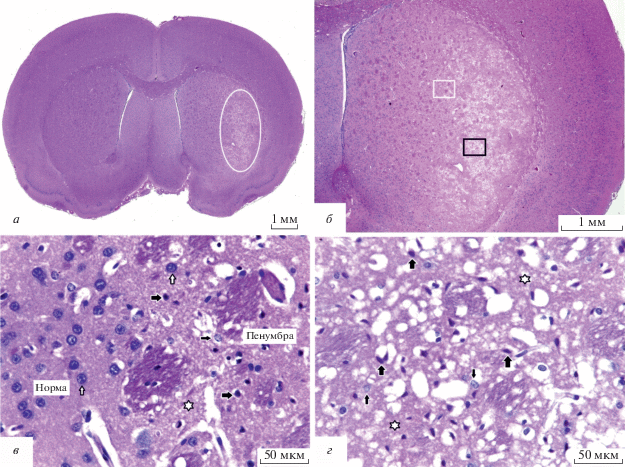
Типичная картина формирования фокальной ишемии в стриатуме показана на рис. 2. Зоны инфаркта имели вытянутую форму в дорсовентральном направлении и захватывали большую часть латеральной области каудопутамена (рис. 2а, б) с отчетливой визуализацией пенумбры – пограничной зоны между ядром инфаркта и нормальной тканью мозга (рис. 2в), и очагов формирования ядра инфаркта с необратимым повреждением нервной ткани, наличием участков некроза с деструкцией элементов нейропиля и погибшими пикноморфными нейронами (рис. 2г). При этом зоны ишемического инсульта охватывали значительную часть базальных ядер до мозолистого тела и наружной капсулы. Менее выраженные патоморфологические изменения наблюдались в пенумбре (рис. 2в). Необходимо отметить, что пенумбра, или “ишемическая полутень” – это перифокальная область гипоксически поврежденных, но сохраняющих жизнеспособность клеток, окружающая очаг первичного необратимого ишемического повреждения. Область полутени может оставаться жизнеспособной в течение нескольких часов после ишемического события и сохраняет возможность обратимых поражений мозга. Согласно патоморфологическим критериям, часть нейронов в перифокальной области инфаркта находилась в состоянии гипоксического повреждения (снижение базофилии хроматина в ядрах, отек и гомогенизация цитоплазмы) и гибели (пикноз и деструкция ядер, лизис цитоплазмы). В пенумбре располагались также нейроны без выраженных патологических изменений (рис. 2в). В медиальной области каудопутамена вне зон визуализируемой фокальной ишемии грубых патологических изменений в перикарионе большинства нейронов не выявлено.
Рис. 2.
Микрофотографии коронарных срезов головного мозга крысы, окрашенных гематоксилином и эозином, через 24 ч после обратимой окклюзии правой средней мозговой артерии. а – Коронарный срез головного мозга на уровне +0.5 мм от брегмы; овалом отмечена зона ишемического повреждения стриатума правого полушария. б – Фокальная ишемия латеральной области стриатума; фрагмент части а при большем увеличении. в – Фрагмент части б, отмеченный белым прямоугольником; зона перехода нормальной ткани в перифокальную область инфаркта; белые стрелки – интактные нейроны, тонкие черные стрелки – снижение базофилии хроматина в ядрах нейронов, толстые черные стрелки – пикноз ядер и перицеллюлярный отек ишемически поврежденных нейронов, белые звездочки – отек и вакуолизация нейропиля. г – Фрагмент части б, отмеченный черным прямоугольником; локус формирования ядра инфаркта; тонкие черные стрелки – снижение базофилии хроматина в ядрах нейронов, толстые черные стрелки – пикноморфные нейроны, белые звездочки – отек и деструкция нейропиля.
Действие семакса на экспрессию мРНК генов цитокинов
Анализ изменений содержания мРНК генов Il1a, Il1b, Il6, Tnfa, Cxcl2, Ccl3 через 24 ч от начала окклюзии СМА в подкорковом отделе мозга крыс группы “ишемия–реперфузия” по сравнению с группой “ложная операция” и животных группы “ишемия–реперфузия + семакс” относительно группы “ишемия–реперфузия” представлен на рис. 3. Согласно проведенному ранее RNA-Seq анализу [19, 20] при воздействии ишемии–реперфузии наблюдается тенденция к увеличению содержания транскриптов генов Il1b, Il6, Tnfa, Cxcl2, Ccl3 (рис. 3а), тогда как введение семакса привело к снижению уровня мРНК гена Ccl3 и выявило статистически незначимое снижение уровня мРНК генов Il1b, Il6, Tnfa, Cxcl2 (рис. 3б). В табл. 3 приведены значения FPKM, характеризующие уровень экспрессии мРНК исследуемых генов, а также представленных для сравнения генов, кодирующих хемокины Cxcl16, Ccl9 и молекулы клеточной адгезии Icam1, экспрессия которых по данным проведенного секвенирования изменилась статистически значимо. Как видим из табл. 3, содержание мРНК большинства исследованных генов было низким в образцах мозга животных всех групп: значение FPKM транскриптов генов Il1a, Il1b, Il6, Tnfa, Cxcl2 было в десятки раз ниже значений FPKM выявленных ДЭГ (Cxcl16, Ccl9 и Icam1) и на несколько порядков ниже FPKM генов домашнего хозяйства (Rpl3 и Gapdh). Низкая представленность мРНК гена Ccl3 в мозге ложнооперированных животных (FPKM – 0.551), по-видимому, также не позволила получить статистически значимых результатов изменения уровня его транскриптов под действием повреждения (табл. 3).
Рис. 3.
Изменение экспрессии генов провоспалительных цитокинов через 24 ч от начала tMCAO в подкорке крыс, получавших физиологический раствор или семакс. а – Группа “ишемия–реперфузия” относительно группы “ложная операция”. б – Группа “ишемия–реперфузия + семакс” относительно группы “ишемия–реперфузия”. Для нормализации содержания мРНК в группах использовали два гена сравнения: Gapdh и Rpl3, уровень мРНК которых принят за 100%. Данные представлены как среднее ± стандартная ошибка среднего.
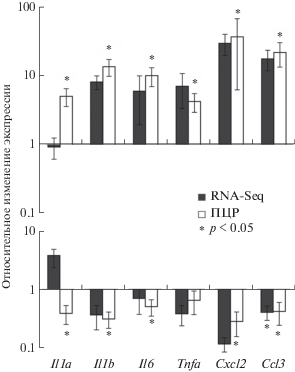
Таблица 3.
Средние значения FPKM, характеризующие уровень экспрессии мРНК генов, кодирующих провоспалительные факторы, и генов домашнего хозяйства Rpl3 и Gapdh в подкорковых структурах мозга крыс
| Ген | FPKM | ||
|---|---|---|---|
| группа “ишемия–реперфузия” | группа “ишемия–реперфузия + семакс” | группа “ложнооперированные” | |
| Гены медиаторов воспаления | |||
| Il1a | 0.069 | 0.268 | 0.076 |
| Il1b | 1.390 | 0.509 | 0.166 |
| Il6 | 1.501 | 1.005 | 0.244 |
| Tnfa | 1.637 | 0.602 | 0.225 |
| Cxcl2 | 1.803 | 0.201 | 0.059 |
| Ccl3 | 10.017 | 3.813 | 0.551 |
| Гены сравнения (ДЭГ по данным RNA-Seq) | |||
| Cxcl16 | 26.550 | 17.545 | 5.185 |
| Ccl9 | 12.806 | 6.605 | 5.068 |
| Icam1 | 9.687 | 6.158 | 2.845 |
| Гены домашнего хозяйства | |||
| Gapdh | 2305.257 | 2123.387 | 2385.423 |
| Rpl3 | 482.763 | 448.423 | 363.870 |
По данным ПЦР в реальном времени через 24 ч от начала окклюзии СМА содержание мРНК всех исследованных генов в группе животных “ишемия–реперфузия” по сравнению с группой “ложная операция” повышалось статистически значимо (рис. 3а). Содержание транскриптов генов провоспалительных цитокинов Il1b и Il6 было увеличено более чем в 10 раз, генов Il1a и Tnfa – более чем в 5 раз относительно контроля. Транскрипция генов хемокинов также существенно повысилась: Cxcl2 – более чем в 30 раз, Ccl3 – более чем в 20 раз. Согласно результатам ПЦР в реальном времени под воздействием семакса содержание мРНК генов Il1a, Il1b, Il6, Cxcl2, Ccl3 в подкорке снизилось более чем в 2 раза по сравнению с контролем, тогда как снижение уровня мРНК гена Tnfa не было статистически значимым (рис. 3).
Таким образом, по данным ПЦР в реальном времени в условиях использованной нами модели церебральной ишемии tMCAO через 24 ч после начала окклюзии в подкорке крыс значительно повысилась экспрессия генов провоспалительных цитокинов, включая интерлейкины и хемокины. Введение семакса животным с ишемией снижало активацию транскрипции генов провоспалительных интерлейкинов IL-1α, IL-1β, IL-6 и хемокинов Cxcl2, Ccl3, но не оказало заметного эффекта на экспрессию цитокина Tnfa.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние пептидного препарата семакс на экспрессию генов, кодирующих провоспалительные цитокины, мы анализировали на модели обратимой ишемии мозга экспериментальных животных с использованием филаментов. Эта модель наилучшим образом отражает события, происходящие при ишемическом инсульте у человека и его лечении тромболитическими препаратами [26, 27]. Согласно данным МРТ при постановке модели к концу первых суток после окклюзии СМА у всех животных детектировали очаг повреждения, который локализовался в подкорковой области и частично (у 40% крыс) распространялся на кору. Известно, что при постановке данной модели размер повреждения в мозге животных может значительно варьировать из-за их анатомических особенностей, размера филамента, точности позиционирования нити, прилежания филамента к стенкам сосуда, степенью его перекрытия [28]. В связи с этим для применения данной модели чрезвычайно важны ее воспроизводимость и локализация очага повреждения. В условиях нашей модели tMCAO с помощью МРТ (рис. 1) и гистопатологического исследования (рис. 2) ишемический очаг и область пенумбры были локализованы в подкорковых структурах головного мозга крыс, взятой для исследования экспрессии мРНК ряда генов провоспалительных цитокинов с помощью ОТ-ПЦР в реальном времени.
Сравнительный анализ изменений содержания мРНК генов Il1a, Il1b, Il6, Tnfa, Cxcl2, Ccl3 в подкорковых структурах головного мозга крыс, подвергнутых ишемии–реперфузии, и у ложнооперированных животных, проведенный с помощью ОТ-ПЦР в реальном времени, выявил существенное увеличение уровня транскриптов всех цитокинов, что подтверждает результаты других экспериментаторов [6–8]. В то же время под воздействием семакса детектировалось статистически значимое снижение экспрессии мРНК провоспалительных цитокинов IL-1α, IL-1β, IL-6, Ccl3, Cxcl2, свидетельствующее о выраженном противовоспалительном действии пептида (рис. 3).
Ранее мы провели сравнительный RNA-Seq-анализ ДЭГ в подкорковой области мозга животных, подвергнутых ишемии–реперфузии, и у ложнооперированных животных. Группы сравнения содержали по три животных, были сгенерированы 10 млн ридов в каждом образце, и использована программа Cuffdiff для анализа ДЭГ. В результате обнаружено около 2000 ДЭГ, экспрессия которых изменилась более чем в 1.5 раза (Padj <0.05) [19]. Однако среди выявленных ДЭГ мы не обнаружили генов, кодирующих известные медиаторы воспаления – IL-1α, IL-1β, IL-6, TNF-α, Ccl3, Cxcl2. Согласно данным RNA-Seq, наблюдается тенденция к увеличению уровня транскриптов большинства этих генов под действием ишемии–реперфузии. В аналогичном исследовании выявлено около 400 генов (ДЭГ), экспрессия которых отличалась в подкорке животных, подвергнутых tMCAO, и получавших семакс или физиологический раствор. При этом статистически значимо снизилось только содержание мРНК гена Ccl3 [20]. По данным RNA-Seq значение FPKM для транскриптов большинства исследованных генов цитокинов было в десятки раз ниже значений выявленных ДЭГ (Cxcl16, Ccl9 и Icam1), что свидетельствовало о низком их содержании (табл. 3).
В настоящее время метод RNA-Seq, позволяющий оценить транскрипционную активность всего генома единовременно, является основным подходом к поиску ДЭГ, построению сигнальных путей, которые участвуют в ответе на то или иное специфическое воздействие [29, 30]. Однако применение технологий секвенирования мРНК для количественной оценки транскриптов с низким содержанием затруднено из-за возможных технических требований (число животных в группах, глубина секвенирования, биоинформатический анализ данных и других). К числу важных показателей, используемых при RNA-Seq, относится порог экспрессии генов [31]. Значения FPKM, отсекающие низко представленные транскрипты, строго не обозначены и в разных исследованиях варьируют от 0.3 до 12 [31–33]. При этом наряду с экспериментальным шумом могут отсекаться активные, но достаточно низко представленные транскрипты. Видно, что в условиях использованного нами метода RNA-Seq в число транскриптов с показателем FPKM ниже 0.3 вошли активные транскрипты, содержание которых определено с помощью метода ОТ-ПЦР в реальном времени. Имеются данные, что для получения высоконадежных оценок экспрессии генов в случае низко представленных транскриптов необходимо проанализировать не менее 20–30 млн ридов в каждом образце [32]. Однако высокая стоимость RNA-Seq не всегда позволяет достичь такой глубины секвенирования. По-видимому, при меньшем, допустимом для анализа, количестве считываний (10 млн) для получения статистически значимых количественных оценок уровня экспрессии мРНК с низким FPKM незаменимым остается метод ПЦР в реальном времени. Можно полагать, что применение данного метода, позволяющего использовать большее число экспериментальных точек и большее количество мРНК, необходимо не только для верификации результатов RNA-Seq, но и для выявления возможных активных участников обнаруженных сигнальных путей, кодирующих низко представленные транскрипты.
Таким образом, используя метод ОТ-ПЦР в реальном времени, мы показали, что в условиях tMCAO спустя 24 ч после окклюзии СМА пептидный препарат семакс статистически значимо снизил экспрессию мРНК медиаторов воспаления IL-1α, IL-1β, IL-6, Ccl3 и Cxcl2, компенсировав активацию транскрипции этих генов под действием ишемии–реперфузии. Полученные результаты дополнили число выявленных ранее с помощью RNA-Seq ДЭГ, участвующих в воспалении, экспрессия которых снизилась под действием пептида в условиях tMCAO. Наряду с обнаруженными нами ранее нейропротективным и иммуномодулирующим эффектами, семакс проявил выраженное противовоспалительное действие, важное при лечении инсульта.
Работа выполнена при поддержке Российского научного фонда (грант № 19-14-00268).
Все процедуры, проведенные с участием животных, соответствовали этическим стандартам учреждений или принятой практике таких исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lambertsen K.L., Biber K., Finsen B. (2012) Inflammatory cytokines in experimental and human stroke. J. Cereb. Blood Flow Metab. 32(9), 1677–1698.
Fouda A.Y., Kozak A., Alhusban A., Switzer J.A., Fagan S.C. (2013) Anti-inflammatory IL-10 is upregulated in both hemispheres after experimental ischemic stroke: hypertension blunts the response. Exp. Transl. Stroke Med. 5(1), 12.
Jayaraj R.L., Azimullah S., Beiram R., Jalal F.Y., Rosenberg G.A. (2019) Neuroinflammation: friend and foe for ischemic stroke. J. Neuroinflammation 16(1), 142.
Ramiro L., Simats A., García-Berrocoso T., Montaner (2018) Inflammatory molecules might become both biomarkers and therapeutic targets for stroke management. J. Ther. Adv. Neurol. Disord. 11, 1756286418789340.
Boutin H., LeFeuvre R.A., Horai R., Asano M., Iwakura Y., Rothwell N.J. (2001) Role of IL-1alpha and IL-1beta in ischemic brain damage. J. Neurosci. 21(15), 5528–5534.
Zhai Q.H., Futrell N., Chen F.J. (1997) Gene expression of IL-10 in relationship to TNF-alpha, IL-1beta and IL-2 in the rat brain following middle cerebral artery occlusion. J. Neurol. Sci. 152(2), 119–124.
Schroeter M., Küry P., Jander S. (2003) Inflammatory gene expression in focal cortical brain ischemia: differences between rats and mice. Brain Res. Mol. Brain Res. 117(1), 1–7.
Vikman P., Ansar S., Henriksson M., Stenman E., Edvinsson L. (2007) Cerebral ischemia induces transcription of inflammatory and extracellular-matrix-related genes in rat cerebral arteries. Exp. Brain Res. 183(4), 499–510.
Reichel C.A., Rehberg M., Lerchenberger M., Berberich N., Bihari P., Khandoga A.G., Zahler S., Krombach F. (2009) Ccl2 and Ccl3 mediate neutrophil recruitment via induction of protein synthesis and generation of lipid mediators. Arterioscler. Thromb. Vasc. Biol. 29(11), 1787–1793.
Lee S., Chu H.X., Kim H.A., Real N.C., Sharif S., Fleming S.B., Mercer A.A., Wise L.M., Drummond G.R., Sobey C.G. (2015) Effect of a broad-specificity chemokine-binding protein on brain leukocyte infiltration and infarct development. Stroke. 46(2), 537–544.
Zaremba J., Ilkowski J., Losy J. (2006) Serial measurements of levels of the chemokines CCL2, CCL3 and CCL5 in serum of patients with acute ischaemic stroke. Folia Neuropathol. 44(4), 282–289.
de Wied D. (1997) Neuropeptides in learning and memory processes, Behav. Brain Res. 83, 83–90.
Гривенников И.А., Долотов О.В., Гольдина Ю.И. (1999) Факторы пептидной природы в процессах пролиферации, дифференцировки и поддержания жизнеспособности клеток нервной системы млекопитающих. Молекуляр. биология. 33, 120–126.
Kolomin T., Shadrina M., Slominsky P., Limborska S., Myasoedov N. (2013) A new generation of drugs: synthetic peptides based on natural regulatory peptides, Neurosci. Med. 4, 223–252.
Dmitrieva V.G., Povarova O.V., Skvortsova V.I., Limborska S.A., Myasoedov N.F., Dergunova L.V. (2010) Semax and Pro-Gly-Pro activate the transcription of neurotrophins and their receptor genes after cerebral ischemia. Cell. Mol. Neurobiol. 30(1), 71–79.
Stavchansky V.V., Yuzhakov V.V., Botsina A.Y., Skvortsova V.I., Bondurko L.N., Tsyganova M.G., Limborska S.A., Myasoedov N.F., Dergunova L.V. (2011) The effect of Semax and its C-end peptide PGP on the morphology and proliferative activity of rat brain cells during experimental ischemia: a pilot study. J. Mol. Neurosci. 45, 177–185.
Medvedeva E.V., Dmitrieva V.G., Povarova O.V., Limborska S.A., Skvortsova V.I., Myasoedov N.F., Dergunova L.V. (2014) The peptide semax affects the expression of genes related to the immune and vascular systems in rat brain focal ischemia: genome-wide transcriptional analysis. BMC Genomics. 15, 228.
Medvedeva E.V., Dmitrieva V.G., Limborska S.A., Myasoedov N.F., Dergunova L.V. (2017) Semax, an analog of ACTH(4–7), regulates expression of immune response genes during ischemic brain injury in rats. Mol. Genet. Genomics. 292(3), 635–653.
Dergunova L.V., Filippenkov I.B., Stavchansky V.V., Denisova A.E., Yuzhakov V.V., Mozerov S.A., Gub-sky L.V., Limborska S.A. (2018) Genome-wide transcriptome analysis using RNA-Seq reveals a large number of differentially expressed genes in a transient MCAO rat model. BMC Genomics. 19(1), 655.
Filippenkov I.B., Stavchansky V.V., Denisova A.E., Yuzhakov V.V., Sevan’kaeva L.E., Sudarkina O.Yu., Dmitrieva V.G., Gubsky L.V., Myasoedov N.F., Limborska S.A., Dergunova L.V. (2020) Novel insights into the protective properties of ACTH(4–7)PGP (Semax) peptide at the transcriptome level following cerebral ischaemia-reperfusion in rats. Genes (Basel). 11(6), E681.
Costa C., Giménez-Capitán A., Karachaliou N., Rosell R. (2013) Comprehensive molecular screening: from the RT-PCR to the RNA-seq. Transl. Lung Cancer Res. 2(2), 87–91.
Garcia J.H., Liu K.F., Ho K.L. (1995) Neuronal necrosis after middle cerebral artery occlusion in Wistar rats progresses at different time intervals in the caudoputamen and the cortex. Stroke. 26(4), 636–642
Li Y., Powers C, Jiang N., Chopp M. (1998) Intact, injured, necrotic and apoptotic cells after focal cerebral ischemia in the rat. J. Neurol. Sci. 156(2), 119–132.
Lipton P. Ischemic cell death in brain neurons. (1999) Physiol. Rev. 79(4), 1431–1568.
Paxinos G., Watson C. (1997) The rat brain in stereotaxic coordinates. Compact 3-rd ed. San Diego: Acad. Press.
Nieswandt B., Kleinschnitz C., Stoll G. (2011) Ischaemic stroke: a thrombo-inflammatory disease? J. Physiol. 589(17), 4115–4123.
Ryang Y.M., Dang J., Kipp M., Petersen K.U., Fahlenkamp A.V., Gempt J., Wesp D., Rossaint R., Beyer C., Coburn M. (2011) Solulin reduces infarct volume and regulates gene-expression in transient middle cerebral artery occlusion in rats. BMC Neurosci. 12, 113.
Canazza A., Minati L., Boffano C., Parati E., Binks S. (2014) Experimental models of brain ischemia: a review of techniques, magnetic resonance imaging, and investigational cell-based therapies. Front. Neurol. 5, 19.
Stark R., Grzelak M., Hadfield J. (2019) RNA sequencing: the teenage years. Nat. Rev. Genet. 20(11), 631–656.
Hitzemann R., Bottomly D., Darakjian P., Walter N., Iancu O. Searles R. Wilmot B. McWeeney S. (2013) Genes, behavior and next-generation RNA sequencing. Genes Brain Behav. 12, 1–12.
Hart T., Komori H.K., LaMere S., Podshivalova K., Salomon D.R. (2013) Finding the active genes in deep RNA-seq gene expression studies. BMC Genomics. 14, 778.
Koch C.M., Chiu S.F., Akbarpour M., Bharat A., Ridge K.M., Bartom E.T., Winter D.R. (2018) A beginner’s guide to analysis of RNA sequencing data. Am. J. Respir. Cell Mol. Biol. 59, 145–157.
Ramsköld D., Wang E.T., Burge C.B., Sandberg R. (2009) An abundance of ubiquitously expressed genes revealed by tissue transcriptome sequence data. PLoS Comput. Biol. 5, e1000598.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология