Молекулярная биология, 2021, T. 55, № 3, стр. 519-528
Дисульфидные связи в белках, детектируемые присоединением высокомолекулярных производных малеимида
a Beijing Stomatological Hospital and School of Stomatology, Capital Medical University
100050 Beijing, China
b Department of Stomatology, Beijing Chao-Yang Hospital, Capital Medical University
100020 Beijing, China
* E-mail: dqwonline@163.com
Поступила в редакцию 13.07.2020
После доработки 12.08.2020
Принята к публикации 14.08.2020
Аннотация
Дисульфидные связи играют важную роль в поддержании структуры и функции белков. Однако для изучения дисульфидных связей требуется дорогое оборудование и высокоочищенные образцы белка, поэтому необходимы более простые методы. Представлена новая методика детекции дисульфидных связей в белках, основанная на мечении восстановленных дисульфидных мостиков высокомолекулярными производными малеимида. После необратимого блокирования свободных тиольных групп в белках новые тиолы, высвобождаемые из дисульфидных мостиков метят высокомолекулярными производными малеимида. Локализацию остатков цистеина, участвующих в образовании дисульфидных связей, определяют с помощью мутагенеза. С целью валидации метода к N-концам аквапорина 5 (AQP5) и белка 4 подсемейства V транзиторных каналов ((TRPV4) присоединяли метку FLAG (DYKDDDDK). На присутствие дисульфидных связей указывало увеличение молекулярной массы белков-мишеней, выявляемое с помощью иммуноблотинга. Не выявлено увеличения молекулярной массы AQP5, тогда как в TPRV4 обнаружены остатки цистеина в положениях 639, 645, 652, 660, 770, образующих дисульфидные мостики, что подтверждено путем мутагенеза. Эти данные свидетельствуют об эффективности предложенного метода детекции дисульфидных связей в молекулах белков.
ВВЕДЕНИЕ
Дисульфидная связь, соединяющая два остатка цистеина, – посттранскрипционная модификация, помогающая поддерживать стабильность структуры белков и их функции [1, 2]. Гибкость дисульфидных связей привлекает повышенное внимание с момента их обнаружения в 1960-х в панкреатической рибонуклеазе крупного рогатого скота [3, 4]. Дисульфидные связи повышают термодинамическую стабильность белков и способствуют их правильному фолдингу. Кроме того, дисульфидные связи сильнее повышают устойчивость белков к тепловой денатурации, чем другие виды взаимодействий [5, 6]. Экспонирование высокореакционных свободных остатков цистеина после расщепления дисульфидных мостиков значительно влияет на функции белка [7, 8]. Неправильно замкнутые дисульфидные связи ведут к нарушению фолдинга и, как следствие, функции белка [9].
Для полного понимания механизмов, лежащих в основе роли дисульфидных связей в структуре и функциях белков, необходимы новые усовершенствованные методы. После определения аминокислотной последовательности с использованием метода деградации по Эрдману или масс-спектрометрии дисульфидные связей можно анализировать с помощью таких традиционных методов, как ядерный магнитный резонанс (ЯМР), кристаллографические методы, различные алгоритмы [10, 11]. Однако необходимость использования специализированного и дорогого оборудования в комбинации с недостаточной чистотой образцов часто не позволяет применять такие подходы в рутинных и фундаментальных клинических исследованиях [12].
Для изучения нестабильных тиольных групп, которые образуются в результате расщепления дисульфидных связей, требуются более эффективные методы. Малеимид способен реагировать с тиольными группами с образованием стабильных тиоэфирных связей приблизительно в 1000 раз быстрее, чем амины при нейтральных значениях рН [13]. Эта высокоэффективная реакция широко применяется для конъюгации нагруженных цистеином пептидов и белков [14–16]. Дисульфидная ковалентная связь расщепляется специфически в ходе восстановительного метаболизма путем реакции тиол-дисульфидного обмена, ведущего к регенерации новых тиольных групп [17]. В представленной работе мы сначала блокировали тиольные группы низкомолекулярными производными малеимида с образованием тиоэфирных связей. Затем для восстановления дисульфидных мостиков и регенерации новых тиольных групп использовали Трис(2-карбоксиэтил)фосфин (ТСЕР) – высокоспецифичный и эффективный восстановитель при более низких значениях рН (<6.0). Регенерированные тиольные группы модифицировали затем метоксиполиэтиленгликольмалеимидом (МеО-РЕG-Mal; м.м. 5000). Суммарная молекулярная масса белка при этом увеличивается в результате мечения остатков цистеина, вовлеченных в образование дисульфидных связей, что можно измерить, сравнивая миграцию меченого белка и белка дикого типа. На следующей стадии для подтверждения локализации цистеинов использовали мутагенез остатков Cys, участвующих в формировании дисульфидных связей в белках-мишенях. В качестве модельных белков в настоящем исследовании использовали аквапорин 5 (AQP5) и член 4 подсемейства V транзиторных катионных каналов с рецепторным потенциалом (TRPV4) c N-концевым тагом FLAG. Не обнаружили изменений в миграции белка AQP5, тогда как в случае TRPV4 выявили несколько полос с более высокой молекулярной массой, чем у немеченого белка дикого типа. Появление более высокомолекулярных полос белков TRPV4, по-видимому, обусловлено мечением остатков цистеина в положении 639, 645, 652, 660, 770.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и антитела. ДНК-полимераза PrimeSTAR HS получена от фирмы”TaKaRa Biotechno-logy” (КНР). Использовали эндонуклеазы рестрикции DpnI, HindIII и BamHI (“Promega”, КНР), липофектамин 2000/3000 и стрептавидин Alexa Fluor® 680 (“Invitrogen”, КНР). Колонки для спинового обессоливания (Zeba™ Spin Desalting Columns, 7K MWCO, 0.5 мл, “ThermoFisher Scientific Inc.”, США). Антитела к AQP5 и TRPV4 получены от “Santa Cruz Biotechnology” (США), а антитела к FLAG – от “OriGene Technologies” (США). Meтоксиполиэтиленгликольмалеимид (MeO-PEG-Mal, м.м. 750, 2000, 5000) и другие реагенты были фирмы “Sigma” (США).
Клеточные культуры и трансфекция клеток. Клетки линии 293 (НЕК293) эмбриональной почки человека культивировали в модифицированной Дульбекко среде Игла (DMEM) c 10% (v/v) фетальной сыворотки крупного рогатого скота, 100 ед./мл пенициллина и стрептомицина при 37°С во влажной атмосфере с 5% CO2. Для трансфекции клеток HEK293 использовали липофектамин согласно рекомендациям изготовителя.
Конструирование плазмид и мутагенез. Плазмиды с геном AQP5 человека конструировали согласно [18] (табл. 1 ). Плазмида с геном TRPV4 человека (дикий тип) подарена Miguel A. Valverde (табл. 1 ). Фрагмент FLAG-AQP5 встраивали по сайтам HindIII (верхний) и BamHI (нижний) в pcDNA 4.0 (“Invitrogen”) (табл. 1 ).
Таблица 1. Нуклеотидные последовательности праймеров, использованных для клонирования
| Праймер | Нуклеотидная последовательность |
|---|---|
| FLAG-AQP5 | 5′-CCAAGCTTGGGATGGACTACAAGGACGATGATGACAAGAAGAAGGAGGT-3′ |
| 5′-CGCGGATCCGCGTCAGCGGGTGGT-3′ | |
| AQP5-FLAG | 5′-CCCAAGCTTGGGATGAAGAAG-3′ |
| 5′-CGCGGATCCGCGTCACTTGTCATCATCGTCCTTGTAGTCGCGGGTGGT-3′ | |
| FLAG-TRPV4 | 5′-CCCAAGCTTGGGATGGACTACAAGGACGATGATGACAAGGCGGATTCCAG-3′ |
| 5′-CGCGGATCCGCGCTAGAGCGGG-3′ | |
| TRPV4-FLAG | 5′-CCCAAGCTTGGGATGGCGGATT-3′ |
| 5′-CGCGGATCCGCGTCACTTGTCATCATCGTCCTTGTAGTCGAGCGGGGCG-3′ |
Мутагенез остатков цистеина проводили следующим образом: 10 нг плазмидной матрицы амплифицировали с 2 ед. ДНК-полимеразы РrimeSTAR HS в присутствии 250 нM праймеров (табл. 2 ). Aмплификацию проводили в следующем режиме: 1 цикл при 94°C в течение 5 мин, затем 25 циклов – 94°C, 20 с; 55°C, 20 с, и 72°C, 4 мин (AQP5) или 8 мин (TRPV4). Далее ампликоны инкубировали с 10 ед. DpnI (1 ч, 37°C) для удаления исходной метилированной ДНК, после чего 10 мкл реакционной смеси трансфицировали клетки DH5α и высевали на чашки со средой LB с ампициллином. Клоны дикого типа и мутантные клоны проверяли секвенированием.
Таблица 2. Нуклеотидные последовательности праймеров для мутагенеза остатков цистеина
| Праймер | Нуклеотидная последовательность |
|---|---|
| Cys194Gly-F | 5′-GCCATCTACGGGGAAGACCGGCCTGCCCAA-3′ |
| Cys194Gly-R | 5′-CGGTCTTCCCCGTAGATGGCTCTCGAAACT-3′ |
| Cys250Gly-F | 5′-ACATCGCCATTGAGCGTCGCGGCAAACACTA-3′ |
| Cys250Gly-R | 5′-CGCGACGCTCAATGGCGATGTGCAGGGCTG-3′ |
| Cys294Gly-F | 5′-GCCCCTGTCGCTGGCTGCCGGCACCAACCA-3′ |
| Cys294Gly-R | 5′-CGGCAGCCAGCGACAGGGGCAGCTCCCCAA-3′ |
| Cys353Gly-F | 5′-CGACCTGCTGCTGCTCAAGGGTGCCCGCCT-3′ |
| Cys353Gly-R | 5′-CCTTGAGCAGCAGCAGGTCGTACATCTTGG-3′ |
| Cys427Gly-F | 5′-ACCTCTCCTCCCTGGACACGGGTGGGGAAGA-3′ |
| Cys427Gly-R | 5′-CCGTGTCCAGGGAGGAGAGGTCATAAAGCG-3′ |
| Cys480Gly-F | 5′-CAACGTGGTCTCCTACCTGGGTGCCATGGT-3′ |
| Cys480Gly-R | 5′-CCAGGTAGGAGACCACGTTGATGTAGAAGG-3′ |
| Cys537Gly-F | 5′-AGACTTGTTCATGAAGAAAGGCCCTGGAGTG-3′ |
| Cys537Gly-R | 5′-CTTTCTTCATGAACAAGTCTTTGATGTTGG-3′ |
| Cys639Gly-F | 5′-GGTCTCCCTCCTGAACCCGGGTGCCAACATG-3′ |
| Cys639Gly-R | 5′-CCGGGTTCAGGAGGGAGACCAGGGCTGAAG-3′ |
| Cys645Gly-F | 5′-CGTGTGCCAACATGAAGGTGGGCAATGAGGA-3′ |
| Cys645Gly-R | 5′-CCACCTTCATGTTGGCACACGGGTTCAGGA-3′ |
| Cys652Gly-F | 5′-AATGAGGACCAGACCAACGGCACAGTGCC-3′ |
| Cys652Gly-R | 5′-CGTTGGTCTGGTCCTCATTGCACACCTTC-3′ |
| Cys660Gly-F | 5′-CAGTGCCCACTTACCCCTCGGGCCGTGACAG-3′ |
| Cys660Gly-R | 5′-CCGAGGGGTAAGTGGGCACTGTGCAGTTGG-3′ |
| Cys777Gly-F | 5′-GCACTCCTGACCGCAGGTGGGGCTTCAGGG-3′ |
| Cys777Gly-R | 5′-CCCACCTGCGGTCAGGAGTGCCGTCCGAGC-3′ |
| Cys853Gly-F | 5′-AGCATGGGGAACCCCCGCGGCGATGGCCA-3′ |
| Cys853Gly-R | 5′-CGCGGGGGTTCCCCATGCTGTCCAGAGGC-3′ |
Иммуноблотинг. Контрольные и обработанные клетки ресуспендировали в лизирующем буфере, содержащем 50 мM Tрис-HCl (pH 7.0), 150 мM NaCl, 0.1% SDS, 0.5% дезоксихолата натрия, 5 мM EDTA, 5 мM EGTA, коктейль ингибиторов протеаз и 20 мг/мл MeO-PEG-Mal (м.м. 750). Суммарные белки лизата денатурировали (70°C, 10 мин) и обрабатывали согласно методике, затем реконструировали в буфере для нанесения в отсутствие восстанавливающего агента. Концентрацию белка определяли, используя метод Брэдфорда. Белки разделяли с помощью электрофореза в денатурирующем полиакриламидном геле (SDS-ПААГ) и переносили на поливинилидендифторидные мембраны (PVDF, “Millipore”, США). Мембраны блокировали 5%-ным обезжиренным молоком, обрабатывали первичными антителами, затем инкубировали со вторыми антителами IRDye680RD/800CW согласно инструкции производителя (LI-COR “Biosciences”, CША). Иммунореактивные полосы визуализировали, используя Odyssey® Infrared Imaging System (LI-COR “Biosciences”).
Cтатистический анализ. В настоящем исследовании применили рандомизированный полноблочный дизайн (RCBD). Результаты анализировали, используя программу SPSS 22.0, и представляли как среднее значение ± стандартная ошибка. Сравнение внутри и между группами проводили, используя однофакторный метод ANOVA или тест Стъюдента. Значения P < 0.05 считали статистически значимымиt.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение дисульфидных связей в белках-мишенях
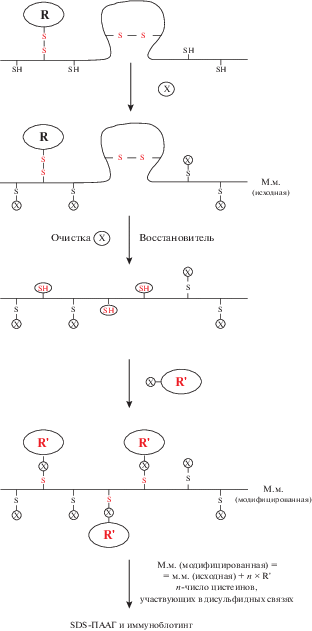
Нами предложен подход к определению дисульфидных связей в белках (рис. 1). Свободные тиольные группы сначала блокировали малеимидом или MeO-PEG-Mal (м.м. 750) с образованием стабильных тиоэфирных связей при pH 6.5–7.5. Затем реакционную смесь наносили на колонку Zeba™ Spin Desalting Column, coдержащую сорбент для эксклюзионной хроматографии, которая обеспечивает эффективное обессоливание белка и его высокий выход, центрифугировали при 1500 g в течение 2 мин. Затем для расщепления дисульфидных связей и регенерации новых тиольных групп использовали TCEP (50 мM, pH 6.0) с последующей очисткой на колонке для обессоливания. Затем к регенерированным тиольным группам присоединяли. MeO-PEG-Mal (м.м. 5000) в 1 M Tрис-HCl-буфере pH 7.0. Более высокая молекулярная масса указывает на большее число дисульфидных связей в исследуемом белке, и это значение вычисляется по разнице в миграции полос белка, обработанного по описанной схеме, и исходного при иммуноблотинге. Результаты иммуноблотинга подтверждали с помощью мутагенеза остатков цистеина.
Оценка метода с использованием авидина
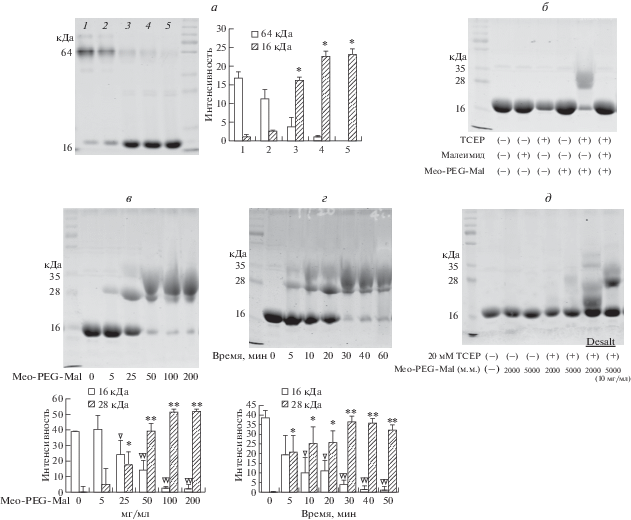
Aвидин (“Sigma”, A9275) – природный тетрамер с двумя остатками цистеина (4, 83), которые образуют внутримономерный дисульфидный мостик [19], использовали для оценки специфичности и эффективности метода. Aвидин денатурировали при 70°C в течение разного времени (0, 1, 5, 10, 20 мин) для определения точки, в которой происходит максимальное превращение мономера в тетрамер. Стабильно максимальное содержание мономера авидина детектировали через 10 мин (рис. 2а). Обработка TCEP, малеимидом и MeO-PEG-Mal не приводила к изменению молекулярной массы мономера авидина (рис. 2б). Однако обработка TCEP (20 мM, pH 7.0), а затем MeO-PEG-Mal (м.м. 5000, 10 мг) привела к появлению полосы 28 кДа. После обработки MeO-PEG-Mal (м.м. 5000) молекулярная масса мономера авидина увеличивалась на 12 кДа. Это указывает на участие двух остатков цистеина в образовании дисульфидного мостика. Maксимальное мечение авидина наблюдали при его инкубации с MeO-PEG-Mal (50 мг/мл) и TCEP в течение 30–60 мин при 4°C (рис. 2г). MeO-PEG-Mal в дозе 50−200 мг/мл в комбинации с TCEP вызывал изменение молекулярной массы у большей части мономеров авидина (10 мг/мл) (рис. 2в). Удаление TCEP после восстановления привело к длительному повышению эффективности мечения MeO-PEG-Mal (10 мг/мл) по сравнению с эффективностью мечения в присутствии TCEP (рис. 2д).
Рис. 2.
Конъюгация MeO-PEG-Mal с авидином. а − Tепловая денатурация авидина. Слева: электрофореграмма авидина после тепловой денатурации в течение 0, 1, 5, 10, 20 мин (дорожки 1−5). Справа: диаграмма интенсивности полос нативного (64 кДа) и денатурированного (16 кДа) авидина в дорожках 1−5. б − Электрофореграмма денатурированного авидиана, обработанного малеимидом, TCEP или MeO-PEG-Mal (м.м. 5000). в − Обработка авидина MeO-PEG-Mal в разной концентрации. Вверху: электрофореграмма продуктов обработки авидина MeO-PEG-Mal. Внизу: диаграмма интенсивности соответствующих полос. г − Обработка авидина MeO-PEG-Mal и ТСЕР в течение разных промежутков времени. Вверху: электрофореграмма продуктов обработки. Внизу: диаграмма интенсивности соответствующих полос. д − Электрофореграмма продуктов обработки денатурированного авидина TCEP, MeO-PEG-Mal (м.м. 2000, 5000) с/без обессоливания. *, ▽: P < 0.05; **, ▽▽: P < 0.01.
Блокирование свободных тиольных групп в суммарном белке
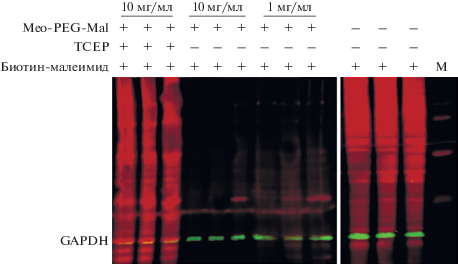
Чтобы точно оценить число дисульфидных мостиков, все свободные тиольные группы в белке-мишени должны быть блокированы. Эффективность блокирования свободных тиольных групп малеимидом оценивали с использованием системы биотин-стрептавидин-680AF. Биотин-малеимид (10 мкг/мл) использовали для прямого мечения свободных тиольных групп в белках в лизирующем буфере в отсутствие MeO-PEG-Mal (4°C, 1 ч, pH 7.0). Меченые белки разделяли с помощью SDS-ПААГ и переносили на PVDF-мембрану. Мембрану инкубировали со стрептавидином-680AF (0.1 мкг/л, при комнатной температуре, 1 ч) для получения ярко-красного сигнала в трех независимых образцах. Блокирование денатурированных образцов (70°C, 10 мин) в лизирующем буфере с MeO-PEG-Mal (м.м. 750) в концентрации 1 и 10 мг/мл до мечения биотин-малеимидом значительно снижает интенсивность ярко-красного сигнала. Соответствующий сигнал от образцов с концентрацией МеО-PEG-Mal (м.м. 750) 10 мг/мл групп едва виден или отсутствует. Однако сигнал появляется снова, когда образцы метят биотин-малеимидом с последующей обработкой TCEP образцов, блокированных MeO-PEG-Mal (рис. 3). Эти результаты показывают, что обработка MeO-PEG-Mal (м.м. 750) в концентрации 10 мг/мл достаточна для блокирования свободных тиольных групп и выполнения необходимого предварительного условия этого метода.
Рис. 3.
Блокирование свободных тиольных групп MeO-PEG-Mal (м.м. 750). Три независимых денатурированных образца обрабатывали биотин-малеимидом, MeO-PEG-Mal + биотин-малеимид и MeO-PEG-Mal + TCEP + биотин-малеимидом. Результаты блокирования визуализировали с использованием системы биотин-стрептавидин-680AF. M – маркер. Зеленые полосы − GAPDH.
Оценка метода с использованием белков-мишеней
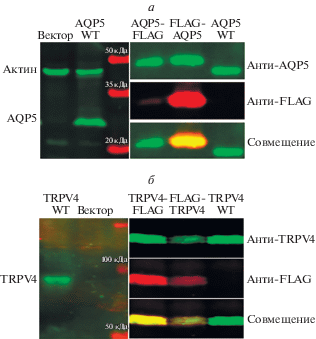
В клетках HEK293, трансфицированных AQP5 (wt), FLAG-AQP5 или AQP5-FLAG, антитела к AQP5 детектируют полосу 27 кДа (зеленая), которая соответствует химерному белку 1 кДа FLAG-таг + 27 кДа AQP5 (рис. 4а). Антитела к FLAG детектируют химерный белок (красная полоса), но не AQP5 (wt), что подтверждает их специфичность. Антитела к FLAG имеют также более высокое сродство к FLAG-AQP5, чем к AQP5-FLAG. Полоса, соответствующая мол. массе более 100 кДа (зеленая), детектируется в клетках HEK293, трансфицированных TRPV4 (wt), но не контрольным вектором (рис. 4б). В клетках HEK293, трансфицированных TRPV4(wt), FLAG-TRPV4 или TRPV4-FLAG, полосы, соответствуюшие молекулярной массе примерно 100 кДа (зеленые), белков TRPV4 дикого типа и химерных белков детектируются антителами к TRPV4 (рис. 4б, дорожки TRPV4 wt/FLAG-TRPV4/TRPV4-FLAG), а антитела к FLAG детектируют химерный белок (красный). На основе этих результатов для дальнейших опытов отобрали два слитых белка (FLAG-AQP5/FLAG-TRPV4).
Рис. 4.
Экспрессия слитых белков AQP5 TRPV4 в клетках HEK293. а − Антитела к AQP5 (зеленые) и FLAG (красные) использовали для подтверждения успешной трансфекции и экспрессии AQP5(wt)/FLAG-AQP5/AQP5-FLAG в клетках HEK293. б − Антитела к TRPV4 (зеленые) и к FLAG (красные) использовали для подтверждения успешной трансфекции и экспрессии TRPV4 (wt)/FLAG-TRPV4- /TRPV4-FLAG в клетках HEK293.
Образцы выдерживали в течение 30−40 мин при 4°C, подвергали тепловой денатурации (70°C, 10 мин), а затем для удаления всех следов MeO-PEG-Mal дважды пропускали через колонки для обессоливания (рис. 5а, дорожки 1, 4, 7, рис. 5б, дорожка блокированный образец). Одну порцию обессоленных образцов инкубировали с MeO-PEG-Mal (м.м. 5000, 10−50 мг, pH 7.2) при 4°C в течение 60 мин (рис. 5а, дорожки 2, 5, 8, рис. 5б, дорожка негативный контроль). Другие образцы обрабатывали TCEP (50 мM, pH 6.0) при 4°C в течение 30−40 мин с последующей инкубацией с MeO-PEG-Mal м.м. 5000, 10−50 мг) в 50 мM буфере Tрис-HCl pH 7.0 при 4°C в течение 60 мин (рис. 5а, 3, 6, 9, рис. 5б (все дорожки, кроме блокированного образца и негативного контроля), рис. 5в).
Рис. 5.
Идентификация дисульфидных мостиков в AQP5 и TRPV4. а − Иммуноблот FLAG-AQP5. Блокированные образцы (дорожки 1, 4, 7); негативный контроль: блокированные образцы, инкубированные с MeO-PEG-Mal (дорожки 2, 5, 8); блокированные образцы, инкубированные с MeO-PEG-Mal после восстановления TCEP (дорожки 3, 6, 9). б − Иммуноблот FLAG-TRPV4 дикого типа и 13 вариантов с единичными мутациями остатков цистеина. в − Иммуноблот мутантов FLAG-TRPV4 (мутанты с заменами одного, двух, трех и четырех остатков цистеина в положениях 639, 645, 652, 660, 777.
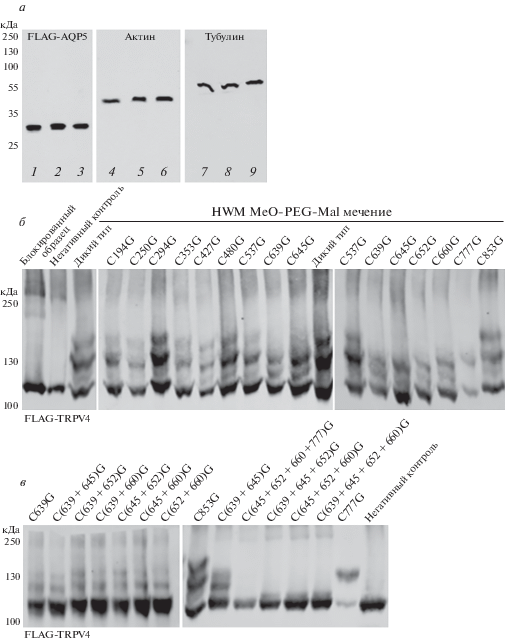
В TRPV4 (wt) мы детектировали три более высокомолекулярные полосы (рис. 5б, дикий тип), но ни одной такой полосы не найдено в AQP5 (рис. 5а, дорожка 3). Более высокомолекулярными были полосы мутантов TRPV4 по единичным остаткам цистеина в положениях 639, 645, 652, 660, 777, но не в 194, 250, 294, 353, 427, 480, 537, 853 (рис. 5б). Более того, паттерны миграции случайных мутантов по двум остаткам цистеина (639, 645, 652, 660) сходны с паттернами мутантов по этим единичным остаткам (рис. 5в). Число более высокомолекулярных полос снижалось с трех до одной при мутациях более чем в трех остатках цистеина одновременно. При одновременном мутировании остатков в положениях 645, 652, 660, 777 отсутствовали полосы с более высокой молекулярной массой (рис. 5в). Эти результаты показывают, что остатки цистеинов в положениях 639, 645, 652, 660, 777 образуют дисульфидные связи в TRPV4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Миграция белков в SDS-ПААГ определяется размером белка. Полимеризация белков приводит к изменению скорости миграции. Таким образом, мономер и полимер можно легко дифференцировать по различию в их молекулярных массах. Однако в случае белков с внутримолекулярными дисульфидными мостиками, образованными двумя близко расположенными остатками цистеина, это отличие может быть неочевидным или сложно идентифицируемым [20]. Небольшие различия в миграции белков с правильными внутрицепочечными дисульфидными мостиками и несформированными мостиками отмечены у относительно крупных белков. Чтобы лучше понять, как дисульфидные мостики влияют на фолдинг белков, нами разработан удобный метод амплификации этих небольших различий с целью их более легкой визуальной идентификации. Разработан простой подход, состоящий из блокирования свободных тиольных групп белка, восстановления дисульфидных связей с последующей модификацией вновь образованных тиольных групп и идентификацией с помощью SDS-ПААГ. Сравнивая различия в скорости миграции и числе полос в модифицированных и немодифицированных образцах с помощью иммуноблотинга, можно установить число и статус дисульфидных мостиков. В отличие от таких сложных методов, как рентгеноструктурный анализ и ЯМР, этот метод позволяет прямо визуализировать и предсказывать дисульфидные мостики в белках. В нашей работе с помощью этого подхода протестированы AQP5, бета-актин, тубулин и TRPV4, успешно и точно идентифицированы дисульфидные связи в этих белках.
Учитывая, что DTT и β-меркаптоэтанол содержат активные тиольные группы, потенциально способные взаимодействовать с малеимидными группами, в настоящей работе мы использовали TCEP, чтобы обеспечить чувствительность и специфичность нового подхода. Кроме того, TCEP сохраняет достаточно высокую активность в широком диапазоне значений pH. После обессоливания образца дисульфидные мостики можно успешно расщепить при pH 6.0, что минимизирует потенциальные взаимодействия между вновь регенерированными тиольными группами и оставшимся блокирующим агентом.
Сначала мы пытались прямо метить свободные тиольные группы MeO-PEG-Mal для определения дисульфидных мостиков в белке-мишени. Однако мечение свободных тиольных групп высокомолекулярным MeO-PEG-Mal влияет на взаимодействие между антителами и белком-мишенью. Это, вероятно, обусловлено блокированием сайтов связывания антител длинными цепями MeO-PEG-Mal, конъюгированными с тиольными группами. Таким образом, идеальные антитела должны иметь сайты связывания, удаленные от образуемых дисульфидных мостиков.
В качестве отрицательного контроля мы использовали образцы, образованные высокомолекулярными MeO-PEG-Mal в отсутствие TCEP. После восстановления TCEP образцы обрабатывали MeO-PEG-Mal в разных концентрациях (10, 20 и 50 мг) для стабильного максимального мечения дисульфидных мостиков в белке-мишени. После введения метки проводили обессоливание, направленное на снижение количества остаточного непрореагировавшего MeO-PEG-Mal (м.м. 5000), чтобы предотвратить его влияние на миграцию полос в SDS-ПААГ и результаты последующего анализа.
Каналы TRP выполняют разные функции в качестве сенсоров многих стимулов [21]. Все TRP-каналы представляют собой симметричные тетрамеры с центральной порой для проникновения ионов, в которых С-концевые области опосредуют прямое взаимодействие между субъединицами [22]. Нами установлено, что С-концевые остатки цистеина (639, 645, 652, 660, 777) образуют дисульфидные связи в TRPV4. Рандомные мутанты с двойными заменами остатков цистеина в положении 639, 645, 652, 660 имеют сходные профили миграции с мутантами по единичным остаткам цистеинов, что указывает на участие этих четырех цистеинов в произвольном формировании двух дисульфидных связей. Замены трех или четырех остатков цистеина (639, 645, 652, 660) нарушали внутрицепочечные дисульфидные связи и значительно изменяли паттерны миграции белковых полос (с трех до одной). Полосы высокомолекулярных производных отсутствовали в случае мутантов по цистеинам в положении 645, 652, 660, 777, что свидетельствует об участии цистеина-777 в образовании дисульфидной связи. Криоэлектронная микроскопия и рентгеноструктурный анализ TRPV4 Xenopus tropicalis показали, что остатки I674, G675, M676, D678, E680 образуют ион-проницаемую пору [23]. Отметим, что остатки цистеина 639, 645, 652, 660, которые образуют дисульфидные мостики в TRPV4 человека, выявленные в нашей работе, прилежат к функциональным аминокислотным остаткам, образующим ион-проницаемую пору. Учитывая участие дисульфидных мостиков, локализованных вблизи поры, в потенциальной модуляции чувствительности к экзогенным стимулам, показанное при изучении TRPV4 мыши [24], роль новых идентифицированных дисульфидных связей и их вклад в функционирование TRPV4 можно рассматривать как область дальнейших исследований.
ВЫВОДЫ
Нами разработан простой и чувствительный подход, позволяющий специфически детектировать дисульфидные связи в белке-мишени. Основное преимущество этого метода – возможность идентифицировать и охарактеризовать важные дисульфидные мостики в белках более простым и экономически выгодным способом.
Мы выражаем признательность Miguel A. Valverde (Universitat Pompeu Fabra, Barcelona, Spain) за предоставленные плазмиды и Xiaomin Wang (Capital Medical University, Beijing, China) за помощь с лабораторным оборудованием.
Выполнение работы поддержано National Nature Science Foundation of China (nos. 81100765, 81570990).
В данной работе не использовали животных в качестве объектов исследования
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Bulaj G. (2005) Formation of disulfide bonds in proteins and peptides. Biotechnol. Adv. 23, 87–92.
Cook K.M., Hogg P.J. (2013) Post-translational control of protein function by disulfide bond cleavage. Antioxidants Redox Signaling. 18, 1987–2015.
Goldberger R.F., Epstein C.J., Anfinsen C.B. (1963) Acceleration of reactivation of reduced bovine pancreatic ribonuclease by a microsomal system from rat liver. J. Biol. Chemistry. 238, 628–635.
Anfinsen C.B., Haber E. (1961) Studies on the reduction and re-formation of protein disulfide bonds. J. Biol. Chemistry. 236, 1361–1363.
Bonander N., Leckner J., Guo H., Karlsson B.G., Sjolin L. (2000) Crystal structure of the disulfide bond-deficient azurin mutant C3A/C26A: how important is the S-S bond for folding and stability? Eur. J. Biochemistry. 267, 4511–4519.
Wetzel R., Perry L.J., Baase W.A., Becktel W.J. (1988) Disulfide bonds and thermal stability in T4 lysozyme. Proc. Natl. Acad. Sci. USA. 85, 401–405.
Hogg P.J. (2003) Disulfide bonds as switches for protein function. Trends Biochem. Sci. 28, 210–214.
Go Y.M., Jones D.P. (2013) Thiol/disulfide redox states in signaling and sensing. Critical Rev. Biochem. Mol. Biol. 48, 173–181.
Tarnow P., Schoneberg T., Krude H., Gruters A., Biebermann H. (2003) Mutationally induced disulfide bond formation within the third extracellular loop causes melanocortin 4 receptor inactivation in patients with obesity. J. Biol. Chem. 278, 48666–48673.
Singh R. (2008) A review of algorithmic techniques for disulfide-bond determination. Brief. Funct. Genomics Proteomics. 7, 157–172.
Tsai C.H., Chan C.H., Chen B.J., Kao C.Y., Liu H.L., Hsu J.P. (2007) Bioinformatics approaches for disulfide connectivity prediction. Curr. Prot. Peptide Sci. 8, 243–260.
Singh R., Murad W. (2013) Protein disulfide topology determination through the fusion of mass spectrometric analysis and sequence-based prediction using Dempster–Shafer theory. BMC Bioinform. 14(Suppl. 2), S20.
Planey S.L. (2012) Discovery of selective and potent inhibitors of palmitoylation. Intech. 9, 251–288.
Fontaine S.D., Reid R., Robinson L., Ashley G.W., Santi D.V. (2015) Long-term stabilization of maleimide-thiol conjugates. Bioconjugate Chem. 26, 145–152.
Ravi S., Krishnamurthy V.R., Caves J.M., Haller C.A., Chaikof E.L. (2012) Maleimide-thiol coupling of a bioactive peptide to an elastin-like protein polymer. Acta Biomaterialia. 8, 627–635.
Ghosh S.S., Kao P.M., McCue A.W., Chappelle H.L. (1990) Use of maleimide-thiol coupling chemistry for efficient syntheses of oligonucleotide-enzyme conjugate hybridization probes. Bioconjugate Chem. 1, 71–76.
Singh R., Whitesides G.M. (1994) Reagents for rapid reduction of native disulfide bonds in proteins. Bioorg. Chem. 22, 109–115.
Ding Q.W., Zhang Y., Wang Y., Wang Y.N., Zhang L., Ding C., Wu L.L., Yu G.Y. (2010) Functional vanilloid receptor-1 in human submandibular glands. J. Dental Res. 89, 711–716.
Nordlund H.R., Laitinen O.H., Uotila S.T., Nyholm T., Hytonen V.P., Slotte J.P., Kulomaa M.S. (2003) Enhancing the thermal stability of avidin. Introduction of disulfide bridges between subunit interfaces. J. Biol. Chem. 278, 2479–2483.
Carugo O., Cemazar M., Zahariev S., Hudaky I., Gaspari Z., Perczel A., Pongor S. (2003) Vicinal disulfide turns. Protein Engin. 16, 637–639.
Caterina M.J. (2007) Transient receptor potential ion channels as participants in thermosensation and thermoregulation. Am. J. Physiol. Regul. Integr. Comp. Physiol. 292, R64–76.
Wang S., Chuang H.H. (2011) C-terminal dimerization activates the nociceptive transduction channel transient receptor potential vanilloid 1. J. Biol. Chem. 286, 40601–4067.
Deng Z., Paknejad N., Maksaev G., Sala-Rabanal M., Nichols C.G., Hite R.K., Yuan P. (2018) Cryo-EM and X-ray structures of TRPV4 reveal insight into ion permeation and gating mechanisms. Nat. Struct. Mol. Biol. 25, 252–260.
Duan J., Li J., Zeng B., Chen G.L., Peng X., Zhang Y., Wang J., Clapham D.E., Li Z., Zhang J. (2018). Structure of the mouse TRPC4 ion channel. Nat. Commun. 9, 3102.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология