Молекулярная биология, 2021, T. 55, № 3, стр. 510-518
Перекрестные связи между сигнальными путями глутаматных и лептиновых рецепторов
А. Л. Проскура a, *, М. Ю. Исламова a, С. О. Вечкапова a
a Федеральный исследовательский центр информационных и вычислительных технологий,
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: annleop@mail.ru
Поступила в редакцию 27.07.2020
После доработки 05.09.2020
Принята к публикации 10.09.2020
Аннотация
Гормон лептин, который продуцируется адипоцитами – клетками белой жировой ткани, проникает через гематоэнцефалический барьер, а его рецепторы представлены в отделах мозга, участвующих в реализации высших когнитивных функций. Лептин влияет на рециркуляцию глутаматных рецепторов (на синапсах СА3 → CA1), что сопровождается повышением уровня фосфатидилинозитол-3,4,5-трифосфатов, контролируемого фосфоинозитид-3-киназой. Считается, что в этом задействован участок сигнального пути другого гормона, инсулина. Однако эффекты этих гормонов различаются как на клеточном, так и на поведенческом уровне, а зачастую и противоположны. Нами проведен анализ доменной организации синаптических белков нейронов поля СА1. Предложен молекулярный механизм реализации эффектов лептина в гиппокампе через пересечение регуляторных путей его рецепторов и глутаматных рецепторов типа NMDA. Нерецепторные тирозиновые протеинкиназы подсемейства Src, в частности Fyn, входят в макрокомплексы глутаматных рецепторов и вовлечены в регуляшию эффективности синаптической передачи. Киназа Fyn, как мы предполагаем, через свой SH2-домен может взаимодействовать прямо или через другие белки с рецепторами лептина и таким образом способствовать реализации его эффектов через сигнальный путь фосфоинозитид-3-киназы. Наша гипотеза объясняет наблюдаемые в экспериментах процессы и позволяет, по крайней мере отчасти, пролить свет на тонкую настройку гормональной модуляции синаптических процессов в гиппокампе.
ВВЕДЕНИЕ
Ионотропные глутаматные рецепторы (рецепторы N-метил-D-аспартата, NMDA, и α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты, AMPA) – ключевые компоненты возбуждающих синапсов в мозге. Они формируют макрокомплексы, которые обеспечивают регуляцию белок-белковых сетей в протеоме постсинаптической части синапсов (дендритные шипики) пирамидных нейронов поля СА1 гиппокампа. В настоящее время установлено, что синапс СА3 → → CA1 (коллатерали шафера поля СА3 → пирамидные нейроны поля СА1) способен воспринимать широкий спектр сигналов помимо классических нейротрансмиттеров. На постсинаптической части синапсов гиппокампа располагается множество рецепторов различной природы, в том числе и ряда гормонов. Протеом дендритных шипиков гиппокампа представляет собой мультифункциональную и многоуровневую систему контроля глутаматергической нейротрансмиссии [1]. Это объясняет вовлеченность гиппокампа в реализацию как высших когнитивных функций, так и в модуляцию широкого спектра физиологических процессов в организме [2].
Гормон лептин (OB, или LEP, кодируется геном LEP у человека и Lep у мыши) – белок 16 кДа, который продуцируется адипоцитами белой жировой ткани и вызывает различные биологические эффекты. Лептин проникает через гематоэнцефалический барьер и, действуя через свои рецепторы в гипоталамусе, участвует в регуляции энергетического обмена организма и массы тела. Очевидно, что центральная активность лептина распространяется и на другие области мозга. Считается, что этот гормон оказывает прокогнитивное и антидепрессивное действие на центральную нервную систему. Лептин влияет на регуляцию синаптической пластичности, синаптогенез и взрослый нейрогенез, а резистентность к нему сопровождается нарушением зависимого от гиппокампа поведения и депрессивно-подобным состоянием. Прямая инъекция лептина в головной мозг мышей усиливает долговременную потенциацию (ДВП) и способствует формированию у них пространственной памяти [3–6].
Считается, что лептин может действовать через некоторые компоненты сигнального каскада инсулина, в частности, через сигнальный каскад белка IRS (субстрат рецептора инсулина (Insulin receptor substrate)): IRS/фосфоинозитид-3-киназа/протеинкиназа В (IRS/РI3K/PKВ) [7–9]. Однако это предположение не представляется достаточно экспериментально обоснованным, по крайней мере для возбуждающих синапсов гиппокампа, и требует дополнительных исследований.
Цель нашей работы состояла в том, чтобы выяснить возможный молекулярный механизм реализации модулирующих эффектов лептина на изменение и поддержание эффективности синаптической передачи в поле СА1 гиппокампа после индукции ДВП, зависимой от NMDAR. Чтобы уточнить механизмы, с помощью которых лептин может способствовать накоплению фосфатидилинозитол-3,4,5-трифосфатов (PIP3), нами проведен поиск вероятного белка, обеспечивающего ассоциацию между рецептором лептина и сигнальным путем PI3K в интерактоме синаптических белков, представленных в базе GeneNet. Анализ опубликованных данных позволил провести реконструкцию перекрестных белок-белковых взаимодействий между сигнальными путями рецепторов глутамата и лептина.
ВТОРИЧНЫЕ ПОСРЕДНИКИ В РЕГУЛЯТОРНЫХ СЕТЯХ СИНАПСОВ ГИППОКАМПА
ДВП – общепринятая клеточная модель синаптической пластичности in vitro, проявляется усилением синаптической эффективности на протяжении длительного времени. Считается, что ДВП отражает процессы, протекающие в мозге при обучении и запоминании [10]. В базе данных GeneNet (РОСПАТЕНТ № 990006 от 15/02/1999) [11, 12] представлена информация об основных белках, участвующих в процессах изменения и поддержания эффективности синаптической передачи при ДВП в поле СА1 гиппокампа, на основании которой реконструированы диаграммы синаптических процессов во взрослом гиппокампе (http://wwwmgs.bionet.nsc.ru/mgs/gnw/genenet/viewer) [13–15].
Вторичные посредники появляются в ответ на внеклеточные сигнальные агенты, например гормоны. Фосфоинозитиды (РI) выполняют в клетке не структурную, а регуляторную функцию. Примерно 5% PI фосфорилируется только в положении 4 (фосфатидилинозитол-4-фосфат (PI(4)P)) и в положениях 4 и 5 (фосфатидилинозитол-4,5-дифосфат (PI(4,5)P2, или PIP2)) и менее 0.25% – в положении 3 (фосфатидилинозитол-3-фосфат (PI(3)P); фосфатидилинозитол-3,4,5-трифосфат (PI(3,4,5)P3, или PIP3)) [16].
Генерация пула вторичных посредников на плазматической мембране – это ключевое событие после индукции ДВП на возбуждающих синапсах гиппокампа, которое контролируется PI-специфичными киназами и фосфатазами: переход PI(4)P → PI(4,5)P2 контролирует фосфоинозитид-5-киназа (PI5К), которая активируется после индукции ДВП [17–19]; PI(4,5)P2 → → PI(3,4,5)P3 – PI3К. PIP2 запускает процесс клатринзависимого эндоцитоза, перемещение везикул, а PIP3 инициирует локальный синтез белка, а также перестройку цитоскелета [13, 14, 19–23].
Показано, что лептин способствует накоплению PIP3, что сопряжено с активацией NMDAR. При этом блокаторы PIP3К класса I, в отличие от блокаторов МАРК-киназ, приводили к ингибированию этих эффектов лептина [5, 8]. Предынкубация с лептином способствует увеличению плотности АМPАR, в состав которых входит субъединица GluR1 [24]. После индукции ДВП эти рецепторы замещают конститутивно присутствующие на синапсах АМPAR, содержащие субъединицы GluR2/GluR3 (GluR2/3-АМPAR), которые определяют базовую нейротрансмиссию, а также индукцию ДВП [20]. При этом происходит дезактивация конститутивно активного антагониста PI3К – фосфатазы PTEN (the phosphatase and tensin homolog deleted on chromosome 10) [24], которая обеспечивает низкий уровень PIP3 [25]. Дезактивация PTEN обусловлена кооперативным фосфорилированием ее цитоплазматического домена по Ser370, Ser385 казеинкиназой 2 (CK2) и Thr366 киназой гликогенсинтазы 3β (GSK3β, Glycogen synthase kinase 3β) [26].
СИГНАЛЬНЫЙ ПУТЬ РЕЦЕПТОРА ЛЕПТИНА
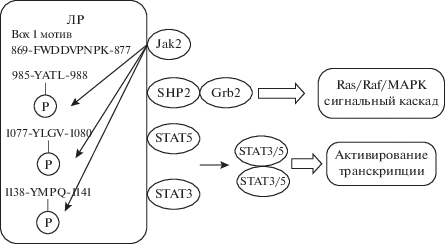
Рецептор лептина (продукт гена LEPR человека и Lepr мыши) относится к рецепторам цитокинов класса I. Рецептор лептина не обладает собственной тирозинкиназной активностью в отличие от рецептора инсулина. После взаимодействия с лептином его рецептор связывается с Янус-киназой (Jak2, Janus kinases) и димеризуется. Далее Jak2 фосфорилирует остатки тирозина, расположенные на цитоплазматических участках рецептора лептина – Tyr985, Tyr1077 и Tyr1138, которые далее служат площадками для закрепления определенных белков – SHP2 (SH2 (Src-like homology 2) domain-containing protein tyrosine phosphatase), STAT5 и STAT3 – преобразователей сигнала и активаторов транскрипции 5 и 3 (signal transducer and activator of transcription 5 and 3) соответственно. Взаимодействие с белками обеспечивают SH2-домены, которые закрепляются на фосфорилированных остатках тирозина. Белки STAT фосфорилируются Jak2, после чего отсоединяются от рецептора лептина, димеризуются и транслоцируются в ядро, где обеспечивают активацию транскрипции, в частности, ранних генов. Jak2 фосфорилирует также определенный остаток тирозина в SHP2, что обеспечивает закрепление адаптерного белка Grb2 (growth factor receptor binding-2), который инициирует передачу сигнала от рецептора лептина в ядро через сигнальный каскад: рецептор лептина → SHP2 → Grb2 → → Ras/Raf/MAPK [9] (рис. 1).
Белок IRS хорошо представлен на постсинаптических мембранах гиппокампа, где он фосфорилируется активным рецептором инсулина и участвует в реализации его эффектов [27]. Предполагается, что IRS вовлечен в активацию РI3K в сигнальном пути рецептора лептина [9]. Взаимодействие регуляторной субъединицы p85 с каталитической субъединицей p110 приводит к активации PI3K [28]. Это может происходить после закрепления р85 через собственный SH2-домен на определенных цитоплазматических участках мембранных рецепторов с фосфорилированным остатком тирозина на коротких мотивах – рYXXM [29].
Действительно, большинство эффектов инсулина связано с активацией PI3K, что позволяет считать это точкой пересечения сигнальных путей инсулина и лептина. Так, например, показано, что в гипоталамусе, а также в жировой ткани, поджелудочной железе и печени лептин индуцирует сигнальный путь, включающий PI3K. Кроме того, косвенные доказательства участия каскада IRS / PI3K в реализации эффектов лептина получены на мышах с нуль-мутацией IRS2 с гиперфагией и гипометаболическим состоянием, что также сопровождается ожирением и гиперлептинемией, но не столь выраженными, как у животных db/db (см. обзор [9]). Однако мы задали вопрос: могут ли существовать другие точки пересечения сигнальных путей лептина и сети контроля глутаматергической нейротрансмиссии в протеоме дендритных шипиков? С этой целью проанализирована доменная организация представленных в базе данных GeneNet синаптических белков, гипотетически способных обеспечивать запускаемое лептином накопление PIP3 и увеличение плотности синаптических GluR1-АМPАR.
ТОЧКИ ПЕРЕСЕЧЕНИЯ СИГНАЛЬНЫХ ПУТЕЙ ГЛУТАМАТНЫХ И ЛЕПТИНОВЫХ РЕЦЕПТОРОВ
Нами предложена гипотеза, согласно которой в синаптическом интерактоме после зависимой от NMDAR индукции ДВП и в присутствии лептина (в эксперименте – предынкубация с лептином до индукции ДВП) фосфорилированный остаток тирозина, локализованный в цитоплазматическом участке рецептора лептина, взаимодействует с SH2-доменом/ми белка, который через свой SH3-домен способен закрепить на рецепторе лептина регуляторную субъединицу р85 PI3K.
Домен белка представляет собой достаточно стабильную и независимую субструктуру, сворачивание которой происходит независимо от других частей молекулы и опосредует специфические функции, определяя место белка в сигнальных каскадах. Структурно сходные домены обнаружены не только в родственных белках, но и в белках, выполняющих совершенно разные функции [29].
Домены SH2 и SH3 (Src homology) опосредуют белок-белковые взаимодействия в путях сигнальной трансдукции. Домены SH2 закрепляются на коротких мотивах – YXXM, в которых первый остаток тирозина (Tyr = Y) должен быть фосфорилирован (pYXXM). Взаимодействие pYXXM-SH2 запускает передачу сигнала от рецептора внутрь клетки. Домены SH3 взаимодействуют с участками, обогащенными остатками пролина (Prolin rich domain, PRD), и опосредуют пространственную стыковку в макрокомплексах белков [29].
Согласно данным базы Swiss-Prot (https:// www.uniprot.org/) (P26450 (P85A_MOUSE)) содержит два SH2- и один SH3-домен, а также участок, богатый пролином (84-PPTPKPRPP-92). SH2-домены регуляторной субъединицы р85 закрепляются на каноническом YXXM мотиве, который представлен в молекуле рецептора инсулина: 1351-YTHM-1354 (P15208 (INSR_MOUSE)). IRS обладает множеством таких участков: 9 мотивов у IRS1 (P35569 (IRS1_MOUSE)): 460-YICM-463; 546-YTEM-549; 608-YMPM-611; 628-YMPM-631; 658-YMMM-661; 727-YMNM-730; 935-YMNM-938; 983-YMTM-986; 1006-YADM-1009; в молекуле IRS2 (P81122 (IRS2_MOUSE)) семь классических мотивов связывания с доменами SH2: 536-YGYM-539; 594-YTLM-597; 649-YMPM-652; 671-YMPM-674; 734-YMRM-737; 814-YVLM-817; 1061-YTEM-1064.
Рецептор лептина не содержит классических мотивов YXXM, на которых может закрепиться регуляторная субъединица р85. Однако показано его взаимодействие с SH2-доменами некоторых белков через остатки тирозина, фосфорилируемые Jak2 (рис. 1).
Ряд синаптических белков, депонированных в базу данных GeneNet, имеют домены обоих типов – SH2 и SH3. Особый интерес представляют нерецепторные тирозиновые протеинкиназы подсемейства Src – Abl, Src, Fyn, Lyn, Yes. Протеинкиназы этого класса вовлечены в различные пути регуляции синаптической пластичности [30]. Fyn экспрессируется в зрелых синапсах и отсутствует в раннем развитии. Показано, что мутации Fyn ослабляют синаптическую передачу у взрослых мышей и нарушают пространственное зависимое от гиппокампа обучение, хотя мутации других нерецепторных тирозинкиназ (Src, Yes и Abl) не приводят ни к нарушению индукции ДВП, ни к проблемам в ее поддержании [31]. Более того, Fyn совместно с рецептором лептина включена в макрокомплексы NMDAR, в состав которых входит субъединица NR2B [32, 33]. Fyn закрепляется на белках постсинаптического уплотнения и прямо участвует в процессах пальмитоилирования и регуляции закрепления АМPАR на синапсах [34].
Все это позволяет нам сосредоточиться на изучении вероятности взаимодействия SH2-домена Fyn с неклассическими мотивами в цитоплазматическом участке рецептора лептина, несущими остатки тирозина, которые фосфорилируются Jak2. С этой целью мы решили оценить уровень сходства аминокислотных последовательностей SH2-доменов Fyn и белков, взаимодействие которых с фосфорилированными остатками тирозина (pY) в цитоплазматическом участке рецептора лептина показано достоверно. К таким белкам относятся SHP2, STAT3, STAT5, а также белок Grb2. Grb2 служит посредником между SHP2 и сигнальным каскадом МАРК. Имеются данные, что индуцируемое лептином накопление PIP3 блокируется ингибиторами PI3К и не чувствительно к ингибиторам МАРК-киназного пути [6, 7]. Кроме того, в выборку включили Jak2, цитоплазматический домен которой содержит неканонический SH2-мотив.
В работе использовали алгоритм Смита–Уотермана (http://www.ebi.ac.uk/Tools/psa/emboss_water/). Аминокислотные последовательности белков получены из базы данных Swiss-Prot.
Согласно данным Swiss-Prot сформирована выборка доменов SH2:
| Mouse FYN (P39688 (FYN_MOUSE)) 149–246 | SH2 |
| WYFGKLGRKDAERQLLSFGNPRGTFLIRESETTKGAYSLSIRDWDDMKGDHVKHYKIRKLDNGGYYITTRA-QFETLQQLVQHYSERAAGLCCRLVVPC | |
| mouse STAT3 (P42227 (STAT3_MOUSE)) 580–670 | SH2 |
| WNEGYIMGFISKERERAILSTKPPGTFLLRFSESSKEGGVTFTWVEKDISGKTQIQSVEPYTKQQLNNMSFAEI-IMGYKIMDATNILVSPL | |
| Mouse STA5 (P42230 (STA5A_MOUSE)) 589–686 | SH2 |
| WNDGAILGFVNKQQAHDLLINKPDGTFLLRFSDSEIGGITIAWKFDSPDRNLWNLKPFTTRDFSIRSLADRL-GDLNYLIYVFPDRPKDEVFAKYYTPV | |
| Mouse Jak2 (Q62120 (JAK2_MOUSE)) 401–482 | SH2; atypical |
| HGPISMDFAISKLKKAGNQTGLYVLRCSPKDFNKYFLTFAVERENVIEYKHCLITKNENGEYNLSGTKRNFSN-LKDLLNCYQ | |
| Mouse SHP2 (P35235 (PTN11_MOUSE)) 6–102 | SH2 (6–102) |
| WFHPNITGVEAENLLLTRGVDGSFLARPSKSNPGDFTLSVRRNGAVTHIKIQNTGDYYDLYGGEKFATLAELV-QYYMEHHGQLKEKNGDVIELKYPL | |
| Mouse SHP2 (P35235 (PTN11_MOUSE)) 112–216 | SH2 (112–216) |
| WFHGHLSGKEAEKLLTEKGKHGSFLVRESQSHPGDFVLSVRTGDDKGESNDGKSKVTHVMIRCQELKYDVG-GGERFDSLTDLVEHYKKNPMVETLGTVLQLKQPL | |
| Mouse GRB2 (Q60631 (GRB2_MOUSE)) 60–152 | SH2 |
| WFFGKIPRAKAEEMLSKQRHDGAFLIRESESAPGDFSLSVKFGNDVQHFKVLRDGAGKYFLWVVKFNSLNEL-VDYHRSTSVSRNQQIFLRDIE | |
Для количественного определения сходства двух биологических последовательностей используется парное выравнивание. Показателем сходства служит параметр score, или счет выравнивания. Чем больше позиций, содержащих одинаковые или похожие остатки, и чем меньше позиций, содержащих разные остатки или разрывы, тем выше будет значение этого параметра. Таким образом, его можно считать мерой сходства последовательностей.
Проведенное нами парное выравнивание выявило высокую меру сходства, а также значительный процент идентичных и сходных по аминокислотному составу участков в последовательностях Fyn и Grb2. Домены SHP2 также показали высокий уровень сходства (табл. 1).
Таблица 1.
Результаты парного выравнивания SH2-доменов
| Белок, связывающийся с рецептором лептина посредством SH2-домена | Fyn, идентичность/сходство, % |
Мера сходства |
|---|---|---|
| Stat3 | 36.1/55.7 | 64.0 |
| Stat5 | 24.2/ 47.0 | 48.5 |
| Jak2 | 27.4/ 46.4 | 65.5 |
| SH2 (6–102) SHP2 | 34.9/54.7 | 106.5 |
| SH2 (112–216) SHP2 | 37.9/53.7 | 135.0 |
| Grb2 | 38.6/60.2 | 141.0 |
Таким образом, мы можем предположить, что Fyn с определенной долей вероятности может конкурировать за взаимодействие с pY-985 либо непосредственно, либо пристыковываясь к pY-SHP2. Как уже упоминалось ранее, зависимое от лептина накопление PIP3 не чувствительно к блокаторам МАРК-киназ [6, 7].
Сравнили также меры сходства SH2-доменов у некоторых представителей подсемейства нерецепторных тирозинкиназ Src (Src, Yes и Abl) (согласно [31]) (табл. 2).
Таблица 2.
Результаты парного выравнивания SH2-доменов Src-киназ и белков сигнального пути лептина
| Мера сходства SH2-доменов | ||||||
|---|---|---|---|---|---|---|
| Белок подсемейства тирозинкиназ Src | Grb2 | Stat3 | Stat5 | Jak2 | SHP2 (6–102) |
SHP2 (112–216) |
| Src | 151.5 | 59.0 | 65.5 | 52.0 | 104.5 | 121.5 |
| Yes | 387.0 | 47 | 45 | 77.5 | 116.5 | 137 |
| c-Abl | 159.0 | 53.5 | 51 | 42.5 | 146.5 | 128 |
| Fyn | 141.0 | 64.0 | 48.5 | 65.5 | 106.5 | 135.0 |
Высокая мера сходства с SH2-доменами Grb2 и SHP2 выявлена и у других представителей подсемейства Src. Однако с учетом данных [31] мы предполагаем, что именно Fyn может рассматриваться как точка пересечения сигнальных путей лептина и NMDAR в зрелых синапсах. Данные, представленные в табл. 2, косвенно подтверждают, что лептин может вовлекаться в регуляцию синаптической пластичности через сигнальный путь PI3К на ранних стадиях развития или в течение нейрогенеза.
На основании анализа данных PubMed мы реконструировали белок-белковые взаимодействия между сигнальными путями рецепторов лептина и NMDAR после индукции ДВП для синапсов поля СА1 гиппокампа.
Moult и соавт. показали (на срезах взрослого гиппокампа), что лептин повышает экспрессию синаптических GluR1-АМРAR, что сопровождалось накоплением PIP3, а также инактивацией фосфатазы PTEN за счет ее кооперативного фосфорилирования протеинкиназами СК2 и GSK3b [24].
Негативная регуляция конститутивно активной GSK3β осуществляется преимущественно посредством фосфорилирования Ser9 (pS9), главным образом РКВ: рецептор → p85 → p85/p110 → PIP3 → → присоединение и активация РКB → рS9-GSK3β. При этом наблюдается не полное, а скорее конкурентное ингибирование GSK3β. Полная активация GSK3β достигается за счет фосфорилирования Y216 в ее активационной петле, возможно, протеинкиназой Fyn [35]. Стоит также отметить, что GSK3β ингибирует Rab5, которая инициирует процесс сортировки AMPAR в покрытые клатрином везикулы при эндоцитозе [36].
После индукции NMDAR-опосредованной ДВП запускается целый каскад процессов, обеспечивающих повышение эффективности синаптической передачи вследствие увеличения плотности синаптических AMPAR и ее дальнейшее поддержание. Ключевым событием является выведение из синапсов GluR2-AMPAR и введение GluR1-AMPAR, что, в итоге, и формирует новую плотность AMPAR, поддерживаемую далее конститутивным кругооборотом (балансирование процессов эндоцитоза рецепторов ↔ возврата рецепторов на плазматическую мембрану) GluR2-AMPAR [20].
Рис. 1.
Схема сигнальных путей рецептора лептина. ЛР – рецептор лептина; Jak2 – Янус-киназа 2; STAT3 и STAT5 – преобразователи сигнала и активаторы транскрипции 3 и 5 соответственно; SHP2 –тирозинфосфатаза с доменом SH2; Grb2 – белок 2, связывающий рецептор фактора роста (growth factor receptor binding-2); Ras – малая GТPаза Ras; Raf – серин-треониновая протеинкиназа Raf; MAPK – митоген-активируемые протеинкиназы. Ⓟ остаток фосфорной кислоты, присоединяемый протеинкиназой Jak2 к определенным остаткам тирозина в молекуле рецептора лептина.
Эти процессы контролируются протеинкиназами и фосфатазами, которые активируются после индукции ДВП. Одна из ключевых протеинкиназ – РКС, фосфорилирует остатки серина в AMPAR – S880 в GluR2-АМPAR, что необходимо для их отсоединения от белков синапса и выведения во внесинаптическую зону, где они будут подвергаться сортировке и поступать в эндосомы для эндоцитоза. GluR1, для их корректной фиксации и активации, также фосфорилируются РКС по остатку S818 [13], а для активации РКС необходима активность NMDAR и диацилглицерина – продукта распада PI(4,5)P2.
На основании анализа опубликованных данных мы предлагаем вероятный молекулярный механизм пересечения сигнальных путей глутаматных и лептиновых рецепторов после индукции NMDAR-опосредованной ДВП:
Лептин/рецептор лептина → Jak2 → pY-SHP2 → → Fyn → Fyn/p85A → p85/p100-PI3K → [PIP2 → → PIP3].
Лептин/рецептор лептина → Jak2 → pY-SHP2 → → Fyn → pY216-GSK3b → pThr366-PTEN.
Таким образом, лептин может запускать сигнальный путь PI3К через протеинкиназу Fyn. Fyn, с одной стороны, может напрямую взаимодействовать с обогащенным остатками пролина участком р85 и запускать сигнальный путь PI3К, с другой, непосредственно активировать GSК3β. GSК3β в кооперации с СК2 ингибирует активность PTEN. Это будет способствовать накоплению PIP3. PIP3 через РКВ также может способствовать индукции локального синтеза белка в дендритах – формированию пула белков, готовых к отправке к активным синапсам, в том числе AMPAR.
Рис. 2.
Схема пересечения сигнальных путей NMDAR и рецепторов лептина. 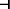 – Блокирующее влияние; стрелки – активирующее влияние. ЛР – рецептор лептина; GluR1-,
GluR2/3 – субъединицы АМPAR; PI5К – фосфоинозитид-5-киназа; PI3К – фосфоинозитид-3-киназа;
р85 и р110 – регуляторная и каталитическая субъединицы PI3К соответственно; pY985
– фосфорилированный Tyr985 в цитоплазматическом участке ЛР; Fyn – нерецепторная тирозиновая
протеинкиназа Fyn подсемейства Src; SH3 и SH2 – домены Src-like homology 3 и 2 соответственно;
PKВ – протеинкиназа В; PI4P – фосфатидилинозитол-4-фосфат; PI(3,4,5)P3 – фосфатидилинозитол-3,4,5-трифосфат;
PI(4,5)P2 – фосфатидилинозитол-4,5-дифосфат; Jak2 – Янус-киназа 2; CK2 – казеинкиназа
2; SHP2 –тирозинфосфатаза с доменом SH2; PKС – протеинкиназа С; ДАГ – диацилглицерин.
– Блокирующее влияние; стрелки – активирующее влияние. ЛР – рецептор лептина; GluR1-,
GluR2/3 – субъединицы АМPAR; PI5К – фосфоинозитид-5-киназа; PI3К – фосфоинозитид-3-киназа;
р85 и р110 – регуляторная и каталитическая субъединицы PI3К соответственно; pY985
– фосфорилированный Tyr985 в цитоплазматическом участке ЛР; Fyn – нерецепторная тирозиновая
протеинкиназа Fyn подсемейства Src; SH3 и SH2 – домены Src-like homology 3 и 2 соответственно;
PKВ – протеинкиназа В; PI4P – фосфатидилинозитол-4-фосфат; PI(3,4,5)P3 – фосфатидилинозитол-3,4,5-трифосфат;
PI(4,5)P2 – фосфатидилинозитол-4,5-дифосфат; Jak2 – Янус-киназа 2; CK2 – казеинкиназа
2; SHP2 –тирозинфосфатаза с доменом SH2; PKС – протеинкиназа С; ДАГ – диацилглицерин.
GSK3β, ингибируя Rab5, способствует также замедлению процесса эндоцитоза, обеспечивая дополнительно повышение плотности рецепторов. GluR1-AMPAR в зоне синаптического контакта фиксируются в том числе с помощью нитей актина [13]. PIP3 способствует активации белка PREX (Phosphatidylinositol 3,4,5-trisphosphate-dependent Rac exchanger 2 protein), который запускает их полимеризацию [37].
Таким образом, эффекты лептина, который вводили до индукции ДВП (предынкубация), будут сводиться к формированию пула новых рецепторов на уровне дендритов. Синапс приходит в состояние, предподготовленное для перехода на новый уровень нейротранcмиссии. Однако PI3К запускает также процесс обратной негативной регуляции через GSK3β (РКВ ингибирует GSK3β). Это обеспечивает сбалансированное состояние системы и защищает от излишнего повышения плотности синаптических AMPAR (рис. 2).
Таким образом, в протеоме дендритного шипика гормон лептин будет способствовать перегруппировке синаптических белков с формированием временных комплексов белков, что может лежать в основе пропотенцирующего эффекта этого гормона на ДВП в гиппокампе. Появление комплексов с новыми свойствами может быть общим механизмом гормонального контроля синаптической пластичности.
Предложенная нами гипотеза о вкладе нерецепторной протеинкиназы Fyn в пересечение сигнальных путей глутаматных и лептиновых рецепторов на синапсах СА3 → СА1 гиппокампа объясняет наблюдаемые в экспериментах эффекты лептина после индукции ДВП без привлечения сигнального пути другого гормона, а именно инсулина, – рецептор инсулина/IRS. Непродолжительное воздействие инсулина в эксперименте способствовало развитию депрессии в поле СА1 гиппокампа вследствие эндоцитоза GluR2-АМPAR, что не было связано с активностью ионотропных глутаматных рецепторов, в частности NMDAR [38]. Лептин способствует увеличению плотности AMPAR при ДВП, запускаемой NMDAR, что сопровождалось накоплением PIP3 [24]. Таким образом, полученные нами данные способствуют лучшему пониманию тонкой настройки модуляции синаптических процессов в гиппокампе двумя гормонами с привлечением схожих компонентов их сигнальных каскадов.
В работе использованы материалы, полученные при выполнении базового проекта фундаментальных исследований РАН (VI.35.2.6).
Настоящая статья не содержит каких-либо исследований, выполненных с использованием биологических материалов.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Proskura A.L., Ratushnyak A.S., Vechkapova S.O., Zapara T.A. (2018) Synapse as a multi-component and multi-level information system. Studies in Computational Intelligence. 736, 186–192.
Lathe R. (2001) Hormones and the hippocampus. J. Endocrinol. 169(2), 205–231.
Oomura Y., Hori N., Shiraishi T., Fukunaga K., Takeda H., Tsuji M., Matsumiya T., Ishibashi M., Aou S., Li X.L., Kohno D., Uramura K., Sougawa H., Yada T., Wayner M.J., Sasaki K. (2006) Leptin facilitates learning and memory performance and enhances hippocampal CA1 long-term potentiation and CaMK II phosphorylation in rats. Peptides. 27, 2738–2749.
Van Doorn Y.C., Macht V.A., Grillo C.A., Reagan L.P. (2017) Leptin resistance and hippocampal behavioral deficits. Physiol. Behav. 176, 207–213.
McGregor G., Clements L., Farah A., Irving A.J., Harvey J. (2018) Age-dependent regulation of excitatory synaptic transmission at hippocampal temporoammonic-CA1 synapses by leptin. Neurobiol. Aging. 69, 76–93.
Harvey J., Solovyova N., Irving A. (2006) Leptin and its role in hippocampal synaptic plasticity. Prog. Lipid Res. 45(5), 369–378.
O'Malley D., Irving A.J., Harvey J. (2005) Leptin-induced dynamic alterations in the actin cytoskeleton mediate the activation and synaptic clustering of BK channels. FASEB J. 19(13), 1917–1919.
Shanley L.J., O’Malley D., Irving A.J., Ashford M.L., Harvey J. (2002) Leptin inhibits epileptiform-like activity in rat hippocampal neurones via PI 3-kinase-driven activation of BK channels. J. Physiol. 545(Pt 3), 933–944.
Frühbeck G. (2006) Intracellular signalling pathways activated by leptin. Biochem. J. 393, 7–20.
Bliss T.V., Collingridge G.L. (1993) A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31–39.
Ananko E.A., Podkolodny N.L., Stepanenko I.L., Podkolodnaya O.A., Rasskazov D.A., Miginsky D.S., Likhoshvai V.A., Ratushny A.V., Podkolodnaya N.N., Kolchanov N.A. (2005) GeneNet in 2005. Nucl. Acids Res. 33, 425–427.
Колчанов Н.А., Воевода М.И., Кузнецова Т.Н., Мордвинов В.А., Игнатьева Е.В. (2006) Генные сети липидного метаболизма. Бюлл. СО РАМН. 2, 29–42.
Проскура А.Л., Малахин И.А., Турнаев И.И., Суслов В.В., Запара Т.А., Ратушняк А.С. (2013) Межмолекулярные взаимодействия в функциональных системах нейрона. Вавиловский журн. генетики и селекции. 17, 620–628.
Proskura A.L., Ratushnyak A.S., Zapara T.A. (2014) The protein-protein interaction networks of dendritic spines in the early phase of long-term potentiation. J. Comput. Sci. Syst. Biol. 7, 40–44.
Запара Т.А., Ромащенко А.В., Проскура А.Л., Ратушняк А.С. (2018) Влияние физической активности на структурную асимметрию гиппокампа мыши. Вавиловский журн. генетики и селекции. 22 (8), 1084–1089.
Rameh L.E., Cantley L.C. (1999) The role of phosphoinositide 3-kinase lipid products in cell function. J. Biol. Chem. 274(13), 8347–8350.
Sakagami H. (2008) The EFA6 family: guanine nucleotide exchange factors for ADP ribosylation factor 6 at neuronal synapses. Tohoku J. Exp. Med. 214(3), 191–198.
Sakagami H., Honma T., Sukegawa J., Owada Y., Yanagisawa T., Kondo H. (2007) Somatodendritic localization of EFA6A, a guanine nucleotide exchange factor for ADP-ribosylation factor 6, and its possible interaction with alpha-actinin in dendritic spines. Eur. J. Neurosci. 25(3), 618–628.
Krauss M., Kinuta M., Wenk M.R., De Camilli P., Takei K., Haucke V. (2003) ARF6 stimulates clathrin/AP-2 recruitment to synaptic membranes by activating phosphatidylinositol phosphate kinase type Igamma. J. Cell. Biol. 162(1), 113–124.
Newpher T.M., Ehlers M.D. (2008) Glutamate receptor dynamics in dendritic microdomains. Neuron. 58, 472–497.
Traub L.M. (2003) Sorting it out: AP-2 and alternate clathrin adaptors in endocytic cargo selection. J. Cell. Biol. 163(2), 203–208.
Fernández-Monreal M., Sánchez-Castillo C., Esteban J.A. (2016) APPL1 gates long-term potentiation through its plekstrin homology domain. J. Cell. Sci. 129(14), 2793–2803.
Чеснокова Е.А., Колосов П.М. (2016) Локальный синтез белка в дендритных окончаниях и способы его регуляции в норме и при пластических изменениях. Журн. высшей нервной деятельности. 66(2), 163–180.
Moult P.R., Cross A., Santos S.D., Carvalho A.L., Lindsay Y., Connolly C.N., Irving A.J., Leslie N.R., Harvey J. (2010) Leptin regulates AMPA receptor trafficking via PTEN inhibition. J. Neurosci. 30, 4088–4101.
Maehama T., Dixon J.E. (1998) The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate. J. Biol. Chem. 273(22), 13375–13378.
Al-Khouri A.M., Ma Y., Togo S.H., Williams S., Mustelin T. (2005) Cooperative phosphorylation of the tumor suppressor phosphatase and tensin homologue (PTEN) by casein kinases and glycogen synthase kinase 3beta. J. Biol. Chem. 280(42), 35195–35202.
Abbott M.A., Wells D.G., Fallon J.R. (1999) The insulin receptor tyrosine kinase substrate p58/53 and the insulin receptor are components of CNS synapses. J. Neurosci. 19(17), 7300–7308.
Yu J., Zhang Y., McIlroy J., Rordorf-Nikolic T., Orr G.A., Backer J.M. (1998) Regulation of the p85/p110 phosphatidylinositol 3'-kinase: stabilization and inhibition of the p110alpha catalytic subunit by the p85 regulatory subunit. Mol. Cell. Biol. 18(3), 1379–1387.
Pawson T., Nash P. (2000) Protein-protein interactions define specificity in signal transduction. Genes Dev. 14(9), 1027–1047.
Salter M.W. (1998) Src, N-methyl-D-aspartate (NMDA) receptors, and synaptic plasticity. Biochem. Pharmacol. 56(7), 789–798.
Grant S.G., O’Dell T.J., Karl K.A., Stein P.L., Soriano P., Kandel E.R. (1992) Impaired long-term potentiation, spatial learning, and hippocampal development in Fyn mutant mice, Science. 258(5090), 1903–1910.
Brigidi G.S., Santyr B., Shimell J., Jovellar B., Bamji S.X. (2015) Activity-regulated trafficking of the palmitoyl-acyl transferase DHHC5. Nat. Commun. 6, 8200.
Bland T., Zhu M., Dillon C., Sahin G.S., Rodriguez-Llamas J.L., Appleyard S.M., Wayman G.A. (2020) Leptin controls glutamatergic synaptogenesis and NMDA-receptor trafficking via Fyn kinase regulation of NR2B. Endocrinology. 161(2), bqz030.
Brigidi G.S., Sun Y., Beccano-Kelly D., Pitman K., Mobasser M., Borgland S.L., Milnerwood A.J., Bamji S.X. (2014) Palmitoylation of δ-catenin by DHHC5 mediates activity-induced synapse plasticity. Nat. Neurosci. 17(4), 522–532.
Bhat R.V., Shanley J., Correll M.P., Fieles W.E., Keith R.A., Scott C.W., Lee C.M. (2000) Regulation and localization of tyrosine216 phosphorylation of glycogen synthase kinase-3beta in cellular and animal models of neuronal degeneration. Proc. Natl. Acad. Sci. USA. 97(20), 11074–11079.
Wei J., Liu W., Yan Z. (2010) Regulation of AMPA receptor trafficking and function by glycogen synthase kinase 3. J. Biol. Chem. 285(34), 26369–26376.
Donald S., Hill K., Lecureuil C., Barnouin R., Krugmann S., John Coadwell W., Andrews S.R., Walker S.A., Hawkins P.T., Stephens L.R., Welch H.C. (2004) P‑Rex2, a new guanine-nucleotide exchange factor for Rac. FEBS Lett. 572, 172–176.
Huang C.C., Lee C.C., Hsu K.S. (2004) An investigation into signal transduction mechanisms involved in insulin-induced long-term depression in the CA1 region of the hippocampus. J. Neurochem. 89(1), 217–231.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


