Молекулярная биология, 2021, T. 55, № 3, стр. 460-467
Гипоксия ускоряет экспрессию β-актина через активацию транскрипции ACTB ядерным фактором дыхания-1
X. T. Wang a, K. Cheng a, L. Zhu a, *
a Institute of Special Environmental Medicine, Nantong University
226019 Nantong, China
* E-mail: zhuli85051796@163.com
Поступила в редакцию 05.05.2020
После доработки 30.05.2020
Принята к публикации 04.06.2020
Аннотация
Белок цитоскелета β-актин в большом количестве присутствует в цитоплазме и ядре, поэтому его часто считают внутренним контролем при анализе экспрессии генов. Недавно замечено, что содержание β-актина в различных клетках изменяется после гипоксической стимуляции, но механизм этого явления не выяснен. Мы проанализировали, приводит ли индуцированное гипоксией изменение экспрессии ядерного респираторного фактора-1 (NRF-1) к изменению экспрессии β-актина, а также исследовали механизм NRF-1-опосредованной транскрипционной регуляции экспрессии β-актина. У трети пациентов с раком желудка обнаружено значительное повышение уровней NRF-1 и β-актина в опухолях и прилегающей ткани. При обработке 1%-ным O2 линий клеток рака желудка и линии клеток желудка уровни NRF-1 и β-актина изменялись однонаправленно. Регулируя экспрессию NRF-1 посредством сверхэкспресссии или сайленсинга, мы обнаружили, что уровень β‑актина изменялся синхронно. В результате анализа потенциальных сайтов связывания NRF-1 на гене β-актина (ACTB) идентифицировано три сайта, которые консервативны в геномах человека, мыши и крысы. Эксперименты с ChIP доказали, что NRF-1 напрямую связывается с кодирующими областями ACTB человека и Actb мыши и регулирует транскрипцию этих генов.
ВВЕДЕНИЕ
β-Актин ‒ важный, широко представленный в цитоплазме и ядре белок цитоскелета, который участвует в поддержании морфологии клеток, их миграции и пролиферации, ремоделировании хроматина и модификации гистонов [1, 2]. Благодаря высокому уровню экспрессии в клетках ген β-актина (ACTB) часто используют в качестве внутреннего референс-гена при исследовании генной экспрессии [3]. Однако в последние годы сообщается, что после гипоксической стимуляции уровень β-актина в различных клетках значительно изменяется [4]. Zhong и др. [5] сообщали, что в условиях гипоксии уровни экспрессии 28S рРНК были постоянными, независимо от содержания O2, но уровни GAPDH, β-актина и циклофилина широко варьировали при гипоксии. Bruge и др. [6] продемонстрировали, что экспрессия ACTB изменяется гораздо сильнее, чем референс-генов GAPDH и SDHA/TBP в фибробластах кожи человека после лечения гипоксией. По-видимому, β-актин нестабилен при гипоксии, и это изменение более очевидно в опухолевых клетках [7]. Экспрессия β-актина всегда значительно выше в опухолевых тканях, чем в нормальных [8]. Динамические изменения β-актина инициируют миграцию опухолевых клеток и метастазирование опухолей [9, 10]. Всего несколько исследований было посвящено анализу причин увеличения уровня β-актина в опухолевой ткани. Учитывая, что гипоксия стимулирует функции опухолевых клеток, такие как пролиферация и миграция [11], мы предположили, что гипоксия инициирует экспрессию β-актина и стимулирует миграцию опухолевых клеток. Хотя в ряде исследований сообщалось об очевидном влиянии гипоксии на экспрессию β-актина, механизм этого процесса до сих пор не выяснен.
Гипоксия вызывает сильные изменения в функционировании митохондрий, которые важны для ответа клеток на гипоксию и адаптации [12]. Показано, что при гипоксии в клетках ядерный дыхательный фактор-1 (NRF-1) ‒ важный транскрипционный фактор ‒ индуцирует усиление митохондриального метаболизма и повышение уровня митохондриального дыхательного белка [13, 14]. Сначала было показано, что NRF-1 связывается с промоторной областью цитохрома с [15]. Впоследствии сообщалось, что NRF-1 может связываться с рядом генов, вовлеченных в процессы клеточного цикла и пролиферации, включая сплайсинг РНК, метаболизм, репарацию повреждений ДНК и деградацию белков убиквитинированием [16]. В дальнейшем показано, что NRF-1 широко экспрессируется в организме, регулирует ядерную транскрипцию многих генов и играет важную роль в метаболизме и дыхательной функции митохондрий [8]. Satoh и др. [17] обнаружили, что в нейрональных клетках можно найти тысячи генов-мишеней NRF-1, которые участвуют во множестве сигнальных путей, таких как функционирование митохондрий, регуляция клеточного цикла, клеточный метаболизм, нервные импульсы и т.д. Эти же авторы обнаружили, что ген β-актина может быть мишенью для NRF-1. Ранее Jayanta и др. [18] сообщали и о том, что экспрессия NRF-1 значительно повышена в некоторых опухолевых тканях, и высказывали предположение, что изменение уровня β-актина в клетках при гипоксии и в опухолевой ткани индуцировано регуляцией транскрипции гена ACTB фактором NRF-1.
Учитывая изложенные выше данные, мы задались целью определить, коррелирует ли экспрессия NRF-1 и β-актина в опухолевой и нормальной тканях и влияет ли изменение уровня NRF-1, вызванное гипоксией, на содержвание β-актина в клетках рака желудка. Кроме того, исследован механизм NRF-1-регуляции транскрипции гена ACTB.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культура клеток и гипоксия. Клетки эпителия желудка человека GES-1 были любезно предоставлены клинической больницей Наньтунского университета (Affiliated Hospital of Nantong University, Китай). Клетки культивировали в среде DMEM с 10% эмбриональной сыворотки крупного рогатого скота (FBS) при 5% CO2 и 37°C. Эпителиальные клетки карциномы желудка человека: AGS, MKN28, MKN1, SNV-719 и MKN45 ‒ культивировали в среде RPMI-1640 с 10% FBS при 5% CO2 и 37°C.
Для создания условий гипоксии клетки инкубировали при 1% O2 и 5% CO2 при 37°C в течение 48 ч. Для регуляции NRF-1 клетки GES-1 трансфицировали плазмидами с избыточной экспрессией NRF-1 или короткой интерферирующей (si) РНК к мРНК NRF-1 и инкубировали в течение 24 ч.
Иммуноблотинг. Клетки рака желудка и прилегающих тканей, полученные от пациентов, и клетки, подвергшиеся действию гипоксии, собирали и обрабатывали реагентами для экстракции белка, помещали на лед на 30 мин и центрифугировали при 15 000 × g и 4°C в течение 30 мин. Концентрацию белка определяли методом бицинхониновой кислоты. Белки разделяли электрофорезом в SDS-PAG и переносили на PVDF-мембраны полусухим способом. Мембраны инкубировали в течение 1 ч в 5%-ном обезжиренном сухом молоке, а в течение ночи при 4°C с кроличьими антителами против NRF-1 (ab175932; “Abcam”, Великобритания), β-актина (ab8227; “Abcam”) и гистона H3 (ab1791; “Abcam”). Связывание первичных антител визуализировали с помощью вторичных антител, в качестве которых использованы конъюгированные с пероксидазой хрена (HRP) ослиные антитела против кроличьих (#711-035-152; “Jackson ImmunoReseach Europe Ltd.”, Велиикобритания), и системы ECL-Plus. Анализ оттенков серого проводили с использованием программы Image J (https://imagej.nih.gov/ij/).
Иммунопреципитация хроматина (ChIP). ChIP-анализ выполняли с использованием набора SimpleChIP® Enzymatic Chromatin IP Kit (Magnetic Beads) (#9003; “Cell Signaling Technology”, Нидерланды) в соответствии с инструкциями производителя. Для сшивания белков с ДНК клетки GES-1 фиксировали в культуральной среде, содержащей 1% формальдегида, при комнатной температуре в течение 10 мин. Клетки лизировали и собирали с последующим добавлением 0.5 мкл микрококковой нуклеазы на IP-препарат и инкубировали в течение 20 мин при 37°C для расщепления ДНК до длины приблизительно 200‒500 п.о. Затем обработанный ультразвуком лизат подвергали иммунопреципитации с 2.5 мкг кроличьих антител к NRF-1 (ab34682, “Abcam”) или кроличьего IgG в качестве отрицательного контроля при 4°C в течение ночи. “Вытянутый” хроматин промывали, “расшивали” и очищали. Очищенную ДНК амплифицировали с помощью ПЦР в реальном времени с соответствующими праймерами. Режим реакции: 98°C в течение 5 мин, затем 40 трехступенчатых циклов: 30 с при 98°C, 30 с при 60°C и 30 с при 72°C. Праймеры были сконструированы следующим образом:
human ACTB S1: 5'-GCTCTTGCCAATGGGGATCG-3' (прямой) и
5'-CAGTTAGCGCCTTGAGTCCC3-3' (обратный);
human ACTB S2: 5'-TGCCTTTTATGGTAATAACGCGG-3' (прямой) и
5'-AAAGGACAAGAAGCCCTGAG-3' (обратный);
human CYTC: 5'-CCGTACACCCTAACATGCTC-3' (прямой) и
5'-TGGCACAACGAACACTCC-3' (обратный);
mouse Actb S1: 5'-ACAGTATTGGGAACCAGACG-3' (прямой) и
5'-GCAGCTAACTAGGAAGAGGG-3' (обратный);
mouse Actb S2: 5'-CTGCGCTTCCTTTGTC-3' (прямой) и
5'-CCCATTCCCACCATCA-3' (обратный).
Статистическая обработка результатов. Все данные представлены как среднее ± стандартное отклонение (SD). Средние значения двух выборок сравнивали с использованием непарного t-критерия Стьюдента. Различия считались статистически значимыми при р < 0.05. Для анализа данных использовано статистическое программное обеспечение SPSS 17.0 (https://www.ibm.com/ analytics/us/en/technology/spss/).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
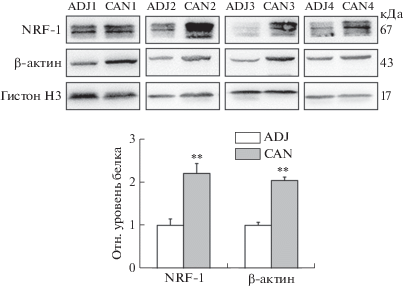
Уровни как NRF-1, так и β-актина в раковых клетках выше, чем в прилегающих тканях пациентов с раком желудка
В связи с тем, что опухоль всегда находится в гипоксическом микроокружении, мы сначала проанализировали уровни белков NRF-1 и β-актина в клетках рака желудка и прилегающих тканях, взятых у пациентов. Обнаружено, что у 33% пациентов содержание этих двух белков в опухолевых клетках было значительно выше, чем в прилегающих тканях (рис. 1).
Сходные изменения уровней NRF-1 и β-актина в эпителиальных клетках карциномы желудка после гипоксии
Для выявления изменений в экспрессии NRF-1 и β-актина в условиях гипоксии линию эпителиальных клеток желудка GES-1 и эпителиальные клетки карциномы линий AGS, MKN28, SNU-719, MKN1 и MKN45 выдерживали в среде с 1% O2 в течение 48 ч. Как видно на рис. 2а и 2в, уровни как мРНК, так и белка NRF-1 в клетках AGS, MKN28 и SNU-719 были значительно снижены. Уровень белка β-актина тоже снижался в соответствии с NRF-1, в то время как для мРНК снижение уровня не всегда было статистически значимым, в том числе в клетках AGS и MKN28. На рис. 2б и 2г видно, что уровень мРНК и белка как NRF-1, так и β-актина в клетках MKN1, MKN45 и GES-1 повышался, за исключением белка β-актина в GES-1. На основании приведенных результатов можно говорить о том, что уровни NRF-1 и β-актина изменяются однонаправленно в эпителиальных клетках карциномы желудка.
Рис. 2.
Уровни NRF-1 и β-актина изменяются синхронно в клетках карциномы желудка и в клеточных линиях желудка после гипоксии. Клетки AGS, MKN28, SNU-719, MKN1, MKN45 и GES-1 выдерживали в течение 48 ч при 1% O2. Уровни экспрессии NRF-1 и β-актина анализировали методом иммуноблотинга (а и б) и ПЦР в реальном времени(в и г) (n = 3). *p < 0.05, **p < 0.01, ***p < 0.001 по сравнению с 0 ч.
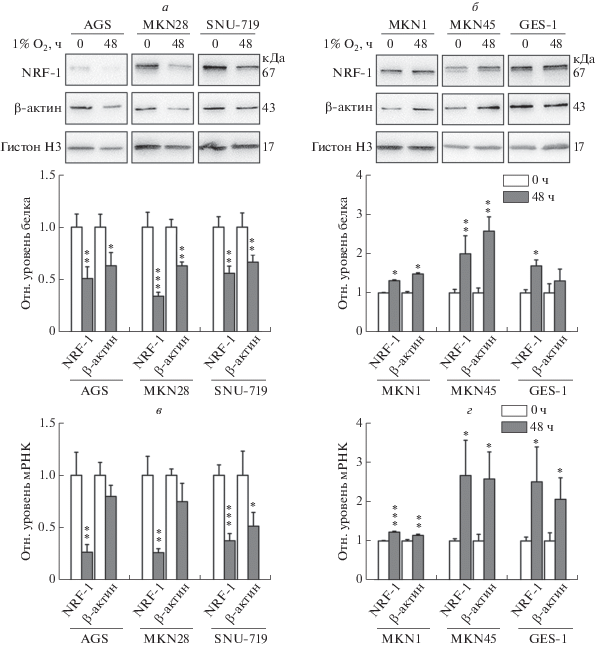
По результатам иммуноблотинга и ПЦР в реальном времени гипоксия индуцировала синхронные изменения в уровнях NRF-1 и β-актина: они снижались в клетках AGS, MKN28 и SNU-719 и повышались в клетках MKN1, MKN45 и GES-1 (рис. 2).
Транскрипционная активность гена ACTB регулируется связыванием NRF-1 с кодирующей областью
С целью идентифицировать взаимосвязь между NRF-1 и β-актином мы сконструировали плазмиды со сверхэкспрессией NRF-1 или siРНК, нацеленной на ген NRF1, и трансфицировали ими клетки GES-1. Как показано на рис. 3а и 3б, трансфекция NRF-1-экспрессирующих плазмид индуцировала значительное повышение уровней как белка, так и мРНК NRF-1 по сравнению с контрольным пустым вектором, в то время как siРНК к NRF1 сильно снижала количество NRF-1 по сравнению с контрольной siРНК. В соответствии с NRF-1 уровни как белка, так и мРНК β-актина были повышены в клетках со свехэкспрессией NRF-1 и подавлены в клетках с РНК-интерференцией NRF1.
Рис. 3.
NRF-1 связывается с геном ACTB и регулирует его экспрессию. а – Клетки GES-1 трансфицировали плазмидой со сверхэкспрессией NRF-1 (NRF-1 OE) или с siРНК к NRF1 (siРНК NRF-1) или контрольной (siРНК Con), помещали в условия гипоксии (1% O2) на 24 ч. Изменения в экспрессии NRF-1 и β-актина анализировали методом иммуноблотинга (а) и ПЦР в реальном времени (б). в ‒ Клетки GES-1 обрабатывали актиномицином D (5 мкг/мл) в течение указанного времени. Уровни мРНК β-актина анализировали ОТ-ПЦР в реальном времени. Полученные данные норамлизовали по уровню 18S рРНК (n = 3). г – Потенциальные сайты связывания NRF-1 в составе генов ACTB человека и Actb мыши и крысы. д, е – ChIP-анализ обогащения генов ACTB человека и Actb мыши по NRF-1. Группы IgG использовали в качестве отрицательного контроля для групп NRF-1. Продукты ChIP анализировали методом ПЦР в реальном времени. Цифрами указаны позиции от сайта начала транскрипции. Ген CYTC использован в качестве положительного контроля в ChIP-анализе. Эффект обогащения в ChIP-анализе рассчитывали в сравнении с IgG (n = 3). Nor ‒ условия нормоксии, Hyp ‒ условия гипоксии. *p < 0.05, **p < 0.01, ***p < 0.001.
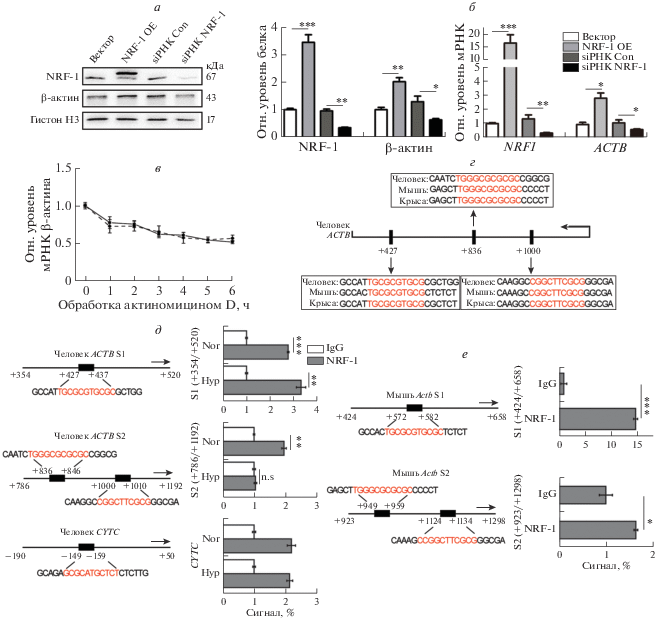
Кроме того, мы обрабатывали клетки актиномицином D в течение указанного периода времени для блокирования транскрипции и проверки стабильности мРНК β-актина с помощью ПЦР [19]. Как видно на рис. 3в, не зарегистрировано значимых различий между этими уровнями в клетках с контрольной siРНК и siРНК NRF1, из чего можно сделать вывод, что интерференция NRF1 не влияет на стабильность мРНК β-актина. Все данные указывали на то, что NRF-1 инициирует транскрипцию ACTB, тем самым активируя экспрессию β‑актина.
Вполне логичным было проверить, активирует ли NRF-1 транскрипцию ACTB. С помощью программного обеспечения JASPAR (http://jaspar.genereg.net/) мы обнаружили, что в кодирующих областях ACTB человека есть три потенциальных сайта связывания NRF-1, которые высококонсервативны в гомологах мыши и крысы (рис. 3г). С целью проверить, взаимодействуют ли напрямую NRF-1 с кодирующей областью ACTB человека, мы провели ChIP-анализ. Показано, что кодирующая область +354/+520 ACTB человека и область промотора ‒190/+50 CYTC человека обогащены NRF-1, особенно при гипоксии, в то время как только при нормоксии кодирующая область +786/+1192 ACTB обогащена NRF-1 (рис. 3д). С целью выснить, происходит ли связывание NRF-1 с такой же областью в гомологах ACTB, то есть консервативно среди видов, мы провели ChIP-анализ с соответствующим регионом Actb мыши. Как показано на рис. 3е, в условиях нормоксии NRF-1 связывался с кодирующими областями +424/+658 и +923/+1298 Actb мыши. Таким образом, транскрипционная активация ACTB фактором NRF-1 не была видоспецифичной.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В этой работе впервые обнаружены различия в уровнях NRF-1 и β-актина в клетках рака желудка и прилегающих тканях. Уровни экспрессии NRF-1 и β-актина были значительно повышены в некоторых тканях рака желудка, что согласуется с данными Shafqat и др., показавшим что содержание β-актина в опухолевой ткани возрастет [20]. Гипоксия микроокружения ‒ важная особенность сóлидных опухолей, а также одно из важных различий между опухолевыми тканями и прилегающими тканями. Мы предположили, что гипоксия микроокружения вызывает изменения в экспрессии NRF-1 и β-актина. Для этого линии клеток рака желудка и линию клеток нормальной ткани желудка выдерживали в условиях 1% O2 и оценивали экспрессию NRF-1 и β-актина. Выявлены аналогичные тенденции изменений уровней NRF-1 и β-актина. Однако количество этих белков снижалось в клетках AGS, MKN28 и SNU-719, что было противоположно их изменениям в опухолевых тканях и в других клетках рака желудка. По-видимому, эти различия не связаны со степенью дифференцировки клеток, так как и ASG, и MKN45 были низкодифференцированными клетками, тогда как MKN28 умеренно дифференцированной, а SNU-719 высокодифференцированной линией. В этой работе мы не исследовали причин этих различий, хотя и раньше замечали разные направления в изменениях уровней NRF-1 в различных клеточных линиях из других опухолевых источников в условиях гипоксии. Между тем сообщалось, что гипоксия индуцирует различные изменения даже в нормальных тканях [21], из чего следует, что опосредованное гипоксией изменение экспрессии NRF-1 имеет сложный характер.
С целью понять, вызвано ли изменение экспрессии β-актина изменением NRF-1, мы модифицировали экспрессию NRF-1 в клетках GES-1. Для дифференциации эндогенного и экзогенного NRF-1 на С-конце NRF-1, встроенного в плазмиду и сверхэкспрессируемого ею, был добавлен тег FLAG. Выявлено, что уровень β-актина изменялся синхронно с NRF-1. Учитывая, что NRF-1 ‒ важный транскрипционный фактор, мы предположили, что NRF-1 регулирует экспрессию β-актина на транскрипционном уровне. Проанализировав область промотора и интронов гена ACTB, мы не обнаружили сайтов связывания NRF-1, тогда как в кодирующей области ACTB идентифицировали 3 потенциальных сайта связывания; причем они оказались высококонсервативными у млекопитающих. В результате проведенного ChIP-анализа также показано, что NRF-1 связывается с кодирующей областью ACTB. Это отличается от нашего привычного понимания регуляции транскрипции, хотя ранее Stergachis и соавт. [22], используя технологию высокопроизводительного секвенирования, обнаружили, что связывание транскрипционных факторов с кодирующей областью гена – достаточно общее явление и может играть роль в регуляции эпигенетических изменений. Нами показано, что изменение экспрессии NRF-1 во время гипоксии приводит к значительному изменению уровня β-актина, подтверждая нестабильность экспрессии β-актина в условиях гипоксии. Эти результаты согласуются с данными Turkoglu и Kockar [23], которые еще в 2012 году указывали на то, что ген β-актина не подходит в качестве гена внутреннего стандарта для ПЦР, что обусловдено нестабильностью его экспрессии в условиях гипоксии. Сообщалось также, что и другие известные гены, экспрессия которых считается стабильной, включая GAPDH и тубулин, не подходят в качестве внутренних референс-генов [24].
В результате проведенного исследования еще раз подтверждено, что NRF-1 играет важную роль для клетки в целом. Sant и соат. [25] сообщали, что нокаутирование по NRF1 было летальным событием для животных. Нами также обнаружено, что клетки с нокаутом по NRF1 были нежизнеспособными (неопубликованные данные). На основании этого мы предполагаем, что аномалии в экспрессии NRF-1 вызывают не только митохондриальную дисфункцию, но и нарушения цитоскелета. Цитоскелет играет очень важную роль в поддержании клеточной структуры, транспорта и метаболизма. Нарушенния в структуре цитоскелета приводят к дисфункции клеток, а затем к их апоптозу или аномальной пролиферации [26]. В опухолевых тканях изменение уровня β-актина служит триггером миграции клеток, что связано с гипоксией в микроокружении [27]. Нами показано, что изменение уровня NRF-1, индуцированное гипоксией в микроокружении, может быть основной причиной миграции клеток опухоли. Из-за множества эффектов NRF-1 в клетке встает много вопросов, на которые предстоит ответить в будущем. Например, могут ли индуцированные гипоксией изменения в уровне NRF-1 вызывать ответы различных клеточных систем, каков механизм этих изменений при адаптации к условиям гипоксии и как это влияет на судьбу клетки. Кроме того, взаимосвязь между изменениями дыхательной функции клеток, β-актином и другими компонентами цитоскелета также заслуживает внимания.
ЗАКЛЮЧЕНИЕ
Нами показано, что NRF-1 активирует транскрипцию гена ACTB, связываясь со следующими участками в кодирующей области: +427…+437, +836…+846 и +1000…+1010. В условиях гипоксии в раковых клетках изменения в уровнях NRF-1 приводят к изменениям в экспрессии β-актина. Из этого следует, что в экспериментах, выполняемых в условиях меняющихся концентраций кислорода, ген ACTB не пригоден для использования в качестве внутреннего контроля.
Авторы благодарят д-ра Dan Wang, д-ра Yapeng Lu, д-ра Zhangji Dong и д-ра Xiaomei Wu за их полезные советы в ходе исследования.
Исследование поддержано Национальным фондом естественных наук Китая (the National Natural Science Foundation of China; Progects 31500965, 31471141, 31671206), Академической программой приоритетного развития высшего учебного заведения Цзянсу (the Priority Academic Program Development of Jiangsu Higher Education Institution, PAPD) и Цзянсунской Программой приглашенных зарубежных ученых для выдающихся университетских преподавателей и руководителей молодого и среднего возраста (Jiangsu Overseas Visiting Scholar Program for University Prominent Young & Middle-aged Teachers and Presidents).
Исследование было одобрено Комитетом по этике исследований на людях Клинической больницы Наньтунского университета (the Human Research Ethics Committee of the Affiliated Hospital of Nantong University; 2017-K036). От пациентов было получено письменное информированное согласие на публикацию этого исследования.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Sturzenbaum S.R., Kille P. (2001) Control genes in quantitative molecular biological techniques: the variability of invariance. Comp. Biochem. Phys. B. 130, 281‒289.
Farrants A.K.O. (2008) Chromatin remodelling and actin organisation. FEBS Lett. 582, 2041‒2050.
Rohn G., Koch A., Krischek B., Stavrinou P., Goldbrunner R., Timmer M. (2018) ACTB and SDHA are suitable endogenous reference genes for gene expression studies in human astrocytomas using quantitative RT-PCR. Technol. Cancer Res. Treat. 17, 1533033818802318.
Yang Y., Ma L., Ge R., Fan W., Zhu L., Zhao T., Wu Y., Fan M. (2008) Effects of hypoxia on mRNA expression of housekeeping genes in rat brain tissue and primary cultured neural cells. Front. Med. China. 2, 239‒243. https://doi.org/10.1007/s11684-008-0045-7
Zhong H., Simons J.W. (1999) Direct comparison of GAPDH, beta-actin, cyclophilin, and 28S rRNA as internal standards for quantifying RNA levels under hypoxia. Biochem. Biophys. Res. Commun. 259, 523‒526.
Bruge F., Venditti E., Tiano L., Littarru G.P., Damiani E. (2011) Reference gene validation for qPCR on normoxia- and hypoxia-cultured human dermal fibroblasts exposed to UVA: is beta-actin a reliable normalizer for photoaging studies? J. Biotechnol. 156, 153‒162.
Glass J.J., Phillips P.A., Gunning P.W., Stehn J.R. (2015) Hypoxia alters the recruitment of tropomyosins into the actin stress fibres of neuroblastoma cells. BMC Cancer. 15, 712.
Haghparast S.M.A., Kihara T., Shimizu Y., Yuba S., Miyake J. (2013) Actin-based biomechanical features of suspended normal and cancer cells. J. Biosci. Bioeng. 116, 380‒385.
Al Absi A., Wurzer H., Guerin C., Hoffmann C., Moreau F., Mao X.Q., Brown-Clay J., Petrolli R., Casellas C.P., Dieterle M., Thiery J.P., Chouaib S., Berchem G., Janji B., Thomas C. (2018) Actin cytoskeleton remodeling drives breast cancer cell escape from natural killer-mediated cytotoxicity. Cancer Res. 78, 5631‒5643.
Tseng R.C., Chang J.W., Mao J.S., Tsai C.D., Wu P.C., Lin C.J., Lu Y.L., Liao S.Y., Cheng H.C., Hsu H.S., Wang Y.C. (2015) Growth-arrest-specific 7C protein inhibits tumor metastasis via the N-WASP/FAK/F-actin and hnRNP U/beta-TrCP/beta-catenin pathways in lung cancer. Oncotarget. 6, 44207‒44221.
Liu Y., Wang Z.Y., Huang D., Wu C., Li H.H., Zhang X., Meng B., Li Z.J., Zhu T.H., Yang S., Sun W. (2017) LMO2 promotes tumor cell invasion and metastasis in basal-type breast cancer by altering actin cytoskeleton remodeling. Oncotarget. 8, 9513‒9524.
Dai Q.S., Shah A.A., Garde R.V., Yonish B.A., Zhang L., Medvitz N.A., Miller S.E., Hansen E.L., Dunn C.N., Price T.M. (2013) A truncated progesterone receptor (PR-M) localizes to the mitochondrion and controls cellular respiration. Mol. Endocrinol. 27, 741‒753.
Hoppeler H., Vogt M., Weibel E.R., Fluck M. (2003) Response of skeletal muscle mitochondria to hypoxia. Exp. Physiol. 88, 109‒119.
Yuan X.M., Chen C.Z., Wang L., He X. (2017) Inhibition of microRNA-182 reduces hypoxia/re-oxygenation-induced HL-1 cardiomyocyte apoptosis by targeting the nuclear respiratory factor-1/mitochondrial transcription factor A (NRF-1/mtTFA) pathway. Int. J. Clin. Exp. Pathol. 10, 5162‒5170.
Evans M.J., Scarpulla R.C. (1989) Interaction of nuclear factors with multiple sites in the somatic cytochrome c promoter. Characterization of upstream NRF-1, ATF, and intron Sp1 recognition sequences. J. Biol. Chem. 264, 14361‒14368.
Virbasius C.A., Virbasius J.V., Scarpulla R.C. (1993) NRF-1, an activator involved in nuclear-mitochondrial interactions, utilizes a new DNA-binding domain conserved in a family of developmental regulators. Genes Dev. 7, 2431‒2445.
Satoh J., Kawana N., Yamamoto Y. (2013) Pathway analysis of ChIP-Seq-based NRF1 target genes suggests a logical hypothesis of their involvement in the pathogenesis of neurodegenerative diseases. Gene Regul. Syst. Bio. 7, 139‒152.
Jayanta K.D., Quentin F., Robert P., Robert M.J., Deodutta R. (2018) Nuclear respiratory factor 1 acting as an oncoprotein drives estrogen-induced breast carcinogenesis. Cells. 7, 234.
Wang D., Zhang J., Lu Y.P., Luo Q.Q., Zhu L. (2016) Nuclear respiratory factor-1 (NRF-1) regulated hypoxia-inducible factor-1 (HIF-1) under hypoxia in HEK293T. IUBMB Life. 68, 748‒755.
Shafqat A.K., Monica T., Ajit K.S., Savio G.B., Bhawna S., Mukta R., Shailesh V.S., Sanjay G. (2014) Cell-type specificity of β-actin expression and its clinicopathological correlation in gastric adenocarcinoma. World J. Gastroenterol. 20, 12202‒12211.
Biswas M., Chan J.Y. (2010) Role of Nrf1 in antioxidant response element-mediated gene expression and beyond. Toxicol. Appl. Pharm. 244, 16‒20.
Stergachis A.B., Haugen E., Shafer A., Fu W.Q., Vernot B., Reynolds A., Raubitschek A., Ziegler S., LeProust E.M., Akey J.M., Stamatoyannopoulos J.A. (2013) Exonic transcription factor binding directs codon choice and affects protein evolution. Science. 342, 1367‒1372.
Turkoglu S.A., Kockar F. (2012) Expression of Gapdh, B-actin and B-2-microglobulin genes under chemically induced hypoxic conditions in Hep3b and Pc3 cells. J. Appl. Biol. Sci. 6(3), 1‒6.
Mori R., Wang Q.C., Danenberg K.D., Pinski J.K., Danenberg P.V. (2008) Both beta-actin and GAPDH are useful reference genes for normalization of quantitative RT-PCR in human FFPE tissue samples of prostate cancer. Prostate. 68, 1555‒1560.
Sant K.E., Hansen J.M., Williams L.M., Tran N.L., Goldstone J.V., Stegeman J.J., Hahn M.E., Timme-Laragy A. (2017) The role of Nrf1 and Nrf2 in the regulation of glutathione and redox dynamics in the develo-ping zebrafish embryo. Redox Biol. 13, 207‒218.
Veselska R., Zitterbart K., Jelinkova S., Neradil J., Svoboda A. (2003) Specific cytoskeleton changes during apoptosis accompanying induced differentiation of HL-60 myeloid leukemia cells. Oncol. Rep. 10, 1049‒1058.
Vogler M., Vogel S., Krull S., Farhat K., Leisering P., Lutz S., Wuertz C.M., Katschinski D.M., Zieseniss A. (2013) Hypoxia modulates fibroblastic architecture, adhesion and migration: a role for HIF-1alpha in cofilin regulation and cytoplasmic actin distribution. PLoS One. 8, e69128.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология