Молекулярная биология, 2021, T. 55, № 4, стр. 617-625
Сайленсинг гена MUC4 ингибирует TGF-β1-индуцированный эпителиально-мезенхимальный переход в эпителиальных клетках NCI-H292 респираторного тракта человека через сигнальный путь ERK1/2
Y.-D. Kim a, b, Y. S. Choi a, H. G. Na a, S.-Y. Song a, C. H. Bae a, *
a Department of Otorhinolaryngology-Head and Neck Surgery, College of Medicine, Yeungnam University
42415 Daegu, Republic of Korea
b Regional Center for Respiratory Diseases, Yeungnam University Medical Center
42415 Daegu, Republic of Korea
* E-mail: baich@med.yu.ac.kr
Поступила в редакцию 01.07.2020
После доработки 17.08.2020
Принята к публикации 19.08.2020
Аннотация
MUC4, превалирующий мембрансвязанный муцин, защищает эпителиальную поверхность и играет важную роль в процессах обновления и дифференцировки эпителиальных клеток, передаче сигналов, адгезии клеток и канцерогенезе. Недавно показано, что экспрессия MUC4 регулирует эпителиально-мезенхимальный переход (ЭMП) раковых клеток яичников, поджелудочной железы и легких. Однако влияние экспрессии MUC4 на ЭМП в эпителиальных клетках дыхательных путей человека еще недостаточно хорошо изучено. Нами исследовано влияние индуцированной трансформирующим фактором роста бета-1 (TGF-β1) экспрессии MUC4 на ЭМП и оценено ее влияние на нижележащий сигнальный каскад в эпителиальных клетках респираторного тракта человека NCI-H292. Выявлено, что TGF-β1 индуцирует экспрессию генов MUC4, CDH2, VIM и SNAI1 и кодируемых ими белков: MUC4, N-кадгерина, виментина и Snail ‒ и снижает уровень CDH1 и его продукта ‒ E-кадгерина. В клетках с нокдауном MUC4 под действием TGF-β1 наблюдали супрессию экспрессии генов MUC4, CDH2, VIM и SNAI1 и соответствующих белков, но не CDH1 и соответственно E-кадгерина. Кроме того, в этих клетках обнаружили супрессию индуцируемого TGF-β1 фосфорилирования регулируемой внеклеточными сигналами киназы ERK1/2, но не Smad2/3, Akt и p38. Таким образом, сайленсинг MUC4 ингибирует TGF-β1-индуцированный ЭМП через сигнальный путь ERK1/2, из чего можно предполагать участие MUC4 в индукции ЭМП в эпителиальных клетках дыхательных путей человека.
Муцины представляют собой высокомолекулярные гликопротеины, которые можно разделить на подсемейства секреторных и связанных с мембраной [1]. MUC4 ‒ это доминирующий мембрансвязанный муцин, находящийся на апикальной поверхности эпителия [2]. MUC4 состоит из внеклеточной α-цепи и β-цепи, содержащей трансмембранный домен и цитоплазматический хвост. MUC4 экспрессируется в эпителиальных клетках кишечника, респираторного тракта и мочеполовых путей, а также в слюнных и слезных железах [3, 4]. MUC4, прежде всего, выполняет роль “смазки” и протектора эпителиальных клеток от инфекций и повреждений. Кроме того, он вовлечен в дифференцировку и обновление эпителиальных клеток, клеточную адгезию, передачу сигналов между клетками и канцерогенез [5, 6].
Процесс превращения эпителиальных клеток в мезенхимальные стволовые клетки известен как эпителиально-мезенхимальный переход (ЭМП) и включает согласованные молекулярные и клеточные изменения, такие как диссоциация плотных контактов и потеря апикально-базолатеральной полярности в эпителиальных клетках [7]. Во время ЭМП уровень эпителиальных маркеров, таких как клаудин, E-кадгерин, окклюдин и десмоплакин, снижается, в то время как мезенхимальных маркеров, таких как фибронектин, виментин, N-кадгерин и Snail, со временем индуцируется. Эти процессы сопровождаются такими изменениями морфологии клеток, которые характерны как при развитии, так и при инвазии раковых клеток, в том числе поджелудочной железы, яичников, молочной железы и легких [5, 7]. Следовательно, можно предположить, что экспрессия MUC4 вовлечена в индукцию ЭМП и в эпителиальных клетках респираторного тракта человека.
Семейство трансформирующего фактора роста бета (TGF-β) состоит из трех изоформ, которые регулируют различные процессы при развитии нормальных эпителиальных клеток: пролиферацию, дифференцировку, миграцию и образование внеклеточного матрикса [8, 9]. Сигналинг TGF-β также участвует в поддержании гомеостаза тканей и обеспечении выполнения клетками своих функций [10, 11]. TGF-β1, член семейства TGF-β, представляет собой многофункциональный фактор роста, который регулирует многие биологические процессы, включая индукцию ЭМП и канцерогенез [9, 11]. Недавно показано, что экспрессия MUC4 регулирует ЭМП в клетках рака яичников, поджелудочной железы, молочной железы, шейки матки и легких, хотя при различных видах рака роль MUC4 в индукции ЭМП различается. Во время ЭМП в раковых клетках проявляются различные характерные особенности, изменяющие межклеточные взаимодействия и взаимодействия клеток с матриксом, способствуя процессам инвазии и метастазирования [12, 13]. Однако влияние экспрессии MUC4 на ЭМП в эпителиальных клетках дыхательных путей человека пока не изучено.
Таким образом, цель исследования состояла в выяснении возможного участия MUC4 в индукцию ЭМП в обработанных TGF-β1 эпителиальных клетках респираторного тракта человека. В работе изучено влияние сайленсинга гена MUC4 на TGF-β1-индуцированный ЭМП и нижележащий сигнальный каскад в клетках NCI-H292.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использован рекомбинантный белок человека TGF-β1 (240-B-002), приобретенный у компании “R&D Systems, Inc.” (США); эпителиальные клетки респираторного тракта человека NCI-H292 из Американской коллекции типовых культур (ATCC; American Type Culture Collection, США), фетальная сыворотка крупного рогатого скота (FBS) и BSA (“Hyclone Laboratories, Inc.”, США); TRIzol и среда Roswell Park Memorial Institute (RPMI) 1640 (“Life Technologies”, США).
Для анализа жизнеспособности клеток колориметрическим методом с водорастворимой солью тетразолия (WST-1) использован набор EZ-Cytox Cell Viability Assay Kit (EZ-1000), приобретенный у “Daeil Lab Service Co. Ltd” (Корея).
При проведении ПЦР, ПЦР в реальном времени и обратной транскрипции использованы наборы компаний “Bio-Rad Laboratories” (США) и “Thermo Fisher Scientific” (США) соответственно.
В иммуноферментном анализе (ИФА) в качестве первичных использованы моноклональные мышиные антитела против MUC4 (ab-60720; “Abcam”, Великобритания); против E-кадгерина (3195), N-кадгерина (13116), виментина (5741) и Snail (3879) фирмы “Cell Signaling Technology” (США); в качестве вторичных ‒ конъюгированные с пероксидазой хрена (HRP) козьи антитела против IgG мыши (sc-2005; “Santa Cruz Biotechnology”, США).
Для иммуноблотинга в качестве первичных использованы моноклональные кроличьи антитела к Smad2/3 (8685), фосфо-Smad2/3 (8828), Akt (9272), фосфо-Akt (9271), регулируемой внеклеточными сигналами киназе 1/2 (ERK1/2) (9102), фосфо-ERK1/2 (9101) и p38 (9212) и фосфо-p38 (9211) фирмы “Cell Signaling Technology”; в качестве вторичных ‒ HRP-конъюгированные ослиные антитела против кроличьего IgG (NB7185; “Novus Biologicals”, США).
Для трансфекции клеток использованы малые интерферирующие РНК (siРНК): к гену MUC4 (s9071) и контрольная, ‒ Lipofectamine 2000 и культуральная среда Opti-MEMTM I с пониженным содержанием сыворотки (“Thermo Fisher Scientific”).
Культивирование клеток, обработка TGF-β1 и оценка жизнеспособности. Эпителиальные клетки респираторного тракта человека линии NCI-H292 культивировали в среде RPMI 1640 с добавлением 10% FBS, 1% (v/v) раствора пенициллина (10 000 ед./мл) и 1% (v/v) раствора стрептомицина (10 мг/мл) при 37°C в увлажненной атмосфере, содержащей 5% CO2. После достижения 80‒90%-ной конфлюентности клетки инкубировали в бессывороточной среде в течение суток. После этого клетки промывали фосфатным буфером и обрабатывали TGF-β1 (5 нг/мл), растворенным в бессывороточной среде. Контрольные клетки инкубировали только с культуральной средой в течение того же времени. Жизнеспособность клеток определяли количественно с использованием набора EZ-Cytox Cell Viability Assay Kit для проведения анализа с WST-1. Все эксперименты проведены в трех повторах.
ПЦР в реальном времени и ПЦР с обратной транскрипцией (ОТ-ПЦР). ПЦР в реальном времени проводили с использованием набора iQ SYBR Green Supermix (“Bio-Rad Laboratories, Inc.”), а для ОТ-ПЦР использовали набор GeneAmp RNA PCR Core (“Thermo Fisher Scientific”) в соответствии с рекомендациями производителей. Подбор последовательностей праймеров, условий амплификации и представление результатов проводили по ранее опубликованным методикам для оценки экспрессии генов MUC4, CDH1, CDH2, VIM и SNAI1, кодирующих белки MUC4, E-кадгерин, N-кадгерин, виментин и Snail [14, 15].
При проведении ПЦР в реальном времени значения экспрессии, полученные для целевого гена, были нормализованы к экспрессии гена глицеральдегид-3-фосфатдегидрогеназы (GAPDH). Кривые плавления использовали для оценки специфичности амплификации. Рассчитывали среднее значение трех повторов для каждого образца и выражали как порог цикла (CT). Уровень экспрессии гена рассчитывали как разницу (∆CT) между значением CT для целевого гена и значением CT для GAPDH. Кратность изменения экспрессии мРНК целевого гена определяли согласно инструкциям производителя (“Bio-Rad Laboratories, Inc.”).
При проведении ОТ-ПЦР полуколичественный анализ продукта реакции выполняли на сканированных изображениях геля, при этом интенсивность полос оценивали с использованием коммерчески доступного программного обеспечения для визуализации (“Scion, Frederick”, США). Относительную интенсивность отдельных полос на изображении геля определяли по соотношению интенсивности целевого гена к интенсивности GAPDH.
Иммуноферментный анализ (ИФА). Лизаты клеток и супернатанты получали из клеток NCI-H292 эпителия респираторного тракта человека. ИФА проводили по ранее опубликованной методике для оценки уровня белка MUC4 [15]. Вкратце так. Образцы разбавляли фосфатно-солевым буфером (PBS) и переносили в 96-луночные планшеты F96 Cert. Maxisorp Nunc-Immunoplate (“Fisher Scientific”, США) и инкубировали при 4°C в течение ночи. Затем образцы блокировали 2%-ным BSA в течение 1 ч и инкубировали с моноклональными мышиными антителами против MUC4 (разведение 1 : 200 в PBS с 0.05% Tween 20) в течение 1 ч. Затем образцы инкубировали с HRP-конъюгированными козьими антителами против мышиного IgG (разведение 1 : 5000 в PBS с 0.05% Твин 20) в течение 1 ч. TMB (3,3',5,5'-тетраметилбензидин) использовали в качестве субстрата HRP, и реакцию останавливали 2 N H2SO4. Оптическую плотность измеряли на планшетном ридере EL800 (“BIO-TEK Instruments”, США) при 450 нм. Результаты выражали как кратное изменение по сравнению со значением для не обработанных TGF-β1 клеток.
Иммуноблотинг. Образовавшие монослой клетки NCI-H292 обрабатывали TGF-β1 (5 нг/мл) отдельно или совместно с siРНК MUC4. Клетки лизировали в буфере для лизиса (30 мM Трис-HCl, pH 8.0, 5 мM EDTA, 150 мM NaCl, 1% Triton X-100, 1 мM PMSF и коктейль ингибиторов протеаз), центрифугировали при 2500 g в течение 10 мин, супернатант собирали и оценивали в нем концентрацию белка. Образцы, содержащие 20 мкг белка, анализировали электрофорезом в 10%-ном ПААГ-SDS, после чего проводили перенос на поливинилидендифторидную (PVDF) мембрану. Мембрану блокировали в буфере 20 мM Трис-HCl, pH 7.6, 135 мM NaCl, содержащем 0.1% Tween 20 и 5% BSA, а затем инкубировали с первичными антителами в течение 4 ч при комнатной температуре с последующей инкубацией со вторичными антителами в течение 1 ч. Сигналы, соответствующие исследуемым белкам, детектировали с использованием усиленного хемилюминесцентного субстрата West Pico (“Thermo Fisher Scientific”) и системы визуализации хемилюминесценции FUSION FX7 (“Vilber Lourmat”, Франция). В качестве положительного контроля использовали β-актин, который добавляли в каждый образец. Результаты рассчитывали в виде кратного изменения по отношению к не обработанному TGF-β1 контролю.
Трансфекция клеток siРНК. Для трансфекции клеток NCI-H292 использовали следующие последовательности siРНК к MUC4: смысловая ‒ 5'‑GUCGUGUGAUUGAAGCCUATT-3' и анти-смысловая ‒ 5'-UAGGCUUCAAUCACACGACCA-3'. Показано, что эффективность трансфекции siРНК MUC4 составляет более 80%. Трансфекцию проводили в соответствии с протоколом производителя (“Thermo Fisher Scientific”). Вкратце так. Клетки высевали в 6-луночный планшет из расчета 1 × × 105 клеток/лунку и инкубировали в течение ночи в среде RPMI 1 640, не содержащей антибиотики. На следующий день, при достижении 80‒90%-ной конфлюэнтности, клетки промывали PBS, вносили среду Opti-MEMTM I с пониженным содержанием сыворотки и комплекс siРНК с Lipofectamine 2000 в той же среде (предварительно siРНК MUC4 инкубировали с Lipofectamine 2000 в среде Opti-MEMTM I с пониженным содержанием сыворотки в течение 20 мин при комнатной температуре) в расчете, что конечная концентрация siРНК составляет 100 нМ. Клетки инкубировали в течение 24 ч при 37°C в CO2-инкубаторе. Через 4 ч среду, содержащую комплекс siРНК MUC4‒липофектамин, заменяли на RPMI 1 640 без потери трансфекционной активности. Через 24 ч трансфекции siРНК MUC4 к клеткам добавляли TGF-β1 (5 нг/мл). Эту же процедуру выполняли с контрольной siРНК.
Статистический анализ. Экспериментальные данные анализировали с помощью SPSS версии 13.0 (SPSS, США). Все экспериментальные данные представлены как среднее ± стандартное отклонение по результатам трех независимых экспериментов. Сравнение данных проводили с помощью непарного t-критерия Стьюдента или одностороннего дисперсионного анализа Краскела‒Уоллиса с последующим расчетом критерия Манна‒Уитни. Для всех тестов значение p < 0.05 считалось статистически значимым.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ жизнеспособности клеток
В результате предварительно проведенного WST-1-анализа влияния TGF-β1 в концентрациях 0, 2 и 5 нг/мл на жизнеспособность эпителиальных клеток респираторного тракта человека NCI-H292 мы выяснили, что обработка клеток TGF-β1 в концентрации 5 нг/мл в течение 24 ч не изменяет их жизнеспособность (данные не представлены).
TGF-β1 индуцирует ЭМП и экспрессию MUC4
При исследовании влияния TGF-β1 на ЭМП и экспрессию MUC4 клетки линии NCI-H292 обрабатывали TGF-β1 (5 нг/мл) в течение 4, 24 и 48 ч. Результаты ОТ-ПЦР, ПЦР в реальном времени и ИФА показали, что TGF-β1 эффективно индуцировал экспрессию мРНК и белка MUC4 (рис. 1a, б). Кроме того, обработка клеток TGF-β1 приводила к повышению уровней мРНК N-кадгерина, виментина и Snail и к снижению мРНК E-кадгерина (рис. 1в). Аналогичным образом по результатам иммуноблоттинга видно, что обработка клеток TGF-β1 приводила к значительному повышению уровней белков MUC4, N-кадгерина, виментина и Snail и к сильному снижению E-кадгерина (рис. 1г).
Рис. 1.
TGF-β1 индуцирует ЭМП и экспрессию MUC4 в эпителиальных клетках респираторного тракта человека NCI-H292. Влияние обработки TGF-β1 на экспрессию мРНК (а) и белка MUC4 (б) в клетках NCI-H292. Влияние обработки TGF-β1 на экспрессию мРНК N-кадгерина, виментина, Snail и E-кадгерина (в) и соответствующих белков (г) в клетках NCI-H292. Приведенные данные представляют собой средние значения ± SD, рассчитанные по результатам трех независимых экспериментов, выполненных в трех повторах. *p < 0.05 по сравнению с не обработанным TGF-β1 контролем.
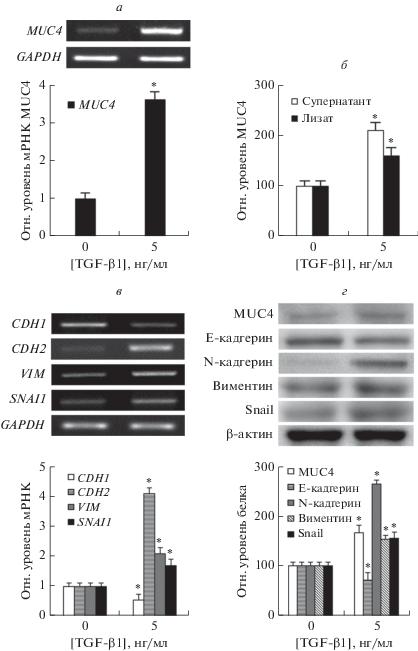
siРНК MUC4 ингибирует TGF-β1-индуцированный ЭМП в клетках NCI-H292
Чтобы исследовать влияние сайленсинга MUC4 на TGF-β1-индуцированный ЭМП, клетки трансфицировали siРНК к MUC4, а затем обрабатывали TGF-β1 (5 нг/мл) в течение 4, 24, 48 и 96 ч. По результатам ОТ-ПЦР и ПЦР в реальном времени выявлено, что трансфекция siРНК MUC4 сопровождалась значительным ингибированием TGF-β1-индуцированной экспрессии мРНК MUC4, N-кадгерина, виментина и Snail и повышением снижаемого под действием TGF-β1 уровня мРНК E-кадгерина (рис. 2а, б).
Рис. 2.
siРНК MUC4 подавляет TGF-β1-индуцированный ЭМП и экспрессию MUC4 в клетках NCI-H292. Влияние трансфекции siРНК MUC4 на индуцируемую обработкой TGF-β1 экспрессию мРНК MUC4 (а), N-кадгерина, виментина и Snail, а также супрессируемую TGF-β1 экспрессию E-кадгерина (б). Анализ лизатов клеток NCI-H292, обработанных TGF-β1 и трансфицированных siРНК MUC4, методом иммуноблоттинга (в). Морфологический анализ клеток NCI-H29 (г), достигших конфлюентности (булыжникообразная форма) через 96 ч, и тех же клеток, культивированных в присутствии TGF-β1 (удлиненная форма, характерная для ЭМП-фенотипа) и трансфицированных siРНК MUC4 (восстановление булыжникообразной формы). Масштаб ‒ 100 мкм. Данные представлены как среднее ± SD на основании трех независимых экспериментов, выполненных в трех повторах. *p < 0.05 по сравнению с контрольной siРНК. †p < 0.05 по сравнению с TGF-β1 (5 нг/мл) + контрольная siРНК (siРНК-Con).
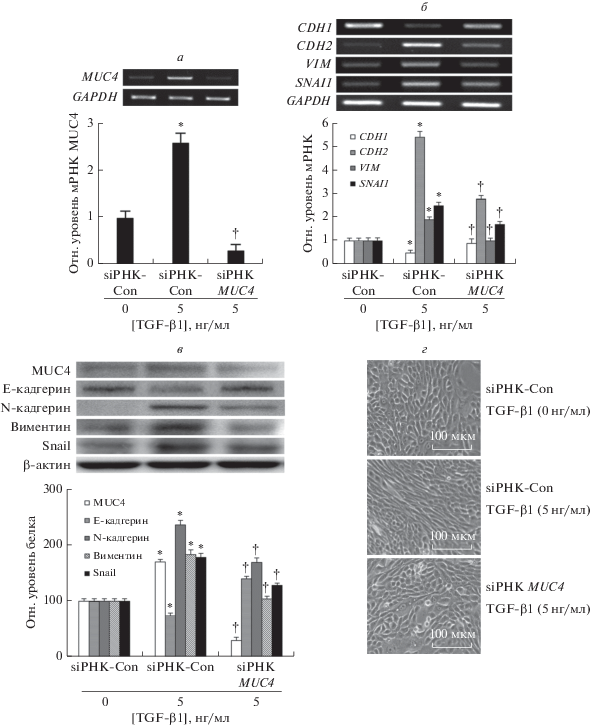
Методом иммуноблоттинга показано, что экспрессия белков MUC4, N-кадгерина, виментина и Snail, индуцируемая TGF-β1, значимо снижалась, а E-кадгерина повышалась в клетках NCI-H292, трансфицированных siРНК MUC4 (рис. 2в).
По результатам микроскопии клетки NCI-H292, достигшие конфлюентности, имели булыжникообразную морфологию. После обработки TGF-β1 клетки принимали удлиненную форму ‒ что считается характерным морфологическим фенотипом ЭМП. В клетках с нокдауном MUC4 морфология клеток восстанавливалась от изменений, индуцированных TGF-β1 (рис. 2г).
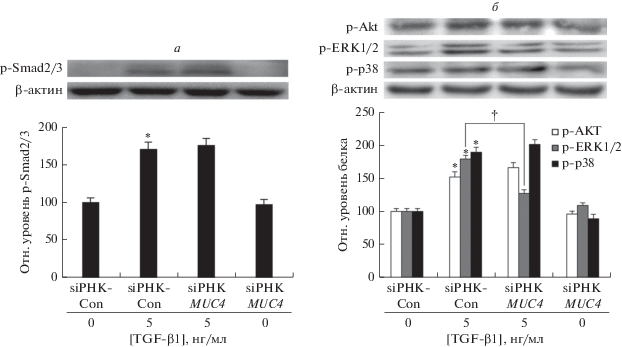
siРНК MUC4 супрессирует индуцированное TGF-β1 фосфорилирование ERK1/2
С целью исследовать участие Smad2/3, Akt, ERK1/2 и p38 в механизме опосредованной MUC4 супрессии TGF-β1-индуцированного ЭМП клетки NCI-H292 трансфицировали siРНК MUC4 и инкубировали с TGF-β1 (5 нг/мл) в течение 2 ч, после чего исследовали фосфорилирование этих киназ. В результате проведенного иммуноблоттинга в лизатах клеток выявлено значительное повышение уровня фосфорилирования Smad2/3, Akt, ERK1/2 и p38 под действием TGF-β1. В клетках с нокдауном MUC4, обработанных TGF-β1, повышенные уровни фосфорилирования Smad2/3, Akt и p38 сохранялись, в то время как степень фосфорилирования ERK1/2 была снижена (рис. 3a, б).
Рис. 3.
siРНК MUC4 супрессирует индуцированное TGF-β1 фосфорилирование ERK1/2, но не Smad2/3, Akt и p38 в клетках NCI-H292. Анализ лизатов клеток методом иммуноблотинга с использованием антител к фосфорилированным (р) белкам: p-Smad2/3 (a), p-Akt, p-ERK1/2 и p-p38 (б). Данные представлены как среднее ± SD на основании трех независимых экспериментов, выполненных в трех повторах. *p < 0.05 по сравнению с контрольной siРНК (siРНК-Con); †p < 0.05 по сравнению с TGF-β1 (5 нг/мл) + siРНК-Con.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ген, кодирующий MUC4, расположен в хромосомном локусе 3q29 и экспрессируется в норме во многих эпителиальных клетках, таких как клетки конъюнктивы, слюнной и молочной желез, трахеи, бронхов, легких, тонкой и толстой кишки, матки и влагалища. Кроме того, MUC4 экспрессируется при некоторых воспалительных заболеваниях: болезни Крона, хроническом панкреатите и астме, ‒ а также вовлечен в развитие различных видов рака: поджелудочной железы, яичников, молочной железы и легкого [5, 16]. MUC4 выполняет различные биологические функции: участвует в обновлении и дифференцировке эпителиальных клеток, передаче клеточных сигналов, клеточной адгезии и канцерогенезе, а также выполняет роль смазки и протектора клеток эпителия [4, 5].
Сообщения о роли MUC4 в ЭМП и канцерогенезе противоречивы: в одних MUC4 участвует в подавлении, в других в индукции ЭМП в раковых клетках человека [7, 12, 17‒19]. Так, сообщалось, что MUC4 индуцирует ЭМП и канцерогенез: через сигнальный путь киназы фокальных контактов усиливает экспрессию N-кадгерина, который индуцирует ЭМП и регулирует инвазивность, рост и метастатический потенциал клеток рака яичников [7]. Сверхэкспрессия MUC4 при раке поджелудочной железы индуцирует ЭМП, что приводит к усилению инвазии и метастазирования за счет стабилизации рецептора 1 фактора роста фибробластов, вызванной активацией N-кадгерина [17]. Более того, экспрессия MUC4 вызывает значительные изменения в экспрессии мезенхимальных и эпителиальных маркеров клеток рака легкого: фенотип ЭМП и дифференциальная экспрессия N-кадгерина коррелируют со сверхэкспрессией и нокдауном MUC4 в клетках рака легкого A549 [12] и экспрессия MUC4 влияет на адгезию клеток, межклеточные контакты, гликозилирование и передачу сигналов, что связано с более низкой общей выживаемостью при плоскоклеточной аденокарциноме легкого [20].
Таким образом, в проведенном нами исследовании проанализирована ассоциация экспрессии MUC4 с ЭМП в эпителиальных клетках респираторного тракта человека. Показано, что TGF-β1 индуцирует экспрессию MUC4, N-кадгерина, виментина и Snail, но снижает экспрессию E-кадгерина в клетках NCI-H292. Кроме того, при нокдауне MUC4 с помощью siРНК MUC4 TGF-β1-индуцированная экспрессия MUC4, N-кадгерина, виментина и Snail была супрессирована, но индуцирована подавляемая TGF-β1 экспрессия E-кадгерина. В клетках NCI-H292, обработанных TGF-β1, с нокдауном MUC4 морфология восстанавливалась до нормальной в результате изменения TGF-β1-индуцированного морфологического ЭМП-фенотипа. На основании полученных результатов можно предполагать вовлечение MUC4 в TGF-β1-индуцированный ЭМП в эпителиальных клетках респираторного тракта человека.
Экспрессия MUC4 регулируется многими патофизиологическими медиаторами, такими как регулятор трансмембранной проводимости при муковисцидозе, инсулиноподобные факторы роста, интерлейкин-4, интерлейкин-9, эластаза нейтрофилов, интерферон гамма, ретиноевая кислота, а также TGF-β1 [6, 21]. Среди этих факторов TGF-β1 индуцирует экспрессию MUC4 путем активации нескольких сигнальных путей: фосфоинозитид-3-киназы (PI3K), сигнальных каскадов протеинкиназы A, митогенактивируемой протеинкиназы (MAPK) и Smad. В раковых клетках сверхэкспрессия MUC4 снижает апоптоз и индуцирует ЭМП, вызывает их пролиферацию, инвазию и метастазирование через различные нижестоящие сигнальные пути: Raf, Ras, MAPK, фосфолипазы C, Akt, Smad, сигнального трансдуктора и активатора транскрипции (STAT), Rho и PI3K [5, 21].
Наше исследование было сосредоточено на выяснении роли сигнальных путей Smad2/3, Akt, ERK1/2 и p38 при TGF-β1-индуцированном ЭМП и экспрессии MUC4 в клетках NCI-H292. Показано, что в клетках NCI-H292 нокдаун MUC4 с помощью siРНК MUC4 не супрессирует индуцированное TGF-β1 фосфорилирование Smad2/3, Akt и p38, но подавляет индуцированное TGF-β1 фосфорилирование ERK1/2. Таким образом, экспрессия MUC4 может играть определенную роль в TGF-β1-индуцированном ЭМП за счет модуляции сигнального пути ERK1/2.
Однако при интерпретации результатов необходимо учитывать некоторые ограничения. Во-первых, нами исследовано всего несколько маркеров ЭМП, причем на единственной линии эпителиальных клеток человека. Во-вторых, проанализирована лишь небольшая часть сигнальных путей, регулируемых MUC4 при TGF-β1-индуцированном ЭМП, причем с использованием только одной технологии ‒ РНК-интерференции. Следовательно, полученной информации недостаточно для полного понимания влияния сайленсинга MUC4 на TGF-β1-индуцированный ЭМП. Эти ограничения будут сняты в последующих экспериментах, в которых будут исследованы различные маркеры ЭМП и соответствующие сигнальные пути и расширены технологии введения нокдауна или нокаута, а также репертуар линий эпителиальных клеток человека и модельных животных.
Итак, нами показано, что в эпителиальных клетках респираторного тракта человека сайленсинг MUC4 супрессирует TGF-β1-индуцированный ЭМП через сигнальный путь ERK1/2. В последующих исследованиях планируется проанализировать влияние экспрессии MUC4 и вовлеченных в нее сигнальных путей на ЭМП. Результаты этого исследования предоставляют важные данные относительно возможной роли MUC4 в индукции ЭМП в эпителиальных клетках респираторного тракта человека.
Исследование поддержано исследовательским грантом 2017 Yeungnam University.
Все протоколы экспериментов были одобрены Наблюдательным советом больницы Йоннамского университета (the Yeungnam University Hospital-Institutional Review Board, No 2018-08-011).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ma J., Rubin B.K., Voynow J.A. (2018) Mucins, mucus, and goblet cells. Chest. 154, 169‒176.
Rowson-Hodel A.R., Wald J.H., Hatakeyama J., O’Neal W.K., Stonebraker J.R., VanderVorst K., Saldana M.J., Borowsky A.D., Sweeney C., Carraway K.L., 3rd. (2018) Membrane mucin Muc4 promotes blood cell association with tumor cells and mediates efficient metastasis in a mouse model of breast cancer. Oncogene. 37, 197‒207.
Govindarajan B., Gipson I.K. (2010) Membrane-tethered mucins have multiple functions on the ocular surface. Exp. Eye Res. 90, 655‒663.
van Putten J.P.M., Strijbis K. (2017) Transmembrane mucins: Signaling receptors at the intersection of inflammation and cancer. J. Innate Immun. 9, 281‒299.
Xia P., Choi A.H., Deng Z., Yang Y., Zhao J., Wang Y., Hardwidge P.R., Zhu G. (2017) Cell membrane-anchored MUC4 promotes tumorigenicity in epithelial carcinomas. Oncotarget. 8, 14147‒14157.
Kim Y.D., Bae C.H., Song S.Y., Choi Y.S. (2015) Effect of β-glucan on MUC4 and MUC5B expression in human airway epithelial cells. Int. Forum Allergy Rhinol. 5, 708‒715.
Ponnusamy M.P., Lakshmanan I., Jain M., Das S., Chakraborty S., Dey P., Batra S.K. (2010) MUC4 mucin-induced epithelial to mesenchymal transition: a novel mechanism for metastasis of human ovarian cancer cells. Oncogene. 29, 5741‒5754.
Komai T., Okamura T., Yamamoto K., Fujio K. (2016) The effects of TGF-βs on immune responses. Nihon Rinsho Meneki Gakkai Kaishi (Jpn.). 39, 51‒58.
Hao Y., Baker D., Ten Dijke P. (2019) TGF-β-mediated epithelial-mesenchymal transition and cancer metastasis. Int. J. Mol. Sci. 20, 2767.
Nakao A., Afrakhte M., Morén A., Nakayama T., Christian J.L., Heuchel R., Itoh S., Kawabata M., Heldin N.E., Heldin C.H., ten Dijke P. (1997) Identification of Smad7, a TGFβ-inducible antagonist of TGF-β signalling. Nature. 389, 631‒635.
Kolosova I., Nethery D., Kern J.A. (2011) Role of Smad2/3 and p38 MAP kinase in TGF-β1-induced epithelial-mesenchymal transition of pulmonary epithelial cells. J. Cell Physiol. 226, 1248‒1254.
Ponnusamy M.P., Seshacharyulu P., Lakshmanan I., Vaz A.P., Chugh S., Batra S.K. (2013) Emerging role of mucins in epithelial to mesenchymal transition. Curr. Cancer Drug Targets. 13, 945‒956.
Xu D., Liu S., Zhang L., Song L. (2017) MiR-211 inhibits invasion and epithelial-to-mesenchymal transition (EMT) of cervical cancer cells via targeting MUC4. Biochem. Biophys. Res. Commun. 485, 556‒562.
Matull W.R., Andreola F., Loh A., Adiguzel Z., Deheragoda M., Qureshi U., Batra S. K., Swallow D.M., Pereira S.P. (2008) MUC4 and MUC5AC are highly specific tumour-associated mucins in biliary tract cancer. Br. J. Cancer. 98, 1675‒1681.
Hu J., Zhou Z., Shi S., Zhu X., Wang X., Zhang W., Hu S., Qian H., Xu W. (2013) Mesenchymal stem-like cells isolated from human esophageal carcinoma and adjacent non-cancerous tissues. Oncol. Lett. 5, 179‒184.
Chaturvedi P., Singh A.P., Batra S.K. (2008) Structure, evolution, and biology of the MUC4 mucin. FASEB. J. 22, 966‒981.
Rachagani S., Macha M.A., Ponnusamy M.P., Haridas D., Kaur S., Jain M., Batra S.K. (2012) MUC4 potentiates invasion and metastasis of pancreatic cancer cells through stabilization of fibroblast growth factor receptor 1. Carcinogenesis. 33, 1953‒1964.
Majhi P.D., Lakshmanan I., Ponnusamy M.P., Jain M., Das S., Kaur S., Shimizu S.T., West W.W., Johansson S.L., Smith L.M., Yu F., Rolle C.E., Sharma P., Carey G.B., Batra S.K., Ganti A.K. (2013) Pathobiological implications of MUC4 in non-small-cell lung cancer. J. Thorac. Oncol. 8, 398‒407.
Gao L., Liu J., Zhang B., Zhang H., Wang D., Zhang T., Liu Y., Wang C. (2014) Functional MUC4 suppress epithelial-mesenchymal transition in lung adenocarcinoma metastasis. Tumor Biol. 35, 1335‒1341.
Jonckheere N., Van Seuningen I. (2018) Integrative analysis of the cancer genome atlas and cancer cell lines encyclopedia large-scale genomic databases: MUC4/ MUC16/MUC20 signature is associated with poor survival in human carcinomas. J. Transl. Med. 16, 259.
Reynolds I.S., Fichtner M., McNamara D.A., Kay E.W., Prehn J.H.M., Burke J.P. (2019) Mucin glycoproteins block apoptosis; promote invasion, proliferation, and migration; and cause chemoresistance through diverse pathways in epithelial cancers. Cancer Metastasis Rev. 38, 237‒257.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


