Молекулярная биология, 2021, T. 55, № 5, стр. 707-733
Транскрипционные факторы прямого пронейронального репрограммирования в онтогенезе и ex vivo
Е. М. Самойлова a, *, В. В. Белопасов b, В. П. Баклаушев a
a Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства Российской Федерации
115682 Москва, Россия
b Кафедра неврологии, Астраханская государственная медицинская академия
414000 Астрахань, Россия
* E-mail: samoyket@gmail.com
Поступила в редакцию 11.10.2020
После доработки 14.12.2020
Принята к публикации 15.12.2020
Аннотация
Технология прямого репрограммирования позволяет получать различные специфические типы клеток, включая специализированные нейроны, из легко доступных аутологичных соматических клеток. Это открывает уникальные возможности для развития персонализированной медицины ‒ от разработки in vitro моделей наследственных и дегенеративных неврологических заболеваний до создания нейрорегенеративных технологий. За последние 10 лет опубликовано множество различных протоколов первичного репрограммирования, однако воспроизводимое получение гомогенных популяций репрограммированных в нейрональном направлении клеток по сей день остается трудновыполнимой задачей. Объединяет все существующие протоколы то, что в них используются транскрипционные факторы, так или иначе участвующие в эмбриональном нейрогенезе. Можно предположить, что именно там кроется ключ к получению высокоэффективных и воспроизводимых технологий для осуществления нейрогенеза ex vivo. Анализ функциональных особенностей транскрипционных факторов в эмбриональном и взрослом нейрогенезе позволит не только усовершенствовать протоколы репрограммирования, но и путем детекции клеточных маркеров точно определить ‒ на какую стадию нейрогенеза выводит тот или иной протокол. Цель данного обзора ‒ охарактеризовать общие факторы, играющие ключевую роль в нейрогенезе в эмбриональном и взрослом периодах, а также в клеточном репрограммировании, и оценить соответствие получаемых в результате репрограммирования клеток формам онтогенетического ряда нервной системы – от плюрипотентных стволовых клеток до специализированных нейронов.
ВВЕДЕНИЕ
До недавнего времени проведение исследований в области регенеративной терапии некурабельных заболеваний центральной нервной системы (ЦНС) было затруднительным из-за отсутствия возможности получения необходимых типов клеток нервной ткани, включая все переходные формы: от мультипотентных стволовых клеток до высокоспециализированных нейронов. Создание технологии индуцированных плюрипотентных стволовых клеток (iPSCs; induced pluri-potent stem cells), а затем и технологии прямого репрограммирования (получение нейральных прогениторных клеток напрямую ‒ без стадии индуцированной плюрипотентности) стало началом новой эры в области нейрорегенерации [1‒5]. Известно, что при большинстве нейродегенеративных заболеваний преимущественно повреждаются определенные подтипы нейронов. Так, при болезни Паркинсона дегенерируют дофаминергические нейроны среднего мозга, при болезни Хантингтона повреждаются ГАМКергические нейроны стриатума (γ-аминомасляная кислота (ГАМК) ‒ нейротрансмиттер), при спинальной мышечной атрофии и боковом амиотрофическом склерозе дегенерируют двигательные нейроны [6]. Клеточное репрограммирование открывает перспективы для воссоздания утраченных специализированных нейронов, а также для создания специфичных для пациента клеточных моделей, включая генетические и спорадические заболевания, для исследования интимных механизмов патогенеза и разработки новых методов терапии некурабельных на данном этапе психоневрологических и нейродегенеративных заболеваний [7, 8].
Некоторые исследователи отмечают, что развитие клеток контролируется не только биохимическим, но и пространственно-временным контекстом окружения [9‒11]. С этой точки зрения технология получения iPSCs и прямое репрограммирование принципиально отличаются друг от друга, поскольку при получении iPSCs происходит “обнуление” эпигенетического возраста трансформированной клетки [10]. Прямое репрограммирование соматических клеток взрослого пациента позволяет миновать неустойчивую и потенциально небезопасную стадию iPSCs и при этом сохранить основной эпигенетический “портрет” исходной клетки [11]. Сохранение возрастных особенностей обусловливает предпочтительное применение прямо репрограммированных нейральных прогениторных клеток (directly reprogrammed neural precursor cells; drNPCs) [2], например при исследованиях возрастных нейродегенеративных заболеваний, таких как болезни Альцгеймера и Гентингтона [11].
Открытием многих транскрипционных факторов и целого ряда малых молекул, применяющихся сейчас для прямого репрограммирования, мы обязаны исследованиям в области биологии развития нервной системы. Более того, в настоящее время становится очевидным, что и нейрорегенеративные технологии восстановления пирамидной системы при таких заболеваниях, как тяжелая спинальная травма или инсульт, с помощью iPSCs или drNPCs не могут быть разработаны без глубокого понимания и моделирования процессов эмбрионального нейрогенеза. Простая имплантация даже сингенных эмбриональных нейральных стволовых клеток (НСК) не приводит к полноценной регенерацией взрослой ЦНС вследствие несовпадения эпигенетических сигналов, отсутствия градиентов морфогенных факторов и других важных компонентов клеточного микроокружения, без которых нейрорегенерация невозможна [9‒11].
Цель обзора – охарактеризовать общие факторы, играющие ключевую роль в нейрогенезе в эмбриональном и взрослом периодах, а также в клеточном репрограммировании и оценить соответствие получаемых в результате репрограммирования клеток формам онтогенетического ряда нервной системы – от плюрипотентных стволовых клеток до специализированных нейронов.
НЕЙРОГЕНЕЗ В ЭМБРИОНАЛЬНОМ ПЕРИОДЕ
В эмбриогенезе развитие нервной системы или нейральная индукция начинаются на стадии гаструлы, когда нервная пластина складывается, образуя нервную трубку, из которой затем развиваются головной и спинной мозг. Источником различных типов клеток спинного мозга у позвоночных служат нейромезодермальные предшественники (neuromesodermal progenitors), расположенные в каудолатеральной области эпибласта (caudal lateral epiblast) [12‒14]. Процесс нейральной индукции определятся градиентами нескольких морфогенных факторов вдоль рострально-каудальной (rostral-caudal; RC) и дорсально-вентральной (dorsal-ventral; DV) осей, что обеспечивает радиальную и продольную/тангенциальную миграцию клеток-предшественников. К основным морфогенам, отвечающим за паттерн формирования RC-оси, относят факторы сигнального пути Wnt, ретиноевую кислоту (retinoic acid; RA) и семейство факторов роста фибробластов (Fibroblast Growth Factors; FGF), тогда как в формировании паттерна DV-оси участвуют факторы сигнальных путей Wnt и SHH11, а также семейство костных морфогенетических белков (bone morphogenetic proteins; BMP) (рис. 1а).
Рис. 1.
Факторы нейрогенеза в эмбриональном и взрослом мозге человека. а ‒ Основные морфогенные градиенты эмбрионального мозга на раннем этапе развития и зоны функционирования пронейрональных транскрипционных факторов в эмбриональном мозге на стадии мозговых пузырей (справа). б ‒ Области экспрессии и мишени пронейрональных транскрипционных факторов во взрослом мозге. Продольный срез: зубчатая извилина, сетчатка и мозжечок; поперечный срез: гиппокамп, субгранулярная (SGZ) и субвентрикулярная/субэпендимальная (SVZ) зоны. На схеме слоя коры показано, что гены нейрогенина-1 и -2 (NGN1 и NGN2) экспрессируются в пирамидных нейронах всех слоев коры взрослого головного мозга и звездчатых клетках IV слоя коры головного мозга, а ген белка BRN2 (POU3F2) экспрессируется в пирамидных нейронах II, III и V слоев коры взрослого головного мозга, а также в шванновских клетках. Обозначения: Ctx (cortex) ‒ кора головного мозга; LGE (lateral ganglionic eminence) ‒ латеральное ганглиозное возвышение; MGE (medial ganglionic eminence) ‒ медиальное ганглиозное возвышение; RP (roof plate) ‒ дорзальная часть хорды; FP (floor plate) ‒ вентральная пластина; V0‒V3 (ventral interneurons) ‒ вентральные интернейроны; pMN (motoneuron progenitors) – прогениторы моторный нейронов.
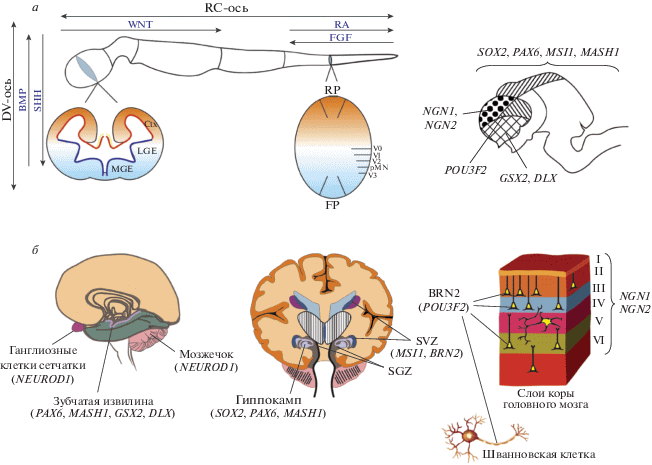
К основным каудализирующим морфогенам относятся белки семейств WNT, FGF, а также RA. WNT1 и FGF-8 продуцируются клетками на границе среднего и заднего мозга и необходимы для формирования идентичности среднего и заднего мозга посредством регуляции генов OTX1 (кодируемый белок, homeobox protein OTX1, определяет границы переднего и среднего мозга) и GBX2 (кодируемый белок, gastrulation brain homeobox 2, определяет границы заднего мозга) [15]. Принудительная активация пути Wnt малой молекулой CHIR99021 способствует формированию региональных нейрональных предшественников; при этом чем выше доза CHIR99021 (и активность соответственно WNT), тем большую каудальную идентичность приобретают клетки [16]. С помощью такого дозозависимого эффекта удалось получить нейрональные предшественники, идентичные клеткам переднего, среднего, заднего мозга, а также переднего спинного мозга [16]. Точность дозозависимого влияния CHIR99021 на морфогенные свойства белков WNT настолько высока, что с помощью подбора концентрации этой молекулы можно получить предшественники, специфичные для очень близких областей, например вентрального среднего мозга и субталамического ядра [17]. RA функционирует в обратном, ростральном, направлении и ослабляет влияние сигнальных путей Wnt и FGF [18, 19]. На молекулярном уровне RA ингибирует экспрессию гена FGF8, тем самым препятствуя дальнейшему удлинению каудального отдела спинного мозга [20, 21].
Транскрипционные факторы семейства SHH продуцируются хордой и мезодермальной тканью под вентральным полюсом нервной трубки и за счет активации одноименного сигнального пути формируют основной вентральный паттерн, а транскипционные факторы семейства BMP, в частности BMP2, BMP4, BMP5, BMP7 и другие, секретируемые в дорсальной части хорды (roof plate), и WNT, напротив, определяют дорсальный паттерн [13, 22, 23]. Эти морфогены формируют антипараллельные градиенты сигналов, контролирующих работу транскрипционных факторов, экспрессия которых, в свою очередь, делит спинной мозг на 14 отдельных доменов в DV-направлении с различными типами клеток [24, 25]. Так, градиент SHH за счет активации транскрипционных факторов семейств PAX (paired box), NKX (NK2 homeobox 1), DBX (developing brain homeobox protein) и IRX (iroquois homeobox protein) в вентральном отделе спинного мозга определяет формирование предшественников моторных нейронов и интернейронов (V0–V3), а также клеток вентральной пластины (floor plateс сells). Напротив, клетки нервного гребня и предшественники интернейронов dI1–dI6 генерируются в дорсальной части нервной трубки под влиянием градиента BMP [26]. Эмбриональный конечный мозг включает в себя два основных региона: дорсальный (паллий) и вентральный (субпаллий). Передняя и боковая части дорсального конечного мозга образуют неокортекс и палеокортекс, задняя и медиальная области позже развиваются в гиппокамп (архикортекс), кортикальную кромку (один из основных источников клеток Кахаля–Ретциуса) и хороидное сплетение [27]. В вентральной части конечного мозга формируются латеральное, медиальное и хвостовое ганглиозные возвышения, которые участвуют в формировании базальных ганглиев, ГАМКергических интернейронов коры и рострального миграционного тракта [28‒31]. Формирование этих доменов в эмбриональном мозге контролируется морфогенами WNT, BMP, SHH, FGF и PAX6. Экспрессия белков PAX6, WNT и BMP прежде всего определяет формирование дорсального конечного мозга [29, 32], а повышение уровня SHH – его вентральных отделов [33]. PAX6 относится к факторам транскрипции, экспрессия которых формирует границу между дорсальным и вентральным отделами мозга совместно с экспрессией гена GSX2, продукт которого, GSH2, локализуется в вентральной части конечного мозга [34]. Дорсальная граница экспрессии GSX2 примыкает к вентральной границе паллиального домена PAX6 с узким перекрытием, а перекрестные репрессивные взаимодействия между GSX2 и PAX6 устанавливают паллиально-субпаллиальную границу [35‒37].
СПЕЦИФИКАЦИЯ ТЕРМИНАЛЬНЫХ НЕЙРОННЫХ ПОДТИПОВ
Помимо морфогенов, определяющих RC- и DV-ориентацию, существует немало транскрипционных факторов, обеспечивающих специализацию формирующихся нейронов. Наиболее исследован этот процесс в регионе конечного мозга, так как именно из его дорсальной части формируется кора. Первичные кортикальные нейроны зарождаются из активно делящейся радиальной глии в более глубоком слое (слой VI) и лишь потом – в верхнем (слой I), а затем последовательно генерируются нейроны, находящиеся в слоях V, IV, III и II. Cначала активируются факторы FOXP2 (forkhead box protein P2) и CTIP2, ответственные за формирование нейронов в слоях V‒VI, после чего появляются клетки, экспрессирующие POU3F3 (POU class 3 homeobox 3), CUX1/2 (Cut-like homeobox 1/2) и LHX2 (LIM homeobox 2) в слое IV, далее клетки, экспрессирующие LMO3 (LIM domain only protein 3) и TLE3 (transducin-like enhancer protein 3) в слое III, и, наконец, клетки, экспрессирующие PLXND1 (Ple-xin D1) в слое II [38]. Показано, что PAX6, NGN1 (Neurogenin 1) и NGN2 определяют образование глутаматергических нейронов и ингибируют астроглиальную дифференцировку [39‒42]. PAX6 может активировать нейрогенез как через NGN-зависимый механизм и далее через активацию факторов нейрогенной дифференцировки NeuroD (neuronal differentiation), а также TBR1 и TBR2 (T‑box brain protein 1/2) [39], так и через NGN-независимый механизм [32]. Активность NGN1 и NGN2 индуцируется WNT [42, 43]. Ганглиозные возвышения дают начало соматостатиновым ГАМКергическим и холинергическим интернейронам и нейропептид Y-иммунопозитивным (NPY) интернейронам [31, 44]. Один из основных индукторов ГАМКергическх нейронов ‒ транскрипционный фактор ASCL1 (Achaete-scute homolog 1; ген MASH1) [40, 45‒47]. ГАМКергические нейроны характеризуются экспрессией фактора LHX6 [48, 49], а холинергические ‒ LHX8 или ISL1 [48, 50]. За специализацию нейронов в вентральном отделе конечного мозга также отвечают гены, кодирующие семейство транскрипционных факторов DLX (Distal-less homeobox) [51, 52], и сигнального пути SHH: GLI1, GLI2 и GLI3 [53, 54]. В формировании дофаминергических нейронов черной субстанции среднего мозга принимают участие факторы FGF2, FGF8 и WNT. Под их действием образуются тирозингидроксилаза-позитивные нейроны, экспрессирующие гены PITX3 (pituitary homeobox 3) и NR4A2 (кодирует белок NURR1; nuclear receptor related 1 protein) [55].
Таким образом, в результате пространственно-временной организации перечисленных факторов транскрипции ‒ мастер-регуляторов ‒ и запускаемых ими вторичных морфогенетических и специализирующих факторов в процессе нейрональной индукции образуется все многообразие нейронов и глиальных клеток в конечных структурах головного и спинного мозга. В этом обзоре мы не будем подробно останавливаться на факторах специализации терминальных нейрональных подтипов в контексте прямого репрограммирования, так как протоколы терминальной дифференцировки универсальны и не зависят от способа репрограммирования.
ОСОБЕННОСТИ НЕЙРОГЕНЕЗА ВО ВЗРОСЛОМ МОЗГЕ
Нейрогенез во взрослом мозге ‒ это возникновение функционально активных нейронов de novo из клеток-предшественников (радиальная глия, НСК), происходящее на протяжении всей жизни в субвентрикулярной (SVZ) и субгранулярной (SGZ) зонах головного мозга [56, 57]. Нейрогенез, впервые обнаруженный у певчих птиц в 70-х годах прошлого века, затем был обнаружен в SVZ и SGZ мозга мелких млекопитающих, а чуть позже в тех же зонах мозга приматов и человека (см. обзоры [58, 59]). В последнее время появляются данные о нейрогенезе и в других областях мозга млекопитающих, таких как гипоталамус, нигростриарная система, миндалевидное тело и различные отделы коры, хотя пока рано утверждать, что там происходит именно нейрогенез, а не миграция клеток из SVZ и SGZ [57]. Основные функции нейрогенеза во взрослом мозге ‒ регенерация ольфакторных клеток и образование новых нейронов и глиоцитов в структурах, осуществляющих функционирование памяти и других когнитивных процессов, поддержание нейрональной пластичности в целом [57‒59]. В условиях патологии все процессы в нишах стволовых клеток мозга претерпевают существенные изменения. Так, активация нейрогенеза во взрослом мозге происходит в ответ на массовую гибель нейронов при инсультах, черепно-мозговых травмах, нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и др. [57‒59].
Нейральные стволовые/прогениторные клетки субэпендимальной и субгранулярной зон происходят из эмбриональных НСК, образующихся в процессе раннего нейрогенеза и затем находящихся в состоянии покоя вплоть до постнатального периода [60]. Постанатально эти клетки проходят несколько делений, прежде чем в SGZ дать начало клеткам радиальной глии (РГ) I типа или их аналогам ‒ клеткам B1 в SVZ, которые формируют нишу стволовых клеток взрослого мозга. Принято считать, что НСК в SVZ и SGZ взрослого мозга облигатно экспрессируют GFAP (glial fibrillary acidic protein) и нестин и опционально SOX2 (sex determining region Y (SRY)-box 2 ) или SHH, ‒ что свидетельствует о гетерогенности их популяции [61].
В SVZ клетки РГ I типа подвергаются ассиметричному делению, в результате которого образуются прогениторные клетки II типа, имеющие астроглиальный фенотип (2а), а также промежуточные нейрональные прогениторы (клетки 2b), дающие начало молодым нейронам [62]. Проглиальные клетки 2а характеризуются экспрессией SHH, WNT, инсулинподобного фактора роста 1 (IGF-1), FGF-2, SOX2 и ядерного белка TLX (T Cell Leukemia Homeobox) [61]. Активность путей SHH, WNT, IGF-1 и FGF-2 необходима для дифференцировки и созревания клеток II типа, а локальные изменения концентрации IGF-1 определяют направление миграции [63]. Эти клетки также экспрессируют рецепторы ГАМК и реагируют на наличие ГАМК в окружающей среде [62]. Кроме ГАМК пролиферацию и созревание клеток II типа также регулируют дофамин и серотонин, о чем свидетельствует экспрессия в них генов дофаминовых (D2/D3) и серотониновых (5-HT) рецепторов [64, 65]. Пронейрональные клетки 2b, помимо общих для всех клеток II типа факторов, экспрессируют гены DCX (Doublecortin), NT3 (neurotrophin-3), TBR2, MASH1, NEUROD1 и PROX1 (prospero homeobox protein 1) [61]. Клетки 2b в дальнейшем дифференцируются в клетки III типа (нейробласты и преддеференцированные нейроны). Раннюю стадию формирования этих клеток называют фазой постмитотического созревания [62]. В этом процессе клетки III типа меняют свою пространственную ориентацию на более вертикальную в толще SGZ и приобретают полярную форму, выпуская дендриты в зубчатый молекулярный слой и аксоны, уходящие к слою пирамидных клеток в области CA3 [66]. Далее эти клетки созревают, формируя дендритные шипики и удлиняя аксоны в зону CA2 [61]. В молодых клетках III типа продолжается экспрессия пронейрональных генов, активных в клетках I и II типа (DCX, WNT, NOTCH, GABA, NEUROD1 и PROX1) [67], которую затем заменяет экспрессия генов зрелых нейронов, таких как BDNF (кодирует нейротрофический фактор головного мозга), RELIN (рилин), CREB (cAMP response element-binding protein), RBFOX3 (RNA binding FOX-1 homolog 3), CALB2 (кальретинин), AP1 (activating protein 1) [67]. Релин представляет собой гликопротеин внеклеточного матрикса, регулирующий процессы миграции, позиционирования нейронов и формирование дендритных шипиков [68]. Фосфорилирование CREB активирует транскрипцию генов других ключевых молекул, таких как c-FOS, JUN-B, BCL-2, GDNF (glial cell-derived neurotrophic factor), и различных нейротрофинов для регулирования выживания и регенерации нейронов [69]. Сигнальный каскад Wnt активирует AP-1, который представляет собой гетеродимер, состоящий из субъединиц c-FOS и c-JUN, и влияет на пролиферацию, дифференцицировку и апоптоз нейронов [70].
SVZ боковых желудочков, или субэпендимальная зона, содержит большое количество НСК, называемых клетками РГ типа В1, которые морфологически напоминают взрослые радиальные астроциты, экспрессируют гены GFAP, транспортеров глутамата и аспартата, липидсвязывающего белка мозга и контактируют своими отростками с капиллярами [57, 71, 72]. Активированные клетки В1 экспрессируют нестин и ассиметрично делятся с образованием клеток B2, также имеющих астроглиальный фенотип и взаимодействующих с капиллярами, но не контактирующих с апикальной поверхностью эпендимы, а также с образованием транзиторно амплифицирующихся промежуточных клеток типа С, экспрессирующих маркеры ASCL1 и DLX. Клетки типа С несколько раз ассиметрично делятся и формируют пул клеток типа А (нейроболастов), которые затем мигрируют по ростральному миграционному пути в обонятельные луковицы [57, 71, 73]. Для клеток типа А характерна экспрессия DCX, CRMP-4 (collapsin-response mediator protein 4), PSA-NCAM (prostate-specific antigen‒neural cell adhesion molecule), ганглиозида 9-O-ацетил-GD3 и других белков клеточной адгезии и интегринов, которые обеспечивают эффективную миграцию клеток к обонятельным луковицам, регулируемую такими факторами, как TN-С (тенасцин-С) и РК2 (прокинетицин-2) [57].
Нейрогенез во взрослом мозге обычно рассматривается как ограниченное и упрощенное продолжение эмбрионального нейрогенеза [13]. Сходство эмбрионального и взрослого нейрогенеза, в частности, заключается в том, что и в эмбриональном, и во взрослом мозге нейроны происходят от клеток РГ [74]. Однако во взрослом и эмбриональном нейрогенезе есть и принципиальные различия, заключающиеся как в особенностях окружения, так и в ключевых молекулярных механизмах. Так, анализ транскриптома показал, что эмбриональные клетки РГ наиболее близки к нейробластам и транзиторно амплифицирующимся прогениторным клеткам (ТАП-клетки), в то время как паттерн экспрессии клеток РГ во взрослом мозге более соответствует дифференцированным астроцитам и эпендимальным клеткам [9]. Последние играют важную роль в формировании ниши стволовых клеток в субэпендимальном пространстве и SGZ взрослого мозга [75] и отсутствуют в окружении НСК раннего эмбрионального мозга [76]. Эта особенность микроокружения, вероятно, приводит к тому, что эмбриональные НСК дифференцируются преимущественно в нейрональном направлении, а взрослые НСК предпочтительно осуществляют глиогенез [9].
В экспериментах с трансплантацией показано, что культивированные эмбриональные и взрослые НСК, которые in vitro легко дифференцируются в нейроны, при пересадке в паренхиму головного мозга взрослого животного меняют направление дифференцировки в сторону глиогенеза [13]. Интересно, что только в зубчатой извилине гиппокампа трансплантированные клетки могут продуцировать нейроны, хотя и там взрослые НСК окружены глиальными клетками, отсутствующими на эмбриональных стадиях, такими как зрелые олигодендроциты, NG2-глия и астроциты [13]. Это связывают с наличием специализированных механизмов подавления глиогенеза за счет активации сигнального пути BMP [13, 77]. Кроме того, обнаружено, что трансплантация нейрогенно активных клеток в зоны ЦНС, где у взрослого организма отсутствует естественный нейрогенез, приводит к нарушению дифференцировки трансплантированных клеток, в результате чего они либо сохраняют стволовость, либо дифференцируются в глию [78]. К этому же выводу пришли исследователи, показавшие резкое снижение экспрессии пронейрогенных факторов транскрипции, таких как PAX6, ASCL1 и NGN2, после трансплантации in vivo при высокой их активности in vitro [79, 80].
Интересно, что эмбриональная радиальная глия изначально обладает повышенным уровнем экспрессии нейрогенных факторов транскрипции по сравнению с глией во взрослом мозге [9]. НСК во взрослом мозге способны к нейрогенезу только через промежуточные формы и без дополнительной транскрипционной поддержки на последующих стадиях могут сменить направление на глиогенез [81]. Показано, что факторы, регулирующие нейрогенез на ранних этапах развития, такие как PAX6, GSX2, DLX, ASCL1, NGN2 и NEUROD1, также участвуют в регуляции взрослого нейрогенеза [9, 82]. Важное отличие состоит в том, что эмбриональная радиальная глия изначально склонна к прямой нейрональной дифференцировке, в то время как для взрослых НСК необходима серия промежуточных делений для наработки необходимого уровня пронейрональных транскрипционных факторов [81, 83‒85].
Еще одно существенное отличие взрослого нейрогенеза от эмбрионального связано с особенностями регулирования клеточного цикла. Так, в эмбриональном периоде клеточный цикл НСК длится от 10 до 18 ч, что связано с необходимостью в короткий срок сформировать достаточно большой объем нервной ткани, в то время как во взрослом мозге клеточный цикл радиальных глиальных клеток в зубчатой извилине, SVZ и SGZ длится от нескольких суток до двух недель [86‒88].
На основании вышеприведенных сведений можно прийти к заключению, что взрослые НСК ‒ это особый, выделенный на ранних этапах развития, пул клеток, имеющий свои функции и механизмы регуляции пролиферации и дифференцировки. Ключевой особенностью НСК в нише стволовых клеток взрослого мозга является преимущественная склонность к глиогенезу, а не к нейрональной дифференцировке [13, 89]. Эту склонность и “глиогенность” микроокружения взрослого мозга необходимо учитывать при разработке всех нейрорегенеративных технологий, включающих нейрональную дифференцировку.
ПРОНЕЙРОНАЛЬНЫЕ ТРАНСКРИПЦИОННЫЕ ФАКТОРЫ В РЕПРОГРАММИРОВАНИИ
В отличие от технологии iPSC, при применении которой получают плюрипотентные клетки, аналогичные эмбриональным стволовым клеткам (ЭСК), при прямом репрограммировании могут быть получены как прогениторные клетки, так и нейробласты и нейроны той или иной степени зрелости [2, 90, 91]. На основании современных представлений об эмбриональном и взрослом нейрогенезе мы составили онтогенетический ряд клеток ЦНС ‒ от плюрипотентной ЭСК до специализированных нейронов ‒ и попытались систематизировать опубликованные в литературе протоколы репрограммирования c точки зрения соответствия получаемых в результате клеток тем или иным позициям в онтогенетическом ряду (рис. 2, табл. 1).
Рис. 2.
Онтогенетический ряд клеток, от плюрипотентной ЭСК до специализированных нейронов, и протоколы прямого репрограммирования. Стрелками показано соответствие полученных в результате репрограммирования конечных типов клеток тем или иным позициям в онтогенетическом ряду. Указаны протоколы, приводящие к получению смешанной/гетерогенной популяции НСК, НПК, ТАП-клеток, нейробластов (1); охарактеризованных НПК (2); преддиференцированных нейронов (3); терминально дифференцированных нейронов головного и спинного мозга (4). Обозначения: ЭСК – эмбриональная стволовая клетка; ТАП – транзиторно амплифицирующиеся предшественники; НПК – нейральные прогениторные клетки; НСК – нейральные стволовые клентки.
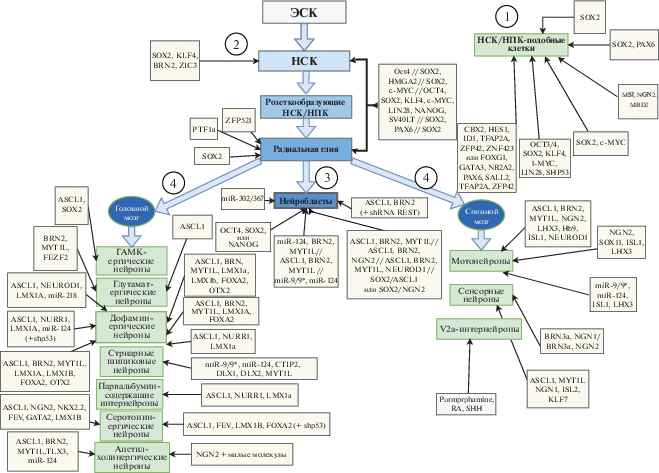
Таблица 1.
Перечень протоколов прямого репрограммирования к рисунку 2
| Целевой тип клеток | Факторы репрограммирования | Литературный источник |
|---|---|---|
| НСК | SOX2, KLF4, BRN2, ZIC3 | Thier M.C. et al. [92] |
| OCT4 | Zhu S. et al. (2014) [93] | |
| SOX2, HMGA2 | Yu K.R. et al. (2015) [94] | |
| SOX2, c-MYC | Sheng C. et al. (2018) [95] | |
| OCT4, SOX2, KLF4, c-MYC, LIN28, NANOG, SV40LT | Cheng L. et al. (2017) [96] | |
| SOX2, PAX6 | Connor B. et al. (2018) [97] | |
| SOX2 | Kim B.E. et al. (2018) [98] | |
| НСК/НПК-подобные клетки | CBX2, HES1, ID1, TFAP2A, ZFP42, ZNF423 или FOXG1, GATA3, NR2A2, PAX6, SALL2, TFAP2A, ZFP42 | Hou P.S. et al. (2017) [99] |
| OCT3/4, SOX2, KLF4, l-MYC, LIN28, shp53 | Capetian P. et al. (2016) [100] | |
| SOX2, c-MYC | Giorgetti A. et al. (2012) [101] | |
| SOX2, c-MYC | Castaño J. et al. (2016) [102] | |
| MSI, NGN2, MBD2 | Ahlfors J.-E. et al. (2019) [2] | |
| SOX2, PAX6 | Maucksch C. et al. (2012) [103] | |
| SOX2 | Ring K.L. et al. (2012) [104] | |
| Радиальная глия | ZFP521 | Shahbazi E. et al. (2016) [105] |
| PTF1a | Xiao D. et al. (2018) [106] | |
| SOX2 | Mirakhori F. et al. (2015) [107] | |
| Нейробласты | miR-302/367 | Ghasemi-Kasman M. et al. (2015) [108] |
| OCT4, SOX2 или NANOG | Corti S. et al. (2012) [109] | |
| miR-124, BRN2, MYT1L | Yoo A.S. et al. (2011) [110] | |
| miR-124, BRN2, MYT1L | Ambasudhan, R. et al. (2011) [111] | |
| miR-124, ASCL1, BRN2, MYT1L | Lau S. et al. (2014) [112] | |
| miR-9/9*, miR-124 | Huh C.J. et al. (2016) [113] | |
| ASCL1, BRN2, MYT1L | Torper O. et al. (2013) [79] | |
| ASCL1, BRN2, MYT1L | Pereira M. et al. (2014) [114] | |
| ASCL1, BRN2, MYT1L | Vierbuchen T. et al. (2010) [115] | |
| ASCL1, BRN2, NGN2 | Meng F. et al. (2012) [116] | |
| ASCL1, BRN2, NGN2 | Mertens J. et al. (2015) [117] | |
| ASCL1, BRN2, MYT1L, NEUROD1 | Pang Z.P. et al. (2011) [118] | |
| ASCL1, BRN2, MYT1L, NEUROD1 | Matsuda T. et al. (2019) [119] | |
| SOX2/ASCL1 или SOX2/NGN2 | Araújo J. et al. (2018) [120] | |
| ASCL1, BRN2 (+ shRNA REST) | Drouin-Ouellet J. et al. (2017) [121] | |
| ГАМКергические нейроны | ASCL1, SOX2 | Karow M. et al. (2012) [122] |
| Глутаматергические нейроны | BRN2, MYT1L, FEZF2 | Miskinyte G. et al. (2017) [123] |
| ASCL1 | Chanda S. et al. (2014) [124] | |
| Дофаминергические нейроны | ASCL1, NEUROD1, LMX1A, miR-218 | Rivetti di Val Cervo et al. (2017) [125] |
| ASCL1, NURR1, LMX1A, miR-124 (+shp53) | Jiang H. et al. (2015) [126] | |
| ASCL1, BRN2, MYT1L, LMX1A, LMX1B, FOXA2, OTX2 | Pereira M. et al. (2014) [114] | |
| ASCL1, BRN2, MYT1L, LMX1A, LMX1B, FOXA2, OTX2 | Torper O. et al. (2013) [79] | |
| ASCL1, BRN2, MYT1L, LMX1A, FOXA2 | Pfisterer U. et al. (2011) [127] | |
| ASCL1, NURR1, LMX1a | Caiazzo M. et al. (2011) [128] | |
| Стриатарные шипиковые нейроны | miR-9/9*, miR-124, CTIP2, DLX1, DLX2, MYT1L | Victor M.B. et al. (2014) [129] |
| Парвальбуминсодержащие интернейроны | ASCL1, NURR1, LMX1a | Pereira M. et al. (2017) [130] |
| Серотонинергические нейроны | ASCL1, NGN2, NKX2.2, FEV, GATA2, LMX1B | Vadodaria K.C. et al. (2016) [131] |
| ASCL1, FEV, LMX1B, FOXA2 (+ shp53) | Xu Z. et al. (2016) [132] | |
| Ацетилхолинергические нейроны | ASCL1, BRN2, MYT1L, TLX3, miR-124 | Liang X.G. et al. (2018) [133] |
| NGN2 + малые молекулы | Liu M.L. et al. (2013) [134] | |
| Мотонейроны | ASCL1, BRN2, MYT1L, NGN2, LHX3, Hb9, ISL1, NEUROD1 | Son E.Y. et al. (2011) [135] |
| NGN2, SOX11, ISL1, LHX3 | Liu M.L. et al. (2016) [136] | |
| miR-9/9*, miR-124, ISL1, LHX3 | Abernathy D.G. et al. (2017) [137] | |
| NGN2, SOX11, ISL1, LHX3 | Tang Y. et al. (2017) [138] | |
| Сенсорные нейроны | BRN3a, NGN1 или BRN3a, NGN2 | Blanchard J.W. et al. (2015) [139] |
| ASCL1, MYT1L, NGN1, ISL2, KLF7 | Wainger B.J. et al. (2015) [140] | |
| V2a-интернейроны | Purmprphamine, RA, SHH | Brown C.R. et al. (2014) [141] |
Среди факторов транскрипции, играющих определяющую роль в эмбриональном и взрослом нейрогенезе, при нейрональном репрограммировании применяют такие мастер-регуляторы, как SOX2 [142] и PAX6 [43]. Последний, в свою очередь, регулирует экспрессию гена NEUROG2, продукт которого, белок NGN2, принимает активное участие в регулировании пролиферации НСК [143]. В дополнение к экспрессии SOX2, PAX6 и NGN2, еще одно общее условие для успешного нейронального репрограммирования ‒ подавление функции репрессора транскрипции REST (RE1-silencing transcription factor), также известного как фактор рестриктивного подавления нейронов (neuron-restrictive silencer factor; NRSF). Продукт гена REST подавляет экспрессию нейронспецифичных генов путем привлечения других корепрессоров: mSin3A/B [144], N-CoR, CtBP [145] или CoREST, ‒ блокируя промоторы кодирующих и некодирующих генов-мишеней [43]. Будучи негативным мастер-регулятором нейрогенеза, REST играет фундаментальную роль как для поддержания покоящегося пула НСК, так и в постмитотических нейронах, где он регулирует экспрессию генов, важных для синаптической пластичности. REST активен во всех ненейрональных клетках и тканях, где он также подавляет экспрессию нейронспецифичных генов. Именно поэтому без инактивации этого супрессора провести пронейрональное репрограммирование соматических клеток невозможно [144].
Кроме упомянутых выше мастер-факторов, таких как SOX2 и PAX6, есть еще немало подконтрольных им генов или кофакторов, участвующих в нейрогенезе и относящихся к потенциальным факторам репрограммирования. В результате проведенного анализа литературы выявлено, что в различных методиках прямого репрограммирования применяют и такие факторы, как MSI1 (Musashi RNA binding protein 1), ASCL1, BRN2, нейрогенины, NEUROD1, MYT1L (myelin transcription factor 1 like), GSX2, DLX, а также микроРНК и малые молекулы. Рассмотрим перечисленные факторы более подробно.
Фактор транскрипции SOX2
SOX2 (SRY-box 2) ‒ многофункциональный транскрипционный мастер-фактор, участвующий в поддержании пролиферации, плюрипотентности стволовых клеток, развитии нервной системы и во многих других процессах в организме [146, 147]. В некоторых исследованиях показано, что уровень экспрессии гена SOX2 в ЭСК жестко регулируется, а небольшие изменения в нем приводят к значительным колебаниям направления дифференцировки, так как SOX2, в противовес OCT4, активно участвует в процессе мезенхимально-эпителиального перехода [148, 149]. SOX2 также предотвращает выход клеток из клеточного цикла и дифференцировку НСК [150, 151]. Показано, что нокаут SOX2 значительно снижает активность пролиферации клеток I типа в SGZ. Интересно, что некоторые нейроны и клетки глии сохраняют высокую экспрессию SOX2, что необходимо для их функционирования [152]. SOX2 непосредственно регулирует экспрессию пути SHH и одновременно подавляет экспрессию NEUROD1 и WNT ‒ чтобы поддерживать способность НСК к самообновлению [153]. Более того, SOX2 контролирует экспрессию ядерного рецептора TLX, который, в свою очередь, поддерживает пролиферацию и самообновление взрослых НСК [43].
Bergsland и соавт. [154] обнаружили, что белки SOX2 запускают в клетках генетическую программу нейрального профиля, активируя нейрональные энхансеры и пронейрональные гены. В частности, с экспрессией SOX2 была связана активация генов SOX1, SOX3, OLIG2 (oligodendrocyte transcription factor 2), NCAM (neural cell adhesion mo-lecule), PAX6 и др. Таким образом, последовательная координация дифференцировки нейронов из стволовых клеток может быть инициирована экспрессией SOX2, что подтверждает его роль в качестве мастер-гена.
В эмбриональном нейрогенезе SOX2 экспрессируется в развивающихся клетках нервной трубки и пролиферирующих предшественниках нервных клеток. Помимо того, что SOX2 входит в состав хорошо известного “коктейля Яманаки”, необходимого для генерации iPSC [1], его активно применяют в drNPCs. Так, в определенных условиях культивирования экспрессия SOX2 индуцировала трансформацию фибробластов мыши и человека в НСК [104, 155]. Показано, что SOX2 относится к тем немногим транскрипционным факторам, индукция которых необходима и достаточна для прямого репрограммирования мышиных астроцитов [156, 157]. Фактически к тем же результатам пришла еще одна группа исследователей [104], преобразовав корковую NG2-глию в нейроны с помощью ретровирусного вектора с геном SOX2. А Ring и соавт. [104] показали, что эктопической экспрессия SOX2 достаточно для репрограммирования не только мышиных, но и человеческих эмбриональных фибробластов в НСК. По-видимому, SOX2, будучи первичным фактором транскрипции, способен взаимодействовать с локально нераскрученными участками ДНК [104, 158]. Выяснилось, что SOX2 стимулирует пронейрональную индукцию через взаимодействие с другим первичным фактором ‒ ASCL1, а также с PAX6 и NR2E1 (nuclear receptor subfamily 2 group E member 1) [159, 160]. Так, Karow и соавт. [161] успешно репрограммировали клетки первичной культуры перицитов человека в индуцированные нейроны с помощью факторов SOX2 и ASCL1. Lujan и соавт. [162] показали, что лентивирусной трансдукиции факторов SOX2, BRN2 и FOXG1 (Forkhead box protein G1) достаточно для превращения эмбриональных фибробластов мыши в индуцированные нейральные клетки-предшественники с потенциалом дальнейшей дифференцировки в нейроны, астроциты и олигодендроциты. Интересно, что комбинация SOX2 и FOXG1 привела к образованию индуцированных нейронных клеток-предшественников, которые дали начало астроцитам и функциональным нейронам. Факторы транскрипции FOXG1 и BRN2 по-отдельности также генерировали клетки-предшественники нейронов, но образующиеся нейроны оказались менее зрелыми, чем под действием SOX2.
Другая группа исследователей для получения НПК из фибробластов взрослой мыши использовала комбинацию пяти транскрипционных факторов: SOX2, BRN2, TLX, c-MYC и BMI1 (B lymphoma Mo-MLV insertion region 1 homolog) [163]. Полученные клетки обладали свойствами, аналогичными первичным НПК, включая уровень пролиферации, самообновления и эффективность дифференцировки. Han и соавт. [164] исследовали возможность прямого репрограммирования мышиных фибробластов в нейрональные клетки и показали, что сочетание основных факторов: SOX2, c-MYC и KLF4 (Kruppel like factor 4) ‒ и двух дополнительных: BRN4 и E47 ‒ приводило к успешному репрограммированию. Однако у полученных НПК была нарушена дифференцировка в олигодендроциты. Наконец, Maucksch и др. [103] показали, что комбинированная эктопическая экспрессия SOX2 и PAX6 с использованием невирусной доставки индуцирует преобразование фибробластов взрослого человека в клетки-предшественники нейронов. В результате были получены НПК, экспрессирующие маркеры нейральных предшественников и дифференцирующиеся в функциональные нейроны и астроциты, но не олигодендроциты.
Фактор транскрипции PAX6
PAX6 (белок аниридии II) ‒ тканеспецифичный фактор транскрипции, один из координирующих генов при развитии глаз и нервной системы в эмбриональном периоде. Ген PAX6 экспрессируется в НСК и на начальных периодах эмбрионального нейрогенеза, формируя мультипотентный потенциал клеток. В процессе дифференцировки и созревания экспрессию PAX6 ингибируют некоторые микроРНК, в частности miR-7а [165, 166], так как непрерывная экспрессия PAX6 блокирует дифференцировку [167]. Однако во взрослом нейрогенезе этот регуляторный механизм функционирует иначе, обеспечивая повышенную экспрессию в НПК и ограничивая ее в НСК с помощью той же miR-7а [166].
В развивающемся мозге PAX6 выполняет множество функций: регуляцию клеточного цикла, нейрогенеза и глиогенеза, формирование пространственно-временных паттернов и даже запуск генерации специализированных подтипов нейронов при взаимодействии с NGN2 [167, 168]. PAX6 запускает экспрессию генов, необходимых для пролиферации и пронейрональной дифференцировки: HMGA2 (high mobility group AT-hook 2), CDK4 (cyclin-dependent kinase 4), GADD45G (growth arrest and DNA damage inducible gamma), NEUROD1, SSTR2 (somatostatin receptor 2) и HES6 (HES family BHLH transcription factor 6) [152]. Кроме того, PAX6 регулирует экспрессию гена NEUROG2, продукт которого, белок NGN2, принимает активное участие в регуляции пролиферации и дифференцировки НСК [153].
Интересно, что ряд аналогичных механизмов запускается и во взрослом мозге млекопитающих в ответ на травматическую гибель нейронов in vivo [80, 169]. Показано, что во взрослом мозге млекопитающих PAX6 функционирует только вместе с содержащим BRG1 (Brahma-related gene-1) комплексом BAF семейства факторов ремоделирования хроматина SWI/SNF [81]. По-видимому, это обусловлено способностью PAX6 связываться только со свободной ДНК, которая превалирует в эмбриональном периоде, но отсутствует во взрослом мозге. PAX6 и BRG1-содержащий BAF-комплекс образуют гетеродимер и активируют регуляторную сеть из трех нейрогенных факторов: BRN2, SOX4/11 и NFIA/B (nuclear factor 1 A/B-type) [81]. Стоит отметить, что в эмбриональном мозге эти механизмы не задействованы, поскольку в нем, как уже отмечалось, превалирует свободный хроматин и нейрогенез происходит в нейрогенной среде, не требующей дополнительной пронейрональной поддержки [169, 170]. Таким образом, по-видимому, только во взрослом мозге активация PAX6 связана с массивным ремоделированием хроматина для активации нижележащей регуляторной сети.
Примеров прямого репрограммирования с помощью PAX6 не так много, как хотелось бы, но нескольким группам исследователей удалось получить функциональные нейроны из глиальных клеток (астроцитов и предшественников олигодендроцитов) с помощью принудительной экспрессии этого фактора [81, 171, 172] (рис. 2).
Фактор транскрипции MSI1
MSI1 (RNA-binding protein Musashi homolog 1) связывает РНК двумя консервативными тандемными мотивами. Этот белок постоянно экспрессируется в НСК/клетках-предшественниках ‒ от эмбриональной [173] до взрослой стадии [174]. Он необходим для поддержания стволовых свойств НСК, вероятно, путем усиления передачи сигналов NOTCH через репрессию трансляции мРНК m-NUMB [175]. Мутация в гене MSI1 приводит к развитию аутосомно-рецессивной первичной микроцефалии. В мозге взрослого млекопитающего MSI1 присутствует в эпендимальных клетках, субэпендимальных клетках и астроцитах, в нишах стволовых клеток, но не в микроглии, олигодендроцитах или зрелых нейронах [173, 174]. Показано, что кластеробразующие пролиферирующие клетки в SVZ после острой или хронической ишемии, очаговой ишемии переднего мозга экспрессируют ген MSI1, но не экспрессируют GFAP [176].
Ввиду того, что экспрессия гена MSI1 характерна только для НСК, его использование в качестве фактора прямого репрограммирования довольно ограничено, хотя есть работы, в которых MSI1 был включен в состав репрограммирующих коктейлей [2]. Используя первичные транскрипционные факторы MSI1 и NGN2 и вторичный BRN2, авторы получили из мультипотентных мезенхимальных стволовых клеток человека жизнеспособные функциональные НСК, позитивные на основные маркеры: SOX2, NESTIN, β-III-TUBULIN и GFAP ‒ и дифференцирующиеся в нейроны, астроциты и олигодендроциты [2].
Фактор транскрипции ASCL1
ASCL1 (продукт гена MASH1) входит в семейство bHLH (“спираль-петля-спираль”). Для успешного связывания ASCL1 с ДНК необходима димеризация с другими белками bHLH. ASCL1 играет ключевую роль в дифференцировке нейронов и индукции обонятельных и вегетативных нейронов [157, 177]. Очень интересны различия в функциях ASCL1 между эмбриональным нейрогенезом и нейрогенезом во взрослом мозге. Так, сниженная активность ASCL1 в эмбриональный период не приводит к каким-либо серьезным последствиям, но ингибирование ASCL1 в клетках зубчатой извилины взрослого мозга практически полностью останавливает нейрогенез [178]. Эктопическая экспрессия MASH1 достаточна для стимулирования нейрональной дифференцировки эмбриональных стволовых клеток, НСК и ранней постнатальной астроглии [124]. Как и SOX2, ASCL1 ‒ первичный фактор транскрипции, так что изначально не нуждается в дополнительных кофакторах [179, 180], однако репрограммирование одним ASCL1 оказалось эффективным только для соматических клеток мыши, но не человека [161]. Для прямого репрограммирования соматических клеток человека необходимы как минимум два фактора транскрипции, например SOX2 и ASCL1 [161]. Однако результаты, полученные группой исследователей под руководством M. Werning [124], ставят под сомнение этот факт ‒ им удалось получить TUJ1- и MAP2-положительные индуцированные нейроны из эмбриональных и постнатальных фибробластов с помощью одного только фактора ASCL1, правда, с гораздо меньшей эффективностью, чем из мышиных клеток. На этом основании авторы сделали вывод, что ASCL1 относится к необходимым и достаточным факторам для прямого пронейронального репрограммирования. В дальнейших экспериментах с использованием технологии РНК-секвенирования в режиме “single cell” они показали [181], что сверхэкспрессия пронейронального первичного фактора ASCL1 приводит к четко определенной инициализации, заставляя клетки выходить из клеточного цикла и перефокусировать экспрессию генов в пронейрональном направлении посредством активации генов нижележащего сигнального каскада. Поначалу первичный генный ответ достаточно однороден, однако дальнейшее проявление конкурирующей миогенной программы ограничивает эффективность репрограммирования. Интересно, что фактор FOXO3 (forkhead box O3), который играет важную роль в негативном контроле нейрогенеза в эмбриональном и постнатальном развитии мозга, также имеет общие гены-мишени с ASCL1 и ингибирует ASCL1-зависимый нейрогенез [182, 183]. Так, успешно проведено прямое репрограммирование мультипотентных мезенхимальных стволовых клеток пуповины в функциональные нейроны коктейлем из трех факторов транскрипции: ASCL1, SOX2 и NGN2 [120]. В сочетании с Brn2/BRN2 и Myt1L/MYT1L или с Lmx1a/LMX1A и Nurr1/NURR1 (nuclear receptor related 1 protein) Ascl1/ASCL1 индуцировал нейрональную конверсию фибробластов мыши и человека в культуре [115, 128, 179]. Получившиеся клетки были названы индуцированными нейрональными клетками. Эти две комбинации трех транскрипционных факторов также напрямую превращали астроциты и NG2-глию в нейроны в полосатом теле взрослой мыши, хотя эти нейроны не были DARPP32 (dopamine- and cAMP-regulated neuronal phosphoprotein)-положительными нейронами стриатальной проекции или дофаминергическими нейронами [184]. Очень похожий коктейль факторов использовала и группа M. Werning [3] для получения функциональных индуцированных нейронов из клеток крови человека. Это сочетание факторов BRN2, ASCL1, MYT1L и NGN2 (BAMN). Ими же продемонстрирована возможность преобразования функциональных гепатоцитов мыши в индуцированные нейроны с помощью факторов Brn2 (BRN2), Ascl1 (ASCL1) и Myt1L (MYT1L) [185]. Хотя одного Ascl1 (ASCL1) достаточно для генерации индуцированных нейронов, экзогенный Myt1L (MYT1L) значительно повышал эффективность перепрограммирования и функциональное созревание полученных клеток [186]. Некоторые научные группы сообщали, что явная нейральная индукция с помощью ASCL1 наблюдалась только тогда, когда трансдукцию проводили с помощью аденовирусного вектора [80, 187]; при использовании аналогичной конструкции с лентивирусным или ретровирусным вектором ASCL1 стимулировал глиогенез [187].
Фактор транскрипции BRN2
BRN2 (продукт гена POU3F2) относится к классу нейрональных транскрипционных факторов POU-III, экспрессируется в клетках-предшественниках SVZ, играя важную роль во взрослом нейрогенезе, а также в постмитотических пирамидных нейронах II, III и V кортикальных слоев [188, 189]. BRN2 связывается с последовательностью распознавания, которая состоит из двух отдельных субдоменов: GCAT и TAAT, ‒ разделенных неконсервативной спейсерной областью из 0, 2 или 3 нуклеотидов [190]. BRN2 совместно с другими факторами транскрипции регулирует ряд генов нейрогенеза, таких как Delta1, который кодирует лиганд NOTCH [191]. Он участвует в развитии неокортекса у мышей и ассоциирован с единичным нуклеотидным полиморфизмом rs1906252, который определяет когнитивный фенотип ‒ скорость обработки информации [192]. Также показано, что BRN2 совместно с BRN1 регулируют радиальную миграцию постмитотических нейронов, а их потеря приводит к ламинарной инверсии коры головного мозга [193]. Кроме того, BRN1/2 необходимы для миграции клеток V слоя и для фактического производства клеток слоев II–IV [194], однако механизмы, осуществляющие этот процесс, пока неясны. Помимо пронейрональной дифферецнировки BRN2 играет важную роль в развитии шванновских клеток [195]. Роль BRN2 в нейрогенезе подтверждается тем, что для перепрограммирования фибробластов в нейроны in vitro его можно использовать в сочетании с экспрессией MASH1 и MYT1L [115, 179, 184]. Несмотря на решающую роль BRN2 в нейрогенезе, его гены-мишени и способ действия остаются плохо изученными. В связи с тем, что BRN2 не относится к первичным транскрипционным факторам, он не способен самостоятельно репрограммировать соматические клетки ‒ для взаимодействия с ДНК ему необходим “проводник” [179].
Нейрогенины
Семейство нейрогенинов, как и ASCL1, относится к факторам транскрипции, содержащим структурный мотив bHLH. В семейство входят 3 фактора: нейрогенин-1 (NGN1), нейрогенин-2 (NGN2) и нейрогенин-3 (NGN3). Из них только первые два участвуют в развитии нервной системы. NGN1 присутствует в коре головного мозга и выступает в качестве стимулятора дифференцировки за счет связывания со своим кофакторным комплексом CBP/p300/SMAD1 [196]. Как и ASCL1, нейрогенины, чтобы связаться с ДНК, формируют димер с другим фактором bHLH-типа. Коактиваторный комплекс CBP/p300/SMAD1 связан с активностью сигнального пути BMP, поэтому в присутствии NGN1 BMP стимулирует дифференцировку нейронов. В то же время NGN1 опосредованно блокирует астроцитарную дифференцировку за счет изоляции комплекса CBP/p300/SMAD1 от ДНК генов, задействованных в глиогенезе, таких как факторы транскрипции STAT. В эмбриональном переднем мозге NGN1 совместно с NGN2 и PAX6 ассоциируется с формированием дорсального паттерна и спецификацией нейронов.
NGN2 активирует экспрессию пронейральных генов и управляет нейронной спецификацией, ингибируя экспрессию глиальных генов в НПК [196]. Интересно, что фактор транскрипции OLIG2 стимулирует экспрессию NGN2 в НПК, хотя и NKX2.2 (homeodomain transcription factors 2.2), и OLIG2 сами по себе стимулируют глиогенез [197]. Считается, что NGN2 участвует в спецификации моторных нейронов и вентральных интернейронов [198]. NGN2 ‒ это еще один первичный транскрипционный фактор, так что в сочетании с другими факторами или малыми молекулами может репрограммировать человеческие фибробласты в холинергические нейроны in vitro [2, 120], а клетки крови человека ‒ в индуцированные нейроны [184]. Ретровирусная экспрессия NGN2 в пролиферирующих клетках индуцировала образование нейронов в спинном мозге, стриатуме и коре [58, 163]. Такую нейрональную индукцию in vivo дополнительно можно усиливать факторами роста или путем совместной экспрессии с BCL2 [199]. В результате образовывались преимущественно глутаматергические пирамидальные нейроны в коре головного мозга [163] или ГАМКергические, но DARPP32-негативные нейроны в полосатом теле [80].
Фактор транскрипции NEUROD1
NEUROD1 ‒ транскрипционный фактор нейрогенной дифференцировки 1 ‒ также относится к структурному семейству bHLH. Как и NGN1, NEUROD1 связывается с коактиваторным комплексом CBP/p300, способствуя регуляции нескольких путей дифференцировки клеток в нервной системе, в том числе тех, которые участвуют в образовании ранних ганглиозных клеток сетчатки, сенсорных нейронов внутреннего уха и гранулярных клеток, образующих либо слой мозжечка, либо слой зубчатой извилины гиппокампа [200]. NEUROD1 также необходим для морфогенеза и поддержания дендритов в коре мозжечка [200]. С помощью эктопической экспрессии ретровирусным вектором с геном NEUROD1 удалось репрограммировать кортикальные астроциты в глутаматергические нейроны и NG2-глию в глутаматергические и ГАМКергические нейроны [125, 201]. Эти преобразованные нейроны давали спонтанные и вызванные синаптические ответы, что указывало на их интеграцию в локальные нервные цепи. Группа М. Werning [115], используя транскрипционные факторы NEUROD1, ASCL1 и LMX1A и микроРНК miR-128, репрограммировала человеческие астроциты in vitro и мышиные астроциты in vivo в дофаминергические нейроны. Важно заметить, что эффективность репрограммирования повышалась под действием низкомолекулярных соединений, которые способствовали ремоделированию хроматина и активации сигнальных путей TGF-β, SHH и WNT. Они же показали возможность прямого репрограммирования фетальных и постнатальных фибробластов человека в индуцированные нейроны под действием коктейля факторов BRN2, ASCLl1, MYT1L и NEUROD1 [118].
Фактор транскрипции GSX2
GSX2 (GS homeobox 2, продукт гена GSX2) – один из транскрипционных факторов, связывающих последовательность 5'-CNAATTAG-3' ДНК и отвечающих за вентрализацию конечного мозга во время эмбрионального развития, где он формирует раннюю спецификацию предшественников латерального ганглиозного возвышения (LGE), медиального ганглиозного возвышения (MGE) и вентральной перегородки [34] и в зависимости от стадии развития определяет нейронную спецификацию. GSX2 необходим для развития полосатых проекционных нейронов и интернейронов обонятельной луковицы ‒ двух основных производных LGE [202]. Аналогично PAX6 и EMX2 (empty spiracles homeobox 2) в дорсальном конечном мозге, ген GSX2 необходим не только для формирования паттернов предшественников LGE, но и для контроля их пролиферации [203]. GSX2 может экспрессироваться в нескольких областях. Так, область с высокой экспрессией GSX2 определяет дорсальную область LGE, которая служит основным источником интернейронов, тогда как более вентральная область LGE ответственна за продукцию нейронов полосатого тела [82]. Аналогичная картина наблюдается в распределении экспрессии GSX2 в зубчатой извилине взрослого мозга: GSX2-положительными НСК чаще обогащена дорсолатеральная область [82]. Интересно, что дорсальнее GSX2-положительных НСК в зубчатой извилине находится небольшая зона PAX6-положительных клеток, а в вентральной зоне пониженной экспрессии GSX2 экспрессируется его ближайший гомолог GSX1 и NKX2.1. Таким образом, в зубчатой извилине взрослого мозга формируется 4 различных субдомена: PAX6-положительный, PAX6/GSX2-положительный, GSX1-положительный латеральный и медиальный субдомены и GSX1/NKX2.1-положительный вентральный субдомен [37, 82]. Показано, что инактивация PAX6 и GSX2 приводит к потере отдельных подмножеств нейронов, в частности тирозингидроксилаза-положительных и кальретинин-гломерулярных нейронов, что свидетельствует о важности региональной идентичности НСК как в эмбриональном, так и во взрослом мозге [9, 82, 204]. Однако в ответ на инактивацию GSX2 в эмбриональном мозге компенсаторно расширяются зоны PAX6-положительного дорсального домена и GSX1-положительного вентрального домена, чего не наблюдается во взрослом мозге [82]. Кроме того, доля утраченных популяций нейронов при инактивации GSX2 во взрослом мозге значительно меньше, чем в эмбриональном, что говорит об ограниченной роли GSX2 во взрослом мозге [82]. Для регенеративной медицины очень важно, что GSX2 участвует в специфической регуляции нейрогенеза в ответ на повреждение мозга у взрослых млекопитающих. Обнаружено, что при постишемическом нейрогенезе экспрессия GSX2 в зубчатой извилине затрагивает те субдомены, в которых отсутствует в норме, а направленное ингибирование экспрессии GSX2 в НСК зубчатой извилины останавливает посттравматический нейрогенез [82]. Еще одно различие между экспрессией GSX2 в эмбриональном и взрослом мозге состоит в ограничении распространения GSX2 среди субпопуляций НСК зубчатой извилины: в эмбриональном мозге экспрессия GSX2 длится до самых поздних стадий, а во взрослом мозге она ограничена переходом от НСК к нейробластам через стадию транзиторно амплифицирующихся предшественников [82]. Интересно, что на этом этапе GSX2 практически одновременно и активирует, и блокирует дальнейший нейрогенез, то есть, чтобы НСК перешли в транзиторно амплифицирующиеся клетки-предшественники и нейробласты, необходимо сначала активировать, а затем ингибировать экспрессию этого транскрипционного фактора. Предполагается, что основная роль GSX2 во взрослом мозге заключается в привлечении НСК в клеточный цикл.
Фактор транскрипции DLX
Факторы транскрипциии семейства DLX (DLX1, DLX2, DLX5 и DLX6) регулируют дифференцировку НСК в преоптической зоне в ГАМКергические нейроны [205]. DLX1 и DLX2 функционально избыточны, так как их раздельное ингибирование не приводит к серьезным нарушениям дифференцировки, но совместный нокаут их генов значительно снижает эффективность образования ГАМКергических нейронов [206]. По отношению к GSX2 факторы DLX1 и DLX2 задействованы в нижележащем сигнальном каскаде и их экспрессия зависят от уровня GSX2. Так, при переходе от транзиторных амплифицирующихся клеток-предшественников к нейробластам экспрессия GSX2 сменяется именно на экспрессию DLX. Также эктопическая экспрессия GSX1 или GSX2 может индуцировать устойчивую экспрессию MASH1 и DLX во многих областях конечного мозга [207]. Сходная связь между GSX1 и GSX2, MASH1 и DLX в восходящем и нисходящем направлениях обнаружена в мозге взрослого человека. Экспрессия MASH1 и DLX снижается в дорсолатеральной области зубчатой извилины при ингибировании GSX2 [82]; условная инактивация ASCL1 и DLX приводит к серьезной потере нейрогенеза во взрослых НСК [178]. В целом, эти результаты показывают, что генетический каскад GSX2/MASH1/DLX участвует в координации нейрогенеза в эмбриональном и взрослом мозге. Исследования прямого репрограммирования и роли ASCL1 в нем показали, что активация комплекса нижележащих генов: ZFP238, SOX8 и DLX3 ‒ ключевой момент работы генной сети ASCL1 [181].
Фактор транскрипции MYT1L
Первичный транскрипционный фактор MYT1L (myelin transcription factor 1 like) – онтогенетический репрессор REST (RE1-silencing transcription factor) и Groucho (transducin-like enhancer; TLE), блокирующий активацию пронейрональных генных сетей. Репрессорная функция MYT1L опосредуется рекрутированием комплекса, содержащего SIN3B, путем связывания с ранее не охарактеризованным N-концевым доменом [186]. В соответствии с его репрессорной функцией сайты связывания MYT1L сходны в нейронах и фибробластах и преимущественно находятся в открытой конфигурации хроматина. MYT1L подавляет путь передачи сигналов Notch через супрессию экспрессии нескольких его членов, включая HES1 [186]. Нокдаун MYT1L в развивающемся мозге мыши имитирует фенотип, опосредованный активацией пути Notch, подтверждая, что MYT1L позволяет эмбриональным нейронам избегать активации пути Notch во время нормального развития. Истощение MYT1L в первичных постмитотических нейронах активирует непронейрональные программы и нарушает экспрессию и функционирование нейрональных генов [186]. Выше описано, как MYT1L может использоваться в прямом репрограммировании, где он выступает как первичный транскрипционный фактор, моделирующий конфигурацию хроматина и подавляющий миогенные программы клетки [180, 185‒187].
МикроРНК
Помимо транскрипционных факторов для прямого пронейрального репрограммирования используются также микроРНК. Это класс некодирующих РНК длиной 20‒25 нуклеотидов, которые регулируют стабильность и трансляцию своей мРНК-мишени посредством связывания с ее 3'-нетранслируемой областью (UTR) или с кодирующей последовательностью [208]. МикроРНК регулируют различные биологические процессы на всех стадиях развития организма, множество разных микроРНК участвует и в нейрогенезе. К ним относится miR-19, которая в эмбриональном нейрогенезе стимулирует пролиферацию НСК и экспансию радиальных клеток глии [208]. Кластер miR-17-92, наоборот, ингибирует экспрессию TBR2, предотвращая переход радиальных клеток глии в нейрональные промежуточные клетки-предшественники [209]. miR-184, miR-let-7b, miR-137, miR-9 и miR-124, о которых мы поговорим далее, оказывают регуляторное действие на нейрогенез у взрослых путем нацеливания на различные нейронально экспрессируемые гены [210‒213].
miR-184 экспрессируется под действием MBD1 (methyl-CpG-binding domain protein 1), который способен модифицировать структуру хроматина через взаимодействие с SETDB1 ‒ гистон-лизин-N-метилтрансферазой. Повышение экспрессии miR-184 снижает уровень мРНК MBD1 с образованием отрицательной петли обратной связи, что способствует пролиферации и ингибирует дифференцировку НСК [213]. Известная мишень miR-184 ‒ ген NUMB, играющий важную роль в функционировании эмбриональных НСК и развитии коры [214]. Напротив, miR-let-7b способствует подавлению пролиферации и стимулирует дифференцировку нейронов через взаимодействие с генами TLX и CCND1, последний из которых кодирует циклин D1 [212].
miR-137 экспрессируется в мозге и способствует дифференцировке НСК через регуляторную петлю с транскрипционным корепрессором TLX, снижая уровень мРНК лизинспецифичной гистон-деметилазы-1 (LSD1), которая, в свою очередь, подавляет транскрипцию miR-137 [211]. Известно, что MSI1 и miR-137 имеют противоположные паттерны воздействия на клетки [215]. Также показано, что дисфункция miR-137 способствует развитию некоторых типов рака человека, таких как нейробластома [216] и мультиформная глиобластома [217]. Обнаружено, что miR-137 может непосредственно нацеливаться на гистон-деметилазу JARID1B (ген KDM5B) ‒ что приводит к дифференцировке ЭСК мыши [218], ‒ экспрессируется в митотической фазе клеточного цикла и сильно активируется во время дифференцировки ЭСК в нервные клетки [219]. Эта активация приводит к репрессии двух факторов транскрипции ЭСК: KLF4 и TBX3, ‒ на которые непосредственно воздействует miR-137. Противоположный эффект miR-137 в модуляции пролиферации и дифференцировки обнаружен в НСК взрослого мозга. Так, miR-137 усиливает пролиферацию и ингибирует дифференцировку посредством посттранскрипционной супрессии EZH2 [220]. На основании этих результатов логично предположить, что выполняемая miR-137 роль определяется контекстом. Интересно, что наличие хотя бы одного функционального аллеля miR-137 важно для нормального эмбрионального развития [221]. Также miR-137 вовлечена в развитие многих психических заболеваний, таких как шизофрения, большое депрессивное расстройство, болезнь Хантингтона [221] и другие.
miR-9 ‒ одна из наиболее высокоэкспрессируемых древних микроРНК в развивающемся и зрелом мозге позвоночных [222, 223]. Это универсальная многопрофильная микроРНК, регулирующая самые разные процессы. Ее уровни экспрессии динамически регулируются во время развития мозга и во время индуцированного in vitro нейрогенеза [224]. Если для подавляющего большинства микроРНК после ассоциации их дуплексов с комплексом RISC сохраняется только одна цепь (5' или 3'), то в случае miR-9 направляющая цепь может быть сгенерирована либо из 5'- (miR-9-5p/miR-9), либо из 3'-плеча (miR-9-3p/miR-9*) ‒ в зависимости от рассматриваемого гена [225]. Экспрессия miR-9 впервые происходит в середине эмбриогенеза, после специализации основных подразделов мозга, сначала в конечном мозге, а затем распространяется на более каудальные области головного и спинного мозга. Во всей ЦНС экспрессия miR-9 преимущественно связана с областями желудочковых НПК [226], хотя некоторые дифференцированные нейроны также экспрессируют miR-9, особенно в дорсальном конечном мозге и спинном мозге [224]. Экспрессия miR-9 определяет активные нейрогенные области и регулируется сигнальным каскадом Notch [226]. В экспериментах in vitro показано, что miR-9/9* способствует дифференцировке взрослых НСК, но только совместно с малыми молекулами форсколина или RA [227]. Также выявлена возможность прямого репрограммирования фетальных фибробластов человека в постмитотические нейроны лентивирусными векторами, содержащими miR-9/9* и miR-124, посредством активации NEUROD2. Однако это преобразование зависит от экспрессии всех трех микроРНК [110]. Удивительно, но ингибирование miR-9 индуцирует повышенную пролиферацию эмбриональных НПК [226] или НСК взрослых мышей [227], но с последующим возобновлением дифференцировки [226], что говорит о факультативности контроля miR-9 над НПК и НСК. Сообщалось, что miR-9 может выполнять противоположные функции, что зависит от клеточного контекста и, вероятно, связано с дифференциальной экспрессией мРНК-мишеней и синергизмом между miR-9 и другими факторами, регулирующими мРНК [224]. У miR-9 много мРНК-мишеней. К ним, например, относятся гены семейства HES ‒ основные эффекторы передачи сигналов Notch и ингибиторы дифференцировки путем репрессии пронейральных генов, таких как MASH1 [228]. Некоторые другие мишени miR-9 также контролируют пролиферацию НПК. К ним относятся факторы транскрипции FOXG1 [224], GSX2 [224], TLX/NR2E1 [229] и ZIC5 [229]. miR-9 и TLX образуют отрицательную петлю обратной связи ‒ чтобы способствовать преждевременной дифференцировке нейронов [229, 230]. Интересно, что miR-9 также участвует в ремоделировании ландшафта микроРНК в нервных клетках, например, ингибируя плюрипотентные факторы LIN28A и LIN28B ‒ РНК-связывающие белки, которые блокируют процессинг некоторых микроРНК, включая miR-let-7 [230]. miR-9 стимулирует дифференцировку нейронов, ингибируя экспрессию факторов пролиферации и специфических для предшественников эпигенетических факторов [226]. Экспрессию miR-9 можно обнаружить и на более поздних этапах развития клетки. Так, miR-9 временно экспрессируется во время дифференцировки мотонейронов спинного мозга, расположенных в боковой моторной колонке и иннервирующих мышцы конечностей. Это действие miR-9 обусловлено ее взаимодействием со своими мишенями: FOXP1 и ISL1/2, ‒ которые экспрессируются в мотонейронах [231]. Кроме того, выявлено участие miR-9 в созревании корковых нейронов ‒ ее экспрессию обнаружили в аксонах и дендритах дифференцированных нейронов [224].
miR-124 ‒ еще одна распространенная в нейральных клетках микроРНК. Считается, что miR-124 способствует дифференцировке НСК, ингибируя экспрессию SOX9, что подтверждается сохранением мультипотентности НСК при нокдауне miR-124 в SVZ [232]. Экспрессия miR-124 обнаружена в резидентной микроглии ЦНС, что, возможно, связано с горизонтальным переносом микроРНК из нейронов в глию [233]. В результате макрофаги подавляли маркеры активации главного комплекса гистосовместимости (MHC) класса II и CD45 в клетках микроглии [234]. Кроме классического эксперимента, доказавшего эффективность прямого репрограммирования фибробластов человека с помощью miR-9/9* и miR-124 [110], есть исследование, в котором продемонстрирована возможность прямого репрограммирования первичных дермальных фибробластов взрослого человека в функциональные нейроны с использованием “коктейля” из miR-124 и факторов транскрипции MYT1L и BRN2 [111].
Малые молекулы
Эпигенетический метод прямого репрограммирования реализуется с помощью малых молекул ‒ низкомолекулярных соединений, влияющих на основные сигнальные пути клетки, доступность и состояние хроматина, метаболизм, активность цитоскелета и т.д. [235, 236]. Несмотря на то, что в некоторых работах продемонстрирована самодостаточность малых молекул как факторов прямого пронейронального репрограммирования [237, 238], метод характеризуется низкой воспроизводимостью, недостаточной специфичностью и, как следствие, большой вариабельностью результатов [239]. В связи с этим большинство исследователей использует малые молекулы вместе с другими факторами репрограммирования. Очень важным вспомогательным направлением при прямом пронейральном репрограммировании считается изменение эпигенетического фона первичной клетки, которая чаще всего имеет мезодермальное происхождение. В первую очередь, этого можно добиться с помощью молекул, повышающих доступность ДНК трансформируемых клеток: вальпроевой кислоты, N-фталил-L-триптофана (RG108)) [239] ‒ и ингибирующих мезодермальную дифференцировку. Например, используя белок Noggin и малую молекулу А-83-01, ингибируют передачу сигналов TGF-β, SMAD и ALK (anaplastic lymphoma kinase) [239]. Значительно повышают эффективность преобразования молекулы, поддерживающие жизнедеятельность и пролиферацию, такие как форсколин, опосредующий активацию аденилатциклазы [134, 240], и Y-27632, ингибирующий RHO-ассоциированную протеинкиназу (ROCK) [241]. Кроме того, существуют малые молекулы, влияние которых на мезодермально-эктодермальный переход более явное. Например, CHIR99021 ингибирует GSK3β (glycogen synthase kinase 3 beta), тем самым активируя сигнальный путь Wnt, который, как упоминалось выше, принимает участие в контроле нейрогенеза; а изоксазол-9 (ISX9) ‒ через опосредованную активацию транскрипционных факторов семейства MEF2 (myocyte enhancer factor-2) регулирует активность таких нейральных транскрипционных факторов, как NEUROD, ASCL1 и BRN2 [242‒245]. Использование вспомогательных факторов позволяет значительно облегчить процесс преобразования и направленной дифференцировки и минимизировать число транскрипционных факторов. Так, с помощью NGN2, ASCL1, белка Noggin и коктейля малых молекул (CHIR-99021, SB-431542, LDN-193189, A-83–01, форсколин и дибутирил-cAMP) удалось репрограммировать человеческие фибробласты в функциональные нейроны [246].
ЗАКЛЮЧЕНИЕ
В результате проведенного анализа многочисленных протоколов репрограммирования выявлено, что практически все они основаны на использовании первичных и вторичных факторов транскрипции, опосредующих нейрогенез в эмбриональном и взрослом мозге. Наиболее часто успех репрограммирования обеспечивают SOX2, PAX6, MSI1 ASCL1, BRN2, нейрогенины, NEUROD1, MYT1L, GSX2 и DLX. Получаемые в результате прямого репрограммирования клеточные типы крайне разнообразны ‒ от стволоподобных нейральных предшественников/нейральных прогениторных клеток и клеток, имеющих характеристики радиальной глии, до нейробластов и “молодых” нейронов, экспрессирующих основные нейрональные маркеры. Гораздо в меньшем числе исследований в результате прямого репрограммирования удалось получить терминально дифференцированные типы нейронов: промежуточные, моторные, сенсорные и осуществляющие специализированную нейротрансмиссию. В отличие от технологии iPSC при получении drNPC большое значение имеет эпигенетический контекст исходных клеток. К важным аспектам относится инактивация супрессии нейронспецифичных генов в исходных соматических клетках, а также преодоление исходной “глиогенности” микроокружения взрослого мозга. Моделирование микроокружения возможно с помощью различных подходов, например применения гидрогелей, содержащих пронейрональные факторы роста, микроРНК и малые молекулы, белки внеклеточного матрикса, биологически активные самособирающиеся пептиды и др. [247‒251].
Авторы благодарят Марию Андреевну Лагарькову за консультативную помощь в написании обзора.
Работа выполнена при финансовой поддержке гранта РНФ 16-15-10432.
Cтатья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Takahashi K., Yamanaka S. (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126(4), 663–676.
Ahlfors J.E., Azimi A., El-Ayoubi R., Velumian A., Vonderwalde I., Boscher C., Mihai O., Mani S., Samoilova M., Khazaei M., Fehlings M.G., Morshead C.M. (2019) Examining the fundamental biology of a novel population of directly reprogrammed human neural precursor cells. Stem Cell Res. Ther. 10(1), 166.
Tanabe K., Ang C.E., Chanda S., Olmos V.H., Haag D., Levinson D.F., Südhof T.C., Wernig M. (2018) Transdifferentiation of human adult peripheral blood T cells into neurons. Proc. Natl. Acad. Sci. USA. 115(25), 6470–6475.
Mall M., Wernig M. (2017) The novel tool of cell reprogramming for applications in molecular medicine. J. Mol. Med. (Berl.). 95(7), 695–703.
Tanabe K., Haag D., Wernig M. (2015). Direct somatic lineage conversion. Philos. Trans. R. Soc. Lond. B Biol. Sci. 370(1680), 20140368.
Kanning K.C., Kaplan A., Henderson C.E. (2010) Motor neuron diversity in development and disease. Annu. Rev. Neurosci. 33, 409–440.
Koch P., Breuer P., Peitz M., Jungverdorben J., Kesavan J., Poppe D., Doerr J., Ladewig J., Mertens J., Tüting T., Hoffmann P., Klockgether T., Evert B.O., Wüllner U., Brüstle O. (2011) Excitation-induced ataxin-3 aggregation in neurons from patients with Machado–Joseph disease. Nature. 480(7378), 543–546.
Brennand K.J., Simone A., Jou J., Gelboin-Burk-hart C., Tran N., Sangar S., Li Y., Mu Y., Chen G., Yu D., McCarthy S., Sebat J., Gage F.H. (2011) Mo-delling schizophrenia using human induced pluripotent stem cells. Nature. 473(7346), 221–225.
Götz M., Nakafuku M., Petrik D. (2016) Neurogenesis in the developing and adult brain-similarities and key differences. Cold Spring Harb. Perspect. Biol. 8(7), a018853.
Miller J.D., Ganat Y.M., Kishinevsky S., Bowman R.L., Liu B., Tu E.Y., Mandal P.K., Vera E., Shim J.W., Kriks S., Taldone T., Fusaki N., Tomishima M.J., Krainc D., Milner T.A., Rossi D.J., Studer L. (2013) Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell. 13(6), 691–705.
Victor M.B., Richner M., Olsen H.E., Lee S.W., Monteys A.M., Ma C., Huh C.J., Zhang B., Davidson B.L., Yang X.W., Yoo A.S. (2018) Striatal neurons directly converted from Huntington’s disease patient fibroblasts recapitulate age-associated disease phenotypes. Nat. Neurosci. 21(3), 341–352.
Tao Y., Zhang S.C. (2016) Neural subtype specification from human pluripotent stem cells. Cell Stem Cell. 19(5), 573–586.
Gouti M., Metzis V., Briscoe J. (2015) The route to spinal cord cell types: a tale of signals and switches. Trends Genet. 31(6), 282–289.
Henrique D., Abranches E., Verrier L., Storey K.G. (2015) Neuromesodermal progenitors and the making of the spinal cord. Development. 142(17), 2864–2875.
Appolloni I., Calzolari F., Corte G., Perris R., Mala-testa P. (2008) Six3 controls the neural progenitor status in the murine CNS. Cereb. Cortex. 18(3), 553–562.
Kirkeby A., Grealish S., Wolf D.A., Nelander J., Wood J., Lundblad M., Lindvall O., Parmar M. (2012) Generation of regionally specified neural progenitors and functional neurons from human embryonic stem cells under defined conditions. Cell Rep. 1(6), 703–714.
Kee N., Volakakis N., Kirkeby A., Dahl L., Storvall H., Nolbrant S., Lahti L., Björklund Å.K., Gillberg L., Joodmardi E., Sandberg R., Parmar M., Perlmann T. (2016) Single-cell analysis reveals a close relationship between differentiating dopamine and subthalamic nucleus neuronal lineages. Cell Stem Cell. 20(1), 29–40.
del Corral R.D., Olivera-Martinez I., Goriely A., Gale E., Maden M., Storey K. (2003) Opposing FGF and retinoid pathways control ventral neural pattern, neuronal differentiation, and segmentation during body axis extension. Neuron. 40(1), 65–79.
Shum A.S., Poon L.L., Tang W.W., Koide T., Chan B.W., Leung Y.C., Shiroishi T., Copp A.J. (1999) Retinoic acid induces down-regulation of Wnt3a, apoptosis and diversion of tail bud cells to a neural fate in the mouse embryo. Mech. Dev. 84(1‒2), 17–30.
Olivera-Martinez I., Harada H., Halley P.A., Storey K.G. (2012) Loss of FGF-dependent mesoderm identity and rise of endogenous retinoid signalling determine cessation of body axis elongation. PLoS Biol. 10(10), e1001415.
Kumar S., Duester G. (2014) Retinoic acid controls body axis extension by directly repressing Fgf8 transcription. Development. 141(15), 2972–2977.
Kiecker C., Lumsden A. (2012) The role of organizers in patterning the nervous system. Annu. Rev. Neurosci. 35. 347–367.
Le Dreau G., Marti E. (2012) Dorsal-ventral patterning of the neural tube: a tale of three signals. Dev. Neurobiol. 72(12), 1471–1481.
Briscoe J., Pierani A., Jessell T.M., Ericson J. (2000) A homeodomain protein code specifies progenitor cell identity and neuronal fate in the ventral neural tube. Cell. 101(4), 435–445.
Alaynick W.A., Jessell T.M., Pfaff S.L. (2011) SnapShot: spinal cord development. Cell. 146(1), 178.
Simoes-Costa M., Bronner M.E. (2015) Establishing neural crest identity: a gene regulatory recipe. Development. 142(2), 242–257.
Molyneaux B.J., Arlotta P., Menezes J.R., Macklis J.D. (2007) Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci. 8(6), 427–437.
Campbell K. (2003) Dorsal-ventral patterning in the mammalian telencephalon. Curr. Opin. Neurobiol. 13(1), 50–56.
Kudoh T., Wilson S.W., Dawid I.B. (2002) Distinct roles for Fgf, Wnt and retinoic acid in posteriorizing the neural ectoderm. Development. 129(18), 4335–4346.
Marin O., Rubenstein J.L. (2003) Cell migration in the forebrain. Annu. Rev. Neurosci. 26, 441–483.
Wichterle H., Turnbull D.H., Nery S., Fishell G., Alvarez-Buylla A. (2001) In utero fate mapping reveals distinct migratory pathways and fates of neurons born in the mammalian basal forebrain. Development. 128(19), 3759–3771.
Quinn J.C., Molinek M., Martynoga B.S., Zaki P.A., Faedo A., Bulfone A., Hevner R.F., West J.D., Price D.J. (2007) Pax6 controls cerebral cortical cell number by regulating exit from the cell cycle and specifies cortical cell identity by a cell autonomous mechanism. Dev. Biol. 302(1), 50–65.
Xu Q., Guo L., Moore H., Waclaw R.R., Campbell K., Anderson S.A. (2010) Sonic hedgehog signaling confers ventral telencephalic progenitors with distinct cortical interneuron fates. Neuron. 65(3), 328–340.
Carney R.S., Cocas L.A., Hirata T., Mansfield K., Corbin J.G. (2009) Differential regulation of telencephalic pallial-subpallial boundary patterning by Pax6 and Gsh2. Cereb. Cortex. 19(4), 745–759.
Toresson H., Potter S.S., Campbell K. (2000) Genetic control of dorsal-ventral identity in the telencephalon: opposing roles for Pax6 and Gsh2. Development. 127(20), 4361–4371.
Young K.M., Fogarty M., Kessaris N., Richardson W.D. (2007) Subventricular zone stem cells are heterogeneous with respect to their embryonic origins and neurogenic fates in the olfactory bulb. J. Neurosci. 27(31), 8286–8296.
Stenman J., Toresson H., Campbell K. (2003) Identification of two distinct progenitor populations in the lateral ganglionic eminence: implications for striatal and olfactory bulb neurogenesis. J. Neurosci. 23(1), 167–174.
Gaspard N., Bouschet T., Hourez R., Dimidschstein J., Naeije G., van den Ameele J., Espuny-Camacho I., Herpoel A., Passante L., Schiffmann S.N., Gaillard A., Vanderhaeghen P. (2008) An intrinsic mechanism of corticogenesis from embryonic stem cells. Nature. 455(7211), 351–357.
Mattar P., Britz O., Johannes C., Nieto M., Ma L., Rebeyka A., Klenin N., Polleux F., Guillemot F., Schuurmans C. (2004) A screen for downstream effectors of Neurogenin2 in the embryonic neocortex. Dev. Biol. 273(2), 373–389.
Parras C.M., Schuurmans C., Scardigli R., Kim J., Anderson D.J., Guillemot F. (2002) Divergent functions of the proneural genes Mash1 and Ngn2 in the specification of neuronal subtype identity. Genes Dev. 16(3), 324–338.
Schuurmans C., Guillemot F. (2002) Molecular mechanisms underlying cell fate specification in the developing telencephalon. Curr. Opin. Neurobiol. 12(1), 26–34.
Schuurmans C., Armant O., Nieto M., Stenman J.M., Britz O., Klenin N., Brown C., Langevin L.M., Seibt J., Tang H., Cunningham J.M., Dyck R., Walsh C., Campbell K., Polleux F., Guillemot F. (2004) Sequential phases of cortical specification involve Neurogenin-dependent and -independent pathways. EMBO J. 23(14), 2892–2902.
Galichet C., Guillemot F., Parras C.M. (2008) Neurogenin 2 has an essential role in development of the dentate gyrus. Development. 135(11), 2031–2041.
Wonders C.P., Anderson S.A. (2006) The origin and specification of cortical interneurons. Nat. Rev. Neurosci. 7(9), 687–696.
Molyneaux B.J., Arlotta P., Fame R.M., MacDonald J.L., MacQuarrie K.L., Macklis J.D. (2009) Novel subtype-specific genes identify distinct subpopulations of callosal projection neurons. J. Neurosci. 29(39), 12343–12354.
Parras C.M., Galli R., Britz O., Soares S., Galichet C., Battiste J., Johnson J.E., Nakafuku M., Vescovi A., Guillemot F. (2004) Mash1 specifies neurons and oligodendrocytes in the postnatal brain. EMBO J. 23(22), 4495–4505.
Wang B., Waclaw R.R., Allen Z.J., Guillemot F., Campbell K. (2009) Ascl1 is a required downstream effector of Gsx gene function in the embryonic mouse telencephalon. Neural Dev. 4, 5.
Fragkouli A., van Wijk N.V., Lopes R., Kessaris N., Pachnis V. (2009) LIM homeodomain transcription factor-dependent specification of bipotential MGE progenitors into cholinergic and GABAergic striatal interneurons. Development. 136(22), 3841–3851.
Liodis P., Denaxa M., Grigoriou M., Akufo-Addo C., Yanagawa Y., Pachnis V. (2007) Lhx6 activity is required for the normal migration and specification of cortical interneuron subtypes. J. Neurosci. 27(12), 3078–3089.
Zhao Y., Marin O., Hermesz E., Powell A., Flames N., Palkovits M., Rubenstein J.L., Westphal H. (2003) The LIM-homeobox gene Lhx8 is required for the deve-lopment of many cholinergic neurons in the mouse forebrain. Proc. Natl. Acad. Sci. USA. 100(15), 9005–9010.
Long J.E., Cobos I., Potter G.B., Rubenstein J.L. (2009) Dlx1&2 and Mash1 transcription factors control MGE and CGE patterning and differentiation through parallel and overlapping pathways. Cereb. Cortex. 19(Suppl. 1), i96–i106.
Petryniak M.A., Potter G.B., Rowitch D.H., Rubenstein J.L. (2007) Dlx1 and Dlx2 control neuronal versus oligodendroglial cell fate acquisition in the developing forebrain. Neuron. 55(3), 417–433.
Yu W., Wang Y., McDonnell K., Stephen D., Bai C.B. (2009) Patterning of ventral telencephalon requires positive function of Gli transcription factors. Dev. Biol. 334(1), 264–275.
Fuccillo M., Rallu M., McMahon A.P., Fishell G. (2004) Temporal requirement for hedgehog signaling in ventral telencephalic patterning. Development. 131(20), 5031–5040.
Kriks S., Shim J.W., Piao J., Ganat Y.M., Wakeman D.R., Xie Z., Carrillo-Reid L., Auyeung G., Antonacci C., Buch A., Yang L., Beal M.F., Surmeier D.J., Kordo-wer J.H., Tabar V., Studer L. (2011) Dopamine neurons derived from human ES cells efficiently engraft in animal models of Parkinson’s disease. Nature. 480(7378), 547–551.
Gross C.G. (2000) Neurogenesis in the adult brain: death of a dogma. Nat. Rev. Neurosci. 1(1), 67–73.
Jurkowski M.P., Bettio L., K Woo E., Patten A., Yau S.Y., Gil-Mohapel J. (2020) Beyond the hippocampus and the SVZ: adult neurogenesis throughout the brain. Front. Cell. Neurosci. 14, 576444.
Fares J., Bou Diab Z., Nabha S., Fares Y. (2019) Neurogenesis in the adult hippocampus: history, regulation, and prospective roles. Int. J. Neurosci. 129(6), 598–611.
Toda T., Parylak S.L., Linker S.B., Gage F.H. (2019) The role of adult hippocampal neurogenesis in brain health and disease. Mol. Psychiatry. 24(1), 67–87.
Fuentealba L.C., Rompani S.B., Parraguez J.I., Obernier K., Romero R., Cepko C.L., Alvarez-Buylla A. (2015) Embryonic origin of postnatal neural stem cells. Cell. 161(7), 1644–1655.
Abbott L.C., Nigussie F. (2020) Adult neurogenesis in the mammalian dentate gyrus. Anat. Histol. Embryol. 49(1), 3–16.
Kempermann G., Song H., Gage F.H. (2015) Neurogenesis in the adult hippocampus. Cold Spring Harb. Perspect. Biol. 7(9), a018812.
Nieto-Estevez V., Oueslati-Morales C.O., Li L., Pickel J., Morales A.V., Vicario-Abejon C. (2016) Brain insulin-like growth factor-I directs the transition from stem cells to mature neurons during postnatal/ adult hippocampal neurogenesis. Stem Cells. 34(8), 2194–2209
Salvi R., Steigleder T., Schlachetzki J. C., Waldmann E., Schwab S., Winner B., Winkler J., Kohl Z. (2016) Distinct effects of chronic dopaminergic stimulation on hippocampal neurogenesis and striatal doublecortin expression in adult mice. Front. Neurosci. 10, 77.
Kohl Z., Ben Abdallah N., Vogelgsang J., Tischer L., Deusser J., Amato D., Anderson S., Müller C.P., Riess O., Masliah E., Nuber S., Winkler J. (2016) Severely impaired hippocampal neurogenesis associates with an early serotonergic deficit in a BAC α-synuclein transgenic rat model of Parkinson’s disease. Neurobiol. Dis. 85, 206–217.
Danzer S.C., Kotloski R.J., Walter C., Hughes M., McNamara J.O. (2008) Altered morphology of hippocampal dentate granule cell presynaptic and postsy-naptic terminals following conditional deletion of TrkB. Hippocampus. 18(7), 668–678.
Gonçalves J.T., Schafer S.T., Gage F.H. (2016) Adult neurogenesis in the hippocampus: from stem cells to behavior. Cell. 167(4), 897–914.
Ampuero E., Jury N., Hartel S., Marzolo M.P., van Zundert B. (2017) Interfering of the Reelin/ ApoER2/PSD95 signaling axis re-activates dendritogenesis of mature hippocampal neurons. J. Cell. Physiol. 232(5), 1187–1199.
Zhang D., Wang X., Lu X.Y. (2016) Adiponectin exerts neurotrophic effects on dendritic arborization, spinogenesis, and neurogenesis of the dentate gyrus of male mice. Endocrinology. 157(7), 2853–2869.
Bengoa-Vergniory N., Kypta R.M. (2015) Canonical and nonca- nonical Wnt signaling in neural stem/progenitor cells. Cell. Mol. Life Sci. 72(21), 4157–4172.
Obernier K., Alvarez-Buylla A. (2019) Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain. Development. 146(4), dev156059.
Mich J.K., Signer R.A.J., Nakada D., Pineda A., Burgess R.J., Vue T.Y., Johnson J.E., Morrison S.J. (2014) Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain. eLife. 3, e02669.
Ponti G., Obernier K., Alvarez-Buylla A. (2013) Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12(11), 1649–1650.
Taverna E., Götz M., Huttner W.B. (2014) The cell biology of neurogenesis: toward an understanding of the development and evolution of the neocortex. Annu. Rev. Cell Dev. Biol. 30, 465–502.
Paez-Gonzalez P., Abdi K., Luciano D., Liu Y., Soriano-Navarro M., Rawlins E., Bennett V., Garcia-Verdugo J.M., Kuo C.T. (2011) Ank3-dependent SVZ niche assembly is required for the continued production of new neurons. Neuron. 71(1), 61–75.
Fuentealba L.C., Obernier K., Alvarez-Buylla A. (2012) Adult neural stem cells bridge their niche. Cell Stem Cell. 10(6), 698–708.
Mira H., Andreu Z., Suh H., Lie D.C., Jessberger S., Consiglio A., San Emeterio J., Hortigüela R., Marqués-Torrejón M.A., Nakashima K., Colak D., Götz M., Fariñas I., Gage F.H. (2010) Signaling through BMPR-IA regulates quiescence and long-term activity of neural stem cells in the adult hippocampus. Cell Stem Cell. 7(1), 78–89.
Barnabé-Heider F., Göritz C., Sabelström H., Takebayashi H., Pfrieger F.W., Meletis K., Frisén J. (2010) Origin of new glial cells in intact and injured adult spinal cord. Cell Stem Cell. 7(4), 470–482.
Torper O., Pfisterer U., Wolf D.A., Pereira M., Lau S., Jakobsson J., Björklund A., Grealish S., Parmar M. (2013) Generation of induced neurons via direct conversion in vivo. Proc. Natl. Acad. Sci. USA. 110(17), 7038–7043.
Grande A., Sumiyoshi K., López-Juárez A., Howard J., Sakthivel B., Aronow B., Campbell K., Nakafuku M. (2013) Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nat. Commun. 4, 2373.
Ninkovic J., Steiner-Mezzadri A., Jawerka M., Akinci U., Masserdotti G., Petricca S., Fischer J., von Holst A., Beckers J., Lie C.D., Petrik D., Miller E., Tang J., Wu J., Lefebvre V., Demmers J., Eisch A., Metzger D., Crabtree G., Irmler M., Poot R., Götz M. (2013) The BAF complex interacts with Pax6 in adult neural progenitors to establish a neurogenic cross-regulatory transcriptional network. Cell Stem Cell. 13(4), 404–408.
López-Juárez A., Howard J., Ullom K., Howard L., Grande A., Pardo A., Waclaw R., Sun Y.Y., Yang D., Kuan C.Y., Campbell K., Nakafuku M. (2013) Gsx2 controls region-specific activation of neural stem cells and injury-induced neurogenesis in the adult subventricular zone. Genes Dev. 27(11), 1272–1287.
Costa M.R., Ortega F., Brill M.S., Beckervordersandforth R., Petrone C., Schroeder T., Götz M., Berninger B. (2011) Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138(6), 1057–1068.
Haubst N., Berger J., Radjendirane V., Graw J., Favor J., Saunders G.F., Stoykova A., Götz M. (2004) Molecular dissection of Pax6 function: the specific roles of the paired domain and homeodomain in brain development. Development. 131(24), 6131–6140.
Sohn J., Orosco L., Guo F., Chung S.H., Bannerman P., Mills Ko E., Zarbalis K., Deng W., Pleasure D. (2015) The subventricular zone continues to generate corpus callosum and rostral migratory stream astroglia in normal adult mice. J. Neurosci. 35(9), 3756–3763.
Arai Y., Pulvers J.N., Haffner C., Schilling B., Nüsslein I., Calegari F., Huttner W.B. (2011) Neural stem and progenitor cells shorten S-phase on commitment to neuron production. Nat. Commun. 2, 154.
Bonaguidi M.A., Wheeler M.A., Shapiro J.S., Stadel R.P., Sun G.J., Ming G.L., Song H. (2011) In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145(7), 1142–1155.
Lugert S., Vogt M., Tchorz J.S., Müller M., Giachino C., Taylor V. (2012) Homeostatic neurogenesis in the adult hippocampus does not involve amplification of Ascl1 (high) intermediate progenitors. Nat. Commun. 3, 670.
Ortega F., Gascón S., Masserdotti G., Deshpande A., Simon C., Fischer J., Dimou L., Chichung Lie D., Schroeder T., Berninger B. (2013) Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat. Cell Biol. 15(6), 602–613.
Gascón S., Masserdotti G., Russo G.L., Götz M. (2017) Direct neuronal reprogramming: achievements, hurdles, and new roads to success. Cell Stem Cell. 21(1), 18‒34.
Colasante G., Rubio A., Massimino L., Broccoli V. (2019) Direct neuronal reprogramming reveals unknown functions for known transcription factors. Front. Neurosci. 13, 283.
Thier M.C., Hommerding O., Panten J., Pinna R., García-González D., Berger T., Wörsdörfer P., Assenov Y., Scognamiglio R., Przybylla A., Kaschutnig P., Becker L., Milsom M.D., Jauch A., Utikal J., Herrmann C., Monyer H., Edenhofer F., Trumpp A. (2019) Identification of embryonic neural plate border stem cells and their generation by direct reprogramming from adult human blood cells. Cell Stem Cell. 24(1), 166–182.
Zhu S., Ambasudhan R., Sun W., Kim H.J., Talantova M., Wang X., Zhang M., Zhang Y., Laurent T., Parker J., Kim H.S., Zaremba J.D., Saleem S., Sanz-Blasco S., Masliah E., McKercher S.R., Cho Y.S., Lipton S.A., Kim J., Ding S. (2014) Small molecules enable OCT4-mediated direct reprogramming into expandable human neural stem cells. Cell Res. 24(1), 126–129.
Yu K.R., Shi J.H., Ki J.J., Koo M.G., Lee J.Y., Choi S.W., Kim H.S., Seo Y., Lee S., Shin T.H., Jee M.K., Kim D.W., Jung S.J., Shin S., Han D.W., Kang K.S. (2015) Rapid and efficient direct conversion of human adult somatic cells into neural stem cells by HMGA2/let-7b. Cell Rep. 10(3), 441–452.
Sheng C., Jungverdorben J., Wiethoff H., Lin Q., Flitsch L.J., Eckert D., Hebisch M., Fischer J., Kesavan J., Weykopf B., Schneider L., Holtkamp D., Beck H., Till A., Wüllner U., Ziller M.J., Wagner W., Peitz M., Brüstle O. (2018) A stably self-renewing adult blood-derived induced neural stem cell exhibiting patternability and epigenetic rejuvenation. Nat. Commun. 9(1), 4047.
Cheng L., Lei Q., Yin C., Wang H.Y., Jin K., Xiang M. (2017) Generation of urine cell-derived non-integrative human iPSCs and iNSCs: a step-by-step optimized protocol. Front. Mol. Neurosci. 10, 348.
Connor B. (2018) Concise review: the use of stem cells for understanding and treating Huntington’s disease. Stem Cells. 36(2), 146–160.
Kim B.E., Choi S.W., Shin J.H., Kim J.J., Kang I., Lee B.C., Lee J.Y., Kook M.G., Kang K.S. (2018) Single-factor SOX2 mediates direct neural reprogramming of human mesenchymal stem cells via transfection of in vitro transcribed mRNA. Cell Transplant. 27(7), 1154–1167.
Hou P.S., Chuang C.Y., Yeh C.H., Chiang W., Liu H.J., Lin T.N., Kuo H.C. (2017) Direct conversion of human fibroblasts into neural progenitors using transcription factors enriched in human ESC-derived neural progenitors. Stem Cell Reports. 8(1), 54–68.
Capetian P., Azmitia L., Pauly M.G., Krajka V., Stengel F., Bernhardi E.M., Klett M., Meier B., Seibler P., Stanslowsky N., Moser A., Knopp A., Gillessen-Kaesbach G., Nikkhah G., Wegner F., Döbrössy M., Klein C. (2016) Plasmid-based generation of induced neural stem cells from adult human fibroblasts. Front. Cell. Neurosci. 10, 245.
Giorgetti A., Marchetto M.C., Li M., Yu D., Fazzina R., Mu Y., Adamo A., Paramonov I., Cardoso J.C., Monasterio M.B., Bardy C., Cassiani-Ingoni R., Liu G.H., Gage F.H., Izpisua Belmonte J.C. (2012) Cord blood-derived neuronal cells by ectopic expression of Sox2 and c-Myc. Proc. Natl. Acad. Sci. USA. 109(31), 12556–12561.
Castaño J., Menendez P., Bruzos-Cidon C., Straccia M., Sousa A., Zabaleta L., Vazquez N., Zubiarrain A., Sonntag K.C., Ugedo L., Carvajal-Vergara X., Canals J.M., Torrecilla M., Sanchez-Pernaute R., Giorgetti A. (2014) Fast and efficient neural conversion of human hematopoietic cells. Stem Cell Reports. 3(6), 1118–1131.
Maucksch C., Firmin E., Butler-Munro C., Montgomery J., Dottori M., Connor B. (2012) Non-viral generation of neural precursor-like cells from adult human fibroblasts. J. Stem Cells Regen. Med. 8(3), 162–170.
Ring K.L., Tong L.M., Balestra M.E., Javier R., Andrews-Zwilling Y., Li G., Walker D., Zhang W.R., Kreitzer A.C., Huang Y. (2012) Direct reprogramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor. Cell Stem Cell. 11(1), 100–109.
Shahbazi E., Moradi S., Nemati S., Satarian L., Basiri M., Gourabi H., Zare Mehrjardi N., Günther P., Lam-pert A., Händler K., Hatay F.F., Schmidt D., Molcanyi M., Hescheler J., Schultze J.L., Saric T., Baharvand H. (2016) Conversion of human fibroblasts to stably self-renewing neural stem cells with a single zinc-finger transcription factor. Stem Cell Reports. 6(4), 539–551.
Xiao D., Liu X., Zhang M., Zou M., Deng Q., Sun D., Bian X., Cai Y., Guo Y., Liu S., Li S., Shiang E., Zhong H., Cheng L., Xu H., Jin K., Xiang M. (2018) Direct reprogramming of fibroblasts into neural stem cells by single non-neural progenitor transcription factor Ptf1a. Nat. Commun. 9(1), 2865.
Mirakhori F., Zeynali B., Kiani S., Baharvand H. (2015) Brief azacytidine step allows the conversion of suspension human fibroblasts into neural progenitor-like cells. Cell J. 17(1), 153–158.
Ghasemi-Kasman M., Hajikaram M., Baharvand H., Javan M. (2015) MicroRNA-mediated in vitro and in vivo direct conversion of astrocytes to neuroblasts. PloS One. 10(6), e0127878.
Corti S., Nizzardo M., Simone C., Falcone M., Donadoni C., Salani S., Rizzo F., Nardini M., Riboldi G., Magri F., Zanetta C., Faravelli I., Bresolin N., Comi G.P. (2012) Direct reprogramming of human astrocytes into neural stem cells and neurons. Exp. Cell Res. 318(13), 1528–1541.
Yoo A.S., Sun A.X., Li L., Shcheglovitov A., Portmann T., Li Y., Lee-Messer C., Dolmetsch R.E., Tsien R.W., Crabtree G.R. (2011) MicroRNA-mediated conversion of human fibroblasts to neurons. Nature. 476(7359), 228–231.
Ambasudhan R., Talantova M., Coleman R., Yuan X., Zhu S., Lipton S.A., Ding S. (2011) Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions. Cell Stem Cell. 9(2), 113–118.
Lau S., Rylander Ottosson D., Jakobsson J., Parmar M. (2014) Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9(5), 1673–1680.
Huh C.J., Zhang B., Victor M.B., Dahiya S., Batista L.F., Horvath S., Yoo A.S. (2016) Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. eLife. 5, e18648.
Pereira M., Pfisterer U., Rylander D., Torper O., Lau S., Lundblad M., Grealish S., Parmar M. (2014) Highly efficient generation of induced neurons from human fibroblasts that survive transplantation into the adult rat brain. Sci. Rep. 4, 6330.
Vierbuchen T., Ostermeier A., Pang Z.P., Kokubu Y., Sudhof T.C., Wernig M. (2010) Direct conversion of fibroblasts to functional neurons by defined factors. Nature. 463(7284), 1035–1041.
Meng F., Chen S., Miao Q., Zhou K., Lao Q., Zhang X., Guo W., Jiao J. (2012) Induction of fibroblasts to neurons through adenoviral gene delivery. Cell Res. 22(2), 436–440.
Mertens J., Paquola A., Ku M., Hatch E., Böhnke L., Ladjevardi S., McGrath S., Campbell B., Lee H., Herdy J.R., Gonçalves J.T., Toda T., Kim Y., Winkler J., Yao J., Hetzer M.W., Gage F.H. (2015) Directly reprogrammed human neurons retain aging-associated transcriptomic signatures and reveal age-related nucleocytoplasmic defects. Cell Stem Cell. 17(6), 705–718.
Pang Z.P., Yang N., Vierbuchen T., Ostermeier A., Fuentes D.R., Yang T.Q., Citri A., Sebastiano V., Marro S., Südhof T.C., Wernig M. (2011) Induction of human neuronal cells by defined transcription factors. Nature. 476(7359), 220–223.
Matsuda T., Irie T., Katsurabayashi S., Hayashi Y., Nagai T., Hamazaki N., Adefuin A.M.D., Miura F., Ito T., Kimura H., Shirahige K., Takeda T., Iwasaki K., Imamura T., Nakashima K. (2019) Pioneer factor neuroD1 rearranges transcriptional and epigenetic profiles to execute microglia-neuron conversion. Neuron. 101, 472‒485.
Araújo J.A.M., Hilscher M.M., Marques-Coelho D., Golbert D.C.F., Cornelio D.A., Batistuzzo de Medeiros S.R., Leão R.N., Costa M.R. (2018) Direct reprogramming of adult human somatic stem cells into functional neurons using Sox2, Ascl1, and neurog2. Front. Cell. Neurosci. 12, 155.
Drouin-Ouellet J., Lau S., Brattås P.L., Rylander Ottosson D., Pircs K., Grassi D.A., Collins L.M., Vuono R., Andersson Sjöland A., Westergren-Thorsson G., Graff C., Minthon L., Toresson H., Barker R.A., Jakobsson J., Parmar M. (2017) REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol. Med. 9(8), 1117–1131.
Karow M., Sánchez R., Schichor C., Masserdotti G., Ortega F., Heinrich C., Gascón S., Khan M.A., Lie D.C., Dellavalle A., Cossu G., Goldbrunner R., Götz M., Berninger B. (2012) Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11(4), 471–476.
Miskinyte G., Devaraju K., Grønning Hansen M., Monni E., Tornero D., Woods N.B., Bengzon J., Ahlenius H., Lindvall O., Kokaia Z. (2017) Direct conversion of human fibroblasts to functional exci-tatory cortical neurons integrating into human neural networks. Stem Cell Res. Ther. 8, 207–225.
Chanda S., Ang C.E., Davila J., Pak C., Mall M., Lee Q.Y., Ahlenius H., Jung S.W., Sudhof T.C., Wernig M. (2014) Generation of induced neuronal cells by the single reprogramming factor ASCL1. Stem Cell Reports. 3(2), 282–296.
Rivetti di Val Cervo P., Romanov R.A., Spigolon G., Masini D., Martín-Montañez E., Toledo E.M., La Manno G., Feyder M., Pifl C., Ng Y.H., Sánchez S.P., Linnarsson S., Wernig M., Harkany T., Fisone G., Arenas E. (2017) Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson’s disease model. Nat. Biotechnol. 35(5), 444–452.
Jiang H., Xu Z., Zhong P., Ren Y., Liang G., Schilling H.A., Hu Z., Zhang Y., Wang X., Chen S., Yan Z., Feng J. (2015) Cell cycle and p53 gate the direct conversion of human fibroblasts to dopaminergic neurons. Nat. Commun. 6, 10100.
Pfisterer U., Kirkeby A., Torper O., Wood J., Nelan-der J., Dufour A., Björklund A., Lindvall O., Jakobsson J., Parmar M. (2011) Direct conversion of human fibroblasts to dopaminergic neurons. Proc. Natl. Acad. Sci. USA. 108(25), 10343–10348.
Caiazzo M., Dell’Anno M.T., Dvoretskova E., Lazarevic D., Taverna S., Leo D., Sotnikova T.D., Menegon A., Roncaglia P., Colciago G., Russo G., Carninci P., Pezzoli G., Gainetdinov R.R., Gustincich S., Dityatev A., Broccoli V. (2011) Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476(7359), 224–227.
Victor M.B., Richner M., Hermanstyne T.O., Ransdell J.L., Sobieski C., Deng P.Y., Klyachko V.A., Nerbonne J.M., Yoo A.S. (2014) Generation of human striatal neurons by microRNA-dependent direct conversion of fibroblasts. Neuron. 84(2), 311–323.
Pereira M., Birtele M., Shrigley S., Benitez J.A., Hedlund E., Parmar M., Ottosson D.R. (2017) Direct reprogramming of resident NG2 glia into neurons with properties of fast-spiking parvalbumin-containing interneurons. Stem Cell Reports. 9(3), 742–751.
Vadodaria K.C., Mertens J., Paquola A., Bardy C., Li X., Jappelli R., Fung L., Marchetto M.C., Hamm M., Gorris M., Koch P., Gage F.H. (2016) Generation of functional human serotonergic neurons from fibroblasts. Mol. Psychiatry. 21(1), 49–61.
Xu Z., Jiang H., Zhong P., Yan Z., Chen S., Feng J. (2016) Direct conversion of human fibroblasts to induced serotonergic neurons. Mol. Psychiatry. 21(1), 62–70.
Liang X.G., Tan C., Wang C.K., Tao R.R., Huang Y.J., Ma K.F., Fukunaga K., Huang M.Z., Han F. (2018) Myt1l induced direct reprogramming of pericytes into cholinergic neurons. CNS Neurosci. Ther. 24(9), 801–809.
Liu M.L., Zang T., Zou Y., Chang J.C., Gibson J.R., Huber K.M., Zhang C.L. (2013) Small molecules enable neurogenin 2 to efficiently convert human fibroblasts into cholinergic neurons. Nat. Commun. 4, 2183.
Son E.Y., Ichida J.K., Wainger B.J., Toma J.S., Rafuse V.F., Woolf C.J., Eggan K. (2011) Conversion of mouse and human fibroblasts into functional spinal motor neurons. Cell Stem Cell. 9(3), 205–218.
Liu M.L., Zang T., Zhang C.L. (2016) Direct lineage reprogramming reveals disease-specific phenotypes of motor neurons from human ALS patients. Cell Rep. 14(1), 115–128.
Abernathy D.G., Kim W.K., McCoy M.J., Lake A.M., Ouwenga R., Lee S.W., Xing X., Li D., Lee H.J., Heuckeroth R.O., Dougherty J.D., Wang T., Yoo A.S. (2017) MicroRNAs induce a permissive chromatin environment that enables neuronal subtype-specific reprogramming of adult human fibroblasts. Cell Stem Cell. 21(3), 332–348.
Tang Y., Liu M.L., Zang T., Zhang C.L. (2017) Direct reprogramming rather than iPSC-based reprogramming maintains aging hallmarks in human motor neurons. Front. Mol. Neurosci. 10, 359.
Blanchard J.W., Eade K.T., Szűcs A., Lo Sardo V., Tsunemoto R.K., Williams D., Sanna P.P., Baldwin K.K. (2015) Selective conversion of fibroblasts into peri-pheral sensory neurons. Nat. Neurosci. 18(1), 25–35.
Wainger B.J., Buttermore E.D., Oliveira J.T., Mellin C., Lee S., Saber W.A., Wang A.J., Ichida J.K., Chiu I.M., Barrett L., Huebner E.A., Bilgin C., Tsujimoto N., Brenneis C., Kapur K., Rubin L.L., Eggan K., Woolf C.J. (2015) Modeling pain in vitro using nociceptor neurons reprogrammed from fibroblasts. Nat. Neurosci. 18(1), 17–24.
Brown C.R., Butts J.C., McCreedy D.A., Sakiyama-Elbert S.E. (2014) Generation of V2a interneurons from mouse embryonic stem cells. Stem Cells Dev. 23(15), 1765–1776.
Wegner M. (2011) SOX after SOX: SOXession regulates neurogenesis. Genes Dev. 25(23), 2423–2428.
Mercurio S., Serra L., Nicolis S.K. (2019) More than just stem cells: functional roles of the transcription factor Sox2 in differentiated glia and neurons. Int. J. Mol. Sci. 20(18), 4540.
Naruse Y., Aoki T., Kojima T., Mori N. (1999) Neural restrictive silencer factor recruits mSin3 and histone deacetylase complex to repress neuron-specific target genes. Proc. Natl. Acad. Sci. USA. 96(24), 13691–13696.
Garriga-Canut M., Schoenike B., Qazi R., Bergendahl K., Daley T.J., Pfender R.M., Morrison J.F., Ockuly J., Stafstrom C., Sutula T., Roopra A. (2006) 2-Deoxy-D-glucose reduces epilepsy progression by NRSF-CtBP-dependent metabolic regulation of chromatin structure. Nat. Neurosci. 9(11), 1382–1387.
Berninger B., Costa M.R., Koch U., Schroeder T., Sutor B., Grothe B., Götz M. (2007) Functional pro-perties of neurons derived from in vitro reprogrammed postnatal astroglia. J. Neurosci. 27(32), 8654–8664.
Favaro R., Valotta M., Ferri A.L., Latorre E., Mariani J., Giachino C., Lancini C., Tosetti V., Ottolenghi S., Taylor V., Nicolis S.K. (2009) Hippocampal development and neural stem cell maintenance require Sox2-dependent regulation of Shh. Nat. Neurosci. 12(10), 1248–1256.
Adachi K., Suemori H., Yasuda S.Y., Nakatsuji N., Kawase E. (2010) Role of SOX2 in maintaining pluri-potency of human embryonic stem cells. Genes Cells. 15(5), 455–470.
Thomson M., Liu S.J., Zou L.N., Smith Z., Meissner A., Ramanathan S. (2011) Pluripotency factors in embryonic stem cells regulate differentiation into germ layers. Cell. 145(6), 875–889.
Bylund M., Andersson E., Novitch B.G., Muhr J. (2003) Vertebrate neurogenesis is counteracted by Sox1‒3 activity. Nat. Neurosci. 6(11), 1162‒1168.
Graham V., Khudyakov J., Ellis P., Pevny L. (2003) SOX2 functions to maintain neural progenitor identity. Neuron. 39(5), 749‒765.
Kuwabara T., Hsieh J., Muotri A., Yeo G., Warashina M., Lie D.C., Moore L., Nakashima K., Asashima M., Gage F.H. (2009) Wnt-mediated activation of NeuroD1 and retro-elements during adult neurogenesis. Nat. Neurosci. 12(9), 1097–1105.
Niklison-Chirou M.V., Agostini M., Amelio I., Melino G. (2020) Regulation of adult neurogenesis in mammalian brain. Int. J. Mol. Sci. 21(14), 4869.
Bergsland M., Ramsköld D., Zaouter C., Klum S., Sandberg R., Muhr J. (2011) Sequentially acting Sox transcription factors in neural lineage development. Genes Dev. 25(23), 2453–2464.
Suh H., Consiglio A., Ray J., Sawai T., D’Amour K.A., Gage F.H. (2007) In vivo fate analysis reveals the multipotent and self-renewal capacities of Sox2+ neural stem cells in the adult hippocampus. Cell Stem Cell. 1(5), 515–528.
Su Z., Niu W., Liu M.L., Zou Y., Zhang C.L. (2014) In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nat. Commun. 5, 3338.
Niu W., Zang T., Smith D.K., Vue T.Y., Zou Y., Bachoo R., Johnson J.E., Zhang C.L. (2015) SOX2 reprograms resident astrocytes into neural progenitors in the adult brain. Stem Cell Reports. 4(5), 780–794.
Heinrich C., Bergami M., Gascon S., Lepier A., Vigano F., Dimou L., Sutor B., Berninger B., Gotz M. (2014) Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 3(6), 1000–1014.
Iwafuchi-Doi M., Zaret K.S. (2016) Cell fate control by pioneer transcription factors. Development. 143(11), 1833–1837.
Islam M.M., Smith D.K., Niu W., Fang S., Iqbal N., Sun G., Shi Y., Zhang C.L. (2015) Enhancer analysis unveils genetic interactions between TLX and SOX2 in neural stem cells and in vivo reprogramming. Stem Cell Reports. 5(5), 805–815.
Karow M., Camp J.G., Falk S., Gerber T., Pataskar A., Gac-Santel M., Kageyama J., Brazovskaja A., Garding A., Fan W., Riedemann T., Casamassa A., Smiyakin A., Schichor C., Götz M., Tiwari V.K., Treutlein B., Berninger B. (2018) Direct pericyte-to-neuron reprogramming via unfolding of a neural stem cell-like program. Nat. Neurosci. 21(7), 932–940.
Lujan E., Chanda S., Ahlenius H., Südhof T.C., Wernig M. (2012) Direct conversion of mouse fibroblasts to self-renewing, tripotent neural precursor cells. Proc. Natl. Acad. Sci. USA. 109(7), 2527‒2532.
Tian C., Ambroz R.J., Sun L., Wang Y., Ma K., Chen Q., Zhu B., Zheng J.C. (2012) Direct conversion of dermal fibroblasts into neural progenitor cells by a novel cocktail of defined factors. Curr. Mol. Med. 12(2), 126–137.
Han D.W., Tapia N., Hermann A., Hemmer K., Höing S., Araúzo-Bravo M.J., Zaehres H., Wu G., Frank S., Moritz S., Greber B., Yang J.H., Lee H.T., Schwamborn J.C., Storch A., Schöler H.R. (2012) Direct reprogramming of fibroblasts into neural stem cells by defined factors. Cell Stem Cell. 10(4), 465–472.
Shibata M., Nakao H., Kiyonari H., Abe T., Aizawa S. (2011) MicroRNA-9 regulates neurogenesis in mouse telencephalon by targeting multiple transcription factors. J. Neurosci. 31(9), 3407–3422.
de Chevigny A., Coré N., Follert P., Gaudin M., Barbry P., Béclin C., Cremer H. (2012) miR-7a regulation of Pax6 controls spatial origin of forebrain dopaminergic neurons. Nat. Neurosci. 15(8), 1120–1126.
Berger J., Berger S., Tuoc T.C., D’Amelio M., Cecconi F., Gorski JA., Jones K.R., Gruss P., Stoykova A. (2007) Conditional activation of Pax6 in the develo-ping cortex of transgenic mice causes progenitor apoptosis. Development. 134(7), 1311–1322.
Walcher T., Xie Q., Sun J., Irmler M., Beckers J., Öztürk T., Niessing D., Stoykova A., Cvekl A., Ninko-vic J., Götz M. (2013) Functional dissection of the paired domain of Pax6 reveals molecular mechanisms of coordinating neurogenesis and proliferation. Development. 140(5), 1123–1136.
Osumi N., Shinohara H., Numayama-Tsuruta K., Maekawa M. (2008) Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator. Stem Cells. 26(7), 1663–1672.
Buffo A., Vosko M.R., Ertürk D., Hamann G.F., Jucker M., Rowitch D., Götz M. (2005) Expression pattern of the transcription factor Olig2 in response to brain injuries: implications for neuronal repair. Proc. Natl. Acad. Sci. USA. 102(50), 18183–18188.
Georgala P.A., Carr C.B., Price D.J. (2011) The role of Pax6 in forebrain development. Dev. Neurobiol. 71(8), 690–709.
Heins N., Malatesta P., Cecconi F., Nakafuku M., Tucker K.L., Hack M.A., Chapouton P., Barde Y.A., Götz M. (2002) Glial cells generate neurons: the role of the transcription factor Pax6. Nat. Neurosci. 5(4), 308–315.
Sakakibara S., Imai T., Hamaguchi K., Okabe M., Aruga. J., Nakajima K., Yasutomi D., Nagata T., Kurihara Y., Uesugi S., Miyata T., Ogawa M., Mikoshiba K., Okano H. (1996) Mouse-Musashi-1, a neural RNA-binding protein highly enriched in the mammalian CNS stem cell. Dev. Biol. 176(2), 230–242.
Sakakibara S., Okano H. (1997) Expression of neural RNA-binding proteins in the post-natal CNS: implication of their roles in neural and glial cells development. J. Neurosci. 17(21), 8300–8312.
Sakakibara S., Nakamura Y., Yoshida T., Shibata S., Koike M., Takano H., Ueda S., Uchiyama Y., Noda T., Okano H. (2002) RNA-binding protein Musashi family: roles for CNS stem cells and a subpopulation of ependymal cells revealed by targeted disruption and antisense ablation. Proc. Natl. Acad. Sci. USA. 99(23), 15194–15199.
Takasawa K., Kitagawa K., Yagita Y., Sasaki T., Tanaka S., Matsushita K., Ohstuki T., Miyata T., Okano H., Hori M., Matsumoto M. (2002) Increased proliferation of neural progenitor cells but reduced survival of newborn cells in the contralateral hippocampus after focal cerebral ischemia in rats. J. Cereb. Blood Flow Metab. 22(3), 299–307.
Huang C., Chan J.A., Schuurmans C. (2014) Proneural bHLH genes in development and disease. Curr. Top. Dev. Biol. 110, 75–127.
Andersen J., Urbán N., Achimastou A., Ito A., Simic M., Ullom K., Martynoga B., Lebel M., Göritz C., Frisén J., Nakafuku M., Guillemot F.A. (2014) A transcriptional mechanism integrating inputs from extracellular signals to activate hippocampal stem cells. Neuron. 83(5), 1085–1097.
Wapinski O.L., Vierbuchen T., Qu K., Lee Q.Y., Chanda S., Fuentes D.R., Giresi P.G., Ng Y.H., Marro S., Neff N.F., Drechsel D., Martynoga B., Castro D.S., Webb A.E., Südhof T.C., Brunet A., Guillemot F., Chang H.Y., Wernig M. (2013) Hierarchical mechanisms for direct reprogramming of fibroblasts to neurons. Cell. 155(3), 621–635.
Wapinski O.L., Lee Q.Y., Chen A.C., Li R., Corces M.R., Ang C.E., Treutlein B., Xiang C., Baubet V., Suchy F.P., Sankar V., Sim S., Quake S.R., Dahmane N., Wernig M., Chang H.Y. (2017) Rapid chromatin switch in the direct reprogramming of fibroblasts to neurons. Cell Rep. 20(13), 3236–3247.
Treutlein B., Lee Q.Y., Camp J.G., Mall M., Koh W., Shariati S.A., Sim S., Neff N.F., Skotheim J.M., Wernig M., Quake S.R. (2016) Dissecting direct reprogramming from fibroblast to neuron using single-cell RNA-seq. Nature. 534(7607), 391–395.
Ahlenius H., Chanda S., Webb A.E., Yousif I., Karmazin J., Prusiner S. B., Brunet A., Südhof T.C., Wernig M. (2016) FoxO3 regulates neuronal reprogramming of cells from postnatal and aging mice. Proc. Natl. Acad. Sci. USA. 113(30), 8514–8519.
Webb A.E., Pollina E.A., Vierbuchen T., Urbán N., Ucar D., Leeman D.S., Martynoga B., Sewak M., RandoT.A., Guillemot F., Wernig M., Brunet A. (2013). FOXO3 shares common targets with ASCL1 genome-wide and inhibits ASCL1-dependent neurogenesis. Cell Rep. 4(3), 477–491.
Torper O., Ottosson D.R., Pereira M., Lau S., Cardoso T., Grealish S., Parmar M. (2015) In vivo reprogramming of striatal NG2 glia into functional neurons that integrate into local host circuitry. Cell Rep. 12(3), 474–481.
Marro S., Pang Z.P., Yang N., Tsai M.C., Qu K., Chang H.Y., Südhof T.C., Wernig M. (2011) Direct lineage conversion of terminally differentiated hepatocytes to functional neurons. Cell Stem Cell. 9(4), 374–382.
Mall M., Kareta M.S., Chanda S., Ahlenius H., Perotti N., Zhou B., Grieder S.D., Ge X., Drake S., Euong Ang C., Walker B.M., Vierbuchen T., Fuentes D.R., Brennecke P., Nitta K.R., Jolma A., Steinmetz L.M., Taipale J., Südhof T.C., Wernig M. (2017) Myt1l safeguards neuronal identity by actively repressing many non-neuronal fates. Nature. 544(7649), 245–249.
Jessberger S., Toni N., Clemenson G.D. Jr., Ray J., Gage F.H. (2008) Directed differentiation of hippocampal stem/progenitor cells in the adult brain. Nat. Neurosci. 11(8), 888–893.
Hagino-Yamagishi K., Saijoh Y., Ikeda M., Ichikawa M., Minamikawa-Tachino R., Hamada H. (1997) Predominant expression of Brn-2 in the postmitotic neurons of the developing mouse neocortex. Brain Res. 752(1–2), 261–268.
Schonemann M.D., Ryan A.K., Erkman L., McEvilly R.J., Bermingham J., Rosenfeld M.G. (1998) POU domain factors in neural development. Adv. Exp. Med. Biol. 449, 39–53.
Klemm J.D., Pabo C.O. (1996) Oct-1 POU domain-DNA interactions: cooperative binding of isolated subdomains and effects of covalent linkage. Genes Dev. 10(1), 27–36.
Castro D.S., Skowronska-Krawczyk D., Armant O., Donaldson I.J., Parras C., Hunt C., Critchley J.A., Nguyen L., Gossler A., Göttgens B., Matter J.M., Guillemot F. (2006) Proneural bHLH and Brn proteins coregulate a neurogenic program through cooperative binding to a conserved DNA motif. Dev. Cell. 11(6), 831–844.
Mühleisen T.W., Leber M., Schulze T.G, Strohmaier J., Degenhardt F., Treutlein J., Mattheisen M., Forstner A.J., Schumacher J., Breuer R., Meier S., Herms S., Hoffmann P., Lacour A., Witt S.H., Reif A., Müller-Myhsok B., Lucae S., Maier W., Schwarz M., Vedder H., Kammerer-Ciernioch J., Pfennig A., Bauer M., Hautzinger M., Moebus S., Priebe L., Czerski P.M., Hauser J., Lissowska J., Szeszenia-Dabrowska N., Brennan P., McKay J.D., Wright A., Mitchell P.B., Fullerton J.M., Schofield P.R., Montgomery G.W., Medland S.E., Gordon S.D., Martin N.G., Krasnow V., Chuchalin A., Babadjanova G., Pantelejeva G., Abramova L.I., Tiganov A.S., Polo-nikov A., Khusnutdinova E., Alda M., Grof P., Rouleau G.A., Turecki G., Laprise C., Rivas F., Mayoral F., Kogevinas M., Grigoroiu-Serbanescu M., Propping P., Becker T., Rietschel M., Nöthen M.M., Cichon S. (2014) Genome-wide association study reveals two new risk loci for bipolar disorder. Nat. Commun. 5, 3339.
McEvilly R.J., de Diaz M.O., Schonemann M.D., Hooshmand F., Rosenfeld M.G. (2002) Transcriptional regulation of cortical neuron migration by POU domain factors. Science. 295(5559), 1528–1532.
Sugitani Y., Nakai S., Minowa O., Nishi M., Jisha-ge K.-I., Kawano H., Mori K., Ogawa M., Noda T. (2002) Brn-1 and Brn-2 share crucial roles in the production and positioning of mouse neocortical neurons. Genes Dev. 16(14), 1760–1765.
Jaegle M., Ghazvini M., Mandemakers W., Piirsoo M., Driegen S., Levavasseur F., Raghoenath S., Grosveld F., Meijer D. (2003) The POU proteins Brn-2 and Oct-6 share important functions in Schwann cell development. Genes Dev. 17(11), 1380–1391.
Morrison S.J. (2001) Neuronal differentiation: proneural genes inhibit gliogenesis. Curr. Biol. 11(9), 349–351.
Marquardt T., Pfaff S.L. (2001) Cracking the transcriptional code for cell specification in the neural tube. Cell. 106(6), 651–654.
Lai H.C., Johnson J.E. (2008) Neurogenesis or neuronal specification: phosphorylation strikes again! Neuron. 58(1), 3–5.
Gascon S., Murenu E., Masserdotti G., Ortega F., Russo G.L., Petrik D., Deshpande A., Heinrich C., Karow M., Robertson S.P., Schroeder T., Beckers J., Irmler M., Berndt C., Angeli J.P., Conrad M., Berninger B., Gotz M. (2016) Identification and successful negotiation of a metabolic checkpoint in direct neuronal reprogramming. Cell Stem Cell. 18(3), 396–409.
Schwab M.H., Bartholomae A., Heimrich B., Feldmeyer D., Druffel-Augustin S., Goebbels S., Naya F.J., Zhao S., Frotscher M., Tsai M.J., Nave K.A. (2000) Neuronal basic helix-loop-helix proteins (NEX and BETA2/Neuro D) regulate terminal granule cell differentiation in the hippocampus. J. Neurosci. 20(10), 3714–3724.
Guo Z., Zhang L., Wu Z., Chen Y., Wang F., Chen G. (2014) In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14(2), 188–202.
Toresson H., Campbell K. (2001) A role for Gsh1 in the developing striatum and olfactory bulb of Gsh2 mutant mice. Development. 128(23), 4769–4780.
Waclaw R.R., Wang B., Pei Z., Ehrman L.A., Campbell K. (2009) Distinct temporal requirements for the homeobox gene Gsx2 in specifying striatal and olfactory bulb neuronal fates. Neuron. 63(4), 451–465.
Merkle F.T., Fuentealba L.C., Sanders T.A., Magno L., Kessaris N., Alvarez-Buylla A. (2014) Adult neural stem cells in distinct microdomains generate previously unknown interneuron types. Nat. Neurosci. 17(2), 207–214.
Panganiban G., Rubenstein J.L. (2002) Developmental functions of the Distal-less/Dlx homeobox genes. Development. 129(19), 4371–4386.
Cobos I., Calcagnotto M.E., Vilaythong A.J., Thwin M.T., Noebels J.L., Baraban S.C., Rubenstein J.L. (2005) Mice lacking Dlx1 show subtype-specific loss of interneurons, reduced inhibition and epilepsy. Nat. Neurosci. 8(8), 1059–1068.
Pei Z., Wang B., Chen G., Nagao M., Nakafuku M., Campbell K. (2011) Homeobox genes Gsx1 and Gsx2 differentially regulate telencephalic progenitor maturation. Proc. Natl. Acad. Sci. USA. 108(4), 1675–1680.
Li X., Jin P. (2010) Roles of small regulatory RNAs in determining neuronal identity. Nat. Rev. Neurosci. 11(5), 329–338.
Bian S., Hong J., Li Q., Schebelle L., Pollock A., Knauss J.L., Garg V., Sun T. (2013) MicroRNA cluster miR-17–92 regulates neural stem cell expansion and transition to intermediate progenitors in the developing mouse neocortex. Cell Rep. 3(5), 1398–1406.
Dajas-Bailador F., Bonev B., Garcez P., Stanley P., Guillemot F., Papalopulu N. (2012) microRNA-9 regulates axon extension and branching by targeting Map1b in mouse cortical neurons. Nat. Neurosci. 15(5), 697–699.
Sun G., Ye P., Murai K., Lang M.F., Li S., Zhang H., Li W., Fu C., Yin J., Wang A., Ma X., Shi Y. (2011) miR-137 forms a regulatory loop with nuclear receptor TLX and LSD1 in neural stem cells. Nat. Commun. 2, 529.
Zhao C., Sun G., Li S., Lang M.F., Yang S., Li W., Shi Y. (2010) MicroRNA let-7b regulates neural stem cell proliferation and differentiation by targeting nuclear receptor TLX signaling. Proc. Natl. Acad. Sci. USA. 107(5), 1876–1881.
Liu C., Teng Z.Q., Santistevan N.J., Szulwach K.E., Guo W., Jin P., Zhao X. (2010) Epigenetic regulation of miR-184 by MBD1 governs neural stem cell proli-feration and differentiation. Cell Stem Cell. 6(5), 433–444.
Li H.S., Wang D., Shen Q., Schonemann M.D., Gorski J.A., Jones K.R., Temple S., Jan L.Y., Jan Y.N. (2003) Inactivation of Numb and Numblike in embryonic dorsal forebrain impairs neurogenesis and disrupts cortical morphogenesis. Neuron. 40(6), 1105–1118.
Vo D.T., Qiao M., Smith A.D., Burns S.C., Brenner A.J., Penalva L.O.F. (2011) The oncogenic RNA-binding protein Musashi1 is regulated by tumor suppressor miRNAs. RNA Biol. 8(5), 817–828.
Althoff K., Beckers A., Odersky A., Mestdagh P., Koster J., Bray I.M., Bryan K., Vandesompele J., Speleman F., Stallings R.L., Schramm A., Eggert A., Sprüssel A., Schulte J.H. (2013) MiR-137 functions as a tumor suppressor in neuroblastoma by downregulating KDM1A. Int. J. Cancer. 133(5), 1064–1073.
Silber J., Lim D.A., Petritsch C., Persson A.I., Maunakea A.K., Yu M., Vandenberg S.R., Ginzin-ger D.G., James C.D., Costello J.F., Bergers G., Weiss W.A., Alvarez-Buylla A., Hodgson J.G. (2008) miR-124 and miR-137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation of brain tumor stem cells. BMC Med. 6, 14.
Tarantino C., Paolella G., Cozzuto L., Minopoli G., Pastore L., Parisi S., Russo T. (2010) miRNA 34a, 100, and 137 modulate differentiation of mouse embryonic stem cells. FASEB J. 24(9), 3255–3263.
Jiang K., Ren C., Nair V.D. (2013) MicroRNA-137 represses Klf4 and Tbx3 during differentiation of mouse embryonic stem cells. Stem Cell Res. 11(3), 1299–1313.
Szulwach K.E., Li X., Smrt R.D., Li Y., Luo Y., Lin L., Santistevan N.J., Li W., Zhao X., Jin P. (2010) Cross talk between microRNA and epigenetic regulation in adult neurogenesis. J. Cell Biol. 189(1), 127–141.
Mahmoudi E., Cairns M.J. (2017) MiR-137: an important player in neural development and neoplastic transformation. Mol. Psychiatry. 22(1), 44–55.
Sempere L.F., Freemantle S., Pitha-Rowe I., Moss E., Dmitrovsky E., Ambros V. (2004) Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation. Genome Biol. 5(3), 13.
Krichevsky A.M., Sonntag K.-C., Isacson O., Kosik K.S. (2006) Specific microRNAs modulate embryonic stem cell-derived neurogenesis. Stem Cells. 24(4), 857–864.
Coolen M., Katz S., Bally-Cuif L. (2013) miR-9: a versatile regulator of neurogenesis. Front. Cell. Neurosci. 7, 220.
Coolen M., Thieffry D., Drivenes Ø., Becker T. S., Bally-Cuif L. (2012) miR-9 controls the timing of neurogenesis through the direct inhibition of antagonistic factors. Dev. Cell. 22(5), 1052–1064.
Zhao C., Sun G., Li S., Shi Y. (2009) A feedback re-gulatory loop involving microRNA-9 and nuclear receptor TLX in neural stem cell fate determination. Nat. Struct. Mol. Biol. 16(4), 365–371.
Yoo A.S., Staahl B.T., Chen L., Crabtree G.R. (2009). MicroRNA-mediated switching of chromatin-remodelling complexes in neural development. Nature. 460(7255), 642–646.
Kageyama R., Ohtsuka T., Kobayashi T. (2008) Roles of Hes genes in neural development. Dev. Growth Differ. 50(Suppl. 1), 97–103.
Bonev B., Pisco A., Papalopulu N. (2011). MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20(1), 19–32.
La Torre A., Georgi S., Reh T.A. (2013) Conserved microRNA pathway regulates developmental timing of retinal neurogenesis. Proc. Natl. Acad. Sci. USA. 110(26), 2362–2370.
Otaegi G., Pollock A., Hong J., Sun T. (2011) MicroRNA miR-9 modifies motor neuron columns by a tuning regulation of FoxP1 levels in developing spinal cords. J. Neurosci. 31(3), 809–818.
Cheng L.C., Pastrana E., Tavazoie M., Doetsch F. (2009) miR-124 regulates adult neurogenesis in the subventricular zone stem cell niche. Nat. Neurosci. 12(4), 399–408.
Veremeyko T., Kuznetsova I.S., Dukhinova M., Yung A.W.Y., Kopeikina E., Barteneva N.S., Pono-marev E.D. (2019) Neuronal extracellular microRNAs miR-124 and miR-9 mediate cell-cell communication between neurons and microglia. J. Neurosci. Res. 97(2), 162–184.
Ponomarev E.D., Veremeyko T., Barteneva N., Krichevsky A.M., Weiner H.L. (2011) MicroRNA-124 promotes microglia quiescence and suppresses EAE by deactivating macrophages via the C/EBP-α-PU.1 pathway. Nat. Med. 17(1), 64–70.
Qin H., Zhao A., Fu X. (2017) Small molecules for reprogramming and transdifferentiation. Cell Mol. Life Sci. 74(19), 3553–3575.
Samoilova E.M., Kalsin V.A., Kushnir N.M., Chistyakov D.A., Troitskiy A.V., Baklaushev V.P. (2018) Adult neural stem cells: basic research and production strategies for neurorestorative therapy. Stem Cells Int. 2018, 4835491.
Cheng L., Hu W., Qiu B., Zhao J., Yu Y., Guan W., Wang M., Yang W., Pei G. (2014) Generation of neural progenitor cells by chemical cocktails and hypoxia. Cell Res. 24(6), 665–679.
Fu Y., Huang C., Xu X., Gu H., Ye Y., Jiang C., Qiu Z., Xie X. (2015) Direct reprogramming of mouse fibroblasts into cardiomyocytes with chemical cocktails. Cell Res. 25(9), 1013–1024.
Samoilova E.M., Revkova V.A., Brovkina O.I., Kalsin V.A., Melnikov P.A., Konoplyannikov M.A., Galimov K.R., Nikitin A.G., Troitskiy A.V., Baklaushev V.P. (2019) Chemical reprogramming of somatic cells in neural direction: myth or reality? Bull. Exp. Biol. Med. 167(4), 546–555.
Ladewig J., Mertens J., Kesavan J., Doerr J., Poppe D., Glaue F., Herms S., Wernet P., Kögler G., Müller F.J., Koch P., Brüstle O. (2012) Small molecules enable highly efficient neuronal conversion of human fibroblasts. Nat. Methods. 9(6), 575–578.
Wu X., Wang S., Li M., Li J., Shen J., Zhao Y., Pang J., Wen Q., Chen M., Wei B., Kaboli P. J., Du F., Zhao Q., Cho C. H., Wang Y., Xiao Z., Wu X. (2020) Conditional reprogramming: next generation cell culture. Acta Pharm. Sin. B. 10(8), 1360–1381.
Bettio L.E.B., Gil-Mohapel J., Patten A.R., O’Rourke N.F., Hanley R.P., Gopalakrishnan K., Wulff J.E., Christie B.R. (2017) Effects of Isx-9 and stress on adult hippocampal neurogenesis: experimental considerations and future perspectives. Neurogenesis (Austin). 4(1), e1317692.
Li H., Radford J.C., Ragusa M.J., Shea K.L., McKercher S.R., Zaremba J.D., Soussou W., Nie Z., Kang Y.J., Nakanishi N., Okamoto S., Roberts A.J., Schwarz J.J., Lipton S.A. (2008) Transcription factor MEF2C influences neural stem/progenitor cell differentiation and maturation in vivo. Proc. Natl. Acad. Sci. USA. 105(27), 9397–9402.
Li X., Zuo X., Jing J., Ma Y., Wang J., Liu D., Zhu J., Du X., Xiong L., Du Y., Xu J., Xiao X., Wang J., Chai Z., Zhao Y., Deng H. (2015) Small-molecule-driven direct reprogramming of mouse fibroblasts into functional neuros. Cell Stem Cell. 17(2), 195–203.
Potthoff M.J., Olson E.N. (2007) MEF2: a central regulator of diverse developmental programs. Development. 134(23), 4131–4140.
Herdy J., Schafer S., Kim Y., Ansari Z., Zangwill D., Ku M., Paquola A., Lee H., Mertens J., Gage F.H. (2019) Chemical modulation of transcriptionally enriched signaling pathways to optimize the conversion of fibroblasts into neurons. eLife. 8, e41356.
Führmann T., Tam R.Y., Ballarin B., Coles B., Elliott Donaghue I., van der Kooy D., Nagy A., Tator C.H., Morshead C.M., Shoichet M.S. (2016) Injectable hydrogel promotes early survival of induced pluripotent stem cell-derived oligodendrocytes and attenuates longterm teratoma formation in a spinal cord injury model. Biomaterials. 83, 23–36.
Guan X., Avci-Adali M., Alarçin E., Cheng H., Kashaf S.S., Li Y., Chawla A., Jang H.L., Khademhosseini A. (2017) Development of hydrogels for regenerative engineering. Biotechnol. J. 12(5).https://doi.org/10.1002/biot.201600394
Silva J., Bento A.R., Barros D., Laundos T.L., Sousa S.R., Quelhas P., Sousa M.M., Pêgo A.P., Amaral I.F. (2017) Fibrin functionalization with synthetic adhesive ligands interacting with α6β1 integrin receptor enhance neurite outgrowth of embryonic stem cell-derived neural stem/progenitors. Acta Biomater. 59, 243‒256.
Goh K.L., Holmes D.F. (2017) Collagenous extracellular matrix biomaterials for tissue engineering: lessons from the common sea urchin tissue. Int. J. Mol. Sci. 18(5), 901.
Baklaushev V.P., Bogush V.G., Kalsin V.A., Sovetnikov N.N., Samoilova E.M., Revkova V.A., Sido-ruk K.V., Konoplyannikov M.A., Timashev P.S., Kotova S.L., Yushkov K.B., Averyanov A.V., Troitskiy A.V., Ahlfors J.E. (2019) Tissue engineered neural constructs composed of neural precursor cells, recombinant spidroin and PRP for neural tissue regeneration. Sci. Rep. 9(1), 3161.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


