Молекулярная биология, 2021, T. 55, № 6, стр. 1011-1020
Сыворотки мышей, иммунизированных металлопротеиназой MT1-MMP, снижают миграционный потенциал клеток рака поджелудочной железы
Н. А. Митькин a, *, А. С. Устюгова a, А. Н. Уварова a, К. А. Румянцев b, К. В. Корнеев a, В. В. Павшинцев c
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский клинический научный центр им. А.С. Логинова Департамента здравоохранения г. Москвы
111123 Москва, Россия
c ООО “НИИ Митоинженерии МГУ”
119192 Москва, Россия
* E-mail: mitkin.n.a@gmail.com
Поступила в редакцию 18.03.2021
После доработки 05.05.2021
Принята к публикации 13.05.2021
Аннотация
Экспрессия матриксных металлопротеиназ, в частности MT1-MMP, повышена в клетках рака поджелудочной железы (РПЖ), что ассоциировано с усилением способности опухоли к пролиферации, инвазии и миграции. MT1-MMP в настоящий момент рассматривается в качестве перспективной мишени для медикаментозной терапии РПЖ. Однако использование ингибиторов и терапевтических антител к MT1-MMP ограничено узкими временными рамками: эффективность их действия достигает максимума только на ранней бессимптомной стадии заболевания. Эта проблема может быть решена методом активной иммунизации собственными MMP на стадии обнаружения первичной опухоли. В этом случае терапевтический эффект могут оказывать MMP-специфичные антитела, продукция которых возобновляется при появлении рецидивов. В результате проведенного исследования подобран оптимальный режим активной иммунизации фрагментами MT1-MMP, позволяющий получать высокий титр специфичных антител, блокирующих ферментативную активность этой ММР в сыворотке крови мышей линии C57BL/6. Полученные антисыворотки снижают миграцию клеток PANC-02 (РПЖ мышей) через коллагеновый матрикс, а также ингибируют активацию основных индукторов эпителиально-мезенхимального перехода: TGF-β и MMP-2. В перспективе результаты, полученные в ходе исследования, могут быть использованы при разработке препаратов для иммунотерапии РПЖ, а предлагаемый подход ‒ для дизайна противоопухолевых препаратов пролонгированного действия.
Рак поджелудочной железы (РПЖ) относится к агрессивным злокачественным новообразованиям: средние время жизни пациентов после постановки диагноза составляет 4‒6 месяцев, а 5-летняя выживаемость только 5‒7% [1]. Во многом это связано с тем, что ранние стадии заболевания протекают бессимптомно, что затрудняет своевременную диагностику РПЖ – только у 20% пациентов с впервые диагностированным РПЖ опухоль подлежит хирургическому лечению [2] ‒ наиболее действенному способу терапии, так как эффективность радио- и химиотерапии в отношении этого типа рака остается крайне низкой. Так, выживаемость пациентов, прошедших курс химиотерапии препаратом нового поколения гемцитабином, одобренным для лечения прогрессирующего РПЖ [3], составляет в среднем 6 месяцев [1]. Следует сказать, что у 85% успешно прооперированных пациентов в течение 3 лет развиваются рецидивы, что снижает выживаемость больных РПЖ [4]. При проведении адъювантной химиотерапии (с использованием агента S-1 или гемцитабина) доля пациентов, у которых наблюдаются рецидивы опухоли, снижается, но все равно остается крайне высокой – около 70% в 3-летней перспективе [5, 6]. И тут важнейшая задача ‒ диагностика локальных рецидивов, когда еще возможно их удаление. К сожалению, методы томографии, которые используют в этом случае, далеко не всегда позволяют детектировать опухоль, возникшую в ранее прооперированной ткани [2].
Таким образом, в настоящий момент большое внимание уделяется поиску терапевтических подходов, позволяющих замедлить рост рецидивной опухоли и локализовать ее, тем самым сохраняя ее на момент обнаружения в состоянии, поддающемся хирургическому лечению. Например, в качестве перспективных мишеней рассматриваются матриксные металлопротеиназы (MMP) [7]. Известно, что экспрессия ряда металлопротеиназ (MMP-1, MMP-2, MMP-7, MMP-9, MT1-MMP, MT2-MMP, MT3-MMP) повышена в клетках РПЖ [8], а в крови больных РПЖ детектируют MMP-2, MMP-7 и MMP-9, которые предлагают использовать в качестве диагностических маркеров [9]. Основной эффект MMP в прогрессии опухоли обусловловлен протеолизом коллагена ‒ ключевого компонента внеклеточного матрикса, ‒ что способствует опухолевой инвазии и ангиогенезу [10]. Протеолитическая активность ряда MMP задействована в регуляции активности факторов, индуцирующих онкогенез. Так, MMP-2 и MT1-MMP активируют TGF-β, который, в свою очередь, индуцирует эпителиально-мезенхимальный переход (ЭМП) [11, 12]. Показано, что MT1-MMP участвует в процессинге TGF-β-связывающего белка 1 (LTBP-1), тем самым индуцируя высвобождение латентного TGF-β и последующую активацию белков семейства Snail, усиливающих инвазию и миграцию раковых клеток [13]. Именно селективное ингибирование MT1-MMP, но не MMP-2, ассоциировано с подавлением активности Snail [13]. Еще одна мишень MT1-MMP ‒ микроРНК let-7, которая отвечает за деградацию мРНК HMGA2 (High Mobility Group AT-hook 2) ‒ белка, вовлеченного в организацию структуры хроматина и контроль экспрессии генов. Повышение экспрессии HMGA2, сопровождающееся усиленным фосфорилированием ERK1/2, ассоциировано с устойчивостью раковых клеток к гемцитабину, в то время как ингибиторы MT1-MMP снижают развитие резистентности [14]. Кроме того, под действием MT1-MMP идет протеолиз и активация MMP-2 [15]. На основании вышеизложенного логично предположить, что MT1-MMP стоит рассматривать в качестве перспективной терапевтической мишени для лечения РПЖ [16].
В клинических испытаниях MMP-ингибиторов широкого спектра, таких как маримастат и таномастат, как препаратов для лечения РПЖ, выявлена их эффективность, хотя она была значительно ниже, чем для селективных ингибиторов (в частности специфичных антител DX-2400 и LEM-2/15) [8]. В настоящий момент известно, что низкая эффективность MMP-ингибиторов широкого спектра, прежде всего, связана с ингибированием MMP-9. Это нежелательная мишень при терапии РПЖ, так как отсутствие MMP-9 ассоциировано с повышенным уровнем интерлейкина-6 (IL-6) и усилением инвазивного и метастатического потенциала клеток опухоли в результате активации сигнального каскада STAT-3 [17]. Следует сказать, что многообещающие результаты по снижению способности клеток РПЖ к миграции получены для MT1-MPP-селективных ингибиторов (IS4, THCP8 и т.д.) и специфичных антител (DX-2400, LEM-2/15 и т.д.) [8]. Важно отметить, что любые ингибиторы MMP эффективны как противоопухолевые агенты только в узком временном интервале – до того момента, когда произошло разрастание первичной опухоли [18]. Это затрудняет использование низкомолекулярных ингибиторов и антител к MMP при терапии и предупреждении локальных рецидивов. Именно с этим связывают тот факт, что в клинических испытаниях MMP-ингибиторов и -антител до сих пор не получено желаемых результатов – на прогрессирующей стадии онкологического заболевания они малоэффективны, хотя перспективы их использования на ранних стадиях исследуют [19]. Так, по результатам доклинических испытаний, ингибиторы MMP эффективно подавляют рост злокачественных опухолей на ранних стадиях заболевания [20], а их применение перед хирургическим вмешательством позволяет снизить вероятность возникновения как локальных рецидивов, так и метастазов [21].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторные животные. В исследовании использованы самцы мышей линии C57BL/6 категории SPF в возрасте 8 недель. Животные были получены из SPF-вивария лабораторных животных Института цитологии и генетики СО РАН (Новосибирск, Россия). Мышей содержали в стандартных условиях: температура 20–24°С (дневная разница температуры не более 2°С), относительная влажность воздуха 30–70%, световой цикл 12/12 с началом дневной фазы в 9:00 по местному времени, стандартная диета. Все манипуляции с животными проводили между 14:00 и 18:00 по местному времени.
Экспериментальные группы и иммунизация мышей C57BL/6 фрагментами белка MT1-MMP. Описание антигенов, а также названия экспериментальных групп животных (n = 10 для каждой группы) представлены ниже:
‒ imMT1: пептид AEPWTVRNEDLNGND, V-B петля каталитического домена, использованная для получения антител LEM-2/15, ингибирующих активность MT1-MMP человека и мыши и не обладающих кросс-реактивностью к другим MMP [22];
‒ imMT2: пептид NEITFCIQNY, фрагмент MT-петли, используемый для получения антител, блокирующих ферментативную активность MT1-MMP [23];
‒ imMT3: плазмидный вектор pcDNA 3.1, содержащий кодирующую последовательность полного каталитического домена MT1-MMP;
‒ imMT4: плазмидный вектор pcDNA 3.1, содержащий кодирующую последовательность пептида AEPWTVRNEDLNGND;
‒ imMT5: плазмидный вектор pcDNA 3.1, содержащий кодирующую последовательность пептида NEITFCIQNY;
‒ imMT6: плазмидный вектор pcDNA 3.1, содержащий кодирующую последовательность фрагмента каталитического домена MT1-MMP, часто используемого в качестве антигена для продукции антител (аминокислотные остатки 145‒174);
‒ пептидный контроль: инъекция белка KLH (Keyhole Limpet Hemocyanin, гемоцианин лимфы улитки) совместно с адъювантом;
‒ плазмидный контроль: инъекция “пустой” плазмиды pcDNA 3.1.
Пептидные фрагменты (группы imMT1 и imMT2), синтезированные на контрактной основе (“Life Tein”, США), конъюгировали со стандартным белком-носителем KLH (“Sigma-Aldrich”, США). Иммунизацию животных в группах imMT1 и imMT2 проводили на 1, 10 и 21 сутки эксперимента, вводя подкожно препарат, одна доза которого содержала 100 мкг исследуемого конъюгата или контрольной субстанции и 100 мкл 2%-ного гидроксида алюминия AlumVax (“OZ BIOSCIENCES”, Франция) в качестве адъюванта.
Сборку плазмид для вакцинации (группы imMT3, imMT4, imMT5, imMT6) проводили на базе вектора pcDNA 3.1 (“Promega”, США), широко используемого для конструирования противоопухолевых ДНК-вакцинах [24]. Проводили амплификацию необходимых кодирующих последовательностей, используя в качестве матрицы коммерчески доступную полноразмерную последовательность, кодирующую MT1-MMP (MG51026-UT, “Sino Biological”, США), и праймеры, содержащие сайты рестрикции NheI для прямых праймеров и HindIII для обратных (табл. 1). Смесь для ПЦР-амплификации включала 100 нг ДНК-матрицы, 200 мМ каждого dNTP, однократный буфер Phusion HF (F-530L; “Thermo Fisher Scientific”, США), 15 пкмоль каждого праймера, 0.5 ед. активности ДНК-полимеразы Phusion (F-530L; “Thermo Fisher Scientific”). Общий объем смеси составлял 20 мкл. Амплификацию проводили в течение 35 циклов с использованием следующих условий: денатурация ДНК при 98°С в течение 10 с, отжиг праймеров при 6°С в течение 20 с, элонгация цепи ДНК при 72°С в течение 15 с. Полученные ампликоны клонировали в плазмиду pcDNA 3.1 по сайтам рестрикции NheI и HindIII, для чего продукты амплификации и плазмиды обрабатывали рестриктазами NheI и HindIII (“Thermo Fisher Scientific”) при 37°С в течение 2 ч в рекомендуемом производителем буфере Tango, после чего ампликоны и плазмиды лигировали с использованием ДНК-лигазы T4 (“Thermo Fisher Scientific”). Собранные плазмиды очищали, верифицировали и накапливали в препаративных количествах с использованием набора Plasmid Midiprep kit (“Invitrogen”, США) по методикам, опубликованным ранее [25, 26]. Все полученные плазмиды вводили мышам линии C57BL/6 по следующей схеме: трехкратная внутримышечная инъекция раствора, содержащего 100 мкг плазмиды (на 1, 10 и 21 сутки эксперимента).
Таблица 1.
Последовательности праймеров для амплификации фрагментов ДНК, кодирующих пептидные фрагменты MT1-MMP
| Праймерa | Последовательность, 5' → 3' |
|---|---|
| imMT3 fw | ATAGCTAGCTACGCCATCCAGGGTCTCAA |
| imMT3 rev | ATAAAGCTTCCCTGACTCACCCCCATAAA |
| imMT4 fw | ATAGCTAGCGCCGAGCCTTGGACTGTC |
| imMT4 rev | ATCAAGCTTGTCATTTCCATTCAGATCCT |
| imMT5 fw | ATAGCTAGCAACGAAATTACCTTTTGCAT |
| imMT5 rev | ATCAAGCTTATAGTTCTGAATGCAAAAGG |
| imMT6 fw | ATAGCTAGCGCGTTTCGCGTGTGGGAAAG |
| imMT6 rev | ATCAAGCTTTATATTCGCGAAGGCCATGAA |
Забор образцов крови. Забор образцов крови проводили у всех иммунизированных животных на 21 сутки эксперимента из лицевой вены методом открытой капли (в объеме 30 мкл), а на 30 сутки – из камер сердца (в объеме 600 мкл), после чего проводили эвтаназию животных. Все процедуры проводили под изофлурановым наркозом.
Определение титра антител к MT1-MMP в сыворотке крови иммунизированных животных. Титры антител в сыворотке крови оценивали методом иммуноферментного анализа (ИФА) с использованием конъюгированных с пероксидазой хрена (HRP) антител кролика против IgG мыши (“ИМТЕК”, Россия) и тетраметилбензидина (TMB) в качестве субстрата HRP (ЗАО “Иммунотех”, Россия). Интенсивность окраски измеряли на планшетном спектрофотометре при длине волны 450 нм, как описано ранее [27]. Для определения титров антител, выработанных на разные антигены, использовали 96-луночные планшеты, сенсибилизированные следующими препаратами:
‒ рекомбинантным белком MT1-MMP мыши (“Creative Biomart”, США);
‒ рекомбинантным белком MT1-MMP человека (“R&D Systems”, США), предназначенным для контроля перекрестной специфичности мышиных антисывороток с белком человека;
‒ рекомбинантным белком MMP-9 мыши (“Novus Biologicals”, США), предназначенным для контроля перекрестной специфичности мышиных антисывороток к “нежелательной” мишени;
‒ бычьим сывороточным альбумином (BSA) для контроля неспецифичного связывания антител.
Определение ферментативной активности мышиных MT1-MMP и MMP-9. Анализ выполняли с использованием рекомбинантных мышиных белков MT1-MMP (“Creative Biomart”) и MMP-9 (“Novus Biologicals”), обладающих ферментативной активностью, и набора для определения активности металлопротеиназ MMP Activity Assay kit (ab112146; “Abcam”, Великобритания) с фирменным пептидным субстратом MMP Green. В опытные образцы добавляли антисыворотки, собранные на 30 сутки эксперимента, для оценки их влияния на активность исследуемых металлопротеиназ. В качестве контроля использовали неселективный ингибитор металлопротеиназ CP-101537 (“Sigma-Aldrich”). Анализ проводили по протоколам производителя.
Линии клеток. Клетки линии РПЖ мыши PANC-02 приобретены в официальном репозитории (ATCC, США). Клетки культивировали в среде DMEM (“Life Technologies”, США), содержащей 10% эмбриональной телячьей сыворотки (FBS; “Thermo Fisher Scientific”).
Анализ антисывороток как ингибиторов миграционной активности клеток PANC-02. Миграционную активность клеток определяли на культуральных планшетах с 8-микрометровыми вставками Transwell (“Corning”, США), предварительно обработанными коллагеном 1 типа (“BD Biosciences”, США). Скорость миграции клеток PANC-02 через коллагеновый матрикс в присутствии/ отсутствие исследуемых сывороток анализировали в течение 40 ч. В качестве положительного контроля использовали антитела LEM-2/15 (“Creative Biolabs”, США), специфически ингибирующие ферментативную активность MT1-MMP [22]. Подсчет мигрировавших клеток осуществляли с использованием колориметрического MTT-теста по методике, описанной ранее [28].
Определение ферментативной активности MMP-2. Клетки PANC-02 инкубировали с MT1-MMP-специфичными антисыворотками, которые добавляли непосредственно в кондиционную среду. В качестве положительного контроля использовали антитела LEM-2/15. Ферментативную активности MMP-2 в кондиционной среде определяли по отношению к фирменному пептидному субстрату CS-61 с использованием набора MMP-2 Biotrak Activity Assay (“GE Healthcare”, США) по протоколу производителя.
Определение содержания активной формы TGF-β в кондиционной среде. Клетки PANC-02 инкубировали с MT1-MMP-специфичными антисыворотками, которые вносили в кондиционную среду. В качестве положительного контроля использовали антитела LEM-2/15. Измерение уровней активной формы TGF-β1 в кондиционной среде проводили методом ИФА с использованием набора LEGEND MAX™ Free Active TGF-β1 ELISA kit (“Biolegend”, США) по протоколу производителя. Использованный метод позволяет определить содержание активного (свободной формы) TGF-β1, не детектируя при этом латентную форму TGF-β1 ‒ в виде комплекса с латентно ассоциированным пептидом (LAP).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Иммунизация мышей линии C57BL/6 пептидными фрагментами MT1-MMP индуцирует высокие титры антител, специфичных к MT1-MMP человека и мыши
Мышей линии C57BL/6 иммунизировали пептидными фрагментами металлопротеиназы MT1-MMP с целью получения антисывороток, удовлетворяющих следующим критериям: высокий титр анти-MT1-MMP-антител; ингибирование ферментативной активности MT1-MMP; отсутствие кросс-специфичности к MMP-9 как “нежелательной” мишени при терапии РПЖ. Последнее требование связано с тем, что, как упоминалось выше, в отсутствие MMP-9 активируется сигнальный каскад STAT-3, вовлеченный в канцерогенез опухоли [17]. Именно этот фактор ограничивает использование полноразмерного белка MT1-MMP в качестве антигена, так как индуцируемые им поликлональные антитела могут быть специфичны и к MMP-9. Для выбора оптимальных условий иммунизации мы проанализировали два основных типа антигенов: пептидные фрагменты MT1-MMP и плазмидные ДНК-вакцины, кодирующие эти пептидные фрагменты (см. раздел “Экспериментальные группы и иммунизация мышей C57BL/6 фрагментами белка MT1-MMP”).
Иммуногенность исследованных образцов оценивали методом ИФА ‒ по титрам MT1-MMP-специфичных антител в сыворотках крови животных (рис. 1).
Рис. 1.
Титры антител к MT1-MMP мыши и человека, а также к MMP-9 мыши в сыворотках крови мышей на 0, 22 и 30 сутки после завершения иммунизации образцами imMT1‒imMT6. Сыворотки анализировали методом ИФА, в качестве антигенов использованы соответствующие белки: MT1-MMP мыши, MT1-MMP человека, MMP-9 мыши, а также BSA (в качестве отрицательного контроля), ‒ адсорбированные на поверхности 96-луночного планшета. n = 10 для каждой группы. *Р < 0.01 относительно группы “пептидный контроль” для групп imMT1 и imMT2; относительно группы “плазмидный контроль” для групп imMT3, imMT4, imMT5 и imMT6.
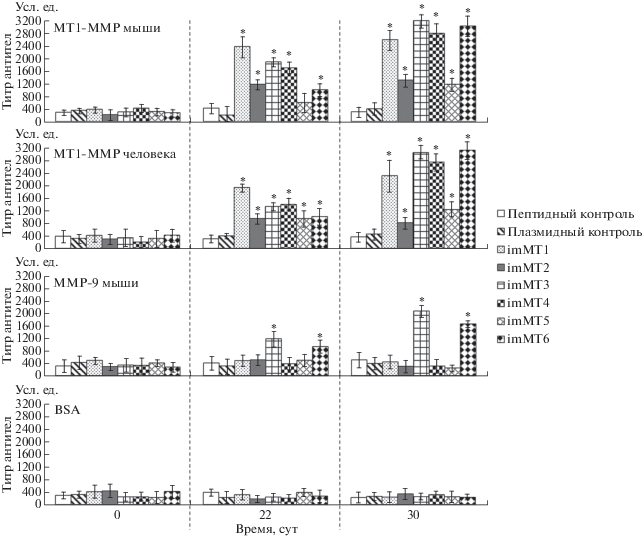
Из представленных результатов видно, что наиболее высокие титры антител наблюдаются на 30 сутки при иммунизации агентами imMT1, imMT3, imMT4 и imMT6. Следует заметить, что при использовании пептидных антигенов (imMT1 и imMT2) уровень антител к MT1-MMP мыши и человека повышается на 22 сутки и остается практически таким же на 30 сутки. В случае ДНК-конструкций (imMT3, imMT4, imMT5 и imMT6) титр антител на 30 сутки гораздо выше, чем через 22 суток. Более длительное время формирования специфического ответа при использовании ДНК-варианта иммуногенов может быть обусловлено многостадийностью процессов иммуногенеза: для выработки антител необходимо проникновение плазмиды в мышечные клетки и затем наработка в них антигена в достаточном количестве [29].
Следует отметить, что для всех антител выявлена перекрестная специфичность к MT1-MMP мыши и человека, а сыворотки imMT3 и imMT6 связывались и с MMP-9 ‒ “нежелательным” антигеном. Широкая кросс-реактивность imMT3 и imMT6 может быть связана с тем, что в качестве иммуногена использованы крупные фрагменты белка MT1-MMP, а это повышает вероятность присутствия в них эпитопов других металлопротеиназ.
Полученные антисыворотки ингибируют ферментативную активность MT1-MMP
На следующем этапе мы оценили способность всех полученных антисывороток ингибировать гидролитическую активность мышиных MT1-MMP (рис. 2а) и MMP-9 (рис. 2б) по отношению к пептидному субстрату MMP Green.
Рис. 2.
Влияние исследуемых сывороток на ферментативную активность мышиных MT1-MMP и MMP-9 in vitro. Анализ ферментативной активности выполняли с использованием активных форм рекомбинантных мышиных белков MT1-MMP (а) и MMP-9 (б) и набора Activity Assay kit (ab112146; “Abcam”) для определения активности металлопротеиназ на пептидном субстрате MMP Green. n = 10 для каждой точки. *Р < 0.01, #Р < 0.05 (относительно отрицательного контроля). Обозначения: К ‒ отрицательный контроль (без ингибиторов); Пептид ‒ пептидный контроль; Плазмина ‒ плазмидный контроль; CP-101537 ‒ ингибитор металлопротеиназ.
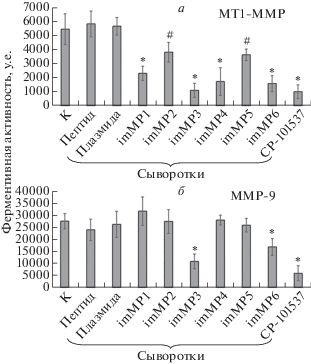
Из результатов, представленных на рис. 2, видно, что все полученные антисыворотки ингибируют гидролитическую активность MT1-MMP по отношению к пептидному субстрату MMP Green, хотя для imMT2 и imMT5 этот эффект выражен слабее, что коррелирует с низким содержанием антител в этих сыворотках (рис. 1). Показано, что сыворотки imMT3 и imMT6 не только связываются с MMP-9, но и ингибируют активность этой металлопротеиназы, то есть дают нежелательный эффект. На основании полученных результатов дальнейшие исследования мы проводили на сыворотках imMT1 и imMT4, полученных на фрагмент AEPWTVRNEDLNGND белка MT1-MMP.
MT1-MMP-специфичные антисыворотки ингибируют миграцию клеток PANC-02
С целью оценить потенциал выбранных нами сывороток, imMT1 и imMT4, как ингибиторов инвазии и метастазировния раковых клеток мы проанализировали их способность подавлять миграцию клеток линии PANC-02 РПЖ мыши, для которых характерна повышенная продукция металлопротеиназ MT1-MMP, MMP-9 и MMP-2 [30]. Результаты анализа скорости миграции клеток PANC-02 через коллагеновый матрикс в течение 40 ч в присутствии антисывороток imMT1 и imMT4 или контрольных антител LEM-2/15, специфично ингибирующих активность MT1-MMP [22], представлены на рис. 3.
Рис. 3.
Влияние сывороток imMT1 и imMT4 на миг-рационную активность клеток PANC-02. Результаты представлены как процент клеток, мигрировавших через вставку Transwell в течение 40 ч, от общего числа нанесенных клеток (принято за 100%). n = 10 для каждой точки. *Р < 0.01 относительно отрицательного контроля. Обозначения см. в подписи к рис. 2.
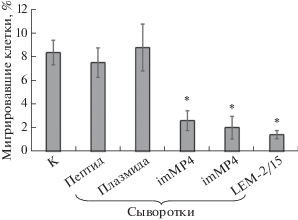
Из представленных результатов видно, что обе антисыворотки: imMT1 и imMT4 ‒ замедляют миграцию клеток PANC-02, причем по величине этот эффект сопоставим с антителами LEM-2/15. Таким образом, в системе in vitro получены обнадеживающие результаты относительно действия сывороток imMT1 и imMT4 на миграционную активность раковых клеток. Ответ на вопрос, ингибируют ли они инвазивную активность и метастазирование раковых клеток, предстоит дать в дальнейших исследованиях – уже в системах in vivo.
MT1-MMP-специфичные антисыворотки значимо снижают ферментативную активность MMP-2 и содержание активной формы TGF-β в кондиционной среде
Нами проанализировано действие сывороток imMT1 и imMT4 на регуляторные процессы, которые могут играть значимую роль в прогрессии РПЖ. В частности известно, что субстратами протеолитического действия MT1-MMP служат такие белки, как MMP-2 [15] и TGF-β [11]. При прогрессии опухоли активация TGF-β индуцирует ЭМП [11], при этом активированная MT1-MMP-протеолизом металлопротеиназа MMP-2, как и MT1-MMP, тоже напрямую активирует TGF-β [15]. С целью исследовать действие анти-MT1-MMP-сывороток imMT1 и imMT4 как ингибиторов активации TGF-β мы проанализировали ферментативную активность MT1-MMP в кондиционной среде клеток PANC-02 с этими и контрольными мышиными сыворотками. В этом эксперименте оценивали ферментативную активность MMP-2 и содержание активной формы TGF-β в кондиционной среде (рис. 4).
Рис. 4.
Влияние сывороток imMT1 и imMT4 на ферментативную активность MMP-2 (а) и содержание активной формы TGF-β (б) в кондиционной среде клеток PANC-02. *Р < 0.01, #Р < 0.05 (относительно отрицательного контроля). Обозначения см. в подписи к рис. 2.
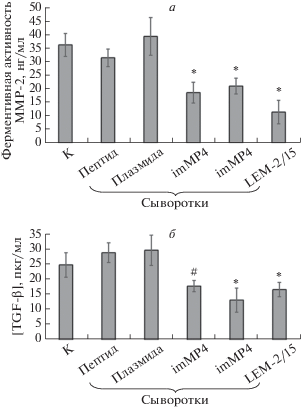
Обе антисыворотки значимо снижали как активность MMP-2 (рис. 4а), так и содержание активной формы TGF-β (рис. 4б) в кондиционной среде, причем эффективность их действия сопоставима с антителами LEM-2/15. Таким образом, подтверждено действие анти-MT1-MMP-сывороток imMT1 и imMT4 как ингибиторов активации TGF-β ‒ фактора, играющего ключевую роль в прогрессии РПЖ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенного исследования подобран режим иммунизации мышей пептидными фрагментами MT1-MMP, позволяющий получать высокий титр специфичных антител в сыворотке. Эти антитела могут замедлять процессы, играющие ключевую роль в прогрессии и метастазировании РПЖ. Иммуногенность плазмиды, кодирующей фрагмент AEPWTVRNEDLNGND белка MT1-MMP (imMT4), сравнима с таковой для индивидуального пептида (imMT1), что важно в перспективе при разработке лекарственного препарата. Преимущество ДНК-вакцин состоит в том, что эта технология позволяет ввести в состав плазмиды последовательность, кодирующую полноразмерный белок-иммуноген или его фрагмент, а их корректный фолдинг обеспечивает клеточный аппарат хозяина [31]. Кроме того, ДНК-вакцины характеризуются высокой стабильностью, а бактериальные последовательности ДНК (с неметилированными CpG-участками), присутствующие в векторе, играют роль адъюванта, активируя рецептор врожденного иммунитета TLR9 [31]. В настоящий момент ряд противоопухолевых препаратов, полученных на ДНК-платформе, находится на стадии клинических испытаний: вакцинация антигенами PAP и PSMA при раке простаты, HER2 и Mam-A при раке молочной железы, CEA при колоректальном раке [29], фрагментами белка p62 при некоторых сóлидных опухолях [32].
В целом, иммунизация фрагментом белка MT1-MMP на стадии обнаружения первичной опухоли представляется хорошей альтернативой использованию ингибиторов. Эта стратегия направлена на подавление активности MT1-MMP в первичной опухоли и индукцию гуморального иммунного ответа (продукцию MT1-MMP-специфичных антител) в случае рецидива. Это позволит решить проблему узкого временного интервала, в рамках которого эффективно использование ингибиторов MT1-MMP.
Использование аутогенных белков-регуляторов в качестве антигенов с помощью предложенного метода иммунизации представляет большой интерес, так как позволяет в течение длительного времени изменять активность целевого белка при минимальном воздействии [33]. Так, в доклинических испытаниях выявлена эффективность и безопасность иммунизации эндогенным TNF как препарата, подавляющего развитие артрита [34, 35]. Недавно показано, что иммунизация крыс рекомбинантной алкогольдегидрогеназой (АДГ) индуцирует образование АДГ-специфичных антител, а их уровень коррелирует со снижением потребления алкоголя животными и нормализацией поведенческих параметров, причем без развития аутоиммунной патологии [36, 37]. В настоящий момент в разработке находится ряд препаратов для иммунотерапии онкологических заболеваний, в которых в качестве иммуногенов использованы фрагменты онкогенов или специфичных раковых антигенов, таких как CEA, MUC-1, SOX-2, OCT-4, IL-2 [38].
Таким образом, подходы активной иммунизации (как с использованием пептидов и белков в качестве антигенов, так и ДНК-плазмид, кодирующих эти антигены) в настоящий момент бурно развиваются и рассматриваются как альтернатива ингибиторам, особенно когда продолжительность действия становится одним из параметров, определяющих эффективность лекарственного препарата.
Необходимо сказать и о вызывающих озабоченность моментах при применении в качестве иммуногенов собственных антигенов организма ‒ это риск развития аутоиммунной патологии. Это основной аргумент критиков аутоиммунизации [39]. Однако в ряде работ постулируется, что подход можно считать достаточно безопасным при нешироком распространении антигена в организме в период ремиссии [32, 40]: мягкие режимы иммунизации приводят к запуску только B-клеточного ответа, а при отсутствии презентации антигена данный тип ответа переходит в неактивное состояние. В случае MT1-MMP важно отметить низкую распространенность этой металлопротеиназы в организме [41] и крайне низкую доступность даже для малых молекул. В клинических испытаниях антиракового препарата BT1718, токсичного для клеток, продуцирующих MT1-MMP, продемонстрирована его безопасность для здоровых людей [42]. Описанные факты позволяют предположить наличие в организме MT1-MMP в количествах, достаточных для презентации и запуска нацеленного на него повторного B-клеточного ответа, только при наличии опухоли.
Работа выполнена при поддержке Российского научного фонда (№ 19-74-00096).
При работе с животными соблюдены все международные, государственные и институциональные правила ухода и использования животных в научных исследованиях.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Seicean A., Petrusel L., Seicean R. (2015) New targeted therapies in pancreatic cancer. World J. Gastroenterol. 21, 6127‒6145.
Oberstein P.E., Olive K.P. (2013) Pancreatic cancer: why is it so hard to treat? Therap. Adv. Gastroenterol. 6(4), 321–337.
Oberstein P.E., Saif M.W. (2011) First-line treatment for advanced pancreatic cancer. JOP. J. Pancreas. 12, 96–100.
Lee J., Ahn S., Cho I.K., Lee J., Kim J., Hwang J.-H. (2018) Management of recurrent pancreatic cancer after surgical resection: a protocol for systematic review, evidence mapping and meta-analysis. BMJ Open. 8, e017249.
Xu J.-B., Jiang B., Chen Y., Qi F.-Z., Zhang J.-H., Yuan H. (2017) Optimal adjuvant chemotherapy for resected pancreatic adenocarcinoma: a systematic review and network meta-analysis. Oncotarget. 8(46), 81419‒81429.
Oettle H., Post S., Neuhaus P., Gellert K., Langrehr J., Ridwelski K., Schramm H., Fahlke J., Zuelke C., Burkart C. (2007) Adjuvant chemotherapy with gemci-tabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 297(3), 267–277.
Fields G.B. (2015) New strategies for targeting matrix metalloproteinases. Matrix Biol. 44, 239–246.
Knapinska A.M., Estrada C.-A., Fields G.B. (2017) The roles of matrix metalloproteinases in pancreatic cancer. Prog. Mol. Biol. Transl. Sci. 148, 339–354.
Roy R., Yang J., Moses M.A. (2009) Matrix metalloproteinases as novel biomarkers and potential therapeutic targets in human cancer. J. Clin. Oncol. 27(31), 5287‒5297.
Vihinen P., Kähäri V. (2002) Matrix metalloproteinases in cancer: prognostic markers and therapeutic targets. Int. J. Cancer 99, 157–166.
Nguyen H.-L., Kadam P., Helkin A., Cao K., Wu S., Samara G.J., Zhang Q., Zucker S., Cao J. (2016) MT1-MMP activation of TGF-β signaling enables intercellular activation of an epithelial-mesenchymal transition program in cancer. Curr. Cancer Drug Targets. 16, 618–630.
Gialeli C., Theocharis A.D., Karamanos N.K. (2011) Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting. FEBS J. 278, 16–27.
Shields M.A., Dangi-Garimella S., Krantz S.B., Bentrem D.J., Munshi H.G. (2011) Pancreatic cancer cells respond to type I collagen by inducing Snail expression to promote membrane type 1 matrix metalloproteinase-dependent collagen invasion. J. Biol. Chem. 286, 10495–10504.
Dangi-Garimella S., Strouch M.J., Grippo P.J., Bentrem D.J., Munshi H.G. (2011) Collagen regulation of let-7 in pancreatic cancer involves TGF-β1-mediated membrane type 1-matrix metalloproteinase expression. Oncogene. 30, 1002–1008.
Ellenrieder V., Alber B., Lacher U., Hendler S.F., Menke A., Boeck W., Wagner M., Wilda M., Friess H., Büchler M. (2000) Role of MT-MMPs and MMP-2 in pancreatic cancer progression. Int. J. Cancer. 85, 14–20.
Pahwa S., Stawikowski M.J., Fields G.B. (2014) Monitoring and inhibiting MT1-MMP during cancer initiation and progression. Cancers (Basel). 6, 416–435.
Grünwald B., Vandooren J., Gerg M., Ahomaa K., Hunger A., Berchtold S., Akbareian S., Schaten S., Knolle P., Edwards D.R. (2016) Systemic ablation of MMP-9 triggers invasive growth and metastasis of pancreatic cancer via deregulation of IL6 expression in the bone marrow. Mol. Cancer Res. 14, 1147–1158.
Bloomston M., Zervos E.E., Rosemurgy A.S. (2002) Matrix metalloproteinases and their role in pancreatic cancer: a review of preclinical studies and clinical trials. Ann. Surg. Oncol. 9, 668–674.
Winer A., Adams S., Mignatti P. (2018) Matrix metalloproteinase inhibitors in cancer therapy: turning past failures into future successes. Mol. Cancer Ther. 17, 1147–1155.
Cathcart J., Pulkoski-Gross A., Cao J. (2015) Targeting matrix metalloproteinases in cancer: bringing new life to old ideas. Genes Dis. 2, 26–34.
Winer A., Janosky M., Harrison B., Zhong J., Moussai D., Siyah P., Schatz-Siemers N., Zeng J., Adams S., Mig-natti P. (2016) Inhibition of breast cancer metastasis by presurgical treatment with an oral matrix metalloproteinase inhibitor: a preclinical proof-of-principle study. Mol. Cancer Ther. 15, 2370–2377.
Udi Y., Grossman M., Solomonov I., Dym O., Rozenberg H., Moreno V., Cuniasse P., Dive V., Arroyo A.G., Sagi I. (2015) Inhibition mechanism of membrane metalloprotease by an exosite-swiveling conformational antibody. Structure. 23, 104–115.
Shiryaev S.A., Remacle A.G., Golubkov V.S., Ingvar-sen S., Porse A., Behrendt N., Cieplak P., Strongin A.Y. (2013) A monoclonal antibody interferes with TIMP-2 binding and incapacitates the MMP-2-activating function of multifunctional, pro-tumorigenic MMP-14/ MT1–MMP. Oncogenesis. 2, e80–e80.
Liu T.-T., Wu Y., Niu T. (2018) Human DKK1 and human HSP70 fusion DNA vaccine induces an effective anti-tumor efficacy in murine multiple myeloma. Oncotarget. 9(1), 178‒191.
Korneev K.V., Sviriaeva E.N., Mitkin N.A., Gorbacheva A.M., Uvarova A.N., Ustiugova A.S., Polanovsky O.L., Kulakovskiy I.V., Afanasyeva M.A., Schwartz A.M., Kuprash D.V. (2020) Minor C allele of the SNP rs7873784 associated with rheumatoid arthritis and type-2 diabetes mellitus binds PU.1 and enhances TLR4 expression. Biochim. Biophys. Acta Mol. Basis Dis. 1866(3), 165626.
Митькин Н.А., Корнеев К.В., Горбачева А.М., Купраш Д.В. (2019) Сравнение эффективности связывания факторов транскрипции с аллельными вариантами регуляторных участков генов человека методами иммунопреципитации и ПЦР в реальном времени. Мол. биология. 53, 393–401.
Mitkin N.A., Muratova A.M., Sharonov G. V., Kor-neev K.V., Sviriaeva E.N., Mazurov D., Schwartz A.M., Kuprash D.V. (2017) p63 and p73 repress CXCR5 chemokine receptor gene expression in p53-deficient MCF-7 breast cancer cells during genotoxic stress. Biochim. Biophys. Acta Gene Regul. Mech. 1860, 1169–1178.
Mitkin N.A., Hook C.D., Schwartz A.M., Biswas S., Kochetkov D.V., Muratova A.M., Afanasyeva M.A., Kravchenko J.E., Bhattacharyya A., Kuprash D.V. (2015) P53-dependent expression of CXCR5 chemo-kine receptor in MCF-7 breast cancer cells. Sci. Rep. 5, 1–9.
Yang B., Jeang J., Yang A., Wu T.C., Hung C.-F. (2014) DNA vaccine for cancer immunotherapy. Hum. Vaccin. Immunother. 10, 3153–3164.
Slapak E.J., Duitman J., Tekin C., Bijlsma M.F., Spek C.A. (2020) Matrix metalloproteases in pancreatic ductal adenocarcinoma: key drivers of disease progression? Biology (Basel). 9(4), 80.
Senovilla L., Vacchelli E., Garcia P., Eggermont A., Fridman W.H., Galon J., Zitvogel L., Kroemer G., Galluzzi L. (2013) Trial watch: DNA vaccines for cancer therapy. Oncoimmunology. 2(4), e23803.
Ponomarenko D.M., Klimova I.D., Chapygina Y.A., Dvornichenko V.V., Zhukova N.V., Orlova R.V., Manikhas G.M., Zyryanov A.V., Burkhanova L.A., Badrtdinova I.I. (2017) Safety and efficacy of p62 DNA vaccine ELENAGEN in a first-in-human trial in patients with advanced solid tumors. Oncotarget. 8(32), 53730‒53739.
Cappellano G., Woldetsadik A.D., Orilieri E., Shivakumar Y., Rizzi M., Carniato F., Gigliotti C.L., Boggio E., Clemente N., Comi C. (2014) Subcutaneous inverse vaccination with PLGA particles loaded with a MOG peptide and IL-10 decreases the severity of experimental autoimmune encephalomyelitis. Vaccine. 32, 5681–5689.
Jia T., Pan Y., Li J., Wang L. (2013) Strategies for active TNF-α vaccination in rheumatoid arthritis treatment. Vaccine. 31, 4063–4068.
Durez P., Vandepapeliere P., Miranda P., Toncheva A., Berman A., Kehler T., Mociran E., Fautrel B., Mariette X., Dhellin O. (2014) Therapeutic vaccination with TNF-Kinoid in TNF antagonist-resistant rheumatoid arthritis: a phase II randomized, controlled clinical trial. PLoS One. 9(12), e113465.
Pavshintsev V.V., Mitkin N.A., Frolova O.Y., Kushnir E.A., Averina O.A., Lovat M.L. (2017) Individual roles of brain and serum alcohol dehydrogenase isoforms in regulation of alcohol consumption in SPF Wistar rats. Physiol. Behav. 179, 458–466.
Mitkin N.A., Anokhin P.K., Belopolskaya M.V., Frolova O.Y., Kushnir E.A., Lovat M.L., Pavshintsev V.V. (2020) Active immunization against serum alcohol dehydrogenase normalizes brain dopamine metabolism disturbed during chronic alcohol consumption. Alcohol. 83, 17–28.
Guo C., Manjili M.H., Subjeck J.R., Sarkar D., Fisher P.B., Wang X.-Y. (2013) Therapeutic cancer vaccines: past, present, and future. Adv. Cancer Res. 119, 421–475.
Vadalà M., Poddighe D., Laurino C., Palmieri B. (2017) Vaccination and autoimmune diseases: is prevention of adverse health effects on the horizon? EPMA J. 8, 295–311.
Nicholas D., Odumosu O., Langridge W.H.R. (2011) Autoantigen based vaccines for type 1 diabetes. Discov. Med. 11(59), 293‒301.
Zucker S., Pei D., Cao J., Lopez-Otin C. (2003) Membrane type-matrix metalloproteinases (MT-MMP). Curr. Top. Dev. Biol. 54, 1‒74.
Banerji U., Cook N., Evans T.R.J., Moreno Candilejo I., Roxburgh P., Kelly C.L.S., Sabaratnam N., Passi R., Leslie S., Katugampola S. (2018) A cancer кesearch UK phase I/IIa trial of BT1718 (a first in class bicycle drug conjugate) given intravenously in patients with advanced solid tumours. J. Clin. Oncol. 36(15_suppl), 2610. https://doi.org/10.1200/JCO.2018.36.15_suppl.TPS2610
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


