Молекулярная биология, 2021, T. 55, № 6, стр. 972-981
POU2F1(Oct-1) разнонаправленно участвует в ауторегуляции альтернативных промоторов за счет связывания с различными регуляторными участками гена POU2F1
Е. В. Панкратова a, *, Т. Н. Порцева a, А. А. Макарова a, Б. М. Льянова a, С. Г. Георгиева a, А. Г. Степченко a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: pank@eimb.ru
Поступила в редакцию 02.12.2020
После доработки 20.05.2021
Принята к публикации 25.05.2021
Аннотация
Ген POU2F1, играющий важную роль в регуляции генома и развитии млекопитающих, имеет как убиквитарный, так и тканеспецифический промоторы и отличается сложной регуляцией. Нами идентифицированы участки гена POU2F1, содержащие множественные сайты связывания кодируемого им фактора транскрипции Oct-1. Межвидовая гомология в этих участках геномов человека, мыши, крысы, свиньи и собаки составляет более 90%, причем выявлена полная идентичность почти всех сайтов связывания белка Oct-1. Часть этих сайтов находится вблизи каждого из двух альтернативных промоторов гена POU2F1, тогда как другие обнаружены в 5'-некодирующей области гена на расстоянии 6 тыс.п.о. до старта транскрипции. Методами иммунопреципитации хроматина (ChIP) и задержки подвижности в геле комплека ДНК-белок (EMSA) выявлено присутствие Oct-1 на этих сайтах. Подавление экспрессии Oct-1 в клетках Namalwa с использованием технологии РНК-интерференции приводило к активации убиквитарного промотора U и ингибированию транскрипции с тканеспецифического промотора L, тогда как избыточная экспрессия Oct-1 давала обратный результат. Таким образом, выявлено, что в естественном контексте на убиквитарном промоторе U гена POU2F1 через низкоаффинные сайты связывания Oct-1, при повышении его концентрации в клетке, действует отрицательная обратная связь и одновременно на тканеспецифическом промоторе L через высокоаффинные канонические Oct-1-связывающие сайты (oct-сайты) действует положительная обратная связь.
Oct-1 – один из важнейших регуляторных белков человека и других позвоночных, кодируемый геном POU2F1. Убиквитарный транскрипционный фактор Oct-1 и его тканеспецифические изоформы вовлечены в регуляцию основных клеточных процессов, таких как апоптоз, деление клеток, поддержание гомеостаза, ответ на стресс, синтез интерлейкинов и других медиаторов [1].
Количество белка Oct-1 в клетке критично для нормального клеточного роста и дифференцировки. Существенное повышение уровня экспрессии Oct-1 в норме наблюдается в эмбриогенезе [2], а у взрослых организмов высокий уровень экспрессии Oct-1 обнаружен в стволовых клетках [3]. Опухолевые стволовые клетки также характеризуются высоким содержанием Oct-1. Высокий уровень экспрессии Oct-1 в опухоли считается крайне неблагоприятным диагностическим признаком и коррелирует с высокой смертностью пациентов [4, 5]. Белок Oct-1 относится к проонкогенным факторам и имеет потенциальное прогностическое и терапевтическое значение. Анализ профилей экспрессии генов в опухолевых клетках показывает значительное увеличение экспрессии гена POU2F1 при раке желудка [4], колоректальном раке [5], инфильтрационном и поверхностном раке мочевого пузыря [6], раке молочной железы [7], глиобластоме, лимфоме Ходжкина, лимфоме тимуса и при меланоме [3]. Xiao и др. [8] показали, что при раке шейки матки концентрация Oct-1 в опухолевых клетках увеличивается почти в 6 раз по сравнению с нормальными клетками. Повышенные уровни мРНК Oct-1 обнаружены в опухолевых клетках плоскоклеточного рака головы и шеи по сравнению с нормальными кератиноцитами [9].
Транскрипция гена POU2F1 регулируется двумя отдельными промоторами: U и L [10]. С промотора U экспрессируется убиквитарная изоформа Oct-1A, тогда как с промотора L – тканеспецифическая изоформа Oct-1L. Эти белки имеют различные N-концевые аминокислотные последовательности, что наводит на мысль о сложной системе регуляции экспрессии и функционирования белка Oct-1 [11, 12]. Индивидуальные функции субформ Oct-1 в клетке различаются [13]. Субформы Oct-1 могут играть особую роль в процессах, обеспечивающих дифференцировку и/или малигнизацию клеток [13, 14]. Ранее нами сообщалось о тканеспецифической регуляции транскрипции отдельных субформ Oct-1 [12].
Актуален вопрос о механизмах избирательной активации альтернативных промоторов и регуляции экспрессии субформ фактора транскрипции Oct-1 в различных популяциях нормальных и опухолевых клеток человека. Трудность решения этой задачи определяется тем, что генный локус POU2F1 имеет сложное строение ‒ с гетерогенным 5'-концом. Убиквитарный промотор U расположен в 5'-области гена POU2F1, тогда как тканеспецифический промотор L ‒ в середине гена, на расстоянии 100 тыс.п.о. ниже промотора U. Механизмы активации или репрессии транскрипции с этих промоторов пока не изучены.
Нами показано существование высокоаффинных и низкоаффинных сайтов связывания для Oct-1 в регуляторных областях гена POU2F1, из чего можно сделать вывод о возможной ауторегуляции этого гена.
Ауторегуляция ‒ важный механизм поддержания необходимого уровня транскрипции жизненно важных для клетки генов [15]. Ауторегуляция необходима для того, чтобы ограничить колебания в числе копий данного белка в клетке, а утрата этого механизма для некоторых генов в опухолях человека способствует онкогенезу [16]. Ранее нами показано [12], что в некоторых опухолевых линиях клеток активируется транскрипция тканеспецифической изоформы Oct-1L, которую в норме в клетках такого же тканевого происхождения не регистрируют. Из этого следует, что активация промотора L может коррелировать со злокачественным перерождением клеток.
Теперь нами показано, что опухолевым линиям клеток Namalwa и HeLa присущ сложный механизм ауторегуляции гена POU2F1; при этом ауторегуляция может быть как положительной, так и отрицательной ‒ в зависимости от промотора, с которого реализуется транскрипция. Обнаружены эволюционно консервативные последовательности в 5'-некодирующей области и в областях двух альтернативных промоторов гена POU2F1, которые содержат множественные сайты связывания белка Oct-1. Нокдаун POU2F1 в клетках Namalwa приводит к активации убиквитарного промотора U и подавлению транскрипции с тканеспецифического промотора L, в то время как сверхэкспрессия ‒ к обратному результату. Таким образом, в опухолевых линиях клеток ауторегуляция убиквитарного промотора гена POU2F1 происходит по принципу отрицательной обратной связи, а тканеспецифического промотора по принципу положительной обратной связи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии. В работе использованы следующие опухолевые линии клеток человека: Namalwa (лимфома Беркитта) и HeLa ‒ из Коллекции клеточных культур Института цитологии РАН (Санкт-Петербург, Россия). Клетки культивировали в полной среде DMEM (“GIBCO, Thermo Fisher Scietific”, США), содержащей 10% эмбриональной сыворотки крупного рогатого скота (FBS; “HyClone”, США), 100 ед/мл пенициллина, 100 мкг/мл стрептомицина.
Нокдаун и сверхэкспрессия гена POU2F1. Для нокдауна гена POU2F1 использовали технологию РНК-интерференции. На основе лентивирусного вектора pGPV.ma4 были созданы конструкции для синтеза коротких РНК со шпилечной структурой (shРНК): scrambled (scr) (контрольная) и anti-POU2F1 (shРНК для нокдауна тотальной мРНК всех изоформ Oct-1) (“Евроген”, Россия), ‒ которыми трансфицировали клетки HEK-293 и получали соответствующие лентивирусные стоки. Клетки Namalwa (106 клеток) трансдуцировали полученными лентивирусными частицами. После селекции, проведенной пуромицином, получили линии клеток Namalwa со стабильным нокдауном гена POU2F1 и контрольную линию клеток Namalwa (scrambled).
Для РНК-интерференции использована shРНК к мРНК Oct-1 (анти-POU2F1): 5'-GATCCGCCAAGACCTTCAAACAAATTCAAGAGATTTGTTTGAAGGTCTTGGCT-TTTTTG-3' ‒ и shРНК-scr (нуклеотидная последовательность, не имеющая гомологии с РНК человека) в качестве отрицательного контроля: 5'-GATCCGCAAAAATTCTCCGAACGTGT-TCAAGAGACACGTTCGGAGAATTTTTGT-TTT-TTG-3'.
Конструкции pL-Oct-1A-3FLAG, pL-Oct-1L-3FLAG, pL-Oct-1X-3FLAG были созданы путем встраивания копии кодирующих последовательностей Oct-1 человека в вектор pLenti6/V5-D-TOPO (“Invitrogen”, США) [13]. Для стабильной трансдукция клеток использовали систему лентивирусной экспрессии ViraPower (“Invitrogen”) согласно протоколу производителя. Для селекции и поддержания стабильной трансформации использовали бластицидин.
Уровень экспрессии POU2F1 и Oct-1 измеряли с использованием количественной ПЦР и иммуноблотинга. В работе использованы поликлональные кроличьи антитела к белку Oct-1, полученные ранее в нашей лаборатории [13], кроличьи поликлональные антитела против Oct-1 (Ab66132; “Abcam”, Великобритания), мышиные моноклональные анти-FLAG-антитела (F9291; “Sigma-Aldrich”, США), мышиные моноклональные антитела против Lamin B1 (sc-377000; “Santa Cruse Boitechnology”, США), кроличьи поликлональные антитела против фосфо-РНК-полимеразы II (Phospho RNA PolII (S5); Ab240740; “Abcam”) и кроличьи поликлональные антитела против β-актина (Ab6276; “Abcam”).
Выделение РНК, обратная транскрипция и ПЦР в реальном времени (количественная ОТ-ПЦР). Для очистки РНК из клеточных линий использовали TRIzol Reagent (“Ambion”, США). Обратную транскрипцию проводили с помощью набора Maxima First Strand DNA Synthesis (“Thermo Fisher Scientific”, США), для количественной ОТ-ПЦР использовали набор qPCRmix-HS-SYBR (“Евроген”). Условия реакции амплификации для количественной ПЦР: 2 мин при 95°С и 45 циклов: 30 с при 95°С, 30 с при 60°С, 30 с при 72°С. Для проведения ПЦР на кДНК полноразмерного транскрипта гена POU2F1 использовали ДНК-полимеразу DyNAzyme EXT и буфер, рекомендованный производителем (“Thermo Fisher Scientific”). Условия реакции амплификации: 4 мин при 95°С, затем 28 циклов: 30 с при 95°С, 1 мин при 62°С, 2 мин 30 с при 72°С. Для определения уровня мРНК Oct-1 использовали следуюшие праймеры:
Oct-1A-F: 5'-TATTCAAAATGGCGGACGGA-3';
Oct-1L-F: 5'-CCACCCCAAACTGCTACCTGT-3';
Oct-1X-F: 5'-CAGCACGATTTGTTGGATGTG-3';
Oct-1-R: 5'-GTTTCTGACGGATTGTTCATTC-3'.
Уровни мРНК Oct-1 нормализовали к уровню мРНК глюкоронидазы (GUSB), для чего использовали следуюшие праймеры:
GUS-F: 5'-CGTGGTTGGAGAGCTCATTTGGA-3' и GUS-R: 5'-ATTTCCCCAGCACTCTCCGTCGGT-3'.
Иммунопреципитация хроматина (ChIP). В одной реакции иммунопреципитации использовали хроматин, выделенный из 3 × 106 клеток Namalwa или HeLa. “Сшивку” проводили, добавляя к клеткам, ресуспендированным в PBS, формальдегид до концентрации 0.8% с последующей инкубацией в течение 10 мин при комнатной температуре. Реакцию останавливали добавлением буфера 2.5 М глицин-HCl (рН 6.0) до концентрации 0.125 М (1/20 от общего объема). После отмывки тремя объемами холодного раствора PBS хроматин ресуспендировали в буфере, содержащем 50 мМ HEPES-KOH (pH 7.9), 140 мМ NaCl, 1 мМ EDТА, 1% тритона X-100, 0.1% дезоксихолата натрия, 0.1% SDS, коктейль протеаз (“Roche”, Швейцария), “дробили” ультразвуком до фрагментов размером ~500 нуклеотидов и центрифугировали дважды при 16 000 × g в течение 20 мин, отбирали супернатант (растворимую фракцию хроматина), фасовали и замораживали в жидком азоте.
Хроматин (100 мкг в пересчете на ДНК) предварительно инкубировали с 10 мкг IgG неиммунизированного кролика в течение 2 ч при 4°С, вносили 20 мкг Protein-A-сефарозы (“Sigma-Aldrich”) и инкубировали еще 1 ч при перемешивании. Неспецифические комплексы, связанные с Protein-A-сефарозой, осаждали (2000 × g, 2 мин, 4°С). Супернатант использовали для иммунопреципитации хроматина.
Стандартная реакционная смесь для иммунопреципитации хроматина содержала 100 мкг хроматина, 10 мкг антител к Oct-1, а также 1 мг/мл ДНК спермы лосося и 1 мг/мл BSA. Иммунопреципитацию проводили при 4°С в течение ночи, затем добавляли 15 мкл Protein-A-сефарозы и инкубировали 2 ч при 4°С на ротаторе. После центрифугирования при (2000 × g, 2 мин, 4°С) супернатант удаляли и промывали сефарозу последовательно следующими буферами: RIPA с 0.5 М NaCl, LiCl-буфером (20 мМ Трис-HCl, pH 8.0, 1 мМ EDТА, 250 мМ LiCl, 0.5% дезоксихолат натрия) и дважды ТЕ (10 мМ Трис-HCl, pH 8.0, 1 мМ EDTA). Элюцию связавшихся с Protein-A-сефарозой ДНК-белковых комплексов проводили в буфере TSE (20 мМ Трис-HCl, pH 8.0, 1% SDS, 1 мМ EDТА) в течение 20 мин при покачивании при комнатной температуре. Сефарозу осаждали центрифугированием при 2000 × g в течение 2 мин. К супернатанту добавляли 5 М NaCl до концентрации 150 мМ и инкубировали смесь при 65°С в течение 16 ч при перемешивании (процедура “расшивки” хроматина).
После расшивки хроматин обрабатывали протеазой К (3 мкл 20 мг/мл протеиназы К, 5 мкл 0.5 М EDТА на 500 мкл реакционной смеси) в течение 4 ч при 55°С при перемешивании. ДНК экстрагировали смесью фенол–хлороформ, осаждали спиртом, осадок суспендировали в буфере TE. Полученную ДНК анализировали методом количественной ПЦР и определяли соотношение осажденной/исходной фракции (%). Каждое измерение выполняли как минимум в трех повторах и вычисляли среднее значение.
Для количественной ПЦР использованы следующие праймеры:
РУ-F1: 5'-AGGGTTGGAAGGGTTTGCCTA-3'
РУ-R1: 5'-TCCCCAGTCCAATAACTGCAA-3'
РУ-F2: 5'-TTTCAAAAGCATAATGCAGTGGTG-3'
РУ-R2: 5'-TGTTTGAATTCCATCTTGGCCCT-3'
РУ-F3: 5'-TGATGTGAGCAACTTCCCTTG-3'
РУ-R3: 5'-ATGATAATGTTTTTCCTGGAATGGA-3'
A-prom-F: 5'-AGTCAAGATGAGAGTTCAGCCG-3'
A-prom-R: 5'-AGCCGGGGTTGAGTATGA-3'
L-prom-F1: 5'-TCCCTTCATGCACTGCCAAT-3'
L-prom-R1: 5'-ACTGAAAGCACTCCCTGCAT-3'
L-prom-F2: 5’-GCAGGGAAGGAGGAAAGCAT-3'
L-prom-R2: 5'-AGAGCTAGTCACAGGGAGGG-3'
Oct-1-exon 15-F: 5'-CAGTGAGACCAGCACAACACA -3'
Oct-1-exon 15-R: 5'-CTCCACCTCAGACGTGAATGAGAT-3'
CD3-5': 5'-AGTGAGCCCCTTCAAGATACCTAT-3'
CD3-3': 5'-TTCGATAATGAACTTGCACGG-3'
Клонирование и очистка POU-домена Oct-1. POU-домен клонировали в модифицированной плазмиде pET30b, содержащей на 5'-конце полилинкера последовательность ДНК, которая соответствует 6 остаткам гистидина в рамке считывания с POU-доменом. Наработку и очистку белка 6×His-POU проводили по протоколу фирмы-производителя (“QIAGEN”, Германия).
Анализ сдвига электрофоретической подвижности (EMSA). Связывание [32P]-меченых олигонуклеотидов с POU-доменом Oct-1 проводили в 20 мкл буфера, содержащего 20 мМ Трис-HCl, pH 7.8, 1 мМ EDTA, 60 мМ KCl, 1 мМ DTT, 200 мкг/мл BSA, 0.5 нг меченого олигонуклеотида и 10‒30 нг ДНК-связывающего POU-домена Oct-1. Реакционную смесь инкубировали в течение 30 мин при комнатной температуре, после чего 15 мкл наносили на 6%-ный ПААГ. В качестве контроля использовали олигонуклеотиды: oct (5'-ATGCAAAT), PORE (5'-ATTTGAAATGCAAAT) и MORE (5'-ATGCATATGCAT). Использовали следующие двухцепочечные олигонуклеотиды, соответствующие регуляторным областям гена POU2F1 (сайты связывания белка Oct-1 выделены прописными буквами):
L1: 5'-atcctcctaattattATGCTGGCactcaggagataattt-3'
L2: 5'-caattaatATGCAAATagcctgataaatatttatgcaacg-3'
L3: 5'-taacgaggagagATTTGCATaaggccctaat-3'
L4: 5'-ggaaagcATTTGCAAagcacaagcttacttgaATTTGCAGtag-3'
РУ1: 5'-gtcaaagggttggaaggGTTTGCCTaggaatgagtgcg-3'
РУ2: 5'-gtaatgcagtggtgtataaaatttaataatgtataaaacttgttATGGAAATt-3'
РУ3: 5'-gtttcctaaaATAAGCATtatcatatacagagaagactggaaatc-3'.
Статистический анализ. Сравнение экспериментальных групп проводили с использованием t-критерия Стьюдента. Все данные представлены в виде среднего значения ± стандартного отклонения (SD), рассчитанных на основании не менее трех независимых экспериментов. Различия считались статистически значимыми при P < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Oct-1 взаимодействует с регуляторными областями гена POU2F1
Ген POU2F1 человека расположен на хромосоме 1, его длина составляет 212 тыс.п.о. Этот ген содержит убиквитарный промотор U и тканеспецифический промотор L (рис. 1а). С целью понять возможные механизмы регуляции транскрипции гена POU2F1 мы провели сравнительный анализ нуклеотидной последовательности генов POU2F1 человека, мыши, свиньи и собаки и идентифицировали в них эволюционно консервативные некодирующие области.
Рис. 1.
Oct-1 взаимодействует с регуляторными областями гена POU2F1. а ‒ Схема гена POU2F1 человека и расположение в регуляторных областях сайтов связывания Oct-1. Сравнение с геном POU2F1 других млекопитающих. Сайты связывания Oct-1 обозначены звездочками. Области высокой межвидовой гомологии (>90%) выделены светло-серым цветом. Стрелками показано положение праймеров, использованных в ПЦР для анализа продуктов ChIP. б ‒ Экспрессия мРНК Oct-1 изоформ A и 1L в клетках линий HeLa и Namalwa по результатам полноразмерной ОТ-ПЦР. в ‒ Присутствие транскрипционно активной РНК-полимеразы II (Phospho S5) на убиквитарном (U) и тканеспецифическом (L) промоторе гена POU2F1 в клетках HeLa и Namalwa по результатам ChIP-анализа. г ‒ Распределение белка Oct-1 в регуляторных областях гена POU2F1 в клетках линий HeLa и Namalwa по результатам ChIP-анализа с антителами к Oct-1. Стрелками на рисунке (а) обозначено положение олигонуклеотидов, использованных для анализа ChIP. *P < 0.05, **P < 0.01.
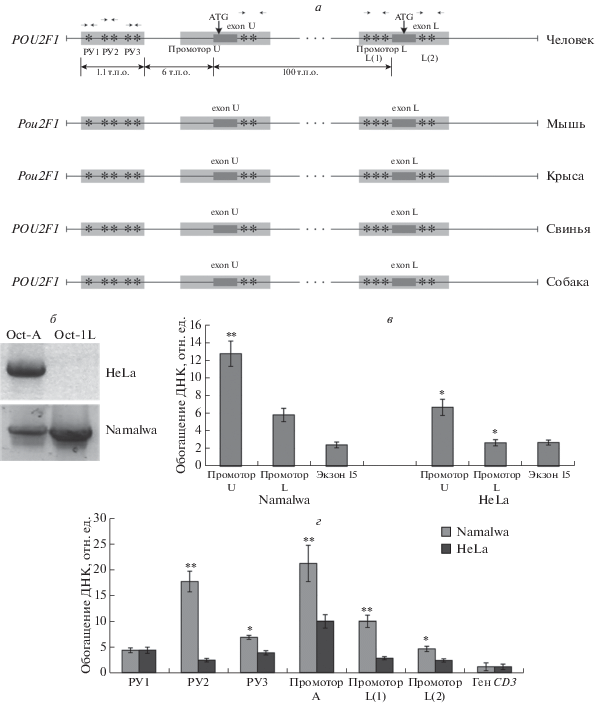
В 5'-области гена POU2F1 обнаружено несколько участков высокой межвидовой гомологии (>90%), две из которых находятся в областях промоторов U и L (рис. 1а). Кроме того, на расстоянии 6 тыс.п.о. в 5'-области от старта транскрипции промотора U обнаружено три участка с высокой гомологией (>90%) между сравниваемыми видами. Эти возможные регуляторные участки обозначены далее как РУ1, РУ2 и РУ3. В результате проведенного сравнительного анализа выявлено, что их нуклеотидные последовательности содержат множественные сайты связывания Oct-1, включая PORE, MORE и канонические Oct-1-связывающие сайты, oct-сайты, (ATGCAAAT) и oct-подобные сайты с единичными нуклеотидными заменами. Эти сайты оказались идентичны у сравниваемых видов (рис. 1а), а их положение в геноме человека, на хромосоме 1, указано в табл. 1. Мы предполагаем, что консервативные oct- и oct-подобные сайты регуляторных областей гена POU2F1 могут участвовать в ауторегуляции этого гена [17].
Таблица 1.
Участки связывания белка Oct-1 в регуляторных областях гена POU2F1 человека
| Регуляторный участокa | Геномные координаты, хромосома 1 человека (RCh38.p13) | Нуклеотидная последовательность,b 5' → 3' |
|---|---|---|
| L1 | 167 328 704‒167 328 741 | atcctcctaattattATGCTGGCactcaggagataattt |
| L2 | 167 328 760‒167 328 799 | caattaatATGCAAATagcctgataaatatttatgcaacg |
| L3 | 167 328 879‒167 328 910 | taacgaggagagATTTGCATaaggccctaat |
| L4, L5 | 167 329 443‒167 329 485 | ggaaagcATTTGCAAagcacaagcttacttgaATTTGCAGtag |
| U1 | 167 220 972‒167 220 996 | Cattttaсatattcatattcatact |
| U2 | 167 221 026‒167 221 037 | Gacttagcataa |
| РУ1 | 167 207 453‒167 207 485 | gacaaagggttggaaggGTTTGCCTaggaatga |
| РУ2 | 167 207 757‒167 207 808 | taatgcagtggtgtataaaatttaataatgtataaaacttgttATGGAAATt |
| РУ3(1) | 167 208 074‒167 208 117 | tttcctaaaATAAGCATtatcatatacagagaagactggaaatc |
| РУ3(2) | 167 208 135‒167 208 172 | cttcccttgattatgacaggaagcCTGCATATataatc |
а Положение регуляторных участков указано на рис. 1а. b Сайты связывания Oct-1 выделены прописными буквами.
Влияние Oct-1 на экспрессию гена POU2F1 исследовано нами в двух культурах клеток: HeLa и Namalwa. В клетках Namalwa оба промотора активны (рис. 1б, в), в то время как в клетках HeLa работает только U-промотор, что подтверждается как отсутствием тканеспецифического транскрипта (рис. 1б), так и отсутствием РНК-полимеразы II (Phospho S5) на промоторе L в клетках HeLa (рис. 1в).
Связывание Oct-1 с идентифицированными консервативными областями гена POU2F1 проанализировано методом ChIP. Из полученных результатов следует, что белок Oct-1 взаимодействует с oct-сайтами, расположенными в промоторах U и L, а также c предполагаемыми регуляторными участками РУ1, РУ2 и РУ3, расположенными в 5'‑области гена. Взаимодействие с этими участками обнаружено как в клетках HeLa, так и Namalwa. Интересно, что в клетках HeLa Oct-1 присутствует на промоторе L, который по нашим данным неактивен в этих клетках.
Возможные сайты связывания Oct-1, идентифицированные методом ChIP, проанализированы методом EMSA (рис. 2а, б). Взаимодействие Oct-1 с ДНК исследовали, используя аффинно очищенный ДНК-связывающий POU-домен белка Oct-1 и ДНК-зонды, идентичные геномной последовательности регуляторных участков POU2F1. Несмотря на то, что последовательность РУ1 содержит две замены в oct-сайте (GTTTGCCT), она образует мономерный комплекс с POU-доменом. В участке РУ2 обнаружен только один oct-подобный сайт (ATGGAAAT), однако POU-домен образует мультимерные комплексы с этим зондом. С РУ3 POU-домен образует моно-, ди- и тримерные комплексы. Таким образом, сайты связывания Oct-1, идентифицированные методом ChIP и сравнительного анализа геномов млекопитающих, взаимодействуют с POU-доменом белка Oct-1.
Рис. 2.
Анализ взаимодействия POU-домена белка Oct-1 с канонической oct-последовательностью и с неканоническими ДНК-последовательности из энхансерной (а) и промоторной (промотор L) (б) областей гена POU2F1 методом EMSA. Обозначения: 1 – в реакцию добавлено 60 нг аффинно очищенного POU-домена; 2 ‒ в реакцию добавлено 20 нг аффинно очищенного POU-домена.
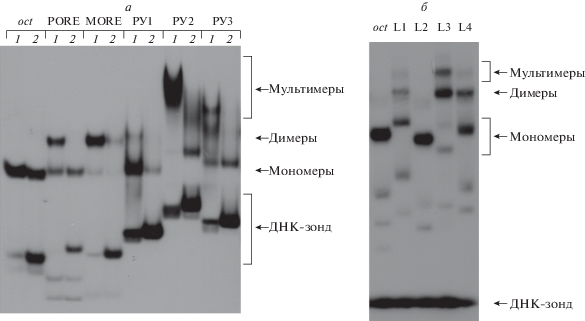
При низкой концентрации Oct-1 взаимодействует только с высокоаффинными сайтами, при этом, независимо от типа последовательности (oct, PORE или MORE), формируются преимущественно мономерные комплексы; при повышении концентрации Oct-1 на сайтах PORE и MORE образуются димеры белка Oct-1 (рис. 2а).
POU-домен белка Oct-1 состоит из двух ДНК-связывающих субдоменов: POU-специфического (POUsp) и POU-гомеодомена (POUh), ‒ соединенных гибким аминокислотным линкером. POU-домен обладает такой же ДНК-связывающей активностью и специфичностью, как и полноразмерный белок Oct-1. В силу позиционной лабильности двух ДНК-узнающих POU-субдоменов Oct-белки могут взаимодействовать с очень вырожденными ДНК-последовательностями, не содержащими канонических сайтов связывания. Формирование димеров и мультимеров на этих сайтах (рис. 2а) зависит как от нуклеотидной последовательности самого сайта, так и от концентрации Oct-1. Таким образом, повышение содержания белка Oct-1 в клетке может приводить к расширению спектра ДНК-сайтов, изменению конформации Oct-1 за счет его димеризации на этих сайтах и к изменению репертуара регулируемых генов.
Таким образом, показано, что Oct-1 связывается с областями как убиквитарного, так и специфического промоторов гена POU2F1. Большое число сайтов связывания Oct-1 и их высокая межвидовая консервативность в областях альтернативных промоторов позволяет предположить, что ауторегуляция транскрипции гена POU2F1 достаточно сложная, а повышение концентрации белка Oct-1 в клетке может приводить к изменению характера его взаимодействия с ДНК-мишенями и изменению транскрипционной активности регулируемых генов-мишеней.
Понижение уровня Oct-1 в клетке вызывает активацию транскрипции с U-промотора и снижение транскрипции с L-промотора гена POU2F1
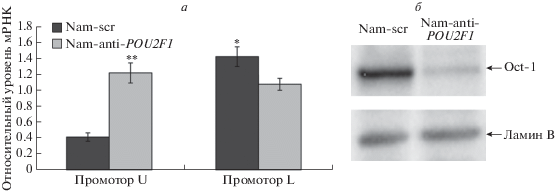
С целью изучения ауторегуляции гена POU2F1 в клетках Namalwa проведен нокдаун POU2F1 с помощью shРНК. В этих клетках активны оба промотора гена POU2F1 (U и L) и Oct-1, как показано, присутствует на обоих промоторах. Нокдаун приводит к снижению уровня мРНК Oct-1L, транскрибируемой с тканеспецифического L-промотора, и к одновременному усилению транскрипции с U-промотора (рис. 3). На основании этих данных можно сделать вывод, что механизмы, задействованные в регуляции этих двух промоторов, различны, причем снижение уровня Oct-1 в клетке приводит к активации убиквитарного промотора U.
Рис. 3.
Нокдаун POU2F1 приводит к активации транскрипции с промотора U и одновременно к подавлению транскрипции с промотора L. а ‒ Изменение уровня мРНК Oct-1 в клетках Namalwa при нокдауне POU2F1 под действием shРНК anti-POU2F1 (Nam-anti-POU2F1), нацеленной на все транскрипты POU2F1, по сравнению с уровнем в клетках с shРНК-scr (Nam-scr). Экспрессию гена POU2F1 под контролем промоторов U и L оценивали методом количественной ОТ-ПЦР с использованием олигонуклеотидов, специфичных к 5'-концам убиквитарного или тканеспецифического транскрипта Oct-1. б ‒ По результатам иммуноблотинга с антителами к Oct-1 нокдаун POU2F1 приводит к снижению уровня белка Oct-1 в клетках Namalwa. Контроль нанесения образцов проведен с антителами к ламину В. На дорожки нанесено по 10 мкг клеточного экстракта. *P < 0.05, **P < 0.01.
Повышение уровня Oct-1 в клетке ингибирует транскрипцию с U-промотора и активирует транскрипцию с промотора L
Проанализировано связывание изоформ Oct-1A и Oct-1L с oct-сайтами промоторов U и L гена POU2F1. Методом ChIP показано, что при сверхэкспрессии Oct-1A или Oct-1L в клетке на промоторах U и L повышается содержание белка Oct-1 (рис. 4а).
Рис. 4.
Избыточная экспрессия Oct-1 приводит к активации транскрипции с промотора L и одновременно к подавлению транскрипции с промотора U гена POU2F1. а ‒ ChIP-анализ изоформ Oct-1A или Oct-1L в клетках Namalwa при сверхэкспрессии Oct-1. При сверхэкспрессии изоформ Oct-1A и Oct-1L в клетках Namalwa увеличивается содержание белка Oct-1 на промоторах гена POU2F1. б ‒ Влияние сверхэкспрессии Oct-1 на транскрипцию с альтернативных промоторов гена POU2F1 в клетках Namalwa: нормальная (Nam) и повышенная экспрессия (Nam-Oct-1). Уровень транскриптов с U- и L-промоторов измеряли методом количественной ОТ-ПЦР. ПЦР проводили с использованием олигонуклеотидов, специфичных к 5'-концам убиквитарного или тканеспецифического транскрипта Oct-1. В клетках Namalwa сверхэкспрессирована изоформа Oct-1X [13], на 5'-конце мРНК которой отсутствуют участки, специфичные для изоформ Oct-1А и Oct-1L, поэтому методом ПЦР определяется присутствие только эндогенных изоформ. в ‒ Вестерн-блот-анализ сверхэкспрессии Oct-1 в клетках Namalwa с использованием антител к Oct-1. На дорожки нанесено по 10 мкг клеточного экстракта. β-актин и соответствующие антитела использованы для контроля нанесения образцов Результаты по сверхэкспрессии изоформ Oct-1 в клетках Namalwa детально представлены нами ранее [13]. *P < 0.05, **P < 0.01.
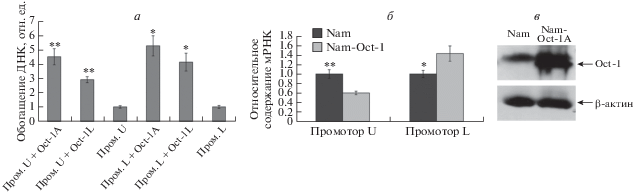
Показано, что повышение концентрации Oct-1 в клетке влияет на транскрипцию с промоторов U и L (рис. 4б). Так, сверхэкспрессия Oct-1 в клетках Namalwa приводила к подавлению транскрипции с промотора U и одновременно к активации транскрипции с промотора L. Таким образом, изменение концентрации белка Oct-1 в клетке вызывает разнонаправленное изменение транскрипции с альтернативных промоторов гена POU2F1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенного исследования на примере двух клеточных линий различного тканевого происхождения показано, что белок Oct-1 взаимодействует с регуляторными областями гена POU2F1 и вовлечен в ауторегуляцию двух альтернативных промоторов. Чрезвычайно высокая межвидовая гомология в регуляторных областях гена POU2F1 и полная идентичность сайтов связывания Oct-1 в альтернативных промоторах и в отдаленной 5'-области ‒ признак большой значимости ауторегуляции гена POU2F1 в поддержании клеточного гомеостаза.
Убиквитарный промотор U расположен в 5'‑области гена POU2F1, тогда как тканеспецифический промотор L расположен в середине гена, на 100 тыс.п.о. ниже промотора U. Механизм тканеспецифической активации или репрессии транскрипции промоторов U и L пока не выяснен. Во всех клетках человека идет транскрипция с убиквитарного промотора U. В норме промотор L активен только в клетках лимфоидного ряда и в мозге [13]. Ранее нами показано, что в некоторых опухолевых линиях клеток начинается активация промотора L, тогда как в нормальных клетках такого же тканевого происхождения этот промотор “молчит” [14]. Таким образом, активация промотора L может коррелировать со злокачественной трансформацией клеток. Ранее методом направленного мутагенеза и транзиентной трансфекции нами показано, что в системе in vitro промотор L гена POU2F ауторегулиремый [18].
Однако до сих пор нет полного понимания механизмов регуляции генов в естественном контексте, а это важно с точки зрения выяснения вклада множества геномных элементов в контроль генной экспрессии. Здесь нами обнаружено, что в естественном контексте на убиквитарном промоторе U гена POU2F действует отрицательная обратная связь ‒ через низкоаффинные сайты связывания Oct-1 при повышении его концентрации в клетке ‒ и одновременно на тканеспецифическом промоторе L действует положительная обратная связь ‒ через высокоаффинные канонические oct-сайты.
Ауторегуляция ‒ важный механизм поддержания необходимого уровня транскрипции генов “домашнего хозяйства” клетки. В ауторегуляции гена POU2F1 реализуются два разнонаправленных механизма: отрицательная обратная связь и положительная обратная связь, причем не только через промоторы, но и через регуляторные участки в 5'-области гена, расположенные на значительном расстоянии от убиквитарного промотора. Такой механизм “разнонаправленной” ауторегуляции свидетельствует о том, что, во-первых, Oct-1 участвует в тонкой настройке регуляции собственной транскрипции и, во-вторых, что задача направленного понижения количества белка Oct-1 в опухолевой клетке ‒ функция с несколькими переменными.
Белок Oct-1 экспрессируется на относительно постоянном уровне в каждом типе клеток. Повышение уровня белка Oct-1 в клетке приводит к нарушению клеточного гомеостаза, развитию эффекта Варбурга, изменению скорости деления клеток [13]. Таким образом, повышение уровня Oct-1 может приводить к малигнизации клеток. В работах последних нескольких лет появляется все больше фактов о роли Oct-1 как проонкогенного фактора для ряда эпителиальных и других опухолей [19‒21]. Важно отметить, что те опухоли, в которых повышен уровень экспрессии Oct-1, гораздо хуже поддаются лечению и их развитие связано с крайне неблагоприятным прогнозом для пациента [22]. На основе полученных нами результатов можно предполагать, что повышение уровня белка Oct-1 при злокачественной трансформации клеток приводит к расширению спектра ДНК-сайтов, изменению конформации белка Oct-1 за счет его димеризации на этих сайтах и, как следствие, к изменению набора регулируемых им генов. Анализ взаимодействия Oct-1 c ДНК важен для понимания протуморогенного эффекта высоких концентраций Oct-1 в опухолевых клетках. В некоторых исследованиях выявлена положительная корреляция между высоким уровнем белка Oct-1 в злокачественных опухолях и низкой выживаемостью больных [8, 9, 21]. Так, уровень экспрессии Oct-1 в опухолях J. Qian и соавт. [21] считают более надежным прогностическим параметром, чем стадирование по шкале American Joint Committee on Cancer (AJCC) при раке желудка.
Понимание механизмов регуляции экспрессии гена POU2F1 на транскрипционном уровне необходимо для идентификации регуляторных путей, которые могут стать мишенями новых лекарственных препаратов.
Работа выполнена при поддержке Российского научного фонда (грант № 19-14-00365).
Статья не содержит экспериментов с привлечением животных или людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kang J., Shakya A., Tantin D. (2009) Stem cells, stress, metabolism and cancer: a drama in two Octs. Trends Biochem. Sci. 34, 491–499.
Veenstra G.J., Beumer T.L., Peterson-Maduro J., Stegeman B.I., Karg H.A., van der Vliet P.C., Destrée O.H. (1995) Dynamic and differential Oct-1 expression during early Xenopus embryogenesis: persistence of Oct-1 protein following down-regulation of the RNA. Mech. Dev. 50, 103–117.
Vázquez-Arreguín K., Tantin D. (2016) The Oct1 transcription factor and epithelial malignancies: old protein learns new tricks. Biochim. Biophys. Acta. 1859, 792–804.
Chen X., Leung S.Y., Yuen S.T., Chu K.M., Ji J., Li R., Chan A.S., Law S., Troyanskaya O.G., Wong J., So S., Botstein D., Brown P.O. (2003) Variation in gene expression patterns in human gastric cancers. Mol. Biol. Cell. 14, 3208–3215.
Wang Y.P., Song G.H., Chen J., Xiao C., Li C., Zhong L., Sun X., Wang Z.W., Den G.L., Yu F.D., Xue Y.M., Tang H.M., Peng Z.H., Wang X.L. (2016) Elevated OCT1 participates in colon tumorigenesis and independently predicts poor prognoses of colorectal cancer patients. Tumour Biol. 37, 3247–3255.
Sanchez-Carbayo M., Socci N.D., Lozano J., Saint F., Cordon-Cardo C. (2006) Defining molecular profiles of poor outcome in patients with invasive bladder cancer using oligonucleotide microarrays. J. Clin. Oncol. 24, 778–789.
Finak G., Bertos N., Pepin F., Sadekova S., Souleimanova M., Zhao H., Chen H., Omeroglu G., Mete-rissian S., Omerogl A., Hallett M., Park M. (2008) Stromal gene expression predicts clinical outcome in breast cancer. Nat. Med. 14, 518–527.
Xiao S., Liao S., Zhou Y., Jiang B., Li Y., Xue M. (2014) High expression of octamer transcription factor 1 in cervical cancer. Oncol. Lett. 7, 1889–1894.
Sharpe D.J., Orr K.S., Mora M., White, S. J., McQuaid S., Lappin T.R., Thompson A., James J.A. (2014) POU2F1 activity regulates HOXD10 and HOXD11 promoting a proliferative and invasive phenotype in head and neck cancer. Oncotarget. 5, 8803–8815.
Pankratova E.V., Sytina E.V., Luchina N.N., Krivega I.V. (2003) The regulation of the Oct-1 gene transcription is mediated by two promoters. Immunol. Lett. 88, 15–20.
Sytina E.V., Pankratova E.V. (2003) Oct-1 transcription factor – plasticity and polyfunctionality. Mol. Biol. (Mosk.). 37, 755‒767.
Luchina N.N., Krivega I.V., Pankratov E.V. (2003) Human Oct-1L isoform has tissue-specific expression pattern similar to Oct-2. Immunol. Lett. 85, 237–241.
Pankratova E.V., Stepchenko A.G., Portseva T., Mogila V.A., Georgieva S.G. (2016) Different N-terminal isoforms of Oct-1 control expression of distinct sets of genes and their high levels in Namalwa Burkitt’s lymphoma cells affect a wide range of cellular processes. Nucleic Acids Res. 44, 9218–9230.
Pankratova E.V., Stepchenko A.G., Krylova I.D., Por-tseva T.N., Georgieva S.G. (2018) The regulatory interplay between Oct-1 isoforms contributes to hematopoiesis and the isoforms imbalance correlates with a malignant transformation of B cells. Oncotarget. 9, 29892‒29905.
Pinson J., Simpson T.I., Maso J.O., Price D.J. (2006) Positive autoregulation of the transcription factor Pax6 in response to increased levels of either of its major isoforms, Pax6 or Pax6(5a), in cultured cells. BMC Dev. Biol. 6, 25.
Facchini L.M., Chen S., Marhin W.W., Lear J.N., Penn L.Z. (1997) The Myc negative autoregulation mechanism requires Myc-Max association and involves the c‑myc P2 minimal promoter. Mol. Cell. Biol. 17, 100–114.
Степченко А.Г., Георгиева С.Г., Панкратова Е.В. (2019) Множественный характер взаимодействия транскрипционного фактора Oct-1 (POU2F1) с последовательностями PORE и MORE. Мол. биология. 53, 430–435.
Pankratova E., Sytina E., Polanovsky O. (2006) Autoregulation of Oct-1 gene expression is mediated by two octa-sites in alternative promoter. Biochimie. 88, 1323–1329.
Xu S.H., Huang J.Z., Xu M.L., Yu G., Yin X.F., Chen D., Yan G.R. (2015). ACK1 promotes gastric cancer epithelial-mesenchymal transition and metastasis through AKT-POU2F1-ECD signalling. J. Pathol. 236, 175–185.
Hwang-Verslues W.W., Chang P.H., Jeng Y.M., Kuo W.H., Chiang P.H., Chang Y.C., Hsieh T.H., Su F.Y., Lin L.C., Abbondante S., Yang C.Y., Hsu H.M., Yu J.C., Chang K.J., Shew J.Y., Lee E.Y., Lee W.H. (2013) Loss of corepressor PER2 under hypoxia up-regulates OCT1-mediated EMT gene expression and enhances tumor malignancy. Proc. Natl. Acad. Sci. USA. 110, 12331–12336.
Qian J., Kong X., Deng N., Tan P., Chen H., Wang J., Li Z., Hu Y., Zou W., Xu J., Fang J.Y. (2015) OCT1 is a determinant of synbindin-related ERK signalling with independent prognostic significance in gastric cancer. Gut. 64, 37–48.
Kalamohan K., Periasamy J., Bhaskar R.D., Barnabas G.D., Ponnaiyan S., Ganesan K. (2014) Transcriptional coexpression network reveals the involvement of varying stem cell features with different dysregulations in different gastric cancer subtypes. Mol. Oncol. 8, 1306–1325.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


