Молекулярная биология, 2021, T. 55, № 6, стр. 883-896
Плазмолипин и его роль в клеточных процессах
А. А. Шульгин a, b, *, Т. Д. Лебедев a, В. С. Прасолов a, П. В. Спирин a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский физико-технический институт (национальный исследовательский университет)
141701 Долгопрудный, Московская обл., Россия
* E-mail: ashu69@mail.ru
Поступила в редакцию 04.03.2021
После доработки 26.03.2021
Принята к публикации 05.04.2021
Аннотация
Изучение механизмов возникновения и развития онкологических и нейродегенеративных заболеваний представляет важное направление современной биомедицины. В прогнозировании течения заболеваний и разработке эффективных методов борьбы с ними существенная роль принадлежит молекулярным маркерам, связанным с перестройкой внутриклеточной сигнализации. Таким маркером может быть протеолипид плазмолипин – один из основных компонентов миелиновой оболочки, участвующий в формировании и нормальном функционировании нервной системы. Плазмолипин вовлечен во внутриклеточный транспорт, формирование липидных рафтов и Notch-сигнализацию. Полагают, что плазмолипин может участвовать в развитии целого ряда патологий, включая онкозаболевания, шизофрению, болезнь Альцгеймера, сахарный диабет типа 2. Плазмолипин и его гомологи рассматривают в качестве клеточных рецепторов, необходимых для проникновения некоторых вирусов в клетку. В представленном обзоре обобщены данные о структуре плазмолипина, его функциях в нормальных клетках и при патологических нарушениях.
ВВЕДЕНИЕ
В начале 1950-х годов в нормальных и опухолевых тканях мозга обнаружили протеолипиды – новый класс белково-липидных соединений, нерастворимых в воде, но способных растворяться в хлороформ-метанольной смеси [1]. Протеолипидный белок (PLP) входит в состав первого из основных протеолипидов, выделенных из клеток, формирующих миелиновую оболочку, имеет молекулярную массу 30 кДа и составляет примерно 10–30% общего белка миелина [2, 3]. PLP обладает гидрофобными свойствами, способен к гомодимеризации и взаимодействию с мембранными липидами [4]. Протеолипиды входят в состав растительных, животных и бактериальных клеток, а также являются одним из основных компонентов миелина центральной и периферической нервной системы (ЦНС и ПНС соответственно). Высокое содержание гидрофобных аминокислотных остатков определяет существенную роль протеолипидов в поддержании структуры липидного бислоя мембран [5–7]. Олигомеризация протеолипидов способствует образованию ион-проводящих трансмембранных пор, активность которых может обеспечиваться конформационными изменениями протеолипидов. Подобные поры обнаружены на митохондриальных и бактериальных мембранах [8, 9].
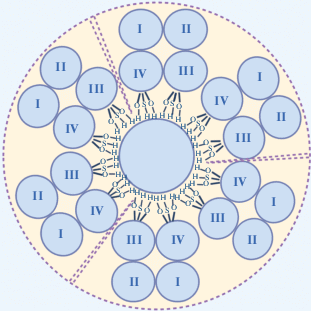
Впервые протеолипид плазмолипин (PLLP) выделили в 1981 году из плазматических мембран клеток почки быка. Гетеродимерный PLLP был назван протеолипидным комплексом плазматической мембраны клеток почки (PMPLP) [10, 11]. Показано, что внесение PMPLP в липидный бислой вызывает формирование катион-селективных K+ и Na+-каналов. К формированию этих каналов, как оказалось, приводит олигомеризация трех комплексов PMPLP, что позволило предложить модель пространственной структуры канала (рис. 1) [10–12]. Достоверных сведений о существовании таких каналов in vivo нет, однако выявлена обратная корреляция между экспрессией PLLP и степенью проводимости плазматических мембран культивируемых клеток для ионов K+. Более того, в аминокислотной последовательности PLLP не найдено значительной гомологии с известными K+ -каналами [13, 14].
Рис. 1.
Схематическое изображение модели ионного канала, представленного тримером комплексов PMPLP. Трансмембранные сегменты III и IV выстилают стенки канала благодаря присутствию большого количества гидроксильных групп.
Позднее показали, что PMPLP входит в состав синаптических плазматических мембран, а также миелиновых оболочек. PMPLP синтезируется на гранулярном эндоплазматическом ретикулуме (RER) и не подвергается значительным посттрансляционным модификациям в процессе созревания [15–17]. Изначально плазмолипином назвали гетеродимер PMPLP, однако в дальнейшем было показано, что субъединицы данного комплекса идентичны и кодируются одним геном [13, 16, 18]. В настоящий момент термин плазмолипин относится к мономерному продукту гена PLLP [13].
СТРУКТУРА ПЛАЗМОЛИПИНА
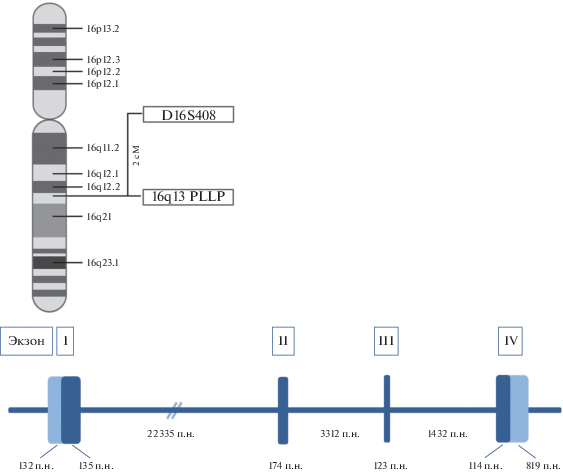
Ген hPLLP человека, локализованный на длинном плече хромосомы 16 (16q13), содержит четыре экзона и большой первый интрон (рис. 2), что свойственно структуре генов, кодирующих белки с четырьмя трансмембранными доменами (ТМ). Ген PLLP человека состоит примерно из 28.5 т.п.н. Экзон I и часть экзона II кодируют первый ТМ, а экзоны II, III и IV кодируют домены II, III и IV соответственно. Ген pllp мыши имеет сходную структуру, но он более короткий (около 19 т.п.н.). Сравнение кДНК мыши и крысы с кДНК человека выявило высокую степень гомологии нуклеотидных последовательностей в кодирующих областях (93.7 и 86% соответственно) [21–23].
Рис. 2.
Схематическое изображение структуры и локализации гена hPLLP. Экзоны указаны римскими цифрами. Нетранслруемые участки в экзонах выделены светло-голубым.
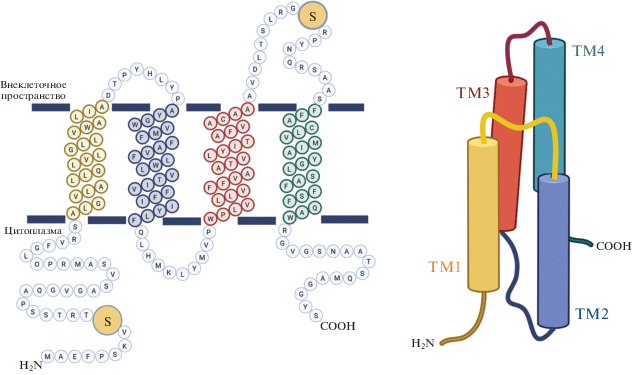
Ген PLLP содержит два сайта инициации транскрипции (ATG) и область из 546 п.н., кодирующую полипептид из 182 аминокислотных остатков с высоким содержанием гидрофобных аминокислот (72%) и молекулярной массой порядка 19.4 кДа [13, 16]. Большой процент гидрофобных остатков способствует формированию вторичной структуры с высоким содержанием α-спиралей (примерно 70%), образующих четыре гидрофобные области (I–IV) длиной 20–25 аминокислотных остатков. В третичной структуре эти области представлены TM, связанными между собой короткими гидрофильными внемембранными неструктурированными участками [16]. С помощью биоинформатического алгоритма PHDhtm [19] получена модель третичной структуры белка (рис. 2), согласно которой PLLP может иметь два сайта фосфорилирования (Ser9 и Ser130) [13]. Расчет конформации PLLP с помощью компьютерного моделирования позволил предсказать возможность ступенчатого расположения ТМ в гидрофобной среде (рис. 3) [20]. Гидрофильные участки между ТМ I и II, а также между III и IV содержат остатки пролина, способствующие сближению и компактизации данных доменов. Гидроксильные группы в ТМ III и IV могут способствовать формированию стенок ионного канала. Предполагается, что N- и C-концы данного протеолипида ориентированы в сторону цитоплазмы. При этом на N-конце отсутствует сигнальный пептид, что свойственно таким трансмембранным белкам миелина, как коннексин 32 (Cx32), миелиновый и лимфоцитарный белок крысы (rMAL), периферический белок миелина 22 кДа (PMP22) и PLP [16].
ГОМОЛОГИ ПЛАЗМОЛИПИНА
Анализ нуклеотидных последовательностей, представленных в базах данных GenBank и PIR, позволил выявить значительное число частичных гомологов PLLP на уровне аминокислотной последовательности. Установлено, что аминокислотная последовательность ТМ PLLP обладает частичной гомологией (более 20%) с ТМ некоторых мембранных транспортных белков. Выявлена 50%-ная идентичность между II ТМ PLLP и вторым ТМ белков rMAL и hMAL Кроме того, PLLP обладает структурной гомологией с rMAL, PMP22, PLP, Cx32 и другими белками, участвующими в миелинизации, которые относятся к классу тетраспановых белков миелиновой оболочки [13, 16, 21, 24].
Высокогидрофобный белок MAL – один из наиболее близких гомологов PLLP [25]. rMAL активно синтезируется в миелинизирующих олигодендроцитах и играет важную роль во внутриклеточном транспорте и сортинге белков. rMAL синтезируется в селезенке, почках, мозге и седалищном нерве [26, 27]. Показано, что белок cMAL, выделенный из почки собаки, in vitro включается в мембранные микродомены (GEM), обогащенные гликосфинголипидами и холестерином, а также входит в состав транспортных везикул. Белок cMAL локализуется на апикальной поверхности клеток эпителия и непрерывно перемещается между транс-Гольджи-сетью, плазматической мембраной и эндосомами. Подавление экспрессии эндогенного сMAL в клетках почки собаки Madin-Darby (MDCK) с помощью антисмысловых олигонуклеотидов приводит к нарушению апикального транспорта мембранных и секреторных белков [28–30]. Общая идентичность аминокислотных последовательностей MAL и PLLP составляет 29%, при этом все белки семейства MAL и PLLP имеют общую консервативную последовательность [(Q,Y)GWVM(F,Y)V(S,A)(V,L)], что позволяет отнести PLLP к этому семейству [26, 31, 32].
Значительное число родственных MAL белков, ассоциированных с везикулярным транспортом и мембранными взаимодействиями, содержат общий домен MARVEL (MAL and related proteins for vesicle trafficking and membrane link). Все белки с этим доменом имеют М-образную топологию (четыре спиральных ТМ с цитоплазматическими N- и C-концами). Высоко консервативный домен MARVEL имеет древнее эволюционное происхождение. Этот домен обнаружен у представителей различных таксономических групп, в частности у Caenorhabditis elgans и Drosophila melanogaster [32]. Белки семейства MARVEL участвуют в везикулярном транспорте и в формировании плотных контактов. Показано, что PLLP содержит этот домен, что косвенно может указывать на сходство функций PLLP и других белков, содержащих MARVEL [20, 32–37].
ТКАНЕСПЕЦФИЧНОСТЬ И ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ПЛАЗМОЛИПИНА
Экспрессия PLLP характерна для клеток, формирующих нервную систему, желудочно-кишечный тракт (желудок, пищевод и толстая кишка), почки, а также клеток сердечной и скелетных мышц, легких, тимуса, яичников и яичек. Экспрессия PLLP обнаружена в клетках надпочечников, околоушной, подчелюстной, куперовой, предстательной и щитовидной желез [13, 16, 21, 38]. Наиболее высокий уровень PLLP наблюдается в эпителиальных клетках и клетках ЦНС и ПНС. Относительно высокий уровень PLLP обнаружен в эпителиальных клетках люминальной стороны канальцев нефронов коркового вещества почки и в клетках люминальной стороны собирательных канальцев мозгового вещества почки. Белок PLLP обнаружен на апикальной поверхности клеток железистого эпителия различных отделов желудка, а именно, в области свода, ямках желудка и в привратнике [21, 38]. Высокое содержание PLLP отмечено в белом веществе спинного мозга, в компактном миелине периферических нервов, образованном шванновскими клетками, а также в олигодендроцитах, формирующих миелиновую оболочку сигнальных путей ЦНС [13, 16, 21, 38]. Области головного мозга, наиболее богатые белым веществом, как правило, содержат больше PLLP. Изучение коронарных срезов переднего отдела мозга взрослой крысы выявило значительное количество PLLP в миелине колена мозолистого тела, хвостатого ядра, в передней части передней комиссуры, а также в обонятельном и зрительном нервах. В заднем отделе мозга высокие уровни PLLP обнаружены в пирамидном пути, в путях задней части ретикулярного ядра, в верхних ножках и белом веществе мозжечка. Относительно небольшие количества PLLP найдены в телах нейронов неокортекса, а также в клетках гранулярных и пирамидных слоев гиппокампа. Существенно, что экспрессия PLLP не обнаружена в нейронах мозжечка и спинного мозга, в менингеальных фибробластах, в протоплазматических астроцитах и клетках сосудистых сплетений желудочков мозга [13, 18, 21, 24, 38, 39]. Исследование белковых фракций, полученных из седалищного нерва крысы, указывает на присутствие PLLP во фракциях, связанных с компактным миелином, некомпактным миелином (надрезы Шмидта–Лантермана), аксолеммой и периаксолеммой (параузловые петли) [39–42].
Показано, что PLLP локазизован преимущественно на апикальных мембранах поляризованных клеток, хотя незначительные количества белка обнаружены и на базолатеральных мембранах. Первичная сегрегация PLLP, как и его гомолога MAL, в обогащенные гликосфинголипидами и холестерином липидные рафты в транс-Гольджи предшествует его транспорту к апикальным и базолатеральным поверхностям клетки [38, 42–45]. К плазматической мембране PLLP поступает по микротрубочкам в везикулах, образованных из этих рафтов [42, 43]. Экспонированный на поверхности клеток PLLP может подвергаться эндоцитозу с формированием окаймленных везикул и обратному транспорту в сеть Гольджи и другие компартменты клетки. Таким образом, в клетках происходит постоянная рециркуляция PLLP [42, 46, 47, 62].
РОЛЬ ПЛАЗМОЛИПИНА В РАЗВИТИИ И ФУНКЦИОНИРОВАНИИ НЕРВНОЙ СИСТЕМЫ
При изучении онтогенеза головного мозга крысы обнаружили две изоформы PLLP – эмбриональную и постнатальную, имеющие разную молекулярную массу. Эмбриональная изоформа, как следует из ее названия, наиболее активно синтезируется в процессе пренатального нейрогенеза крысы. В частности, это связывают с дифференцировкой эмбриональных предшественников нейронов. Снижение общего количества эмбриональной формы характерно для окончания перинатального периода, а полное исчезновение наблюдается к концу первой постнатальной недели. Уровень экспрессии PLLP в пренатальный период незначителен, а его резкое увеличение в период с первой по третью постнатальнную неделю коррелирует с активной фазой миелинизации нервных волокон [43, 49]. При этом отмечено существенное преобладание фосфорилированного PLLP в белковых фракциях, полученных из очищенных миелиновых оболочек седалищного нерва молодых крыс (постнатальные 2–3 недели) по сравнению со взрослыми крысами [13, 38]. Индукция дифференцировки клеток нейробластомы NB2a сопровождается активацией синтеза эмбриональной изоформы РLLP. Показано, что повышение синтеза этой изоформы коррелирует с увеличением числа и длины нейритов, характерным для активной фазы дифференцировки. Снижение скорости образования и удлинения нейритов, наблюдаемое на поздних фазах дифференцировки клеток NB2a, совпадает с резким снижением синтеза и уменьшением общего количества эмбрионального PLLP [50].
PLLP, как и многие белки, содержащие домен MARVEL, может формировать олигомеры с помощью мотивов ØxxØ (x – любой аминокислотный остаток, Ø – аминокислота с неполярным радикалом, например, L/M/F/I/V), облегчающих спираль-спиральные взаимодействия [20, 51]. Олигомеризация PLLP и стабилизация его конформации требуют привлечения холестерина и сфинголипидов, что опосредует синтез жидкокристаллических мембранных доменов высокой вязкости – основных компонентов миелиновых мембран. Это указывает на важную роль PLLP в биогенезе миелиновых мембран и миелинизации [20, 38, 42, 51]. Показано, что созревание олигодендроцитов мыши коррелирует с повышением синтеза PLLP и сопровождается формированием плоских мембран и сети отростков. При этом наблюдается частичное изменение локализации PLLP от тела клетки к ее отросткам и в область плоских мембран [24]. В культуре шванновских клеток PLLP находится преимущественно в комплексе Гольджи, что установлено по его колокализации с маркером комплекса Гольджи – белком p115. Cовместное культивирование этих клеток с нейронами приводит к изменению локализации PLLP в шванновских клетках в области богатого белками-маркерами компактного (MBP – основной белок миелина) и некомпактного миелина (MAG – гликопротеин, ассоциированный с миелином) [42].
PLLP может участвовать в механизмах, ассоциированных с регенерацией нервов после повреждения. При этом обнаружена прямая корреляция между интенсивностью ремиелинизации и количеством мРНК и белка PLLP в области регенерации [13, 38].
Известно, что нормальное формирование миелиновой оболочки связано с регуляцией динамики ионов и жидкости в шванновских клетках и олигодендроцитах. Локализация PLLP в области параузловых петель может быть сопряжена с этими процессами [40]. Кроме того, локализация PLLP в окаймленных везикулах и его присутствие на синаптических мембранах могут указывать на участие PLLP в быстром аксонном транспорте белков [46, 48].
РОЛЬ ПЛАЗМОЛИПИНА В МОРФОГЕНЕЗЕ КИШЕЧНИКА
Изучение морфогенеза аквариумной рыбки Danio rerio показало, что PLLP может принимать активное участие в развитии кишечника. Установлено, что экспрессия гена PLLP в клетках заднего сегмента средней кишки повышается при формировании и расширении ее просвета у личинок. Через 5 сут после оплодотворения PLLP накапливается в апикальных областях эпителиальных клеток формируемого кишечника. При этом большая часть PLLP находится в канальцах и везикулах, лежащих чуть ниже апикальной плазматической мембраны. Относительно небольшое его количество обнаружено в апикальных микроворсинках и базальных эндосомах. Субапикальное расположение PLLP может указывать на его участие в рециркуляции и сортировке белковых молекул в области плазматической мембраны, осуществляемых при участии апикальных рециркулирующих эндосом (ARE). Это подтверждено колокализацией PLLP с белком Rab11 (маркер ARE). Rab11 входит в семейство малых GTPаз Rab, которые активно участвуют в различных этапах внутриклеточного транспорта и служат маркерами разных внутриклеточных мембранных структур [52–54]. Высокая представленность PLLP в клетках, обогащенных белком Lamp2, специфическим маркером лизосом, указывает на то, что PLLP может служить маркером энтероцитов заднего сегмента средней кишки на начальных этапах дифференцировки кишечника [62–64].
Введение инактивирующей мутации в ген pllp (pllppd111) D. rerio вызывает неправильное распределение Rab11 в цитоплазме эпителиальных клеток задней кишки, что указывает на принципиальное участие PLLP в нормальном функционировании апикальных рециркулирующих эндосом. Существенно, что нокаут PLLP не приводил к изменению строения кишечника в период его раннего развития, однако значительно снижал количество клеток, способных к активному эндоцитозу и поглощению питательных веществ из просвета кишечника. В этих клетках наблюдалось уменьшение размера и количества апикальных эндосом, а также длины апикальных микроворсинок. Мутация pllppd111 приводит к нарушению складчатости кишечника на поздних этапах его формирования, значительному разрастанию апикальных мембран клеток кишечного эпителия, к снижению поглощения питательных веществ и значительному уменьшению выживаемости личинок, выращенных в условиях ограниченного запаса пищи. С помощью модельной 3D-культуры клеток линии MDCK с нокаутом PLLP подтверждена роль PLLP в созревании лизосом, формировании ARE и поляризации клеток [62, 63].
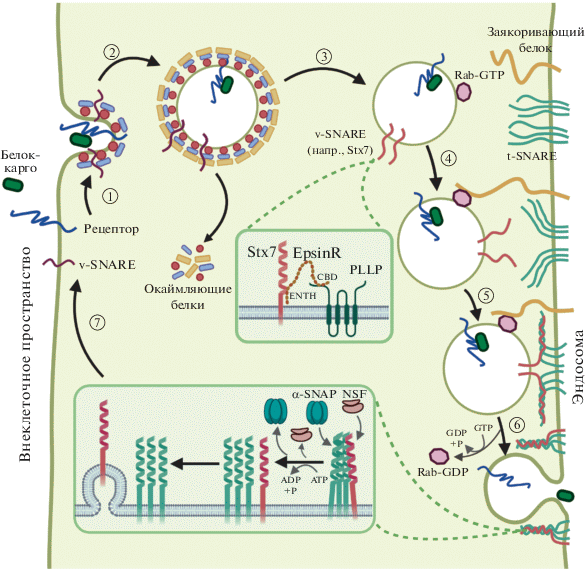
Синтаксин 7 (Stx7) входит в семейство белков SNARE, экспонированных на поверхностях внутриклеточных транспортных везикул и участвующих в их слиянии с различными органеллами-мишенями и клеточной мембраной. Показано, что Stx7 может взаимодействовать с N-концевым доменом ENTH белка энтопротина (EpsR) и обеспечивать обратный транспорт мембранных белков на плазматическую мембрану [52–54, 58–62]. Установлено, что EpsR частично колокализуется с PLLP на внутренних эндосомах и может взаимодействовать с ним за счет своего C-концевого домена. Stx7 также колокализуется и взаимодействует с PLLP в субапикальном компартменте. Нокдаун PLLP в клетках MDCK приводит к снижению синтеза белков Rab7, EpsR, Stx7 и нарушению их локализации. Известно, что Rab7 регулирует переход сортировочных эндосом (SE) в поздние/литические эндосомы (LE). Влияние PLLP на Rab7 может указывать на его участие в созревании поздних эндосом. Существенно, что нокдаун stx7, EpsR или PLLP в клетках MDCK приводит к нарушению образования кисты в 3D-культуре клеток MDCK и неправильному распределению белка Rab11, что свидетельствует о вовлеченности PLLP в функционирование белков SNARE (рис. 4) [62, 63, 65].
Рис. 4.
Возможное участие PLLP в везикулярном внутриклеточном транспорте посредством механизма сортировки белков SNARE. 1) Взаимодействие белка-карго с рецептором иницирует образование окаймленной ямки с привлечением окаймляющих белков, белков семейства Rab, а также v-SNARE (везикулярные SNARE). Привлечение специфических везикулярных SNARE может осуществляться путем их взаимодействия с PLLP через EpsinR. 2) Образование и отпочковывание окаймленной везикулы. 3) Удаление окаймляющих белков с поверхности везикулы. 4) Специфическое узнавание белка семейства Rab заякоривающим белком приводит к закреплению везикул вблизи поверхности эндосомы. 5) Образование комплекса транс-SNARE. 6) Комплекс транс-SNARE опосредует слияние везикулы с эндосомой. 7) Распутывание комплекса транс-SNARE белком NSF позволяет рассортировать высвободившиеся белки v-SNARE и t-SNARE (таргетные SNARE) для их повторного использования в везикулярном транспорте и эндоцитозе.
Показано, что PLLP способен стимулировать интернализацию трансмембранных белков Crumbs (CRB) (рис. 5). Трансмембранные белки этого семейства играют важную роль в установлении полярности эпителиальных клеток и регулируют морфогенез плотных и адгезивных контактов [64, 66, 67]. К числу таких белков относится Crumbs3 (CRB3). На модели 3D-культуры клеток MDCK показано, что динамика увеличения экспрессии PLLP в процессе образования кисты в 3D-культуре коррелирует с накоплением CRB3 в области плотных контактов и формированием незрелых апикальных соединительных комплексов (IAJC), которые в дальнейшем формируют зрелые адгезивные и плотные контакты (TJ). Нокдаун PLLP в клетках MDCK или их обработка ингибиторами эндоцитоза приводит к нарушению локализации CRB3 с его дальнейшим накоплением в области апикальных поверхностей клеток [62–64, 66]. В ходе анализа протеома клеток MDCK обнаружено, что PLLP может колокализоваться с N- и C-концами окклюдина и N-концом клаудина-4. Совместную локализацию PLLP с окклюдином и клаудином-4 в области плотных контактов на базолатеральных плазматических мембранах клеток MDCK в дальнейшем подтвердили путем окрашивания антителами [45].
Рис. 5.
В зрелых сортирующих эндосомах (SE/LE) PLLP может привлекать EpsR, который связывает эндосомный Stx7, и осуществлять рециркуляцию Stx7 через апикальные рециркулирующие эндосомы (ARE) в области апикальной мембрны. PLLP совместно с Stx7 может регулировать интернализацию CRB и рецептора Notch.
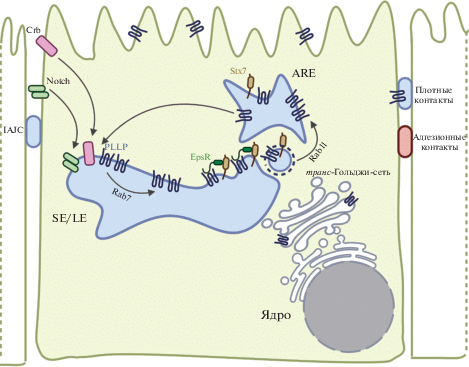
Установлено, что PLLP может играть существенную роль в активации сигнального пути Notch (рис. 5), необходимого для дифференцировки клеток. Нокаут PLLP у D. rerio приводит к нарушению Notch-сигнализации в клетках-предшественниках кишечного эпителия и к дефектам дифференцировки этих клеток. Схожие изменения возникают в клетках с мутацией mib1ta52b, приводящей к нарушению передачи сигналов Notch, или при использовании химических ингибиторов Notch. Взаимодействие Notch с лигандом (например, Jagged-1 или Delta-like1) приводит к расщеплению Notch и высвобождению его внутриклеточного домена (NCID). Нокдаун pllp или EpsR в клетках MDCK приводит к снижению количества NICD, а сверхэкспрессия PLLP стимулирует интернализацию Notch. Совместное культивирование клеток MDCK, экспрессирующих Jagged-1, с клетками, дефектными по PLLP или EpsR, вызывает подавление активации Notch [62, 63].
РОЛЬ ПЛАЗМОЛИПИНА В ПАТОГЕНЕЗЕ ЗАБОЛЕВАНИЙ
Мутации в генах, кодирующих трансмембранные белки миелина, часто ассоциированы с наследственными демиелинизирущими заболеваниями. Так, мутации в гене, кодирующем PLP, приводят к болезни Пелицеуса–Мерцбахера, мутации в PMP22 – к наследственной нейропатии, мутации в гене GJB1, кодирующем коннексин-32, к Х-сцепленной болезни Шарко–Мари–Тута [69–75]. PLLP может быть вовлечен в развитие различных заболеваний.
Онкологические заболевания
Изучение механизмов метастазирования меланомы и рака молочной железы на мышиных моделях выявило существенное увеличение экспрессии генов CXCR4, PLLP и TNFSF4 в метастазах в головной мозг, а также генов Tph2, Sspo и Polas в окружающих их тканях [76, 77]. Известно, что опухолевые клетки глиобластомы претуморальной зоны головного мозга (PBZ) проявляют повышенную способность к инвазии по сравнению с клетками в ядре опухоли (TC). Установлено, что экспрессия PLLP в опухолевых клетках PBZ ниже, чем в клетках ядра опухоли [78].
Демиелинизирующие заболевания
Префронтальная кора составляет значительную часть ЦНС и играет важную роль в формировании социального поведения человека. Изучение профиля экспрессии генов в клетках префронтальной коры головного мозга у людей разного возраста показало, что плазмолипин более значительно вовлечен в регуляцию экспрессии генов, отвечающих за функционирование клеток префронтальной коры у лиц 40–70 лет, чем в более ранние периоды жизни [79]. Предполагают, что PLLP вовлечен в развитие и поддержание нервной системы не только на стадии эмбриогенеза, но и на протяжении всей жизни. Установлено, что хроническая депривация сна может приводить к истончению миелина, нарушению развития предшественников олигодендроцитов и сопровождаться снижением экспрессии генов, участвующих в миелинизации, включая гены PLLP и CD-9. Экспрессия PLLP и других генов, участвующих в формировании миелина (OPALIN,Qk), сильно возрастает уже через несколько часов после засыпания [80–82]. По-видимому, нарушение дифференцировки олигодендроцитов и, как следствие, нарушение миелинизации может приводить к шизофрении и большому депрессивному расстройству. Анализ транскриптома клеток височной коры пациентов с этими заболеваниями выявил значительное снижение экспрессии PLLP и генов, связанных с дифференцировкой олигодендроцитов и структурными компонентами миелина [83–90]. Это представляет существенный интерес, поскольку в участке гена, кодирующего домен ENTH EpsR, обнаружены полиморфизмы, ассоциированные с развитием шизофрении [63, 86, 91]. С помощью протеомного анализа образцов неокортекса, полученных от пациентов с болезнью Альцгеймера, выявлено повышение количества PLLP, что может указывать на его связь с развитим данного заболевания [92].
Эндокринные заболевания
PLLP может быть вовлечен в развитие осложнений, возникающих при сахарном диабете типа 2 (инсулиннезависимый сахарный диабет). К числу таких осложнений относятся диабетическая стопа, микро- и макроангиопатия, почечная недостаточность и ретинопатия, приводящая к слепоте. Показано, что уровень экспрессии PLLP и синтаксина 7 в образцах кожи пациентов с диабетом типа 2 значительно ниже, чем у здоровых людей. Вклад PLLP связывают с его участием в регуляции сигнального пути Notch, вовлеченного в регенерацию эпидермиса и заживление ран [63, 93, 94].
Дегенеративные заболевания глаз
Кератоконус – прогрессирующее дегенеративное заболевание роговицы глаза, приводящее к ухудшению зрительной функции. Этиология этого заболевания до сих пор не известна. В ходе анализа транскриптома образцов, полученных от пациентов с кератоконусом, установлено значительное снижение уровней экспрессии как PLLP, так и Notch1 на начальных стадиях этого заболевания по сравнению с уровнями в образцах, полученных от здоровых доноров. Это косвенно указывает на участие PLLP в поддержании нормальной структуры роговицы человека [95].
Системные заболевания
Саркоидоз – мультисистемное, воспалительное заболевание, отличительной чертой которого является образование гранулем в пораженных органах. В 95% случаев саркоидоза развиваются поражения легких. В результате протеомного анализа обнаружено снижение количества PLLP в смывах, полученных при бронхоальвеолярном лаваже больных саркоидозом. Кроме того, выявлены существенные изменения протеома, позволяющие судить об активном участии различных цитокинов в развитии саркоидоза [96]. Необходимо отметить обратную зависимость между экспрессией PLLP и генов, кодирующих некоторые цитокины и факторы роста (IL-1, IL-6, IL-8, VEGFA), что может косвенно указывать на возможное участие PLLP в механизмах регуляции экспрессии этих генов [83, 84, 97–101].
Генетические заболевания
Гиперальфалипопротеинемия – редкое заболевание, вызванное нарушением обмена липопротеинов, при котором повышается содержание липопротеинов высокой потности (HDL) в плазме крови. HDL участвуют в обратном транспорте холестерина, обладают антиоксидантными и противовоспалительными свойствами, тем самым способствуя кардиопротекции. При помощи полноэкзомного секвенирования образцов, полученных от пациентов с гиперальфалипопротеинемией, выявлено несколько несинонимичных однонуклеотидных полиморфизмов (nsSNP) в генах, связанных с обменом липидов. Необходимо отметить, что в гене PLLP обнаружены три nsSNP, что может указывать на возможность участия PLLP в обмене липидов и развитии гиперальфалипопротеинемии [102]. Известно, что новосинтезированный белок apoA-I, секретируемый гепатоцитами и энтероцитами, участвует в биогенезе еще незрелых частиц HDL, взаимодействуя с ATP-связывающим кассетным транспортером типа A1 (ABCA1). Это взаимодействие опосредует отток клеточного холестерина и фосфолипидов от клеточной мембраны к apoA-I с последующим образованием дискоидных предшественников HDL (pre-β-HDL). Уменьшение количества холестерина и фосфолипидов на плазматической мембране приводит к подавлению оттока холестерина, опосредованного ABCA1, в то время как избыток холестерина и фосфолипидов приводит к его увеличению. Таким образом, представленность холестерина на плазматических мембранах гепатоцитов и энтероцитов может влиять на образование HDL [6, 103, 104]. Интересно, что в результате замены A53V в молекуле PLLP появляется дополнительный ØxxØ-мотив, который может облегчить олигомеризацию PLLP, необходимую для образования и поддержания богатых холестерином липидных рафтов.
На длинном плече хромосомы 16 (16q13), где картирован ген PLLP человека, локализован также локус гена BBS2 (16q13–21), мутации в котором вызывают синдром Барде–Бидля типа 2 – редкое аутосомно-доминантное наследственное заболевание, имеющее полиморфные клинические проявления, включая колбочко-палочковую дистрофию, ожирение, дисфункцию почек и умственную отсталость. Предполагают, что PLLP может быть связан с развитием синдрома Барде–Бидля типа 2 [21, 105].
Роль плазмолипина и его гомологов в вирусной инфекции
Эндогенный ретровирус мышей Mus caroli (McERV) считается родственным вирусу лейкоза гиббонов (GALV), а также эндогенным ретровирусам M. dunni (MDEV) и M. musculus (MmERV) [106]. В результате анализа, проведенного с помощью бактериальных искусственных хромосом, установленно, что PLLP может использоваться в качестве рецептора для проникновения McERV в клетку. Как уже отмечено ранее, PLLP человека и мыши имеют высокую степень гомологии. McERV способен эффективно заражать клетки как мыши, так и человека, что имеет существенное значение в связи с высокой вероятностью межвидового переноса [106, 107].
Вирусы желтой головы (YHV) и синдрома белого пятна (WSSV) относятся к основным патогенным вирусам белых креветок (Litopenaeus vannamei) и черных тигровых креветок (Penaeus monodon), они вызывают массовую гибель ракообразных в условиях аквакультуры. Лимфоидные органы, жабры и мягкие ткани головы относятся к основным мишеням YHV. Известно, что развитие инфекций, вызванных YHV и WSSV, способствует повышению экспрессии двух изоформ PLLP – PmPLP1 и PmPLP2, которые синтезируются в здоровых тканях лимфоидных органов, нервных тканях, жабрах, гемоцитах и кишечнике креветок и служат рецепторами для проникновения вирусов в клетку [108, 109].
Все эти данные указывают на возможное участие PLLP и его гомологов в патогенезе вирусных инфекций. Известно, что часть вирусных белков (например, ZIKV, SARS-CoV-2) содержит общий YxxØ-мотив, который обеспечивает их связывание с клеточными адаптерными белками, вовлеченными во внутриклеточный транспорт. PLLP участвует во внутриклеточном транспорте белков, часто обнаруживается на плазматической мембране и способен привлекать белок EpsR, который, в свою очередь, также может взаимодействовать с адаптерными белками. Приведенные сведения могут указывать на участие PLLP в регуляции внутриклеточных механизмов, ответственных за важные этапы жизненного цикла вирусов, например, за проникновение вирусов в клетку [110, 111].
Обзор подготовлен при финансовой поддержке Российского фонда фундаментальных исследований (гранты № 17-29-06049 и № 20-04-60401).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Folch J., Lees M. (1951) Proteolipides, a new type of tissue lipoproteins; their isolation from brain. J. Biol. Chem. 191(2), 807–817.
Eng L.F., Chao F.-C., Gerstl B., Pratt D., Tavaststjerna M.G. (1968) The maturation of human white matter myelin. Fractionation of the myelin membrane proteins. Biochem. 7(12), 4455–4465.
Siegel G., Albers R.W., Brady S., Price D. (2006) Basic Neurochemistry: Molecular, Cellular and Medical Aspects. 7th ed. Elsevier Acad. Press Inc.
Agrawal H.C., Hartman B.K., Shearer W.T., Kalmbach S., Margolis F.L. (1977) Purification and immunohistochemical localization of rat brain myelin proteolipid protein. J. Neurochem. 28, 495–508.
Lees M., Sakura D., Sapirstein V., Curatolo W. (1979) Structure and function of proteolipids in myelin and non-myelin membranes. Biochim. Biophys. Acta. 559, 209–230.
Folch-Pi J., Stoffyn P.J. (1972) Proteolipids from membrane systems. Ann. N.Y. Acad. Sci. 195, 86–107.
Guerin M., Napias C. (1978) Phosphate transport in yeast mitochondria: purification and characterization of a mitoribosomal synthesis dependent proteolipid showing a high affinity for phosphate. Biochem. 17(13), 2510–2516.
Racker E., Eytan E. (1975) A coupling factor from sarcoplasmic reticulum required for the translocation of Ca2+ ions in a reconstituted Ca2+ATPase pump. J. Biol. Chem. 250(18), 7533–7534.
Farrell L.B., Nagley P. (1987) Human liver cDNA clones encoding proteolipid subunit 9 of the mitochondrial ATPase complex. Biochem. Biophys. Res. Commun. 144(3), 1257–1264.
Sapirstein V., Rounds T.C. (1983) Circular dichroism and fluorescence studies on a cation channel forming plasma membrane proteolipid. Biochemistry. 22(14), 3330–3335.
Fischer I., Durrie R., Sapirstein V. (1994) Plasmolipin: the other myelin proteolipid. A review of studies on its structure, expression, and function. Neurochem. Res. 19(8), 959–966.
Tosteson M.T., Sapirstein V. (1981) Protein interactions with lipid bilayers: the channels of kidney plasma membrane proteolipids. J. Membrane Biol. 63, 77–84.
Gillen C., Gleichmann M., Greiner-Petter R., Zoidl G., Kupfer S., Bosse F., Auer J., Muller H.W. (1996) Full-length cloning, expression and cellular localization of rat plasmolipin mRNA, a proteolipid of PNS and CNS. Europ. J. Neurosci. 8, 405–414.
Wilson G.F., Chiu S.Y. (1993) Mitogenic factors regulate ion channels in Schwann cells cultured from newborn rat sciatic nerve. J. Physiol. 470, 501–520.
Fischer I., Sapirstein V. (1986) Characterization and biosynthesis of the plasma membrane proteolipid protein in neural tissue. J. Neurochem. 47, 232–238.
Fischer I., Sapirstein V. (1994) Molecular cloning of plasmolipin. Characterization of a novel proteolipid restricted to brain and kidney. J. Biol. Chem. 269(40), 24912–24919.
Kalwy S.A., Smith R., Kidd G.J. (1997) Myelin proteolipid protein expressed in COS-1 cells is targeted to actin-associated surfaces. J. Neurosci. Res. 48, 201–211.
Cochary E.F., Bizzozero O.A., Sapirstein V., Nolan C., Fischer I. (1990) Presence of the plasma membrane proteolipid (plasmolipin) in myelin. J. Neurochem. 55, 602–610.
Rost B., Sander C. (1994) Combining evolutionary information and neural networks to predict protein secondary structure. Proteins. 19, 55–72.
Yaffe Y., Shepshelovitch J., Nevo-Yassaf I., Yeheskel A., Shmerling H., Kwiatek J.M., Gaus K., Pasmanik-Chor M., Hirschberg K. (2012) The MARVEL transmembrane motif of occluding mediates oligomerization and targeting to the basolateral surface in epithelia. J. Cell. Sci. 125(15), 3545–3556.
Hamacher M., Pippirs U., Kohler A., Muller H.W., Bosse F. (2001) Plasmolipin: genomic structure, chromosomal localization, protein expression pattern, and putative association with Bardet-Biedl syndrome. Mammalian Genome. 12, 933–937.
Strausberg R.L., Feingold E.A., Grouse L.H., Derge J.G., Klausner R.D., Collins F.S., Wagner L., Shenmen C.M., Schuler G.D., Altschul S.F., Zeeberg B., Buetow K.H., Schaefer C.F., Bhat N.K., Hopkins R.F., Jordan H., Moore T., Max S.I., Wang J., Hsieh F., Diatchenko L., Marusina K., Farmer A.A., Rubin G.M., Hong L., Stapleton M., Soares M.B., Bonaldo M.F., Casavant T.L., Scheetz T.E., Brownstein M.J., Usdin T.B., Toshiyuki S., Carninci P., Prange C., Raha S.S., Loquellano N.A., Peters G.J., Abramson R.D., Mullahy S.J., Bosak S.A., McEwan P.J., McKernan K.J., Malek J.A., Gunaratne P.H., Richards S., Worley K.C., Hale S., Garcia A.M., Gay L.J., Hulyk S.W., Villalon D.K., Muzny D.M., Sodergren E.J., Lu X., Gibbs R.A., Fahey J., Helton E., Ketteman M., Madan A., Rodrigues S., Sanchez A., Whiting M., Madan A., Young A.C., Shevchenko Y., Bouffard G.G., Blakesley R.W., Touchman J.W., Green E.D., Dickson M.C., Rodriguez A.C., Grimwood J., Schmutz J., Myers R.M., Butterfield Y.S.N., Krzywinski M.I., Skalska U., Smailus D.E., Schnerch A., Schein J.E., Jones S.J.M., Marra M.A. (2002) Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences. Proc. Natl. Acad. Sci. USA. 99(26), 16899–16903.
Martin J., Han C., Gordon L.A., Terry A., Prabhakar S., She X., Xie G., Hellsten U., Man Chan Y., Altherr M., Couronne O., Aerts A., Bajorek E., Black S., Blumer H., Branscomb E., Brown N.C., Bruno W.J., Buckingham J.M., Callen D.F., Campbell C.S., Campbell M.L., Campbell E.W., Caoile C., Challacombe J.F., Chas-teen L.A., Chertkov O., Chi H.C., Christensen M., Clark L.M., Cohn J.D., Denys M., Detter J.C., Dickson M., Dimitrijevic-Bussod M., Escobar J., Fawcett J.J., Flowers D., Fotopulos D., Glavina T., Gomez T., Gonzales E., Goodstein D., Goodwin L.A., Grady D.L., Grigoriev I., Groza M., Hammon N., Hawkins T., Haydu L., Hildebrand C., Huang W., Israni S., Jett J., Jewett P.B., Kadner K., Kimball H., Kobayashi A., Krawczyk M.-K., Leyba T., Longmire J.L., Lopez F., Lou Y., Lowry S., Ludeman T., Manohar C.F., Mark G.A., McMurray K.L., Mein-cke L.J., Morgan J., Moyzis R.K., Mundt M.O., Munk C., Nandkeshwar R.D., Pitluck C., Pollard M., Predki P., Parson-Quintana B., Ramirez C., Rash S., Retterer J., Ricke D.O., Robinson D.L., Rodriguez A., Salamov A., Saunders E.H., Scott D., Shough T., Stallings R.L., Stalvey M., Sutherland R.D., Tapia R., Tesmer J.G., Thayer N., Thompson L.S., Tice H., Torney D.C., Tran-Gyamfi M., Tsai M., Ulanovsky L.E., Ustaszewska A., Vo N., White P.S., Williams A.L., Wills P.L., Wu J.-R., Wu K., Yang J., Dejong P., Bruce D., Doggett N.A., Deaven L., Schmutz J., Grimwood J., Richardson P., Rokhsar D.S., Eichler E.E., Gilna P., Lucas S.M., Myers R.M., Rubin E.M., Pennacchio L.A. (2004) The sequence and analysis of duplication-rich human chromosome 16. Nature. 432(7020), 988–994.
Fischer I., Cochary E.F., Konola J.T., Romano-Clarke G. (1991) Expression of plasmolipin in oligodendrocytes. J. Neurosci. Res. 28, P. 81–89.
Alonso M.A., Weissman S.M. (1987) cDNA cloning and sequence of MAL, a hydrophobic protein associated with human T-cell differentiation. Proc. Natl. Acad. Sci. USA. 84, 1997–2001.
Magyar J., Ebensperger C., Schaeren-Wiemers N., Suter U. (1997) Myelin and lymphocyte protein (MAL/MVP17/VIP17) and plasmolipin are members of an extended gene family. Gene. 189, P. 269–275.
Kim T., Fiedler K., Madison D.L., Krueger W.H., Pfeiffer S.E. (1995) Cloning and characterization of MVPl7: a developmentally regulated myelin protein in oligodendrocytes. J. Neurosci. Res. 42, 413–422.
Puertollano R., Alonso M.A. (1999) MAL, an integral element of the apical sorting machinery, is an itinerant protein that cycles between the trans-Golgi network and the plasma membrane. Mol. Biol. Cell. 10, 3435–3447.
Puertollano R., Martin-Belmonte F., Millan J., de Marco M.C., Albar J.P., Kremer L., Alonso M.A. (1999) The MAL proteolipid is necessary for normal apical transport and accurate sorting of the influenza virus hemagglutinin in Madin-Darby canine kidney cells. J. Cell Biol. 145(1), 141–151.
Martin-Belmonte F., Arvan P., Alonso M.A. (2001) MAL mediates apical transport of secretory proteins in polarized epithelial Madin-Darby canine kidney cells. J. Biol. Chem. 276(52), 49337–49342.
Perez P., Puertollano R., Alonso M.A. (1997) Structural and biochemical similarities reveal a family of proteins related to the MAL proteolipid, a component of detergent-insoluble membrane microdomains. Biochem. Biophys. Res. Commun. 232, 618–621.
Sanchez-Pulido L., Martin-Belmonte F., Valencia A., Alonso M.A. (2002) MARVEL: a conserved domain involved in membrane apposition events. Trends Biochem. Sci. 27(12), 599–601.
Janz R., Sudhof T.C., Hammer R.E., Unni V., Siegelbaum S.A., Bolshakov V.Y. (1999) Essential roles in synaptic plasticity for synaptogyrin I and synaptophysin I. Neuron. 24(3), 687–700.
Haass N.K., Kartenbeck M.A., Leube R.E. (1996) Pantophysin is a ubiquitously expressed synaptophysin homologue and defines constitutive transport vesicles. J. Cell Biol. 134(3), 731–746.
Furuse M., Hirase T., Itoh M., Nagafuchi A., Yonemura S., Tsukita S. (1993) Occludin: a novel integral membrane protein localizing at tight junctions. J. Cell Biol. 123(6), 1777–1788.
Raleigh D.R., Marchiando A.M., Zhang Y., Shen L., Sasaki H., Wang Y., Long M., Turner J.R. (2010) Tight junction-associated MARVEL proteins marveld3, tricellulin, and occludin have distinct but overlapping functions. Mol. Biol. Cell. 21, 1200–1213.
Chou A., Lee A., Hendargo K.J., Reddy V.S., Shly-kov M.A., Kuppusamykrishnan H., Medrano-Soto A., Saier Jr M.A. (2017) Characterization of the tetraspan junctional complex (4JC) superfamily. Biochim. Biophys. Acta. 1859(3), 402–414.
Bosse F., Hasse B., Pippirs U., Greiner-Petter R., Muller H.W. (2003) Proteolipid plasmolipin: localization in polarized cells, regulated expression and lipid raft association in CNS and PNS myelin. J. Neurochem. 86, 508–518.
Cochary E., Konola J., Fischer I. (1990) Expression and localization of plasmolipin in oligodendroglia. Trans. Am. Soc. Neurochem. 21, 397.
Sapirstein V., Durrie R., Nolan C., Marks N. (1993) Identification of membrane-bound carbonic anhydrase in white matter coated vesicles: the fate of carbonic anhydrase and other white matter coated vesicle proteins in triethyl tin-induced leukoencephalopathy. J. Neurosci. Res. 35, 83–91.
Sapirstein V., Durrie R., Cherksey B., Beard M.E., Flynn C.J., Fischer I. (1992) Isolation and characterization of periaxolemmal and axolemmal enriched membrane fractions from the rat central nervous system. J. Neurosci. Res. 32, 593–604.
Yaffe Y., Hugger I., Yassaf I.N., Shepshelovitch J., Sklan E.H., Elkabetz Y., Yeheskel A., Pasmanik-Chor M., Benzing C., Macmillan A., Gaus K., Eshed-Eisenbach Y., Peles E., Hirschberg K. (2015) The myelin proteolipid plasmolipin forms oligomers and induces liquid-ordered membranes in the Golgi complex. J. Cell Sci. 128, 2293–2302.
Shea T., Fischer I., Sapirstein V. (1986) Expression of a plasma membrane proteolipid during differentiation of neuronal and glial cells in primary culture. J. Neurochem. 47, 697–706.
Hasse B., Bosse F., Muller H.W. (2002) Proteins of peripheral myelin are associated with glycosphingolipid/cholesterol-enriched membranes. J. Neurosci. Res. 69, 227–232.
Fredriksson K., Van Itallie C.M., Aponte A., Gucek M., Tietgens A.J., Anderson J.M. (2015) Proteomic analysis of proteins surrounding occludin and claudin-4 reveals their proximity to signaling and trafficking networks. PloS One. 10(3), e0117074.
Sapirstein V., Nolan C., Stern R., Ciocci M., Masur S. (1988) Identification of the plasma membrane proteolipid protein as a constituent of brain coated vesicles and synaptic plasma membrane. J. Neurochem. 51, 925–933.
Sapirstein V., Nolan C., Stern R., Gray-Board G., Beard M. (1992) Identification of plasmolipin as a major constituent of white matter clathrin-coated vesicles. J. Neurochem. 58, 1372–1378.
Haucke V. (2005) Phosphoinositide regulation of clathrin-mediated endocytosis. Biochem. Soc. Trans. 33(6), 1285–1289.
Sapirstein V., Nolan C., Stadler I.I., Fischer I. (1992) Expression of plasmolipin in the developing rat brain. J. Neurosci. Res. 31, 96–102.
Shea T.B., Fischer I. (1989) Expression of the plasma membrane proteolipid in mouse neuroblastoma cells: transient increase in synthesis during differentiation with N6,O2-dibutyryl adenosine 3',5'-cyclic monophosphate. Expl. Cell. Biol. 57, 131–138.
Magal L.G., Yaffe Y., Shepshelovich J., Aranda J.F., de Marco M.C., Gaus K., Alonso M.A., Hirschberg K. (2009) Clustering and lateral concentration of raft lipids by the MAL protein. Mol. Biol. Cell. 20(16), 3751–3762.
Seabra M.C., Mules E.H., Hume A.N. (2002) Rab GTPases, intracellular traffic and disease. Trends Mol. Med. 2002. 8(1), 23–30.
Bonifacino J.S., Glick B.S. (2004) The mechanisms of vesicle budding and fusion. Cell. 116(2), 153–166.
Mills I.G., Praefcke G.J.K., Vallis Y., Peter B.J., Olesen L.E., Gallop J.L., Butler P.J.G., Evans P.R., McMahon H.T. (2003) EpsinR: an AP1/clathrin interacting protein involved in vesicle trafficking. J. Cell. Biol. 160(2), 213–222.
Perret E., Lakkaraju A., Deborde S., Schreiner R., Rodriguez-Bouln E. (2005) Evolving endosomes: how many varieties and why? Curr. Opin. Cell Biol. 17(4), 423–434.
Winckler B., Faundez V., Maday S., Cai Q., Almeida C.G., Zhang H. (2018) The endolysosomal system and proteostasis: from development to degeneration. J. Neurosci. 38(44), 9364–9374.
Hu C., Ahmed M., Melia T.J., Sollner T., Mayer T., Rothman J. (2003) Fusion of cells by flipped SNAREs. Science. 300(5626), 1745–1749.
Miller S.E., Collins B.M., McCoyA.J., Robinson M.S., Owen D.J. (2007) A SNARE-adaptor interaction is a new mode of cargo recognition in clathrin-coated vesicles. Nature. 450(7169), 570–574.
Chidambaram S., Müllers N., Wiederhold K., Haucke V., Fischer von Mollard G. (2004) Specific interaction between SNAREs and epsin N-terminal homology (ENTH) domains of epsin-related proteins in trans-Golgi network to endosome transport. J. Biol. Chem. 279(6), 4175–4179.
Попова Н.В., Деев И.Е., Петренко А.Г. (2013) Клатрин-зависимый эндоцитоз и белки-адаптеры. Acta Naturae. 5(3), 66–77.
Prekeris R., Yang B., Oorschot V., Klumperman J., Scheller R.H. (1999) Differential roles of syntaxin 7 and syntaxin 8 in endosomal trafficking. Mol. Biol. Cell. 10(11), 3891–3908.
Guelte A.L., Macara I.G. (2015) Plasmolipin – a new player in endocytosis and epithelial development. EMBO J. 34(9), 1147–1148.
Rodriguez-Fraticelli A.E., Bagwell J., Bosch-Fortea M., Boncompain G., Reglero-Real N., Garcia-Leon M.J., Andres G., Toribio M.L., Alonso M.A., Millan J., Perez F., Bagnat M., Martin-Belmonte F. (2015). Developmental regulation of apical endocytosis controls epithelial patterning in vertebrate tubular organs. Nat. Cell. Biol. 17, 241–250.
Rodriguez-Boulan E., Macara I.G. (2014) Organization and execution of the epithelial polarity programme. Nat. Rev. Mol. Cell Biol. 15, 225–242.
Roux K.J., Kim D.I., Raida M., Burke B. (2012) A promiscuous biotin ligase fusion protein identifies proximal and interacting proteins in mammalian cells. J. Cell. Biol. 196(6), 801–810.
Thompson B.J., Pichaud F., Roper K. (2013) Sticking together the Crumbs – an unexpected function for an old friend. Nat. Rev. Mol. Cell. Biol. 14, 307–314.
Jewett C.E., Prekeris R. (2018) Insane in the apical membrane: trafficking events mediating apicobasal epithelial polarity during tube morphogenesis. Traffic. 19, 666–678.
Vaccari T., Lu H., Kanwar R., Fortini M.E., Bilder D. (2008) Endosomal entry regulates Notch receptor activation in Drosophila melanogaster. J. Cell. Biol. 180(4), 755–762.
Spreyer P., Kuhn G., Hanemann C., Gillen C., Schaal H., Kuhn R., Lemke G., Müller H.W. (1991) Axon-regulated expression of a Schwann cell transcript that is homologous to a ‘growth arrest-specific’ gene. EMBO J. 10(12), 3661–3668.
Schaeren-Wiemers N., Valenzuela D.M., Frank M., Schwab M.E. (1995) Characterization of a rat gene, rMAL, encoding a protein with four hydrophobic domains in central and peripheral myelin. J. Neurosci. 15(8), 5753–5764.
Bennett M.V.L., Bario L.C., Bargiello T.A., Spray D.C., Hertzberg E., Sáez J.C. (1991) Gap junctions: new tools, new answers, new questions. Neuron. 6, 305–320.
Hobson G.M., Garbern J.Y. (2012) Pelizaeus–Merzbacher disease, Pelizaeus–Merzbacher-like disease 1, and related hypomyelinating disorders. Semin. Neurol. 32, 62–67.
Lupski J.R., Wise C.A., Kuwano A., Pentao L., Parke T.J., Glaze D.G., Ledbetter D.H., Greenberg F., Patel P.I. (1992) Gene dosage is a mechanism for Charcot–Marie–Tooth disease type 1A. Nat. Genet. 1(1), 29–33.
Bergoffen J., Scherer S.S., Wang S., Scott M.O., Bone L.J., Paul D.L., Chen K., Lensch M.W., Chance P.F., Fischbeck K.H. Connexin mutations in X-linked Charcot–Marie–Tooth disease. Science. 262(5142), 2039–2042.
Chance P.F., Alderson M.K., Leppig K.A., Lensch M.W., Matsunami N., Smith B., Swanson P.D., Odelberg S.J., Disteche C.M., Bird T.D. (1993) DNA deletion associated with hereditary neuropathy with liability to pressure palsies. Cell. 72, 143–151.
Sato R., Nakano T., Hosonaga M., Sampetrean O., Harigai R., Sasaki T., Koya I., Okano H., Kudoh J., Saya H., Arima Y. (2017) RNA sequencing analysis reveals interactions between breast cancer or melanoma cells and the tissue microenvironment during brain metastasis. Biomed. Res. Int. 1–10.
Bos P.D., Zhang X. H.-F, Nadal C., Shu W., Go-mis R.R., Nguyen D.X., Minn A.J., van de Vijver M.J., Gerald W.L., Foekens J.A., Massagué J. (2009) Genes that mediate breast cancer metastasis to the brain. Nature. 459(7249), 1005–1009.
Luo X., Xu S., Zhong Y., Tu T., Xu Y., Li X., Wang B., Yang F. (2019) High gene expression levels of VEGFA and CXCL8 in the peritumoral brain zone are associated with the recurrence of glioblastoma: a bioinformatics analysis. Oncol. Lett. 18(6), 6171–6179.
Wang H., Wu Y., Fang R., Sa J., Li Z., Cao H., Cui Y. (2020) Time-varying gene network analysis of human prefrontal cortex development. Front. Genet. 11, 1–17.
Bellesi M., Haswell J.D., Vivo L., Marshall W., Roseboom P., Tononi G., Cirelli C. (2018) Myelin modifications after chronic sleep loss in adolescent mice. Sleep. 41(5), 1–11.
Bellesi M., Pfister-Genskow M., Maret S., Keles S., Tononi G., Cirelli C. (2013) Effects of sleep and wake on oligodendrocytes and their precursors. J. Neurosci. 33(36), 14288–14300.
Nakamura Y., Iwamoto R., Mekada E. (1996) Expression and distribution of CD9 in myelin of the central and peripheral nervous systems. Am. J. Pathol. 149(2), 575–583.
Aston C., Jiang L., Sokolov B. (2004) Microarray analysis of postmortem temporal cortex from patients with schizophrenia. J. Neurosci. Res. 77(6), 858–866.
Aston C., Jiang L., Sokolov B. (2005) Transcriptional profiling reveals evidence for signaling and oligodendroglial abnormalities in the temporal cortex from patients with major depressive disorder. Mol. Psych. 10, 309–322.
Коломеец Н.С. (2017) Нарушения дифференцировки олигодендроцитов в мозге при шизофрении: связь с основными гипотезами заболевания. Журн. неврологии и психиатрии им. С.С. Корсакова. 117(8), 108–117.
Tang R.Q., Zhao X.Z., Shi Y.Y., Tang W., Gu N.F., Feng G.Y., Xing Y.L., Zhu S.M., Sang H., Liang P.J., He L. (2006) Family-based association study of epsin 4 and schizophrenia. Mol. Psych. 11(4), 395–399.
Harrison P.J. (1999) The neuropathology of schizophrenia. A critical review of the data and their interpretation. Brain. 122, 593–624.
Tkachev D., Mimmack M.L., Ryan M.M., Wayland M., Freeman T., Jones P.B., Starkey M., Webster M.J., Yolken R.H., Bahn S. (2003) Oligodendrocyte dysfunction in schizophrenia and bipolar disorder. Lancet. 362, 798–805.
Mirnics K., Middleton F.A., Marquez A., Lewis D.A., Levitt P. (2000) Molecular characterization of schizophrenia viewed by microarray analysis of gene expression in prefrontal cortex. Neuron. 28, 53–67.
Meucci O., Fatatis A., Simen A.A., Miller R.J. (2000) Expression of CX3CR1 chemokine receptors on neurons and their role in neuronal survival. Proc. Natl. Acad. Sci. USA. 97, 8075–8080.
Pimm J., McQuillin A., Thirumalai S., Lawrence J., Quested D., Bass N., Lamb G., Moorey H., Datta S.R., Kalsi G., Badacsonyi A., Kelly K., Morgan J., Punukollu B., Curtis D., Gurling H. (2005) The epsin 4 gene on chromosome 5q, which encodes the clathrin-associated protein enthoprotin, is involved in the genetic susceptibility to schizophrenia. Am. J. Hum. Genet. 76(5), 902–907.
Musunuri S., Wetterhall M., Ingelsson M., Lannfelt L., Artemenko K., Bergquist J., Kultima K., Shevchenko G. (2014) Quantification of the brain proteome in Alzheimer’s disease using multiplexed mass spectrometry. J. Proteome Res. 13, 2056–2068.
Takematsu E., Spencer A., Auster J., Chen P.-C., Graham A., Martin P., Baker A.B. (2020) Genome wide analysis of gene expression changes in skin from patients with type 2 diabetes. PloS One. 15(2), e0225267.
Shu B., Yang R., Shi Y., Xu Y.-B., Wang P., Lio X.S., Qi S.-H., Xie J.-L. (2016) Notch1 signaling regulates wound healing via changing the characteristics of epidermal stem cells. J. Stem Cell Res. Ther. 6(7), 1–10.
You J., Corley S., Wen L., Hodge C., Höllhumer R., Madigan M.C., Wilkins M.R., Sutton G. (2018) RNA-Seq analysis and comparison of corneal epithelium in keratoconus and myopia patients. Sci. Rep. 8(1), 1–13.
Bhargava M., Viken K.J., Barkes B., Griffin T.J., Gillespie M., Jagtap P.D., Sajulga R., Peterson E.J., Dincer H.E., Li L., Restrepo C.I., O’Connor B.P., Fingerlin T.E., Perlman D.M., Maier L.A. (2020) Novel protein pathways in development and progression of pulmonary sarcoidosis. Sci. Rep. 10, 13282.
Swindell W.R., Beamer M.A., Sarkar M.K., Loftus S., Fullmer J., Xing X., Ward N.L., Tsoi L.C., Kahlenberg M.J., Liang Y., Gudjonsson J.E. (2018) RNA-Seq analysis of IL-1B and IL-36 responses in epidermal keratinocytes identifies a shared MyD88-dependent gene signature. Front. Immunol. 9(80), 1–20.
Luo X., Xu S., Zhong Y., Tu T., Xu Y., Li X., Wang B., Yang F. (2019) High gene expression levels of VEGFA and CXCL8 in the peritumoral brain zone are associated with the recurrence of glioblastoma: a bioinformatics analysis. Oncol. Lett. 18, 6171–6179.
Shelton R.C., Claiborne J., Sidoryk-Wegrzynowicz M., Reddy R., Aschner M., Lewis D.A., Mirnics K. (2011) Altered expression of genes involved in inflammation and apoptosis in frontal cortex in major depression. Mol. Psychiatry. 16(7), 751–762.
Zhou B., Zhu Z., Ransom B.R., Xiaoping T. (2021) Oligodendrocyte lineage cells and depression. Mol. Psychiatry. 26, 103–117
Xu L., Qi X., Zhu C., Wan L. (2018) Activation of IL-8 and its participation in cancer in schizophrenia patients: new evidence for the autoimmune hypothesis of schizophrenia. Neur. Dis. Treat. 14, 3393–3403.
Oates C.P., Koenig D., Rhyne J., Bogush N., O’Connel J., Mitchell B.D., Miller M. (2018) Novel polymorphisms associated with hyperalphalipoproteinemia and apparent cardioprotection. J. Clin. Lipidol. 12(1), 110–115.
Sun Y., Hao M., Luo Y., Liang C.-P., Silver D.L., Cheng C., Maxfield F.R., Tall A.R. (2003) Stearoyl-CoA desaturase inhibits ATP-binding cassette transporter A1-mediated cholesterol efflux and modulates membrane domain structure. J. Biol. Chem. 278(8), 5813–5820.
Rothblat G.H., Phillips M.C. (2010) High-density lipoprotein heterogeneity and function in reverse cholesterol transport. Curr. Opin. Lipidol. 21(3), 229–238.
Kwitek-Black A.E., Carmi R., Duyk G.M., Buetow K.H., Elbedour K., Parvari R., Yandava C.N., Stone E.M., Sheffield V.C. (1993) Linkage of Bardet–Biedl syndrome to chromosome 16q and evidence for non-allelic genetic heterogeneity. Nat. Genet. 5, 392–396.
Denner J. (2016) Transspecies transmission of gammaretroviruses and the origin of the gibbon ape leukaemia virus (GaLV) and the koala retrovirus (KoRV). Viruses. 8(336), 1–10.
Miller A.D., Bergholz U., Ziegler M., Stocking C. (2008) Identification of the myelin protein plasmolipin as the cell entry receptor for Mus caroli endogenous retrovirus. J. Virol. 82(14), 6862–6868.
Vatanavicharn T., Pongsomboon S., Tassanakajon A. (2012) Two plasmolipins from the black tiger shrimp, Penaeus monodon and their response to virus pathogens. Dev. Comp. Immunol. 8, 389–394.
Matjank W., Ponprateep S., Rimphanitchayakit V., Rimphanitchayakit V., Tassanakajon A., Somboonwiwat K., Vatanavicharn T. (2018) Plasmolipin, PmPLP1, from Penaeus monodon is a potential receptor for yellow head virus infection. Dev. Compar. Immun. 88, 137–143.
Yuan S., Chu H., Huang J., Zhao X., Ye Z.-W., Lai P.-M., Wen L., Cai J.-P., Mo Y., Cao J., Liang R., Poon V. K.-M., Sze K.-H., Zhou J., To K. K.-W., Chen Z., Chen H., Jin D.-Y., Chan J. F.-W., Yuen K.-Y. (2020) Viruses harness YxxØ motif to interact with host AP2M1 for replication: a vulnerable broad-spectrum antiviral target. Sci. Adv. 6, eaba7910.
Hist J., Motley A., Harasaki K., Chew S.Y.P., Robinson M.S. (2003) EpsinR: an ENTH domain-containing protein that interacts with AP-1. Mol. Biol. Cell. 14(2), 625–641.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология