Молекулярная биология, 2022, T. 56, № 2, стр. 336-342
Адаптация биологического микрочипа для анализа сывороточного амилоидного белка А в сыворотке крови человека
О. В. Смолдовская a, *, С. А. Волошин a, А. А. Новиков b, Е. Н. Александрова b, Г. У. Фейзханова a, А. Ю. Рубина a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский клинический научный центр им. А.С. Логинова
111123 Москва, Россия
* E-mail: grasshopper27@list.ru
Поступила в редакцию 30.06.2021
После доработки 08.09.2021
Принята к публикации 08.09.2021
- EDN: ITKJXL
- DOI: 10.31857/S0026898422020173
Аннотация
Содержание одного из белков острой фазы – сывороточного амилоидного белка А (SAA) – изменяется при инфекционных и воспалительных заболеваниях. Однако склонность SAA к агрегации и комплексообразованию затрудняет определение его концентрации в образцах, особенно с повышенным содержанием этого белка. Метод иммунофлуоресцентного мультиплексного анализа провоспалительных маркеров на биочипе адаптирован нами к определению SAA в сыворотке крови человека: подобраны калибровочные пробы и условия проведения анализа, при которых динамический диапазон определения составляет от 1 до 100 мкг/мл. Для изготовления калибраторов использовали смеси сывороток крови животных (кролика, козла, мыши) с добавлением определенных концентраций рекомбинантного антигена. Метод протестирован на образцах сывороток крови 15 больных ревматоидным артритом или анкилозирующим спондилитом и 9 здоровых доноров. Показано, что результаты, получаемые на биочипе, хорошо коррелируют с результатами определения SAA с помощью ИФА (коэффициент корреляции Пирсона 0.93). Разработанный метод может использоваться для оценки уровня SAA при таких заболеваниях, как ревматоидный артрит или инфекции различной этиологии, характеризующиеся значимым увеличением содержания SAA в крови. Использование биочипа позволяет определять концентрации SAA совместно с другими маркерами воспаления.
ВВЕДЕНИЕ
Сывороточный амилоидный белок А (serum amyloid A, SAA) – один из белков острой фазы, вырабатывающийся при различных воспалительных процессах. Белки семейства SAA синтезируются преимущественно в печени. Будучи аполипопротеинами, они, как правило, существуют в связанной форме, образуя комплексы с липопротеинами, в основном, с липопротеинами высокой плотности. Подобное связывание стабилизирует альфа-спираль в структуре SAA и защищает его от протеолиза и неправильного сворачивания [1]. Помимо липопротеинов высокой плотности, SAA способен взаимодействовать с липопротеинами других классов (липопротеины низкой и очень низкой плотности) [2], а также c рецепторами, участвующими в защите хозяина или в метаболизме липидов (TLR, RAGE, SR-B1, CLA-1, LOX1, P2X7, FPR2), базальными белками мембран (фибронектин, ламинин), белками плазмы крови (цистатин, фибрин) [3, 4].
Нормальный уровень SAA в плазме здоровых взрослых доноров не превышает 10 мг/л, в то же время медианное значение концентрации SAA в европейской популяции составляет 3 мг/л [5]. Концентрация SAA в крови повышается при бактериальных и вирусных инфекциях. В процессе развития инфекционного воспаления уровень SAA, как и С-реактивного белка (СРБ), может возрасти более чем в 1000 раз, достигая пикового значения через 2–3 дня после начала воспаления. Так, показано, что значительное повышение уровней SAA и СРБ имеет большее значение для прогноза тяжести течения COVID-19, чем уровни прокальцитонина и лейкоцитов [6]. Кроме того, содержание SAA может изменяться в зависимости от стадии или активности рака легкого [7], других онкопатологий [8], при переднем увеите [9], периодической болезни [10] и большинстве ревматических заболеваний.
Несмотря на то, что при ряде заболеваний SAA является эффективным и более чувствительным маркером, чем такие маркеры острой фазы, как СРБ и скорость оседания эритроцитов, в настоящее время предпочтение отдается двум последним из-за их большей доступности и низкой стоимости анализа. Введение SAA в рутинную клиническую практику затрудняют не только свойства самого белка (склонность к агрегации и комплексообразованию), но и сложности выделения и хранения SAA в высоких концентрациях, а также стандартизация контролей, калибраторов и используемых антител.
SAA определяют с использованием как высокочувствительных ИФА систем (предел определения до 3 нг/мл), так и иммунонефелометрических или иммунотурбидиметрических методов с более низкой чувствительностью (>3 мг/л) [11]. При этом в ряде случаев при проведении ИФА необходимо предварительно разводить образец, так как SAA, присутствующий в нем в высоких концентрациях, адсорбируется на поверхности пластиковых лунок микротитровального планшета. Кроме того, это моноплексные методы, т.е. SAA анализируют отдельно от других маркеров воспаления.
Поскольку SAA, как и многие другие маркеры воспаления, не является высоко специфичным белком, проведение исследований или анализов, направленных на определение стадии или активности заболевания, может включать также определение других маркеров воспаления (например, провоспалительных цитокинов), концентрация которых в образцах может быть сравнимой с концентрацией SAA (СРБ) или гораздо более низкой. Исходя из этого, важно иметь метод, который, с одной стороны, позволяет детектировать SAA в образцах плазмы или сыворотки крови без разведения, а с другой – не исключает проведения этого анализа совместно с определением других необходимых антигенов.
Ранее [12] мы разработали метод одновременного определения SAA и ряда других маркеров воспаления в культуральных средах с использованием биологических микрочипов. В данной работе иммунофлуоресцентный метод адаптирован для выявления SAA в сыворотках крови пациентов на биочипах, показана его работоспособность в сравнении с классическим ИФА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и буферы. В работе использованы следующие реагенты: Tween-20, поливиниловый спирт (PVA) 50 кДa, поливинилпирролидон (PVP) 360 кДa, конъюгат стрептавидина с Cy5 (Streptavidin-Cy5) (“GE Healthcare”, США), фосфатно-солевой буфер pH 7.4 (PBS), PBS с 0.01% Tween-20 (PBST); буфер для разведения (PBS, 0.14% PVA, 0.14% PVР), сыворотка крови кролика (“Biosera”, Франция), сыворотка крови козы (“Bio-sera”), сыворотка крови мыши (“Biosera”), моноклональные антитела к SAA (клон SAA1, клон SAA15) и их конъюгаты с биотином (“HyTest”, Россия), SAA человека (“HyTest”).
Изготовление биочипов. Биочипы изготавливали по методике, описанной ранее [12]. Для иммобилизации использовали моноклональные антитела мыши к SAA человека, а также антиген SAA человека, концентрация которых в гелевых композициях составляла 1.4 и 0.3 мг/мл соответственно. Моноклональные антитела и антиген SAA, смешанные с гелеобразующей композицией, а также гелеобразующую композицию, не содержащую белков (пустой гель), наносили с помощью пинового робота Qarray (“Genetix Limited”, Великобритания) на стеклянные слайды, предварительно активированные Bind-Silane. Сополимеризацию гелевых ячеек проводили после нанесения под УФ-лампой с максимумом излучения 350 нм в токе азота. После полимеризации биочипы отмывали в PBST и блокировали в 1%-ном PVA. Наличие всех гелевых ячеек контролировали с помощью микроскопа в проходящем свете.
Образцы. В работе проанализированы 15 образцов сывороток крови пациентов с ревматоидным артритом или анкилозирующим спондилитом, а также 9 образцов сывороток крови здоровых доноров, предоставленных Московским клиническим научным центром (МКНЦ) имени А.С. Логинова. Проведение исследования одобрено локальным этическим комитетом МКНЦ.
Сэндвич-анализ на биочипе. Для проведения сэндвич-анализа на ячейки биочипа наносили 65 мкл образца (сыворотка крови, раствор SAA в буфере для разведения или смесь сывороток животных) и инкубировали при 37°C от 15 мин до 20 ч. После промывки в PBST (20 мин) биочипы ополаскивали дистиллированной водой и высушивали. На ячейки наносили 65 мкл раствора биотинилированных антител SAA1 или SAA15 (6 мкг/мл) и инкубировали в течение 1 ч при 37°С. После промывки в PBST (20 мин) биочипы снова ополаскивали дистиллированной водой и высушивали. На ячейки биочипа наносили 50 мкл раствора стрептавидин-Cy5 (5 мкг/мл) в буфере для разведения и инкубировали в течение 30 мин при 37°С. После инкубации биочипы промывали в PBST (30 мин), ополаскивали дистиллированной водой, высушивали и получали изображения ячеек на флуоресцентном микроскопе.
Анализ флуоресцентных изображений биочипов. Флуоресцентные изображения биочипов получали с помощью флуоресцентного микроскопа с лазерным возбуждением, разработанного в ИМБ РАН [13]. Флуоресцентные сигналы анализировали с использованием программного обеспечения ImageAssay (ИМБ РАН).
ИФА образцов сывороток крови. Концентрацию SAA в образцах определяли с использованием SAA, Human, ELISA kit (“Hycult Biotech”, США) в соответствии с инструкцией производителя.
Построение калибровочных кривых. Для построения калибровочных кривых, по которым определяли концентрации SAA в образцах, и пересчета флуоресцентных сигналов от ячеек, содержащих антитела к SAA, дополнительно анализировали калибровочные образцы. В качестве калибровочных образцов использовали раствор рекомбинантного SAA человека в смеси сывороток животных (мыши, козла, кролика), смешанных в равных объемах. Концентрация SAA в растворе варьировала от 0 (нулевая проба) до 100 мкг/мл.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В настоящей работе сэндвич-анализ в формате биочипа адаптирован к выявлению SAA в сыворотке крови человека. Биочип, используемый для проведения анализа, сконструирован ранее и содержал, помимо SAA, ряд других маркеров воспаления. Так как концентрация SAA в образцах сравнительно высокая (мкг/мл по сравнению с нг/мл и пг/мл у других маркеров), при изготовлении биочипов были уменьшены концентрации anti-SAA для иммобилизации в ячейках, а также время выдержки при получении флуоресцентного изображения на микроскопе. Количественная оценка SAA в образцах, наряду с анализом на биочипах самих образцов, предполагает построение калибровочной кривой в каждом из экспериментов. В качестве калибровочных образцов протестированы образцы, содержащие SAA в различных концентрациях как в смеси сывороток животных (кролика, мыши, козла), так и в буфере для разведения.
Тестирование калибровочных образцов, изготовленных на основе буфера для разведения
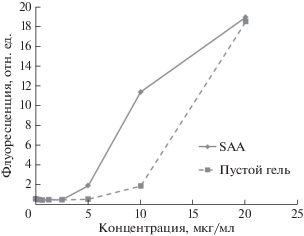
Изначально образцы с биочипами инкубировали в течение 20 ч при 37°C, так как ранее [12] мы показали, что таким образом можно получать приемлемые калибровки для данного антигена. Результаты анализа калибровочных образцов на основе буфера для разведения приведены на рис. 1. Видно, что в случае подобных калибровочных образцов удовлетворительные результаты получаются при концентрации SAA не более 10 мкг/мл. При более высоких концентрациях SAA наблюдается значительное повышение флуоресцентного сигнала от ячеек, не содержащих иммобилизованных белков (“пустой гель”).
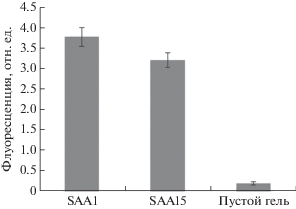
Рис. 1.
Зависимость величины флуоресцентного сигнала от концентрации SAA при анализе антигена, растворенного в буфере для разведения. SAA – флуоресцентный сигнал от ячейки с иммобилизованным SAA; пустой гель – флуоресцентный сигнал от ячеек с иммобилизованным гелем, не содержащим белков, характеризует неспецифическое взаимодействие.
Образец, содержащий SAA в концентрации 10 мкг/мл, анализировали с использованием биотинилированных антител (SAA15 или SAA1) на биочипах с иммобилизованными антителами SAA1. При использовании и одних, и других проявляющих антител наблюдали флуоресцентные сигналы, статистически значимо отличающиеся от сигналов пустого геля (рис. 2).
Тестирование калибровочных образцов, изготовленных на основе животных сывороток
Помимо калибровочных образцов на основе буфера для разведения, проведено тестирование калибраторов, представляющих собой смесь сывороток крови животных с добавлением определенных концентраций рекомбинантного SAA человека.
Анализ образцов, содержащих сыворотку животных, при длительной инкубации с биочипами не позволил получить калибровочные кривые: флуоресцентные сигналы от ячеек, содержащих SAA в концентрациях от 1 до 100 мкг/мл, практически не отличались друг от друга и от флуоресцентного сигнала пустого геля.
Нами также проанализирован ряд параметров, способных влиять на результат, таких как добавление детергента, температура и изменение времени инкубации. Изменение температуры инкубации и добавление различных детергентов в образец не повлияло существенно на получаемые результаты.
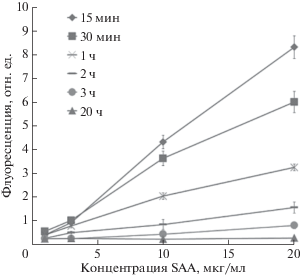
Существенное сокращение времени инкубации образца на биочипе позволило получить набор флуоресцентных сигналов для построения калибровочных кривых; при уменьшении времени инкубации наблюдалось повышение сигналов флуоресценции. На рис. 3 представлены калибровочные кривые, полученные при различных временах инкубации образца на биочипах: 15 и 30 мин, 1, 2, 3 ч. Сигнал от пустого геля во всех экспериментах не превышал 0.25 отн. ед.
Рис. 3.
Зависимость флуоресцентного сигнала от концентрации SAA при анализе антигена, растворенного в смеси сывороток животных (мыши, козла, кролика). Приведены значения флуоресценции от ячеек, содержащих антитела к SAA. Сигнал от пустого геля во всех экспериментах не превышал 0.25 отн. ед.
Проведен дополнительный эксперимент по оценке стабильности калибраторов. Показано, что при анализе калибровочных проб непосредственно после приготовления калибровочная кривая не отличается (в пределах статистической погрешности) от калибровочной кривой, полученной с использованием калибраторов через 1 ч после приготовления.
Исходя из полученных результатов, анализ SAA в сыворотках крови проводили в течение короткого промежутка времени (30 мин), а для пересчета флуоресцентных значений в концентрации использовали калибровочные кривые, построенные на основе калибраторов с добавлением сыворотки.
Для оценки влияния сывороток крови животных в качестве матрицы проведен сравнительный анализ двух образцов, представляющих собой смесь сывороток животных или сыворотку крови человека с низкой концентрацией SAA (0.2 мкг/мл по результатам ИФА), в которые был добавлен рекомбинантный SAA человека в концентрации 10 мкг/мл. Показано, что флуоресцентные сигналы при анализе SAA в смеси сывороток животных не отличаются статистически значимо от флуоресцентных сигналов при анализе SAA в человеческой сыворотке, что говорит об отсутствии влияния выбранной сывороточной среды на результат анализа.
Анализ сывороток, содержащих SAA, на биочипе
Анализ сывороток крови, содержащих SAA, проводили при кратковременной инкубации образца с биочипом. Характерное флуоресцентное изображение ячеек после кратковременной инкубации сыворотки приведен на рис. 4. Там же для сравнения приведен характерный вид ячеек после длительной инкубации той же сыворотки, а также образца, содержащего раствор SAA, в буфере для разведения. Видно, что в отличие от калибровочного образца, где флуоресцентный сигнал, а значит и SAA, сравнительно равномерно распределены в объеме ячейки, в случае SAA из сыворотки наблюдается более высокая концентрация антигена в поверхностном слое геля вблизи краев ячейки.
Рис. 4.
Флуоресцентное изображение ячеек с иммобилизованными антителами к SAA, после анализа аналитов, содержащих SAA. а – Анализ сыворотки, содержащей SAA, кратковременная инкубация с образцом. б – Анализ сыворотки, содержащей SAA, инкубация с образцом в течение 20 ч. в – Анализ раствора SAA в буфере для разведения (PBS, 0.14% PVA, 0.14% PVP), инкубация с образцом в течение 20 ч.

Сравнение данных, получаемых на биочипе, с результатами ИФА
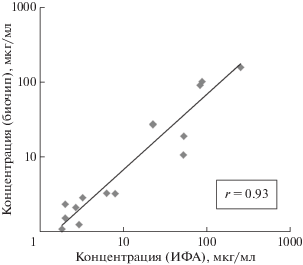
Результаты, полученные при анализе образцов сывороток крови на биочипах, сравнили с концентрациями в этих же образцах, измеренными с помощью тест-системы на основе ИФА.
Концентрация SAA при анализе на биочипе образцов здоровых доноров не превышала 1 мкг/мл. Концентрации SAA в этих же образцах, определенные методом ИФА, находились в диапазоне от 0.23 до 1.2 мкг/мл. Результаты определения SAA в образцах пациентов с ревматоидным артритом и анкилозирующим спондилитом представлены на рис. 5. Коэффициент корреляции Пирсона составил 0.93.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе иммунофлуоресцентный мультиплексный метод анализа провоспалительных маркеров на биочипе адаптирован для количественного определения SAA в сыворотке крови человека.
Большое внимание при этом уделено тестированию калибровочных образцов, содержащих рекомбинантный SAA человека, так как в отличие от других медиаторов воспаления, классические буферосодержащие калибраторы, использованные нами ранее, были непригодны: при концентрациях более 10 мкг/мл наблюдалось значительное повышение флуоресцентного сигнала от “отрицательного контроля” – ячеек, не содержащих иммобилизованных белков (рис. 1). Полученные результаты могут объясняться физико-химическими свойствами SAA, в частности, его склонностью к агрегации [1], в результате чего антиген, при его высоких концентрациях в буферном растворе, не содержащем веществ, способных его стабилизировать, неспецифически взаимодействует с поверхностью биочипов.
Для иммобилизации на биочипе были выбраны моноклональные антитела SAA1, которые, с одной стороны, способны взаимодействовать только с одной антигенной детерминантой, с другой, при анализе калибраторов способны образовывать сэндвич “антитела SAA1–SAA из раствора–биотинилированные антитела SAA1” (рис. 2). Так как в структуре SAA не содержатся повторяющиеся аминокислотные последовательности, работоспособность пары “иммобилизованные SAA1–проявляющие SAA1”, по-видимому, может объясняться частичной олигомеризацией SAA в растворе. Олигомеризация SAA в целом не характерна для антигена, находящегося в сыворотке, поэтому рекомбинантный SAA в растворе для разведения, не содержащем дополнительных стабилизирующих белков, для построения калибровочных кривых в дальнейшем не использовали.
Калибраторы на основе сывороток крови животных позволяют избежать образования олигомеров, так как SAA будет естественным образом связываться с липопротеинами, присутствующими в сыворотке. Кроме того, сывороточные белки способствуют уменьшению неспецифического налипания SAA на ячейки.
Анализ калибровочных образцов при различном времени инкубации показал, что кратковременная инкубация (15–30 мин) позволяет получать более интенсивные флуоресцентные сигналы, чем более длительная (более 1 ч) (рис. 3). Кроме того, аналогичное снижение флуоресцентного сигнала при увеличении времени инкубации наблюдалось и в образце сыворотки крови человека (рис. 4б). Стоит отметить, что для анализа SAA в сыворотках крови характерно неравномерное распределение сигнала по объему ячейки (рис. 4б): более интенсивное свечение, а значит, и более высокая концентрация SAA, доступного для связывания с детектирующими антителами, наблюдается в поверхностном слое геля. Полученная картина может объясняться двумя причинами: 1) ограниченной проницаемостью гелевых ячеек для SAA в составе гетерогенных белково-липидных комплексов; 2) стерическими затруднениями, возникающими из-за большого скопления белково-липидных комплексов вблизи поверхности ячейки. Последняя причина также приводит к тому, что проявляющие антитела не могут в достаточном количестве проникнуть в ячейку для связывания с молекулами SAA, находящимися в глубине ячейки. При этом, чем больше время инкубации с образцами, содержащими сыворотку, тем больше экранирование поверхности ячейки белково-липидными комплексами, а значит, тем ниже флуоресцентный сигнал.
Разработанный метод позволяет определять SAA в сыворотке крови в диапазоне от 1 до 100 мкг/мл, что удобно для оценки уровня этого антигена при ряде заболеваний, таких как ревматоидный артрит или инфекции различной этиологии, характеризующиеся значимым увеличением содержания этого антигена в крови.
Метод показывает хорошую сходимость с результатами, полученными классическим ИФА (коэффициент корреляции Пирсона 0.93), и требует разведения образца, если концентрация превышает 100 мкг/мл, в то время как в большинстве высокочувствительных ИФА для измерения SAA (единицы и десятки нг/мл) разводят все образцы без исключения. Таким образом, использование биочипа не позволяет полностью отказаться от разведения, но позволяет сократить их количество.
Помимо ИФА, концентрацию SAA часто определяют с помощью анализаторов, использующих технологии иммунонефелометрии, иммунотурбидиметрии или иммунофлуоресценции [14], а также методом иммунохроматографического анализа [15, 16]. Сравнение приведенных в исследованиях по валидации различных тест-систем численных значений, полученных при определении SAA разными методами, показывает высокую корреляцию [17], сравнимую с полученной нами в настоящем исследовании, однако, в некоторых исследованиях наблюдаются некоторые смещения концентраций [14, 18]. В то же время известно, что, например, при ревматоидном артрите средние или медианные значения SAA могут измеряться в единицах [19], десятках [20] или даже сотнях [21] мкг/мл (мг/л). В популяции здоровых доноров в медианных и средних уровнях также наблюдаются существенные отличия [22, 23].
Причиной таких отличий могут быть не только различия в выборках, но и отсутствие стандартизации калибровочных образцов в различных тест-системах, а также различия в принципе проведения анализа. Следовательно, для дальнейшей валидации и возможности применения метода в клинической практике необходимы также дополнительные исследования и сравнение с другими сертифицированными методами, которые используют для определения SAA, а также анализ образцов, полученных от пациентов с различными заболеваниями, и расширение выборки здоровых доноров с целью определения пороговых концентраций (cutoff) для каждой из патологий.
Работа выполнена при поддержке гранта Российского научного фонда (соглашение № 19-15-00283).
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От всех пациентов получено письменное информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Jayaraman S., Gantz D.L., Haupt C., Gursky O. (2017) Serum amyloid A forms stable oligomers that disrupt vesicles at lysosomal pH and contribute to the pathogenesis of reactive amyloidosis. Proc. Natl. Acad. Sci. USA. 114, E6507–E6515. https://doi.org/10.1073/pnas.1707120114
Wilson P.G., Thompson J.C., Shridas P., McNama-ra P.J., de Beer M.C., de Beer F.C., Webb N.R., Tannock L.R. (2018) Serum amyloid A is an exchangeable apolipoprotein. Arterioscler. Thromb. Vasc. Biol. 38, 1890–1900. https://doi.org/10.1161/ATVBAHA.118.310979
Gursky O. (2020) Structural basis for vital function and malfunction of serum amyloid A: an acute-phase protein that wears hydrophobicity on its sleeve. Curr. Atheroscler. Rep. 22, 69. https://doi.org/10.1007/s11883-020-00888-y
Page M.J., Thomson G., Nunes J.M., Engelbrecht A.M., Nell T.A., de Villiers W., de Beer M.C., Engelbrecht L., Kell D.B., Pretorius E. (2019) Serum amyloid A binds to fibrin(ogen), promoting fibrin amyloid formation. Sci. Rep. 9, 3102. https://doi.org/10.1038/s41598-019-39056-x
Saxena A., Cronstein B.N. (2013) Acute phase reactants and theconcept of inflammation. In: Kelley’s Textbook of Rheumatology. Eds Firestein G.S., Budd R.C., Gabriel S.E., McInnes I.B., O’Dell J.R. Philadelphia, PA: Elseviers Saunders, 818–829.
Li H., Xiang X., Ren H., Xu L., Zhao L., Chen X., Long H., Wang Q., Wu Q. (2020) Serum amyloid A is a biomarker of severe coronavirus disease and poor prognosis. J. Infect. 80, 646–655. https://doi.org/10.1016/j.jinf.2020.03.035
Zhang G., Sun X., Lv H., Yang X., Kang X. (2012) Serum amyloid A: a new potential serum marker correlated with the stage of breast cancer. Oncol. Lett. 3, 940-944. https://doi.org/10.3892/ol.2012.584
Glojnarić I., Casl M.T., Simić D., Lukac J. (2001) Serum amyloid A protein (SAA) in colorectal carcinoma. Clin. Chem. Lab. Med. 39, 129–133. https://doi.org/10.1515/CCLM.2001.022
Dai M.L., Fan S., Li Z., Yu X., Lin D., Huang X.F., Wang Y. (2020) Correlation of serum amyloid A levels, clinical manifestations, treatment, and disease activity in patients with acute anterior uveitis. Eye. 34, 1672–1678. https://doi.org/10.1038/s41433-019-0740-4
Duzova A., Bakkaloglu A., Besbas N., Topaloglu R., Ozen S., Ozaltin F., Bassoy Y., Yilmaz E. (2003) Role of A-SAA in monitoring subclinical inflammation and in colchicine dosage in familial Mediterranean fever. Clin. Exp. Rheumatol. 21, 509–514.
Sorić Hosman I., Kos I., Lamot L. (2021) Serum amyloid A in inflammatory rheumatic diseases: a compendious review of a renowned biomarker. Front. Immunol. 11, 631299. https://doi.org/10.3389/fimmu.2020.631299
Волошин С.А., Фейзханова Г.У., Савватеева Е.Н., Смолдовская О.В., Рубина А.Ю. (2020) Мультиплексный метод определения биомаркеров воспаления в культуральной среде. Молекуляр. биология. 54, 1046–1056.
Lysov Y., Barsky V., Urasov D., Urasov R., Cherepanov A., Mamaev D., Yegorov Y., Chudinov A., Surzhikov S., Rubina A., Smoldovskaya O., Zasedatelev A. (2017) Microarray analyzer based on widefield fluorescent microscopy with laser illumination and a device for speckle suppression. Biomed. Opt. Express. 8, 4798–4810. https://doi.org/10.1364/BOE.8.004798
Zong Z., Kan L., Luo Y., Wang C., Wang X., Wang M., Xiong D., Zhang X. (2020) Performance evaluation of the XPEN60 CRP&SAA, a novel automated hematology analyzer, in detecting complete blood count, C-reactive protein, and serum amyloid A. J. Clin. Lab. Anal. 34, e23395. https://doi.org/10.1002/jcla.23395
Li Y., Liu X., Guo J., Zhang Y., Guo J., Wu X., Wang B., Ma X. (2021) Simultaneous detection of inflammatory biomarkers by SERS nanotag-based lateral flow assay with portable cloud Raman spectrometer. Nanomaterials (Basel). 11, 1496. https://doi.org/10.3390/nano11061496
He P.J.W., Katis I.N., Eason R.W., Sones C.L. (2018) Rapid multiplexed detection on lateral-flow devices using a laser direct-write technique. Biosensors (Basel). 8, 97. https://doi.org/10.3390/bios8040097
Wada A., Yamada T., Kubota N. (1997) Measurement of serum amyloid A by commonly used automated analysers. Ann. Clin. Biochem. 34, 569–570.
Ledue T.B., Weiner D.L., Sipe J.D., Poulin S.E., Collins M.F., Rifai N. (1998) Analytical evaluation of particle-enhanced immunonephelometric assays for C-reactive protein, serum amyloid A and mannose-binding protein in human serum. Ann. Clin. Biochem. 35, 745–753.
Shen C., Sun X.G., Liu N., Mu Y., Hong C.C., Wei W., Zheng F. (2015) Increased serum amyloid A and its association with autoantibodies, acute phase reactants and disease activity in patients with rheumatoid arthritis. Mol. Med. Rep. 11, 1528–1534. https://doi.org/10.3892/mmr.2014.2804
Hwang Y.G., Balasubramani G.K., Metes I.D., Leves-que M.C., Bridges S.L., Jr, Moreland L.W. (2016) Differential response of serum amyloid A to different therapies in early rheumatoid arthritis and its potential value as a disease activity biomarker. Arthritis Res. Therapy. 18, 108. https://doi.org/10.1186/s13075-016-1009-y
Targońska-Stępniak B., Majdan M. (2014) Serum amyloid a as a marker of persistent inflammation and an indicator of cardiovascular and renal involvement in patients with rheumatoid arthritis mediators of inflammation. 2014, 793628. https://doi.org/10.1155/2014/793628
Liu Q., Li Y., Yang F., Xu T., Yao L., Sun J., Liang W. (2020) Distribution of serum amyloid A and establishment of reference intervals in healthy adults. J. Clin. Lab. Anal. 34, e23120. https://doi.org/10.1002/jcla.23120
Carbone T., Pafundi V., Schievano C., Assunta D., Padula M.C., Giordano M., Canora G., Lazzari C., Padula A.A., D’Angelo S. (2021) Serum amyloid A in healthy subjects: assessment of reference value using ELISA method. J. Immunoassay Immunochem. 42, 129–137. https://doi.org/10.1080/15321819.2020.1837160
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология