Молекулярная биология, 2022, T. 56, № 4, стр. 557-563
Белок CG9890 дрозофилы участвует в регуляции экдизонзависимой транскрипции
Ю. В. Николенко a, Н. А. Фурсова a, М. Ю. Мазина a, Н. Е. Воробьева a, А. Н. Краснов a, *
a Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: krasnov@genebiology.ru
Поступила в редакцию 17.11.2021
После доработки 14.12.2021
Принята к публикации 14.12.2021
- EDN: DGDWJC
- DOI: 10.31857/S0026898422040085
Аннотация
Ранее нами было показано, что белок CG9890 c доменами цинковых пальцев взаимодействует с ENY2-содержащими комплексами дрозофилы и локализуется преимущественно на промоторах активных генов. Белок CG9890 участвует в регуляции экспрессии части генов, на промоторах которых он находится, причем в число этих генов входят гены экдизонового каскада. В представленной работе изучена роль белка CG9890 в регуляции экдизонзависимой индуцибельной транскрипции. Идентифицированы 12 экдизонзависимых генов, на промоторах которых локализован белок CG9890. Изучена их активация после добавления к клеткам 20-гидроксиэкдизона как в норме, так и после РНК-интерференции CG9890. Экспрессия экдизонзависимых генов существенно повышается в ответ на обработку клеток экдизоном, в отличие от контрольных генов. Причем в линии клеток, подвергнутых РНК-интерференции CG9890, транскрипция 8 из 12 генов была значительно выше, чем в контрольных клетках. Таким образом, белок CG9890 участвует в регуляции транскрипции экдизонзависимых генов, причем в большинстве случаев выступает в роли репрессора.
ВВЕДЕНИЕ
Ранее мы выделили и охарактеризовали белок ENY2, который оказался компонентом множества белковых комплексов, вовлеченных в регуляцию транскрипции и репликации. ENY2 входит в состав транскрипционных комплексов SAGA, AMEX, THO и связывает различные этапы экспрессии генов ‒ организацию транскрипционных доменов и модификацию хроматина, активацию и элонгацию транскрипции, экспорт мРНК и регуляцию пространственного расположения генов в ядре [1‒6]. Кроме того, ENY2 входит также в состав репликационного комплекса ORC, ответственного за позиционирование точек начала репликации [7‒10]. Показано, что белок Su(Hw), содержащий домены цинковых пальцев, взаимодействует с ENY2-содержащими комплексами дрозофилы и необходим для их привлечения на сайты связывания Su(Hw), что необходимо для создания активной структуры хроматина и позиционирования точек начала репликации [1, 2, 5].
В ходе предыдущей работы мы обнаружили взаимодействие ENY2 с еще одним ранее не охарактеризованным белком – CG9890, который содержит домен цинковых пальцев, как и Su(Hw) [11]. Установлено, что белок CG9890 локализован в ядре клетки. Биохимическими методами показано взаимодействие белка CG9890 с комплексами SAGA, ORC, dSWI/SNF, TFIID и THOC [11]. CG9890 связывается с транскрипционными комплексами, вовлеченными в инициацию и элонгацию транскрипции, но не взаимодействует с комплексом AMEX, участвующим в экспорте мРНК из ядра в цитоплазму, что указывает на работу CG9890 в первых стадиях транскрипционного цикла.
Идентифицированы сайты связывания CG9890 в геноме и показано, что они локализованы преимущественно на промоторах генов. Определена полногеномная корреляция сайтов связывания CG9890 и комплексов SAGA, ORC и dSWI/SNF. Сайты связывания белка CG9890 характеризуются более низкой плотностью нуклеосом (представленностью гистона H3), чем в среднем по геному и на промоторах, что указывает на активное состояние этих регуляторных элементов [12]. С использованием метода ОТ-кПЦР проанализировано изменение уровня мРНК 21 CG9890-ассоциированного гена в клетках после РНК-интерференции CG9890 по сравнению с контрольными образцами. Обнаружено, что пять из 10 генов, экспрессия которых изменилась статистически значимо после РНК-интерференции белка CG9890, это гены экдизонового каскада [12].
Учитывая полученные ранее данные, предположили, что белок CG9890 может участвовать в регуляции не только базальной, но и активируемой транскрипции экдизонзависимых генов. Для изучения этого вопроса проведен биоинформатический анализ и идентифицированы все экдизонзависимые гены, промоторы которых содержат белок CG9890. Далее проанализировали активацию этих экдизонзависимых генов после обработки клеток S2 Шнейдер дрозофилы 20-гидроксиэкдизоном как в норме, так и после РНК-интерференции CG9890.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток линии S2 Шнейдер. РНК-интерференция. Индукция экспрессии экдизонзависимых генов. Клетки культивировали при 25°С в среде Schneider’s insect medium (“Sigma”, США), содержащей 10% фетальной сыворотки крупного рогатого скота (“HyClone”, США). дцРНК синтезировали с использованием TranscriptAid T7 High Yield Transcription Kit (“ThermoScientifiс”, США). Нокдаун белков проводили с помощью РНК-интерференции согласно протоколу [13]. Для нокдауна белка CG9890 синтезировали дцРНК длиной 500 п.н., соответствующую начальному участку его кодирующей последовательности. В качестве контроля использовали дцРНК, соответствующую 500-нуклеотидному фрагменту плазмиды pBluescipt II SK(–) (“Stratagene”, США). дцРНК синтезировали с использованием следующих праймеров:
CG9890, CGACTCACTATAGGGAGAACGTAAACAAATGGAGCACG и CGACTCACTATAGGGAGAAGGTGCGGTCGGTTAG;
pBluesciptIISK(–), GAATTAATACGACTCACTATAGGGAGAGTTACATGATCCCCCATG и GAATTAATACGACTCACTATAGGGAGATTTCGCCCCGAAGAACG.
В каждый эксперимент по РНК-интерференции дцРНК брали из расчета 30 мкг на 1 млн клеток. По прошествии 5 дней инкубации в среде с дцРНК клетки из каждой чашки рассаживали на две чашки, на следующие сутки (6-е с начала инкубации) в одной из них индуцировали экдизоновый каскад. Клетки из второй чашки служили отрицательным контролем. Все эксперименты по индукции экспрессии экдизонзависимых генов в норме и на фоне РНК-интерференции CG9890 проводили в трех повторах. Для активации экдизонового каскада в клеточную среду добавляли 20-гидроксиэкдизон (“Sigma”, h5142) до концентрации 0.3 мкМ и инкубировали в течение 3 ч. Уровень экспрессии CG9890, экдизонзависимых и контрольных генов, использованных в качестве контроля, измеряли методом обратной транскрипции с последующей ПЦР в реальном времени. Использовали следующие праймеры:
CG9890, GCCGATGTGGAGGATATAGC и GGATGTCACACAGCAGGTAG;
Eip75B-RA, CCTCGTCCATCTCCTCCAG и CACCAGCACCAGCAACAA;
Eip75B-RC, GACGGAGGAGTTGGGAGAA и TACCAGCACAACAGCAAGC;
DHR3, CGGTTGCGATTAACACGGTCC и CTGCAAGGGATTCTTTCGAAGATC;
HR4, GTGCGTCTGCACAATGTTGG и GGAACAGTCCATCAGCTCCTCG;
Eip78C, GCATCTACTACAGCAGCAACA и ATTTGTGGCGTTTGTGGAGTA;
Tret1-1, CATCAACCGCTGAGCAACG и TCCTCTGGCAGAATTGTGTCC;
CR43626, TTCGGTGTGTGGACAGCAAG и GGTTCGATGTCGTACCAACTTCT;
Actin 5C, GGCACCACACCTTCTACAATGAGC, GAGGCGTACAGCGAGAGCACAG;
Tubulin 56D, CGAGAACACGGACGAGACCTACTG и GGAATCGGAGGCAGGTGGTTACG;
ras2, GAGGGATTCCTGCTCGTCTTCG и GTCGCACTTGTTACCCACCATC;
CG5455, TTGGAGGTGGTGGAGAAGAA и CAGCGGTGGTGATTCATCC;
СG8745, TCCAGTGTGCTCGCACGTT и ACATGCACGTAGTCGGGCTT;
CG15279, GGCATAGGATCGAATATAGCCATG и CAGCTCGGCGATTCCCAGTA;
E23, AGCAGCAGCAGCAACAACAG и GCAACTGTTTCCTGTTTAGCTGG;
Fatp3, CAGTGGTGGCTCTCCTGCTC и ATCGTCCATCACGAAGCATGT;
Eip74EF, GTCGGAGGCTACGGATTCAGA и ACCAGGTGCCATAGTTGATACCG.
Идентификация сайтов связывания белка CG9890 в геноме дрозофилы. Исходные данные с геномного секвенатора Illumina HiSeq2000 выравнивали на геном дрозофилы dmel_r6.40 с помощью программы Hisat2 в режиме end-to-end. Программа Hisat2 предназначена для обработки данных РНК-Seq, но ее также удобно использовать и для данных ChIP-Seq с ключом no-spliced-alignment. Также устанавливали ключ -a, который позволяет искать множественные выравнивания, с целью их исключения из анализа. В дальнейшую работу брали только уникально картированные риды, обрабатывая флаг “NH:i” в результатах вывода программы Hisat2. Также брали только те риды, уровень мисматчей в которых был менее 5%, обрабатывая флаг “XM:i” в результатах вывода программы Hisat2. Фильтрацию осуществляли с помощью собственной программы. Сайты связывания белка CG9890 определяли с помощью программы MACS2 с использованием параметров по умолчанию (q-value < 0.05).
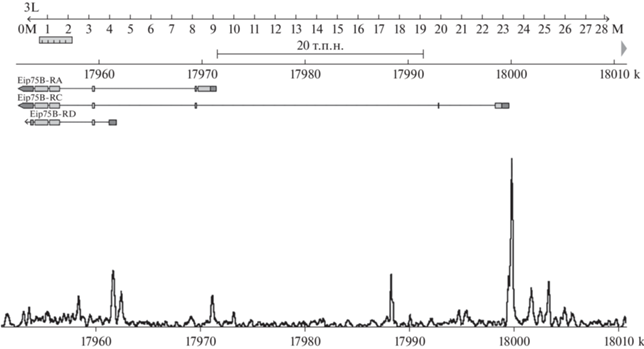
Анализ сайтов связывания белка CG9890 в промоторных областях генов. Промоторные области определяли из аннотации транскриптов генома дрозофилы dmel_r6.40. Промоторной областью считали интервал ±500 п.н. от старта транскрипции. Считали, что сайт связывания находится в промоторной области гена, если пик сайта связывания попадает в заданный интервал. Анализ проводили с помощью программы bedtools. Кроме того, сайты связывания белка CG9890 в области экдизоновых генов дополнительно контролировали путем совмещения структуры транскриптов из геномного браузера и профиля ChIP-Seq (рис. 1). Исследование зависимости транскрипции генов от обогащения белка CG9890 на их промоторах проводили в программе Microsoft Excel, включая расчет коэффициента корреляции.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Белок CG9890 привлекается на промоторы экдизонзависимых генов
С целью идентификации сайтов связывания белка CG9890 на промоторах экдизонзависимых генов с помощью биоинформатических методов проанализировали ChIP-Seq-профиль этого белка [12]. Проанализированы все 17 идентифицированных нами ранее генов, транскрипция которых значительно возрастает (в 3 раза и более) после добавления 20-гидроксиэкдизона к клеткам S2 дрозофилы [14]. Оказалось, что белок CG9890 присутствует на промоторах 12 из 17 генов, что сильно превышает случайное совпадение (среднегеномный уровень колокализации белка CG9890 с промоторами генов составляет, как мы показываем далее, примерно 15%, поэтому уровень случайного совпадения соответствует двум‒трем генам из 17). В качестве примера на рис. 1 представлен профиль CG9890 в области экдизонзависимого гена Eip75B.
Для большинства экдизонзависимых генов характерен альтернативный сплайсинг, причем разные транскрипты могут как активироваться экдизоном, так и нет. Примером такого гена является Eip75B. На рис. 1 видно, что белок CG9890 присутствует на промоторе экдизонзависимого транскрипта Eip75B-RC, тогда как на промоторе другого экдизонзависимого транскрипта Eip75B-RA (рис. 1) данного белка нет. Транскрипт Eip75B-RD экдизоном не активируется.
CG9890 принимает участие в активации экдизонзависимых генов
Далее провели анализ активации выбранных на предыдущем этапе экдизонзависимых генов в обработанных 20-гидроксиэкдизоном клетках ‒ нормальных и после РНК-интерференции CG9890. Проанализировали два разных экдизонзависимых транскрипта гена Eip75B ‒ содержащего CG9890 на промоторе и без этого белка. Результаты анализа представлены на рис. 2.
Рис. 2.
Активация транскрипции экдизонзависимых (а‒г) и контрольных генов (д) в ответ на добавление 20-гидроксиэкдизона к S2 клеткам дрозофилы через 3 ч после индукции. Названия генов указаны под диаграммами. На вертикальной оси указана степень активации транскрипции. Светлые столбцы соответствуют активации транскрипции в нормальных клетках, темные столбцы ‒ активации транскрипции при РНК-интерференции гена CG9890. Измерения проводили в трех повторах. Линии погрешностей соответствуют стандартной ошибке среднего.
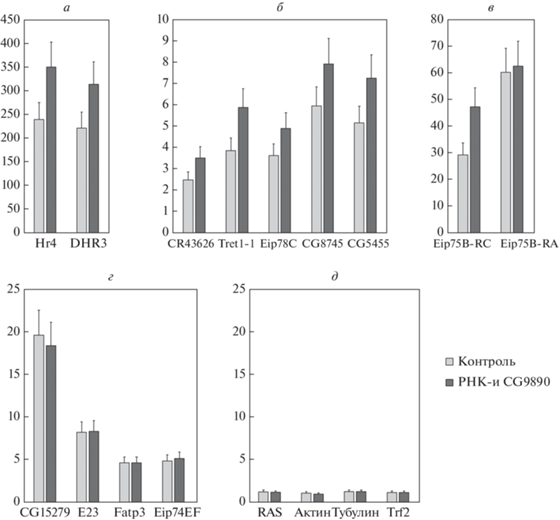
Экспрессия экдизонзависимых генов существенно повышается в ответ на обработку клеток экдизоном в отличие от контрольных генов. Еще большая степень активации 8 из 12 генов наблюдается в клетках после РНК-интерференции белка CG9890 по сравнению с контрольной линией клеток (рис. 2а‒в). Транскрипция контрольных генов при РНК-интерференции CG9890 не изменяется (рис. 2д). Интересно, что уровень транскрипта Eip75B-RC, синтезируемого с промотора, с которым связывается CG9890, повышается при РНК-интерференции CG9890, тогда как уровень транскрипта Eip75B-RA, синтезируемого с промотора, не занятого белком CG9890, не отличается от уровня в контрольных клетках (рис. 2в). На активацию четырех экдизонзависимых генов РНК-интерференция CG9890 не влияет (рис. 2г). На основе полученных данных можно сделать вывод, что белок CG9890 выступает как репрессор экдизонзависимой активации транскрипции.
Характеристика группы CG9890-ассоциированных генов
Ранее мы изучали роль CG9890 в регуляции базальной транскрипции (без активации экдизоном) и обнаружили, что транскрипция части генов возрастает, а части снижается в результате РНК-интерференции CG9890. Белок CG9890 входит в семейство белков с доменами цинковых пальцев, значительная часть которых является факторами транскрипции [15]. Показана зависимость между присутствием многих из белков этого семейства на промоторах и уровнем экспрессии соответствующих генов [16, 17]. Мы решили проверить существование подобной зависимости для белка CG9890. Мы проанализировали ChIP-Seq-профиль белка CG9890 и обнаружили его сайты связывания на промоторах 3160 индивидуальных транскриптов ‒ продуктов 2803 генов, что составляет 15.8% от общего числа аннотированных генов дрозофилы. Так как ChIP-Seq CG9890 выполнен в клетках линии S2, мы проанализировали транскрипцию соответствующих генов также в этой линии и исследовали зависимость транскрипции генов от обогащения белка CG9890 на их промоторах. Результаты представлены на рис. 3. Видно отсутствие корреляции между уровнем представленности белка CG9890 на промоторах данных генов и уровнем их экспрессии в клетках S2 (коэффициент корреляции Спирмена 0.03).
Рис. 3.
Обогащение белка CG9890 на промоторах генов и уровень их экспрессии. По горизонтальной оси представлены 2803 гена, отсортированные по убыванию экспрессии слева направо. Сплошной линией показана экспрессия соответствующих генов, точки указывают представленность CG9890 на промоторах этих генов в терминах z-score (стандартные отклонения относительно среднего).
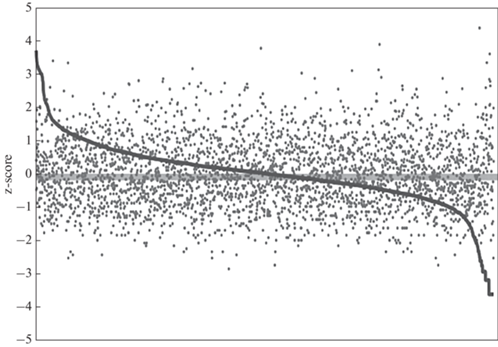
Иными словами, белок CG9890 локализован на промоторах генов как с сильной, так и со слабой экспрессией. Такая локализация на промоторах генов с различной экспрессией характерна также для классических репрессорных факторов — NELF [18, 19] и белков Polycomb-группы [20]. Этот результат позволяет нам предположить, что белок CG9890 не является классическим транскрипционным фактором-активатором, а функционирует по сходным с белками-репрессорами механизмам. Противоположное влияние белка CG9890 на экспрессию различных генов может быть опосредовано вторичными эффектами его нокдауна в клетке. Ранее мы показали, что белок CG9890 локализуется на промоторах многих генов регуляторных факторов. Изменение экспрессии этих белков влияет на экспрессию подконтрольных им генов. В частности, при РНК-интерференции изучаемого белка на 40% падает количество мРНК белка Su(z)2 [12], субъединицы комплекса PRC1, который участвует в репрессии большого числа генов дрозофилы. Это, в свою очередь, может привести к активации каких-то PRC-зависимых генов и изменению экспрессии их генов-мишеней.
Ранее мы обнаружили взаимодействие белка CG9890 с мультифункциональным консервативным белком ENY2 и с белковыми комплексами SAGA, ORC, dSWI/SNF, TFIID и THOC [11]. Cайты связывания CG9890 в геноме дрозофилы локализованы преимущественно на промоторах генов. Белок CG9890 участвует в регуляции экспрессии части генов, на промоторах которых он находится [12]. Нами изучена роль белка CG9890 в регуляции экдизонзависимой индуцибельной транскрипции. С этой целью идентифицированы 12 экдизонзависимых генов, на промоторах которых локализован белок CG9890. Изучена их активация, вызванная добавлением 20-гидроксиэкдизона, как в нормальных клетках, так и после РНК-интерференции CG9890. Экспрессия экдизонзависимых генов существенно повышается в ответ на обработку клеток экдизоном, в отличие от контрольных генов. Причем в клетках после РНК-интерференции CG9890 транскрипция 8 из 12 генов была значительно выше, чем в контрольной линии. Таким образом, белок CG9890 участвует в регуляции транскрипции экдизонзависимых генов, выступая в большинстве случаев, в роли репрессора.
Работа выполнена при поддержке Российского научного фонда (грант № 20-14-00269). Работа выполнена с использованием оборудования ЦКП ИБГ РАН.
В данной работе не использовали людей и животных в качестве объектов исследования.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Vorobyeva N.E., Mazina M.U., Golovnin A.K., Kopytova D.V., Gurskiy D.Y., Nabirochkina E.N., Georgieva S.G., Georgiev P.G., Krasnov A.N. (2013) Insulator protein Su(Hw) recruits SAGA and Brahma complexes and constitutes part of origin recognition complex-binding sites in the Drosophila genome. Nucl. Acids Res. 41, 5717‒5730.
Мазина М.Ю., Воробьева Н.Е., Краснов А.Н. (2013) Способность Su(Hw) создавать платформу для формирования ориджинов репликации не зависит от типа окружающего хроматина. Цитология. 55, 218‒224.
Vorobyeva N.E., Nikolenko J.V., Krasnov A.N., Kuzmina J.L., Panov V.V., Nabirochkina E.N., Georgieva S.G., Shidlovskii Y.V. (2011) SAYP interacts with DHR3 nuclear receptor and participates in ecdysone-dependent transcription regulation. Cell Cycle. 10, 1821‒1827.
Kopytova D.V., Krasnov A.N., Orlova A.V., Gurskiy D.Y., Nabirochkina E.N., Georgieva S.G., Shidlovskii Y.V. (2010) ENY2: couple, triple…more? Cell Cycle. 9, 479‒481.
Kurshakova M., Maksimenko O., Golovnin A., Pulina M., Georgieva S., Georgiev P., Krasnov A. (2007) Evolutionarily conserved E(y)2/Sus1 protein is essential for the barrier activity of Su(Hw)-dependent insulators in Drosophila. Mol. Cell. 27, 332‒338.
Krasnov A.N., Kurshakova M.M., Ramensky V.E., Mardanov P.V., Nabirochkina E.N., Georgieva S.G. (2005) A retrocopy of a gene can functionally displace the source gene in evolution. Nucl. Acids Res. 33, 6654‒6661.
Kopytova D., Popova V., Kurshakova M., Shidlovskii Y., Nabirochkina E., Brechalov A., Georgiev G., Georgieva S. (2016) ORC interacts with THSC/TREX-2 and its subunits promote Nxf1 association with mRNP and mRNA export in Drosophila. Nucl. Acids Res. 44, 4920‒4933.
Eaton M.L., Prinz J.A., MacAlpine H.K., Tretyakov G., Kharchenko P.V., MacAlpine D.M. (2011) Chromatin signatures of the Drosophila replication program. Genome Res. 21, 164‒174.
Masai H., Matsumoto S., You Z., Yoshizawa-Sugata N., Oda M. (2010) Eukaryotic chromosome DNA replication: where, when, and how? Annu. Rev. Biochem. 79, 89‒130.
MacAlpine H.K., Gordan R., Powell S.K., Hartemink A.J., MacAlpine D.M. (2010) Drosophila ORC localizes to open chromatin and marks sites of cohesin complex loading. Genome Res. 20, 201‒211.
Фурсова Н.А., Николенко Ю.В., Сошникова Н.В., Мазина М.Ю., Воробьева Н.Е., Краснов А.Н. (2018) Белок CG9890 с доменами цинковых пальцев ‒ новый компонент ENY2-содержащих комплексов дрозофилы. Acta Naturae. 10(4), 110‒114.
Фурсова Н.А., Мазина М.Ю., Николенко Ю.В., Воробьева Н.Е., Краснов А.Н. (2020) Белок CG9890 дрозофилы, содержащий домены цинковых пальцев, колокализуется с комплексами модификации и ремоделирования хроматина на промоторах генов и участвует в регуляции транскрипции. Acta Naturae. 12(4), 114‒119.
Clemens J.C., Worby C.A., Simonson-Leff N., Muda M., Maehama T., Hemmings B.A., Dixon J.E. (2000) Use of double-stranded RNA interference in Drosophila cell lines to dissect signal transduction pathways. Proc. Natl. Acad. Sci. USA. 97, 6499‒6503.
Mazina M.Y., Nikolenko J.V., Fursova N.A., Nedil’ko P.N., Krasnov A.N., Vorobyeva N.E. (2015) Early-late genes of the ecdysone cascade as models for transcriptional studies. Cell Cycle. 14, 3593‒3601.
Разин С.В., Борунова В.В., Максименко О.Г., Кантидзе О.Л. (2012) Семейство белков, содержащих мотив цинковые пальцы CYS2HIS2-типа: классификация, функции, важнейшие представители. Биохимия. 77, 277‒288.
Cheng C., Alexander R., Min R., Leng J., Yip K.Y., Rozowsky J., Yan K.K., Dong X., Djebali S., Ruan Y., Davis C.A., Carninci P., Lassman T., Gingeras T.R., Guigo R., Birney E., Weng Z., Snyder M., Gerstein M. (2012) Understanding transcriptional regulation by integrative analysis of transcription factor binding data. Genome Res. 22, 1658‒1667.
Jiang N., Emberly E., Cuvier O., Hart C.M. (2009) Genome-wide mapping of boundary element-associated factor (BEAF) binding sites in Drosophila melanogaster links BEAF to transcription. Mol. Cell. Biol. 29, 3556‒3568.
Gilchrist D.A., Nechaev S., Lee C., Ghosh S.K., Collins J.B., Li L., Gilmour D.S., Adelman K. (2008) NELF-mediated stalling of Pol II can enhance gene expression by blocking promoter-proximal nucleosome assembly. Genes Dev. 22, 1921‒1933.
Mazina M.Y., Kovalenko E.V., Vorobyeva N.E. (2021) The negative elongation factor NELF promotes induced transcriptional response of Drosophila ecdysone-dependent genes. Sci. Rep. 11, 172.
Brookes E., de Santiago I., Hebenstreit D., Morris K.J., Carroll T., Xie S.Q., Stock J.K., Heidemann M., Eick D., Nozaki N., Kimura H., Ragoussis J., Teichmann S.A., Pombo A. (2012) Polycomb associates genome-wide with a specific RNA polymerase II variant, and regulates metabolic genes in ESCs. Cell Stem Cell. 10, 157‒170.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология