Молекулярная биология, 2022, T. 56, № 4, стр. 671-684
Однодоменные антитела для предобработки протеома мочи человека с целью анализа онкобиомаркеров
С. В. Тиллиб a, *, О. С. Горяйнова a, А. М. Сачко a, Т. И. Иванова a, b, М. Я. Гаас c, Н. В. Воробьев a, d, e, А. Д. Каприн f, П. В. Шегай a, f
a Институт биологии гена Российской академии наук
119334 Москва, Россия
b Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центра радиологии Министерства здравоохранения Российской Федерации
249036 Калужская область, Обнинск, Россия
c Медицинский институт Российского университета дружбы народов
117198 Москва, Россия
d Московский научно-исследовательский онкологический институт им. П.А. Герцена – филиал Национального медицинского исследовательского центра радиологии Министерства здравоохранения Российской Федерации
125284 Москва, Россия
e Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации
119991 Москва, Россия
f Национальный медицинский исследовательский центр радиологии Министерства здравоохранения
Российской Федерации
125284 Москва, Россия
* E-mail: tillib@genebiology.ru
Поступила в редакцию 09.11.2021
После доработки 13.12.2021
Принята к публикации 14.12.2021
- EDN: UGSMSU
- DOI: 10.31857/S0026898422040127
Аннотация
Проведен анализ возможности применения ряда полученных нами ранее однодоменных антител (нанотел) к основным маркерным белкам крови для предобработки образцов мочи больных раком мочевого пузыря (РМП). Продемонстрированы уникальные возможности использования нанотел в неинвазивных диагностических исследованиях наряду с такими традиционными методами, как электрофорез и, в перспективе, масс-спектрометрический анализ. Путем анализа 22 образцов мочи больных РМП показано, что развитие РМП сопровождается увеличением содержания в моче мажорных белков крови, некоторые из которых уже были предложены в качестве биомаркеров РМП. Использование иммуносорбентов на основе нанотел позволяет как специфически обогащать, так и удалять из биологической жидкости заданные белки-антигены и субпротеомы, ассоциированные с ними. Особый интерес представляет выделение иммунных комплексов из мочи конкретного пациента. Первичное изучение этих комплексов выявляет в них не только увеличенное содержание IgA и IgG на поздних (инвазивных) стадиях болезни, но и другие компоненты, которые потенциально могут быть биомаркерами патологического процесса у конкретного пациента. Предлагаемые подходы мы планируем в дальнейшем использовать для более масштабного исследования образцов мочи на разных стадиях развития РМП с целью идентификации новых перспективных биомаркеров этого эаболевания.
ВВЕДЕНИЕ
Рак мочевого пузыря (РМП) ‒ наиболее распространенное злокачественное заболевание мочевыводящих путей, занимает шестое место по распространенности среди мужского населения во всем мире и 10-е, если учитывать оба пола [1]. Основным гистологическим подтипом РМП является уротелиальная карцинома [2]. У подавляющего большинства больных (примерно 75%) диагноз РМП устанавливают на относительно ранней стадии (мышечно-неинвазивный РМП (NMIBC)): Ta, T1 или карцинома in situ (CIS). Однако известно, что примерно у 10‒30% пациентов болезнь будет прогрессировать до мышечно-инвазивной стадии (MIBC) [3, 4]. Примерно в 25% случаев первичный РМП диагностируется на поздней стадии (Т2, Т3 и Т4). Существует эффективный метод лечения мышечно-неинвазивного РМП в виде трансуретральной резекции опухоли (ТУР мочевого пузыря), позволяющий добиться достаточно высоких показателей пятилетней прогнозируемой выживаемости (хотя крайне часты рецидивы заболевания и требуется регулярный мониторинг пациентов), однако в случае поздних инвазивных стадий РМП (Т2, Т3 и Т4) прогнозируемая выживаемость существенно ниже – 69.4, 34.9 и 4.8% соответственно [5]. Очевидно, что ранняя диагностика и выявление рецидивов опухолей представляют наиболее важную проблему в ведении пациентов данной группы. В настоящее время золотым стандартом диагностики РМП и контрольного наблюдения за пациентами, перенесшими лечение по поводу этого заболевания, считается комбинация цитологического исследования осадка мочи и цистоскопии [2, 6]. Однако как низкая чувствительность цитологических тестов (в среднем 38% при специфичности около 98% [7]), так и высокая инвазивность, сложность проведения цистоскопии, сопровождающаяся трудностями в интерпретации результатов относительно характера и степени инвазии опухоли, указывают на настоятельную необходимость поиска новых малоинвазивных методов клинической диагностики, мониторинга и методов лечения пациентов с РМП.
При разработке диагностических подходов к неинвазивной диагностике РМП, особенно с целью массового скрининга образцов мочи пациентов группы риска, первичным материалом для анализа традиционно являются надосадок (супернатант) мочи и первичный ее осадок, получаемые в результате низкоскоростного центрифугирования. В последние годы пытаются использовать и более сложно выделяемые компоненты мочи, например, внеклеточные везикулы. Это, безусловно, очень перспективные для диагностики компоненты, однако, в настоящий момент еще требуется разработка и оптимизация новых эффективных методов выделения и анализа внеклеточных везикул, На наш взгляд, недоисследованными и недооцененными остаются возможности прямого анализа белков мочи для персонализованной диагностики, особенно если учесть, что появляются новые возможности предобработки мочи с помощью иммуноаффинного фракционирования заданных белковых компонентов с использованием специально получаемых антител.
Начиная с 2003 года, в ИБГ РАН научным коллективом под руководством Тиллиба С.В. разрабатывается и используется технология генерирования особых однодоменных моноклональных рекомбинантных антител (нанотел) для получения новых инструментов и методов таргетирования широкого спектра заданных антигенов с целью решения актуальных биологических и медицинских задач [8‒13]. В последние годы Тиллиб и соавт. получали множество новых высокоспецифичных нанотел к различным белкам плазмы крови как к богато представленным (сывороточному альбумину, разным классам иммуноглобулинов, фибриногену, фибронектину, трансферрину, альфа-2-макроглобулину, аполипопротеинам В и А1, лактоферрину и др. [10, 12]), так и к некоторым минорным белкам-маркерам (в том числе и опухолеассоциированным) [14, 15].
В данной работе мы изучали возможность применения ранее полученных нанотел к мажорным маркерным белкам крови для предобработки препаратов мочи больных РМП, чтобы повысить эффективность неинвазивного диагностического определения биомаркеров РМП. Наряду с пред-обработкой образцов мочи с помощью иммунных сорбентов на основе нанотел, мы использовали для фракционирования и анализа белков мочи широко применяемый в исследовательских лабораториях метод электрофореза в денатурирующем полиакриламидном геле (SDS-ПААГ) по Лэммли [16]. Несмотря на бόльшую разрешающую силу современных вариантов двумерного (2D) электрофореза, мы считаем их слишком сложными и дорогими для рутинного использования в клинике. В качестве компромиссного варианта для разрабатываемого метода клинического тестирования белков мочи мы видим именно относительно простой метод 1D-электрофоретического фракционирования белков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы мочи и плазмы крови. В работе использовали образцы мочи 22 первичных больных, находящихся на лечении по поводу РМП в отделении онкоурологии Московского научно-исследовательского онкологического института имени П.А. Герцена ‒ филиала “НМИЦ радиологии” Минздрава России (табл. 1). У 18 больных диагностирована уротелиальная карцинома мочевого пузыря, представленная в большинстве случаев (12) немышечно-инвазивным РМП. У половины больных определена высокая степень злокачественности опухоли. Мышечно-инвазивный рак диагностирован у шести пациентов. У четверых обнаружены доброкачественные новообразования мочевого пузыря. Постановку диагноза и классификацию заболеваний проводили в соответствии с клиническими рекомендациями Министерства здравоохранения Российской Федерации (протокол от 20.12.2019 г. № 10/2-3-4).
Таблица 1.
Характеристика больных раком мочевого пузыря (номера присвоены согласно классификационным критериям опухоли по системе TNM и гистологическому анализу)
| № | Пол, М. Ж | Возраст | Внешние характеристики мочи | Диагноз | Стадия TNM | Степень злокачествен-ности* |
|---|---|---|---|---|---|---|
| 1 | М | 60 | Светло-желтая, слабомутная | Доброкачественное новообразование | – | – |
| 2 | М | 61 | Желтая, прозрачная | То же | – | – |
| 3 | Ж | 74 | Светло-желтая, слабомутная | » | – | – |
| 4 | Ж | 61 | Светло-желтая, прозрачная | » | – | – |
| 5 | М | 42 | Светло-желтая, прозрачная | Немышечно-инвазивный РМП | pT1N0M0 | G1 |
| 6** | М | 31 | Светло-желтая, прозрачная | То же | cT1N0M0 | То же |
| 7 | М | 54 | Желтая, очень мутная | » | рT1N0M0 | » |
| 8** | Ж | 84 | Розовая, слабомутная | » | сT1N0M0 | » |
| 9 | М. | 61 | Желтая, прозрачная | » | рT1N0M0 | » |
| 10 | Ж | 44 | Желтая, мутная | » | То же | HG (G2) |
| 11 | Ж | 79 | Желтая, мутная | » | » | То же |
| 12 | М | 58 | Светло-желтая, слабомутная | » | » | » |
| 13 | М | 65 | Темно-желтая, мутная | » | » | » |
| 14 | М | 71 | Темно-желтая, мутная | » | » | » |
| 15 | М | 71 | Желтая, мутная | » | сT1N0M0 | HG |
| 16*** | Ж | 83 | Малиновая, мутная | » | pT1N0M0 | – |
| 17 | М | 81 | Светло коричневая, мутная | Мышечно- инвазивный РМП | рT2N0M0 | HG (G3) |
| 18 | М | 80 | Желтая, слабомутная | То же | pT2aN0M0 | HG |
| 19*** | Ж | 68 | Желтая, очень мутная | » | pT2N0M0 | – |
| 20 | М | 62 | Светло-желтая, очень мутная | » | pT2N0M0 | HG |
| 21 | М | 83 | Темно коричневая, мутная | » | pT2aN0M0 | HG (G3) |
| 22 | М | 62 | Розовая, мутная | » | рT4aN1M0 | HG (G4) |
* Высокая степень злокачественности, низкодифференцированная опухоль ‒ HG (high-grade), G2‒G4; низкая степень злокачественности, высокодифференцированная опухоль ‒ LG (low grade), G1. ** Судить об инвазии нельзя, поскольку в гистологическом препарате мышечный слой не представлен. *** Установить степень злокачественности клеток не представляется возможным. Примечание. Символ “р” означает, что стадия опухоли установлена после оперативного вмешательства; “с” ‒ стадия установлена по данным неинвазивных методов обследования.
Образцы утренней мочи вскоре после получения транспортировали из Московского научно-исследовательского онкологического института имени П.А. Герцена в Институт биологии гена РАН, где образцы сразу подвергали низкоскоростному центрифугированию (2000 g, 15 мин) при комнатной температуре. Аликвоты супернатантов помещали на хранение в морозильник на –80°С. Осадки суспендировали в стандартном фосфатно-солевом буферном растворе (1× PBS), содержащем 20% глицерина и 0.025% Tween 20, переносили в пробирки объемом 1.5‒2.0 мл и также помещали на хранение в морозильник на –80°С.
Образцы утренней мочи здоровых доноров брали у добровольцев разного пола не отличающихся значимо по возрасту от больных РМП исследуемой группы.
Плазма периферической крови здоровых доноров получена в Медицинском радиологическом научном центре им. А.Ф. Цыба – филиале “НМИРЦ” Минздрава России. В качестве коагулянта использовали гепарин (50 ед./мл).
Работа с нанотелами, создание и использование иммуносорбентов. Наша работа базируется на ранее полученных нами клонах последовательностей, кодирующих новые однодоменные антитела к ряду белков человека. Отобранные ранее последовательности однодоменных антител были переклонированы и отформатированы, после чего нанотела наработали, используя бактериальную систему экспрессии и эффективную процедуру выделения и очистки, охарактеризовали с помощью хроматографического, электрофоретического и иммуноферментного анализа, как описано ранее [9, 10, 12]. Получаемые нанотела содержат на С-конце длинную линкерную последовательность (28 аминокислот длинного варианта шарнирного участка неканонического верблюжьего антитела), после которой идут два пептидных фрагмента: гемагглютинин (НА)-таг, позволяющий детектировать наноантитело с помощью коммерческих антител к этому пептиду, и последовательность из шести остатков гистидина (His-таг), позволяющая эффективно очищать содержащий ее белок с помощью металл-хелатной аффинной хроматографии на Ni-NTA-агарозе. Используемый линкерный линейный участок содержит четыре удобно расположенных и хорошо доступных аминокислотных остатка лизина. По этим остаткам очень удобно проводить химические реакции пришивки других молекул, в том числе иммобилизовать наноантитело на BrCN-сефарозе.
Отобранные однодоменные антитела использовали для создания иммуносорбентов, специфически связывающих заданные белки плазмы крови и мочи человека.
Наработанные форматированные нанотела пришивали к CNBr-активированной сефарозе 4В (“GE Healthcare Life Sciences”, США) согласно рекомендациям производителя и как описано ранее [10]. Количество используемой сефарозы рассчитывали для каждого иммуносорбента, исходя из количества иммобилизуемых нанотел. Как правило, на 1 мл сорбента пришивали 1‒3 мг нанотела. В зависимости от объема реакционной смеси реакцию пришивки (связывания) проводили в пробирках объемом 2 или 15 мл. Содержимое пробирок перемешивали при комнатной температуре с использованием медицинского ротационного смесителя (ELMI Rotamix RM-1, Латвия) в течение 2‒4 ч. Процедуру связывания останавливали, добавляя 1 M Трис-HCl, pH 8.0 до конечной концентрации 0.1 M, после чего снова качали пробирку со смесью на медицинском ротационном смесителе (1‒2 ч при комнатной температуре). Обычно пробирки оставляли на 16‒18 ч при +4°С, после чего отбирали водную фазу, содержащую несвязавшиеся антитела. Полученные иммуносорбенты последовательно промывали растворами с низким и высоким значением pH: 0.1 M ацетатом натрия, pH 4.0, содержащим 0.5 М NaCl, и 0.1 M Трис-HCl, pH 8.0, содержащим 0.5 М NaCl. Такую промывку проводили как минимум 3 раза из расчета 5 объемов буфера на 1 объем колонки. Полученную сефарозу с иммобилизованными однодоменными антителами хранили при +4°С либо в PBS, добавляя азид натрия в рабочей концентрации, либо в 20%-ном спирте. Иммуносорбент перед каждым использованием промывали 3‒5 объемами PBS. Таким образом получали новые иммуносорбенты (иммуноаффинные колонки), специфичность которых определялась свойствами иммобилизованных нанотел. Иммуносорбенты с иммобилизованными отобранными нанотелами использовали как для выделения связываемых белков (с целью их анализа и идентификации), так и для специфического истощения протеома мочи. Эти хроматографические эксперименты проводили, как описано ранее [10, 12]. В ходе работы получены и использованы высокоаффинные иммуносорбенты, связывающие следующие белки плазмы крови и мочи человека: сывороточный альбумин, иммуноглобулин A, иммуноглобулин G, фибриноген, трансферрин, альфа-2-макроглобулин, аполипопротеин A1, аполипопротеин B, фибронектин, лактоферрин. Подробная схема получения большинства представленных иммуносорбентов описана в [12]. Подробная схема получения однодоменных антител, связывающих лактоферрин, представлена в [10].
Получение специфически истощенной или обогащенной фракции белков надосадка мочи. На основе отобранных однодоменных антител получены как индивидуальные, так и комбинированные иммуносорбенты, связывающие описанные белки плазмы крови и надосадка мочи. Для получения истощенной или обогащенной фракции белков использовали свежеприготовленные или свежеразмороженные препараты мочи больных и здоровых доноров. Исходное количество анализируемых препаратов мочи рассчитывали индивидуально. Препараты последовательно пропускали через иммуносорбенты с иммобилизованными однодоменными антителами. Проводили дробную промывку иммуносорбента, связавшего антиген, 10 объемами солевого буфера PBS. Связавшийся белок элюировали при пониженных значениях pH, что позволяло разрушить комплекс антиген/антитело без нарушения функциональности вариабельного домена, иммобилизованного на колонке. С этой целью использовали буфер глицин-HCl pH 2.7, конечный объем элюата составлял 3 объема колонки. Полученный элюат нейтрализовали, добавляя 1 M раствор Tрис. Таким образом получены фракции проскока, из которых удалены заданные высокопредставленные белки, и фракции элюата, напротив, обогащенные целевыми белками и связанными с ними субпротеомами.
Подготовка проб для электрофоретического фракционирования белков в различных образцах крови и мочи. Для проведения электрофоретического анализа отбирали аликвоты исходного образца, проскока или элюата. Размер аликвот определяли в каждом конкретном случае. Объем наносимой на гель пробы уменьшали, концентрируя белки во фракциях с помощью фильтрационно-центрифужных приспособлений Amicon (“Millipore”, США) c размером отсечения 10 кДа или осаждали, используя метод Wessel‒Fluеgge [17]. В последнем случае к образцу объемом 150 мкл при перемешивании добавляли 600 мкл метанола. Если объем образца превышал 150 мкл, то его распределяли по пробиркам (150 мкл в каждой). К полученной смеси добавляли 150 мкл хлороформа и перемешивали пробу с использованием вортекса (Heidolph reax top, Германия) до формирования однородной фазы. Затем добавляли 450 мкл деионизированной воды (mQ), тщательно перемешивали, после чего в течение минуты центрифугировали при 12 000 g. После центрифугирования аккуратно удаляли верхнюю органическую фазу с сохранением интерфазы, содержащей белок. Затем добавляли 450 мкл метанола и тщательно перемешивали с использованием вортекса. Препарат центрифугировали в течение 2 мин при 12 000 g, затем супернатант удаляли, а полученный осадок растворяли в Лэммли-буфере для нанесения на гель с целью последующего анализа образцов.
Электрофоретическое фракционирование белков в различных образцах крови и мочи. Пробы, полученные описанным выше способом, анализировали с использованием электрофореза в градиентном (5‒19%) ПААГ. Электрофорез проводили по методу Лэммли [18] в стандартном SDS-буфере с использованием прибора MiniProtean III (“Bio-Rad”, США) и источника питания Эльф-4 (“ДНК-Технология”, Россия). В качестве восстанавливающего агента использовали дитиотреитол. В качестве белкового маркера использовали либо Spectra Multicolor Broad Range Protein Ladder (“Thermo Fisher Scientific”, США), либо Precision Plus Protein Standards Dual Color (“Bio-Rad”).
Измерение концентрации креатинина и общего белка в образцах мочи. Количественное содержание креатинина и общего белка определяли с помощью анализатора мочи “URiСКАН-БК” производства фирмы “Эйлитон” (Россия) и наборов реагентов той же фирмы для количественного определения содержания креатинина (Креатинин-UTS) и белка (ПГК-UTS) в моче.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выявление обогащения протеома мочи больных РМП белками плазмы крови
Благодаря создаваемому нами (в рамках проекта РНФ) банку аннотированных образцов мочи больных РМП, мы смогли сравнить главные белки мочи, разделенные методом 1D электрофореза в 5‒19%-ном градиентном ПААГ (в восстанавливающих и невосстанавливающих условиях), здоровых людей, больных мышечно-неинвазивным и мышечно-инвазивным РМП.
Образцы для нанесения на гель готовили из 150 мкл супернатанта мочи больных РМП или из 1500 мкл супернатанта мочи здоровых доноров, которые дополнительно центрифугировали (12 000 g, 30 мин), а затем концентрировали с помощью ультрафильтрации (Amicon-картриджи, “Millipore”). Полученные электрофореграммы, представленные на рис. 1, нас весьма впечатлили. Сразу бросаются в глаза явные количественные различия в мажорных белках мочи из образцов здоровых доноров (специально взятых в десятикратном избытке, так как без этого белки не детектируются) и из образцов больных РМП. У всех больных РМП отмечено существенное увеличение содержания сывороточного альбумина, IgA, IgG, трансферрина. Причем заметная часть IgA в моче представлена, по-видимому, секреторной формой (sIgA) [19], состоящей из димера IgA (2× 160 кДа) и секреторного компонента (60 кДа). При электрофорезе в невосстанавливающих условиях IgA выявляется в самой верхней зоне геля, представленного на рис. 1 слева. В восстанавливающих условиях тяжелая цепь IgA практически сливается с альбумином. Только при сопоставлении интенсивностей полос на электрофореграммах, полученных в разных условиях, можно заключить, что IgA является основным вариантом иммуноглобулина (в дополнение к IgG), присутствующим как в виде мономера, так и димера, а также секреторного sIgA или иных олигомерных форм.
Рис. 1.
Фракционирование в градиентном 5‒19%-ном ПААГ белков из 150 мкл супернатанта мочи больных РМП (указаны номера образцов из табл. 1, степень инвазивности и злокачественности опухоли), трех образцов белков из 1500 мкл мочи здоровых доноров, а также контрольных белков из плазмы крови здорового донора (ПК, К1, К2). ПК – 0.1 мкл исходной плазмы крови; К1 – маркерная смесь белков 1 (трансферрин – Tf, сывороточный альбумин – SA, иммуноглобулин G – IgG); и К2 – маркерная смесь белков 2 (ɑ2-макроглобулин – ɑ2МА, иммуноглобулин A – IgA), выделенные нами из плазмы крови с помощью иммобилизованных на аффинных колонках нанотел, как описано ранее [12]. М – маркер молекулярной массы полипептидов. Стрелками, направленными направо, отмечено положение известных белков (из смесей К1 и К2). Стрелками, направленными налево, обозначены белки, которыми обогащена моча больных РМП по сравнению с контрольными образцами. HG – высокая степень злокачественности опухоли. Н, И и Д – мышечно-неинвазивная, мышечно-инвазивная и доброкачественная опухоль соответственно. ДТТ – дитиотреитол.
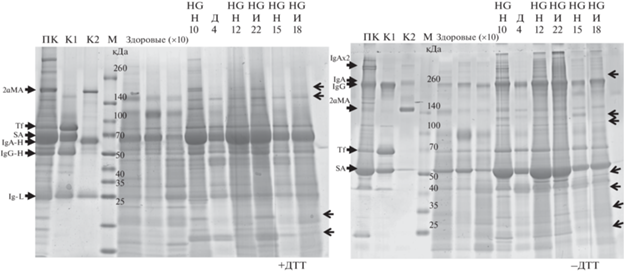
Стрелками, направленными слева направо, на рис. 1 обозначены полосы, соответствующие известным белкам, которые особенно наглядно можно видеть в разработанных нами маркерных смесях белков К1 и К2, состоящих из ряда мажорных белков крови, специально выделенных из плазмы крови здорового донора с помощью иммобилизованных на сефарозе нанотел, полученных нами ранее [12], которые узнают заданные белки. Проведено масс-спектрометрическое подтверждение (идентификация) белков крови, связываемых с используемыми в данной работе нанотелами [12].
На электрофорегамме явно выделяется ряд белковых полос, характерных именно для больных РМП. Одна из них соответствует одному из относительно мажорных белков крови размером примерно 150 кДа (чуть выше маркера 140 кДа и ниже приготовленного нами маркера – альфа-2-макроглобулина, размером 185 кДа в восстанавливающих условиях). Таким условиям соответствует практически только один белок – Factor F, который ингибирует активацию комплемента и является известным диагностическим маркером РМП (BTA, bladder tumor antigen). Другим РМП-специфическим маркером может быть еще неизвестный нам белок размером примерно 13 кДа. Когда этого белка особенно много, чуть ниже появляется еще одна полоса размером 12 кДа, возможно, это процессированный продукт. Другие подобные белки, содержание которых в моче больных РМП может быть значительно выше, чем в контрольных образцах, и которые можно увидеть уже при данном фракционировании (обозначены на рис. 1 стрелками, направленными справа налево).
Наглядность результатов, полученных при сравнении белков мочи, была настолько впечатляющей, что мы сравнили пробы мочи других больных РМП, хранящиеся в создаваемом нами банке образцов. На рис. 2 представлен результат подобного прямого электрофоретического анализа белков в моче 20 больных с различными стадиями РМП. На рис. 2 (в отличие от рис. 1) представлены образцы, отражающие более широкий диапазон вариантов заболевания. Можно наблюдать прямую зависимость степени обогащения мочи больных белками крови от стадии развития болезни.
Рис. 2.
Электрофоретическое фракционирование в градиентном 5–19%-ном ПААГ в восстанавливающих условиях белков из 75 мкл супернатанта мочи больных РМП (указаны номера образцов из табл. 1, степень инвазивности и злокачественности соответствующей опухоли). ПК – 0.1 мкл исходной плазмы крови, М – маркер молекулярной массы полипептидов. Стрелками обозначены белки, которыми обогащена моча больных РМП по сравнению с контрольными образцами и образцами больных с доброкачественными новообразованиями. HG – высокая степень злокачественности опухоли. Н, И и Д – мышечно-неинвазивные, мышечно-инвазивные и доброкачественные опухоли соответственно.
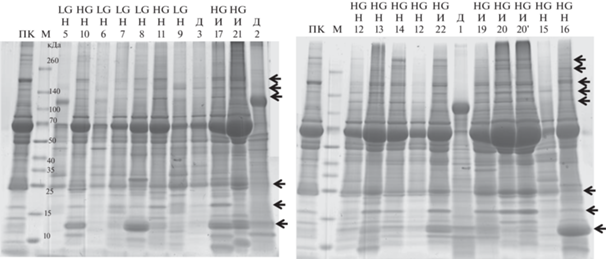
Меньше всего белков крови обнаружено в моче больных с доброкачественными и неинвазивными опухолями с низкой степенью злокачественности. Соответственно, наибольшее количество белков, характерных для крови, выявлено в образцах мочи больных РМП с высокой степенью злокачественности, особенно в случае мышечно-инвазивных опухолей.
В двух из четырех образцов, полученных от пациентов с доброкачественными новообразованиями мочевого пузыря, наблюдается особая картина с одним главным доминирующим белком, предположительно (судя по положению в геле и в сравнении с нормальными пробами), это может быть уромодулин (белок Тамма–Хорсфола). В образцах мочи здоровых людей это самый главный белок – гликопротеид с молекулярной массой примерно 85–95 кДа (в геле движется чуть медленнее полосы маркера 100 кДа) [20].
Электрофореграммы белков остальных образцов мочи больных РМП (конечно, пока на данной ограниченной выборке) выявляют хорошую корреляцию с результатами инвазивных клинических анализов (табл. 1) и, по-видимому, позволяют предсказывать степень злокачественности опухолей, соответствующих данным образцам, и примерную стадию их развития (инвазивность).
Следует отметить, что известным симптомом РМП является гематурия (избыточное количество крови в моче). Однако она связана, в первую очередь, с повышенным содержанием эритроцитов в моче. Мы же наблюдали повышенное содержание мажорных белков крови в моче больных РМП, у которых может и не быть заметной гематурии (табл. 1).
Выделение (обогащение) субпротеомов, ассоциированных с определенными мажорными белками мочи, с помощью иммуноаффинной хроматографии на колонках с иммобилизованными нанотелами
Следующая часть работы посвящена использованию иммобилизованных нанотел к определенным белкам (компонентам мочи) для эффективного выделения заданного субпротеома. Такое выделение может упростить задачу анализа как мажорных, так и минорных биомаркеров (в конкретном субпротеоме или в остаточной фракции после удаления основных компонентов). Мы использовали только четыре характерных образца мочи больных РМП:
1) № 7 (табл. 1), мышечно-неинвазивный РМП низкой степени злокачественности (G1);
2) № 10, мышечно-неинвазивный РМП умеренной степени злокачественности (G2);
3) № 20, мышечно-инвазивный РМП высокой степени злокачественности (G3);
4) № 22, мышечно-инвазивная опухоль высокой степени злокачественности с региональными метастазами (G4).
Каждый образец (1 мл) последовательно пропускали через четыре иммуносорбента с иммобилизованными нанотелами. Первый иммуносорбент содержал однодоменные антитела к сывороточному альбумину; второй – однодоменные антитела к IgA и трансферрину (Tf); третий – однодоменные антитела к фибриногену (Fg), аполипопротеинам A1 и B (ApoA1, ApoB); четвертый – однодоменные антитела к фибронектину (FN), альфа-2-макроглобулину (ɑ2MA), IgG и лактоферрину (Lf). Получены проскоки несвязавшегося материала и элюаты (Э) для каждого иммуносорбента. После пропускания образцов через иммуносорбент с иммобилизованными нанотелами к альбумину отбирали аликвоту для последующего нанесения на гель, соответствующую 150 мкл исходного образца. Полученные элюаты и аликвоту проскока концентрировали с помощью фильтрационно-центрифужных приспособлений Amicon (“Millipore”) c размером отсечения 10 кДа до 100 мкл, после чего для электрофоретического анализа отбирали объем, соответствующий 150 мкл исходного образца. Полученные образцы проверяли с помощью электрофореза в 5–20%-ном градиентном ПААГ. Результаты такого иммуноаффинного выделения и/или истощения представлены на рис. 3.
Рис. 3.
Электрофоретическое разделение в 5–20% градиентном ПААГ белков мочи во фракциях, полученных в результате иммуноаффинного фракционирования белков четырех образцов мочи больных РМП. Исх. – исходный образец мочи; СА – проскок после удаления из исходной мочи сывороточного альбумина (SA); Э1 – элюат субпротеома, ассоциированного с белками IgA и трансферрином (Tf); Э2 – элюат субпротеома, ассоциированного с фибриногеном (Fg) и аполипопротеинами (Apo) А1 и В; Э3 – элюат субпротеома, ассоциированного с белками IgG, фибронектином (FN), лактоферрином (Lf) и ɑ2-макроглобулином (МА). Стрелками обозначены основные белки, которыми обогащены фракции, сокращенные названия этих белков приведены справа.
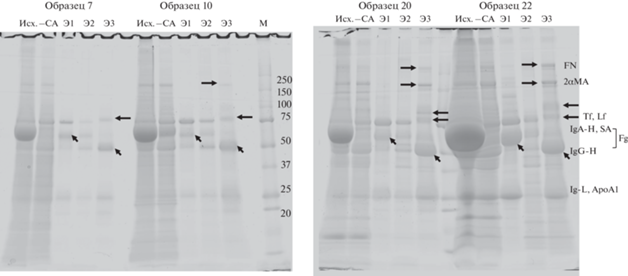
Из рис. 3 видно, что фракционирование позволяет более точно оценить соотношение ряда мажорных компонентов мочи в исследуемых образцах. Так, в элюатах 1 и 3 мы можем сравнить относительную представленность IgA и IgG. В элюатах 3 мы четко видим, особенно в случае злокачественных мышечно-инвазивных опухолей, фибронектин и альфа-2-макроглобулин. Во всех образцах в элюате 3 можно видеть лактоферрин (на геле расположен чуть выше трансферрина, перекрываясь с ним в исходном образце). Следует заметить, что проведенное фракционирование не учитывало такие известные факты, как возможное образование комплексов между IgA и сывороточным альбумином, между трансферрином и фибриногеном. Этим, предположительно, можно объяснить некоторые несовершенства фракционирования. Однако приведенный результат показывает перспективность аффинного выделения определенных субпротеомов, что может облегчить их последующий сравнительный анализ с помощью самых разных методов.
На рис. 4 представлены результаты последовательного фракционирования белков четырех образцов мочи больных РМП и взятого в 10-кратном избытке контрольного образца (К) на иммуноаффинных колонках с нанотелами, узнающими фибриноген (рис. 4а), аполипопротеин А1 (ApoA1) или ɑ2-макроглобулин (рис. 4б). На дорожки геля нанесены образцы, эквивалентные 200 мкл исходной мочи (образцы больных РМП) и 2 мл – в случае контрольного образца здорового человека. В ассоциированных с фибриногеном субпротеомах образцов (20 и 22) мышечно-инвазивного РМП на электрофореграмме (рис. 4а) видно увеличение количества белков по сравнению с образцами мышечно-неинвазивного РМП (7 и 10); также видна, по-видимому, заметная деградация этих белков в образцах инвазивного РМП. В нижней части рис. 4б можно видеть обогащение белками ApoA1 (А1) и ɑ2-макроглобулином (ɑ2М) также при мышечно-инвазивном РМП (их положение отмечено стрелками). В контрольном образце мочи здорового донора (К), взятого в 10-кратном избытке, выявлено относительно небольшое количество фибриногена (в 10 раз меньшее, чем даже у больных мышечно-неинвазивным РМП) и, по-видимому, ApoA1, но не детектируется ɑ2-макроглобулин.
Рис. 4.
Электрофоретическое разделение белков мочи в 5–20%-ном градиентном ПААГ во фракциях, полученных путем иммуноаффинного фракционирования белков четырех образцов, полученных от больных РМП, и взятого в 10-кратном избытке контрольного образца (К) от здорового донора: а – элюаты белков, связавшихся с иммуносорбентом на основе нанотел к фибриногену; б – элюаты белков, связавшихся с иммуносорбентами на основе нанотел к аполипопротеину A1 (ɑ2М) или к ɑ2-макроглобулину (ɑ2М). М – маркер. Стрелками обозначены выявляемые белки ɑ2М и апоА1.
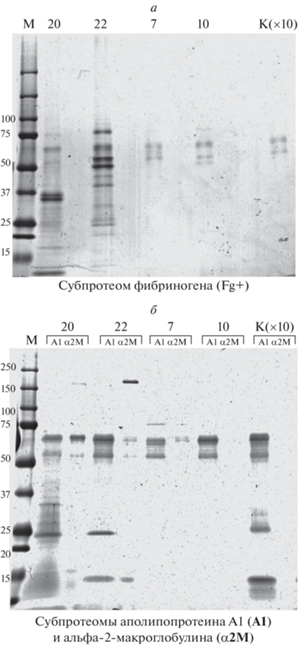
Следует отметить, что при последовательном пропускании образцов мочи через несколько колонок мы частично теряли некоторые маркерные белки, возможно, за счет их неспецифической сорбции или ассоциации с другими отбираемыми компонентами, поэтому мы предполагаем использовать однократное пропускание исходного образца мочи через иммуносорбент, выбранный для предобработки.
Еще одно важное замечание: несмотря на выявление наглядной корреляции, мы пока анализировали аликвоты мочи равного объема. Однако при анализе биомаркеров количественные результаты принято нормировать не по объему мочи, а по концентрации креатинина или общего белка. Некоторые исследователи предполагают проводить нормализацию по концентрации сывороточного альбумина или трансферрина в моче. Мы проанализировали возможности подобных способов нормирования количественных оценок белковых компонентов в моче, выбрав четыре характерных образца мочи.
Изучение компонентов мочи после нормирования по концентрации креатинина или при выравнивании количества общего белка
Мы выбрали четыре характерных образца (№ 7, № 10, № 20 и № 22, табл. 1). Образец № 7 получен от пациента с ранней мышечно-неинвазивной опухолью низкой злокачественности (G1); № 10 – от пациента с мышечно-неинвазивной опухолью более высокой степени злокачественности (G2); № 20 – от пациента с мышечно-инвазивной опухолью высокой злокачественности (G3); № 22 – от пациента с мышечно-инвазивной опухолью высокой злокачественности с метастазами.
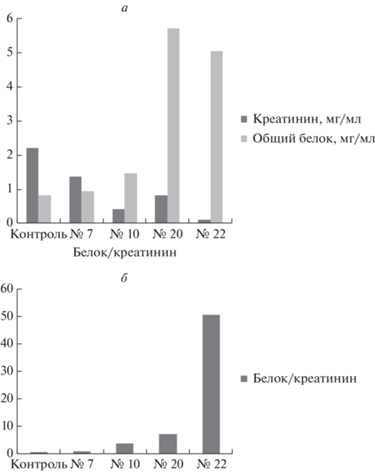
В этих образцах, а также в контрольном образце, полученном от здорового донора, мы измерили концентрации креатинина и общего белка с помощью прибора URiСКАН-БК, специализированного анализатора мочи и наборов реагентов для диагностики протеинурии (“Эйлитон”, Россия). Результаты измерений представлены на рис. 5. Видно, что развитие и тяжесть РМП явно коррелируют с резким возрастанием соотношения концентраций белок/креатинин. Из представленных данных видна сложность нормализации по креатинину образцов мочи при РМП продвинутых стадий, особенно при высокой степени злокачественности. Так, в образце № 22 соотношение белок/креатинин примерно в 100 раз выше нормы, а если выровнять по креатинину этот образец и нормальный, то будет выявлена 100-кратная разница в количестве белка. С одной стороны, выравнивание проб по креатинину еще больше подчеркнет выявляемые в приведенных выше результатах эффекты обогащения определенными белками. С другой стороны, для обнаружения качественных различий в конкретных белковых продуктах более наглядным может быть использование проб, выравненных по общему белку (или по сывороточному альбумину, или трансферрину).
Рис. 5.
Определение концентраций креатинина и общего белка в образцах мочи больных РМП (№ 7, № 10, № 20 и № 22), а также в контрольном образце здорового донора. а – Концентрации креатинина и белка (в мг/мл). б – Соотношение концентраций белка и креатинина.
Мы решили сначала провести нормализацию образцов по общему белку, а затем фракционировать их: выделить IgG и IgA c ассоциированным субпротеомом, а затем альбумин с ассоциированными компонентами. Субпротеом мочи после этих выделений может оказаться перспективным для анализа менее представленных белков, которые могут быть плохо видны в исходном препарате, поскольку затенены указанными наиболее богато представленными белками. Для сравнения фракций, выделенных одинаковым способом из разных образцов, желательно наносить их в соседние дорожки одного геля. Мы проанализировали таким образом фракции, полученные из четырех образцов мочи (рис. 6 и 7). На рис. 6 представлены результаты фракционирования в 5‒19%-ном ПААГ белков исходных образцов мочи (исходные), субпротеома, ассоциированного с сывороточным альбумином (элюаты (СА) белков мочи, связавшихся с иммуносорбентом, созданным на основе нанотел к сывороточному альбумину), а также проскоки белков мочи, не связавшихся ни с иммуносорбентом на основе нанотел к сывороточному альбумину, ни с иммуносорбентами, созданными на основе нанотел к иммуноглобулинам.
Рис. 6.
Фракционирование исходных образцов мочи (исходные), нормализованных по общему белку, а также их фракций: субпротеома, ассоциированного с сывороточным альбумином (элюаты (СА)), и субпротеома проскока (проскоки) из несвязавшихся с анти-СА-иммуносорбентом белков. Номера образцов мочи указаны над электрофореграммой.
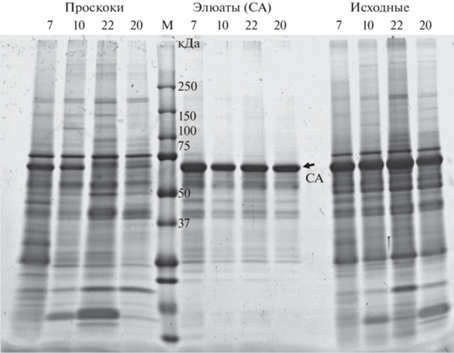
Рис. 7.
Анализ фракций иммуноглобулинов (IgA и IgG) и ассоциированных с ними белков. Сверху указаны номера образцов мочи, которую подвергали фракционированию. M – маркер. Стрелками обозначены белковые продукты, отличающиеся от иммуноглобулинов, и потенциально с ними ассоциированные. На одном геле четыре образца слева фракционировали в восстанавливающих условиях (ДТТ+), а четыре образца справа – в невосстанавливающих (ДТТ-).
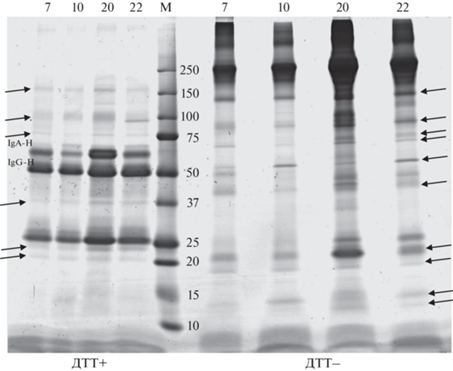
При таком нормализованном по общему белку анализе более наглядно видны относительные различия в представленности конкретных белковых полос внутри каждого образца. На рис. 7 представлен анализ фракций иммуноглобулинов (IgA и IgG) и ассоциированных с ними белков, полученных в результате связывания, промывки и элюции связавшихся белков с колонки, на которой иммобилизованы полученные нами ранее два разных нанотела, связывающие в совокупности константные участки IgG и IgA.
Выделенные субпротеомы содержат не только основные заданные белки, но и другие компоненты, которые потенциально могут быть важными для диагностических исследований. Получение фракции проскока, из которой удалены основные белки, может быть весьма полезным способом предобработки мочи для последующего исследования с помощью различных современных методов, таких как двумерный электрофорез, масс-спектрометрия и другие.
Особый интерес представляет выделение иммунных комплексов из мочи конкретного пациента. При первичном изучении в составе этих комплексов можно увидеть не только повышенное содержание IgA и IgG на инвазивных стадиях болезни, но также и многие другие компоненты, которые потенциально могут быть биомаркерами патологического процесса у конкретного пациента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В представленной работе проанализированы экспериментальные возможности применения ряда полученных нами ранее однодоменных антител (нанотел) к мажорным маркерным белкам крови для предобработки препаратов мочи больных РМП. Показаны уникальные возможности использования нанотел и новых инструментов на их основе (иммуносорбентов, специфически адаптированных парамагнитных частиц или иных носителей) для повышения эффективности неинвазивных диагностических исследований наряду с такими традиционными методами, как электрофорез, а, в перспективе, масс-спектрометрический анализ и другие самые современные подходы.
Одно из перспективных направлений использования нанотел – получение на их основе новых иммуносорбентов (или модифицированных парамагнитных частиц). Насколько нам известно, число публикаций, посвященных получению и адаптации нанотел для использования в составе иммуносорбентов, весьма ограничено. В качестве примера можно привести недавнюю публикацию об иммуносорбенте на основе нанотел к β2-микроглобулину для селективной очистки крови от этого белка, что может отсрочить возникновение диализного амилоидоза [21]. В этой работе описан метод создания иммуносорбента с помощью сайт-специфической пришивки нанотела, показана высокая эффективность получаемого продукта для удаления заданного белка из крови. Потенциал наших разработок намного выше. Здесь речь идет об использовании не одного, а сразу многих высокоаффинных нанотел, с высокой специфичностью связывающих конкретный мажорный белок крови или мочи (сывороточный альбумин, иммуноглобулин A, иммуноглобулин G, фибриноген, трансферрин, α2-макроглобулин, аполипопротеин A1, аполипопротеин B, фибронектин, лактоферрин). Использованные в данной работе нанотела получены и описаны в руководимой Тиллибом лаборатории ИБГ РАН [10, 12]. Все эти нанотела новые и коммерчески недоступные.
Нами не найдено публикаций об использовании методов фракционирования белков мочи, основанных на классических антителах. Возможно, это связано с относительно высокой стоимостью и меньшей стабильностью традиционных моноклональных антител по сравнению с нанотелами. Наше преимущество состоит также в том, что мы имеем продуценты всех используемых в данной работе нанотел и можем в любой момент экономично наработать их в бактериальной системе экспрессии.
Нами показана возможность высокоспецифичного удаления (истощения) или обогащения конкретного белка мочи с помощью соответствующего иммуносорбента. Таким образом, можно специфически предобработать препарат мочи, плазмы крови (что показано нами ранее [12]) или иной биологической жидкости, удалив нежелательные белки, или наоборот, выделить субпротеомы, ассоциированные с конкретным мажорным плазматическим белком-носителем. Такая предобработка может быть полезной для последующего анализа маркерных молекул в соответствующих фракциях, например, с помощью масс-спектрометрии. Подобные обработки могут быть также полезны для повышения чувствительности традиционных методов иммуноферментного и иммунофлуоресцентного анализа.
Мы использовали комбинированный подход для исследования образцов надосадка мочи, полученной от пациентов с разными стадиями РМП. Этот подход заключался в использовании иммуноаффинных колонок с иммобилизованными нанотелами для специфической предобработки образцов мочи и последующего фракционирования белков исходной или предобработанной мочи традиционным методом электрофореза в градиентном SDS-ПААГ, первую версию которого описал Лэммли много лет тому назад [18]. Удивительно, но 1D ПААГ-электрофорез, самый популярный в исследовательских лабораториях вариант, редко используется при проведении клинических анализов мочи. Мы присоединяемся к мнению ряда экспертов в области исследования протеома мочи [16] и видим именно этот относительно простой метод фракционирования белков как компромиссный вариант разрабатываемого рутинного метода клинического тестирования белков мочи.
Помимо технологических инноваций, связанных с использованием новых высокоспецифических нанотел, нами получены следующие важные результаты. Показано, что развитие РМП сопровождается увеличением содержания мажорных белков крови практически во всех 22 исследованных образцах мочи больных. Некоторые из этих белков уже предложены ранее в качестве биомаркеров РМП. Так, мы подтвердили опубликованные ранее данные и выявили повышение содержания ряда конкретных маркерных белков в образцах мочи больных РМП, особенно выраженное при прогрессировании опухоли от мышечно-неинвазивных к мышечно-инвазивным стадиям. Помимо сывороточного альбумина, трансферрина, IgA и IgG, нами выявлено также обогащение фибриногеном (причем при РМП высокой степени злокачественности наблюдали его деградацию), лактоферрином, α2-макроглобулином, аполипопротеином A1, фибронектином, что вполне согласуется с данными [22–26]. Вариант комбинированного иммуносорбента, содержащего использованные в данной работе нанотела к перечисленным выше маркерным белкам, имеющим диагностический потенциал для РМП, может использоваться также для разработки неинвазивного диагностического метода в ближайшем будущем с целью первичного скрининга пациентов из группы риска.
Отметим, что при удалении мажорных белков в колоночном формате возможна неконтролируемая потеря минорных компонентов за счет сорбционных эффектов. Возможно, для исследования минорных биомаркеров более перспективно выделять-обогащаться заданным субпротеомом с целью его более детального исследования.
На наш взгляд, особый интерес представляет выделение иммунных комплексов из мочи конкретного пациента. Наряду с увеличенным содержанием IgA и IgG на инвазивных стадиях болезни в составе этих комплексов можно увидеть и многие другие компоненты, которые потенциально могут быть биомаркерами патологического процесса у конкретного пациента. Мы планируем использовать этот подход в более масштабных исследованиях с целью идентификации компонентов иммунных комплексов, которые могут быть ассоциированы с ответом иммунной системы пациента на растущую злокачественную опухоль, которая контактирует с мочой, что определяет важность использования для диагностики именно мочи.
Безусловно, наша работа это лишь первая пионерская работа в направлении разработки комбинированного диагностического метода начального исследования белков мочи. Мы планируем дальнейшую работу в этом направлении на основе полученных результатов. Для нормализации данных мы предполагаем использовать традиционную практику отнесения белковых данных к концентрации креатинина в моче. Из наших результатов следует, что в таком случае еще лучше будет видна разница между образцами мочи здоровых людей, пациентов с ранними формами РМП и с мышечно-инвазивными опухолями. Усреднение по содержанию общего белка может быть правильным при резком появлении или исчезновении конкретного биомаркера, а для детекции количественных изменений, на наш взгляд, более удачным будет выравнивание образцов по креатинину.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 20-14-00305).
Все процедуры, выполненные с участием биологических жидкостей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От каждого участника, включенного в исследование, получено информированное добровольное согласие. Работа одобрена Этическими комитетами ИБГ РАН (разрешение от 18.01.2021) и Московского научно-исследовательского онкологического института имени П.А. Герцена.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
IARC, Cancer Today. Estimated number of new cases in 2020, worldwide, both sexes, all ages. (2021) https://gco.iarc.fr/today/online-analysis-table
https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/#3
American Cancer Society. What is bladder cancer? (2020) (https://www.cancer.org/cancer/bladder-cancer/ about/what-is-bladder-cancer.html. Accessed September 2020
van Rhijn B.W., Burger M., Lotan Y., Solsona E., Stief C.G., Sylvester R.J., Witjes J.A., Zlotta A.R. (2009) Recurrence and progression of disease in non-muscle-invasive bladder cancer: from epidemiology to treatment strategy. Eur. Urol. 56 (3), 430‒442. https://doi.org/10.1016/j.eururo.2009.06.028
Humphrey P.A., Moch H., Cubilla A.L., Ulbright T.M., Reuter V.E. (2016) The 2016 WHO classification of tumours of the urinary system and male genital organs-part B: prostate and bladder tumours. Eur. Urol. 70 (1), 106‒119.
Santoni G., Morelli M.B., Amantini C. Battelli N. (2018) Urinary markers in bladder cancer: an update. Front. Oncol. 7 (8), 362.
Blick C.G.T., Nazir S.A., Mallett S., Turney B.W., Onwu N.N., Roberts I.S.D., Jeremy P. Crew J.H., Cowan N.C. (2011) Evaluation of diagnostic strategies for bladder cancer using computed tomography (CT) urography, flexible cystoscopy and voided urine cytology: results for 778 patients from a hospital haematuria clinic. BJU Int. 110, 84–94.
Тиллиб С.В., Иванова Т.И., Васильев Л.А. (2010) Фингерпринтный анализ селекции “наноантител” методом фагового дисплея с использованием двух вариантов фагов-помощников. Acta Naturae. 2, 100–108.
Tillib S., Ivanova T.I., Vasilev L.A., Rutovskaya M.V., Saakyan S.A., Gribova I.Y., Tutykhina I.L., Sedova E.S., Lysenko A.A., Shmarov M.M., Logunov D.Y., Na-roditsky B.S., Gintsburg A.L. (2013) Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Res. 97, 245‒254.
Tillib S.V., Privezentseva M.E., Ivanova T.I., Efimov G.A., Gursky Y.G., Georgiev G.P., Goldman I.L., Sadchikova E.R. (2014) Single-domain antibody-based ligands for immunoaffinity separation of recombinant human lactoferrin from the goat lactoferrin of trasgenic goat milk. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 949–950, 48–57.
Тиллиб С.В., Вятчанин А.С., Муилдерманс С. (2014) Молекулярный анализ структуры особых антител Сamelus bactrianus, состоящих только из тяжелых цепей. Биохимия. 79, 1687–1697.
Горяйнова О.С., Иванова Т.И., Рутовская М.В., Тиллиб С.В. (2017) Метод параллельного и последовательного генерирования однодоменных антител для протеомного анализа плазмы крови человека. Молекуляр. биология. 51(6), 985–996.
Тиллиб С.В. (2020) Перспективы использования однодоменных антител в биомедицине. Молекуляр. биология. 54(3), 362‒373.
Тиллиб С.В., Иванова Т.И., Лысюк Е.Ю., Ларин С.С., Кибардин А.В., Коробко Е.В., Вихрева П.Н., Гнучев Н.В., Георгиев Г.П., Коробко И.В. (2012) Наноантитела для детекции и блокирования биологической активности фактора роста эндотелия сосудов A165 человека. Биохимия. 77, 809‒817.
Гарас М.Н., Тиллиб С.В., Зубкова О.В., Рогожин В.Н., Иванова Т.И., Васильев Л.А., Логунов Д.Ю., Шмаров М.М., Тутыхина И.Л., Есмагамбетов И.Б., Грибова И.Ю., Банделюк А.С., Народицкий Б.С., Гинцбург А.Л. (2014) Мишень-специфичная доставка генов с помощью рекомбинантных псевдоаденовирусных частиц, способных эффективно связываться с наноантителами. Acta Naturae. 6(2), 102‒113.
Marshall T., Williams K.M. (1998) Clinical analysis of human urinary proteins using high resolution electrophoretic methods. Electrophoresis. 19, 1752‒1770.
Wessel D., Fluegge U.I. (1984) A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids. Anal. Biochem. 138, 141‒143.
Laemmli U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680‒685.
Floege J., Boddeker M., Stolte H., Koch K.M. (1990) Urinary lgA, secretory lgA and secretory component in women with recurrent urinary tract infections. Nephron. 56, 50‒55.
Machii R., Kubota R., Hiratsuka N., Sugimoto K., Masudo R., Kurihara Y., Kobayashi S., Shiba K. (2004) Urinary protein fraction in healthy subjects using cellulose acetate membrane electrophoresis followed by colloidal silver staining. J. Clin. Lab. Anal. 18, 231–236.
Huang C., Ren J., Ji F., Muyldermans S., Jia L. (2020) Nanobody-based high-performance immunosorbent for selective beta 2-microglobulin purification from blood. Acta Biomaterialia. 107, 232–241.
Betkerur V., Baumgartner G., Talluri K., Sharifi R., Nagubadi S., Guinan P. (1981) Urinary immunoglobulin A in the diagnosis of bladder cancer. J. Surg. Oncol. 16, 215‒217.
Khalifa A., Fathi O., Mousa M.A., el Magraby H. (1987) Immunoglobulin A and alpha 2-macroglobulin as tumor markers in bladder cancer. Chemioter. 6(Suppl. 2), 736‒737.
Li C., Li H., Zhang T., Li J., Liu L., Chang J. (2014) Discovery of Apo-A1 as a potential bladder cancer biomarker by urine proteomics and analysis. Biochem. Biophys. Res. Commun. 446, 1047‒1052.
Dong F., Shen Y., Xu T., Wang X., Gao F., Zhong S., Chen S., Shen Z. (2018) Effectiveness of urine fibronectin as a non-invasive diagnostic biomarker in bladder cancer patients: a systematic review and meta-analysis. World J. Surg. Oncol. 16, 61.
Matsumura E., Kosuge N., Nakanishi S., Suda T., Sugawa A., Fujimura T., Miyagi R., Yoshimi N., Saito S. (2020) Urine lactoferrin as a potential biomarker reflecting the degree of malignancy in urothelial carcinoma of the bladder. Tohoku J. Exp. Med. 252(3), 225‒244.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


