Молекулярная биология, 2022, T. 56, № 4, стр. 585-594
Делеция Aldh4a1 приводит к нарушению созревания сперматозоидов у мышей
Y. Xiao a, Z. Z. Wen b, B. Wu a, H. X. Zhu a, A. Z. Zhang a, *, J. Y. Li c, **, J. G. Gao a, b, ***
a School of Life Science and Key Laboratory of the Ministry of Education for Experimental Teratology,
Shandong University
250100 Jinan, P.R. China
b Medical Science and Technology Innovation Center, Shandong First Medical University
250117 Jinan, P.R. China
c Key Laboratory of Male Reproductive Health, Institute of Science and Technology, National Health Commission
100081 Beijing, P.R. China
* E-mail: aizhenzhang@126.com
** E-mail: sdscli@126.com
*** E-mail: jggao@sdu.edu.cn
Поступила в редакцию 09.10.2021
После доработки 09.02.2022
Принята к публикации 15.02.2022
- EDN: UBCTTZ
- DOI: 10.31857/S0026898422040152
Аннотация
ALDH4A1, член суперсемейства альдегиддегидрогеназ, является ключевым ферментом в митохондриальном пути метаболизма пролина. Недавние исследования показали, что мутации в aldh4a1 приводят к снижению фертильности и преждевременному репродуктивному старению самцов нематод. Однако влияние ALDH4A1 на фертильность самцов мышей не изучалось. В настоящем исследовании использовали технологию CRISPR-Cas9 для создания мышиной модели с нокаутом Aldh4a1, чтобы впервые изучить влияние этого гена на фертильность самцов мышей. Показано, что по сравнению с самцами дикого типа самцы Aldh4a1–/– были фертильны, имели нормальный сперматогенез, но дефект созревания сперматозоидов в эпидидимисе выражался в нарушении подвижности, морфологии и увеличении спонтанной реакции акросомы. Кроме того, с использованием трансмиссионной электронной микроскопии в митохондриях сперматозоидов обнаружены вакуоли, а также выявлены вакуоли и трещины в шейке сперматозоидов у мутантных мышей. Полученные результаты показывают, что ALDH4A1 играет жизненно важную роль в структуре жгутика сперматозоида и процессе созревания сперматозоидов у мышей.
ВВЕДЕНИЕ
Мужское бесплодие является одной из основных проблем здравоохранения во всем мире. По данным Всемирной организации здравоохранения, 9% пар в мире сталкиваются с проблемами фертильности, и на долю мужского бесплодия приходится 50% случаев из общего числа [1]. Здоровье сперматозоидов имеет ключевое значение для мужской фертильности. Тератозооспермия, астеноспермия и олигоспермия вызывают мужское бесплодие [2]. Количество спермы у бесплодных мужчин значительно снижено [3], а качество неуклонно снижается с каждым годом [4]. Недавние исследования показали, что мутация и инактивация альдегиддегидрогеназы 4A1 (ALDH4A1), фермента, катализирующего второй этап катаболизма пролина [5], ухудшает качество спермы и приводит к преждевременному репродуктивному старению [6].
Гены суперсемейства альдегиддегидрогеназ играют важную роль в катаболизме эндогенных и экзогенных альдегидов [7]. Представитель семейства ALDH4A1 локализуется в митохондриях [8] и важен в митохондриальном метаболизме пролина для преобразования 1-пирролин-5-карбоксилата (P5C) в глутаминовую кислоту [5]. Потеря активности фермента вследствие мутаций Aldh4a1 приводит к возникновению гиперлипидемии [9]. Более того, уровень флавинадениндинуклеотида (FAD) снижается, что приводит к изменению функционирования митохондрий [10]. Центральный аксон сперматозоидов окружен девятью внешними плотными волокнами и образует спиральную митохондриальную оболочку шейки и хвоста [11]. Активность митохондрий и цитоплазматический гликолиз обеспечивают движение сперматозоидов [12]. Изменения в ультраструктуре, активности или функции митохондрий могут негативно влиять на нормальное функционирование сперматозоидов и вызывать их дисфункцию [13].
Сперматогенез – это сложный процесс, происходящий в семенниках [14]. Образование зрелых сперматозоидов требует пролиферации и дифференцировки сперматогоний, мейоза для образования сперматозоидов и созревания круглых сперматозоидов [15]. После сперматогенеза сперматозоиды продолжают созревать в эпидидимисе [16, 17], который делится на три части: придаточный эпидидимис, каудальный эпидидимис и тело эпидидимиса [18–20], в которых специфичные ионы и белки изменяют созревание сперматозоидов и способствуют их подвижности [21]. Для изучения влияния ALDH4A1 на мужскую репродукцию были созданы нокаутные мыши с использованием технологии CRISPR-Cas9 [22]. Показано, что нокаут гена Aldh4a1 не влияет на сперматогенез в семенниках, но нарушает созревание сперматозоидов в хвостовом эпидидимисе, приводит к их аномальной морфологии, снижению подвижности сперматозоидов и преждевременной акросомальной реакции. Кроме того, у самцов Aldh4a1–/– в митохондриях сперматозоидов обнаруживали вакуоли, а в шейке сперматозоидов наблюдали трещины и вакуоли. Полученные результаты указывают на важную роль ALDH4A1 в функционировании сперматозоидов у мышей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение мышей с нокаутом Aldh4a1. Технологию CRISPR/Cas9 использовали для нокаута гена Aldh4a1 у мышей C57BL/6. Целевые последовательности направляющих РНК (gRNA) были следующими: gRNA1 – GTTCGGGCTGGGTGATCTGAGGG, gRNA2 – CCCGAGAGAGCGCACCATTTTGG. мРНК hCas9 и gRNA получали путем транскрипции in vitro. Суперовулированных самок дикого типа (WT) C57BL/6 спаривали с самцами C57BL/6 для получения зигот для введения мРНК Cas9 и gRNA. Геномную ДНК выделяли из хвостов новорожденных мышат. Полимеразную цепную реакцию (ПЦР) проводили с использованием прямого праймера ALDH4A1 5'-CCTTCTCGTGGAAAGGAGAAAC-3' и двух обратных праймеров 5'-CTGTGTTATCAACATTCACTTCCACT-3' и 5'-GACAATGACTAGCTCAAGGCTGAA-3' для того, чтобы амплифицировать фрагменты геномной ДНК, окружающие целевые сайты gRNA. Полученные ПЦР-фрагменты секвенировали для выявления мутаций. При скрещивании мутантов F0 сначала гибридизовали с мышами WT на том же фоне C57BL/6, и отбирали гетерозиготных мутантов F1. Затем гетерозиготные F1 скрещивались для получения гомозиготных мутантов F2.
Анализ уровней экспрессии мРНК. РНК из тканей мышей WT выделяли с помощью реагента TRIzol (“Invitrogen”, США). кДНК синтезировали с помощью обратной транскриптазы Primescript (“Takara”, Япония), затем проводили полимеразную цепную реакцию в реальном времени с использованием флуоресцентного красителя SYBR Green (“TakaRa”, Япония). Использовали следующие праймеры: Aldh4a1 прямой, 5'-TCTACTGGGTCTGTGGTGGTGG-3', Aldh4a1 обратный, 5'-GGGGTGATGTCCAGCGTAAG-3'. В качестве референсного гена использовали Gapdh. Все образцы анализировали в трех повторах, и относительные уровни мРНК в каждой ткани были рассчитаны методом –2∆∆t.
Гистологический анализ. Семенники мышей WT и Aldh4a1–/– и их придатки фиксировали раствором Буэна в течение 12 ч при комнатной температуре, затем обезвоживали в градиенте этанола и помещали в парафин. Полученную ткань разрезали на срезы толщиной 4 мкм. После депарафинизации и регидратации срезы тканей окрашивали гематоксилином и эозином (H&E) в соответствии со стандартными процедурами.
Анализ морфологии сперматозоидов. У мышей дикого типа и Aldh4a1–/– двусторонние половые железы вырезали из хвоста придатка семенника и помещали в PBS при 37°C на 15 минут. Затем 10 мкл надосадочной жидкости наносили на предметное стекло и получали мазки методом “тяни‒толкай”. Предметные стекла высушивали на воздухе в течение ночи, фиксировали в 95% этаноле в течение 30 мин при комнатной температуре и окрашивали стандартным методом H&E.
Активация акросомальной реакции. Среду TYH (Aibei Biotechnology Co., Ltd, Nanjing, China), предварительно выдержанную в течение ночи в инкубаторе при 37°C и 5% CO2, использовали при индукции акросомальной реакции сперматозоидов. Двусторонний каудальный эпидидимис мышей WT и Aldh4a1–/– измельчали в предварительно выдержанной среде и держали в инкубаторе при 37°C и 5% CO2 в течение 15 мин, чтобы вызвать акросомальную реакцию сперматозоидов. После мазка спермы акросомы окрашивали агглютинином Arachis hypogaea (арахис) (PNA, “Sigma”, L7381), а ядра окрашивали DAPI. Окрашивание акросом наблюдали в конфокальный лазерный сканирующий микроскоп LSM900 (ZEISS, Oberkochen, Германия). У каждой мыши подсчитывали не менее 200 сперматозоидов. Рассчитывали значение AR как соотношение PNA-отрицательных /API-положительных сперматозоидов.
Анализ подвижности сперматозоидов. Двусторонний хвост придатка семенника взрослых мышей помещали в PBS, затем его надламывали и инкубировали при 37°C в течение 15 мин, чтобы сперматозоиды вышли естественным путем. После этого 10 мкл надосадочной жидкости капали на стеклянную пластину для количественного анализа сперматозоидов. 200 сперматозоидов анализировали с помощью системы компьютерного анализа спермы (CASA) (Tsinghua Tongfang, Пекин, Китай) для получения кинетических параметров сперматозоидов.
Трансмиссионная электронная микроскопия (ТЭМ). Сперматозоиды из хвоста придатка яичка фиксировали в глутаральдегиде и осмиевой кислоте. После добавления 10% желатина сперматозоиды обезвоживали сахарозой и затем замораживали в жидком азоте. Готовили замороженные срезы толщиной 50 нм с помощью крио-ультрамикротома (EM FC7; Leica, Wetzlar, Германия) и просматривали с помощью трансмиссионной электронной микроскопии.
Иммуногистохимический анализ. Парафинированные срезы обезжиривали, регидратировали, блокировали 3% H2O2 в течение 10 мин и прогревали в растворе для демаскировки (10 мМ цитрата натрия). Затем срезы инкубировали с кроличьими моноклональными антителами против SOX9 (1 : 100, “ABclonal”, Китай) при 4°C в течение ночи. Иммуногистохимическое окрашивание парафиновых срезов проводили с помощью иммуногистохимического набора (Beijing Zhongshan Golden Bridge, Пекин, Китай).
Иммунофлуоресцентный анализ. После обезжиривания и регидратации парафинированные срезы помещали в цитрат натрия для демаскировки антигена и пермеабилизировали 0.5% Тритоном Х-100 в течение 10 мин. После блокирования 5% козьей сывороткой при 37°C в течение 30 мин, срезы инкубировали с первичными антителами (γH2aX, “Abcam”, ab26350, Кембридж, Великобритания) при 4°C в течение ночи и вторичными антителами при 37°C в течение часа. После окрашивания DAPI срезы просматривали на LSM900 (ZEISS, Oberkochen, Германия).
Вестерн-блотинг. Общий белок, выделенный из семенников и придатка, смешивали с 5-кратным буфером для образцов и помещали в кипящую воду на 5 мин. Белки разделяли с помощью гель-электрофореза SDS-PAGE и переносили на PVDF мембрану. После блокирования 5%-ным обезжиренным молоком мембрану инкубировали с первичными антителами, разведенными 5% БСА при 4°C в течение ночи (GAPDH, 1 : 20000; ALDH4A1, 1 : 1000, Novus, Littleton, Colorado, USA). Затем вторичные антитела разводили 5%-ным обезжиренным молоком и инкубировали с мембраной при комнатной температуре в течение 1 ч. Количественный анализ полос проводили с помощью программы Image J.
Статистический анализ. Все данные представлены как среднее ± стандартное отклонение (SD). Для сравнения двух групп данных использовали t-тест Стьюдента, и p < 0.05 указывало на статистически значимую разницу.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Получение Aldh4a1–/– мышей с помощью CRISPR-Cas9
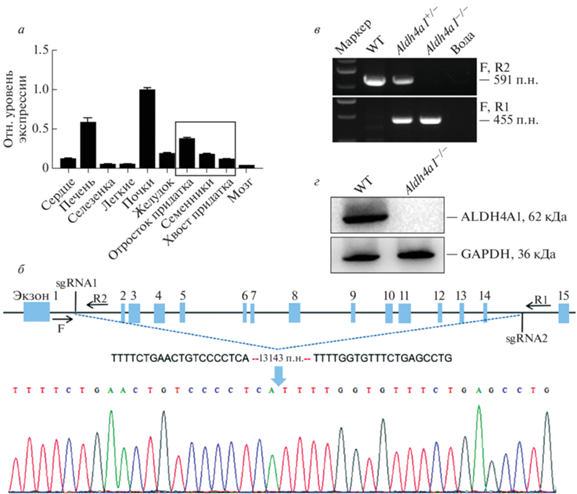
Экспрессию Aldh4a1 в тканях самцов мышей анализировали методом RT-qPCR. Обнаружено, что Aldh4a1 экспрессируется в репродуктивной системе самцов мышей, причем его экспрессия в придатках выше, чем в семенниках и в хвосте придатка (рис. 1a). Для изучения влияния Aldh4a1 на репродуктивную систему самцов мышей с помощью технологии CRISPR-Cas9 получили нокаут гена. Aldh4a1 содержит 15 экзонов, и экзоны со 2 по 14 были удалены двумя sgRNA (рис. 1б). Секвенирование ДНК подтвердило делецию 13143 п.н. в последовательности гена Aldh4a1 (рис. 1б), генотип определяли с помощью ПЦР-анализа (рис. 1в). Вестерн-блот показал также отсутствие белка ALDH4A1 у нокаутных мышей Aldh4a1–/– (рис. 1г). Полученные результаты показывают, что получены мыши с нокаутом Aldh4a1.
Рис. 1.
CRISPR-Cas9-опосредованное получение мышей Aldh4a1–/–. а – Анализ экспрессии ALDH4A1 в тканях мыши, включая сердце, печень, селезенку, легкие, почки, желудок, отростки придатков семенников, семенники, хвосты придатков семенников и мозг, с помощью RT-qPCR. б – Схема нокаута Aldh4a1 с использованием системы CRISPR-Cas9. Между мишенями sgRNA1 и sgRNA2 был удален участок длиной 13143 п.н., делеция между мишенями идентифицирована с помощью ПЦР с прямым (F) и обратными (R1, R2) праймерами. в – Различные фрагменты ДНК при анализе продуктов ПЦР у мышей WT и Aldh4a1–/–. г – Подтверждение отсутствия экспрессии белка ALDH4A1 у мышей Aldh4a1–/– с помощью анализа вестерн-блотинга.
Нормальное развитие и фертильность самцов мышей Aldh4a1–/–
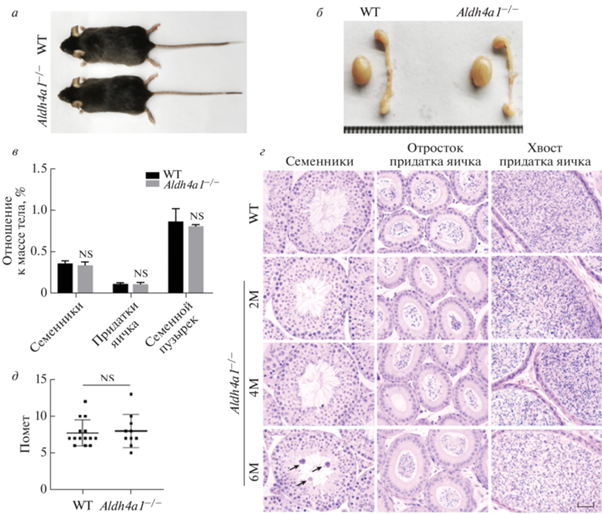
Влияние ALDH4A1 на фертильность самцов изучали, наблюдая развитие репродуктивной системы у самцов мышей Aldh4a1–/–. По сравнению с самцами мышей WT, морфология и масса тела самцов Aldh4a1–/– значимо не отличались (рис. 2а‒в). Гистологический анализ показал, что по сравнению с самцами мышей WT у двух-четырехмесячных самцов Aldh4a1–/– наблюдали нормальную морфологию семенников и придатков, но у 6-месячных особей Aldh4a1–/– в большинстве семенных канальцев присутствовали сфероиды (рис. 2д). Для проверки фертильности взрослых самцов WT и Aldh4a1–/– спаривали со взрослыми самками мышей WT при соотношении самцов и самок 1 : 2 соответственно. В ходе последующих трех месяцев наблюдений обнаружили, что количество потомков, произведенных с участием самцов Aldh4a1–/–, было таким же, как у самцов WT (рис. 2г), что свидетельствует о том, что делеция Aldh4a1 не влияет на репродуктивную способность самцов мышей.
Рис. 2.
Нормальная фертильность и состояние репродуктивной системы у самцов мышей Aldh4a1–/–. а, б – Размеры самцов и размеры семенников и придатков мышей WT и Aldh4a1–/–. в – Отношение массы семенников, придатков и семенных пузырьков к массе тела у самцов мышей Aldh4a1–/– и WT (N = 7). г – Тест на фертильность самцов Aldh4a1–/– и WT (N = 5). д – Парафиновые срезы семенников, придаточного эпидидимиса и каудального эпидидимиса 2-6-месячных самцов мышей WT и Aldh4a1–/–, окрашенные H&E. Аномальные сфероиды в семенниках 6-месячных самцов Aldh4a1-/- показаны стрелкой. Масштабная линейка = 100 мкм.
Нарушение качества спермы у самцов мышей Aldh4a1–/–
Далее мы проверили качество спермы самцов Aldh4a1–/–. Для анализа морфологии и подвижности сперматозоидов они были извлечены из хвоста придатка семенника. Результаты указывают на то, что уровень деформации сперматозоидов в хвосте придатка семенника у самцов Aldh4a1–/– значительно выше, чем у самцов WT. Проявления деформации в основном выражались в аномалии развития головки, шейки и хвоста сперматозоидов, наиболее часто наблюдали изогнутую шейку (рис. 3а, б). Кроме того, определяли подвижность сперматозоидов, в измерениях использовали не менее 200 образцов от каждой мыши. В результате показано, что по сравнению со сперматозоидами самцов мышей WT, жизнеспособность и подвижность сперматозоидов у Aldh4a1–/– резко снижены, в то время как количество иммобилизованных сперматозоидов значимо увеличено (рис. 3в). После этого оценили акросомальные реакции у самцов Aldh4a1–/–. Акросомальная реакция инициируется после соединения сперматозоида и яйцеклетки. Если спонтанная акросомальная реакция происходит до того, как сперматозоид соединится с блестящей оболочкой яйцеклетки, сперматозоид потеряет способность к оплодотворению. Капацитацию сперматозоидов моделировали в среде TYH для последующих измерений частоты спонтанной акросомальной реакции. Показано, что независимо от капацитации спонтанная акросомальная реакция сперматозоидов самцов Aldh4a1–/– значимо увеличена по сравнению со сперматозоидами самцов WT (рис. 3г, д). Полученные результаты говорят о том, что качество спермы у самцов мышей Aldh4a1–/– ухудшено.
Рис. 3.
Анализ качества спермы у самцов Aldh4a1–/–. а – Окрашивание H&E сперматозоидов в хвосте придатка семенника самцов WT и Aldh4a1–/–, аномальная морфология сперматозоидов указана стрелкой. Масштабная линейка = 50 мкм. б – Соотношение деформированных сперматозоидов в хвосте придатка семенника самцов мышей WT и Aldh4a1–/– (N = 6). в – CASA-анализ сперматозоидов в хвосте придатка семенника самцов WT и Aldh4a1–/– (N = 6). PR ‒ прогрессивная подвижность; NP ‒ непрогрессивная подвижность; IM ‒ иммобилизованные сперматозоиды. г – Окрашивание PNA для детекции спонтанной акросомальной реакции. Сперматозоиды без акросомальной реакции оставались интактными (положительное окрашивание PNA, с зеленой флуоресценцией головки, показано красной стрелкой), а сперматозоиды с акросомальной реакцией показали дефект акросомы (отрицательное окрашивание PNA, без зеленой флуоресценции на головке, показано белой стрелкой). Масштабная линейка = 50 мкм. д – Частота спонтанных акросомальных реакций активированных и неактивных сперматозоидов в каудальном эпидидимисе у самцов мышей WT и Aldh4a1–/– (N = 3).

Аномальная структура жгутиков сперматозоидов у самцов мышей Aldh4a1–/–
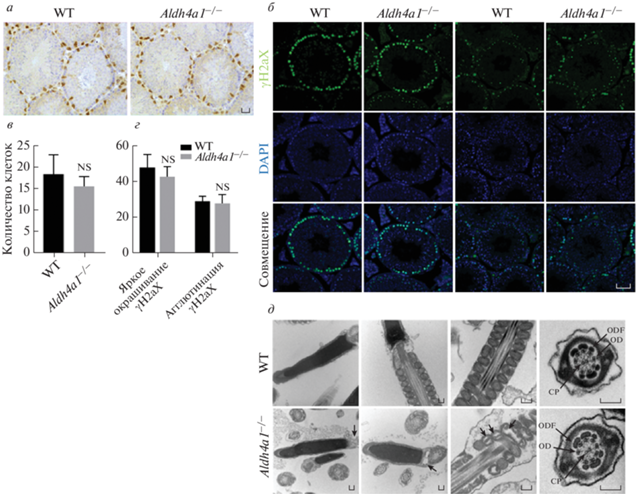
В связи с увеличенным количеством поврежденных сперматозоидов, первым делом, исследовали, является ли нормальным сперматогенез у самцов мышей Aldh4a1–/–. Поскольку клетки Сертоли выстилают семенные канальца и выполняют множество функций в сперматогенезе, провели иммуногистохимический анализ этих клеток. Согласно полученным результатам, по сравнению с самцами WT, у самцов Aldh4a1–/– не выявлено значимых различий в морфологии и количестве клеток Сертоли (рис. 4 а, в). Мейоз является важным процессом в сперматогенезе, и наличие экспрессии γH2aX служит одним из отличительных событий мейоза. Существует два различных типа детекции γH2aX: в одном случае наблюдается яркое окрашивание ядра, а в другом ‒ агглютинация γH2aX. Первый тип появляется в начале сперматогенеза, а второй ‒ перед спермиацией. Анализ двух типов окрашивания γH2aX не выявил их количественных различий у самцов WT и Aldh4a1–/– (рис. 4 б, г). Таким образом, у самцов Aldh4a1–/– обнаружен нормальный сперматогенный эпителий и нормальный сперматогенез.
ALDH4A1 локализуется в матриксе митохондрий и играет важную роль в их функционировании. Проанализировали субклеточную структуру сперматозоидов в хвосте придатка семенника с помощью ТЭМ. По сравнению со сперматозоидами самцов WT, структура акросомы сперматозоидов у самцов Aldh4a1–/– была нормальной (рис. 4 д), но в шейке сперматозоидов самцов Aldh4a1–/– обнаружили трещины и вакуоли (рис. 4 д). Вакуоли присутствовали также во многих митохондриях самцов Aldh4a1–/– (рис. 4 д). Кроме того, в жгутиках сперматозоидов самцов Aldh4a1–/– наблюдали нормальное расположение аксонемы “9 + 2” (рис. 4 д).
Рис. 4.
У самцов Aldh4a1–/– наблюдается нормальный сперматогенез. а – Иммуногистохимия SOX9 парафиновых срезов семенников самцов WT и Aldh4a1–/–. Масштабная линейка = 100 мкм. б – Иммунофлуоресценция парафиновых срезов семенников самцов WT и Aldh4a1–/–, окрашивание γH2aX в сперматогенных канальцах разделено на яркое и агрегационное. Масштабная линейка = 50 мкм. в – Количество клеток Сертоли у самцов Aldh4a1–/– и WT. В каждом случае подсчитывали двадцать сперматогенных канальцев одинакового размера с одинаковым сперматогенным эпителиальным циклом (N = 3). г – Количество сперматогониев у самцов Aldh4a1–/– и WT, определенное с использованием двух типов окрашивания γH2aX. В каждом случае подсчитывали двадцать сперматогенных канальцев одинакового размера и одинакового сперматогенного эпителиального цикла (N = 3). д – Ультраструктура сперматозоидов у самцов WT и Aldh4a1–/–, определенная с помощью ТЭМ. В шейке наблюдали трещины и вакуоли, как показано стрелкой. Морфология акросомы, структура “9 + 2” хвоста и митохондриальная оболочка были нормальными. Масштабная линейка = 1 нм. ODF ‒ наружное плотное волокно; OD ‒ периферические дублеты микротрубочек; CP ‒ центральные микротрубочки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зрелые и здоровые сперматозоиды – основа мужской фертильности. Снижение подвижности, дегенерация и гибель сперматозоидов могут стать причиной мужского бесплодия [23, 24]. Мутация alh-6 гомолога Aldh4a1 у Caenorhabditis elegans может изменять содержание FAD и нарушать гомеостаз митохондрий, что приводит к дисфункции сперматозоидов у самцов нематод и ухудшению репродуктивной способности [6, 10]. Поэтому в представленном исследовании нами впервые использована CRISPR-Cas9 для создания мышиной модели с нокаутом гена Aldh4a1, чтобы изучить влияние ALDH4A1 на мужскую фертильность, сперматогенез и созревание сперматозоидов млекопитающих.
Нокаут Aldh4a1 влияет на созревание сперматозоидов
В нашем исследовании установлено, что самцы мышей Aldh4a1–/– имели нормальную фертильность и сперматогенез, но, по сравнению с самцами мышей WT, созревание сперматозоидов было нарушено, что проявлялось в увеличении числа дефектов их развития, снижении подвижности сперматозоидов и увеличении спонтанных акросомальных реакций. Семейство альдегиддегидрогеназ (ALDH) катализирует превращение ретинола, спиртовой формы витамина А, в ретиноевую кислоту (РК), которая имеет решающее значение для сперматогенеза, и ингибирование экспрессии ALDH приводит к дерегуляции сперматогенеза [25]. ALDH1 ‒ член семейства альдегиддегидрогеназ, который высоко экспрессируется в клетках Сертоли семенников и опосредует образование РК, которая участвует в синтезе тестостерона и способствует сперматогенезу [26]. Аномальный сперматогенез не наблюдали у самцов мышей Aldh4a1–/–, что указывает на то, что ALDH4A1 не играет важную роль в сперматогенезе. Сфероиды, обнаруженные в семенных канальцах семенников 6-месячных самцов мышей Aldh4a1–/–, могут быть вызваны аномальным метаболизмом остаточных телец в сперматогенных канальцах стареющих мышей [27, 28]. Окрашивание H&E среза придатка яичка у самцов мышей Aldh4a1–/– показало, что морфология эпителия придатка семенника была нормальной, что указывает на возможные изменения гомеостаза [29], что, в свою очередь, влияет на функции сперматозоидов. Таким образом, нокаут Aldh4a1 приводит к изменениям в устойчивом состоянии эпидидимиса, что влияет на созревание сперматозоидов.
Дерегуляция митохондриального гомеостаза приводит к нарушению функции сперматозоидов
Aldh4a1 находится в митохондриях, и его мутации могут вызывать гиперпротеинемию II типа [8]. Нокаут Aldh4a1 приводит к нарушению второго этапа катаболизма пролина, а именно превращения P5C в глутаминовую кислоту, что приводит к накоплению P5C, снижению уровня FAD, нарушению гомеостаза АФК и преждевременной репродуктивной недееспособности у самцов [6]. Исследования показали, что экспрессия ALDH4A1 в семенниках самцов и ооцитах самок мышей с возрастом снижается, что предполагает, что ALDH4A1 может быть связан с репродуктивным старением. Значимо увеличенное количество изгибов шейки сперматозоидов у самцов мышей Aldh4a1–/– обусловлено преждевременным репродуктивным старением. Нарушения в субмикроскопической структуре митохондриальной оболочки указывают на то, что нокаут Aldh4a1 может повлиять на митохондриальный гомеостаз, приводящий к окислительному стрессу. Небольшое количество АФК играет положительную роль в капацитации сперматозоидов, акросомальной реакции и т.д. Однако высокий уровень окислительного стресса может вызывать перекисное окисление липидов сперматозоидов и повреждение ДНК, и даже окисление белков и инактивацию ферментов в сперматозоидах, что приводит к бесплодию [30‒32]. Поэтому механизм влияния ALDH4A1 на мужское репродуктивное старение будет направлением наших будущих исследований.
Работа выполнена при финансовой поддержке National Key Research and Developmental Program of China (Grants 2018YFC1003602, 2018YFC1003601).
Все эксперименты с использованием животных одобрены Комитетом по этике Шаньдунского университета (г. Цзинань, Китай) и проведены в строгом соответствии с национальными и местными законами о защите животных.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Fainberg J., Kashanian J. (2019) Recent advances in understanding and managing male infertility. F1000Res. 8, 2 F1000 Faculty Rev-670. https://doi.org/10.12688/f1000research.17076.1
Skoracka K., Eder P., Łykowska-Szuber L., Dobrowolska A., Krela-Kaźmierczak I. (2020) Diet and nutritional factors in male (in) fertility—underestimated factors. J. Clin. Med. 9(5), 1400. https://doi.org/10.3390/jcm9051400
Agarwal A., Baskaran S., Parekh N., Cho C.-L., Henkel R., Vij S., Arafa M., Selvam M.K.P., Shah R. (2021) Male infertility. Lancet. 397(10271), 319‒333. https://doi.org/10.1016/S0140-6736(20)32667-2
Huang C., Li B., Xu K., Liu D., Hu J., Yang Y., Nie H., Fan L., Zhu W. (2017) Decline in semen quality among 30,636 young Chinese men from 2001 to 2015. Fertil. Steril. 107(1), 83‒88. e2. https://doi.org/10.1016/j.fertnstert.2016.09.035
Yoshida A., Rzhetsky A., Hsu L.C., Chang C. (1998) Human aldehyde dehydrogenase gene family. Eur. J. Biochem. 251(3), 549‒557. https://doi.org/10.1046/j.1432-1327.1998.2510549.x
Yen C.A., Curran S.P. (2021) Incomplete proline catabolism drives premature sperm aging. Aging Cell. 20(2), e13308. https://doi.org/10.1111/acel.13308
Jackson B., Brocker C., Thompson D.C., Black W., Vasiliou K., Nebert D.W., Vasiliou V. (2011) Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Hum. Reprod. 5(4), 1‒21. https://doi.org/10.1186/1479-7364-5-4-283
Muzio G., Maggiora M., Paiuzzi E., Oraldi M., Canuto R.A. (2012) Aldehyde dehydrogenases and cell proliferation. Free Radical. Biol. Med. 52(4), 735‒746. https://doi.org/10.1016/j.freeradbiomed.2011.11.033
Marchitti S.A., Brocker C., Stagos D., Vasiliou V. (2008) Non-P450 aldehyde oxidizing enzymes: the aldehyde dehydrogenase superfamily. Expert. Opin. Drug. Metab. Toxicol. 4(6), 697‒720. https://doi.org/10.1517/17425255.4.6.697
Yen C.-A., Ruter D.L., Turner C.D., Pang S., Curran S.P. (2020) Loss of flavin adenine dinucleotide (FAD) impairs sperm function and male reproductive advantage in C. elegans. Elife. 9, e52899. https://doi.org/10.7554/eLife.52899
Xu K., Yang L., Zhang L., Qi H. (2020) Lack of AKAP3 disrupts integrity of the subcellular structure and proteome of mouse sperm and causes male sterility. Development. 147(2), dev181057. https://doi.org/10.1242/dev.181057
Lehti M.S., Sironen A. (2017) Formation and function of sperm tail structures in association with sperm motility defects. Biol. Reprod. 97(4), 522‒536. https://doi.org/10.1093/biolre/iox096
Amaral A., Lourenço B., Marques M., Ramalho-Santos J. (2013) Mitochondria functionality and sperm quality. Reproduction. 146(5), R163‒R174. https://doi.org/10.1530/REP-13-0178
de Kretser D.M., Loveland K.L., Meinhardt A., Simorangkir D., Wreford N. (1998) Spermatogenesis. Hum. Genomics 13(suppl. 1), 1‒8. https://doi.org/10.1093/humrep/13.suppl_1.1
Neto F.T.L., Bach P.V., Najari B.B., Li P.S., Goldstein M. (2016) Spermatogenesis in humans and its affecting factors. Semin. Cell Dev. Biol. 59, 10‒26. https://doi.org/10.1016/j.semcdb.2016.04.009
Rinaldi V.D., Donnard E., Gellatly K., Rasmussen M., Kucukural A., Yukselen O., Garber M., Sharma U., Rando O.J. (2020) An atlas of cell types in the mouse epididymis and vas deferens. Elife. 9, e55474. https://doi.org/10.7554/eLife.55474
Sullivan R., Mieusset R. (2016) The human epididymis: its function in sperm maturation. Hum. Reprod. Update. 22(5), 574‒587. https://doi.org/10.1093/humupd/dmw015
Sullivan R., Legare C., Lamontagne-Proulx J., Breton S., Soulet D. (2019) Revisiting structure/functions of the human epididymis. Andrology. 7(5), 748‒757. https://doi.org/10.1111/andr.12633
Cornwall G.A. (2009) New insights into epididymal biology and function. Hum. Reprod. Update. 15(2), 213‒227. https://doi.org/10.1093/humupd/dmn055
Turner T.T., Johnston D.S., Finger J.N., Jelinsky S.A. (2007) Differential gene expression among the proximal segments of the rat epididymis is lost after efferent duct ligation. Biol. Reprod. 77(1), 165‒171. https://doi.org/10.1095/biolreprod.106.059493
Dacheux J.-L., Dacheux F. (2014) New insights into epididymal function in relation to sperm maturation. Reproduction. 147(2), R27‒R42. https://doi.org/10.1530/REP-13-0420
Henao-Mejia J., Williams A., Rongvaux A., Stein J., Hughes C., Flavell R.A. (2016) Generation of genetically modified mice using the CRISPR–Cas9 genome-editing system. Cold Spring Harbor Protoc. 2016(2), pdb. prot090704. https://doi.org/10.1101/pdb.prot090704
Cedikova M., Miklikova M., Grundmanova,M., Zech N., Králíčková M., Kuncova J. (2014) Sperm mitochondrial function in men with normozoospermia and asthenozoospermia. Ceska Gynaecol. 79(1), 22‒28.
Wilton L.J., Temple-Smith P.D., Baker H.G., de Kretser D.M. (1988) Human male infertility caused by degeneration and death of sperm in the epididymis. Fertil. Steril. 49(6), 1052‒1058. https://doi.org/10.1016/S0015-0282(16)59960-9
Kent T., Arnold S.L., Fasnacht R., Rowsey R., Mit-chell D., Hogarth C.A., Isoherranen N., Griswold M.D. (2016) ALDH enzyme expression is independent of the spermatogenic cycle, and their inhibition causes misregulation of murine spermatogenic processes. Biol. Reprod. 94(1), 12, 1‒13. https://doi.org/10.1095/biolreprod.115.131458
López-Fernández L.A., del Mazo J. (1997) The cytosolic aldehyde dehydrogenase gene (Aldh1) is developmentally expressed in Leydig cells. FEBS Lett. 407(2), 225‒229. https://doi.org/10.1016/S0014-5793(97)00352-9
Xiao C.Y., Wang Y.Q., Li J.H., Tang G.C., Xiao S.S. (2017) Transformation, migration and outcome of residual bodies in the seminiferous tubules of the rat testis. Andrologia. 49(10), e12786. https://doi.org/10.1111/and.12786
Paniagua R., Nistal M., Amat P., Rodriguez M.C., Martin A. (1987) Seminiferous tubule involution in elderly men. Biol. Reprod. 36(4), 939‒947. https://doi.org/10.1095/biolreprod36.4.939
Hinton B.T., Palladino M.A. (1995) Epididymal epithelium: its contribution to the formation of a luminal fluid microenvironment. Microsc. Res. Tech. 30(1), 67‒81. https://doi.org/10.1002/jemt.1070300106
Barati E., Nikzad H., Karimian M. (2020) Oxidative stress and male infertility: current knowledge of pathophysiology and role of antioxidant therapy in disease management. Cell. Mol. Life Sci. 77(1), 93‒113. https://doi.org/10.1007/s00018-019-03253-8
Bisht S., Faiq M., Tolahunase M., Dada R. (2017) Oxidative stress and male infertility. Nat. Rev. Urol. 14(8), 470‒485. https://doi.org/10.1038/nrurol.2017.69
Menezo Y.J., Silvestris E., Dale B., Elder K. (2016) Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction. Reprod. BioMed. Online 33(6), 668‒683. https://doi.org/10.1016/j.rbmo.2016.09.006
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


