Молекулярная биология, 2022, T. 56, № 6, стр. 1086-1094
Transwell-моделирование гематоэнцефалического барьера
А. В. Петровская a, Е. П. Барыкин a, А. М. Тверской a, К. Б. Варшавская a, В. А. Митькевич a, И. Ю. Петрушанко a, А. А. Макаров a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: aamakarov@eimb.ru
Поступила в редакцию 13.05.2022
После доработки 20.06.2022
Принята к публикации 29.06.2022
- EDN: URHPBS
- DOI: 10.31857/S0026898422060179
Аннотация
In vitro моделирование гематоэнцефалического барьера (ГЭБ) при помощи клеток эндотелия мозга, выращиваемых на transwell-мембране, широко применяется при изучении нарушений ГЭБ и факторов, призванных нивелировать эти нарушения. Эндотелиальные клетки, благодаря белкам плотных контактов, обеспечивают избирательную проницаемость для ряда веществ. Низкая по сравнению с физиологической интегральность (т.е. высокая проницаемость) модели ГЭБ осложняет оценку эффектов, получаемых при воздействии на него различными агентами, поэтому крайне важен подбор условий, оптимальных для повышения интегральности барьера. В качестве основы transwell-моделирования мы использовали эндотелиальные клетки мозга мыши bEnd.3. Для установления факторов, усиливающих интегральность ГЭБ, оценивали влияние среды культивирования, числа клеток при высеве, состояния transwell-мембраны, культивирование в присутствии и в отсутствие первичных нейронов мыши и матригеля в качестве матрикса на прохождение флуоресцентной метки через клеточный монослой. Иммуноцитохимическим методом анализировали влияние эмбриональной телячьей сыворотки на белок плотных контактов клаудин-5. Полученные данные о параметрах культивирования вносят вклад в решение проблемы низкой интегральности transwell-модели ГЭБ и приближают модель к физиологически релевантным показателям.
ВВЕДЕНИЕ
In vitro моделирование гематоэнцефалического барьера (ГЭБ) важно как с фундаментальной точки зрения – для изучения структуры и функции плотных контактов и влияния различных физиологических факторов на проницаемость, так и с прикладной – с целью анализа возможности прохождения лекарственных препаратов через ГЭБ, а также моделирования нарушений ГЭБ при сахарном диабете, рассеянном склерозе, болезни Альцгеймера и других заболеваниях.
Несмотря на то, что ГЭБ – это многокомпонентная структура, состоящая в основном из эндотелиальных клеток, астроцитов, перицитов и нейронов, ее ключевым элементом являются эндотелиальные клетки, вернее, белки плотных контактов, соединяющие клетки в монослое, отвечающие за его барьерные свойства и контролирующие поступление токсичных веществ из кровотока в мозг [1, 2]. In vitro эксперименты проводят как на однокомпонентной модели (монослой эндотелиальных клеток), так и на двухкомпонентной и многокомпонентной моделях [3, 4].
В качестве основы для in vitro моделирования ГЭБ часто используется клеточная transwell-модель, представляющая собой мембрану-вставку с монослоем эндотелиальных клеток в культуральной среде, погруженную в лунку планшета [4, 5]. Мембрана-вставка с эндотелиальными клетками (верхний компартмент модели) имитирует сосудистое русло, а лунка планшета (нижний компартмент модели) – остальные компоненты нейроваскулярной единицы. При этом эндотелиальные клетки поляризованы, поэтому верхний и нижний компартменты не идентичны.
В ряде работ приведены результаты исследований, направленных на оптимизацию клеточного состава модели [4, 6] и усиление интегральных свойств модели за счет добавления различных факторов [7, 8]. Для установления оптимальных условий in vitro моделирования ГЭБ на transwell-мембране мы выбрали эндотелиальные клетки bEnd.3 мозга мыши, применяемые для in vitro моделирования ГЭБ [9–12]. Клеточная культура bEnd.3 имеет ряд недостатков при моделировании ГЭБ по сравнению с первичной культурой эндотелиальных клеток, включая низкое трансэндотелиальное электрическое сопротивление и более низкий уровень некоторых белков плотных контактов [13]. При этом уровень этих белков в клетках bEnd.3 достаточен для оценки влияния разных агентов на функциональные свойства клеток [14, 15].
К основным методам функционального анализа клеточного монослоя относятся оценка прохождения флуоресцентной метки через transwell-мембрану и измерение трансэндотелиального сопротивления [16]. Мы выбрали первый способ, основанный на проницаемости эндотелия для флуоресцентной метки и сравнили применимость двух флуоресцентных меток – Na-флуоресцеина и FITC-декстрана – для оценки интегральности ГЭБ. Поскольку в физиологических условиях эндотелиальные клетки формируют плотный монослой, именно параметры рассева клеток и продолжительность их культивирования являются ключевыми для степени интегральности модели – ее основного свойства. С другой стороны, смена культуральной среды и применение эмбриональной телячьей сыворотки (FBS) также может оказывать влияние на состояние клеток. Так, например, условия культивирования bEnd.3 обычно предусматривают использование среды DMEM с FBS (10%), однако эксперименты по моделированию нарушений ГЭБ при болезни Альцгеймера проводят в среде Opti-MEM, позволяющей сократить концентрацию сыворотки [14, 15]. Поскольку ранее показали, что культивирование эндотелиальных клеток в присутствии нейронов и других клеток – элементов нейроваскулярной единицы [4], приводит к улучшению свойств модели, проницаемость модели оценили как в присутствии нейронов, так и в их отсутствие. Для улучшения интегральных свойств важны также вещества, покрывающие мембрану, поэтому проанализировали культивирование клеток на матригеле.
Получены данные по влиянию плотности рассева клеток bEnd.3, культуральной среды, матрикса и культивирования клеток эндотелия c нейронами на проницаемость transwell-модели ГЭБ, определено также влияние FBS на экспрессию белка плотных контактов клаудина-5. Полученные результаты позволили предложить оптимальные условия, обеспечивающие наиболее релевантное использование данной модели.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток. Клетки эндотелия мозга мыши bEnd.3 культивировали в среде DMEM (“Gibco”, США), содержащей 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (PenStrep; “Gibco”), 1% GlutaMax (“Gibco”), 10% FBS (“Gibco”) в инкубаторе при 37°C и 5% CO2. Клетки снимали с подложки при помощи TrypLE (“Thermo Fisher”, США). Среду для культивирования заменяли при пересадке клеток, когда конфлюентность достигала ~80–85%. Все эксперименты проводили на клетках между 7 и 15 пассажами.
Нейроны выделяли из префронтальной коры 12 эмбрионов мыши возраста Е18 по протоколу Pruszak J. и соавт. [17]. Нейроны культивировали в среде Neurobasal (“Gibco”), содержащей 2% B-27 (“Gibco”), 0.5 мМ L-глутамин (“Gibco”), фактор роста нервов (100 нг/мл) (“Sigma-Aldrich”, США), фактор роста фибробластов (10 нг/мл) (“Sigma-Aldrich”), гентамицин (“Gibco”) в соотношении 1 : 100.
Проведение экспериментов на культурах клеток. Для определения влияния культуральной среды на свойства модели среду в апикальном компартменте transwell заменяли на среду DMEM или Opti-MEM, содержащую PenStrep, 1% GlutaMax. В transwell-вставки с DMEM через 4 ч добавляли FBS до 10%, а в transwell-вставки с Opti-MEM через 6 ч вносили FBS до 2.5%.
Для анализа проницаемости модели в присутствии нейронов клетки высевали в базолатеральный компартмент. Эксперимент проводили на 14-й день после высева.
Культивирование клеток на матригеле. Матригель (“Corning”, США) разводили согласно протоколу производителя. Transwell-мембраны (“Corning”) покрывали матригелем с люминальной стороны в соответствии с протоколом, опубликованным в работе [18].
Культивирование клеток на transwell-мембране. Стандартными условиями культивирования клеток на transwell-мембране были: 1) объем среды в наружном (базолатеральном) компартменте 12-луночного планшета 1200 мкл, 24-луночного планшета – 500 мкл; 2) объем среды во внутреннем (апикальном) компартменте – 650 мкл в 12-луночном планшете и 300 мкл в 24-луночном; 3) время культивирования перед экспериментом – 5–6 дней; 4) количество клеток при высеве на transwell-мембрану 12-луночного планшета – 50 ×103 на лунку, если не указано иное.
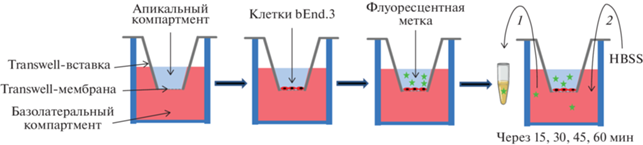
Оценка проницаемости модели ГЭБ. Проницаемость модели на transwell-мембране оценивали по аналогии с существующими протоколами (рис. 1) [8, 19–21]. Использовали флуоресцентные метки Na-флуоресцеин (376.27 г/моль; “Sigma-Aldrich”) и FITC-декстран (70 000 г/моль; “Sigma-Aldrich”). Na-флуоресцеин брали в концентрации 10 мкг/мл (26.58 мкМ), FITC-декстран – 100 мкг/мл (1.43 мкМ) [13, 20, 22]. Пробы отбирали через 15, 30, 45, 60 мин после добавления флуоресцентной метки. В нижний компартмент каждый раз добавляли отобранный ранее объем солей Хэнкса (V; “Gibco”). Интенсивность флуоресценции измеряли в канале FITC на планшетном ридере SPARK (“Tecan”, Швейцария) при возбуждении на длине волны 485 нм и регистрации флуоресценции на длине волны 535 нм, z-position 16 000. В анализе проницаемости учитывали разведение в нижнем компартменте лунки с transwell-вставкой следующим образом:
Рис. 1.
Схема проведения эксперимента с transwell-мембраной. Клетки bEnd.3 эндотелия мозга мыши высаживали в разных количествах на transwell-мембрану и растили до достижения монослоя. Для оценки проницаемости клеток bEnd.3 на transwell-мембране заменяли культуральную среду на раствор солей Хэнкса (HBSS), затем в апикальный компартмент добавляли флуоресцентные метки Na-флуоресцеин или FITC-декстран (флуоресцеинизотиоцианатдекстран). Через 15, 30, 45 и 60 мин из базолатерального компартмента отбирали часть раствора, которую анализировали с помощью флуоресцентного планшетного ридера. В базолатеральный компартмент добавляли соли Хэнкса в объеме, равном отобранному. В этой модели апикальный компартмент имитирует сосудистое русло, базолатеральный – паренхиму мозга.
Иммуноцитохимический анализ экспрессии клаудина-5 в присутствии и в отсутствие FBS. Клетки bEnd.3 высевали в 35-мм Glass Bottom Petri Dish (стекло 12 мм) по 50 × 103 клеток на чашку и растили в течение 2 дней. После достижения монослоя среду в чашках заменяли на DMEM, содержащую 10% FBS, либо DMEM без FBS и культивировали в течение еще 2 дней. Клетки промывали дважды PBS, фиксировали в растворе холодного метанола в течение 15 мин, затем дважды отмывали холодным PBS. Для предотвращения неспецифического связывания антител клетки инкубировали в растворе TBST (50 мМ Трис-HCl (pH 7.4), 150 мМ NaCl, 0.1% Tween-20), содержащем 1% BSA (“Панэко”, Россия), 22.52 мг/мл глицина (“Sigma-Aldrich”) при комнатной температуре в течение 1 ч. Далее клетки инкубировали с моноклональными антителами кролика против клаудина-5 (1 : 500, ab131259, “Abcam”, Великобритания) в течение ночи при +4°С. После отмывки от первичных антител в PBS клетки инкубировали с вторичными антителами козы к иммуноглобулинам кролика, конъюгированными с Alexa Fluor 488 (1 : 1000, 33 342, “Invitrogen”, США), в течение 60 мин при комнатной температуре в темноте. Клетки промывали трижды в PBS, ядра окрашивали Hoechst (33 342, “Invitrogen”) в течение 15 мин при комнатной температуре в темноте. После промывки PBS флуоресценцию визуализировали с помощью микроскопа Leica DMI 8 с использованием светофильтров FITCbp для регистрации флуоресценции FITC и DAPI/TL – для регистрации флуоресценции Hoechst при увеличении ×200. Среднюю интенсивность флуоресценции на снимках оценивали с помощью EMBL ImageJ (Германия).
Оценка морфологических параметров клеток. Клетки высевали в лунки 24-луночного планшета в плотности, соответствующей высеву 25 × 103, 50 × 103 и 100 × 103 клеток на transwell-мембрану 24-луночного планшета, т.е. 22.3 × 103, 44.6 × 103 и 89.2 × 103 клеток на 1 см2 соответственно. Для оценки морфологии проводили съемку клеток в режиме фазового контраста при увеличении ×100 на микроскопе Leica DMIL LED (США).
Статистическая обработка. Рассчитывали среднеарифметические значения и стандартные отклонения. Статистическую обработку осуществляли с использованием программы GraphPad Prism Software 9.1 (“GraphPad Software Inc.”, США) и однофакторного дисперсионного анализа (One-way ANOVA) с применением критерия Тьюки для множественных сравнений, а также t-критерия Стьюдента. Различия считали статистически значимыми при p <0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор протокола культивирования эндотелиальных клеток на transwell-мембране исключительно важен для оценки проницаемости модели ГЭБ. Схема эксперимента по оценке проницаемости приведена на рис. 1. Установлено, что культивирование клеток bEnd.3 в среде DMEM с FBS в концентрации 10% в отличие от культивирования в Opti-MEM с 2.5% FBS способствует интегральности ГЭБ (рис. 2а, б). Поэтому большинство последующих экспериментов проводили в среде DMEM.
Рис. 2.
Параметры, влияющие на интегральность модели ГЭБ, основанной на линии эндотелиальных клеток bEnd.3. а – Проницаемость однокомпонентной модели для Na-флуоресцеина после 7 дней культивирования на transwell-мембране в присутствии или в отсутствие матригеля и клеток bEnd.3. Среда культивирования Opti-MEM с 2.5% FBS. б – Проницаемость однокомпонентной модели на основе bEnd.3, культивируемых в среде DMEM с 10% FBS. в – Фазово-контрастная микроскопия клеток bEnd.3 в первые сутки после высева на лунку 24-луночного планшета (1) и лунку 24-луночного планшета, покрытого матригелем (2). Увеличение ×10. г – Проницаемость модели при высеве клеток bEnd.3 в количестве 100 × 103 и 150 ×103 на мембрану 12-луночного планшета в присутствии и в отсутствие нейронов. а и б – Приведены средние арифметические значения и стандартное отклонения, n = 9. Использовали однофакторный дисперсионный анализ (One-way ANOVA) с применением критерия Тьюки для множественных сравнений (а) и t-критерия Стьюдента (б) для определения значения p. *p < 0.05, ***p < 0.001, ns – статистическая значимость отсутствует.
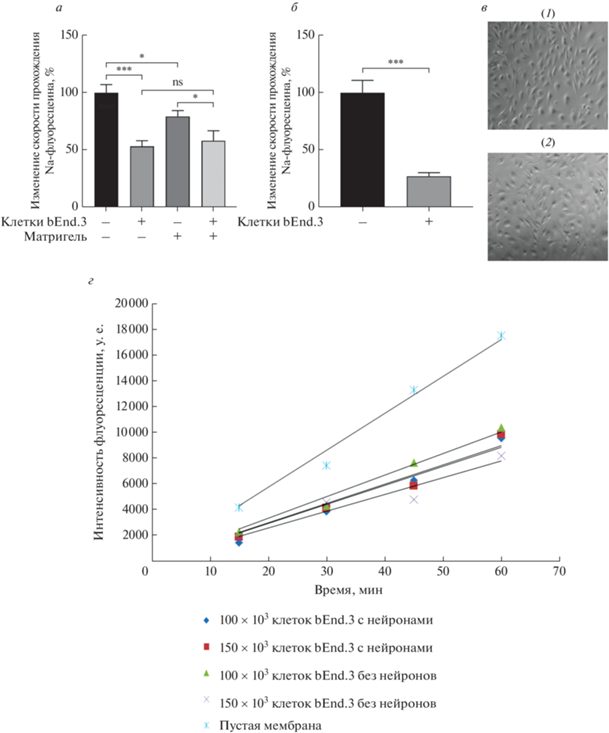
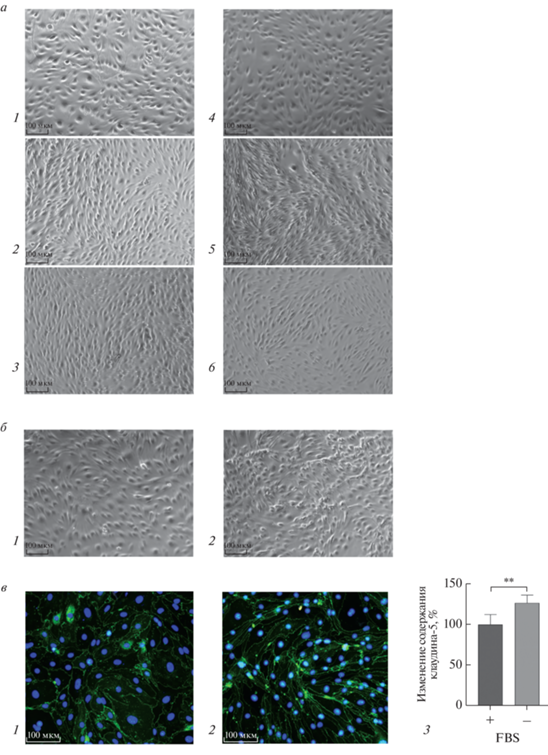
Матригель успешно используется в качестве матрикса для культивирования клеток, в том числе эндотелиальных, для моделирования ангиогенеза. Проницаемость transwell-мембраны с матригелем статистически значимо отличается от проницаемости мембраны, не покрытой матригелем: матригель снижает проницаемость пустой мембраны (рис. 2а), тогда как проницаемость мембраны с клетками bEnd.3 в присутствии и в отсутствие матригеля статистически не отличается (рис. 2а). Культивирование на trasnswell-мембране не позволяет точно оценить конфлюентность клеток, поэтому параллельно с высевом на transwell-мембрану оценивали влияние матригеля на пролиферацию клеток. По данным фазово-контрастной микроскопии эндотелиальные клетки при длительном культивировании приобретают нитеподобный фенотип и распределяются по поверхности матригеля более гетерогенно, чем при культивировании без матригеля (рис. 3а, б). Характер распределения клеток bEnd.3 через день после высева на матригель отличается от их распределения на пластике, не покрытом матригелем (рис. 3в). Согласно визуальной оценке, оптимальные значения высева на мембрану без матригеля соответствуют 50 × 103 клеток на transwell-мембране 12-луночного планшета (рис. 3а, б). Таким образом, матригель не относится к компонентам, необходимым для культививирования bEnd.3 на transwell-мембране с целью оценки проницаемости ГЭБ.
Рис. 3.
Влияние матригеля и сыворотки на морфологию bEnd.3 и экспрессию белка плотных контактов клаудина-5. а – Клетки, высеянные в количестве, соответствующем 25 × 103 (1, 4), 50 × 103 (2, 5), 100 × 103 (3, 6), на transwell-вставку 12-луночного планшета на 4-е сутки, где 1, 2, 3 – высев на мембрану, не покрытую матригелем; 4, 5, 6 – на мембрану, покрытую матригелем. б – Клетки, высеянные в количестве 50 × 103 (1, 2) на transwell-вставку 12-луночного планшета, не покрытого (1) и покрытого (2) матригелем, на 8-е сутки. а и б – Фазово-контрастная микроскопия, увеличение ×10, шкала – 100 мкм. в – Флуоресцентная микроскопия клеток, культивируемых c FBS (1) и без FBS (2) после 48 ч инкубации; изменение содержания клаудина-5 (3). Зеленая флуоресценция – окрашивание антителами на клаудин-5, голубая флуореценция – ядра клеток, окрашенные Hoechst. Увеличение ×200, шкала – 100 мкм. Среднюю флуоресценцию клаудина-5 на снимках рассчитывали с помощью программы EMBL ImageJ. На рис. в (3) приведены средние арифметические значения и стандартные отклонения, n = 9. Использовали t-критерий Стьюдента для определения значения p. **p < 0.01.
Нейрональные клетки могут улучшать свойства модели ГЭБ [4], однако нами не выявлено значимых изменений в проницаемости (или интегральности) при культивировании эндотелиальных клеток bEnd.3 с первичными нейронами мыши (рис. 2г). Полученные данные показывают, что нейрональные клетки не улучшают барьерных характеристик клеток bEnd.3.
Далее мы оценили влияние сыворотки на экспрессию клаудина-5, отвечающего за барьерную функцию клеток. Результаты, полученные при окрашивании антителами к клаудину-5, показывают, что уже на 2-й день культивирования морфология клеток bEnd.3, растущих без FBS, отличается от морфологии клеток, культивируемых в присутствии FBS, т.е. в стандартных условиях (рис. 3в). Клетки, растущие на среде без сыворотки, имеют более вытянутую форму, сходную с наблюдаемой при высеве на мембрану с матригелем. При этом при культивировании без FBS, в отличие от культивирования с сывороткой, не наблюдается неравномерности в распределении клеток. Кроме того, в клетках, культивируемых без FBS, уровень флуоресцентного сигнала от клаудина-5 повышается на 26% (рис. 3в), что может говорить о более высоком уровне экспрессии этого белка в отсутствие сыворотки. Обнаружена также тенденция к увеличению числа клеток при культивировании без сыворотки. Таким образом, для моделирования ГЭБ клетки bEnd.3 лучше культивировать без сыворотки.
Чтобы оценить возможность повторного использования transwell-вставок в модели на основе bEnd.3, мы проанализировали прохождение флуоресцентной метки (Na-флуоресцеин, 10 мкг/мл) через очищенную мембрану без клеток и с монослоем клеток bEnd.3. Эти параметры сопоставили с параметрами новой transwell-мембраны с клетками bEnd.3 и без них. Мембраны, использованные ранее, перед повторным использованием обрабатывали 2 раза TrypLE (каждый раз не менее 2 ч), затем промывали 2 раза деионизированной водой (Milli-Q, “Millipore”, США) и PBS. Очевидно, что transwell-вставки можно использовать повторно: не выявлено различий в прохождении метки через пустую повторно используемую и пустую новую мембрану (рис. 4а). Не отличается также прохождение метки через новую и повторно используемую мембрану с клетками bEnd.3 (рис. 4а). Таким образом, применение традиционного способа снятия клеток с мембраны с помощью TrypLE достаточно для повторного использования transwell-мембраны.
Рис. 4.
Проницаемость модели ГЭБ, основанной на клеточной культуре bEnd.3, в зависимости от состояния transwell-мембраны и типа флуоресцентной метки. а – Проницаемость повторно используемых transwell-мембран 12-луночного планшета (пустых и с клетками bEnd.3) и новых transwell-мембран с монослоем клеток bEnd.3 и без клеток. б, в – Проницаемость однокомпонентной transwell-модели ГЭБ на основе bEnd.3 для Na-флуоресцеина (10 мкг/мл) (б) и FITC-декстрана (100 мкг/мл) (в). Приведены средние арифметические значения и стандартные отклонения, n = 9. Использовали однофакторный дисперсионный анализ (One-way ANOVA) с применением критерия Тьюки для множественных сравнений и определения значения p. **p < 0.01, ***p < 0.001, ns – отсутствует статистическая значимость.
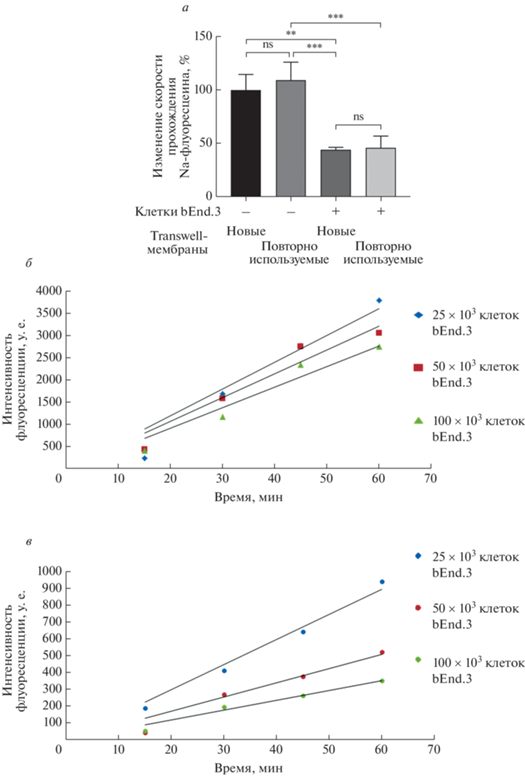
Выбор флуоресцентной метки важен для регистрации барьерной функции. Сравнение прохождения двух флуоресцентных меток (Na-флуоресцеина и FITC-декстрана) через transwell-мембрану показало, что проницаемость барьера для FITC-декстрана лучше коррелирует с плотностью монослоя, т.е. при увеличении количества клеток на transwell-мембране прохождение FITC-декстрана снижается сильнее, чем Na-флуоресцеина (рис. 4б, в).
Не менее важен вопрос о соответствии параметров in vitro модели параметрам in vivo. Так, электрическое сопротивление ГЭБ в паренхиме мозга составляет около 8000 Ом/см2 [23], тогда как проницаемость модели на основе bEnd.3 на 3 сутки после высева составляет 37.3 ± 3.1 Ом/см2 [24] и далее существенно не увеличивается (около 40 Ом/см2 на 7-й день). Все это приводит к значимости усовершенствования модели и подбора условий, начиная с базовых особенностей культивирования и выбора клеточной культуры и заканчивая изменением параметров анализа.
В нашей работе выявлен ряд параметров для моделирования ГЭБ in vitro. Наилучшими условиями для оценки проницаемости ГЭБ с использованием клеток bEnd.3 в качестве модели являются: культивирование клеток на среде DMEM, не менее (50–100) × 103 клеток на transwell-мембрану 12-луночного планшета и культивирование в течение пяти и более дней в отсутствие матригеля. Для повышения конфлюентности клеток и увеличения уровня белков плотных контактов предпочтительнее культивировать клетки без FBS.
Исследование поддержано Министерством науки и высшего образования Российской Федерации (Контракт в системе электронный бюджет № 075-15-2020-795, Соглашение № 13.1902.21.0027 от 29.09.2020, ID проекта: RF-190220X0027).
В работе соблюдены все применимые международные, национальные и/или институциональные принципы ухода и использования животных.
Конфликт интересов не заявляется.
Список литературы
Sweeney M.D., Zhao Z., Montagne A., Nelson A.R., Zlokovic B.V. (2019) Blood–brain barrier: from physiology to disease and back. Physiol. Rev. 99, 21–78.
Abbott N.J., Patabendige A.A.K., Dolman D.E.M., Yusof S.R., Begley D.J. (2010) Structure and function of the blood-brain barrier. Neurobiol. Dis. 37, 13–25.
Zheng Y.-F. Zhou X., Chang D., Bhuyan D.J., Zhang J.P., Yu W.Z., Jiang X.S., Seto S.W., Yeon S.Y., Li J., Li C.G. (2021) A novel tri-culture model for neuroinflammation. J. Neurochem. 156, 249–261.
Stone N.L., England T.J., O’Sullivan S.E. (2019) A novel transwell blood brain barrier model using primary human cells. Front. Cell. Neurosci. 13, 230.
Hatherell K., Couraud P.-O., Romero I.A., Weksler B., Pilkington G.J. (2011) Development of a three-dimensional, all-human in vitro model of the blood-brain barrier using mono-, co-, and tri-cultivation Transwell models. J. Neurosci. Meth. 199, 223–229.
Ito R. Umehara K., Suzuki S, Kitamura K., Nunoya K., Yamaura Y., Imawaka H., Izumi S., Wakayama N., Komori T., Anzai N., Akita H., Furihata T. (2019) A human immortalized cell-based blood–brain barrier triculture model: development and characterization as a promising tool for drug−brain permeability studies. Mol. Pharm. 16, 4461–4471.
Furihata T., Kawamatsu S., Ito R., Saito K., Suzuki S., Kishida S., Saito Y., Kamiichi A., Chiba K. (2015) Hydrocortisone enhances the barrier properties of HBMEC/ciβ, a brain microvascular endothelial cell line, through mesenchymal-to-endothelial transition-like effects. Fluids Barriers CNS. 12, 7.
Dohgu S., Sumi N., Nishioku T., Takata F., Watanabe T., Naito M., Shuto H., Yamauchi A., Kataoka Y. (2010) Cyclosporin A induces hyperpermeability of the blood-brain barrier by inhibiting autocrine adrenomedullin-mediated up-regulation of endothelial barrier function. Eur. J. Pharmacol. 644, 5–9.
Yue Q., Zhou X., Zhang Z., Hoi M.P.M. (2022) Murine beta-amyloid (1–42) oligomers disrupt endothelial barrier integrity and VEGFR signaling via activating astrocytes to release deleterious soluble factors. Int. J. Mol. Sci. 23, 1878.
Park J., Baik S.H., Han S.H., Cho H.J., Choi H., Kim H.J., Choi H., Lee W., Kim D.K., Mook-Jung I. (2017) Annexin A1 restores Aβ1–42-induced blood–brain barrier disruption through the inhibition of RhoA-ROCK signaling pathway. Aging Cell. 16, 149–161.
Sekhar G.N., Georgian A.R., Sanderson L., Vizcay-Barrena G., Brown R.C., Muresan P., Fleck R.A., Thomas S.A. (2017) Organic cation transporter 1 (OCT1) is involved in pentamidine transport at the human and mouse blood-brain barrier (BBB). PLoS One. 12, e0173474.
Qie X., Wen D., Guo H., Xu G., Liu S., Shen Q., Liu Y., Zhang W., Cong B., Ma C. (2017) Endoplasmic reticulum stress mediates methamphetamine-induced blood–brain barrier damage. Front. Pharmacol. 8, 639.
Puscas I., Bernard-Patrzynski F., Jutras M., Lécuyer M.-A., Bourbonnière L., Prat A., Leclair G., Roullin V.G. (2019) IVIVC assessment of two mouse brain endothelial cell models for drug screening. Pharmaceutics. 11, 587.
Chen W., Chan Y., Wan W., Li Y., Zhang C. (2018) Aβ1–42 induces cell damage via RAGE-dependent endoplasmic reticulum stress in bEnd.3 cells. Exp. Cell Res. 362, 83–89.
Chan Y., Chen W., Wan W., Chen Y., Li Y., Zhang C. (2018) Aβ1–42 oligomer induces alteration of tight junction scaffold proteins via RAGE-mediated autophagy in bEnd.3 cells. Exp. Cell Res. 369, 266–274.
Czupalla C.J., Liebner S., Devraj K. (2014) In vitro models of the blood–brain barrier. In: Cerebral angiogenesis: Methods and Protocols. Ed. Milner R. New York: Springer, 415–437.
Pruszak J., Just L., Isacson O., Nikkhah G. (2009) Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. Ch. 2, Unit 2D.5.
Li G., Simon M.J., Cancel L.M., Shi Z.-D., Ji X., Tarbell J.M., Morrison B., Fu B.M. (2010) Permeability of endothelial and astrocyte cocultures: in vitro blood–brain barrier models for drug delivery studies. Ann. Biomed. Eng. 38, 2499–2511.
Mertsch K., Blasig I., Grune T. (2001) 4-Hydroxynonenal impairs the permeability of an in vitro rat blood–brain barrier. Neurosci. Lett. 314, 135–138.
Wan W., Cao L., Liu L., Zhang C., Kalionis B., Tai X., Li Y., Xia S. (2015) Aβ(1–42) oligomer-induced leakage in an in vitro blood–brain barrier model is associated with up-regulation of RAGE and metalloproteinases, and down-regulation of tight junction scaffold proteins. J. Neurochem. 134, 382–393.
Al Ahmad A., Gassmann M., Ogunshola O.O. (2009) Maintaining blood-brain barrier integrity: pericytes perform better than astrocytes during prolonged oxygen deprivation. J. Cell. Physiol. 218, 612–622.
Kook S.-Y., Hong H.S., Moon M., Ha C.M., Chang S., Mook-Jung I. (2012) Aβ1−42-RAGE interaction disrupts tight junctions of the blood–brain barrier via Ca2+-calcineurin signaling. J. Neurosci. Off. J. Soc. Neurosci. 32, 8845–8854.
Smith Q.R., Rapoport S.I. (1986) Cerebrovascular permeability coefficients to sodium, potassium, and chloride. J. Neurochem. 46, 1732–1742.
He F., Yin F., Peng J., Li K.-Z., Wu L.-W., Deng X.-L. (2010) Immortalized mouse brain endothelial cell line Bend.3 displays the comparative barrier characteristics as the primary brain microvascular endothelial cells. Zhongguo Dang Dai Er Ke Za Zhi. J. Contemp. Pediatr. 12, 474–478.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


