Российские нанотехнологии, 2020, T. 15, № 2, стр. 244-251
ВЛИЯНИЕ МНОГОСТЕННЫХ УГЛЕРОДНЫХ НАНОТРУБОК НА ПОВЕДЕНЧЕСКИЕ ФУНКЦИИ МЛЕКОПИТАЮЩИХ ПРИ ИХ ОДНОКРАТНОМ ИНТРАФАРИНГЕАЛЬНОМ И ВНУТРИВЕННОМ ВВЕДЕНИИ
А. А. Анциферова 1, 2, *, Г. А. Тимербулатова 3, 4, Г. Ф. Габидинова 3, Д. О. Никитин 3, А. М. Димиев 5, Ш. Ф. Галялтдинов 5, А. В. Вершинин 6, П. К. Кашкаров 1, 2, 7, Л. М. Фатхутдинова 3
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Московский физико-технический институт (национальный исследовательский университет)
Долгопрудный, Россия
3 Казанский государственный медицинский университет
Казань, Россия
4 Центр гигиены и эпидемиологии в Республике Татарстан (Татарстан)
Казань, Россия
5 Казанский (Приволжский) федеральный университет
Казань, Россия
6 Центральная клиническая больница восстановительного лечения
Федерального медико-биологического агенства России
Голубое, Россия
7 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: antsiferova_aa@nrcki.ru
Поступила в редакцию 16.06.2020
После доработки 22.06.2020
Принята к публикации 22.06.2020
Аннотация
Оценка токсического действия многостенных углеродных нанотрубок (УНТ) на млекопитающих является важной задачей в связи с их распространенностью в качестве загрязнителя окружающей среды. В связи с этим исследовали их возможное влияние на поведенческие функции лабораторных мышей в тестах “Открытое поле”, “Вращающийся стержень” и “Крестообразный лабиринт”. Исследовали два возможных пути поступления нанотрубок в организм: интрафарингеальную аспирацию и внутривенное введение. Моделировали наиболее распространенный способ поступления УНТ – через легкие, а также при усвоении из крови через гистогематические барьеры. Для интрафарингеальной аспирации мышам однократно вводили 20 мкг потенциального токсина, а при внутривенном – 0.2 мкг. Оценивали острый и отсроченный эффекты через 24 ч и через 30 сут после введения для обоих типов поступления нанообъектов. Через 24 ч после интрафарингеальной аспирации УНТ у экспериментальной группы наблюдались скрытое эмоциональное напряжение и ослабление ориентировочно-исследовательских реакций. Через 30 сут также имели место признаки стресса. Через 24 ч после внутривенного введения нанотрубок фиксировалось, напротив, повышение двигательной активности и исследовательского поведения. Данный результат может быть объяснен угнетающим влиянием многостенных УНТ на нижние дыхательные пути и, возможно, отсутствием накопления в органах в связи с крупными размерами и невозможностью проникновения через гистогематические барьеры.
ВВЕДЕНИЕ
Производство углеродных нанотрубок (УНТ) неуклонно увеличивается в связи с растущими потребностями в строительстве, машиностроении, производстве энергии, освоении космоса и биомедицине [1]. В то же время эксперты и потребители поднимают во всем мире вопросы о безопасности УНТ. Эти углеродистые наноструктуры могут высвобождаться в воздух на рабочем месте во время производства и обработки, при износе композитных материалов или в качестве побочных продуктов в различных технологических процессах. Загрязнение атмосферного воздуха УНТ может происходить в городских районах как часть сгорания моторного топлива [2]. Кроме того, УНТ и другие углеродные нанообъекты входят в состав продуктов горения древесины и вулканической деятельности. Потенциал УНТ исследуется в биомедицинских целях (биосенсоры, средства доставки) [3]. Все это делает очень важной оценку токсического воздействия УНТ на биологические и экологические системы. Установление механизмов биологического и токсического действия УНТ при взаимодействии с различными биологическими объектами и организмом человека необходимо для последующей разработки подходов к техническому регулированию их содержания в различных объектах и предупреждению повреждающего действия на организм человека.
Многостенные углеродные нанотрубки (МУНТ) производятся в промышленных масштабах и относятся к быстрорастущему сегменту рынка нанопродукции [4, 5]. Существует достаточное количество работ по оценке токсических эффектов МУНТ на различные системы организма [6–12], однако публикаций по их влиянию на нервную систему крайне мало.
Одно из косвенных доказательств того, что МУНТ не способны проникать через гистогематические барьеры организма, представлено в [13]. В данной работе исследовалось влияние МУНТ “Таунит-М” при хроническом 100-дневном пероральном пути их поступления на когнитивные функции крыс в тесте “Условный рефлекс пассивного избегания”. Препарат ежедневно давали растущим крысам-самцам линии Вистар в дозах от 0.01 до 10 мг/кг массы тела; введение МУНТ осуществляли с питьевой жидкостью в виде водных дисперсий, стабилизированных 1%-ным Tween-20. Никаких достоверных различий в когнитивных функциях по сравнению с контрольной группой выявлено не было. Отметим, что, несмотря на стабилизацию МУНТ поверхностно-активным веществом (ПАВ) Тween-20, при изменении pH такие нанообъекты способны к значительной агломерации, что реализуемо в кислотной среде желудка и щелочной среде кишечника. Низкая проницаемость через естественные барьеры организма, безусловно, могла привести к редуцированию взаимодействия МУНТ с нервной системой и, соответственно, снижению пагубного влияния на последнюю.
При пероральном введении 0.3% коллоидного раствора МУНТ “Таунит” в более высокой дозировке (450 мг/кг) в течение 14 сут у лабораторных животных наблюдались увеличение спонтанной двигательной активности, количества локомоций и снижение порога эмоциональных реакций. Изменение поведенческих реакций сочеталось с морфофункциональными изменениями, что проявлялось в виде венозного полнокровия головного мозга, гипофиза и мозжечка [14].
В [15] показаны нейротоксическое действие МУНТ на синаптическую пластичность гиппокампа и пространственное познание у крыс при внутрибрюшинном введении. Использовался ингибитор аутофагии – хлорохин, чтобы выяснить, играет ли аутофагия важную роль в синаптической пластичности гиппокампа, поврежденной МУНТ. Взрослые самцы крыс Вистар случайным образом были поделены на три группы: контрольную группу, группу, получавшую МУНТ (2.5 мг/кг массы тела в день), и группу, получавшую МУНТ в той же дозе и хлорохин (20 мг/кг массы тела в день). В качестве основы для приготовления суспензии использовался 0.1%-ный Tween-80. После двухнедельных внутрибрюшинных инъекций крысы проходили тест “Водный лабиринт Морриса”, у них определяли долгосрочное потенцирование и биохимические параметры. Было показано, что МУНТ могут вызывать когнитивный дефицит через увеличение уровня аутофагии.
В исследовании [16] при внутрибрюшинном введении МУНТ в дозах 80 и 800 мг/кг массы тела (стабилизация фосфатно-буферным раствором, pH 7.8) мышам NMRI, спустя две недели после однократного введения в экспонированных группах, по сравнению с контрольной группой отмечался повышенный уровень тревожности в тесте “Крестообразный лабиринт” и повышенный уровень депрессии в тесте “Вынужденное плавание”. В тесте “Открытое поле” время, проведенное в центре арены и на периферии, между группами не различалось. Экспрессия гена нейротрофического фактора мозга (BDNF) снизилась по сравнению с контролем в группе, получившей дозу МУНТ 80 мг/кг, но увеличилась в группе, получившей дозу МУНТ 800 мг/кг.
Таким образом, данные, полученные на основе экспериментов с пероральным или внутрибрюшинным поступлением МУНТ, неоднозначны. Необходимо отметить достаточно высокие дозировки, применявшиеся исследователями, что затрудняет распространение результатов на условия реальных экспозиционных сценариев. Вопрос о биораспределении МУНТ и возможности проходить через естественные барьеры организма остается открытым. Вполне возможно, что морфология МУНТ, включая значительный размер в одном измерении (длина в микрометровом диапазоне), затрудняет их проникновение через естественные барьеры организма и дальнейшую аккумуляцию в тканях. На этот вопрос дается косвенный ответ в представленной работе. Целью исследования явилась оценка влияния МУНТ при интрафарингеальном и внутривенном однократном введении в организм млекопитающих (мышей) на их поведенческие функции. Интрафарингеальная аспирация моделировала наиболее распространенный способ поступления МУНТ в организм. Внутривенное введение моделировало влияние поступившего в кровь ксенобиотика. Такой путь может реализовываться при биомедицинском применении МУНТ. Кроме того, исследование внутривенного пути поступления токсина важно для сравнительного контроля результатов интрафарингеального эксперимента, так как убирает эффект легочного барьера.
МАТЕРИАЛЫ И МЕТОДЫ
В работе исследовали влияние МУНТ “Таунит-М”, полученных непосредственно на предприятии по их производству в г. Тамбов, Россия. В соответствии с характеристикой производителя МУНТ “Таунит-М” имеет диаметр в диапазоне 10–30 нм, длину >2 мкм.
Многостенные углеродные нанотрубки предварительно подвергали термической обработке при 250°С в течение 30 мин. Приготовление суспензий проводили следующим образом: изначально готовили гомогенную суспензию МУНТ (1 мг/мл) в растворе ПАВ (0.1%-ный Tween-80 в фосфатно-буферном растворе) путем ультразвуковой соникации, затем путем разбавления получали рабочие концентрации: 0.5 мг/мл для интрафарингеального введения и 0.001 мг/мл для внутривенного введения. Для соникации растворов использовали прибор “Sonics” при следующих параметрах работы: 750 Ватт, 20 кГц, 40% амплитуда, пульс 5/6, время 30 мин. Подготовленные суспензии МУНТ тестировали на содержание бактериальных эндотоксинов; полученные результаты свидетельствовали об отсутствии бактериального загрязнения. Контроль степени диспергирования проводили при помощи просвечивающего электронного микроскопа Carl Zeiss Libra 120 с использованием программы Carl Zeiss AxioVision для компьютерной обработки изображений.
Размер МУНТ в суспензии определяли путем их визуализации с помощью просвечивающего/растрового электронного микроскопа (П/РЭМ) Titan 80-300 TEM/STEM с разрешением 0.79 Å. Непосредственно перед измерением растворы МУНТ подвергали ультразвуковой обработке в течение 15 мин, а затем высаживали на углеродную сетку и высушивали.
В работе использовали мышей-самцов линии C57BL6 в возрасте двух месяцев массой 18 ± 2 г. Всего в эксперименте участвовало 80 мышей: 40 контрольных и 40 экспериментальных.
СХЕМА ЭКСПЕРИМЕНТА
В каждом из экспериментов (интрафарингеальное и внутривенное введение) участвовало по 40 мышей – 20 опытных и 20 контрольных. По 10 лабораторных животных каждой из групп (контрольной и опытной) исследовались через 24 ч и 30 сут после экспозиции.
Для интрафарингеального введения выбрана доза МУНТ, на которой были показаны токсические эффекты в отношении дыхательных путей по данным предыдущих исследований легочной токсичности МУНТ на животных [6–12].
Все растворы подвергали ультразвуковой диспергации непосредственно перед введением, чтобы избежать агрегации частиц МУНТ.
Первая экспериментальная группа получила путем фарингеальной аспирации 20 мкг МУНТ в 40 мкл 0.1%-ного раствора Tween-80 (1 мг/кг массы тела); первой контрольной группе тем же способом было введено 40 мкл 0.1%-ного Tween-80. Техника фарингеальной аспирации включала в себя наркотизацию животного с помощью изофлурана, фиксацию, осторожное вытягивание языка и однократное помещение необходимого объема исследуемого раствора в область корня языка для последующей рефлекторной аспирации животным.
В случае внутривенного пути поступления второй экспериментальной группе вводили 0.2 мкг МУНТ в 200 мкл 0.1%-ного раствора Tween-80 (0.01 мг/кг массы тела); второй контрольной группе тем же способом было введено 200 мкл 0.1%-ного Tween-80. Подбор дозы для внутривенного введения, эквивалентную интрафарингеальной дозе, проводили с учетом коэффициента транслокации 1% [17]. Внутривенную инъекцию проводили в боковую вену хвоста тонкой иглой. Для расширения вен хвост опускали в теплую воду (45–55°С); место укола высушивали и дезинфицировали; прокол делали по возможности периферийнее.
Все работы с животными проводились в строгом соответствии с законодательством Российской Федерации и отвечали принципам надлежащей лабораторной практики [18]. Исследование одобрено локальным этическим комитетом ФГБОУ ВО Казанского ГМУ Минздрава России. Животные содержались в одиночных клетках при температуре помещения +20–26°С и относительной влажности воздуха не более 70%. Для кормления животных использовался овес, мука травяная “Веткорм”, комбикорм конвенциональный ПЗК-120 для лабораторных грызунов.
Поведенческие тесты проводили через 24 ч и 30 сут для каждого типа введения. Батарея поведенческих тестов включала в себя методы “Открытое поле”, “Вращающийся стержень”, “Крестообразный лабиринт”.
Для проведения теста “Открытое поле” использовали установку “Открытое поле для мышей”, круглое, цвет – серый, без разметки (НПК Открытая Наука, Россия). Методика “Открытое поле” предназначена для изучения поведения грызунов в новых стрессогенных условиях и позволяет оценить уровень эмоционально-поведенческой реактивности животного, стратегию исследовательского поведения, симптомы неврологического дефицита. Животное помещалось в центр арены и находилось в установке в течение трех минут. Регистрировались такие показатели, как горизонтальная двигательная активность (количество пересеченных линий), горизонтальная двигательная активность в центре арены (количество посещений центральной части установки), количество обследованных норок, уровень дефекации.
Установка “Приподнятый крестообразный лабиринт” (НПК Открытая наука, Россия) позволяет более полно и детально регистрировать состояние поведения животных в условиях переменной стрессогенности с помощью оценки уровня тревожности по предпочтению темноты/света. Автоматическую регистрацию проводили при помощи специального программного обеспечения для видеотрекинга Etho Vieion (фирма Noldus). Животные также помещались в центр лабиринта, их поведение регистрировалось в течение пяти минут. Учитывались время, проведенное в закрытых и открытых рукавах лабиринта, средняя скорость движения.
Также использовали вращающийся стержень (НПК “Открытая наука”, Россия), что позволило объективно оценить наличие мышечной релаксации, нарушения равновесия и координации движений. Скорость вращения стержня составляла 15 об./мин. Удержание мышей на стержне в течение двух минут считалось максимальным.
В каждом эксперименте сохраняли последовательность и интервал между поведенческими тестами. В первый день проводили тесты “Открытое поле” и “Вращающийся стержень”, причем мышей после проведения первого теста сразу помещали на стержень. На следующий день регистрировали поведение животных в установке “Приподнятый крестообразный лабиринт”.
Статистическую обработку проводили с использованием пакета R. Для сравнения опытной и контрольной групп применяли критерий Манна–Уитни. При оценке взаимодействия факторов времени и введения МУНТ использовали двухфакторный дисперсионный анализ ANOVA; предварительно перед проведением теста выборки проверяли на соответствие нормальному распределению при помощи теста Шапиро–Уилка и на однородность дисперсии при помощи теста Левена; апостериорный анализ с использованием критерия Тьюки проводили при установлении статистически значимой разницы между группами в целом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Многостенные углеродные нанотрубки “Таунит-М”, согласно данным П/РЭМ, представляют собой переплетенные волокна длиной >2 мкм, толщиной 11 ± 2 нм (рис. 1) с остатками катализатора Co на концах. Также в качестве примесей, согласно данным энерго-дисперсионного рентгеновского микроанализа, обнаружены Fe и Mg, скорее всего, попавшие в порошок в процессе синтеза. Достоверно оценить продольный размер данных МУНТ не представлялось возможным в связи со значительной спутанностью волокон (рис. 2).
Рис. 1.
П/РЭМ-изображение МУНТ “Таунит” (0.5 мг/мл), стабилизированных 0.1%-ным Tween-80 в фосфатно-буферном растворе.
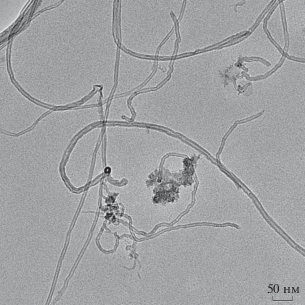
Рис. 2.
П/РЭМ-изображение МУНТ “Таунит” (0.5 мг/мл), стабилизированных 0.1% Tween-80 в фосфатно-буферном растворе. Представлена область с высокой концентрацией МУНТ. Видно, что волокна весьма перепутаны.
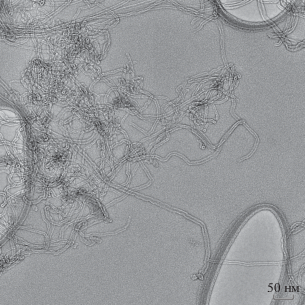
Преобладающий размер агломератов МУНТ в суспензии составлял 0.1–0.3 мкм.
Результаты поведенческих тестов приведены в табл. 1.
Таблица 1.
Результаты поведенческих тестов у мышей линии C57BL6 через 24 ч и 30 дней после однократного интрафарингеального и внутривенного введения МУНТ (медиана [25, 75%])
| “Открытое поле” | “Вращающийся стержень” | “Крестообразный лабиринт” | ||||||
|---|---|---|---|---|---|---|---|---|
| Количество пересеченных линий | Количество посещений центральной арены | Количество обследованных отверстий | Уровень дефекации (количество болюсов) | Время удержания на стержне, с | Время, проведенное в открытых рукавах, с | Время, проведенное в закрытых рукавах, с | Средняя скорость движения, см/с | |
| Эксперимент 1. Интрафарингеальная аспирация (24 ч) | ||||||||
| Контрольная группа | 73.00 [52. 75, 85. 25] |
3.00 [2.25, 4.75]* | 15.50 [9.50, 19.25]* | 0.00 [0.00, 0.00]* | 120.00 [100.00, 120.00] |
4.80 [1.40, 28.82] | 242.74 [165.95, 258.87] |
3.77 [3.19, 4.43] |
| Опытная группа (20 мкг МУНТ/мышь) | 59.50 [36.50, 72.25] |
1.00 [0.00, 1.00]* |
10.00 [6.25, 12.50]* |
0.50 [0.00, 1.00]* |
120.00 [120.00, 120.00] |
2.80 [0.12, 13.50] |
235.25 [197.95, 253.42] |
2.97 [2.68, 3.73] |
| p | 0.13 | 0.0003* | 0.059* | 0.054* | 0.61 | 0.4 | 0.85 | 0.10 |
| Эксперимент 1. Интрафарингеальная аспирация (30 сут) | ||||||||
| Контрольная группа | 57.00 [37.50, 74.75] |
2.00 [0.00, 5.75] |
13.00 [9.25, 16.50] |
0.00 [0.00, 1.50] |
14.00 [4.50. 28.25] |
0.00 [0.00, 1.60] |
202.85 [155.42, 229.22]* |
2.72 [2.23, 2.86] |
| Опытная группа (20 мкг МУНТ/мышь) | 63.50 [47.50, 71.50] |
2.00 [1.00, 3.00] |
14.00 [11.00, 17.00] |
0.00 [0.00, 0.00] |
14.50 [7.50, 32.75] |
0.25 [0.00, 1.57] |
257.19 [243.45, 267.35]* |
2.42 [2.25, 2.71] |
| p | 0.88 | 0.91 | 0.65 | 0.55 | 0.91 | 0.69 | 0.052 * | 0.63 |
| Эксперимент 2. Внутривенное введение (24 ч) | ||||||||
| Контрольная группа | 74.00 [58.00, 80.00]* |
2.00 [2.00, 3.75] |
12.50 [10.50, 20.50] |
0.00 [0.00, 0.00] |
28.50 [3.25, 120.00] |
16.35 [8.30, 24.50] |
230.30 [215.02, 251.85] |
21.32 [19.58, 24.51] |
| Опытная группа (0,2 мкг МУНТ/мышь) | 87.50 [84.50, 105.50]* |
3.00 [1.25, 3.75] |
15.00 [13.00, 17.25] |
0.00 [0.00, 0.00] |
66,00 [25.50, 79.75] |
12.30 [4.97, 14.17] |
249.00 [234.67, 254.75] |
20.36 [19.70, 22.69] |
| p | 0.015 * | 0.70 | 0.59 | 0.5 | 0.59 | 0.19 | 0.14 | 0.63 |
| Эксперимент 2. Внутривенное введение (30 сут) | ||||||||
| Контрольная группа | 29.00 [22.00, 45.50] |
1.00 [0.00, 2.00] |
9.00 [3.50, 12.50] |
0.00 [0.00, 0.75] |
12.00 [3.25, 62.00] |
66.70 [32.07, 93.20] |
144.00 [105.22, 159.65] |
21.54 [18.65, 25.32] |
| Опытная группа (0,2 мкг МУНТ/мышь) | 33.00 [18.00, 36.00] |
2.00 [1.00, 2.00] |
4.00 [1.00, 15.00] |
0.00 [0.00, 2.00] |
18.00 [4.00, 41.00] |
69.10 [38.10, 72.90] |
124.30 [82.30, 159.90] |
20.60 [20.11, 23.10] |
| p | 0.81 | 0.44 | 0.57 | 0.80 | 0.90 | 0.99 | 0.72 | 0.90 |
Использование метода “Открытое поле” в батарее тестов через 24 ч после интрафарингеальной экспозиции позволило обнаружить у опытной группы уменьшение двигательной активности в центре арены по сравнению с контрольной (p < 0.001) (рис. 3), что является признаком скрытого эмоционального напряжения у мышей, получивших дозу МУНТ. Кроме того, в этом же тесте выявлены следующие тенденции: мыши опытной группы обследовали меньше отверстий, чем мыши контрольной группы, что свидетельствует об ослаблении ориентировочно-исследовательских реакций у первых (p = 0.059) (рис. 4). Также опытная группа демонстрировала повышенный уровень дефекации по сравнению с контрольной группой, что, в свою очередь, свидетельствует о возросшем уровне тревожности (p = = 0.055) (рис. 5).
Рис. 3.
Горизонтальная двигательная активность в центре арены в тесте “Открытое поле” через 24 ч после интрафарингеальной аспирации (p < 0.001).
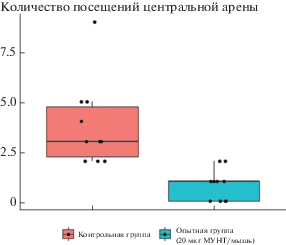
Рис. 4.
Количество обследованных норок в тесте “Открытое поле” через 24 ч после интрафарингеальной аспирации (p = 0.059).

Рис. 5.
Уровень дефекации мышей в тесте “Открытое поле” через 24 ч после интрафарингеальной аспирации (p = 0.055).

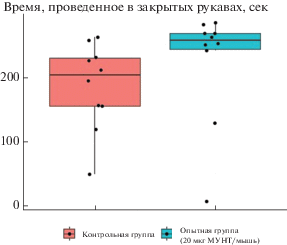
Анализ поведенческих характеристик через 30 сут после экспозиции выявил статистически значимые различия в тесте “Крестообразный лабиринт”: общее время, проведенное в закрытых рукавах, у опытной группы было выше, чем у контрольной (p = 0.052) (рис. 6), что также является показателем повышенного уровня тревожности в незнакомой ситуации.
Рис. 6.
Время, проведенное в закрытых рукавах, в тесте “Крестообразный лабиринт” через 30 сут после интрафарингеальной аспирации (p = 0.052).
В тесте “Вращающийся стержень” мыши опытной группы не демонстрировали нарушения равновесия и координации движения по сравнению с контрольной группой через 24 ч и 30 сут после интрафарингеальной экспозиции.
Через 24 ч после внутривенного введения МУНТ в тесте “Открытое поле” мыши опытной группы демонстрировали более высокую горизонтальную двигательную активность по сравнению с контрольной группой, а спустя 30 сут после воздействия результаты теста свидетельствовали о снижении горизонтальной двигательной активности мышей опытной группы в сравнении с контрольной (рис. 7). При использовании методов “Вращающийся стержень” и “Крестообразный лабиринт” статистически значимых различий между контрольными и опытными группами через 24 ч и 30 сут после внутривенной экспозиции обнаружено не было.
Рис. 7.
Горизонтальная двигательная активность в тесте “Открытое поле” через 24 ч и 30 сут после внутривенной экспозиции (двухфакторный дисперсионный анализ, эффект взаимодействия – p = 0.046).
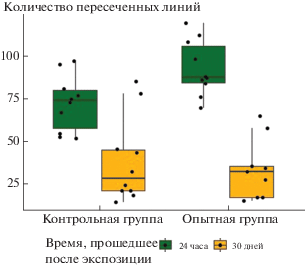
Таким образом, спустя 30 сут после интрафарингеальной экспозиции в дозе 20 мкг/мышь различий в ориентировочно-исследовательских реакциях между опытной и контрольной группами, выявленных через 24 ч после введения МУНТ, не наблюдалось; при этом через 30 сут у опытной группы сохранялся повышенный уровень тревожности, более выраженный в условиях переменной стрессогенности. При внутривенном введении МУНТ в дозе 0.2 мкг/мышь признаки поведенческих нарушений регистрировались через 24 ч и 30 сут после воздействия только при оценке горизонтальной двигательной активности.
ЗАКЛЮЧЕНИЕ
Проведенные исследования выявили некоторые поведенческие отклонения у опытной группы с интрафарингеальной экспозицией по сравнению с контрольной группой через 24 ч и 30 сут после введения МУНТ, что позволяет предположить наличие стресс-реакции со стороны нервной системы на введение суспензии МУНТ. По-видимому, полученные результаты свидетельствуют о раздражающем эффекте суспензии МУНТ на нижние отделы дыхательных путей. Возможно, данный результат связан не с проникновением МУНТ через легочный барьер и последующим их накоплением, а с реакцией на новый раздражитель. Однако это предположение должно быть верифицировано в токсикокинетическом исследовании по изучению биораспределения МУНТ в органах млекопитающих.
При внутривенном введении признаков негативного влияния на нервную систему в обеих группах не наблюдалось. Однако была зафиксирована повышенная двигательная активность по сравнению с контрольной группой в тесте “Открытое поле” через 24 ч с последующим торможением. Возбуждающее действие МУНТ на нервную систему было отмечено другими исследователями при пероральном [13–15] и внутрибрюшинном [16] путях введения значительно более высоких доз.
Необходимо учитывать фактор низкой дозы введенных МУНТ, а также их геометрии, которая приводит к затруднению прохождения через гистогематические барьеры организма. Оба этих фактора, по всей видимости, стали причиной незначительного влияния МУНТ на нервную систему. Однако при интрафарингеальном введении наблюдалось появление стресс-реакции, которая снижалась со временем, что, вероятно, связано с непосредственным контактом МУНТ с тканью легких и косвенно указывает на их естественное выведение с течением времени в составе бронхоальвеолярного лаважа. Отметим, что механизмы воздействия МУНТ на нервную систему животных могут быть реализованы разными путями, и выраженная стресс-реакция в ответ на раздражение легочной ткани может маскировать другой механизм воздействия МУНТ, проявившийся в реакции со стороны нервной системы при внутривенном пути введения.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-32-20197 мол_а_вед, частичное финансирование – грант № 19-315-90046).
Список литературы
Ji Z., Zhang D., Li L. et al. // Nanotechnology. 2009. V. 20. № 44. https://doi.org/10.1088/0957-4484/20/44/445101
Kolosnjaj-Tabi J., Just J., Hartman K.B. et al. // EBioMedicine. 2015. V. 2. № 11. P. 1697.
Vardharajula S., Ali S.Z., Tiwari P.M. et al. // Int. J. Nanomedicine. 2012. V. 7. P. 5361.
Ткачев А.Г., Золотухин И.В. Аппаратура и методы синтеза твердотельных наноструктур: М.: Машиностроение-1. 2007. 316 с.
NIOSH Current intelligence bulletin 65. Occupational exposure to carbon nanotubes and nanofibers. https://www.cdc.gov/niosh/docs/2013-145/pdfs/2013-145.pdf?id=10.26616/NIOSHPUB2013145 (дата обращения 20.06.2020).
Халиуллин Т.О., Шведова А.А., Кисин Е.Р. и др. // Бюллетень экспериментальной биологии и медицины. 2014. Т. 158. № 11. С. 635.
Dymacek J.M., Snyder-Talkington B.N., Raese R. et al. // Int. J. Toxicol. 2018. V. 37. № 4. P. 276.
Mercer R.R., Hubbs A.F., Scabilloni J.F. et al. // Part Fibre Toxicol. 2011. V. 8. № 21. https://doi.org/10.1186/1743-8977-8-21
Muller J., Huaux F., Moreau N. et al. // Toxicol. Appl. Pharmacol. 2005. V. 207. № 3. P. 221.
Nygaard U.C., Hansen J.S., Samuelsen M. et al. // Toxicol. Sci. 2009. V. 109. № 1. P. 113.
Poland C.A., Duffin R., Kinloch I. et al. // Nat. Nanotechnol. 2008. V. 3. № 7. P. 423.
Porter D.W., Hubbs A.F., Mercer R.R. et al. // Toxicology. 2010. V. 269. № 2–3. P. 136.
Шипелин В.А., Шумакова А.А., Масютин А.Г. и др. // Российские нанотехнологии. 2017. Т. 12. № 9–10. С. 96.
Горшенева Е.Б., Топчиева З.С. // Вестн. российских университетов. 2017. Т. 22. № 2. С. 274.
Gao J., Zhang X., Yu M. et al. // Toxicology. 2015. V. 337. P. 21.
Gholamine B., Karimi I., Salimi A. et al. // Toxicol. Industrial Health. 2016. V. 33. P. 340.
Jacobsen N.R., Møller P., Clausen P.A. et al. // Basic Clin Pharmacol Toxicol. 2017. V. 121. Suppl. 3. P. 30.
Национальный стандарт РФ ГОСТ Р 53434-2009. Принципы надлежащей лабораторной практики. Утв. Приказом Федерального агентства по техническому регулированию и метрологии от 2 декабря 2009 г. №544-ст. Доступ из справ.-правовой системы “ГАРАНТ”.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


