Российские нанотехнологии, 2020, T. 15, № 4, стр. 418-434
БИОРЕЗОРБИРУЕМЫЕ КОМПОЗИТЫ ДЛЯ КОСТНОЙ ПЛАСТИКИ
Н. Тагандурдыева 1, *, В. Е. Юдин 1, 2
1 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
2 Институт высокомолекулярных соединений РАН
Санкт-Петербург, Россия
* E-mail: jemala1996@gmail.com
Поступила в редакцию 18.06.2020
После доработки 26.09.2020
Принята к публикации 28.09.2020
Аннотация
Ежегодно в мире проводится более миллиона операций по восстановлению функций костей, утраченных в результате переломов и деформаций, и, несмотря на разнообразие имплантатов для костной пластики, проблемы выбора материала остаются до конца не решенными. Наличие иммунологического барьера и дефицита пластического материала ограничивает применение аллотрансплантатов, высокий модуль упругости по сравнению с костью, а также необходимость проведения повторной операции усложняют применение имплантатов на основе металлов и их сплавов, недостаточные механические свойства, несмотря на биорезорбируемость, ограничивают применениe полимерных имплантатов. В связи с чем ведутся активные разработки композитов на основе резорбируемых полимеров с различными по виду, природе и свойствам наполнителями. Представлен обзор существующих резорбируемых композитов для костной пластики. Композиты по виду наполнителя делятся на армированные волокнами, армированные дисперсными частицами и структурные. Простота переработки, хорошая биоактивность, биосовместимость и остеокондуктивность являются основными преимуществами использования дисперсных наполнителей на основе фосфата кальция; широкий спектр механических и биологических свойств и соответствие свойствам и структуре натуральной кости являются преимуществами армированных композитов волокнами на основе фосфатного стекла, резорбируемых полимеров и структурных композитов. В ближайшем будущем биорезорбируемые композитные имплантаты с механическими свойствами, соответствующими этим свойствам костной ткани и сохраняющимися до полной консолидации перелома, а также дополненные остеогенным потенциалом, могут заменить традиционные металлические устройства.
ОГЛАВЛЕНИЕ
Ввведение
1. Костная ткань
2. Материалы для имплантации
2.1. Аллотрансплантаты
2.2. Металлы
2.3. Полимеры
2.3.1 Полигликолид
2.3.2. Полилактид
2.3.3. Сополимеры лактида и гликолида
2.3.4. Поли-ε-капролактон
2.3.5. Хитин и хитозан
3. Композиты
3.1. Композиты, армированные дисперсными частицами
3.2. Композиты на основе волокнистых наполнителей
3.3. Структурные композиты
Заключение
ВВЕДЕНИЕ
Проблема потери функции костей в результате переломов и деформаций является актуальной проблемой, и на протяжении многих лет развития медицины группы ученых и врачей пытаются найти ее решение.
Число пациентов, нуждающихся в проведении хирургического вмешательства по восстановлению целостности кости, довольно велико: в Европе ежегодно проводится около 400 000 операций по восстановлению костных дефектов, 600 000 в США [1, 2]. Ежегодно в нашей стране травмы получают около 15 млн человек, 70% из них – это пожилые люди. Отметим, что почти 90% всех переломов костей приходится на опорно-двигательный аппарат; число больных, нуждающихся в лечении, составляет свыше 60%. Общая потребность в операциях по эндопротезированию суставов в России составляет около 300 000 в год (в среднем 27 операций на каждые 10 000 жителей РФ), а реально выполняется около 50 000 [3].
Костные переломы фиксируются с использованием внешних или внутренних фиксирующих устройств или и того, и другого [4, 5]. Существуют два принципиально различных подхода к решению проблемы восстановления повреждений костной ткани: замена поврежденного участка кости имплантатом (создание конструкции, замещающей кость); создание условий для восстановления костной ткани в зоне повреждения с помощью имплантата [6].
“Идеальным” имплантатом следует считать тот, который с минимальной дополнительной травмой мягких и костной тканей сохраняет неподвижность отломков и обеспечивает опороспособность поврежденной конечности на всем периоде лечения. При этом, несмотря на разнообразие материалов, применяемых для замещения дефектов костей, вопросы правильного выбора материала (природного или синтетического, полимерного или металлического, резорбируемого и нерезорбируемого) в зависимости от места, размера и формы дефекта, а также вопросы получения единой биомеханической системы кость–имплантат остаются до конца не решенными [7].
1. КОСТНАЯ ТКАНЬ
Для понимая выбора того или иного материала в качестве имплантата кратко рассмотрим состав и структуру костной ткани.
Костная ткань является природным биокерамическим композитом на основе органической матрицы, армированной неорганическим наполнителем – керамической фазой. Основными функциями костной ткани являются обеспечение структурной поддержки мягких тканей, защита внутренних органов от травм и обеспечение движения [8].
Органический матрикс, составляющий примерно 22% от всей массы кости, на 90–95% представлен коллагеновыми волокнами, а остальная часть – гомогенной желатинозной субстанцией, названной основным веществом. Органическая основа отвечает за гибкость кости, а направление коллагеновых волокон по большей части совпадает с направлением сил растяжения [9].
Неорганические минералы составляют 70% всей массы кости, основными компонентами которых являются гидроксиапатит (НА) и аморфный фосфат кальция [10, 11]. Каждый кристалл HA представляет собой длинную плоскую пластину размером около 40 нм в длину, 1–3 нм в высоту и 10 нм в ширину. В неорганическом веществе кости также есть ионы магния, натрия, калия, карбоната, но они не образуют собственных кристаллических структур, а лишь связаны с кристаллами HA [9].
Коллагеновое волокно в компактной кости состоит из периодически повторяющихся участков, каждый длиной около 64 нм, а кристаллы HA тесно с ними взаимодействуют. Эта тесная связь препятствует расслоению костей и смещению волокон и кристаллов друг относительно друга, что повышает прочность костей. Коллагеновые волокна обладают устойчивостью к растяжению, а соли кальция придают им высокую устойчивость к компрессии. Такая комбинация обеспечивает костям чрезвычайную прочность как при компрессии, так и при растяжении [9]. Механические свойства костей представлены в табл. 1. Большой диапазон значений связан с варьированием механических свойств в зависимости от расположения костей, условиями тестирования, возрастом, полом [12–14]. Кроме того, кость содержит клетки типа остеобластов и остеокластов, отвечающих за образование костей и резорбцию костей соответственно [11].
2. МАТЕРИАЛЫ ДЛЯ ИМПЛАНТАЦИИ
Функционирование имплантатов протекает при воздействии на их поверхность тканевой жидкости, крови, лимфы и других компонентов, присутствующих в организме. Данные жидкости обладают свойствами электролитов [15], и протекающие анодные процессы характеризуются ионизацией материалов, диффузией ионов в окружающую биосреду [5–7], вследствие чего изменяются состав и свойства поверхности имплантата, а также происходит нарушение нормальных клеточных процессов в биоструктурах, возникает опасность развития воспалительных процессов и отторжения имплантата [16]. В связи с чем к современным материалам, используемым для замещения костной ткани, предъявляют такие требования, как инертность, отсутствие токсичности как материала, так и продуктов его деструкции (если таковые процессы имеют место быть) по отношению к окружающим живым тканям, наличие удовлетворительной механической прочности, стойкость к воздействию внутренней среды организма и т.д. [17].
В качестве материалов для костных имплантатов могут применяться аллотрансплантаты, металлы и полимеры.
2.1. Аллотрансплантаты
С давних пор предпринимались попытки восстановить утраченную часть кости или хряща с помощью аллотрансплантации [18, 19]. Основную часть таких биоматериалов получали из хрящевой и/или костной тканей человека и животных, а также компонентов кожи, сухожилий, мозговой оболочки. Однако эти материалы должны быть подготовлены непосредственно перед трансплантацией либо необходимо наличие банка для хранения такого материала, что доступно только крупным специализированным медицинским центрам. Помимо этого, наличие иммунологического барьера и дефицита пластического материала делают применение этой технологии весьма ограниченной.
2.2. Металлы
С середины XX века основными материалами для изготовления имплантатов стали металлы, в том числе титан и его сплавы, до сих пор являющиеся “золотым стандартом” в лечении переломов из-за наличия наряду с хорошими прочностными свойствами инертности по отношению к тканям организма [20, 21]. Однако, несмотря на широкое применение металлов в качестве материалов для имплантатов, большинство из них имеет ряд значительных недостатков [22]: раздражение мягких тканей при контакте с поверхностью имплантата, инфекция в области имплантации, миграция имплантата, выделение из металлической конструкции токсических компонентов (никель, хром), необходимость повторного хирургического вмешательства для удаления имплантата. Многие исследования показали, что полноценной регенерации костной ткани препятствует разница в модуле упругости между костью и металлом (табл. 2) [23–25].
Были предприняты попытки снижения жесткости имплантатов при использовании полимеров [26], полимер-металлических систем [27] и полимерных композиционных материалов, армированных, например, углеродными волокнами [28], и на основе полиметилметакрилата и полиэфирсульфоном [29]. Некоторые недостатки были устранены, но все же остается необходимость в проведении повторной операции после восстановления кости. Для исключения этой необходимости устройства могут быть изготовлены из биорезорбируемых материалов, в том числе полимеров, стекол, керамики и композитов на основе этих классов материалов [30].
2.3. Полимеры
Преодолеть большинство недостатков металлических имплантатов и предоставить принципиально новые свойства позволяют имплантаты на основе биорезорбируемых полимеров [20, 34].
Полимерные имплантаты по сравнению с металлическими обладают следующими преимуществами [20, 21, 35–37]:
– способностью полностью резорбироваться, что дает возможность избежать повторных операций и дополнительного травмирования тканей;
– полной совместимостью с современными диагностическими методами (рентген, компьютерная томография, ЯМР);
– отсутствием явления “stress shielding”. Высокий модуль упругости металла по сравнению с костью (Eкости = 6–20 и Eметалла = 100–200 ГПа) приводит к тому, что кость не подвергается воздействию механической нагрузки, вследствие этого возникает так называемый эффект защиты от нагрузок (stress shielding). Защищенная от нагрузки кость регенерирует не полностью или может реконструироваться в соответствии с законом Вольфа, который гласит, что кость адаптируется к подвергаемым нагрузкам, поэтому экранированная область больше подвержена повторному разрушению при удалении имплантата.
Наибольшую популярность среди биорезорбируемых полимеров завоевали полиэфиры, т.е. поли-α-гидроксикислоты и прежде всего сополимеры на основе лактида и гликолида [38, 39]. Большинство используемых в настоящее время резорбируемых имплантатов для остеосинтеза изготовлены именно из этих полимеров. Полидиоксанон и поликапролактон также исследуются в качестве потенциальных материалов, но их механические свойства ограничивают их применение [40].
2.3.1. Полигликолид. Полигликолид или полигликолевая кислота (PGA) – это термопластичный полимер со степенью кристалличности 46–50%, температурой плавления 220–225°C и температурой стеклования ~36°C [41]. Полимер обладает наиболее высокой степенью кристалличности и модулем упругости из ряда поли-α-гидроксикислот, однако из-за его гидролитической нестабильности он теряет свои механические свойства в организме в течение нескольких недель [42], что не всегда соответствует времени полного восстановления поврежденной костной ткани. Также быстрый гидролиз приводит к выделению большого количества гликолевой кислоты, понижающей кислотность в области имплантации, приводящей к локальному остеолизу, неоднородной деградации полимера и повреждению окружающих тканей [43]. Винты из PGA показали срок полной деградации ~6 мес [44]. Еще одним недостатком этого полимера является сложность его переработки из-за небольшого интервала между температурами плавления и деструкции [41].
2.3.2. Полилактид. Полилактид или полимолочная кислота (PLA) – это гидрофобный полимер с температурой плавления около 160–180°C и температурой стеклования в диапазоне 50–60°С [41]. Гидрофобность полимеру придают боковые группы –CH3, благодаря которым он более устойчив к гидролизу, чем PGA (табл. 3). Существуют две оптические формы: D-лактид и L-лактид [45]. PLA встречается в четырех различных формах: поли-L-молочная кислота (PLLA), поли-D-молочная кислота (PDLA), поли-D, L-молочная кислота (PDLLA) и мезо-полимолочная кислота [45, 46].
Таблица 3.
Химическое строение биорезорбируемых полимеров
| Название полимера | Химическое строение |
|---|---|
| Полилактид | 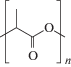 |
| Полигликолид |  |
| Сополимер лактида и гликолида | 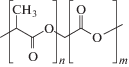 |
| Поли-ε-капролактон | 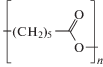 |
| Хитин |  |
| Хитозан | 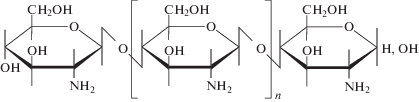 |
Регулирование физических свойств и биоразлагаемости PLA может быть достигнуто путем рацемизации D- и L-изомеров. В ортопедических имплантатах широко используется PLLA, так как этот материал сохраняет свою первоначальную прочность дольше, чем PDLLA. С другой стороны, у PLLA более длительный период резорбции, и, как оказалось, остаточные фрагменты этого материала сохраняются в тканях до 5 лет после имплантации [45].
В [47] исследовано влияние молекулярной массы, диаметра образца и режима обработки отжигом на свойства отлитых под давлением штифтов на основе PLLA. Начальная прочность на изгиб и сдвиг составляла 132 и 58.8 Мпа соответственно; после отжига прочность на изгиб уменьшилась на 27% и прочность на сдвиг увеличилась на 12%. Автор заявил, что основным недостатком этих стержней была их хрупкость при изгибе, но не дал количественной оценки этого параметра. После получения образцов PLLA-стержней с разной молекулярной массой и низким содержанием мономеров он оценил потерю прочности образцов, имплантированных в дорсальную подкожную клетчатку крыс. PLLA с низкой молекулярной массой 125 кДа обладал прочностью при растяжении 28.2 МПа и модулем упругости 4.23 ГПа, которые снижались на 83 и 53% соответственно после восьми недель in vivo. PLLA с высокой молекулярной массой 260 кДа имеет следующие значения: предел прочности при растяжении 57.1 МПа и модуль упругости 5.1 ГПа, которые снижались на 69 и 30% соответственно после 12 нед в экспериментах in vivo.
2.3.3. Сополимеры лактида и гликолида. Сополимеры лактида и гликолида (PLGA) получают ионной полимеризацией и сополимеризацией. Сополимеры, содержащие PLLA и PGA, имеют относительно низкую кристалличность, причем физические характеристики являются промежуточными между характеристиками гомополимеров PGA и PLLA. В зависимости от соотношения полимеров сополимер PLGA сохраняет свою механическую прочность в течение 6–8 нед, с полной резорбцией в течение 1.5–2 лет [48].
2.3.4. Поли-ε-капролактон. Поли-ε-капролактон (PCL) – гидрофобный, частично-кристаллический полимер с температурой стеклования ~–60°C и температурой плавления 59–64°C; его кристалличность уменьшается с увеличением молекулярной массы. Время резорбции PCL составляет 2–4 года (в зависимости от начальной молекулярной массы и геометрических характеристик имплантата) [39, 49, 50].
Хорошая растворимость PCL, его низкая температура плавления, хорошая совместимость с другими полимерами, простота формования стимулировали проведение исследований по изучению его применения в костной хирургии [39, 41, 49–53]. Но, как выяснилось, для замены металлических ортопедических имплантатов (пластин, винтов, гвоздей и т.д.) полимер непригоден в связи с неудовлетворительными механическими свойствами. Армирование PCL различными наполнителями также не показало удовлетворительных результатов. Так, авторы [54] провели фиксацию остеотомии плечевой кости кролика с помощью PCL, армированного стекловолокном. Хотя PCL вызывал меньшее экранирование напряжений, чем нержавеющая сталь, механическая прочность PCL была недостаточной.
Резорбция рассмотренных выше полиэфиров происходит посредством гидролиза, который может усиливаться ферментами in vivo. Случайный гидролиз полимерных цепей приводит к снижению молекулярной массы и прочности полимера. Полимерные имплантаты фрагментируются на мелкие частицы, затем на олигомеры и мономеры, которые разлагаются до воды и углекислого газа в результате естественных метаболических процессов (молочная и гликолевая кислота включаются в цикл трикарбоновых кислот [55]). На гидролиз влияют химический состав, молекулярная масса, степень кристалличности, гидрофильность, ориентация, геометрические размеры, пористость полимера и место имплантации (губчатая/кортикальная кость) [39, 40, 51].
Химическое строение рассмотренных полиэфиров представлено в табл. 3, а средние значения механических характеристик и времена полной резорбции – в табл. 4.
Таблица 4.
Физико-механические характеристики и сроки резорбции рассасывающихся полимеров [30, 37, 39, 44, 49–51, 53, 56–59]
| Материал | Модуль упругости, ГПа | Прочность при изгибе, МПа | Прочность при растяжении, МПа | Срок сохранения прочности, мес | Срок полной биорезорбции, мес |
|---|---|---|---|---|---|
| PGA | 6–7 | 195–375 | 60–80 | 1 | 6–12 |
| PLLA | 3–6 | 109–145 | 50–80 | 3 | 24–72 |
| PDLLA | 1–3.5 | 95–130 | 20–60 | 1 | 12–16 |
| PCL | 0.2–0.4 | 16–29 | 20–30 | Более 6 | 24–48 |
| PLGA | 1–3 | 65 | 40–55 | 1–12 |
Идеальный полимерный материал для костных имплантатов должен отвечать следующим требованиям [20, 40, 55, 60–62]:
– достаточная для фиксации костей прочность полимеров и относительная стабильность их физико-механических параметров до завершения процессов консолидации переломов;
– отсутствие токсичности, аллергических и канцерогенных воздействий, а также биологическая инертность по отношению к окружающим тканям как самих материалов, так и продуктов их биорезорбции;
– простота в изготовлении имплантатов нужной формы, а также доступность исходных материалов;
– возможность проведения стерилизации с минимальной потерей свойств;
– постепенная резорбция с передачей механических нагрузок на вновь формирующуюся кость, т.е. скорость деградации, близкая к скорости восстановления костной ткани;
– плотное прилегание поверхности имплантата к костной ткани во избежание миграции имплантата;
– наличие остеоиндуктивности, т.е. способности активно побуждать остеобласты к формированию костного матрикса и мезенхимальные клетки к дифференцировке в остеогенные клетки, и остеокондуктивности, т.е. врастанию клеток и сосудов в структуры имплантата благодаря топографии его поверхности, химии и освобождению биологически активных продуктов резорбции.
Материалы, удовлетворяющие перечисленным требованиям, смогут гарантировать консолидацию поврежденной кости в самые короткие сроки. В связи с чем ведутся активные разработки композиционных материалов на основе резорбируемых полимеров, наполненных различными по виду, природе, свойствам наполнителями. Совмещение двух материалов позволяет получать материалы с принципиально новыми свойствами, регулируемыми различными способами.
2.3.5. Хитин и хитозан. Хитин – это природный линейный аминосахарид (поли-N-ацетил-D-глюкозо-2-амин), который совместно с минеральными веществами, белками, меланинами образует скелет и внутренние структуры ракообразных и насекомых. Он не растворяется в воде и в органических растворителях, устойчив к действию слабых кислот и оснований, но может быть переведен в растворимую форму путем химической модификации [63].
Самым распространенным производным хитина является хитозан. Хитозан (CS) – катионный полисахарид основного характера, который получают путем деацетилирования хитина в результате его обработки 30–50%-ным водным раствором NaOH при температуре 110–140°С в течение 4–6 ч [64, 65].
Хитозан относится к группе природных полимеров, обладает высокой биологической активностью и совместимостью с тканями человека, обладает антимикробным и противовоспалительным действием в отношении грамположительных и грамотрицательных бактерий, грибов [66], не загрязняет окружающую среду, поскольку полностью разрушается ферментами микроорганизмов. Природный полимер также относится к четвертому классу токсичности, и при температурах более 220°C начинается его термодеструкция [64].
3. КОМПОЗИТЫ
Композиционный материал или композит (КМ) – сплошной продукт, состоящий из двух или более материалов, отличных друг от друга по форме и/или фазовому состоянию и/или химическому составу и/или свойствам, скрепленных, как правило, физической связью и имеющих границу раздела между матрицей и ее наполнителями [67].
Сочетание разнородных компонентов приводит к созданию нового материала, свойства которого отличаются от свойств отдельных его составляющих и зависят от следующих параметров:
– свойства самого наполнителя (форма, размер, химическая природа, ориентация в матрице и т.д.);
– свойства матрицы композита;
– взаимодействие компонентов на межфазной границе матрица–наполнитель (увеличение адгезии между наполнителем и матрицей приводит к повышению прочности композита [68]);
– способ переработки КМ.
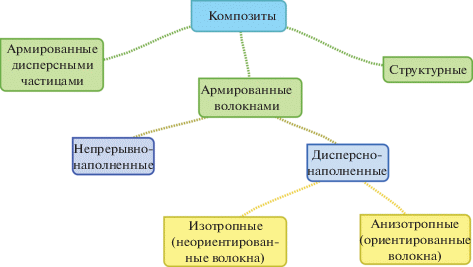
Биокомпозиты – это те же композиционные материалы, но удовлетворяющие всем требованиям, предъявляемым к материалам медицинского назначения в зависимости от места имплантации и выполняемых функций. Они могут состоять из матрицы и наполнителя на основе резорбируемых материалов (например, PCL/PLA/PGA–фосфатные стеклянные волокна, PLA/PGA/PCL–гидроксиаппатит и др. [69, 70]) либо из компонентов, один из которых (обычно армирующий элемент) биосовместим, но нерезорбируем (например, PLA/PGA–биостекло, PLA–углеродное волокно [71–73]), либо из компонентов, оба из которых нерезорбируемы. По этим признакам биокомпозиты делятся на полностью резорбируемые, частично резорбируемые и нерезорбируемые [14]. Помимо этого, КМ по виду наполнителя делятся на армированные волокнами, армированные дисперсными частицами и структурные. Композиты, армированные волокнами, в зависимости от размера волокон бывают дисперсно-наполненные и непрерывно-наполненные, а в зависимости от ориентации волокна – изотропные и анизотропные (рис. 1).
3.1. Композиты, армированные дисперсными частицами
В композитах, армированных дисперсными частицами, наполнитель в виде порошка, гранул и т.д. равномерно распределен в полимерной матрице. Простота переработки является основным преимуществом использования подобных наполнителей. Физико-механические характеристики получаемых на их основе композитов зависят от природы частиц, границы раздела между наполнителем и матрицей, размера частиц и их массовой доли. Например, известно, что модуль упругости полимеров может быть повышен путем включения жестких частиц, таких как керамика, стекло и металлы [64], в то время как силы адгезии между компонентами обеспечивают эффективную передачу напряжения от матрицы к частицам. Размер наполнителей также оказывает влияние на механические свойства композита: частицы меньшего размера обеспечивают большую прочность связи с матрицей благодаря увеличению межфазной поверхности [68, 74].
Одними из самых распространенных дисперсных наполнителей для биокомпозитов являются биокерамика и биостекла [68, 75, 76]. Биокерамика и биостекла бывают биоинертные, биоактивные и биоразлагаемые. Биоинертный материал стабилен в физиологической среде; материал, способный стимулировать определенную биологическую активность, например ремоделирование кости, относится к биологически активному [68, 74, 77, 78]; наконец, биоразлагаемые керамики способны поддаваться влиянию метаболизма клеток организма и распадаться на ионы кальция и фосфора, которые в дальнейшем входят в структуру регенерирующей костной ткани или выводятся из организма [77–79].
Гидроксиапатит – это керамический биоматериал, имитирующий минеральный состав костей у позвоночных, с химической формулой [Ca10(P04)6(ОН)2]. Скорость деградации HA является самой низкой по сравнению с другими видами фосфата кальция [59], при этом он проявляет хорошую биоактивность, биосовместимость и остеокондуктивность как в условиях in vitro, так и in vivo. Он способствует образованию биологически активного слоя гидроксикарбонат-апатита на поверхности частиц при имплантации в организм, имеющего структурный и химический состав, эквивалентный минеральной фазе естественной кости. Однако, несмотря на все преимущества, хрупкая природа HA ограничивает его использование как самостоятельного материала, именно поэтому HA используют в виде наполнителя в сочетании с резорбируемыми полимерами для получения биокомпозитов для костной пластики. Частицы HA в первую очередь улучшают механические свойства полимера, а также такие характеристики имплантатов, как остеоиндуктивность, остеокондуктивность и постепенная резорбция с передачей нагрузки на формирующуюся кость [80].
Помимо HA, для костной пластики представляет интерес другой фосфат кальция – трикальциевый фосфат (TCP) с химической формулой Ca3(PO4)2, который также используется в основном в виде порошка. Подобно НА он обладает превосходной способностью взаимодействовать с костью и сходством с минеральным компонентом кости [81]. Материалы на основе TCP обладают большей скоростью резорбции, а TCP применяется как отдельно, так и в двухфазных материалах НА/TCP, что позволяет контролировать скорость резорбции полимерных композитов на их основе [82]. Так, при исследовании композитов на основе PGA и TCP/HA в соотношении 80/20 и 20/80, имплантированных в область костного дефекта дистального метафиза и диафиза бедренной кости кроликов, выявлена большая скорость биодеградации образцов TCP/HA 80/20, а при использовании TCP/HA 20/80 – большая площадь костной ткани вокруг имплантированных композитов. При введении в состав полимера только НА значительные по размерам фрагменты нерезорбированного материала обнаружены в области имплантации через три месяца, что подтверждает замедленные темпы резорбции данной биокерамики, а введение в PGA только TCP способствовало его быстрой биодеградации, не соответствующей темпам формирования костной ткани. В целом все образцы проявляют выраженную остеоиндуктивность [83].
Фосфаты кальция обладают гидрофильной природой, что сказывается на их агрегации в гидрофобной полиэфирной матрице. Для повышения адгезии между гидрофильным наполнителем и гидрофобным полимером предложено [84] регулировать количество структурной и поверхностной воды в наполнителе и их размер. С этой целью был получен нано-НА со средним размером частиц 8 нм и удельной поверхностью 260 м2/г, а в качестве матрицы выбран полимер из ряда поли-α-гидроксикислот. Перед переработкой компонентов в композит частицы нано-НА подвергали отжигу при температурах 100, 600, 800 и 1200°С для удаления структурной и поверхностной воды. Результаты термического анализа показали, что при 200°С выделяется 5.8 мас. % воды, при 600°С – 1.5 мас. % с увеличением среднего размера частиц до 28 нм и уменьшением удельной площади поверхности до 72 м2/г. Дальнейшее увеличение температуры отжига выше 600°С привело к потере 0.3–0.5 мас. % с образованием больших спеченных частиц с небольшой удельной площадью поверхности; при обработке при температуре 1200°С размер частиц составлял более 1 мм. Таким образом, при температурах ниже 600°C содержание структурной воды в наночастицах было слишком высоким для обеспечения хорошей адгезии к полимеру, а при температурах выше 600°С наблюдалось образование крупных агрегатов, препятствующих образованию нанофазной дисперсии в полимерной матрице, что отразилось и на механических свойствах композитов, изученных после их получения путем прессования при давлении 65 МПа и температуре 165°C в течение 15 мин после предварительного проведения криомиллинга смеси нано-НА и полимера в жидком азоте (точка кипения 77.4 К). Криомиллинг – это процесс измельчения, при котором используемая жидкость поддерживается при криогенных температурах (ниже 120 К) и обычно взаимодействует с измельченным порошком. Прочность композита при сжатии оказалась сильно зависящей от температуры отжига наполнителя перед криомиллингом. Так, для НА, отожженного при температуре 200°C, прочность при сжатии композита составляла 30 МПа, а при 600°C – 110 МПа с модулем Юнга 6 ГПа. При температуре отжига выше 800°C прочность при сжатии композита снизилась до 30 МПа.
Агрегацию частиц, влияющую на механическую прочность композита, можно предотвратить выбором оптимальной степени наполнения. По данным исследования [85] получение композитов со степенью наполнения более 20 мас. % является крайне затруднительным из-за образования крупных агломератов. По мере увеличения степени наполнения полилактида TCP наблюдается уменьшение прочности на разрыв с одновременным увеличением размера частиц до 40 мкм. При этом максимальное значение достигается при 5 мас. % TCP, модуль упругости которого составляет 71 МПа (размер частиц 0.5 мкм) по сравнению с 20 мас. % TCP (51 МПа). При увеличении размера частиц образование магистральных трещин в материале становится менее затруднительным, поэтому прочность композита падает. Но несмотря на понижение прочности на разрыв, при увеличении степени наполнения модуль упругости композиционного материала повышается до 2 ГПа при содержании TCP 20.0 мас. % по сравнению с модулем упругости 1.5 ГПа, соответствующему ненаполненному полилактиду.
Помимо использования в качестве матрицы полимеров на основе поли-α-гидроксикислот, актуально использование природных резорбируемых полимеров, таких как хитозан, желатин, коллаген.
Композиты на основе хитозана, армированные частицами HA, могут быть получены методами in situ-полимеризации [86], осаждения [87, 88], электроспиннинга [89–91], литья и испарения растворителя [92], лиофилизации [93, 94], электрохимического осаждения [95], электрофоретического осаждения [96], мокрого формования [97] и т.д. Такие композиты обладают хорошей остеокондуктивностью и механической прочностью, на которую оказывают влияние взаимодействие между хитозаном и НА с образованием координационной связи, молекулярная масса полимера, а также содержание влаги в композите [98].
Так, в [88] были получены композиты методом осаждения. Для этого порошок CS растворяли в 2%-ном водном растворе уксусной кислоты и перемешивали в течение 5 ч до получения гомогенного 3%-ного раствора CS. Затем к раствору CS добавляли такое количество H3PO4, чтобы в итоге получить композит CS–НА с соотношением компонентов 0/100, 20/80, 30/70, 40/60, 50/50, 60/40, 70/30. Полученную смесь при интенсивном перемешивании медленно совмещали с 4%-ным этаноловым раствором Ca(OH)2 с поддержкой pH на уровне 10 добавлением раствора NaOH. Осадок, образовавшийся в результате 24-часовой выдержки ранее полученного раствора, отфильтровывали, промывали деионизированной водой и сушили в вакууме при температуре выше 80°С. Для получения пористых каркасов к готовому композитному порошку добавляли лимонную кислоту до образования пасты, из которой формовали каркасы необходимых размеров. Исследования структуры композитов показали, что синтезированный НА представляет собой кристаллические образования, равномерно распределенные в матрице. При взаимодействии –NH2-группы, первичной и вторичной группы –ОН хитозана и Ca2+ гидроксиапатита формируется координационная связь между ними, что влияет на механические свойства композитов. При сравнении механических свойств композитов HA–CS c различной степенью наполнения выявили, что максимальная прочность при сжатии наблюдается при соотношении CS/HA 30:70 и составляет 119.86 МПа.
Отсутствие цитотоксичности CS–HA-композитов, а также их способность стимулировать пролиферацию клеток остеобластов, изученная с использованием клеток MC3T3-E1 и L929, доказана в [99–101].
В [102] получен композит на основе CS и HA для внутренней фиксации перелома костей методом in situ-гибридизации, который решает проблему агрегации наноразмерных частиц в полимерной матрице. Композит получали следующим путем: к 100 мл 2%-ного водного раствора уксусной кислоты добавляли Ca(NO3)2 ⋅ 4H2O в количестве 0.625–1.25 г и KH2PO4 в количестве 0.215–0.43 г с последующим перемешиванием до полного растворения солей в кислоте. После этого при активном перемешивании к полученному раствору добавляли 5 г порошка CS со степенью деацетилирования 91% и перемешивали при комнатной температуре до получения гомогенного раствора полимера, который выдерживали в течение 6 ч для удаления пузырьков воздуха. После из раствора формировали стержень диаметром 4.5 мм и длиной 80 мм: раствор CS заливали в цилиндрическую стеклянную форму, которую опускали в 5%-ный водный раствор NaOH на 2 ч для осаждения (рис. 2а). По истечении заданного времени форму с полимером перемещали в свежий раствор NaOH той же концентрации на 8 ч, в результате образовался стержень в виде геля, который промывали в дистиллированной водe до нейтральной рН и удаляли стеклянную форму. Полученный стержень на основе композита CS–НА сушили при температуре 60°C в течение 24 ч для удаления влаги и формирования жесткой структуры (рис. 2б).
Рис. 2.
Фотографии цилиндрического стержня-композита на основе хитозана и гидроксиапатита: влажного гелевого стержня (а) и сухого стержня (б) [102].
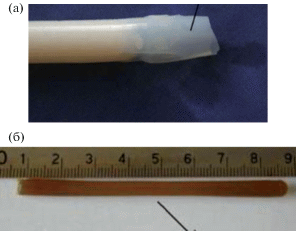
Результаты показали, что наночастицы HA хорошо диспергированы в матрице CS, а структура композита упорядочена. Прочность на изгиб и модуль упругости композита составили 86 МПа и 3.4 ГПа соответственно, что в 2 или 3 раза выше, чем у ПММА и костного цемента. Прочность на изгиб и модуль упругости CS–HA-композитов с содержанием наполнителя 5 мас. % выше, чем у стержня из чистого CS, кроме того, добавление HA также снижает коэффициент водопоглощения CS [102].
В связи с тем, что кость примерно на 22% состоит из коллагеновых волокон и на 70% из неорганического компонента, преимущественно состоящего из HA [9], создание биокомпозита на основе коллагена (Col)–HA для костной пластики представляется весьма обоснованным. Существует 28 основных белков, которые называются коллагенами, они в свою очередь разделены на шесть основных групп. В костной ткани встречается в основном коллаген I типа [103], обладающий хорошей биосовместимостью и благоприятно взаимодействующий с клетками и другими органическими макромолекулами в организме [104]. Добавление в коллагеновые пористые матрицы наночастиц HA увеличивает их механическую прочность в связи образованием межмолекулярных Н-связей между коллагеном и HA. Композиты Col–HA демонстрируют повышенную цитосовместимость, подтвержденную исследованиями in vitro, а именно: прикрепление и пролиферацию клеток остеосаркомы MG63, MC3T3, остеобластов и фибробластов L-929 [105–107].
Наличие частиц биокерамики в составе композита влияет на пористость матриц для костной инженерии. При получении матриц методом 3D-печати из “чернил” на основе композиционного гидрогеля с составом 2% альгината, 10% водного раствора желатина с 10–30 мас. % гранулированного (100–200 мкм) TCP установлено, что общая пористость образцов снижалась с увеличением доли фосфата кальция в композите, составляя 81.98 и 63.92% для 10 и 30 мас. % TCP соответственно. При сравнительном исследовании механических свойств конструкций установлено, что прочность при сжатии монотонно возрастала, а прочность на растяжение снижалась с увеличением доли гранул TCP в композитах [108]. При имплантации трехмерных конструкций состава альгинат–TCP в дефект большой берцовой кости крыс на ранних (2 нед) сроках выявлена достаточно тонкая (до 8–10 слоев клеток) фиброзная капсула, прорастающая кровеносными сосудами. С первых недель после имплантации отмечен активный процесс заполнения пространств между гранулами TCP и фрагментами альгината рыхлой волокнистой соединительной тканью. Через 8–12 нед отмечалось появление в новообразованной соединительной ткани гигантских клеток инородных тел в сочетании с уменьшением размеров гранул TCP, что указывало на начало процесса биорезорбции образцов. Добавление в состав композита желатина ускоряло процесс его биорезорбции и замещения имплантата соединительной тканью, что было заметно уже на ранних сроках наблюдения и четко вырисовывалось к 12-й неделе [108].
Таким образом, дисперсные наполнители увеличивают время резорбции рассасывающихся полимеров, проявляют хорошую биоактивность, биосовместимость и остеокондуктивность, повышают механические свойства полимера.
3.2. Композиты на основе волокнистых наполнителей
Волокнистые наполнители могут входить в состав композита как в виде непрерывных волокон, так и в виде дисперсных (коротких) волокон, в связи с чем материалы на их основе обладают широким спектром механических и биологических свойств и могут соответствовать свойствам и структуре натуральной кости [109]. Например, подобие анизотропной природе кости (продольные механические свойства кости больше, чем в поперечном направлении) может быть достигнуто путем армирования матрицы непрерывными однонаправленными волокнами или волокнами на основе кальций фосфатов [109–111]. В [112–114] были разработаны биорезорбируемые композиты на основе PLLA и PDLLA, армированные биорезорбируемыми волокнами на основе метафосфата кальция (CMP). Волокнистые композиты PDLLA–CMP продемонстрировали модуль упругости при изгибе 6.4–12.8 ГПа и прочность при изгибе 83 МПа, однако в связи с быстрой скоростью резорбции использование подобных материалов на практике ограничено.
На физико-механические свойства армированных волокнами композитов влияет отношение длины к диаметру наполнителей [115]: механические свойства увеличиваются с увеличением соотношения, следовательно, армирующая эффективность волокон значительно выше, чем у частиц. Так, в [72] получены костные пластинки PLLA, усиленные рублеными и непрерывными углеродными волокнами, с их содержанием в полимере 56 об.%. Результаты показали, что более высокие механические характеристики (прочность и модуль упругости) присущи композитам, усиленным непрерывными волокнами.
В костной хирургии известны примеры использования различных типов волокон, таких как углерод [37, 71, 116], биостекло [73, 74, 117, 118], волокна на основе фосфатного стекла [69, 70, 119–121] и рассасывающихся полимеров [122, 123].
В [124] разработаны пластины на основе PLLA, армированными тканью на основе PGA. Подобное армирование увеличило модуль изгиба с 4 до 6 ГПа и ударопрочность в 2–7 раз. При имплантировании в неостеотомизированную голень овцы пластины на основе PLLA не выдержали приложенной нагрузки уже через месяц, в то время как армированные пластины сохраняли свою целостность в течение 7 мес, но имели небольшие трещины в местах крепления металлическими винтами. Подобный композит не подходит для фиксации остеотомий трубчатых костей из-за недостаточной прочности.
При формовании таких композитов необходимо подбирать материал матрицы и волокон таким образом, чтобы температура плавления последних была выше температуры переработки полимера. Так, известна попытка получения методом компрессионного формования композитов на основе аморфного PLDLLA 70:30, армированного волокнами PGA, PLLА, PDLA [125]. Температура плавления PGA (220–225°C) выше температуры переработки композита на 20°C, поэтому композит PLDLLA–PGA удалось получить, чего не сказать о PLDLLA–PLLА-композитах, у которых термостабильность наполнителя оказалась значительно ниже. Для устранения этого недостатка наполнители можно получать в виде гибридной пряжи (совмещение волокон на основе перечисленных выше полимеров с волокнами на основе материала матрицы). Так, в исследованиях [125–127] волокна PLDLLA 70:30, сформованные из расплава и вытянутые в требуемое количество раз, смешаны с волокнами на основе PLLA и PDLA (или получена ткань на их основе) и совмещены с матрицей (PLDLLA 70:30) с получением ориентированного композита в виде штифта. Соотношение волокно/матрица составляло от 45:55 до 60:40. Известно, что прочность на изгиб остается стабильной до 8 нед после имплатации in vivo, после чего наблюдается резкое снижение этого значения, начиная с сохранения менее 50% от первоначальных значений на 12-й неделе. Исследования реакции организма и образования костной ткани в зоне имплантации такого композита выявили следующее: через месяц вокруг штифтов наблюдается образование фиброзной и рыхлой соединительной ткани; через 6 мес обнаружены участки новообразованной и зрелой кости, волокнистая соединительная ткань с несколькими макрофагами и гигантскими клетками с сохранением примерно 70% имплантата (макрофаги начали фагоцитоз олигомеров и/или низкомолекулярных частиц имплантата), почти весь матрикс был заменен фиброзной гиперклеточной соединительной тканью; через 12 мес выявлено наличие участков зрелой кости, большое количество макрофагов и гигантских клеток вокруг частицы в процессе фагоцитоза и почти 90% полимерной матрицы рассосалось с высвобождением волокон.
Еще один пример приведен авторами [128], которые получили композит в виде гибридной ткани на основе PLLA- и CS-волокон. Для этого предварительно получали волокна на основе PLLA сухо-мокрым способом формования, а волокна на основе CS – мокрым способом. PLLA-волокна получали следующим образом: гранулы PLLA сначала растворяли в хлороформе, а затем формовали волокна продавливанием раствора PLLA через фильеру с отверстием диаметром 0.5 мм и длиной 7 мм, после чего, пройдя через воздушный зазор, составлявший 5 см, волокна попадали в спиртовую осадительную ванну с температурой 40–60°C, а вытяжку осуществляли в ванне с силиконовым маслом при 135°С. CS-волокна получали следующим образом: CS с молекулярной массой 4.5⋅105 г/моль и степенью деацетилирования 80% растворяли в уксусной кислоте при комнатной температуре, затем раствор продавливали через фильеру с количеством отверстий 500 в осадительную ванну, нагретую до 30°С и состоящую из 10%-ного раствора гидроксида натрия. Затем волокна промывали водой при 40°С и сушили при комнатной температуре. Из сформованных волокон получали ткань, которая была стерилизована оксидом этилена. При изучении изменения механических свойств при резорбции тканей PLLA–CS in vitro было обнаружено, что их начальная прочность больше, чем у ткани только из PLLA-волокон. Однако после 6 мес наблюдалась противоположная картина: прочность ткани PLLA–CS сохранилась на 35%, в то время как прочность PLLA-тканей сохранилась на 50%. Также при изучении морфологии клеток на ранних стадиях культивирования наблюдалась хорошая адгезия между остеобластами и PLLA–СS-тканью, что свидетельствует о биосовместимости и возможности ее применения в качестве носителя остеобластов для восстановления поврежденной костной ткани.
Хитозановые волокна могут вводиться в состав полимера для улучшения механических свойств, увеличения пористости и биологической активности каркасов для костной инженерии. Так, в [129] получены композиты PLLA–HA–CaSiO3, армированные рублеными CS-волокнами: PLLA (8 мас. %) растворяли в диоксане, предварительно разведенном дистиллированной водой в соотношении 10:1. К полученному раствору при перемешивании добавляли HA, CaSiO3 и CS-волокна, после чего суспензию выдерживали при –40°C в течение 48 ч и при 8°C в течение 2 ч с последующей сублимационной сушкой в течение 48 ч. При изучении полученных композитов с помощью сканирующего электронного микроскопа выявлено образование CS-волокнами сети взаимосвязанных неориентированных волокон в структуре композита (по типу нетканого материала) с формированием в стенках макропор размером 50–250 мкм и многочисленных микропор размером менее 5 мкм. Прочность при сжатии и пористость каркасов, армированных CS-волокнами, увеличилась до 6.8 МПа и 72.8% по сравнению с каркасами без волокон, которым соответствуют значения 5 МПа и 64.8% соответственно. Также выявлено, что наличие CaSiO3 и CS-волокон увеличивало значение кислотности среды, объясняемое тем, что хитозан и присутствии большего количества щелочных ионов нейтрализует молекулы кислоты, образующиеся в результате деградации PLLA, что позволяет избежать воспалительных процессов и стимулирует образование гидроксикарбонат-апатита, способствующего восстановлению костной ткани.
Несмотря на то что PLA известен своей биосовместимостью, на поздних стадиях резорбции PLA наблюдаются воспалительные реакции in vivo, связанные с увеличением содержания продуктов резорбции [130]. Добавление HA, TCP или фосфатного стекла (PG) к PLLA улучшает биосовместимость полимера за счет выделения ионов Ca, P в процессе резорбции и буферизации кислотных продуктов разложения PLA [131].
В отличие от HA и TCP фосфатное стекло легко перерабатывается в волокна (PGF), армирование матрицы которыми улучшает как биосовместимость, так и механические свойства композита [69, 70, 120]. Существуют три основных оксида, входящих в состав стекол: SiO2, B2O3 и P2O5. В фосфатных стеклах основным оксидом является пентоксид фосфора, а основной структурной единицей – тетраэдрический фосфат-анион (${\text{PO}}_{4}^{{3 - }}$) [132].
Фосфатные стекла обладают сочетанием следующих характеристик [60, 120, 133]:
– они полностью резорбируемы в среде организма;
– их химический состав близок к составу минеральной фазы кости;
– биосовместимы и биологически активны;
– могут быть переработаны в волокна с удовлетворительными механическими свойствами (модуль упругости при растяжении ~74 ГПа и прочность при растяжении ~400 МПа [134]);
– легко контролировать скорости резорбции, изменив их состав: с увеличением содержания оксида фосфора увеличивается и скорость резорбции. Например, стекло P40 с содержанием 40P2О5–24MgO–16CaO–16Na2О–4Fe2О3 мол. % рассасывается медленнее стекла P50 с содержанием 50P2О5–40CaO–5 Na2О–5Fe2О3 мол. %.
Так, авторы [135] исследовали реакцию клеток костного мозга человека на фосфатное стекло с составом 45P2О5–3SiO2–26CaO–7MgO–15Na2О–4K2О мол. %. Стекло показало хорошую адгезию и дифференцировку клеток, что по данным некоторых исследователей связано с наличием достаточного количества CaO [136]. На поверхности стекла был образован слой гидроксикарбонат-апатита, что свидетельствует о его биологической активности. Отрицательно на пролиферацию клеток влияет увеличение в составе стекла Na2О (ухудшает резорбцию стекол), поэтому можно утверждать, что скорость резорбции стекла прямо пропорциональна биологической активности [119, 131].
Известны попытки получения пластин на основе PLA и PGF с различными содержаниями волокон, их ориентации и размера. В целом средние значения прочности и модуля упругости при изгибе однонаправленных композитов с объемной долей волокна от 30 до 55% составляли 115 и 170 МПа (прочности), 16 и 15 ГПa (модуля упругости) соответственно [119, 120]. Кроме того, с увеличением механических свойств увеличивается биологическая активность этих композитов. При культивировании мезенхимальных стромальных клеток человека на поверхности PLLA–PGF-композитов с постоянным контролем метаболической активности, выработки щелочной фосфатазы и минерализации в течение трех недель выявлено, что PGF не оказывает существенного влияния на пролиферацию или дифференцировку клеток, но проявляет остеоиндуктивные свойства, способствуя минерализации клеток на поверхности материала. Таким образом, PLLA–PGF-композит обладает хорошими механическими свойствами и является биологически активным, что делает его перспективным материалом для разработки на его основе костных имплантатов [137].
С помощью PGF удалось улучшить механические характеристики такого полимера, как PCL, который обладает низкими механическими показателями, однако армирование PGF сделало PCL перспективным полимером в черепно-лицевой хирургии [69, 138].
3.3. Структурные композиты
К структурным композитам относятся полимеры с так называемой самоусиленной или самоукрепленной (SR) (“self-reinforced”) структурой. Сама технология SR заключается в трансформировании надмолекулярной структуры полимеров в ориентированные полимерные цепи, которые в случае частично кристаллических полимеров образовывают такие морфологические структуры, как микрофибриллы, макрофибриллы, кристаллы шиш-кебаба и т.д. [126, 139]. Самоусиление проводится при температурах выше температуры стеклования и ниже температуры плавления. Особенностью элементов армирования полимерных SR-композитов является высокая степень молекулярной ориентации, которая делает элементы жесткими и прочными в направлении их длинной оси, что также придает высокую прочность и модуль упругости макроско-композиту в направлении ориентации. Прочность и модуль упругости композита SR зависят от молекулярной массы полимера и степени вытяжки [140]. Разработка биодеградируемых SR-имплантатов началась с использования полимеров на основе PLA и PGA, которые после трансформации надмолекулярной структуры сохраняют прочность на изгиб (в частности, SR–PLLA примерно до 245 МПа) в течение 12 нед без наличия воспалительной реакции даже через 27 мес после операции, что изучено с участием пациентов с переломами небольших фрагментов или остеотомиями [139, 141].
Положительные результаты наблюдались и при ориентации неупорядоченной надмолекулярной структуры в фибриллярную для штифта на основе PLDLLA 70:30, обладающего прочностью и модулем упругости на изгиб 90–124 МПа и 3.6–3.9 ГПа в неориентированном состоянии, т.е. ниже тех же параметров кортикальной кости (прочность 140–200 МПа и модуль упругости 3–30 ГПа [10, 11, 14]). Штифты подвергали ориентации 3 (SR-3), 5 (SR-5) и 7 (SR-7) раз при температуре 58°С и скорости вытяжки 25 мм/мин. Конечный диаметр стержней составлял 4.5 мм. Очевидно, что с увеличением степени вытяжки увеличиваются механические свойства: после ориентации SR-3, SR-5, SR-7 прочность при изгибе составляла 129.7 ± 3.9, 143.9 ± 2.6 и 164.1 ± ± 1.9 МПа с увеличением модуля упругости примерно на 13, 21 и 31% соответственно. При этом хрупкое разрушение (раскол на несколько частей), характерное для невытянутых полимеров, сменялось разрушением вязкого характера (без фрагментации) [142].
При исследовании биосовместимости SR–PLLA с молекулярной массой 45–65 кДа и кристалличностью 50% многочисленные исследования продемонстрировали клинически выраженную отрицательную реакцию тканей на полимер в 0.2% случаев [43]. Эти незначительные осложнения появлялись через 3–5 лет после имплантации, что предположительно соответствует резорбции кристалличных участков PLLA-имплантата [143]. Эти предположения подтверждаются результатами исследований [144, 145], в которых описано опухание места имплантации через 3–5 лет при использовании имплантатов с высокой молекулярной массой (до 106 кДа), что, очевидно, заключается в том, что SR–PLLA распадается на частицы с высокой степенью кристалличности, при поглощении которых макрофагами происходит высвобождение химических медиаторов, ответственных за воспаление, поэтому иногда наблюдается поздняя клинически выраженная реакция на инородное тело [145].
Следовательно, костные имплантаты на основе SR-полимеров обладают механическими свойствами, близкими к механическим свойствам кости, и лишь изредка вызывают отрицательную реакцию со стороны организма, что делает их безопасной и эффективной альтернативой металлическим имплантатам.
ЗАКЛЮЧЕНИЕ
В костной пластике использование имплантатов на основе биорезорбируемых полимеров, биокерамики, биостекол и т.д. для замены металлических конструкций ограниченно в связи с невыполнением ряда требований, основным из которых являются их низкие механические характеристики. Но с другой стороны, использование этих материалов в костной пластике является весьма перспективным из-за отсутствия необходимости проведения повторного хирургического вмешательства с целью удаления имплантата, выполнившего свои функции. Для решения данной проблемы в настоящее время активно разрабатываются композиционные материалы на основе этих же материалов, основным преимуществом которых является приобретение принципиально новых или улучшение имеющихся свойств путем совмещения нескольких компонентов.
В обзоре рассмотрены биорезорбируемые композиты с различными видами наполнителей, каждый из которых имеет свои достоинства и недостатки. Одним из основных вопросов при выборе того или иного вида композита являются скорость его биорезорбции и потери механических свойств. Некоторые биорезорбируемые композиты не сохраняют свои механические свойства до полной консолидации перелома, значительно различающейся в зависимости от тяжести травмы, возраста и индивидуальных особенностей организма. Также немаловажен вопрос образования продуктов реакции биорезорбции композитов, которые в значительных количествах могут накапливаться в тканях организма и негативно влиять на клеточные процессы. В силу химической инертности и устойчивости металлические сплавы лишены подобных недостатков.
В ближайшем будущем биорезорбируемые композитные имплантаты заменят традиционные металлические устройства. Преимущества биорезорбируемых полимерных композиционных материалов дополняются остеогенным потенциалом, который может усиливаться физиологически активными компонентами, ускоряющими или облегчающими заживление, а устранение указанных выше недостатков стимулирует проведение новых исследований с целью поиска новых материалов, а также открывает путь для будущих исследований в области биотехнологии, где технология получения материалов объединена с медициной для создания синтетических устройств, преобразующих или заменяющих живые функциональные ткани или органы.
Работа выполнена при поддержке Российского научного фонда (грант № 19-73-30003).
Список литературы
Hing K.A. // Phil. Trans. R. Soc. Lond. A. 2004. № 362. P. 2821. https://doi.org/10.1098/rsta.2004.1466
Parikh S.N. // J. Orthopedics. 2002. № 25 (11). P. 301.
Тихилов Р.М. // Травматология и ортопедия России. 2011. № 2 (60). С. 153. https://doi.org/10.21823/2311-2905-2011-0-2-153-159
Калита В.И., Маланин Д.А., Мамаева В.А. и др. // Вестник ВолГМУ. 2009. № 4 (32). С. 17.
Карлов А.В., Хлусов И.А. // Гений ортопедии. 2003. № 3. С. 46.
Попков А.В. // Гений ортопедии. 2014. № 3. С. 94.
Разина И.С., Чернова В.И., Колоколов М.А., Мусин И.Н. // Вестн. Казан. технол. ун-та. 2014. Т. 17. № 16. С. 162.
Tortora G. Introduction to the human body. New York: Harper Row, 1988. 656 p.
Холл Дж.Э. Медицинская физиология по Гайтону и Холлу. М.: Логосфера, 2018. 1328 с.
Athanasiou K.A., Zhu C., Lanctot D.R. et al. // Tissue Engineering. 2000. № 6 (4). P. 361. https://doi.org/10.1089/107632700418083
Nather A. Bone grafts and bone substitutes: basic science and clinical applications. Singapore: World Scientific Pub Co Inc, 2005. 592 p. https://doi.org/10.1142/5695
Evans F.G. // Bull. NY Acad. Med. 1973. № 49 (9). P. 751.
An Y., Draughn R. Mechanical Testing of Bone and the Bone-Implant Interface. Boca Raton: CRC Press, 1999. 648 p. https://doi.org/10.1201/9781420073560
Ramakrishna S., Mayer J., Wintermantel E., Leong K.W. // Compos. Sci. Technol. 2001. № 61 (9). P. 1189. https://doi.org/10.1016/S0266-3538(00)00241-4
Schmutz P., Quach-Vu, Gerber I. // Electrochem. Soc. Interface. 2008. № 17 (2). P. 35.
Yoshimitsu O., Emiko G., Takeshi M., Kihei K. // Biomaterials. 2004. № 25 (28). P. 5913. https://doi.org/10.1016/j.biomaterials.2004.01.064
Скрябин В.Л. Дис. “Эндопротезы из углеродного композиционного материала” … д-ра мед. наук. Ярославль, ПГМУ им. ак. Е.А. Вагнера,1993.
Hughes C.W., Page K., Bibb R. et al. // Br. J. Oral. Maxillofac. Surg. 2003. № 41. P. 50. https://doi.org/10.1016/s0266435602002498
Schlickewei W., Schlickewei C. // J. Macromol. Symp. 2007. № 253. P. 10. https://doi.org/10.1002/masy.200750702
Агаджанян В.В., Пронских А.А., Демина В.А. и др. // Политравма. 2016. № 4. С. 85.
Eglin D., Alini M. // European Cells and Materials. 2008. № 16. P. 80. https://doi.org/10.22203/ecm.v016a09
Bozkurt M., Tigaran C., Dalstra M. et al. // J. Foot Ankle Surg. 2004. № 43. P. 138. https://doi.org/10.1053/j.jfas.2004.03.010
Volova T.G., Sevastianov V.I., Shishatskaya E.I. Polyhydroxyalkanoates biodegradable polymers for medicine. Krasnoyarsk: Platina Publishers, 2006. 288 p.
Baino F. // Acta Biomater. 2011. № 7. P. 3248. https://doi.org/10.1016/j.actbio.2011.05.016
Woo S.L., Akeson W.H., Coutts, R.D. et al. // J. Bone Jt. Surg. 1976. № 15-A. P. 190.
Brown S.A., Vandergrift J. // Biomater. Med. Dev. Art. Org. 1981. № 9 (1). P. 27. https://doi.org/10.3109/10731198109117598
Sziver J.A., Weatherly G.C., Pilliar R.M., Cameron H.U. // J. Biomed. Mater. Res. 1981. № 15(6). P. 853. https://doi.org/10.1002/jbm.820150610
Gillett N., Brown S.A., Dumbleton J.H., Pool R.P. // Biomaterials. 1985. № 6 (2). P. 113. https://doi.org/10.1016/0142-9612(85)90074-2
Tonino A.J., Folmer R.C. // Clin. Mater. 1987. № 2. P. 275.
Gogolewski S. // Injury. 2000. № 31. P. 28. https://doi.org/10.1016/s0020-1383(00)80020-0
Navarro M., Michiardi A., Castano O., Planell J.A. // J. R. Soc. Interface. 2008. № 5 (27). P. 1137. https://doi.org/10.1098/rsif.2008.0151
Maman P., Nagpal M., Aggarval G. // Nanobiomater. Tissue Eng. 2019. P. 121. https://doi.org/10.1016/B978-0-12-816909-4.00006-3
Hermawan H., Ramdan D., Djuansjah J.R.P. Metals for Biomedical Applications, Biomedical Engineering – From Theory to Applications. Rijeca: InTech, 2011. 486 p. https://doi.org/10.5772/19033
Гомзяк В.И., Демина В.А., Разуваева Е.В. и др. // Тонкие химические технологии. 2017. Т. 12. № 5. С. 5. https://doi.org/10.32362/2410-6593-2017-12-5-5-20
Ashammakhi N., Peltoniemi H., Waris E. // Plast. Reconstr. Surg. 2001. № 108. P. 167. https://doi.org/10.1097/00006534-200107000-00027
Ashammakhi N., Suuronen R., Tiainen J. // J. Craniofac. Surg. 2003. № 14. P. 247. https://doi.org/10.1097/00001665-200303000-00021
Daniels A.U., Melissa K.C., Kirk P.A. // J. Appl. Biomater. 1990. № 1. P. 57. https://doi.org/10.1002/jab.770010109
Sodergard A., Stolt M. // Prog. Polym. Sci. 2002. № 27 (6). P. 1123. https://doi.org/10.1016/S0079-6700(02)00012-6
Middleton J.C., Tipton A.J. // Biomaterials. 2000. № 21 (23). P. 2335. https://doi.org/10.1016/s0142-9612(00)00101-0
Waris E., Konttinen Y.T., Ashammakhi N. et al. // Expert Rev. Med. Devices. 2004. № 1 (2). P. 229. https://doi.org/10.1586/17434440.1.2.229
Nair L.S., Laurencin C.T. // Prog. Polym. Sci. 2007. № 32. P. 762. https://doi.org/10.1016/j.progpolymsci.2007.05.017
Vasenius J., Vainionpää S., Vihtonen K. // Biomaterials. 1990. № 11. P. 501. https://doi.org/10.1016/0142-9612(90)90065-x
Böstman O.M., Pihlajamäki H.K. // Clin. Orthop. 2000. № 371. P. 216.
Vroman I., Tighzert L. // Materials. 2009. № 2. P. 307. https://doi.org/10.3390/ma2020307
Maharana T., Mohanty B., Negi Y.S. // Prog. Polym. Sci. 2009. № 34. P. 99. https://doi.org/10.1016/j.progpolymsci.2008.10.001
Ramot Y., Zada M.H., Domb A.J., Nyska A. // Adv. Drug Deliv. Rev. 2016. № 107. P. 153. https://doi.org/10.1016/j.addr.2016.03.012
Pohjonen T., Heponen V.P., Pellinen M. et al. // Trans. SOC. Biomater. 1988. № 11.
Tiainen J., Soini Y., Tormala P. et al. // J. Biomed. Mater. Res. 2004. № 70B. P. 49. https://doi.org/10.1002/jbm.b.30013
Holland S.J., Tighe B.J. // Adv. Pharmaceutical Sci. 1992. № 6. P. 101.
Gunatillake P.A., Adhikari R. // Eur. Cells Mater. 2003 № 5. P. 1. https://doi.org/10.22203/ecm.v005a01
Chandra R., Rustgi R. // Prog. Polym. Sci. 1998. № 23. P. 1273.
Dash T.K., Konkimalla V.B. // J. Control. Release. 2012. № 158 (1). P. 15. https://doi.org/10.1016/j.jconrel.2011.09.064
Estelles J.M., Vidaurre A., Duenes J.M.M. et al. // J. Mater. Sci. Mater. Med. 2008. № 19 (1). P. 189. https://doi.org/10.1007/s10856-006-0101-2
Lowry K.J., Hamson K.R., Bear L. et al. // J. Biomed. Mater. Res. A. 1997. № 36. P. 536. https://doi.org/10.1002/(sici)1097-4636(19970915)36:4<536::aid-jbm12>3.0.co;2-8
Simon J.A., Ricci L., Cesare D. // Am. J. Orthop. 1998. № 26. P. 665.
Maurus P.B., Kaeding C.C. // Operative Techniques in Sports Medicine. 2004. № 12 (3). P. 158.
Eshraghi S., Das S. // Acta Biomater. 2010. № 6 (7). P. 2467. https://doi.org/10.1016/j.actbio.2010.02.002
Sabir M., Xu X., Li L. // J. Mater. Sci. 2009. № 44 (21). P. 5713. https://doi.org/10.1007/s10853-009-3770-7
Rezwan K., Chen Q.Z., Blaker I.I., Boccaccini A.R. // Biomaterials. 2006. № 27 (18). P. 3413. https://doi.org/10.1016/j.biomaterials.2006.01.039
LeGeros RZ. // Clin. Orthop. Relat. Res. 2002. № 395. P. 81. https://doi.org/10.1097/00003086-200202000-00009
Миронов С.П., Гинцбург А.Л., Еськин Н.А. // Сборник тезисов IX съезда травматологов-ортопедов: в 3-х т. Саратов, 2010. Т. III. С. 1122.
Pezzatini S., Solito R., Morbidelli L. et al. // J. Biomed. Mater. Res. A. 2006. № 76(3). P. 656. https://doi.org/10.1002/jbm.a.30524
Chatelet C., Damour O., Domard A. // Biomaterials. 2001. № 3 (22). P. 261. https://doi.org/10.1016/s0142-9612(00)00183-6
Dash M., Chiellini F., Ottenbrite R.M., Chiellini E. // Prog. Polym. Sci. (Oxford). 2011. № 8(36). P. 981. https://doi.org/10.1016/j.progpolymsci.2011.02.001
Камская В.Е. // Научное обозрение. Биологические науки. 2016. № 6. С. 36.
Ueno H., Mori T., Fujinaga T. // Adv. Drug Deliv. Rev. 2001. № 52 P. 105. https://doi.org/10.1016/s0169-409x(01)00189-2
ГОСТ 32794-2014 Композиты полимерные. Термины и определения. Введ. 2015-09-01. М.: Стандартформ, 2015. 98 с.
Fu S., Feng X., Lauke B., Mai Y.-W. // Composites. B. 2008. № 39 (6). P. 933. https://doi.org/10.1016/j.compositesb.2008.01.002
Ahmed I., Parsons A.I., Palmer G. et al. // Acta Biomater. 2008. № 4 (5). P. 1307. https://doi.org/10.1016/j.actbio.2008.03.018
Ahmed I., Cronin P.S., Abou Neel E.A et al. // J. Biomed. Mater. Res. B. 2009. № 898 (1). P. 18. https://doi.org/10.1002/jbm.b.31182
Wan Y.Z., Wang Y.L., Xu X.H., Li Q.Y. // J. Appl. Polim. Sci. 2001. № 82 (1). P. 150. https://doi.org/10.1002/app.1834
Zimmerman M., Alexander H., Parsons R., Bajpai P.K. // Am. Chem. Soc. 1991. P. 132.
Jiang G., Evans M.E., Jones I.A. et al. // Biomaterials. 2005. № 26 (15). P. 2281. https://doi.org/10.1016/j.biomaterials.2004.07.042
Boccaccini A.R., Erol M., Stark W. et al. // Compos. Sci. Technol. 2010. № 70(13). P. 1764. https://doi.org/10.1016/j.compscitech.2010.06.002
Lu J., Dejou M., Descamps M., Koubi G. et al. // J. Biomed. Mater. Res. 2002. № 63(4). P. 408. https://doi.org/10.1002/jbm.10259
Dorozhkin S.V. // Biomaterials. 2010. № 31 (7). P. 1465. https://doi.org/10.1016/j.biomaterials.2009.11.050
Misra S.K., Ansari T., Mohn D. et al. // J. R. Soc. Interface. 2010. № 7 (44). P. 453. https://doi.org/10.1098/rsif.2009.0255
Misra S.K., Nazhat S.N., Valappil S.P. et al. // Biomacromolecules. 2007. № 8 (7). P. 2112. https://doi.org/10.1021/bm0701954
Ohtsuki C., Kamitakahara M., Miyazaki T. // J. R. Soc. Interface. 2009. № 6 (3). P. 5349. https://doi.org/10.1098/rsif.2008.0419.focus
Ramesh N., Moratti S.C., Dias G.J. // Soc. Biomater. 2017. № 00B. P. 1. https://doi.org/10.1002/jbm.b.33950
Ambard A., Mueninghoff J. // J. Proshodont. 2006. № 15. P. 321. https://doi.org/10.1111/j.1532-849X.2006.00129.x
Пахалюк В.И., Калинин С.И., Олиниченко Г.Д. // Ортопедия, травматология. 2003. № 4. С. 162.
Бенгус Л.М., Дедух Н.В., Малышкина С.В. // Украинский морфологичный альманах. 2009. Т. 7. № 3. С. 11.
Pietrzykowska E., Mukhovskyi R., Chodara A. // Mater. Lett. 2019. № 236. P. 625. https://doi.org/10.1016/j.matlet.2018.11.018
Dong Q., Chow L.C., Wang T. et al. // Colloids Surf. A. 2014. № 457. P. 256. https://doi.org/10.1016/j.colsurfa.2014.05.047
Wang X., Tan Y., Zhang B. et al. // J. Biomed. Mater. Res. A. 2009. № 89. P. 1079. https://doi.org/10.1002/jbm.a.32087
Wang X., Ma J., Wang Y., He B. // Biomaterials. 2002. № 23 (21). P. 4167. https://doi.org/10.1016/s0142-9612(02)00153-9
Li Zh., Yubao L., Aiping Y. et al. // J. Mater. Sci.: Mater. Med. 2005. № 16. P. 213. https://doi.org/10.1007/s10856-005-6682-3
Teng S., Lee E., Yoon B. et al. // J. Biomed. Mater. Res. A. 2009. № 88. P. 569. https://doi.org/10.1002/jbm.a.31897
Zhang Y., Venugopal J.R., El-Turki A. et al. // Biomaterials. 2008. № 29 (32). P. 4314. https://doi.org/10.1016/j.biomaterials.2008.07.038
Yamaguchi I., Tokuchi K., Fukuzaki H. et al. // J. Biomed. Mater. Res. 2001. № 55 (1). P. 20. https://doi.org/10.1002/1097-4636(200104)55:1<20::aid-jbm30>3.0.co;2-f
Xianmiao C., Yubao L., Yi Z. et al. // Mater. Sci. Eng. C. 2009. № 29 (1). P. 29. https://doi.org/10.1016/j.msec.2008.05.008
Manjubala I., Ponomarev I., Wilke I., Jandt K. // J. Biomed. Mater. Res. A. 2008. № 84 (1). P. 7. https://doi.org/10.1002/jbm.b.30838
Thein-Han W., Misra R. // Acta Biomater. 2009. № 5 (4). P. 1182. https://doi.org/10.1016/j.actbio.2008.11.025
Huang Z., Dong Y., Chu C., Lin P. // Mater. Lett. 2008. № 62 (19). P. 3376. https://doi.org/10.1016/j.matlet.2008.03.045
Pang X., Casagrande T., Zhitomirsky I. // J. Colloid. Interface Sci. 2009. № 330 (2). P. 323. https://doi.org/10.1016/j.jcis.2008.10.070
Matsuda A., Ikoma T., Kobayashi H., Tanaka J. // Mater. Sci. Eng. C. 2004. № 24. P. 723. https://doi.org/10.1016/j.msec.2004.08.047
Venkatesan J., Kim S.-K. // Mar. Drugs. 2010. № 8 (8). P. 2252. https://doi.org/10.3390/md8082252
Oliveira J., Rodrigues M., Silva S. et al. // Biomaterials. 2006. № 27 (36). P. 6123. https://doi.org/10.1016/j.biomaterials.2006.07.034
Xu H., Simon C. // Biomaterials. 2005. № 26 (12). P. 1337. https://doi.org/10.1016/j.biomaterials.2004.04.043
Yuan H., Chen N., Lu X., Zheng B. // J. Nanjing Med. Univ. 2008. № 22 (6). P. 372. https://doi.org/10.1016/S1007-4376(09)60009-5
Hu Q., Li B., Wang M., Shen J. // Biomaterials. 2004. № 25 (5). P. 779. https://doi.org/10.1016/s0142-9612(03)00582-9
Sherman V.R., Yang W., Meyers M.A. // J. Mech. Behav. Biomed. Mater. 2015 № 52. P. 22. https://doi.org/10.1016/j.jmbbm.2015.05.023
Geiger M. // Adv. Drug Deliv. Rev. 2003. № 55 (12). P. 1613. https://doi.org/10.1016/j.addr.2003.08.010
Islam M.S., Todo M.E. // Mater. Lett. 2016. № 173. P. 231. https://doi.org/10.1080/21870764.2019.1600226
Chen L., Hu J., Ran J. et al. // Polym. Compos. 2016. № 37(1). P. 81. https://doi.org/10.1002/pc.23157
Vozzi G., Corallo C., Carta S. et al. // J. Biomed. Mater. Res. A. 2014. № 102(5). P. 1415. https://doi.org/10.1002/jbm.a.34823
Каралкин П.А., Сергеева Н.С., Комлев В.С. и др. // Гены и клетки. 2016. Т. 11. № 3. С. 94.
Kharazi A.Z., Fathi M.H., Bahmany F. // Mater. Des. 2010. № 31(3). P. 1468. https://doi.org/10.1016/j.matdes.2009.08.043
Ehrenfried L., Patel M., Cameron R. // J. Mater. Sci.: Mater. Med. 2008. № 19 (1). P. 459. https://doi.org/10.1007/s10856-006-0061-6
Zhou H., Touny A., Bhaduri S. // J. Mater. Sci.: Mater. Med. 2011. № 22 (5). P. 1183. https://doi.org/10.1007/s10856-011-4295-6
Dunn R.L., Casper R.A. Method of producing biodegradable prosthesis and products. From Eur. Pat. 1984. 146, 398.
Casper R.A., Dunn R.L., Kelley B.S. // Proceedings of Second World Congress on Biomaterials, Washington, D.C., 1984. P. 278.
Kelley B.S., Dunn R.L., Battiston G. C. et al. // Proceedings of the Twelfth Annual Meeting of the Society of Biomaterials, Minneapolis-St Paul, Minnesota, USA, 1986. P. 167.
DePolo W.S., Baird D.G. // Polym. Comp. 2009. № 30 (2). P. 188. https://doi.org/10.1002/pc.20554
Liao X.-I., Xu W.-F., Wang Y.-I. et al. // Trans. Nonferrous Metals Society China. 2009. № 3 (0). P. 748.
Boccaccini A.R., Maquet V. // Comp. Sci. Technol. 2003. № 63 (16). P. 2417.
Pirhonen E., Niiranen H., Niemelii T. et al. // J. Biomed. Mater. Res. B. 2006. № 77 (2). P. 227.
Brauer D., Russel C., Vogt S. et al. // J. Mater. Sci.: Mater. Med. 2008. № 19 (1). P. 121. https://doi.org/10.1007/s10856-007-3147-x
Parsons A.J., Ahmed I., Haque P. et al. // J. Biol. Eng. 2009. № 6 (4). P. 318. https://doi.org/10.1016/S1672-6529(08)60132-8
Scotchford C.A., Shataheri M., Chen P.S. et al. // J. Biomed. Mater. Res. A. 2010. № 96 (1). P. 230. https://doi.org/10.1002/jbm.a.32977
Feng S.S. // Expert. Rev. Med. Dev. 2004. № 1 (1). P. 115. https://doi.org/10.1586/17434440.1.1.115
Liu H., Slamovich E.B., Webster T. // Int. J. Nanomed. 2006. № 1 (4). P. 541. https://doi.org/10.2147/nano.2006.1.4.541
Christel P., Chabot F., Leray J.C. et al. Biodegradable composites for internal fixation. In Biomaterials. New York: John Wiley, 1980, 271 p.
Dauner M. // J. Mater. Sci.: Mater. Med. 1998. № 9. P. 173. https://doi.org/10.1023/a:1008823804460
Tormala P., Vainionpaa S., Pellinen M. et al. // Trans. SOC. Biomater. 1988. № 11. P. 501.
Vainionpaa S., Majola A., Mero M. et al. // Trans. SOC. Biomater. 1988. № 11. P. 500.
Zhang X., Hua H., Shen X., Yang Q. // Polymer. 2007. № 48 (4). P. 1005. https://doi.org/10.1016/j.polymer.2006.12.028
Wang J., Li H., Gao J., Meng X. // Adv. Mater. Res. 2009. № 79 (82). P. 2055. DOI: 10.4028/www.scientific.net/AMR.79-82.2055
Bergsma E., de Bruijn W.E., Rozema F.R. et al. // Biomaterials. 1995. № 16 (1). P. 25. https://doi.org/10.1016/0142-9612(95)91092-d
Hoppe A., Giildal N.S., Boccaccini A.R. // Biomaterials. 2011. № 32 (11). P. 2757. https://doi.org/10.1016/j.biomaterials.2011.01.004
Brow R.K. // J. Non- Crystalline Solids. 2000. № 263–264. P. 1. https://doi.org/10.1016/S0022-3093(99)00620-1
Lee Y.K., Choi S.H. // J. Korean Acad. Periodontol. 2008. № 28. P. 273. https://doi.org/10.5051/jkape.2008.38.Suppl.273
Haque P., Parsons A.J., Barker I.A. et al. // Compos. Sci. Technol. 2010. № 70(13). P. 1854.
Leonardi E., Ciapetti G., Baldini N. et al. // Acta Biomater. 2010. № 6 (2). P. 598. https://doi.org/10.1016/j.actbio.2009.07.017
Navarro M., Ginebra M.P., Planell J.A. // J. Biomed. Mater. Res. A. 2003. № 67 (3). P. 1009. https://doi.org/10.1002/jbm.a.20014
Melo P., Tarrant E. Swift T. et al. // Mater. Sci. Engin. 2019. № 104. P. 1. https://doi.org/10.1016/j.msec.2019.109929
Onal L., Cozien-Cazuc S., Jones I.A., Rudd C.D. // J. Appl. Polym. Sci. 2008. № 107. P. 3750. https://doi.org/10.1002/app.27518
Pohjonen T., Tormala P., Mikkola J. et al. // Proceedings of the Sixth International Conference PIMS, Leeuwenhorst Congress Centre, The Netherlands, 1989. P. 34/1.
Raiha J.E. // Clin. Mater. 1992. № 10(1). P. 35. https://doi.org/10.1016/0267-6605(92)90082-5
Pihlajamaki H., Bostman O., Hirvensalo E. et al. // J. Bone Jt. Surg. 1992. № 74B. P. 853.
Stares S.L., Boehs L., Fredel M.C. // Polymeros. 2012. № 22(4). P. 378. https://doi.org/10.1590/S0104-14282012005000056
Suuronen R., Pohjonen T., Hietanen J., Lindqvist C. // J. Oral Maxillofac. Surg. 1998. № 56. P. 604. https://doi.org/10.1016/s0278-2391(98)90461-x
Bos R.R., Boering G., Rozema F.R., Leenslag J.W. // J. Oral Maxillofac. Surg. 1987. № 45. P. 751. https://doi.org/10.1016/0278-2391(87)90194-7
Bergsma J.E., de Bruijn W.C., Rozema F.R. et al. // Biomaterials. 1995. № 16. P. 25. https://doi.org/10.1016/0142-9612(95)91092-d
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии