Российские нанотехнологии, 2020, T. 15, № 5, стр. 560-567
ПАЛЕОГЕНЕТИЧЕСКОЕ ИССЛЕДОВАНИЕ ДРЕВНЕЕГИПЕТСКИХ МУМИЙ В НИЦ “КУРЧАТОВСКИЙ ИНСТИТУТ”
Е. Б. Яцишина 1, Е. С. Булыгина 1, *, С. В. Васильев 2, Р. М. Галеев 2, Н. В. Слободова 1, С. В. Цыганкова 1, Ф. С. Шарко 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт этнологии и антропологии РАН им. Н.Н. Миклухо-Маклая
Москва, Россия
* E-mail: eugenia.bulygina@gmail.com
Поступила в редакцию 16.08.2020
После доработки 28.09.2020
Принята к публикации 06.10.2020
Аннотация
В НИЦ “Курчатовский институт” проведено междисциплинарное исследование десяти древнеегипетских мумий из коллекции ГМИИ им. А.С. Пушкина, относящихся к I тыс. до н.э.–началу н.э. На начальном этапе была осуществлена их компьютерная томография (КТ), которая стала основой дальнейших исследований: антропологического, медицинского и криминалистического анализа. Для палеогенетического и изотопного анализа на основе данных КТ были изъяты наиболее хорошо сохранившиеся образцы костной ткани мумий. Представлены результаты экспериментальных исследований, определивших митохондриальные и Y-хромосомные гаплогруппы части исследованных мумий, подтвержден установленный ранее антропологами пол и найдены ДНК некоторых патогенов, проведен изотопный анализ. Полученные с помощью естественно-научных методов данные дополняют важную историческую информацию о генетическом разнообразии населения Древнего Египта, миграционных процессах в этом регионе.
ВВЕДЕНИЕ
Цивилизация Древнего Египта на протяжении многих лет остается одной из самых интересных и плодотворных областей для исследований у историков, археологов, искусствоведов.
Мумии как важнейший элемент культа загробной жизни – весьма информативный материальный источник по древнеегипетской истории. Стремление сохранить тело усопшего для его дальнейшего существования в Царстве мертвых было неотъемлемой частью культуры Древнего Египта. Мумификация превратилась в своего рода сплав религии, искусства и науки. Это касается как медицинских аспектов, патологоанатомических технологий, так и составления сложных химических составов для бальзамирования тел.
Не случайно именно мумии стали одним из символов Древнего Египта со всеми вытекающими отсюда отнюдь не благоприятными последствиями, касающимися их сохранности. Подсчитать количество уничтоженных мумий не представляется возможным. В прежние века разрушение мумий для различных целей было осознанным, но и с началом их научного изучения неосторожные манипуляции, к сожалению, иногда также приводили к их необратимым повреждениям [1–3].
Ситуация начала меняться с развитием в начале ХХ в. методов физического материаловедения, прежде всего связанных с рентгеновским излучением. Первый рентгеновский снимок мумии был сделан в 1896 г. [4]. В 1970-х годах с появлением портативного рентгеновского оборудования оно стало активно применяться в музеях, в том числе для исследования коллекций мумий в Каирском Египетском и Британском музеях. До широкого внедрения компьютерной томографии (КТ) для исследования мумий кроме разворачивания и аутопсии использовали различные радиологические методы (стационарные и портативные пленочные аппараты), гистологические срезы регидратированных мумифицированных тканей, электронную микроскопию для палеопатологических исследований. Большая часть рентгенологических исследований впоследствии была уточнена и скорректирована с помощью КТ [5].
С развитием метода КТ изучение объектов культурного наследия, в том числе мумий, перешло на новый уровень. Первое томографическое сканирование мумий было проведено почти 40 лет назад, и на сегодня это самый эффективный недеструктивный метод изучения мумий, с помощью которого также проводится виртуальная реконструкция их внешности [6].
В то же время анализ древней ДНК, несколько десятилетий назад пополнивший арсенал естественно-научных методов, до недавнего времени считался невозможным при исследовании мумий. Закономерный скептицизм исследователей вызывала ее сохранность: жаркий климат, высокая влажность в гробницах, а также обработка тел различными составами в процессе бальзамирования способствовали ускоренной деградации генетического материала. Часто и подлинность выделенной ДНК ставится под сомнение в связи с потенциальными загрязнениями в ходе экстракции [7]. Несмотря на то, что именно с исследований древнеегипетских мумий началась история палеогенетики [8], только в 2017 г. произошел прорыв в этом направлении. Немецкие исследователи из Отдела археогенетики Института эволюционной антропологии общества им. Мак-са Планка определили последовательность митохондриальных геномов из девяноста мумий, а полногеномные данные, включающие в себя анализ ядерной ДНК, были получены только для трех из них. На сегодня подобные исследования применительно к древнеегипетским мумиям все еще немногочисленны [9–11].
Однако, невзирая на все эти трудности, анализ ДНК является важным методом, который вкупе с другими подходами позволяет получить новую информацию об изменениях антропологического состава населения Древнего Египта.
Благодаря своему географическому положению и документально подтвержденным взаимодействиям с цивилизациями Восточного Средиземноморья, Азии и Африки Древний Египет является идеальным регионом для изучения древних миграций человеческих популяций. Более того, последние генетические исследования показали, что миграционные волны происходили не только из Африки, но и в обратном направлении с Востока, в том числе, в эпохи палеолита и неолита [12–14].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Проведенное в НИЦ “Курчатовский институт” палеогенетическое исследование ставило перед собой задачу подтвердить или опровергнуть данные выполненного ранее краниометрического анализа [15]. Также было запланировано при возможности подтвердить установленный антропологами пол и определить наличие заболеваний. Задача определения родства у исследованных мумий не ставилась, так как все они происходят из разных источников, а в собрание Государственного музея изобразительных искусств им. А.С. Пушкина (ГМИИ) попали из нескольких коллекций.
Основой для всего комплекса исследования мумий послужили данные рентгеновской КТ, проведенной в Курчатовском комплексе НБИКС-природоподобных технологий на первом этапе исследования. С помощью антропологического, медицинского и криминалистического анализа были описаны физические параметры мумий, патологии, травмы, особенности мумификации. Также уточнены их пол, возраст, определен антропологический тип и исследованы вещества, использованные при бальзамировании тел и волос мумий [16–18].
В развитии этих исследований важным этапом стала разработка методического подхода к изъятию образцов костной ткани для палеогенетического и изотопного анализа. Настоящая работа продемонстрировала эффективность использования данных КТ для отбора и экстракции образов из мумифицированных останков.
Качественный и количественный анализ результатов КТ позволяет получать образцы с высоким содержанием эндогенной ДНК наименее разрушающим способом, используя заранее определенные области поверхности мумии как “точки входа”.
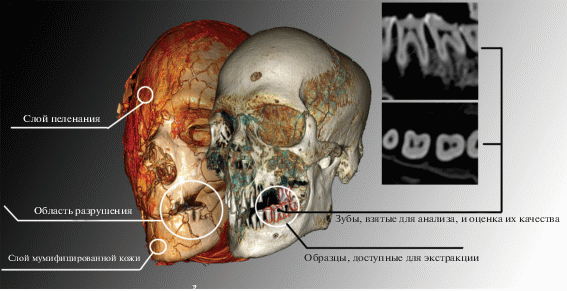
В качестве точек входа использовали участки поверхности мумии, которые уже были затронуты реставрационными работами (рис. 1). Известно, что плотность костной ткани положительно коррелирует с содержанием в ней эндогенной ДНК [19]. В настоящее время наиболее качественными объектами для палеогенетического анализа считаются пирамида височной кости, зубы (клыки и моляры) и реже плотные слои компактного вещества длинных костей. Качество образца оценивают визуальным осмотром на предмет сохранения целостности и отсутствия возможного загрязнения образца экзогенной ДНК, что невозможно при работе с мумифицированными останками, когда качество можно оценить только после извлечения и очистки образца от смол и битумов. Однако современные методы обработки DICOM (Digital Imaging and Communications in Medicine) изображений позволяют оценить не только целостность образца до его изъятия, но и относительно точно прогнозировать количество костного порошка, получаемого из объектов разных размеров [20].
Последующее развитие описанного методического подхода позволит с высокой точностью планировать наименее разрушающие и безопасные способы получения материала из любых недоступных для визуального анализа объектов. За счет более точного определения содержания ДНК в конкретном образце также снизятся расходы на палеогенетические исследования.
По итогам консультаций с реставраторами ГМИИ от них было получено разрешение на изъятие проб только у четырех мумий описанным выше методом отбора. По его результатам в Курчатовский институт были переданы образцы костной ткани и зубы четырех египетских мумий из коллекции ГМИИ (табл. 1).
Таблица 1.
Антропологический материал: египетские мумии из коллекции ГМИИ им. А.С. Пушкина, использованные для палеогенетического анализа
| Образец | Номер по ката-логу ГМИИ | Краткое описание | Использованные образцы |
|---|---|---|---|
| 1 | 1241 | Мужчина 30–60 лет | Два моляра |
| 2 | 6756 | Женщина (негроидный тип), 30–35 лет | Изолированные зубы: клык, премоляры |
| 3 | 1290 | Разрушенная мумия мужчины, 35–40 лет | Пирамида височной кости |
| 4 | 5302 | Мужчина, 20–25 лет | Таранная кость |
Работы по выделению древней ДНК проводили в специально оборудованном чистом блоке Курчатовского комплекса НБИКС-природоподобных технологий с соблюдением всех необходимых для подобных экспериментов условий. Перед выделением образцы обрабатывали под ультрафиолетом в течение 20 мин, после чего их верхние слои удаляли. Сверление проводили с помощью стоматологической бормашины при 3–4 тыс. об./мин. Для каждого образца при возможности проводили два–три независимых выделения ДНК.
Выделение ДНК проводили по стандартной методике с небольшими модификациями [21]. Для амплификации участков D-петли митохондриальной ДНК (мтДНК) использовали праймерные системы, предложенные ранее [22]. Последовательности ПЦР-фрагментов длиной 138–210 пар нуклеотидов, покрывающих участок D-петли мтДНК, прочитывали, используя секвенатор ABI 3730xl (Thermo Fisher Scientific). Кроме того, часть ДНК была использована для приготовления ДНК-библиотек для последующего глубокого секвенирования. Для этого использовали набор Ovation Ultralow Library System V2 (Tecan Genomics). Секвенирование проводили на приборе NovaSeq6000 (Illumina).
Список нуклеотидных различий последовательностей мтДНК исследуемых образцов от референсной мтДНК – rCRS – определяли с использованием программы mtDNAprofiler [23]. Для определения митохондриальных гаплотипов применяли программу HaploGrep [24].
Анализ данных с секвенатора Illumina NovaSeq6000 проводили с помощью программного конвейера PALEOMIX [25] и референсной последовательности генома человека GRCh37 (hg19), Y-хромосомные гаплогруппы определяли, используя программу Yleaf [26]. Анализ бактериальных патогенов, сопутствующих человеку, проводили с помощью программы MetaPhlAn 2.0 [27].
Изотопный анализ костных образцов был сделан в Институте истории материальной культуры РАН (Санкт-Петербург). Его проводили на установке для определения изотопного состава углерода и азота в костном материале, состоящей из масс-спектрометра DELTA V, элементного анализатора и устройств их соединения. Сжигание органического вещества (измельченных костей или коллагена) в среде кислорода проводили в элементном анализаторе для перевода твердой органики в углекислый газ и молекулярный азот, необходимые для анализа в масс-спектрометре. Температура сжигания образцов при кислородном пиролизе достигала 1200°С. Масса загружаемых в элементный анализатор образцов варьировала в пределах 2–4 мг.
Определение изотопного состава углерода в форме углекислого газа и азота проводили на масс-спектрометре, в котором осуществляется ионизация газа за счет электронного удара с дальнейшим разделением ионов в магнитном поле. Регистрация ионов проводится электрометрическими усилителями.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Палеогенетический анализ. На первом этапе междисциплинарного исследования мумий в НИЦ “Курчатовский институт” по итогам антропологических исследований пять мумий были определены как мужские и пять как женские. Были описаны черепа мумий с использованием классической краниологической программы [28].
Такие краниологические характеристики, как мезокрания, грацильность, узколицесть, значительная горизонтальная профилированность и относительно высокий и узкий нос исследованных мумий, позволили отнести почти всех индивидов к одному из вариантов средиземноморского антропологического типа европеоидной расы. Однако по результатам внутригруппового анализа необходимо отметить неоднородность и мужчин, и женщин по формообразующим параметрам мозговой коробки, что означает их происхождение из разных областей.
Лишь одна из исследованных мумий (№ I.1а 6756 по каталогу ГМИИ) женщины 30–35 лет имеет ярко выраженные негроидные черты: низкий свод черепа, слабую горизонтальную профилировку и относительно короткий и широкий, незначительно выступающий нос с низким переносьем, выраженный альвеолярный прогнатизм. Полученные данные о различных краниологических вариантах подтверждают исторические сведения по данному региону как зоне активных миграций населения [29].
Несмотря на описанные выше объективные трудности с выделением ДНК из древнеегипетских мумий, в результате отбора проб по разработанной неразрушающей методике было успешно осуществлено секвенирование ДНК трех из четырех исследованных проб.
Суммарная ДНК была выделена из всех образцов, однако последующий анализ показал, что эндогенная ДНК присутствовала только в трех из них (образцы 1, 3 и 4). ДНК, выделенная из образца 2, оказалась непригодной, поэтому была исключена из дальнейшего исследования.
Анализ данных, полученных NGS-секвенированием (табл. 2), показал, что процент эндогенной ДНК во всех библиотеках варьирует от 0.2 до 1.8%, что сопоставимо с результатами других исследований [12, 30]. Обращает на себя внимание тот факт, что количество картированных на митохондриальный геном человека прочтений невелико, хотя считается, что мтДНК в древних образцах сохраняется лучше в силу ее кольцевой структуры и большого количества копий. Результаты NGS-секвенирования не позволили определить митохондриальные гаплогруппы исследуемых трех образцов.
Таблица 2.
Статистические данные по результатам секвенирования ДНК-библиотек египетских мумий на приборе NovaSeq6000
| Образец | ДНК-библи-отека | Номер в базе данных NCBI | Количество прочтений, картированных на геном человека (GRCh37) (hg19) | Количество эндогенной ДНК, % | Количество прочтений, картированных на Y-хромосому | Количество прочтений, картированных на митохондриальный геном человека |
|---|---|---|---|---|---|---|
| 1 | Lib1m | SRR12692390 | 37 392 846 | 1.81 | 281 538 | 413 |
| Lib2m | SRR12692389 | 3 166 034 | 0.15 | 22 976 | 210 | |
| 3 | Lib7m | SRR12692388 | 4 196 632 | 0.20 | 37 115 | 96 |
| Lib8m | SRR12692387 | 8 578 050 | 0.42 | 72 847 | 146 | |
| Lib9m | SRR12692386 | 4 954 944 | 0.24 | 38 205 | 211 | |
| 4 | Lib10m | SRR12692385 | 3 232 069 | 0.16 | 26 268 | 125 |
| Lib11m | SRR12692384 | 4 046 838 | 0.20 | 30 525 | 165 | |
| Lib12m | SRR12692383 | 4 056 125 | 0.20 | 33 517 | 114 |
Тем не менее митохондриальные гаплогруппы образцов удалось определить с помощью амплификации коротких ПЦР-фрагментов D-петли мтДНК с последующим сэнгеровским секвенированием. Данный анализ установил принадлежность двух образцов к гаплотипу N, а третьего – к L3 (табл. 3).
Таблица 3.
Y-хромосомные и митохондриальные гаплогруппы египетских мумий
| Образец | Номер по ката-логу ГМИИ | Y-хромосомная гаплогруппа | Митохондриальный гаплотип | Митохондриальные маркеры |
|---|---|---|---|---|
| 1 | 1241 | не определена (не хватило покрытия Y-хромосомы) | N | 2485T 3622G 3628T 3630T 3631A 3634A 3643T 3649T3652C 3658A 3667A 3673C 3679T 3685A 3688T 3694A 3700A 3703C 3706A 3712C 3715C 9378A 13709A 14213T |
| 3 | 1290 | R1b1a1b | L3h1 | 2708A 9345T 9378A 11018T |
| 4 | 5302 | E1b1b1a1b2a4b5a | N5 | 3145G 15131T 15137G 15143A 15146A 15149A 15155A 15176A |
Митохондриальные гаплогруппы позволяют оценить происхождение исследуемых останков по материнской линии. Идентифицированные в данном исследовании гаплотипы N и L ранее были найдены среди населения Древнего Египта [10].
Обнаруженная в настоящем исследовании митохондриальная гаплогруппа N широко распространена в современном мире. Носители ее субклад населяют несколько континентов, поэтому ее называют макрогаплогруппой. В свою очередь макрогруппа N представляет собой одну из ветвей гаплогруппы L3, которая происходит от потомков гипотетической митохондриальной Евы. Гаплогруппы L и N ранее были описаны при анализе образцов из Древнего Египта, относящихся к 797–567 годам до н. э. [10]. Таким образом, древние египтяне имели больше общего с населением Ближнего Востока в тот период, чем с современными египтянами. Более того, гаплогруппа L с высокой вероятностью сохраняется на этой территории в автохтонных популяциях и в настоящее время [25].
Неплохое покрытие Y-хромосомы позволило, во-первых, подтвердить определенный ранее антропологами пол у трех мумий (№ 1241, 1290 и 5302 по каталогу ГМИИ), во-вторых, определить Y-гаплогруппы у двух образцов: № 3 (1,1а 1290 ГМИИ) и № 4 (1,1а 5302 ГМИИ) (табл. 3). Определить Y-гаплогруппу у первого образца оказалось невозможным, хотя количество эндогенной ДНК и количество прочтений, картированных на Y-хромосому, были максимальными. Проблема, по-видимому, заключается в контаминации данного образца современным генетическим материалом, поскольку анализ NGS-данных показал наличие нескольких типов последовательностей, принадлежащих разным людям.
Y-хромосомные гаплогруппы позволяют оценить происхождение исследуемых останков по отцовской линии. Одна из определенных в данной работе гаплогрупп E1b1b1a1b2a4b5a была ранее описана при широкомасштабном генетическом анализе мумий доптолемеевского, птолемеевского и римского периодов [10], показавшем глубокие генетические связи древних египтян с населением Ближнего Востока и выявившем довольно сильное отличие от современных египтян по доле африканского генетического компонента, приобретенного ими в более позднее время.
Гаплогруппа R1b1a1b, выделенная в изученных образцах, также нехарактерна для современного населения Египта, ее частота в популяции составляет менее 1%, при этом она встречается приблизительно у половины мужского населения Западной Европы [10]. Кроме того, эти гаплогруппы обычны для Кавказа и Европы периода железного века [32–34]. Таким образом, генетический анализ подтвердил, что данные мумии относятся к средиземноморскому антропологическому типу, а также подтверждены выводы краниологического анализа об их происхождении из разных областей.
Анализ патогенов. Значительный объем данных, получаемых посредством глубокого секвенирования, позволяет проводить параллельный анализ ДНК древних людей и сопутствующих им микроорганизмов. Поиск древних патогенов в археологических памятниках привел к появлению линейки методов для проведения подобных исследований [35].
С использованием данных геномного секвенирования и метагеномной базы данных MetaPhlAn 2.0 был проведен анализ на сопутствующую микрофлору, который иногда дает дополнительную информацию об изучаемых образцах. Данные NGS-секвенирования позволили обнаружить не только геномные последовательности микроорганизмов, населяющих почвы, но и патогенные бактерии.
В частности, в проанализированных образцах 1 и 3 выявлена значительная концентрация молекул ДНК, принадлежащих возбудителям из группы сыпного тифа – Rickettsia felis (рис. 2а, 2б) и Rickettsia parkeri (обнаружена только в образце 3). Как известно из исторических источников, эта бактерия сопровождала человечество на протяжении многих тысяч лет. [36].
Рис. 2.
Основные бактериальные таксоны, обнаруженные в египетской мумии 1 (1,1а 1241 ГМИИ) (а), 3 (1,1а 1290 ГМИИ) (б) и 4 (5302 ГМИИ) (в).
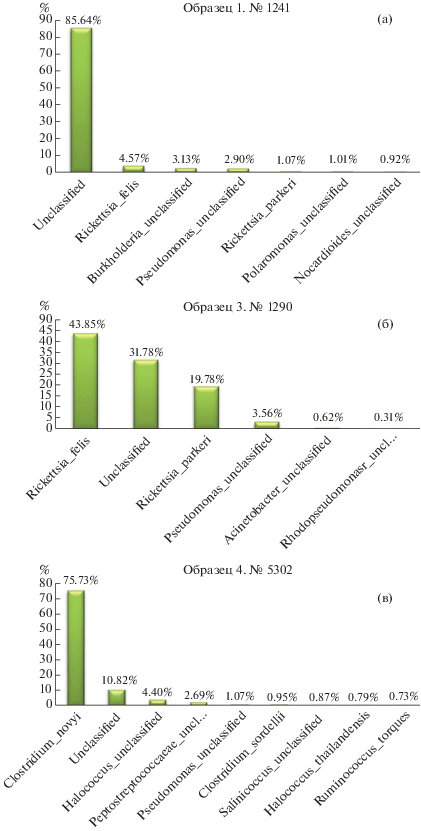
В четвертом образце значительно преобладала Сlostridium novyi (рис. 2в), составляя примерно 85% от всех определенных микроорганизмов. Этот патоген часто выделяется из почвы и фекалий, а также он является одним из основных возбудителей газовой гангрены [37]. Поскольку ДНК этого патогена была обнаружена в генетическом материале, выделенном из костной ткани, можно предположить, что мумифицированный человек был инфицирован при жизни, но для окончательного вывода нужны дополнительные исследования.
Изотопный анализ. Изотопные методы исследования весьма информативны для определения условий обитания и диеты древних людей [38, 39]. Это связано с тем, что все животные и растительные организмы обладают различным изотопным составом главных компонентов белков – углерода и азота. Влияние условий внешней среды – температуры и влажности – приводит к изменениям изотопного состава углерода и азота как в растениях, так и в мясе и костях животных, ими питающихся. Так как любой человек получает растительную и животную пищу в той или иной пропорции, изотопный состав углерода и азота в его костях зависит от типа диеты.
Референсные значения изотопного состава охотничьего, кочевого образа жизни: δ13С = –10– –15‰, δ15N = +12–+18‰ [40].
Значения изотопного состава при земледельческом образе жизни: δ13С = –17– –20‰, δ15N = = +5–+9‰.
Важно учитывать, что изменения климата приводят к изменениям фракционирования изотопов углерода и азота растений. При холодном и влажном климате наблюдаются более отрицательные значения δ13С и более положительные δ15N [41].
Результаты проведенного изотопного анализа костных образцов египетских мумий представлены в табл. 4. По итогам исследований определено, что значения изотопно-легкого углерода и изотопно-тяжелого азота указывают на преобладание в рационе мясной пищи. Доля растительной пищи в диете исследованных индивидуумов была минимальной.
Таблица 4.
Результаты изотопного анализа костных образцов египетских мумий
| Номер анализа | Образец | δ13 С, ‰ | δ15N, ‰ |
|---|---|---|---|
| 3872, 3901 | Мумия 5302 | –19.5 | 14.3 |
| 3873, 3902 | Мумия 1290 | –18.7 | 14.6 |
| 3877, 3906 | Мумия 1241 | –19.8 | 14.9 |
При определении палеодиеты важно учитывать, что анализ коллагена костной ткани позволяет судить только об усредненных параметрах состава пищевого рациона примерно за последние десять лет жизни индивида. Для уточнения его типа питания в детстве информативным может быть исследование зубной эмали [41].
ЗАКЛЮЧЕНИЕ
Полученные результаты представляют несомненный интерес для дальнейших междисциплинарных исследований. Благодаря разработанному методическому подходу к изъятию образцов костной ткани для палеогенетического и изотопного анализа с использованием заранее определенных областей поверхности мумии как “точки входа” удалось получить образцы с высоким содержанием эндогенной ДНК, что значительно повысило вероятность успешного секвенирования ДНК.
Палеогенетический анализ, проведенный в НИЦ “Курчатовский институт”, подтвердил предварительные выводы антропологических исследований, определивших характерные признаки средиземноморского антропологического типа у большинства мумий. Успешное выделение древней ДНК из образцов костной ткани и ткани зубов трех из четырех египетских мумий было проведено впервые в России.
Также исследование позволило обнаружить патогенные бактерии в трех мумиях. В частности, в двух образцах выявлена значительная концентрация молекул ДНК, принадлежащих возбудителям из группы сыпного тифа. Еще в одном образце преобладал микроорганизм, являющийся одним из основных возбудителей газовой гангрены. Такое исследование древних микроорганизмов применительно к египетским мумиям также проведено впервые в России.
По изотопному анализу коллагена, выделенного из костных и зубных образцов мумий, определено преобладание мясной пищи в рационе данных индивидов.
Проведенное исследование имеет большое значение для развития отечественной науки, способствует расширению сферы применения естественно-научных методов в изучении культурного наследия.
Авторы выражают благодарность директору Государственного музея изобразительных искусств им. А.С. Пушкина М.Д. Лошак и сотрудникам отдела Древнего Египта О.А. Васильевой и О.П. Дюжевой за предоставление объектов для исследований и содействие в их изучении, и сотрудникам Института истории материальной культуры РАН (Санкт-Петербург) Н.Д. Буровой и О.В. Лоховой за проведение изотопного анализа.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 17-29-04144 офи_м).
Список литературы
Aufderheide A. The Scientific Study of Mummies. Cambridge University Press, 2002. 608 p. https://doi.org/10.1017/S0021932005216875
Ikram S., Dodson A. Mummy in Ancient Egypt: equipping the dead for eternity. New York Thames Hudson, 1998. 352 p.
Egyptian Mummies and Modern Science / Ed. David R. Cambridge: Cambridge University Press. 2008. 326 p. https://doi.org/10.1017/CBO9780511499654.019
Zesch S., Panzer S., Rosendahl W. et al. // Eur. J. Radiol. open.3(1). 2016. V. 3. P. 172. https://doi.org/10.1016/j.ejro.2016.07.002
Hawass Z., Saleem S.N. Scanning the pharaohs: CT imaging of the New Kingdom Royal Mummies. New York: AUC Press, 2016. 318 p.
Saleem S.N., Hawass Z. // J. Comput. Assist. Tomogr. 2017. № 41. P. 15. https://doi.org/10.1097/RCT.0000000000000489
Gilbert M.T., Darnes I., Collins M.J. et al. // Am. J. Phys. Anthropol. 2005. V. 128. P. 110. https://doi.org/10.1002/ajpa.20045
Paabo S. // Proc. Nat. Acad. Sci. USA. 1989. V. 86. P. 1939. https://doi.org/10.1073/pnas.86.6.1939
Paabo S. // Nature. 1985. V. 314. P. 644. https://doi.org/10.1038/314644a0
Schuenemann V.J., Peltzer A., Welte B. et al. // Nat. Commun. 2017. V. 8. Art. 15694. https://doi.org/10.1038/ncomms15694
Loreille O., Ratnayake S., Bazinet A.L. et al. // Genes (Basel). 2018. V. 9. P. 135. https://doi.org/10.3390/genes9030135
Oras E., Anderson J., Tõrv M. et al. // PLoS ONE. 2020. V. 15. P. e0227446. https://doi.org/10.1371/journal.pone.0227446
Llorente M.G., Jones E.R., Ericsson A. et al. // Science. 2015. V. 350. P. 820. https://doi.org/10.1126/science.aad2879
Hervella M., Svensson E.M., Alberdi A. et al. // Scientific Reports. 2016. V. 6. Art. 25501. https://doi.org/10.1038/srep25501
Яцишина Е.Б., Ковальчук М.В., Лошак М.Д. и др. // Кристаллография. 2018. Т. 63. С. 479.
Яцишина Е.Б., Пожидаев В.М., Васильева О.А. и др. // Тонкие химические технологии. 2019. Т. 14. № 4. С. 45. https://doi.org/10.32362/2410-6593-2019-14-4-45-58
Яцишина Е.Б., Васильев С.В., Боруцкая С.Б. и др. // Археология, этнография и антропология Евразии. 2019. Т. 47. С. 136. https://doi.org/10.17746/1563-0110.2019.47.3.136-144
Яцишинa Е.Б., Пожидаев В.М., Сергеевa Я.Э. и др. // Журн. аналит. химии. 2020. Т. 75. С. 171. https://doi.org/10.31857/S0044450219120144
Аверьянова Л.А., Авакян А.К., Грушка А.В. и др. // Вісник Національного технічного університету “Харківський політехнічний інститут”. Сер. Нові рішення в сучасних технологіях. 2015. № 39. С. 68.
Alberti F., Gonzalez J., Paijmans J.L.A. et al. // Mol. Ecol. Resour. 2018. V. 18. P. 1. https://doi.org/10.1111/1755-0998.12911
Orlando L., Metcalf J.L., Alberdi M.T. et al. // PNAS. 2009. V. 106. P. 21754. https://doi.org/10.1073/pnas.0903672106
Sampietro M.L., Caramelli D., Lao O. et al. // Ann. Hum. Genet. 2005. V. 69. P. 535. https://doi.org/10.1111/j.1529-8817.2005.00194.x
Yang S., Lee H.Y., Yang W.I. et al. // J. Forensic Sci. 2013. V. 58. P. 972. https://doi.org/10.1111/1556-4029.12139
Weissensteiner H., Pacher D., Kloss-Brandstätter A. et al. // Nucleic Acids Res. 2016. V. 44. P. W58. https://doi.org/10.1093/nar/gkw233
Schubert M., Ermini L., Der Sarkissian C. et al. // Nat. Protoc. 2014. V. 9. P. 1056. https://doi.org/10.1038/nprot.2014.063
Ralf A., González D.M., Zhong K., Kayser M. // Mol. Biol. Evol. 2018. V. 35. P. 1291. https://doi.org/10.1093/molbev/msy080
Segata N., Waldron L., Ballarini A. et al. // Nat. Methods. 2012. V. 9. P. 811. https://doi.org/10.1038/nmeth.2066
Алексеев В.П., Дебец Г.Ф. Краниометрия. Методика антропологических исследований. М.: Наука, 1964. 128 с.
Белова Г.А., Васильев С.В., Боруцкая С.Б. и др. // Stratum Plus. 2020. № 4. P. 73.
Sokolov A.S., Nedoluzhko A.V., Boulygina E.S. et al. // J. Archaeological Sciences. 2016. V. 73. P. 138. https://doi.org/10.1016/j.jas.2016.07.017
Stevanovitch A., Gilles A., Bouzaid E. et al. // Ann. Hum. Genet. 2004. V. 68. P. 23. https://doi.org/10.1046/j.1529-8817.2003.00057.x
Haak W., Lazaridis I., Patterson N. et al. // Nature. 2015. V. 522. P. 207. https://doi.org/10.1038/nature14317
de Barros Damgaard P., Martiniano R., Kamm J. et al. // Science. 2018. V. 360. P. eaar7711. https://doi.org/10.1126/science.aar7711
Boulygina E., Tsygankova S., Sharko F. et al. // J. Archaeological Science Reports. 2020. V. 31. P. 102357. https://doi.org/10.1016/j.jasrep.2020.102357
Key F.M., Posth C., Krause J. et al. // Trends Genet. 2017. V. 33. P. 508. https://doi.org/10.1016/j.tig.2017.05.005
Angelakis E., Mediannikov O., Parola P., Raoultl D. // Trends in Parasitology. 2016. V. 32. P. 554. https://doi.org/10.1016/j.pt.2016.04.009
Атлас по медицинской микробиологии, вирусологии и иммунологии: Учебное пособие для студентов медицинских вузов / Под ред. Воробьева А.А., Быкова А.С. М.: Медицинское информационное агентство, 2003. 236 с.
Добровольская М.В., Решетова И.К. // Дивногорский сборник: Труды музея-заповедника “Дивногорье”. Воронеж: Научная книга, 2012. С. 142.
Добровольская М.В., Тиунов А.В. // Археология, этнография и антропология Евразии. 2013. Т. 53. С. 78.
Bocherens H., Drucker D. // Int. J. Osteoarcheology. 2003. V. 13. № 1. P. 46.
Кузьмин Я.В. // Геоархеология: естественно-научные методы в археологических исследованиях. Томск: Издательский дом ТГУ, 2017. С. 245.
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии